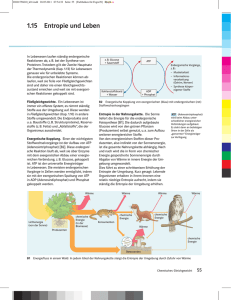
Reversibles Mischen
Werbung

Reversibles Mischen - SystemPhysik Seite 1 von 1 Reversibles Mischen Aus SystemPhysik Giesst man 10 Kilogramm Wasser von 80°C in ein Eis-Wasser-Gemisch von 0°C (8 Liter Wasser und 2 kg Eis) stellt sich eine bestimmte Temperatur oder ein neues Eis-Wasser-Gemisch ein. Obwohl die Energie erhalten bleibt, scheint bei diesem Mischvorgang eine gewisse Qualität verloren zu gehen (heisse und ganz kalte Getränke sind irgendwie hochwertiger als ein lauwarmes Gesöff). Wie wir alle wissen, geht beim Mischen nichts verloren, sondern es wird sogar etwas produziert: bei allen irreversiblen Vorgängen wird Entropie erzeugt! 1. Welcher Endzustand stellt sich bei diesem Mischvorgang ein? 2. Wie viel Entropie wird produziert? 3. Welcher Endzustand würde sich einstellen, wenn der Temperaturausgleich reversibel, also mit Hilfe einer idealen Wärmekraftmaschine herbeigeführt würde? 4. Wie viel Energie im Sinne von Arbeitsvermögen würde die Wärmekraftmaschine abgeben? Wasser: ■ ■ ■ ■ spezifische Schmelzenthalpie 334 kJ/kg spezifische Verdampfungsenthalpie 2'256 kJ/kg spezifische Enthalpiekapazität (spez. Wärmekapazität Wasser) 4.19 kJ/(kg K) spezifische Enthalpiekapazität (spez. Wärmekapazität Eis) 2.1 kJ/(kg K) Lösung Von „http://www.systemdesign.ch/index.php?title=Reversibles_Mischen“ Kategorien: Thermo | Aufgaben | ThermoAuf | UebAV ■ Diese Seite wurde zuletzt am 21. März 2009 um 08:40 Uhr geändert. http://www.systemdesign.ch/index.php?title=Reversibles_Mischen&printable=yes 16.03.2010 Lösung zu Reversibles Mischen - SystemPhysik Seite 1 von 2 Lösung zu Reversibles Mischen Aus SystemPhysik Eine Wassermenge von 10 Kilogramm setzt 10 kg * 4.19 kJ/(kg K) * 80 K = 3.35 MJ Energie in Form von Wärme frei, falls sie von 80°C auf 0°C abgekühlt wird. Um 2 Kilogramm Eis zu schmelzen, benötigt man nur 2 kg * 334 kJ/kg = 668 kJ Energie. Die freiwerdende Energie des Heisswasser reicht also, um das Eis zu schmelzen und deshalb ist nach dem fraglichen Mischvorgang nur noch Wasser vorhanden. Inhaltsverzeichnis Lösung 1 Kühlt man die 10 Kilogramm Wasser von 80°C auf 0°C ab und lässt 2 Kilogramm Eis abschmelzen, erhält man einen Energieüberschuss von 3.35 MJ - 668 kJ = 2.68 MJ. Mit diesem Überschuss kann die ganze Wassermenge von 20 Kilogramm wieder von 0°C auf 2.68 MJ / 4.19 kJ/(kg K) / 20 kg = 32.0°C erwärmt werden. Im Endzustand hat das Wasser somit eine Temperatur Tirr von 32°C = 305 K. Falls man weiss, dass im Endzustand nur noch Wasser vorhanden ist, lässt sich die Endtemperatur auch direkt mit Hilfe der Energieerhaltung berechnen ∆H = mEq + (mk + mE)c(Tirr − Ts) + mhc(Tirr − Ta) = 0, Tirr = abs. Endtemp. des Gemisches, TS = 273 K = Schmelztemp. von Eis, Ta = 353 K = Anfangstemp. des heissen Wassers, mE = 2 kg = Masse des anfänglichen Eises, mk = 8 kg = Masse des anfänglich kalten Wassers, mh = 10 kg = Masse des anfänglich heissen Wassers. Man löst die Gleichung ∆H = 0 nach Tirr auf und erhält dann ebenfalls 305 K. Lösung 2 Die produzierte Entropie ist gleich der Differenz zwischen der vom Eiswasser aufgenommenen und der vom Heisswasser abgegebenen Entropie: = 967 J/K, weil mh = mE + mk. Lösung 3 Um die Temperaturen mit einer Wärmekraftmaschine (WKM) auszugleichen, würde man das Heisswasser als Wärmereservoir und das Eiswassergemisch als Kältereservoir für die WKM verwenden. Falls diese WKM reversibel arbeitete, bliebe die Entropie erhalten, d.h., dass keine zusätzliche Entropie produziert würde und dass die Entropieabnahme im Heisswasser gleich der Entropiezunahme im Eiswassergemisch wäre: http://www.systemdesign.ch/index.php?title=L%C3%B6sung_zu_Reversibles_Misch... 24.03.2010 Lösung zu Reversibles Mischen - SystemPhysik Seite 2 von 2 = 0. Die Endtemperatur wäre dann gleich = 301.5 K (28.5°C). Lösung 4 Die von der reversiblen WKM als Arbeit abgegebene Energie WProzess ist dann gleich Energieabgabe W1 des Heisswassers minus Energieaufnahme W2 des Eiswassers. Die Energieabgabe W1 entspricht der negativen Enthalpieänderung des Heisswassers, W1 = - ∆HHW, die Energieaufnahme W2 der Enthalpieänderung des Eiswassers, W2 = ∆HEW, also wird die abgegebene Prozessenergie WProzess = - ∆HHW - ∆HEW = - ∆H = mhc(Ts + Ta − 2Trev) − mEq = 296 kJ. Dieser Wert entspricht der Enthalpiedifferenz zwischen den beiden Mischvorgängen ∆H = 2mhc(Tirr − Trev). Man kann den thermischen Ausgleich ideal reversibel durchführen und danach das ganze Wasser nochmals etwas aufheizen, indem man mit der im reversiblen Prozess gewonnenen Energie Entropie erzeugt. Der Endzustand ist dann wieder der selbe wie beim unkontrollierten (irreversiblen) Mischen des Wasser. Bis Ende des 19. Jahrhunderts hat man Energie als Arbeitsvermögen bezeichnet. Albert Einstein konnte dann um 1905 zeigen, dass Energie und Masse gleichwertige Bezeichnungen für die gleiche physikalische Grösse sind (Masse und Energie sind äquivalent). Dieser scheinbare Widerspruch zwischen der alten und der neuen Vorstellung von Energie löst sich auf, wenn man zwischen zugeordnetem Energiestrom und Prozessleistung unterscheidet. Nur die in einem Prozess freigesetzte Energie darf als Arbeitsvermögen bezeichnet werden. Dies lässt sich nirgends so gut zeigen wie in der Thermodynamik. Überlässt man ein System sich selber, bleibt die Energie erhalten. Will man aber die maximale Energie im Sinne von Arbeitsvermögen gewinnen, muss man dafür sorgen, dass die Entropie erhalten bleibt. Aufgabe Von „http://www.systemdesign.ch/index.php?title=L%C3%B6sung_zu_Reversibles_Mischen“ ■ Diese Seite wurde zuletzt am 24. März 2010 um 18:38 Uhr geändert. http://www.systemdesign.ch/index.php?title=L%C3%B6sung_zu_Reversibles_Misch... 24.03.2010