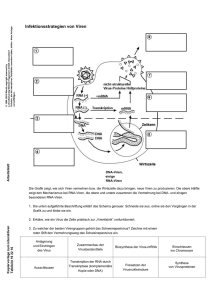
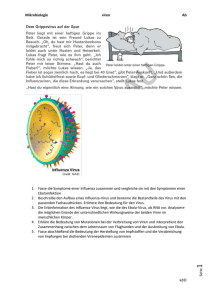
virus - InterActive MediaDesign
Werbung

Virusporträts 2005/2006 Beilagen zur Vorlesung Virologie 2005/2006 Teil I Virus Porträts M. Ackermann, H. Adler, M. Engels, C. Griot, A. Metzler, U. Müller-Doblies, D. Müller-Doblies, M. Schwyzer, N. Stäuber, M. Suter 2005 Virusporträts 2005/2006 Inhaltsverzeichnis Arboviren.......................................................................................................................... 2 AHS ...................................................................................................................... 2 BTV ...................................................................................................................... 7 FSME.................................................................................................................. 16 West-Nil-Virus ................................................................................................... 22 ASP................................................................................................................................. 27 Borna .............................................................................................................................. 32 CIRCO ............................................................................................................................ 40 Ebola............................................................................................................................... 43 HCC ................................................................................................................................ 48 Herpesviren..................................................................................................................... 51 Aujeszky ............................................................................................................. 51 BKF .................................................................................................................... 57 EHV .................................................................................................................... 61 IBR/IPV .............................................................................................................. 65 Influenza ......................................................................................................................... 74 Influenza equi ..................................................................................................... 83 MKS ........................................................................................................................... 8584 Nidovirales (Arteri- und Coronaviren) ....................................................................... 9291 EAV ................................................................................................................ 9291 EVD ................................................................................................................ 9695 FIP .................................................................................................................. 9897 PRRS .......................................................................................................... 103102 SARS .......................................................................................................... 107106 TGE ............................................................................................................ 112110 Papilloma ................................................................................................................ 121119 Parvovirosen der Fleischfresser.............................................................................. 126124 Parvovirose der Schweine ...................................................................................... 132131 Pesti ........................................................................................................................ 136135 Poxviren.................................................................................................................. 145144 Pocken ........................................................................................................ 145144 Animale Poxviren....................................................................................... 150149 Prionen.................................................................................................................... 152151 BSE............................................................................................................. 152151 SCRAPIE.................................................................................................... 161160 Retroviren ............................................................................................................... 169168 CAE ............................................................................................................ 169168 EBL............................................................................................................. 176175 EIA ............................................................................................................. 182181 FeLV........................................................................................................... 184183 FIV.............................................................................................................. 189188 Maedi .......................................................................................................... 193192 Rindergrippe ........................................................................................................... 196195 PI-3/BRSV.................................................................................................. 196195 Rotaviren ................................................................................................................ 202201 Staupe ..................................................................................................................... 212211 SVD ........................................................................................................................ 218217 Tollwut ................................................................................................................... 220219 Seite 1 Kapitel, Arboviren, AHS Arboviren AHS Autoren: Norbert Stäuber, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc AHS Afrikanische Pferdesterbe - African horse sickness Virus Die Afrikanische Pferdepest (African horse sickness, AHS) ist eine durch blutsaugende Arthropoden übertragene, saisonal auftretende, akute oder subakute, nicht-kontagiöse Infektionskrankheit der Pferde und anderer Equiden. Sie ist verursacht durch ein doppelsträngiges RNS Orbivirus (African horse sickness virus, AHSV) aus der Familie Reoviridae , und ist charakterisiert durch Fieber, Hämorrhagien und Oedeme des subkutanen Gewebes, der Lungen, der inneren Körperhöhlen und des Herzens. Besonderheiten Empfänglich für AHSV sind Equiden, Pferde sind am empfänglichsten, wo die Mortalität bis auf 95% steigen kann, sie sind aber nicht verantwortlich für das längere Überleben des Virus. Genesene Pferde sind keine Virusträger oder -ausscheider. Esel und Maultiere sind resistenter gegen AHS, und Zebras sind hochresistent, ausser mildem Fieber zeigen sie meist keine anderen Symptome. Hund erkranken nach Genuss von AHSV-verseuchtem Fleisch, epidemiologisch scheinen sie aber keine Rolle zu spielen. Weiter empfänglich sind Labornager. Antikörper gegen AHSV wurden in verschiedenen anderen Tierarten gefunden, die Bedeutung ist jedoch unklar. Geschichte Die Pferdepest ist auf dem afrikanischen Kontinent seit Jahrhunderten bekannt. Erstmals als Syndrom beschrieben wurde sie Ende des 18. Jahrhunderts nach der Einführung von Pferden, Maultieren und Eseln während der Kolonisation Südafrikas durch Europäer. 1903 wurde zum erstenmal vermutet, dass blutsaugende Insekten die Krankheit übertragen könnten, aber erst 40 Jahre später wurden Culicoides Mücken als Hauptüberträger identifiziert. Verbreitung AHS kommt endemisch in den zentralen Tropenregionen Afrikas vor. Gebunden an den Lebenszyklus des biologischen Vektors Culicoides tritt AHS gegen Ende Sommer (Trockenzeit), mit Einsetzen von feucht-warmer Witterung auf. Unregelmässige Seuchenzüge können sich nach Süden (bis Südafrika), Norden und Osten (bis Mittelmeerküste, Mittlerer Osten, Indien und Südwestasien) ausbreiten. Seite 2 Kapitel, Arboviren, AHS Kalte Witterung und Beginn des Winters beenden die Seuchenzüge. Ausbrüche wurden 1966 und 1987-1990 im Süden der iberischen Halbinsel verzeichnet. Erreger Das AHSV gehört zum Genus Orbivirus in der Familie Reoviridae. Das Prototypvirus des Genus Orbivirus ist das Blauzungen- oder Bluetongue Virus (BTV) der Schafe und Kühe. Andere nah verwandte Viren sind das Virus der epizootischen hämorrhagischen Krankheit der Hirsche (EHDV) oder das Ibaraki Virus der Kühe und Hirsche. Es existieren neun verschiedene Serotypen des AHSV. Ein Viruspartikel ist etwa 80 nm gross und ist aufgebaut aus sieben Strukturproteinen. In infizierten Zellen findet man zusätzlich 4 Nicht-Strukturproteine. Die Nukleinsäure liegt in Form einer segmentierten, doppelsträngigen RNS vor. Weitere Einzelheiten sind beim Bluetongue Virus beschrieben. Virusvermehrung und Genexpression siehe Bluetongue Virus Epidemiologie Blutsaugende, infizierte Arthropoden übertragen das Virus bei ihrer Mahlzeit auf empfängliche Vertebraten. Während der Virämie dient dann ein infiziertes Tier als Virusquelle für die Infektion weiterer Arthropoden, womit sich der Zyklus schliesst. Das Virus vermehrt sich nicht nur im VertebratenWirt, sondern auch im biologischen Vektor, beim AHSV Mücken der Gattung Culicoides. Die adulten Mücken scheinen dabei zeitlebens infiziert zu bleiben. Experimentell wurde nachgewiesen, dass auch andere Mücken (Aedes spp., Anopheles spp., Culex spp.) und Zecken (Hyalomma spp.) als biologische Vektoren wirken können. Ebenso kann das Virus mechanisch, durch Arthropoden oder iatrogen, übertragen werden. Für die Ausbreitung der Krankheit und Entstehung von Seuchenzügen sind die Vektoren hauptverantwortlich, wobei aber infizierte Vertebraten während der Inkubationszeit oder nur inapparent infizierte Tiere, wie es oft beim Zebra der Fall ist, ebenfalls ein grosses Risiko darstellen. Wo das Virus interepizootische Perioden und den Winter verbringt ist nach wie vor unklar. Es wurde ein Reservoirwirt für AHSV vermutet, jedoch gibt es keine verlässlichen Hinweise, ausser einigen serologischen Untersuchungen, wo Antikörper in Elefanten, Hunden und anderen afrikanischen Carnivoren, Kamelen, Schafen und Ziegen gefunden wurden. Die epidemiologische Bedeutung dieser Befunde ist unklar. Seite 3 Kapitel, Arboviren, AHS Desinfektion Weil das Virus nur über eine sehr geringe Tenazität verfügt, ist keine Desinfektion nötig. Infolge der Virämie ist jedoch das Fleisch als kontaminiert zu betrachten und sollte vor dem Verzehr oder der Verfütterung an Hunde gekocht werden. Mit der Milch ausgeschiedenes Virus kann durch Pasteurisation inaktiviert werden. Pathogenese Das Virus vermehrt sich vorerst im lymphatischen Gewebe. Danach tritt eine Virämie ein, die durchschnittlich 1 Woche dauert, beim Pferd aber bis 18 und beim Zebra bis 27 Tage anhalten kann. Nach einer Inkubationszeit von 3-14 Tagen treten die ersten klinischen Erscheinungen auf. Allerdings treten bei Esel, Maultier und Zebra in der Regel keine klinischen Erscheinungen auf, und dadurch können diese Tiere bei der Verbreitung der Krankheit ein grosses Risiko darstellen. Das Virus besitzt eine Affinität zu den Endothelzellen der Blutgefässe, und wurde auf und in Erythrocyten bis 90 Tage nach Infektion nachgewiesen. Virusauscheidung erfolgt über Urin, Milch und andere Körperflüssigkeiten, und intrauterine Infektionen sind möglich. Klinik Je nach Tropismus und Virulenz des Virustyps entstehen vier theoretische klinische Formen. • Die Fieberform, die nach einer Inkubationszeit von 4-5 Tagen rund eine Woche dauert und vor allem bei Esel und Zebra anzutreffen ist. Allerdings kommen bei diesen Tieren auch subklinische Infektionen vor. • Die akute oder Lungenform ist charakterisiert durch eine 3-5 tägige Inkubation, dauert bis 12 Tage, und hat beim Pferd eine fast 100%-ige Lethalität. Symptome sind Dyspnoe, Hustenparoxysmen, Lungenödem. • Die subakute oder Herzform ist etwas milder, mit einer Inkubationszeit von 7-14 Tagen und einer Dauer von bis zu 15 Tagen. Typische Symptome sind subkutane Oedeme, supraorbitales Oedem, Petechien auf Schleimhäuten und Koliken. Tod kann eintreten durch Herzversagen. • Die vierte oder gemischte Form ist diejenige, die in der Praxis am häufigsten anzutreffen ist, mit dominierenden Symptomen der einen oder anderen Form. Immunreaktion Neutralisierende Antikörper sind gegen Epitope auf dem Protein VP2 gerichtet. Gruppenspezifische Antikörper sind vor allem gegen VP7 gerichtet. Tiere, die die Krankheit überleben, sind immun gegen den homologen Virustyp, aber nur partiell geschützt gegen heterologe Typen. Passive Immunität kann durch Antikörper im Kolostrum auf das Fohlen übertragen werden und schützt dieses bis 2-4 Monate nach der Geburt. Seite 4 Kapitel, Arboviren, AHS Die hohe Prävalenz von anti-AHSV Antikörpern in einigen enzootischen Regionen Afrikas lässt vermuten, dass afrikanische Pferde und Esel, möglicherweise aufgrund einer natürlichen Selektion, relativ resistent gegen AHSV sind. Polyvalente Impfstoffe kommen bei einem Ausbruch zum Einsatz, bis das Virus typisiert ist. Lebend attenuierte, polyvalente Impfstoffe induzieren keine echte polyvalente Immunität, nur die lebend attenuierten, monovalenten Impfstoffe induzieren einen guten, zum Teil lebenslangen Schutz. Daher muss bei einem Ausbruch das Virus so schnell wie möglich typisiert werden um den monovalenten Impfstoff zur Schutzimpfung noch nicht befallener Tiere einsetzen zu können. Monovalente inaktivierte Impfstoffe sind weniger wirkungsvoll, daher sind unbedingt Wiederholungsimpfungen nötig. Prophylaxe Ausser der Schutzimpfung ist in endemischen Gebieten und bei Ausbrüchen die Verbringung der Tiere in Ställe mit Insektengittern zu empfehlen, vor allem während der Nacht. Mücken der Gattung Culicoides sind nachtaktiv. Dazu ist auch die Bekämpfung der Insekten mit Insektiziden hilfreich. Zur Verhinderung der Verschleppung der Krankheit in seuchenfreie Gebiete sind seuchenpolizeiliche Massnahmen (und deren Einhaltung) von höchster Wichtigkeit. Diagnose Die Diagnose kann gestellt werden einerseits aufgrund der klinischen Symptome, dem regionalen und zeitlichen Auftreten, sollte aber andrerseits aufgrund der möglichen Verwechslung mit anderen Krankheiten unbedingt bestätigt werden durch eine Labordiagnose. Labordiagnose Virusisolation ist möglich durch Inokulation von embryonierten Hühnereiern, intracerebrale Inokulation von Babymäusen oder direkte Adaptation des Virus an Zellkulturen. Die Identifizierung des Virus erfolgt mittels KBR, IIF, ELISA und PCR. Der Antikörpernachweis geschieht mittels gruppenspezifischen Tests wie KBR, AGID, ELISA, und typenspezifischen Tests wie HHT und SNT. Equine infektiöse Anämie, Equine infektiöse Arteritis, Milzbrand, Babesiose, Trypanosomiasen. Differentialdiagnose Bei Verdacht Einsendung von Untersuchungsmaterial soll grundsätzlich mit dem Labor abgesprochen werden. Für die Diagnostik von AHSV ist in der Schweiz das Institut für Viruskrankheiten und Immunprophylaxe in Mittelhäusern/Bern zuständig. 031 848 9211. Seite 5 Kapitel, Arboviren, AHS Untersuchungsmaterial Zur Virusisolation ist Heparin-Blut von virämischen Tieren geeignet, oder post mortem Organproben aus Lymphknoten, Milz und Lunge. Spezifische Antikörper treten ab dem 10-14 Tag nach Infektion auf und können im Serum nachgewiesen werden. Therapie Es gibt keine Virus-spezifische Therapie. Staatliche Massnahmen Vorschriften des Internationalen Tierseuchenamtes in Paris (Office international des Epizooties, O.I.E.) und des Bundesamtes für Veterinärwesen sind massgebend (O.I.E. Animal health code on AHS; Tierseuchenverordnung). Für den internationalen Verkehr mit Pferden ist der standardisierte Pferdepass mit Gesundheitszertifikat notwendig. Export von Pferden aus Infektionszonen ist nur während der ungfährlichen Saison erlaubt. Seropositive Pferde mit Impfzeugnis werden nicht diskriminiert, das heisst, sie dürfen ungehindert importiert/exportiert werden. Bestimmungen bezüglich Quarantäne, Impfungen und Untersuch auf Antikörper müssen aber berücksichtigt werden. Der Handel mit Maultieren, Eseln und Zebras ist massiv erschwert, und aus infizierten Zonen ist er gänzlich untersagt. Seite 6 Kapitel, Arboviren, Bluetongue BTV Autoren: Norbert Stäuber, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc BTV Blauzungenkrankheit - Bluetongue Disease Die Blauzungen Krankheit oder Bluetongue disease (BT) ist eine durch blutsaugende Arthropoden übertragene, saisonal auftretende, nicht-kontagiöse Infektionskrankheit der Schafe, Kühe, Ziegen und anderer Wiederkäuer. Sie ist verursacht durch ein doppelsträngiges RNS Orbivirus (Bluetongue Virus, BTV) (orbis = lat. Ring, Kreis) aus der Familie Reoviridae, und ist charakterisiert durch Fieber, Hämorrhagien und Oedeme. Besonderheiten Empfänglich für BTV sind Wiederkäuer, Schafe sind am empfänglichsten, Kühe, Ziegen und Wildwiederkäuer sind oft nur inapparent infiziert, können aber als Reservoir des Virus dienen. Je nach Virulenz des Virustyps und Rasse des befallenen Tieres entwickeln sich mehr oder weniger starke Symptome. BTV wurde nur einmal aus Nagetieren isoliert, aber experimentell sind diese empfänglich für die Infektion. Drastisch erweitert hat sich das Wirtsspektrum 1994, als in den USA nach einer Serie von Aborten und Todesfällen bei tragenden Hündinnen das BTV als Ursache erkannt wurde. Offenbar wurden Hündinnen mit Impfstoffen geimpft, die auf Zellkulturen hergestellt wurden, welche mit BTV kontaminiert waren. Das nicht oder nur ungenügend attenuierte BTV vermochte dann die geimpften Tiere zu infizieren. In einer anschliessenden Untersuchung wurde auch eine natürliche Infektion von afrikanischen Carnivoren mit BTV festgestellt. Geschichte BT als Krankheitsbild wurde das erste Mal 1881 beschrieben als epizootischer Katarrh der Merino-Schafe. 1905 wurde der Namen Bluetongue für dieses Syndrom gegeben, und 1906 wurde durch Resultate aus Filtrationsversuchen die virale Natur der Krankheit postuliert, und vermutet, dass das saisonale Auftreten mit einem Insekten-Vektor zusammenhängen könnte. 1934 wurde dann das infektiöse Agens aus Aedes-Mücken isoliert, und 1944 fanden erste Übertragungsversuche von infizierten Mücken auf Schafe statt. Kurz nach den Filtrationsversuchen und somit der Klärung der Natur des infektiösen Agens wurde mit Impfversuchen begonnen. Seite 7 Kapitel, Arboviren, Bluetongue 1908 wurde beschrieben wie das infektiöse Agens nach mehrmaliger Passage in Schafen offenbar an Virulenz einbüsste und als attenuierter Impfstoff verwendet werden konnte. Dieser Virusstamm diente für über 40 Jahre als Impfstoff, mit weltweit über 50 Millionen verimpften Dosen. Verbreitung BTV tritt entsprechend dem Verbreitungsgebiet des Vektors, blutsaugende Stechmücken der Gattung Culicoides (Stechgnitzen), in einem Gürtel nördlich und südlich des Aequators auf, zwischen 50°N und 30°S in Amerika und zwischen 40°N und 35°S in Europa, Afrika, Asien und Australien auf. Gebunden an den Entwicklungszyklus des Vektors tritt BTV saisonal auf. Seit der ersten Beschreibung in Süd-Afrika hat BTV sich kontinuierlich weltweit ausgebreitet, mit Ausbrüchen auf der iberischen Halbinsel in den Jahren 1956-60. Bis 1977 galt Australien frei von BTV, im Rahmen von epidemiologischen Untersuchungen wurde dann aber das Virus aus Mücken isoliert, und bis heute acht Serotypen identifiziert. Allerdings wurden nie klinische Ausbrüche der Krankheit in Schafen registriert. Erreger Das Blauzungen- oder Bluetongue Virus (BTV) ist das am besten untersuchte Virus, und somit das Prototypvirus, des Genus Orbivirus. Zusammen mit den Genera Reovirus, Rotavirus und Coltivirus ist es in der Familie Reoviridae eingeteilt. Nah verwandte Viren sind das Virus der Afrikanischen Pferdepest (AHSV), das Virus der epizootischen hämorrhagischen Krankheit der Hirsche (EHDV) oder das Ibaraki Virus der Kühe und Hirsche. Es existieren weltweit 24 verschiedene Serotypen des BTV, welche in regionale Gruppen eingeteilt werden können. VP2 VP5 VP7 VP3 10 Segmente dsRNS VP1 VP4 VP6 Seite 8 Kapitel, Arboviren, Bluetongue Die Struktur eines Partikels sowie die Lokalisation von Proteinen wurde gezeigt durch Kristallisation von Proteinen (VP7 bei einer Auflösung von 2.5 Angström), durch Röntgenstrahlen-Analyse und kryo-elektronenmikroskopische Aufnahmen und dreidimensionale Analyse bis zu einer Auflösung von 28 Angström. Ein Viruspartikel ist etwa 80 nm gross, ist unbehüllt, und besteht aus einer diffusen äusseren Proteinschicht gebildet von den zwei Proteinen VP2 (180 Moleküle) und VP5 (120 Moleküle). Ein Core mit ikosahedrischer Symmetrie wird gebildet von 780 Molekülen des Proteins VP7, die in 260 Trimeren angeordnet sind, sowie dem darunterliegenden Protein VP3. Darin eingeschlossen sind die Proteine VP1, VP4 und VP6 und die 10 Segmente doppelsträngiger RNS (dsRNS). Zusätzlich kommen in infizierten Zellen mindestens drei Nicht-Strukturproteine vor, NS1, NS2 und NS3. Das Genom mehrerer Serotypen ist komplett sequenziert (10 Segmente ergeben total etwa 20'400 Basenpaare). Jedes Segment kodiert für ein Protein. Mittels Expression in verschiedenen rekombinanten Systemen (wie dem Baculovirussystem) können alle viralen Proteine synthetisiert werden. Dies erlaubt das strukturelle und funktionelle Studium der einzelnen Proteine oder mehrerer zusammen gleichzeitig. Bei simultaner Synthese der Strukturproteine bilden diese leere Viruspartikel, entweder nur Core-ähnliche Partikel (VP7 und VP3) oder Virus-ähnliche Partikel (VP7, VP3, VP2 und VP5), die keine Nukleinsäure enthalten, aber ansonsten den natürlich vorkommenden Virus-Partikeln identisch sind. Dies wiederum erlaubt ein weitergehendes Studium des Virus. Zusätzlich wurde gezeigt, dass diese leeren Viruspartikel ein potenter Impfstoff sind. VP2 VP3 VP5 VP7 VP5 VP7 Core-ähnlicher Partikel Das Virus ist stabil in lipid-haltigen Lösungsmitteln sowie in nicht-ionischen Detergenzien. Monovalente und divalente Kationen können die äussere Proteinschicht destabilisieren, dies ist pH-abhängig. Virus-Partikel sind am stabilsten bei einem pH zwischen 8-9, wogegen Core-Partikel stabil sind bis zu einem pH von 5. Seite 9 Kapitel, Arboviren, Bluetongue Nicht-gereinigte Partikel in infizierten Zellen sind stark assoziert mit dem Zellskelett und bei niederen Temperaturen über lange Zeit extrem stabil. Virusvermehrung und Genexpression Viele Details des Replikations-Zyklus von BTV und Orbiviren sind noch unbekannt, es wird aber angenommen, dass die grundlegenden Mechanismen bei den Reoviridae ähnlich sind. Allerdings kommen bei Orbiviren, die sich, im Gegensatz zu Rotaviren und Reoviren, auch in Arthropoden vermehren, strukturelle und funktionelle Besonderheiten vor. Der gesamte Replikations-Zyklus spielt sich im Zytoplasma ab. Die Adsorption an Zellen wird durch das Protein VP2 vermittelt, und es wird angenommen, dass zelluläre Rezeptoren für die Bindung verantwortlich sind. Bis heute wurden jedoch diese Rezeptoren nicht identifiziert. Das CoreProtein VP7 spielt wahrscheinlich auch eine Rolle bei der Bindung, da dieses Protein ein RGD-Motiv (Arginin-GlycinAsparaginsäure) aufweist, wie es zum Beispiel auch beim Maul-und Klauenseuche Virus gefunden wird. Die Penetration des BTV ins Zellinnere geschieht durch Endozytose. Durch Verschmelzung mit Lysosomen und entsprechendem Abfall des pH werden die zwei Proteine VP2 und VP5 abgebaut und übrig bleibt der Core-Partikel. Dies führt zu einer Aktivierung der Transkription des viralen Genoms. Core-Partikel werden dann ins Zytoplasma entlassen, wo die Transkription beginnt. Der Core-Partikel bleibt im Zytoplasma intakt. Es gelang nie, nackte dsRNS von dsRNSViren im Zytoplasma nachzuweisen. Zelleigene Enzyme wie die Protein Kinase werden über dsRNS effizient aktiviert. Über nachfolgende Enzym-Kaskaden wird die Produktion von antiviralen Substanzen wie Interferon oder RNasen oder Mechanismen wie Apoptosis ausgelöst. Daher ist es für die Viren wichtig, dass keine freie dsRNS in Zellen vorkommt. Verschiedene Viren haben verschiedene Strategien entwickelt, um gegen die zelluläre Antwort gewappnet zu sein. Virale dsRNS-bindende Proteine wie NS2 bei BTV sind eine weitere Möglichkeit, die durch dsRNS induzierten antiviralen Mechanismen der Zelle zu verhindern. Messenger-RNS (mRNS) aller 10 Segmente, welche methyliert ist und am 5'-Ende ein Cap-Stuktur besitzt, wird innerhalb des Core-Partikels synthetisiert. Der negative Strang der viralen dsRNS dient dabei als Original für die Ablesung. Die mRNS wird aus dem Core ausgeschleust und virusspezifische Polypeptide und Proteine werden durch Translation am Endoplasmatischen Retikulum synthetisiert. Solche Peptide sind schon nach 2-4 Stunden nach Infektion in der Zelle nachweisbar. Die Bildung von Virus-Einschlusskörperchen in der Zelle ist ein Hinweis auf den Zusammenbau von neuen Virus-Partikeln. Seite 10 Kapitel, Arboviren, Bluetongue Dabei scheint mRNS von viralen Proteinen gebunden und in neu geformten Core-Partikeln dann zu dsRNS synthetisiert zu werden. Ebenso kommen im Zytoplasma Tubuli vor, zylindrische Stücke des viralen Proteins NS1, dessen Funktion jedoch unbekannt ist. Neu zusammengesetzte Viruspartikel, ebenso wie Einschlusskörperchen und Tubuli sind alle sehr eng assoziert mit dem Vimentin-reichen, intermediären Filament-Netzwerk des Zytoskeletons. Die Freisetzung der kompletten Viruspartikel erfolgt dann entweder durch Budding oder durch Lyse der infizierten Zelle. Das Nicht-Strukturprotein NS3 scheint bei der Virusausschleusung aus der intakten Zelle eine Rolle zu spielen. Rezeptor mRNS Endosom Core NS1 Tubuli VP2 NS3 RER VP1, 3,4, 5,6,7, NS2 Nukleus Einschlusskörper Budding Durch das segmentierte Genom von BTV besteht die Möglichkeit, dass bei einer Koinfektion verschiedene Virustypen reassortieren. Dieser Mechanismus für eine genetische Shift und Evolution von Viren ist auch von anderen segmentierten Viren bekannt. Im Zeitalter vor der Sequenzierung von Nukleinsäuren und RNS TranslationsStudien wurde diese Fähigkeit der Reassortierung genutzt, um die Kodierung der verschiedenen Segmente und die Funktionen der entsprechenden Proteine herauszufinden. In Feldinfektionen können oft gemischte Populationen von Viren isoliert werden. Es können im selben Wirt somit antigenetisch verschiedene Viren auftreten. Dabei ist die Reassortierungs-Rate im Insekten-Vektor viel höher als im Vertebraten-Wirt. Es bestehen auch Unterschiede in der Reassortierungs-Rate der verschiedenen Segmente. Trotzdem dass diese Reassortierung mit relativ hoher Frequenz vorkommt, scheint die genomische Zusammensetzung der verschiedenen Orbivirus-Stämme relativ konstant über längere Zeiträume, bedingt durch möglicherweise inkompatible Reassortanten oder Reassortanten mit niedrigerer Kompetitivität als Wildtypen. Seite 11 Kapitel, Arboviren, Bluetongue Epidemiologie Blutsaugende, infizierte Arthropoden übertragen das Virus bei ihrer Mahlzeit auf empfängliche Vertebraten. Während der Virämie dient dann ein infiziertes Tier als Virusquelle für die Infektion weiterer Arthropoden, womit sich der Zyklus schliesst. Stechmücken der Gattung Culicoides sind die biologischen Vektoren für BTV, in welchen das Virus repliziert. Im Vektor ist eine vertikale, transovarielle Übertragung des Virus möglich. Das Virus kann auch in diesen Vektoren überwintern. In verschiedenen geographischen Regionen dienen unterschiedliche Spezies als Haupt-Vektoren. Selbst innerhalb einer Spezies treten individuelle Unterschiede bezüglich Vektor-Kompetenz und -Kapazität auf. Über das Vorkommen von potentiellen Vektoren in Europa liegen nur wenige Studien vor. Weltweit gibt es über 1000 Spezies der Gattung Culicoides, aber nur 8 Spezies sind kompetente Überträger von BTV. Experimentell wurde eine Virusübertragung durch in Grossbritannien heimische Culicoides spp. gezeigt. Mehrere Culicoides spp., darunter ein Hauptüberträger von BTV und Afrikanischer Pferdepest, Culicoides imicola, sind im Mittelmeerraum heimisch, wie weit nördlich sich deren Lebensraum erstreckt ist jedoch nicht genau bekannt. Weiter wurde BTV aus Zecken isoliert. Auch eine experimentelle biologische Übertragung durch Zecken (Ornithodurus spp.) wurde nachgewiesen. Ebenso ist eine rein mechanische Übertragung von BTV durch blutsaugende Arthropoden oder auch iatrogen möglich. Eine Voraussage über das Auftreten von BTV und anderen Arboviren könnte durch Identifizierung potentieller Vektoren, deren notwendigen klimatischen Lebensbedingungen sowie durch Analyse von genetisch kompetenten Vektoren verbessert werden. Andere Möglichkeiten der Übertragung von BTV wurde gezeigt durch inifzierten Samen von virämischen Stieren zur künstlichen Besamung , jedoch offenbar nicht beim Embryotransfer, weder von der Spender-Kuh auf die Embryonen noch von Embryonen auf die Empfängerkühe. Andrerseits wurde eine transplazentare Übertragung bei Kühen gezeigt, verbunden mit teratogenen Erscheinungen. Beim Schaf ist eine intrauterine Übertragungsweise belegt. Desinfektion Weil das Virus nur über eine sehr geringe Tenazität verfügt, ist keine Desinfektion nötig. Seite 12 Kapitel, Arboviren, Bluetongue Pathogenese Nach Infektion vermehrt sich das Virus vorerst in regionalen Lymphknoten sowie eventuell Tonsillen und Milz, bevor es zu einer Virämie kommt. Das Virus scheint dabei sehr eng assoziert mit verschiedenen Blutzellen. Dabei werden in Erythrocyten-Fraktionen höhere Titer gefunden als im Buffy coat. Experimentell können T-Lymphozyten Kulturen langzeitinfiziert werden. BTV hat eine Affinität zu Endothelzellen, vor allem der kleinen Blutgefässe und Kapillaren. Mit Immunfluoreszenz wurde gezeigt, dass dies vor allem Gefässe der Epithelien betrifft. Ischämische Läsionen der Epithelien folgen den primären viralen Entzündungserscheinungen. Mechanischer Stress in Maul und nasolabialer Gegend sowie sekundär bakterielle Infektionen beeinflussen das Ausmass dieser sekundären Veränderungen. Im weiteren Verlauf der Krankheit sind pathologischanatomisch Kongestion, Oedeme und Hämorrhagien zu finden. Dies betrifft vor allem subkutanes Gewebe, den DigestionsTrakt, das kardiovaskuläre und respiratorische System sowie Lymphknoten, Milz und Nieren. Klinik Viele Wiederkäuer sind empfänglich für BTV, die klinischen Erscheinungen kommen jedoch primär beim Schaf vor. Dabei scheinen die in endemischen Regionen vorkommenden Rassen weniger empfindlich als importierte, europäische Rassen. Ebenso beeinflusst die Virulenz der verschiedenen Serotypen die Ausprägung der Symptome. Die Morbidität kann bis 50% betragen, die Mortalität variiert und kann von 0%-70% erreichen. Oft verläuft die Krankheit symptomlos oder nur mit einer Temperaturerhöhung. Bei der akuten Form treten klinische Erscheinungen nach einer Inkubationszeit von 3 bis 7 Tagen mit dem Höhepunkt der Virämie auf. Hohes Fieber über 6 bis 8 Tage, Dyspnoe, Hyperämie der Kopfschleimhäute, sowie im weiteren Verlauf eitrige Rhinitis und Lippen- und Zungenödem mit Blaufärbung der Zunge, das der Krankheit den Namen gab, können beobachtet werden. Daneben treten Ulzera und Erosionen der Schleimhäute auf. Mit beginnender Heilung der nasalen und oralen Läsionen können sich Pododermatitiden entwickeln. Die epithelialen Läsionen von Maul und nasolabialer Gegend können chronisch werden, mit Ulzerationen und Sekundärinfektionen die zu Nekrosen führen. Bei Jungtieren treten Diarrhöen auf und die Mortalität ist sehr hoch. Bei subakutem Verlauf finden sich ähnliche, aber weniger ausgeprägte Symptome. Im Verlauf von intrauterinen Infektionen entstehen Fetopathien wie Hydrocephalus, Nekrosen, Verkürzung der Gliedmassen und Aborte. Seite 13 Kapitel, Arboviren, Bluetongue Beim Rind ist die Morbidität geringer und die Mortalität klein, der Verlauf der Krankheit oft symptomlos, die Erscheinungen ansonsten ähnlich aber milder, mit Lippenödem, Speichelfluss, Nasenausfluss und Inappetenz. Immunreaktion Die zelluläre Immunreaktion ist schlecht untersucht und charakterisiert. Die humorale Immunantwort kann eingeteilt werden in Serotyp-spezifische und Serogruppen-spezifische Antwort. Die humorale Immunantwort bewirkt einen Abfall des Virustiters im Blut, scheint aber die virale Antigenkonzentration im Gewebe nicht zu beeinträchtigen. Andrerseits wird das Virus offenbar nicht vollständig aus dem Blut eliminiert. Sowohl neutralisierende Antikörper wie auch Virus können bis zu 28 Tagen im Blut nachgewiesen werden. Dabei ist es möglich, dass das Virus sich entweder in den Zellen aufhält oder durch kleine antigenetische Unterschiede des Partikels der humoralen Immunantwort temporär zu entgehen vermag. Virus-Neutralisations Tests sind das wichtigste Werkzeug zur Bestimmung des Serotyps. Neutralisierende und auch hämagglutinierende Antikörper sind gegen Epitope auf dem Protein VP2 gerichtet. Gruppen-spezifische Antikörper sind vor allem gegen VP7 gerichtet. Das Vorkommen von Virusneutralisierenden Antikörpern korreliert sehr gut mit einer protektiven Immunität gegen den homologen Virustyp. Passive Immunität durch Antikörper im Kolostrum schützen das Lamm für ungefähr sechs Monate. Tragende Auen sollten allerdings in der frühen Trächtigkeit nicht geimpft werden wegen möglichen teratogenen Auswirkungen. Der Lebendimpfstoff sollte in nicht-endemischen Gebieten während der Vektor-Saison nicht verwendet werden, da das Virus infektiös ist für den Vektor. Prophylaxe Die Schutzimpfung mit lebend attenuierten Impfstoffen wird in endemischen Gebieten durchgeführt. Zur Verhinderung der Verschleppung der Krankheit in seuchenfreie Gebiete sind seuchenpolizeiliche Massnahmen (und deren Einhaltung) von höchster Wichtigkeit. Diagnose Die Diagnose kann gestellt werden einerseits aufgrund der klinischen Symptome, dem regionalen und zeitlichen Auftreten, sollte aber andrerseits aufgrund der möglichen Verwechslung mit anderen Krankheiten unbedingt bestätigt werden durch eine Labordiagnose. Labordiagnose Virusisolation ist möglich durch Inokulation von Schafen, embryonierten Hühnereiern, intracerebrale Inokulation von Babymäusen oder direkte Adaptation des Virus an Zellkulturen von Säugetier- oder Insektenzellen. Seite 14 Kapitel, Arboviren, Bluetongue Die Identifizierung des Virus erfolgt mittels KBR, IIF, ELISA, EM, Hybridisierungsmethoden und PCR. Zur Erhöhung der Sensitivität des für lange Zeit einzigen diagnostischen Tests, der Inokulation von Schafen, wurde die sogenannte "blood autograft technique" verwendet. Es wurde festgestellt, dass diese Technik die einzig verlässliche war, um Virus von persistent infizierten Bullen nachweisen zu können. Die Methode bestand darin, dass dem Schaf, das mit Probenmaterial des zu testenden Bullen inokuliert wurde, am 5. bis 8. Tag nach Inokulation eine gewisse Menge Blut aus der Vena jugularis entnommen wurde. Dieses Blut wurde dann umgehend demselben Schaf subkutan am Hals injiziert, was offenbar zu einer Aktivierung des Virus führte. Eine Erklärung für dieses Phänomen wurde bisher nicht gefunden. Der Antikörpernachweis geschieht mittels gruppenspezifischen Tests wie KBR, IF, Agargel Präzipitation, ELISA, und typenspezifischen Tests wie HHT und SNT. Differentialdiagnose Mucosal disease/Virus Diarrhö, Infektiöse bovine Rhinotracheitis, Bösartiges Katarrhalfieber, Maul- und Klauenseuche, Vesikuläre Stomatitis oder andere Stomatitiden, Orf. Bei Verdacht Einsendung von Untersuchungsmaterial soll grundsätzlich mit dem Labor abgesprochen werden. Für die Diagnostik von BTV ist in der Schweiz das Institut für Viruskrankheiten und Immunprophylaxe in Mittelhäusern/Bern zuständig. 031 848 9211. Untersuchungsmaterial Zur Virusisolation ist Heparin-Blut von virämischen Tieren geeignet. Es wurde gezeigt, dass Blutzellen das beste Material zur Isolation von Virus sind. In Erythrocyten findet man die höchsten Virustiter über die längste Zeitperiode. Virus kann auch isoliert werden aus dem Samen von Bullen. Neutralisierende Antikörper treten ab dem 6-14 Tag nach Infektion auf und können im Serum nachgewiesen werden, ebenso wie gruppenspezifische, nicht-neutralisierende Antikörper. Therapie Es gibt keine Virus-spezifische Therapie. Staatliche Massnahmen Vorschriften des Internationalen Tierseuchenamtes in Paris (Office international des Epizooties, O.I.E.) und des Bundesamtes für Veterinärwesen sind massgebend (O.I.E. Animal health code; Tierseuchenverordnung). Seite 15 Kapitel, Arboviren, FSME FSME Autoren: Hildegard Adler, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc FSME Die Frühsommermeningoenzephalitis (FSME), auch Zeckenenzephalitis genannt, ist eine Erkrankung des ZNS, deren Erreger, ein Flavivirus, hauptsächlich durch Zeckenstich auf den Menschen übertragen wird. Geschichte 1934 wurde die Klinik der Zeckenenzephalitis im fernen Osten der damaligen Sowjetunion zum ersten Mal beschrieben. 1937 wurde das Virus isoliert und die Virusübertragung nachgewiesen. 1948 wurde die Zeckenenzephalitis zum ersten Mal in Europa erkannt. Verbreitung in Mitteleuropa, Skandinavien und den GUS in sogenannten Naturherden (s.u.) Erreger Das FSME-Virus gehört zur Familie der Flaviviren. Es ist ein behülltes Virus mit einem Durchmesser von etwa 40nm und einem ikosaedrischen Nukleokapsid und enthält eine einzelsträngige positiv-polare RNA von über 11 kb Länge, die infektiös ist. Bisher hat man zwischen einem zentraleuropäischen Subtyp und einem fernöstlichen Subtyp unterschieden. Das basierte v.a. auf der Tatsache, dass man im fernen Osten der damaligen Sowjetunion viel öfter als in Europa ein sehr schweres Krankheitsbild beobachtete. Neuere molekularbiologische Untersuchungen lassen diese Einteilung fraglich erscheinen. Seite 16 Kapitel, Arboviren, FSME Man beachte die Entstehung von M aus dem Vorläuferprotein prM durch proteolytische Spaltung, wobei die Glykosylierung verloren geht, und die davon ausgehende Konformationsänderung von E bei der Virusreifung (links unreifes Virus, welches intrazellulär gefunden wird; rechts reifer Viruspartikel, extrazellulär). C = Coreproteine, welche das Nukleokapsid bilden M = Membranprotein, prM=unreife Vorstufe von M E = Envelopeprotein, welches bei der Reifung dimerisiert und dessen Aussendomäne durch Trypsin abgespalten werden kann Elektronenmikroskopische Aufnahme von FSME Virus (negativ-Kontrast) Genexpression Es gibt ein langes offenes Leseraster (Open-Reading-Frame, ORF) mit über 10'000 Basen, der für Struktur- und Nichtstrukturproteine kodiert. Die Translation beginnt nahe des 5'-Endes des Genoms. Es wird ein langes Polyprotein synthetisiert und die einzelnen viralen Proteine werden co- und posttranslationell durch Peptidasen abgespalten. Strukturproteine 5' C prM Virusvermehrung E Nicht-Strukturproteine 3' NS1-NS5 Nach der Translation der genomischen RNA wird komplementäre negativ-polare RNA synthetisiert, die als Vorlage für die Synthese weiterer positiv-polarer RNA dient. Seite 17 Kapitel, Arboviren, FSME +RNA Nichtstrukturproteine Strukturproteine -RNA +RNA Virionen Tenazität Das FSME-Virus verliert seine Infektiosität durch Austrocknung, Pasteurisierung und Behandlung mit Formalin, H2O2, Detergentien und Aether. In unpasteurisierter Milch und Butter ist es jedoch monatelang haltbar. Epidemiologie Virusüberträger sind Zecken, in Europa hauptsächlich Ixodes ricinus (Holzbock), im fernen Osten v.a. Ixodes persucatus. Der Holzbock verbringt den grössten Teil seines Lebens freilebend am Boden oder in der Vegetation. Typische Zeckenbiotope sind Waldränder und -lichtungen, Flussauen, Schonungen mit Unterholz und Hecken. Zecken sind je nach Witterung von März/April bis Oktober/November aktiv, den Winter verbringen sie gut geschützt unter Laub, wo die Temperatur nicht unter den Gefrierpunkt sinkt und die Luftfeuchtigkeit hoch ist. Es gibt 3 Entwicklungsstadien: Larve (6 Beine), Nymphe (8 Beine), Imago (8 Beine). Zecken saugen an über 100 verschiedenen Arten von Säugern, Reptilien und Vögeln. Jedes Entwicklungsstadium braucht eine Blutmahlzeit ehe es sich weiterentwickeln kann. Diese dauert mehrere Tage. Die Kopulation findet meist vor der letzten Blutmahlzeit auf dem Wirt statt. Danach beginnt das Weibchen eine 6-11 Tage dauernde Blutmahlzeit und legt in den folgenden Monaten 500-5000 Eier in den obersten Bodenschichten ab. Adulte Männchen nehmen in einem kurzen Saugakt nur etwas Gewebeflüssigkeit zu sich. Eine Zeckengeneration vom Ei bis zur Eiablage des befruchteten Weibchens dauert, je nach Witterung, zwischen 6 Monaten und 8 Jahren. Virusübertragung: In der Zecke wird FSME-Virus transovariell (vom Imago auf das Ei, 1% Effizienz) und transstadiell (von Entwicklungsstadium zu Entwicklungsstadium übertragen). Eine infizierte Zecke bleibt zeitlebens Virusträger, das Virus vermehrt sich in ihr und besiedelt nahezu alle Organe. Die Zecke erkrankt dabei nicht. Durch Zeckenstich kann das Virus von der infizierten Zecke auf ihren Wirt und von einem infizierten Wirt auf die Zecke übertragen werden. Seite 18 Kapitel, Arboviren, FSME Auf der Schweizerkarte rot eingezeichnet sind die bekannten FSMENaturherde Naturherde sind Gebiete in denen das FSME-Virus endemisch ist und von Zecken auf ihre Wirte und umgekehrt übertragen wird. Naturherde bleiben über Jahre hinweg stabil. Wichtig für die Zirkulation des Virus im Naturherd sind dabei v.a. kleinere und grössere Wildsäuger, welche in der Regel nicht erkranken. Während ihrer Virämiephase können sich weitere Zecken beim Stich infizieren, wobei ein Mindesttiter an FSME-Virus im Blut vorliegen muss. Der Mensch gilt als Fehlwirt, da er keine ausreichend hohen Virustiter im Blut entwickelt, um das Virus weiterverbreiten zu können. Auch die Haussäugetiere scheinen bei der Verbreitung des Virus keine wesentliche Rolle zu spielen. Der Mensch kann sich auch durch den Genuss virushaltiger Milch (unpasteurisiert) infizieren, da Kühe und kleine Wiederkäuer während der Virämie in der Milch Virus ausscheiden. Dieser Infektionsweg spielt vor allem im fernen Osten eine Rolle. Ausserdem sind auch schon Laborinfektionen durch virushaltige Aerosole vorgekommen. Pathogenese Das Virus vermehrt sich zunächst in den Zellen des Infektionsortes. Danach gelangt es über den Lymphweg in die regionalen Lymphknoten, wo es sich wiederum vermehrt. Auf Blut- und Lymphweg gelangt es in Milz, Leber und Knochenmark, wo eine massive Vermehrung stattfindet. Das Virus wird nun in das Blut abgegeben. Es kommt zur Virämie, was der 1. Phase der klinischen Erkrankung entspricht. Eine starke Virusvermehrung ist Voraussetzung für die Überwindung der Blut-Gehirn-Schranke. Die Kapillarendothelzellen werden vom Lumen her infiziert, vermehren das Virus und geben es ins Gehirngewebe ab. Seite 19 Kapitel, Arboviren, FSME Das FSME-Virus kann sich auch entlang der Nervenfasern ausbreiten. Dies ist der Fall bei Laborinfektionen mit virushaltigen Aerosolen, wo das Virus über das Riechepithel und den Riechnerv direkt ins Gehirn gelangt. Immunreaktion Bildung von virusneutralisierenden, komplementbindenden und hämagglutinationshemmenden Antikörpern IgM ab 3 Wochen nach der Infektion, sind sicher 6 Wochen lang nachweisbar, können aber bis zu 9 Monaten nach der Infektion nachweisbar sein. IgG sind über Jahre hinweg nachweisbar. Klinik Die klinischen Befunde sind nicht pathognomonisch. Beim Menschen: Inkubationszeit 7-14 (2-28) Tage diphasischer Verlauf 1. Phase mit unspezifischen, grippeähnlichen Symptomen, dauert etwa 1 Woche, kann inapparent verlaufen symptomfreies Intervall: 1 Tag bis 1 Woche 2. Phase mit ZNS-Befall: Schwindelgefühle, Uebelkeit Sensoriumstörungen, Tremor, Paresen, Paralysen, hohes Fieber, in seltenen Fällen Koma und Tod Nur etwa 20-30% der Infizierten gelangen in die 2. Phase der Infektion. Bei diesen beträgt die Letalität 1-5%, 7-20% dieser Patienten tragen meist leichtere, bleibende neurologische Schäden davon. Beim Haustier wurden erst wenige Fälle bei Hund, Ziege und Pferd festgestellt. Auch hier ist die Krankheit durch zentralnervöse Symptome charakterisiert. Differentialdiagnose Boreliose, ZNS-Erkrankungen, je nach Spezies Diagnose Virusisolierung aus dem Blut in der Frühphase der Infektion (spielt prakt. keine Rolle) Virusisolierung aus dem Hirnstamm Verstorbener Antikörpernachweis (heutzutage: ELISA oder KBR): Titeranstieg bzw. IgM-Nachweis ab 3 Wochen nach Infektion Untersuchungsmaterial Serum zur Antikörperbestimmung Seite 20 Kapitel, Arboviren, FSME Prophylaxe • • • Therapie -Zeckenstich vermeiden -bei Zeckenstich Zecke herausziehen, nicht vorher mit irgendwas einreiben, da sich die Zecke sonst evt. in ihr Opfer erbricht → Virusübertragung !! Mensch: aktive Immunisierung mit Totimpfstoff passive Immunisierung für gestochene Personen bis 2 Tage nach dem Stick. Der Impfstoff kann bei Hunden Antikörper gegen FSME Virus erzeugen, ist in der Schweiz jedoch nicht für die Verwendung bei Tieren zugelassen. Symptomatisch Seite 21 Kapitel, Arboviren, WNV West-Nil-Virus Autoren: Martin Schwyzer, Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405.doc WNV West-Nil-Virus West-Nil-Virus (WNV) ist ein Arbovirus aus der Familie der Flaviviren. Durch Mücken wird WNV auf Menschen oder Pferde übertragen. Die Infektion beim Menschen beschränkt sich meist auf eine asymptomatische oder fieberhafte Virämie, aber in 1 – 2 % der Fälle gelangt das Virus ins ZNS und erzeugt eine Enzephalitis mit hoher Letalität. Das natürliche Reservoir von WNV sind Vögel. Geschichte 1937 wurde WNV erstmals isoliert aus dem Blut eines eingeborenen Patienten im West Nile District des nördlichen Uganda. Ab 1940 wurde die Verwandtschaft mit Japanischem (JEV) und Saint Louis Enzephalitis Virus (SLEV) beschrieben und die Übertragung durch Mücken nachgewiesen. Grössere Epidemien mit Hunderten bis Tausenden von Fällen traten 1952 in Israel auf, 1962 Frankreich, 1973 Südafrika, 1980 Indien, 1996 Rumänien, seit 1999 Russland, Israel und Nordamerika. In den Jahren 2000 und 2003 waren kleinere Ausbrüche aus Frankreich zu vermelden. Verbreitung Seit 1999 auf allen Kontinenten. Folgt der Verbreitung der entsprechenden Mücken, hauptsächlich Culex, aber auch andere Culicidae, z.B. Aedes, Ochlerotatus. Die Krankheit tritt saisonal auf mit dem Maximum August-September. Die Inzidenz von WNV-Enzephalitis und die damit verbundene Letalität steigt mit dem Alter der Patienten. Höchste Aufmerksamkeit wurde WNV zuteil, als das Virus 1999 erstmals auf dem amerikanischen Kontinent (New York) auftrat und sich in den drei folgenden Jahren über den ganzen östlichen Teil von Nordamerika ausbreitete. Im Jahr 2002 wurde der erste Fall von der Westküste gemeldet. Im Jahr 2003 verlagerte sich die Hauptaktivität, mit 3'000 Fällen allein in Colorado und 2'000 Fällen in Nebraska, auf das Gebiet zwischen die Rocky Mountains und den Mississippi. Die Medien nehmen die aktuelle Epidemie selektiv wahr. Schwerer verlaufende Epidemien mit WNV in Russland (1999) und mit SLEV in USA (1975) fanden weniger Beachtung. Seite 22 Kapitel, Arboviren, WNV Erreger Familie Flaviviridae, behülltes Virus, C, M und E Protein, 7 Nichtstruktur-Proteine, positiv-einzelsträngige RNA mit ~11'000 Nukleotiden. Genexpression und Virusvermehrung verläuft analog zu anderen Flaviviren (siehe FSME). Abbildung. Elektronenmikroskopische Aufnahme von WNV. Verozellen wurden mit einem Hirnextrakt einer tot aufgefundenen Krähe inokuliert. Drei Tage später wurden die Zellen Glutaraldehyd fixiert, dehydriert, in Epon eingebettet, für EM-Untersuchungen geschnitten, auf ein Kupfergrid verbracht, mit Uranyl Acetat und Bleizitrat gefärbt. Die dunklen Punkte (Pfeil) stellen West-Nil-Viruspartikel bei einer 65'000fachen Vergrösserung dar. (Quelle: CDC, Atlanta, http://www.cdc.gov/ncidod/dvbid/westnile/flaviviruses_1.htm) Subtypen Serologisch und mit Sequenzanalysen lassen sich Subtypen mit unterschiedlicher regionaler Verbreitung unterscheiden. Subtyp 1a kommt weltweit vor ausser in Australien und Indien. Subtyp 1b (auch als Kunjin Virus bezeichnet) wurde nur in Australien gefunden und Subtyp 1c in Indien. Subtyp 2 ist auf das südliche Afrika und Madagaskar beschränkt. Isolate von 1999 aus New York gehören zum Subtyp 1a und sind 99,7 % identisch mit Isolaten aus Israel, was eine Einschleppung aus diesem Land vermuten lässt. Seite 23 Kapitel, Arboviren, WNV Epidemiologie Der natürliche Übertragungszyklus von WNV ist MückeVogel-Mücke. Viele Spezies von Vögeln lassen sich infizieren und können hohe Virämietiter entwickeln. Wie für andere Flaviviren sind Mücken vermutlich nicht nur passive Virusträger, sondern sie tragen zur Vermehrung des Virus bei. Eine ganze Reihe von Tieren sind empfänglich. Das Virus wurde schon in Affen, Hunden, Katzen, Kaninchen, Skunks, Eichhörnchen, Alligatoren und Fledermäusen nachgewiesen. Im Jahre 2002 wurden in den USA 14'500 Fälle von WNVErkrankungen bei Pferden festgestellt, wovon 4'500 starben oder euthanasiert werden mussten. Im Jahr 2003 verringerte sich die Inzidenz auf 5'181 Fälle, während bis zum 26. August 2004 noch 351 neue Fälle zu verzeichnen waren. (Quelle und Aktualisierungen: CDC, Atlanta, http://www.aphis.usda.gov/vs/nahps/equine/wnv) Direkte Übertragung zwischen Menschen oder Säugetieren galt bis vor kurzem als ausgeschlossen, d.h. alle Säugetiere waren als Endwirte zu betrachten. Jedoch traten 2002 in USA erstmals Fälle von WNV-Erkrankung auf - mit gravierenden Symptomen ähnlich der Kinderlähmung - die einer direkten Übertragung durch Blut- oder Organspenden zugeschrieben wurden. Deshalb muss die Überwachung der Spender auf HIV, Hepatitis- und andere Viren künftig dringend auch WNV umfassen. Seite 24 Kapitel, Arboviren, WNV Pathogenese Mensch: Erste Replikation vermutlich in Haut und regionären Lymphknoten, gefolgt von primärer Virämie und Übertritt ins Retikuloendothelial-System. Von dort sekundäre Virämie und Durchbruch der Blut-Hirn Schranke möglich. Neurovirulenz wird zum Teil durch das virale E Protein, zum Teil durch Wirtsfaktoren bestimmt. Pathogenese im ZNS beruht auf Virusreplikation in Neuronen und Glia, zytotoxischer Immunabwehr und perivaskulärer Entzündung, speziell in Thalamus, Medulla, Hirnstamm und oberes Rückenmark. Pferd: grundsätzlich gleich. Klinik Mensch: Die Mehrzahl der WNV Infektionen verläuft asymptomatisch. Inkubationszeit für symptomatische Infektionen 2-6 Tage. Plötzliches Fieber über 39°C, Kopf- und Muskelschmerzen. Gastrointestinale Symptome, Hautausschläge und Lymphadenopathien können zusätzlich auftreten. Tritt nur Meningitis auf, so verläuft sie im allgemeinen gutartig. Enzephalitis kann plötzlich beginnen, mit oder ohne vorhergehende Fieberphase. Wie bei anderen ArbovirusEnzephalitiden sind Änderungen im mentalen Status, Erbrechen und Muskelschwäche zu beobachten. Schlaffe Lähmung der Extremitäten, Blasenschwäche und Schluckbeschwerden sind weitere mögliche Symptome. Etwa 15 % der Fälle führen zum Koma. Lähmung der Atemmuskulatur erfordert künstliche Beatmung. Rund die Hälfte aller Enzephalitis Patienten bleiben mit langfristigen physischen oder kognitiven Schäden behaftet. Pferd: Enzephalomyelitis mit hohem Fielber (40°C), wobei eine subklinische, asymptomatische Infektion auch vorkommen kann. Vögel: Viele Spezies sind inapparent infiziert. Tote Vögel mit WNV kommen jedoch vor. In USA gilt dies vor allem für Krähen und dergleichen, die als Warnsignal für die WNVÜberwachung dienen können. Immunreaktion Zellgebundene (vor allem zytotoxische CD8 T-Zellen) und humorale Immunantwort (virusneutralisierende Antikörper). Wegen der Art der Verbreitung durch Insekten ist die Immunität in der Bevölkerung sehr gering, vielleicht mit Ausnahme einiger Gebiete wie Ägypten, wo WNV endemisch ist. Diagnose Aufgrund der klinischen Symptome und dem regionalen und zeitlichen Auftreten; sollte durch Labordiagnose bestätigt werden. Seite 25 Kapitel, Arboviren, WNV Labordiagnose Antikörper gegen WNV im Serum: Mindestens 4-facher Titeranstieg zwischen Akutphase und Rekonvaleszenz, bestimmt durch SNT, HHT oder ELISA. Andere Flaviviren müssen durch parallele Tests ausgeschlossen werden. Serum IgM persistiert in der Zerebrospinalflüssigkeit (CSF) mancher Enzephalitis Patienten (obwohl die Viren selbst offenbar nicht persistieren) und kann mit «antibody capture» ELISA nachgewiesen werden. Virusnachweis: Aus Blut oder CSF lässt sich Virus nur während der ersten Tage isolieren in Zellkulturen oder Babymäusen. Nachweis von Virusgenomen ist mit konventioneller oder TaqMan RT-PCR möglich. Post mortem: ZNS-Immunhistochemie. Differentialdiagnose Mensch: Durch andere Arboviren hervorgerufene Enzephalitiden, Herpes Enzephalitis, Guillain-Barré Syndrom, bakterielle Meningoenzephalitis. Pferd: Tollwut, andere arbovirale Infektionen, Botulismus. Bei Verdacht Institut für Viruskrankheiten und Immunprophylaxe (IVI) benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. Untersuchungsmaterial Blut (Heparin/EDTA, Serum), Liquor, Gehirn. Nach Absprache an das INSTITUT FÜR VIRUSKRANKHEITEN UND IMMUNPROPHYLAXE, 3147 Mittelhäusern senden. Prophylaxe Eine Schutzimpfung für Menschen existiert nicht. Epidemien sind darum über die Vektoren zu bekämpfen. Dazu gehört Verminderung der Anzahl Mückenlarven durch geeignete Massnahmen. Culex Mücken sind nachtaktiv (von Abenddämmerung bis Morgendämmerung). Zu dieser Zeit empfiehlt sich Schutz vor Stichen durch Kleidung, Insektensprays und Insektengitter. Für Pferde wurden Impfstoffe entwickelt, aber deren Wirkung ist noch nicht definitiv etabliert. In den USA sind ein inaktivierter Impfstoff ("West-Nile-Innovator") sowie ein rekombinanter Lebendimpfstoff auf der Basis eines Canarypox-Vektors ("Recombitek") zugelassen. In der Schweiz und in der EU sind beide Impfstoffe (noch) nicht zur Verwendung freigegeben worden. Therapie Symptomatisch. Therapie zerebraler Ödeme, Respirationshilfe, Vermeidung bakterieller Infektionen. Therapieversuche wurden gemacht mit Interferon-alpha, Ribavirin und humanem Immunoglobulin, ohne überzeugenden Erfolg. Seite 26 Kapitel, ASP ASP Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc ASP Afrikanische Schweinepest Fieberhafte Viruserkrankung, die perakut, akut, chronisch oder inapparent verlaufen kann. Beim perakut-akuten Verlauf hat das klinische Bild den Charakter einer Septikämie und geht mit typischen durch Hämorrhagien verursachten, zyanotischen Veränderungen verschiedener Hautpartien (Ohren, Bauch, Extremitäten) einher. Besonderheiten Hohe Tenazität. Besonders in Fleisch- und Fleischprodukten, bleiben die Viren monatelang infektiös. Keine neutralisierenden Antikörper. Keine Impfstoffe. Hochvirulente Virusstämme töten fast 100% der Schweine innert 6 bis 10 Tagen. Schwach virulente Stämme führen zu milder bis initial subklinischer Infektion, die allerdings sehr oft zu immunpathologischen Folgekrankheiten führt. Geschichte Erstmals 1921 durch Montgomery als tödliche Erkrankung europäischer Hausschweine in Afrika beschrieben. Seit ca. 1960 auf der iberischen Halbinsel endemisch (Einsatz einer attenuierten Vakzine begünstigte die Bildung eines Reservoirs). Natürliches Virusreservoir in afrikanischen Warzen- und Buschschweinen, sowie in Zecken. Zwischen 1978 und 1980 Ausbreitung der Seuche auf karibische Inseln, Malta, Sardinien, Brasilien. Ausbrüche auf dem europäischen Festland: 1960 Frankreich, 1985 Belgien, 1986 Holland. Verbreitung Endemisch in südl. Hemisphäre v. Afrika, sowie auf der Iberischen Halbinsel und Sardinien. Sporadische Ausbrüche im übrigen Europa (1985 Belgien, 1986 Holland) und weltweit (Karibik, Brasilien). Erreger Ungewöhnliches DNA Virus, das sich im Zytoplasma vermehrt. Ø 125-300 nm, behüllt, ikosahedrale Symmetrie des Kapsids. dsDNA mit 160-200kbp, nicht segmentiert, kovalente Verbindung der beiden DNA Stränge an den Genomenden. Diverse Enzyme im Viruspartikel. Zytoplasmatische Vermehrung mittels viraler Transkriptasen. Wurde früher zu den Iridoviren gerechnet und ist heute der einzige Vertreter in einer Virusfamilie, die noch keinen Namen trägt. Über 100 virale Proteine. Seite 27 Kapitel, ASP Virusvermehrung Adsorption über zelluläre Rezeptoren oder Internalisierung über opsonisierende Antikörper. Mehrphasiges "uncoating" mit Freisetzung viraler Enzyme und Synthese von frühen (early) viralen Proteinen. Erst anschliessend erfolgt die Replikation des Genoms, sowie die Synthese von späten (late) Proteinen, welche in erster Linie Struktureinheiten der neuen Virusgeneration darstellen. Das ASP Virus verfügt über mehrere Kapsidschichten und über mindestens zwei Hüllen. Die Form des Kapsids ist im EM als typische ikosahedrale Struktur zu erkennen. Es sind nur wenige Details über den molekularen Aufbau bekannt. Obwohl ASPV DNA in den Kernen infizierter Zellen nachgewiesen werden kann, muss man davon ausgehen, dass die meisten Schritte der Transkription und der Replikation im Zytoplasma ablaufen. Die ASP Viren tragen alle notwendigen Faktoren für ihre Vermehrung mit sich im Viruspartikel. Strategie der ASPV Replikation Virion Enzyme dsDNA mRNA mRNA "early" Proteine "late" Proteine neue dsDNA neue Virusgeneration Genexpression Weil die Transkriptionsfakoren der Zelle praktisch nicht in die Virusvermehrung involviert sind, haben sich die viralen Faktoren unabhängig von der Zelle entwickelt und unterscheiden sich stark von zellulären Faktoren. Die Gene des ASP Virus sind deshalb ohne die viralen Faktoren in der Wirtszelle "stumm" und werden nicht exprimiert. Infolgedessen verläuft die Vermehrung und Genexpression von ASPV nach einem streng geordneten, hierarchischen Prinzip ab, das von den viralen Transaktivatoren kaskadenartig gesteuert wird. Frühe und späte Gene sind in kleinen Gruppen zusammengefasst. Die einzelnen Gruppen sind teilweise überlappend angeordnet und über das ganze Genom verteilt. Das Genom kann in eine stark konservierte, zentrale Region und mehr oder weniger variable Genomenden unterteilt werden. In den variablen Genomteilen wurden einige echte Multigenfamilien gefunden, welche möglicherweise eine wichtige Rolle bei der Maskierung der ASP Viren vor dem Immunsystem erfüllen. Seite 28 Kapitel, ASP Epidemiologie Verbreitung durch Verfütterung ungekochter Abfälle aus Metzgereien und Hotelküchen (Belgien, Holland). Zecken, Wildschweine (Afrika). Ständige Bedrohung durch illegalen Import von Fleischwaren aus Spanien und Portugal im Reiseverkehr. Desinfektion 5% Formalin, phenolhaltige Desinfektionsmittel, zusätzlich heisse, hochprozentige Natronlauge. Pathogenese Übertragung direkt von Tier zu Tier oder indirekt über kontaminiertes Futter. In Afrika spielen Zecken der Gattung Ornithodoros (O. moubata) als Überträger eine wichtige Rolle. Bei uns kann der Tierarzt durch unhygienische Handhabung von Injektionsmaterial für die iatrogene Verbreitung verantwortlich sein. Zielzellen des ASP Virus sind die Monozyten und Makrophagen. Bei peroraler Infektion werden diese via Tonsillen und Lymphwege erreicht. Bei parenteraler Inokulation (Zecke, Nadel) werden die Zielzellen direkt im Blutstrom infiziert. Da sich die ASP Viren in den Makrophagen und anderen Antigen-präsentierenden Zellen vermehren und diese dabei zerstören, wird das Immunsystem stark beeinträchtigt. Bestehende Antikörper können die Infektion von Makrophagen durch Opsonisierung begünstigen. In einer zweiten Phase der Virusreplikation kommt es zu einer starken und lang anhaltenden Virämie, wobei sich die ASP Viren an die Erythrozyten anhaften können (Haemadsorption) und so effizient im ganzen Körper verteilt werden. Die Opsonisierung der Ec-gebundenen Viren kann in Verbindung mit Komplement zu hämolytischen Ereignissen führen, welche das Auftreten von Hämorrhagien erklären können. Infolge der Schädigung des Immunsystems kann die Virämie wochen- und monatelang bestehen bleiben, eine wichtige Voraussetzung für die Übertragung durch Zecken. Klinik Es werden perakute, akute, subakute, chronische, inapparente und atypische Formen von ASP unterschieden. Die perakute Form wird von sehr unspezifischen Symptomen, wie Fieber und plötzlichen Todesfällen begleitet. Bei der akuten Form werden zuerst sehr hohes Fieber (bis über 42°C) Inappetenz und Somnolenz beobachtet. Nach 3 bis 6 Tagen treten hämorrhagische Veränderungen auf der Haut, speziell an den Ohren und Extremitäten auf. Seite 29 Kapitel, ASP Erbrechen, Durchfall, Aborte, motorische Inkoordination, Keuchen und Husten können ebenfalls beobachtet werden. 4 bis 8 Tage nach dem Auftreten der ersten Symptome sterben die meisten Tiere an Kreislaufinsuffizienz und Herzversagen. Bei der subakuten Form werden ähnliche Symptome beobachtet. Der Krankheitsverlauf ist jedoch protrahiert und die Symptome erscheinen milder. Die Mortalität sinkt auf 60 bis 90%. Tiere, welche die subakute Krankheit überleben erholen sich in der Regel nicht völlig, sondern entwickeln mit der Zeit die chronische Krankheitsform, welche sehr oft mit Pneumonie einhergeht. Ausserdem entwickeln sich Hautläsionen in Form von nekrotischen Ulzerationen an Ohren, Gelenken, Schnauze und Schwanzspitze. Weiche, schmerzfreie Schwellungen über den Karpal- und Tarsalgelenken, sowie im Bereich der Schnauze werden öfters beobachtet. Die chronische Krankheitsform kann sich über Monate hinweg ziehen. In der Regel erholen sich die Schweine nicht mehr, sondern bleiben krankheitsanfällig und unwirtschaftlich. Die atypische und subklinische Form der ASP wird durch Infektion mit wenig virulenten Virusstämmen verursacht. Klinische Symptome, ähnlich wie bei der chronischen Erkrankung, entwickeln sich oft erst Monate nach der eigentlichen Infektion. Da die Tiere oft über Monate hinweg virämisch bleiben, sind mit grosser Wahrscheinlichkeit immunpathologische Vorgänge an der Ausbildung der atypischen ASP beteiligt. Immunreaktion Sowohl das zelluläre, wie auch das humorale Immunsystem wird durch die Infektion mit ASP Virus stimuliert. Bei der Überwindung der Infektion kommt der zellulären Komponente die grösste Bedeutung zu. Je nach Virulenz des Virusstammes kommt es zur Bildung von Antikörpern oder auch nicht. Bei hochvirulenten Virusstämmen erfolgt der Tod so rasch, dass keine Antikörper nachgewiesen werden können. Bei protrahiertem Krankheitsverlauf treten hohe Konzentrationen von Antikörpern auf, die sowohl für die Pathogenese, als auch für die Diagnostik eine wichtige Rolle spielen. Impfprophylaxe Nicht möglich. Diagnose Bei septikämischen Krankheitsbildern an Schweinepest denken. Typische Symptome sind rascher, tödlicher Krankheitsverlauf, Hämorrhagien an Ohren und Extremitäten, blutige Durchfälle. Hämorrhagisch verfärbte Organe bei der Sektion. Differentialdiagnosen Klassische Schweinepest (KSP). Andere Septikämien (E.Coli, Salmonellen, Mannheimien) aber auch Vergiftung (Aflatoxin). Seite 30 Kapitel, ASP Bei Verdacht Institut für Viruskrankheiten und Immunprophylaxe (IVI) 031 848 9211 benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. Untersuchungsmaterial Tonsillen, Lymphknoten, Milz, Niere, Gehirn und Blut. Nach Absprache an das INSTITUT FÜR VIRUSKRANKHEITEN UND IMMUNPROPHYLAXE, 3147 Mittelhäusern senden. Labordiagnose Immunhistochemie an Organschnitten kann innert Stunden ein positives Ergebnis liefern. PCR-Technik etabliert. Virusisolation in Zellkulturen (Makrophagen) dauert mehrere Tage. Hämadsorption nach Malmquist. Bestandesserologie. Seite 31 Kapitel, Borna Borna Autoren: Doris Müller-Doblies, Mark Suter, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc Borna Bornasche Krankheit; Borna (virus) disease; BD Die Bornasche Krankheit ist eine virusbedingte, akut bis subakut verlaufende, progressive Meningoenzephalomyelitis. Sie kommt als Einzeltiererkrankung vor allem bei Pferden und Schafen in geographisch eng umschriebenen Gebieten (Endemiegebieten) vor. Der Verlauf ist fast immer tödlich. Besonderheiten Der Nachweis von Antikörpern gegen Bornaviren und/oder von viraler RNA in Proben vom Menschen ist schon verschiedentlich beschrieben worden. Dabei wurde häufig eine positive Korrelation zwischen diesen positven Befunden und psychiatrischen Erkrankungen beobachtet. Ob das Bornavirus den Menschen wirklich infizieren kann und ob es bestimmte Krankheitsbilder verursacht, ist jedoch im Moment noch nicht völlig gesichert. Geschichte Erste Berichte über die sogenannte "Kopfkrankheit des Pferdes" stammen aus dem Jahr 1767. In weiterer Folge wurde immer wieder über Enzephalitiden und Myelitiden bei Pferden berichtet, die vermutlich auf das Virus der Bornaschen Krankheit zurückzuführen sind. Den heutigen Namen erhielt die Krankheit 1894/95, als mehrere hundert Pferde in und um die Stadt Borna (Sachsen) während einer Epidemie verendeten. 1909 fanden Joest und Degen Kerneinschlusskörperchen in den Gehirnen von kranken Pferden, vor allem im Bereich des Hippocampus. In den 20er Jahren gelang die erste Übertragung der Krankheit auf Kaninchen, die mit Hirnhomogenat von erkrankten Pferden inokuliert worden waren. Der Verdacht auf eine Virusätiologie drängte sich auf, nachdem die Übertragung auch mit filtriertem, bakterienfreien Material gelang. 1929 wurde der sogenannte "Strain V" isoliert, der bis heute als Laborstamm Verwendung findet. In den 50er und 60er Jahren wurde Bornasche Krankheit als die häufigste Todesursache bei Schafen in manchen Regionen der damaligen DDR angegeben. In den 70er Jahren gelang zum ersten Mal die Virusanzüchtung in Zellkultur. In der Schweiz wurde die Krankheit 1976 zum ersten Mal beschrieben. Seite 32 Kapitel, Borna Seit dem Ende der 70er Jahre sorgen Berichte über Bornaspezifische Antikörper bei Menschen für zunehmendes Interesse an dieser Krankheit, während ihre veterinärmedizinische Bedeutung kontinuierlich in den Hintergrund gedrängt wird. 1994 wurde das komplette Genom sequenziert, und im gleichen Jahr erfolgte die erste Darstellung von Viruspartikeln im Elektronenmikroskop. Verbreitung Das klassische Krankheitsbild der Bornaschen Krankheit bei Pferden und Schafen wurde bisher nur in bestimmten Gebieten Deutschlands (Sachsen, Sachsen-Anhalt, Thüringen, Württemberg und Bayern), in der Ostschweiz, dem Fürstentum Liechtenstein und in Österreich (Vorarlberg) beobachtet. Dabei decken sich die Verbreitungsgebiete von Erkrankungsfällen bei Schaf und Pferd weitgehend. Der Bornaschen Krankheit ähnliche Krankheitsbilder sind von Straussen (Israel) und von Katzen bekannt ("Staggering disease") (Schweden, Österreich). Bedeutung CH Die Krankheit kommt nur in der Ostschweiz (Bündner Herrschaft) und im FL vor. Meist erkrankt nur ein Tier pro Betrieb, selten mehrere. Es gibt aber auch Berichte über das seuchenhafte Auftreten innerhalb eines Betriebes, dem innerhalb kurzer Zeit viele Tiere zum Opfer fallen können. Abbildung 1. Borna Fälle Schweiz, 1990-1996. (Quelle: Hanspeter Meier et al.: "Equinella 1996" Seite 10) Seite 33 Kapitel, Borna Erreger Seit 1996 wird der Erreger in die Ordnung Mononegavirales eingeteilt. Darin ist das Genus Bornavirus der bislang einzige Vertreter der Familie Bornaviridae. Das Virus ist behüllt und hat einen Durchmesser von 80 bis 100 nm. Abbildung 2. Ultradünnschnitt durch ein Bornavirus. Der Pfeil zeigt auf das schwach sichtbare Nukleokapsid, der Balken entspricht einer Länge von 100nm. Die Abbildung stammt aus der Arbeit von TAKEHIRO KOHNO et al., JOURNAL OF VIROLOGY, Jan. 1999, p. 760–766. Das Genom besteht aus einer negativ polaren, einzelsträngigen RNA (-ssRNA) mit circa 8900 Basen. Die Genomorganisation ähnelt derjenigen des Tollwutvirus oder des Staupevirus. NP P M 3' 0 ? 1 L 5' G 2 3 4 5 6 Thousands 7 8 9 Abbildung 3. Genomorganisation des Bornavirus (skaliert). NP = Nucleoprotein (p38/40), P = Phosphoprotein (p24), M = Matrixprotein (p18), G = Glykoprotein (p56), L = grosses (large) Polyprotein mit Replicase Aktivität (p180). ? = kleines ORF, das für ein p10 mit noch unbekannter Funktion kodiert. Virusvermehrung und Genexpression Das Virus kann in Zellkulturen von verschiedensten Spezies gezüchtet werden. Es induziert keinen zytopathischen Effekt. Sowohl Replikation als auch Transkription finden, ungewöhnlich für ein RNA-Virus, im Zellkern statt. In Analogie zur Replikation der Paramyxoviren wird ein Gradient subgenomischer mRNAs gebildet und translatiert. Seite 34 Kapitel, Borna Epidemiologie Die Epidemiologie ist in vielen Punkten noch ungeklärt. Als natürliche Wirte sind bisher Pferde, Schafe, Rinder, Kaninchen, Ziegen, Hirsche, Alpakas, Lamas und eventuell Strausse und Katzen bekannt. Experimentell lassen sich viele Tierarten infizieren, so z.B. Affen, Hühner, Ratten und Mäuse. Bei klinisch erkrankten Tieren wurde Virus-RNA bisher in Speichel, Nasen- sowie Konjunktivalsekret nachgewiesen. Ob die hauptsächliche Übertragung auf einem dieser Wege erfolgt, ist allerdings nicht geklärt. Eine Übertragung via Futter, Wasser, Staub oder Sperma sowie eine vertikale Übertragung konnten bisher nicht beobachtet werden. Ob und in welchem Ausmass neben den klinisch manifesten Erkrankungen auch subklinische oder latente Infektionen vorkommen, ist nach wie vor umstritten. Untersuchungen deuten darauf hin, dass es weltweit Seroreagenten bei verschiedenen Tierarten gibt. Ob diese aber als Virusreservoir dienen und damit für die Weiterverbreitung des Virus von Bedeutung sind, bedarf weiterer Abklärung. Die Erkrankung tritt vor allem in den Frühlings- und Sommermonaten auf. Die Zahl der Krankheitsfälle folgt einem zyklischen Verlauf mit Höhepunkten alle paar Jahre. Ungeklärt ist, in welchem Reservoir das Virus über Jahre persistieren kann, bevor es zu neuen Ausbrüchen kommt. Desinfektion Das Virus kann mit üblichen Desinfektionsmittel ebenso wie durch UV-Strahlung inaktiviert werden. Durch seine lipidhaltige Hülle ist es empfindlich gegenüber Detergentien. Pathogenese Das Virus ist neurotrop. Virales Antigen kann vor allem in Neuronen und Astrozyten in verschiedenen Hirnarealen gefunden werden, wobei der Hirnstamm und das Kleinhirn weitgehend ausgespart bleiben. Am häufigsten werden Zellen in der Hippocampusregion infiziert. Auf welchem Weg das Virus ins Gehirn gelangt, ist nicht geklärt. Diskutiert wird ein intraaxonaler Transport über den N. olfactorius. Die Virusausbreitung im ZNS erfolgt intraaxonal und von dort zentrifugal in periphere Nerven. Das Virus selbst ist nicht zytopathogen, die Erkrankung wird vielmehr durch das Immunsystem des Wirtes ausgelöst. Bei der natürlichen Infektion von Pferden und Schafen sind es vor allem CD4+-T-Zellen (Abbildung 4) und, in etwas geringerem Ausmass, CD8+-T-Zellen, die im perivaskulären Infiltrat gefunden werden und die durch Interaktion mit Neuronen deren Zerstörung auslösen sollen. Die MHC-I- und MHC-IIExpression der Zellen in den entzündeten Gebieten verbleibt intakt. Im Rattenmodell werden in der chronischen Phase vor allem zytotoxische CD8+-T-Zellen dafür verantwortlich gemacht. Seite 35 Kapitel, Borna Abbildung 4. CD4+-T-Zellen (rot angefärbt) als pathogenetischer Faktor bei Borna von Pferd und Schaf. Caplazi and Ehrensperger (1998). Immunreaktion Die Krankheit wird nicht durch das Virus per se, sondern durch die zelluläre Immunreaktion des Wirtstieres ausgelöst. Als Beweis dafür dienen u.a. athymische oder immunkompromittierte Ratten, die nicht erkranken, obwohl eine massive Virusvermehrung im Gehirn stattfindet. Bei den meisten klinisch kranken Tieren können Antikörper sowohl im Blut als auch im Liquor nachgewiesen werden. Diese erreichen aber nur niedrige Titer und sind kaum oder gar nicht in der Lage, das Virus zu neutralisieren. Impfprophylaxe Derzeit ist in der Schweiz kein Impfstoff zugelassen. Alle Versuche, inaktiviertes Virus oder gereinigtes Virusantigen als Impfstoff zu verwenden, sind bisher fehlgeschlagen. Eine Lebendvakzine nach Zwick, die während mehrerer Jahrzehnte angewandt wurde, bestand aus einer Gehirnsuspension von infizierten Kaninchen. Die Virulenz wurde zuvor durch mehrere Passagen in Kaninchen reduziert. Dieser Impfstoff war in lyophilisierter Form unter dem Namen "Dessau" im Gebiet der ehemaligen DDR bis zum 30.6.1992 zugelassen. Seine Wirkungsweise war jedoch ebenso wie der Impferfolg umstritten. Manche Untersuchungen sprechen sogar von höheren Verlusten unter geimpften Tieren, während andere keinen Unterschied zu nichtgeimpften Populationen feststellen konnten. Von den geimpften Tieren entwickelte nur ein kleiner Teil nachweisbare Antikörpertiter, die nach wenigen Wochen wieder unter die Nachweisgrenze gesunken waren. Über die Ausbildung einer zellulären Immunität gibt es in diesem Zusammenhang keine Untersuchungen. Seite 36 Kapitel, Borna Staatliche Massnahmen In der Schweiz gibt es zur Zeit keine staatlichen Massnahmen. In Deutschland ist die Krankheit meldepflichtig. Klinik Die Inkubationszeit wird mit mehreren Wochen angegeben. Die Krankheit beginnt mit unspezifischen Symptomen wie erhöhter Körpertemperatur, Anorexie, unphysiologischer Körperhaltung, Änderungen im Verhalten, Absonderung von der Herde (Schaf). Im weiteren Verlauf kommt es zu zunehmenden Störungen im Sensorium, Depression, Ataxien und somnolentem Verhalten. Bei Schafen wird oftmaliges plötzliches Niederstürzen beobachtet. Im Verlauf von 2 bis maximal 4 Wochen kommt es zu einer zunehmenden Verschlechterung, die in der Regel mit dem Tod des Tieres endet. Es ist nur eine symptomatische Therapie möglich. Abbildung 5. Klassisches Symptom: "Pfeifenrauchersyndrom" beim Pferd. Seite 37 Kapitel, Borna Diagnose Intra vitam: Derzeit gibt es keine labordiagnostische Methode, die einen klinischen Verdacht mit Sicherheit bestätigen oder falsifizieren kann. Post mortem: • Histopathologie: disseminierte, meist mononukleäre Meningitis, Polioenzephalomyelitis, neuronale Degeneration, eventuell mit Kerneinschlusskörperchen (beim Pferd häufiger als beim Schaf). Bevorzugte Lokalisation ist der Hippocampus. • Immunpathologie: Mit Hilfe von monoklonalen Antikörpern gegen p38/40 und p24 kann Virusantigen in Gehirnzellen nachgewiesen werden. • RT-PCR von Gehirnmaterial: Nachweis viraler Nukleinsäure • Antikörperbestimmung: In Serum, Liquor und eventuell Gehirnhomogenat können spezifische Antikörper nachgewiesen werden Differentialdiagnosen Pferd: Tetanus, Tollwut, Enzephalomyelitiden unterschiedlicher Genese (z.B. Eastern-, Western Enzephalomyelitis), EHV1, Hirnabszesse, Neubildungen Schaf: Listeriose, Border disease, Tollwut, Scrapie, Louping Ill, Enterotoxämie, Visna bzw. CAE (Ziege), Coenurose, Hirnabszesse, Trächtigkeitsketose, Cu-Mangel, Neubildungen Bei Verdacht In der Schweiz besteht keine Anzeigepflicht. Eine symptomatische Therapie kann versucht werden, zumal auch über Fälle von Selbstheilung berichtet wird. Meist ist aber aus tierschützerischen Gründen die Tötung angezeigt. Regelmässige Blutentnahmen (Serum) während des Krankheitsverlaufes und Entnahme von Liquor sind für eine Antikörperverlaufskurve interessant und können den klinischen Verdacht erhärten. Untersuchungsmaterial Zu Lebzeiten des Patienten sollten Serum und Liquor auf Antikörper untersucht werden. Dabei ist allerdings zu beachten, dass nicht alle erkrankten Tiere serokonvertieren und dass, manchen Untersuchungen zufolge, gesunde Tiere ebenso hohe Serumantikörpertiter aufweisen können wie kranke Tiere. Post mortem sollte am besten das ganze Tier, zumindest aber das Gehirn zur pathologischen Untersuchung eingeschickt werden (Kontaktaufnahme mit dem Institut für Veterinärpathologie der Universität Zürich). Seite 38 Kapitel, Borna Labordiagnose Virusnachweis: Isolierung von Virus; RT-PCR; Immunhistologie. Benötigt wird dafür jeweils Gehirnmaterial. Antikörpernachweis: Indirekte Immmunfluoreszenz (mit Hilfe infizierter Zellkulturen); ELISA (mit rekombinantem Antigen); Western Blot. Untersucht werden kann Serum, Liquor oder Gehirnextrakt. Literatur Caplazi and Ehrensperger (1998). Spontaneous Borna disease in sheep and horses: immunophenotyping of inflammatory cells and detection of MHC-I and MHC-II antigen expression in Borna encephalitis lesions. Vet. Immunol. Immunopath. 61, 203-220. Seite 39 Kapitel, Circovirus der Schweine CIRCO Autoren: Mathias Ackermann und Christian Griot1 File Info: nw8000:\Vorlesung\Portrats0405b.doc PCV Porcines Circovirus Circovirus der Schweine Das Circovirus Typ 2 der Schweine (porcines Circovirus, PCV) ist ein erst kürzlich als Krankheitserreger identifiziertes Virus, das selbst jedoch seit etwa 1974 bekannt ist. Es wird als Mitverursacher des sogenannten "postweaning multisystemic wasting syndrom" (PMWS) sowie möglicherweise als Komponente des "porcine dermatitis and nephropathy syndrome" (PDNS) beschrieben. Charakteristisch für PMWS sind: Progressive Dispnoe, Kümmern, Vergrösserung von Lymphknoten sowie histopathologisch entzündliche Läsionen mit Lymphadenitis, interstitielle Pneumonie, Hepatitis, interstitielle Nephritis und Pankreatitis. Wie der englische Name des Syndroms andeutet, tritt dieses Krankheitsbild meist nach dem Absetzen auf. Bei PDNS treten Symptome auf, welche an Schweinepest (KSP sowie ASP) erinnern. Besonderheiten Sehr klein: Circoviren sind die kleinsten bekannten Viren. Genom: circuläre, einzelsträngige DNA. 2 Typen: PCV-1 (harmlos) und PCV-2 (konditionell pathogen) Geschichte PCV-1 wurde erstmals 1974 als Kontaminante von Zellkulturen (PK-15, eine Zell Linie, die von porcinen Nierenzellen abstammt) beschrieben. Aufgrund serologischer Studien ist es sehr weit verbreitet. Seit 1997 wird PCV-2 als PMWS-Agens erkannt. Über PDNS wurde erstmals im Jahre 2000 publiziert. Verbreitung In der Schweiz wurden im Jahr 2000 die ersten PCV-2positiven Bestände entdeckt. Zwei davon zeigten typische Symptomatik. Bis 2004 wurde eine ansteigende Inzidenz sowie eine Virulenzsteigerung festgestellt, insbesondere in Bezug auf PMWS-Fälle. Seroprävalenz in USA zirka 53%, Grossbritannien und Deutschland 85%. Krankheitsfälle wurden aus folgenden Ländern gemeldet: USA, Kanada, Spanien, Frankreich, Niederlande, Deutschland, Italien, Irland, UK, Schweiz (November 2000). Erreger Familie Circoviridae, Genus Circovirus. Durchmesser 17-22 nm, nicht behüllt, kreisförmige ssDNA mit 1'759 bis 1'786 nt. Hohe Tenazität. 1 Anschrift: Dr. Christian Griot, Institut für Viruskrankheiten und Immunprophylaxe, 3147 Mittelhäusern Seite 40 Kapitel, Circovirus der Schweine Antigenverwandtschaft Antikörper gegen PCV-1 wurden auch bei Menschen, Mäusen und Rindern gefunden. PCV-2 scheint nur beim Schwein vorzukommen. Keine Antigenverwandtschaft zum Circovirus des Geflügels (chicken anemia agent). Virusvermehrung ??? Genexpression ??? Epidemiologie Fast nichts bekannt. PCV-2 wird in Faeces und Nasensekret ausgeschieden und kann somit direkt übertragen werden. Die Einschleppung in einzelne Bestände erfolgt meist durch Zukauf eines infizierten Tieres. Aufgrund der hohen Tenazität wird auch indirekte Übertragung (Kleider, Stallgeräte) vermutet. Nicht hochansteckend. Desinfektion Gleiche Mittel wie für andere unbehüllte Viren Pathogenese ???. Als Ursache für PDNS wird eine systemische Typ III Hypersensitivität vermutet. Als infektiöse, auslösende Faktoren werden PRRSPRRS (siehe Porträt PRRS) und PCV-2 sowie Streptokokken und Mannheimien genannt. Immunreaktion ??? Impfprophylaxe Kein Impfstoff verfügbar Staatliche Massnahmen Bisher keine. Klinik 1. Normalerweise: Experimentelle Infektion führt nicht zu Krankheit. Das Circovirus wird als notwendiger Bestandteil einer typischen Faktorenkrankheit angesehen. 2. Faktorenkrankheit PMWS: Tritt häufig im Alter von 8 bis 12 (6 bis 16) Wochen auf. Im Gefolge des Absetzens kommt es zu Durchfall, Kümmern, Lymphknoten Schwellungen, progressiver Dispnoe. Bei akuten Ausbrüchen wird eine Mortalität von bis zu 10% beobachtet. In endemisch infizierten Herden verläuft die Krankheit viel milder. 3. PDNS: Tritt eher bei älteren Mastschweinen auf. Auffällig ist eine starke Dermatitis, hauptsächlich über Brust und Vorderbeine, Abdomen und Hinterschenkel mit rötlichen Erhebungen von unterschiedlicher Grösse. Die Tiere erscheinen teilnahmslos, können Fieber zeigen und fressen höchstens lustlos. In Einzelfällen wird auch erschwerte Atmung beobachtet. Bis zu 15% der erkrankten Tiere können eingehen, andere bleiben permanente Kümmerer. Seite 41 Kapitel, Circovirus der Schweine Diagnose Verdacht beim Auftreten von gehäuftem Kümmern, progressiver Dispnoe, Vergrösserung von Lymphknoten, Dermatitis, petechialen Blutungen. Differentialdiagnosen • • • • Viren: PRRS, Hämagglutinierendes Enzephalomyocarditis Virus (HEV), Influenza, Klassische (KSP) und Afrikanische (ASP) Schweinepest Bakterien: Glässersche Krankheit (Haemophilus parasuis), Mycoplasma hyopneumoniae, Lawsonia intracellularis, Colibazillose Parasiten: Cryptosporidien Nicht-infektiös: Wasting pig syndrome, Absetz-Anorexie Bei Verdacht Institut für Viruskrankheiten und Immunprophylaxe (IVI) 031 848 9211. Das Institut für Veterinärpathologie der Universität Zürich koordiniert die Immunhistologische Diagnostik 044 635 8581. Untersuchungsmaterial Vergrösserte Lymphknoten (Mediastinal, renal, mesenterisch, inguinal, portal), Lungen, Leber, Niere, Milz, Ileum, Pankreas, Tonsillen. Labordiagnose PCR kann PCV-1 von PCV-2 unterscheiden. Histopathologie: Infiltration der Lymphknoten mit histozytischen Zellen, Auftreten von Synzytien, stark basophile Einschlusskörperchen in den B-Zell Arealen. Ähnliches Bild in anderen Organen. Bei PDNS gilt eine Hyperimmunreaktion in den Gefässwänden als typisch. Serologische Tests für den Nachweis von Antikörpern sind im Aufbau. Interpretation der Ergebnisse bislang nicht befriedigend. Literatur Gordon and Ellis, 2000 Porcine circovirus: a review. J. Vet. Diag. Invest. 12, 3-14. Rosell et al., 2000 Identification of porcine circovirus in tissues of pigs with porcine dermatitits and nephropathy syndrome. Vet. Rec. 146, 40-43. Sydler and Bürgi, 2004 Remarks on the current PMWS situation in Switzerland (2004). Schweiz. Arch. Tierheilk. 146(10), 469. Seite 42 Kapitel, Ebola Ebola Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc Ebola Filoviren (Ebola; Marburg) ("Outbreak Virus") Erreger von hämorrhagischem Fieber mit meist letalem Ausgang Besonderheiten Biosafety Level 4 Virusreservoir unbekannt Keine Impfstoffe Behandlung mit Interferonen und Seren von überlebenden Patienten Inkubationszeit Virulenz Geschichte 1967 Marburgvirus in Marburg und Frankfurt, sowie Belgrad. 31 Fälle mit 7 Todesfällen. Betroffen waren Laboranten, welche Affennieren für die Gewinnung von Zellkulturen aufarbeiteten. 1976 Epidemie von Ebolavirus in Zaire und Sudan mit 550 Fällen, wobei mehr als 430 Patienten starben. Sekundäre und tertiäre Fälle wiesen weniger hohe Letalität auf (Attenuierung?) 1994 steckte sich eine Schweizer Forscherin bei der Sektion eines Schimpansen an. Sie erkrankte, aber überlebte. 1995 um die 100 Todesfälle in Zaïre, nachdem das Pflegepersonal und die Patienten panikartig ein Spital, in dem Ebola Fälle aufgetreten waren, verlassen hatten. Verbreitung Ursprung in Afrika, Import nach Europa und Amerika mit infizierten Primaten. Erreger Familie der Filoviridae Morphologie: Filamentös, Länge bis 14'000 nm, Durchmesser 80 nm. Helikales Nukleokapsid, Hülle mit Peplomeren Genom: ssRNA mit negativer Polarität (z.B. Ebola: 18,8 kb). Siehe Abbildung 1. NP VP35 VP40 GP VP30 VP24 L Ebola NC 006432 18875 bp Seite 43 Kapitel, Ebola Abbildung 1. Schematische Darstellung des Genoms von Ebola Virus (Isolat aus dem Sudan). NP= Nukleokapsid Protein; VP35= Ko-Faktor des Polymerase Komplexes mit Anti-(Typ-1)-Interferon-Wirkung; VP40= Matrixprotein; GP= sezerniertes Glykoprotein; VP30= kleines Nukleokapsid Protein; VP24= Membran-assoziiertes Protein; L= Polymerase. Abb. 2. Elektronenoptische Aufnahme eines Ebola Virus Wirtsspektrum: Menschen, Affen, Mäuse, Meerschweinchen, Hamster. Keine antigenetische Verwandtschaft zwischen Ebola und Marburg Virus. Virusvermehrung und Genexpression Die Virusvermehrung erfolgt im Zytoplasma. Ähnlichkeit zur Vermehrung anderer -ssRNA Viren (z.B. Rhabdo-, Paramyxoviren)(siehe Abbildungen 3 und 4) 1. Adsorption unbekannt, keine Neutralisation durch Antikörper bei Ebola 2. Penetration unbekannt, möglicherweise Fusion 3. Uncoating vermutlich wie bei Paramyxoviren 4. Biosynthese sehr rasch, im Zytoplasma, Schwellung und Zerstörung der Organellen, massive Akkumulation von Nukleokapsidprotein (Einschlusskörperchen im Zytoplasma) 5. Assembly sehr rasch 6. Aussschleusung sehr rasch, Knospung von der Zytoplasmamembran Seite 44 Kapitel, Ebola Abb. 3. Schema der Genexpression virale Enzyme (-)ssRNA (+)mRNA Proteine (+)RNA (-)RNA Viruspartikel Abb. 4. Strategie der Virusvermehrung Epidemiologie Virusreservoir unbekannt. Ausgeschlossen werden konnten verschiedene Affenarten, sowie Fledermäuse Virusausscheidung: Sekrete und Exkrete, Dauer unbekannt.. Die Ansteckung erfolgt durch engen direkten Kontakt mit erkrankten Personen (Pflegepersonal) oder bei der Sektion (Blut, Gewebe, Instrumente, Injektionsmaterial, kontaminierte Krankenhausabfälle). Tenazität: relativ robust bei Raumtemperatur, wird bei 60°C innerhalb von 30 Minuten zerstört, ebenso wie durch UV- und Gammastrahlung. Desinfektion Zur Desinfektion sind Detergentien (Virushülle), ßPropiolacton (Zerstörung der Nukleinsäure), Hypochlorit und Phenol geeignet. Seite 45 Kapitel, Ebola Pathogenese Die experimentelle Inkubationszeit bei Affen beträgt 4 bis 16 Tage. Ausbreitung im Körper durch Virämie. Das Virus vermehrt sich in Leber, Milz, Lymphknoten, Lungen und in Endothelzellen. In den infizierten Zellen kommt es zur Zerstörung der Organellen, was zu Nekrosen in den betroffenen Organen führt. Nur schwache entzündliche Reaktion. Folgen für den Gesamtorganismus: Hämorrhagien, Dysfunktion der betroffenen Organe, Tod durch Schock. Letalität: 30-90% Bei der Sektion und der Histologie dominieren folgende Veränderungen: hämorrhagische Diathesen, fokale Nekrosen, nur leichte Entzündungserscheinungen. Immunreaktion Im Gefolge der Infektion werden (meist nicht neutralisierende) Antikörper gebildet. Es hat sich gezeigt, dass diese nicht vor Infektion und Erkrankung schützen können. Über die zelluläre Immunität ist noch wenig bekannt. Dem VP35 wird eine anti-(Typ-1)-Interferon-Wirkung zugeschrieben. Impfprophylaxe Es sind keine Impfstoffe verfügbar. Versuche in Labortieren neutralisierende Antikörper zu erzeugen sind bisher fehlgeschlagen. Impfstoffe wären speziell wünschenswert um medizinisches Personal in den Risikogebieten Afrikas, sowie Laborpersonal in den Diagnostikzentren zu schützen. Klinik Inkubationszeit nach natürlicher Infektion: unbekannt. Zuerst äussert sich die Erkrankung wie eine gewöhnliche Grippe mit unspezifischen Symptomen wie Fieber, Kopfschmerzen, Malaise und Muskelschmerzen. Später kommen Bradykardie, Conjunctivitis und Hautrötungen dazu. Nach etwa 2 Tagen kommt es zu Pharyngitis, Nausea, Erbrechen, fortschreitender Blutungsneigung, sodann zu Petechien, Ecchymosen, blutigen Durchfällen und unstillbaren Blutungen. Bei schwangeren Frauen kommt es meist zum Abort. Während der Krankheit geborene Kinder sind meist ebenfalls betroffen. Der Tod tritt in der Regel nach 6 bis 9 Tagen ein. Todesursache: Endotheliale Permeabilität führt zu hypovolämischem Schock. Bei Überlebenden nimmt die Heilung lange Zeit (bis 5 Wochen) in Anspruch. Sie ist gekennzeichnet von Schwäche, Gewichtsverlust und Amnesie für die Zeit der akuten Erkrankung. Seite 46 Kapitel, Ebola Pathologie Makroskopisch: hämorrhagische Diathese in die Haut und die inneren Organe. Oedematöse Schwellung von Milz, Lymphknoten, Nieren und Hirn. Nekrosen von Leber, lymphatischen Organenen und Nieren. Histologisch: zytoplasmatische Einschlusskörperchen in den Hepatozyten, nur wenige inflammatorische Zellen, interstitielle Pneumonie, Pankreatitis, Iridocyclitits Diagnose Virusnachweis im Labor (Biosicherheitsstufe 4) mittels Immunfluoreszenz an fixierten Gewebeproben aus den Zielorganen. Sehr wichtig ist die Anzüchtung der Viren auf Zellkulturen (Vero E6, Affennierenzellen) um weitere Untersuchungen anstellen zu können. Im Überstand der Zellkulturen kann Virus im Elektronenmikroskop nachgewiesen werden. Die Genome von Marburg und Ebola Viren sind zum Teil kloniert und sequenziert worden. Mit den Sequenzen konnten Primer für die RT-PCR synthetisiert werden. Das Nukleokapsid Protein von Ebola wurde bereits in rekombinanten Vaccinia- und Baculoviren exprimiert. Damit sollen biologisch ungefährliche Antigene für serologische Untersuchungen hergestellt werden. Differentialdiagnosen andere akute Fiebererkrankungen, z.B. Malaria, Typhus, Septikämien durch Meningokokken, Leptorspiren, Anthrax, andere hämorrhagische Fieber, wie Lassa (Arenaviridae), fulminante virale Hepatitis Bei Verdacht Mit dem Bundesamt für Gesundheitswesen Kontakt aufnehmen. Untersuchungsmaterial Infizierte Gewebe. Vorgehen nach Absprache Labordiagnose Direkter Virusnachweis. IIF, Viruszüchtung, Elektronenmikroskop Indirekter Virusnachweis. ELISA, IF Bekämpfung Isolation der Patienten, Schutz des Pflegepersonals vor Ansteckung, "clean sweep", Vermehrte Anstrengungen zur Auffindung und Bekämpfung des Reservoirs, bzw. von Vektoren Seite 47 Kapitel, HCC HCC Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc HCC Hepatitis contagiosa canis Die infektiöse Hundehepatitis wird durch das canine Adenovirus 1 (CAV-1) verursacht. Neben einer akuten Hepatitis kann CAV-1 auch respiratorische Erkrankungen, Encephalopathien und Augenerkrankungen verursachen. Besonderheiten Persistenz des Virus in der Niere bis über 1 Jahr nach Abklingen der klinischen Erscheinungen. Geschichte HCC war früher als epizootische Fuchsencephalitis bekannt, die Probleme in Fuchsfarmen verursachte. 1947 wurde durch Rubarth gezeigt, dass die Erreger der HCC und der epizootischen Fuchsencephalitis identisch sind. 1954 gelang die Vermehrung des HCC-Virus in Zellkultur (Cabasso, 1954). 1958 erfolgte die Einführung der homologen Impfung gegen HCC mit attenuiertem CAV-1 (Cabasso, 1958). Weil relativ häufig unerwünschte Nebenwirkungen mit CAV-1 auftraten, wurde später die heterologe Impfung gegen HCC mit CAV-2 etabliert (Appel, 1975). Die Einführung der inaktivierten Impfung erfolgte 1977 (Wilson, 1977). Verbreitung weltweit. Seit Einführung der Impfung ging die Häufigkeit der Erkrankung beim Hund stark zurück. Erreger Das canine Adenovirus (CAV-1) ist ein unbehülltes ikosaedrisches Virus mit einem Durchmesser von 60 bis 90 nm. Adenoviren haben eine doppelsträngige DNA, die durch ein Protein, das an die beiden 5'-Enden der DNA bindet, zum Ring geschlossen wird. Mit CAV-1 ist CAV-2 verwandt, das zu den Erregern des Zwingerhustenkomplexes gehört. Seite 48 Kapitel, HCC Abbildung aus Field's Virology, Seite 1681 (M.S. Horwitz) Virusvermehrung und Genexpresssion Transkription und Replikation finden im Kern statt. Der Replikationszyklus kann unterteilt werden in frühe (early) und späte (late) Phasen, wobei die Spätphase mit der DNAReplikation beginnt. Die Strukturproteine werden hauptsächlich in der Spätphase synthetisiert. Adenoviren codieren für eine DNA-Polymerase, sind aber in vielen anderen Funktionen von der Wirtszelle abhängig. Epidemiologie CAV-1 kommt weltweit bei Caniden vor. Am empfindlichsten sind Hunde, Kojoten, Rotfüchse und Wölfe. Die Virusübertragung findet durch Kontakt und durch Aufnahme von Kot, Urin oder Speichel eines infizierten Tieres statt. Hat sich ein Hund von der klinischen Erkrankung erholt, kann er noch über ein Jahr Virus im Urin ausscheiden (Persistenz des Virus in der Niere). Desinfektion aldehydhaltige Desinfektionsmittel Pathogenese Es handelt sich um eine zyklische Allgemeinerkrankung bei der zuerst eine Virusvermehrung in den Tonsillen und in den Lymphknoten stattfindet. Via Lymphgefässe gelangt das Virus ins Blut, was zur Generalisierung der Infektion führt. Virusreplikation in den Gefässendothelien verursacht Hämorrhagien und Gerinnungsstörungen. Durch Vermehrung der Viren im Nieren- und Leberparenchym und im retikulären Gewebe kommt es zu Nekrosen. Immunkomplexe können Glomerulonephritis und Augenveränderungen (blue eye) verursachen. Klinik Die Inkubationszeit dauert 4 bis 9 Tage. Symptome: hohes Fieber, Apathie, Anorexie, Durchfall und Erbrechen, Schleimhautblutungen, in der Rekonvaleszenz opake Cornea. Die Krankheit ist um so gefährlicher, je jünger der Hund ist. Immunreaktion Starke humorale Immunantwort. Beim Welpen Schutz durch maternale Antikörper. Nach einer Infektion kommt es zu einer lebenslangen Immunität. Die Persistenz des Virus in den Nieren bewirkt anhaltende antigene Stimulation. Immunprophylaxe Immunisierung mit CAV-1 oder CAV-2 (Kreuzimmunität) möglich. In der Schweiz sind Impfstoffe mit inaktiviertem CAV-1, inaktiviertem CAV-2 und attenuiertem CAV-2 zugelassen. Diagnose Verdacht auf HCC bei plötzlichem hohen Fieber mit verlängerter Blutgerinnung, v.a. bei Welpen und Junghunden Seite 49 Kapitel, HCC Differentialdiagnose Staupe Bei Verdacht nach Rücksprache Material einsenden an das Institut für Veterinärpathologie, Universität Zürich, 044 635 8581. Untersuchungsmaterial diverse Organe einschliesslich ZNS formalinfixiert oder ganzer Tierköper, frisch Labordiagnose Erregernachweis mittels Immunhistologie. Die Virusisolation aus Nasensekret, Blut und Urin ist langwierig und aufwendig. Therapie symptomatisch Literatur Appel, M., Carmichael, L.E., and Robson, D.S.: Canine adenovirus type 2-induced immunity to two canine adenoviruses in pups with maternal antibody. Am. J. Vet. Res., 1975, 36: 1199-1202. Cabasso, V.J., Stebbins, M.R., Norton, T.W., and Cox, H.R.: Propagation of infectious canine hepatitis virus in tissue culture. Proc. Soc. Exp. Biol. Med., 1954, 85: 239-245. Cabasso, V.J., Stebbins,, M.R., and Avampato, J.M.: A bivalent live virus vaccine against canine distemper and infectious canine hepatitis. Proc. Soc. Exp. Biol. Med., 1958, 99: 46-51. Rubarth, S.: An acute virus disease with liver lesions in dogs (hepatitis contagiosa canis). A pathologico-anatomical and etiologic investigation. Acta Pathol. Microbiol. Scand., 1947, 24; Suppl. 69. Wilson, J.H.G., Hermann-Dekkers, W.M., Leemans-Dessy, S., and de Meijer, J.W.: Experiments with an inactivated hepatitis leptospirosis caccine in vaccination programmes for dogs. Vet. Rec., 1977, 100: 552-554. Seite 50 Kapitel, Herpes, Aujeszky Herpesviren Aujeszky Autoren: Monika Engels, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc AUJ Aujeszky'sche Krankheit; Pseudowut (Pseudorabies) AUJ ist eine kontagiöse, epidemische Herpesvirusinfektion, die akut und fieberhaft verläuft und primär beim Schwein vorkommt. In Abhängigkeit des Alters der betroffenen Schweine äussert sich die Infektion in Form einer Meningoenzephalitis oder mit respiratorischen Symptomen. Bei adulten Schweinen verläuft die Infektion meist subklinisch. Besonderheiten Wirtsspektrum: Empfänglich sind verschiedene Tierarten; das Schwein dient als Virusreservoir (Hauptwirt). Für andere Tierarten (z.B. Rind, kleine Wiederkäuer, Fleischfresser, Nager) verläuft die Infektion tödlich. Diese Tierarten werden als Endwirte bezeichnet, weil sie das Virus nicht weiter übertragen (keine massive Virusausscheidung) und weil sie kein Virusreservoir darstellen. Bei einigen dieser Tierarten ist ein starker Juckreiz charakteristisch (--> Pseudowut). Latente Infektion: regionäre Ganglien, sowie in verschiedenen lymphatischen Organen und in Zellen des hämatopoietischen Systems (s. unten). Tenazität: die stärkere Resistenz gegenüber Umwelteinflüssen als andere Herpesviren (stabil bei pH 5-12) beeinflusst die Virusübertragung. Staatliche Massnahmen AUJ ist eine staatlich bekämpfte Seuche (Anzeigepflicht). Im Gegensatz zu IBR/IPV wurde früher nicht regelmässig serologisch untersucht. Im Jahr 2001 wurde jedoch eine Stichprobe eingeführt, die jährlich stattzufinden hat. Verdachtsfälle müssen von Amtes wegen geprüft werden. Erkrankte und seropositive Herden werden ausgemerzt. Seite 51 Kapitel, Herpes, Aujeszky Geschichte Erstmals 1813 in den USA bei Kühen beobachtet und beschrieben. In der Schweiz schon 1849 bei Kühen und Hunden gesehen, aber als Tollwut interpretiert. Durch Experimente am Kaninchen gelang es Aujeszky (einem ungarischen Veterinär) 1902, die von ihm Pseudowut genannte Krankheit von der echten Tollwut zu unterscheiden. Die Virusnatur des Erregers, von Aujeszky vermutet, wurde 1910 durch Filtrationsexperimente bestätigt, und in den 30er Jahren wurde der Erreger als Herpesvirus identifiziert. AUJ beim Schwein wurde 1920 erstmals beschrieben. Seit den 50er Jahren kommt die Krankheit enzootisch bei den Schweinen vor (Massentierhaltung). Verbreitung Weltweit, mit unterschiedlicher Prävalenz. Situation Schweiz: Seit 1987 wurden anhand von Serumbanken seroepidemiologische Untersuchungen durchgeführt. Auf diese Weise konnten einige infizierte Herden in der Ostschweiz entdeckt und saniert werden. Seit 1991 wurden keine Reagenten (Stichproben!) mehr gefunden. Auch seit dem Winter 2000/2001 durchgeführte Stichproben brachten bisher keine Seroreagenten zum Vorschein. EU-Raum: unterschiedliche Prävalenz und Inzidenz. Durchseuchungsrate zum Teil sehr hoch. Erreger Aujeskzy Virus; Pseudorabies Virus (PRV); Herpesvirus suis 1; suid Herpesvirus 1 (SuHV-1). Familie Herpesviridae, Subfamilie Alphaherpesvirinae, Genus Varizellovirus. Virionmorphologie, Genomstruktur und Kodierkapazität des Genoms: vergleichbar mit BoHV-1 (s.dort). Anhand der Restriktionsmuster der DNA verschiedener PRV Stämme liess sich eine relativ grosse Variabilität feststellen, jedoch keine Korrelation zwischen einem bestimmten Restriktionsmuster und biologischen, klinischen Eigenschaften (Ausnahme: Vakzinestämme). Es war aber möglich, bestimmte Genomtypen geographisch einzuordnen. Daneben ist zu beachten, dass es stark virulente und weniger virulente Feldvirusstämme gibt. Die Virulenz bestimmt den Schweregrad der Erkrankung. Der Erreger hat eine hohe Tenazität. Überlebt ca. 6 Wochen bei 25°C und ca. 9 Wochen bei 15°C. Stabilität im Bereich pH 5-12; aber bei Extremwerten (z.B. pH 2 oder 13.5) kann es trotzdem 4 Stunden bis zur kompletten Inaktivierung dauern. Stabilität in der Aussenwelt, Beispiele: in reifendem Fleisch bei 4°C stabil; wird bei -18°C inaktiviert innert 35-40 Tagen; wird sofort inaktiviert bei Erhitzung (Fleisch, Wurst, Schinken) auf mindestens 80°C. Überlebt in Urin während 3 (Sommer) bis 15 (Winter) Wochen; im Boden 5-6 Wochen; in Heu und Stroh 15 (Sommer) bis 40 (Winter) Tage. Wie alle Herpesviren ist der Erreger aber labil gegenüber Lipidlösungsmitteln, wie Aether und Chloroform. Seite 52 Kapitel, Herpes, Aujeszky Antigenverwandtschaft Geringgradig mit Herpes Simplex Virus, Herpesvirus B und BoHV-1. BoHV-1: Einwegreaktion = Anti-BoHV-1Antikörper können PRV neutralisieren, nicht aber umgekehrt. Virusvermehrung Im wesentlichen wie BoHV-1 (s. dort). Genexpression Im wesentlichen wie BoHV-1 (s. dort). Epidemiologie Die Virusausscheidung in oronasalen Sekreten dauert 2-3 Wochen lang an. Eine vertikale Übertragung via Milch ist möglich. Vaginalsekret und Samen können infektiös sein. Die Verbreitung der Infektion via Zuchteber oder Samen ist nicht zu unterschätzen. Die Virusausscheidung stoppt zwar i.d.R. beim Auftreten von neutralisierenden Antikörpern, Langzeitausscheider kommen aber trotzdem vor. Die Infektion verbreitet sich innerhalb eines Bestandes vorwiegend aerogen, durch direkten Kontakt und durch kontaminierte Tröge etc. Wiederum spielen der Mensch und unbelebte Vektoren eine grosse Rolle bei der Weiterverbreitung zwischen Betrieben. Es wird auch diskutiert, dass die Virusstreuung in weiten Gebieten via Luft eine wichtige Rolle spielen dürfte. Dennoch bleiben die Haupteinschleppungswege in einen Bestand die folgenden: Zukauf latent infizierter Tiere, Zucht/KB, Verfütterung von ungekochten Metzgerei- und Küchenabfällen (s.Tenazität des Erregers!). Letzteres dürfte auch der Hauptübertragungsweg auf Fleischfresser sein, die selbst Endwirte sind. Als Hauptvirusreservoir dienen latent infizierte Schweine. Neben dem Schwein und den erwähnten Endwirten sind auch wildlebende Nager für die Infektion empfänglich. Als Virusreservoir spielen sie jedoch keine Rolle. AUJ tritt in Endemiegebieten saisonal auf: Ausbrüche meist in kalten Wintermonaten (Okt. - April). Übertragung auf andere Tierarten: Virusausscheidendes Schwein --> beschnuppern, belecken, beissen; via kontaminiertes Futter und Wasser. Bei schlechter Ventilation evtl. auch aerogen. Desinfektion Geeignet sind z.B. 0.5% Natriumhypochlorid und 3%ige Phenolderivate; bei andern üblichen Desinfektionsmitteln müssen, im Vergleich zu andern Herpesviren, höhere Konzentrationen verwendet und/oder längere Einwirkzeiten eingehalten werden. Seite 53 Kapitel, Herpes, Aujeszky Pathogenese Eintrittspforte ist normalerweise der Nasopharynx (aerogene oder orale Übertragung); Übertragung aber auch via Decken bzw. KB möglich. Die erste Virusvermehrung findet an der Eintrittspforte statt, meist ohne Läsionen zu verursachen. Es folgt eine direkte Virusaufnahme durch die lokalen Nervenendigungen. Die Viren werden intraaxonal ins ZNS transportiert und verbreiten sich weiter via Infektion der Schwann'schen Zellen und Fibroblasten des Endoneuriums. Es entstehen neuronale Nekrosen und Entzündungen. Die Neuronenschädigungen sind verantwortlich für die Symptomatik. Neben der Invasion ins ZNS kommt es einerseits zur Infektion des Respirationstraktes (dabei ist die Infektion der Alveolärmakrophagen besonders wichtig) und andererseits, zumindest bei virulenten Virusstämmen, zur Virämie. Das Virus zirkuliert im Blut entweder frei oder gebunden an verschiedene Lymphozyten, nicht aber Monozyten. Das Virus kann sich in Knochenmarks-, Thymus- und peripheren Blutzellen replizieren. Bei Ferkeln kann das Virus in verschiedenen Organen nachgewiesen werden. Die fötale Infektion geschieht via Infektion der Plazenta. Andere Tierarten: Weg der Virusverbreitung ausschliesslich via periphere Nerven zum ZNS, wo neuronale Schäden angerichtet werden, die zu Enzephalomyelitis und Juckreiz an Eintrittspforte führen. Eine beschränkte Vermehrung ist auch in Epithelien (Rind: Nasopharynx; Lunge, Vagina) möglich. Latenz Wie bei BoHV-1 u.a. Herpesvirusinfektionen; latente Infektionen jedoch auch in lymphatischem Gewebe. Immunreaktion Humorale Antikörper erscheinen 6-7 Tage p.i und erreichen ihren Peak 3-5 Wochen p.i. Sie persistieren Monate bis Jahre. Auch sekretorische Antikörper werden nachgewiesen, wobei unbekannt ist, wie lange diese persistieren. Was über die Bedeutung der humoralen und zellvermittelten Immunantwort bei der IBR geschrieben wurde, gilt auch für AUJ. Die zellvermittelte Immunantwort kann bei AUJ ab 4 Tagen p.i. nachgewiesen werden. Maternale Antikörper persistieren während 12-14 Wochen. Der Immunschutz besteht auch bei AUJ, wie bei andern Herpesvirusinfektionen, darin, ein Tier vor schwerwiegender Krankheit und Tod zu bewahren. Sie kann jedoch eine (Re)infektion und die Etablierung/Reaktivierung einer latenten Infektion nicht verhindern. Impfprophylaxe Impfung in der Schweiz verboten wegen unbefriedigender Schutzwirkung (s. verhindert Infektion mit Feldvirus und Latenz nicht); AUJ in der Schweiz selten. Da es sog. Markervakzinen gibt (Vakzinestamm exprimiert ein Glykoprotein nicht, z.B. gE) wäre eine Differenzierung zwischen geimpften und infizierten Tieren möglich. Seite 54 Kapitel, Herpes, Aujeszky Markervakzine Genom Gen für gE gE Protein kein gE anti-gE Klinik kein Gen für gE kein anti-gE A. Hauptwirt und Reservoir Schwein: 1. Neugeborene: Inkubationszeit 36-48 Stunden. Fieber (41°C), Depression und Erbrechen; im Vordergrund aber meist motorische Störungen, wie Muskelzittern, Ataxie, Inkoordination, Paralyse der Hintergliedmassen, Opisthotonus, epileptiforme Anfälle. Die Krankheit entwickelt sich sehr rasch und der Tod tritt meist innert 36 Stunden nach Auftreten der Symptome ein. 100% Mortalität bei 1-2 Wochen alten Ferkeln. Bei 3-4 Wochen alten ähnliche Symptome, aber Krankheitsverlauf langsamer und Mortalität bei ca. 50-70%. Bei mehr als 4 Wochen alten Ferkeln stehen respiratorische Symptome im Vordergrund (leicht Fieber, Niesen, Husten, Nasenausfluss, Dyspnoe; Appetitverlust). Meist erfolgt Heilung, manchmal können jedoch immer noch tödlich verlaufende ZNS-Störungen dazukommen --> Mortalität 530%. 2. Mastferkel: Inkubationszeit 3-5 Tage; Morbidität 100%, die Symptome jedoch fast ausschliesslich respiratorischer Art. Mortalität <3%. 3. Erwachsene Schweine: milde respiratorische Symptome, selten leichtgradige Ataxie; sehr oft klinisch inapparent. Bei trächtigen Sauen: Abort oder Geburt toter oder mumifizierter Ferkel. Der Abort tritt ca. 10 Tage p.i. auf. Die Infektion führt in Mastbetrieben zu wirtschaftlichen Schäden durch reduzierte Tageszunahmen. In einem Zuchtbestand kann es zu temporären Fertilitätsstörungen (Sauen und Eber) kommen. B. Endwirte (tödlicher Verlauf, minimale Virusausscheidung): Seite 55 Kapitel, Herpes, Aujeszky Rind und kleine Wdk.: Fatale Enzephalomyelitis, begleitet von einem starken Juckreiz an verschiedenen Körperstellen. Inkubationszeit (Rind) : 4-7 Tage. Krankheitsverlauf sehr rasch und immer tödlich (Tod 10 bis 48 Stunden nach Auftreten der Symptome). Bei Ziegen kann der Juckreiz fehlen. Fleischfresser: Symptomatik ähnlich wie Wiederkäuer; rascher Eintritt des Todes. Diagnose Verdacht beim Auftreten von zentralnervösen Störungen (v.a. bei Ferkeln), sowie bei Aborten/Totgeburten (alle Ferkel mit gleichen Massen --> zum gleichen Zeitpunkt abgestorben). Zusatzindiz: tote Katze(n)/Hund(e) auf dem Betrieb. Differentialdiagnosen Schweine: Schweinepest; bei respiratorischen Symptomen: Mannheimien, Influenza; bei Ferkeln mit Diarrhöe: TGE; bei Aborten und Fertilitätsstörungen: PRRS, Parvovirose. Andere Tierarten: Tollwut. Bei Verdacht Kontaktaufnahme mit dem Institut für Virologie der Vetsuisse Fakultät in Zürich, 044 635 8718; Absprache betreffend Einsendung von Untersuchungsmaterial. Im Bestand soweit möglich Management- und Hygienemassnahmen zum Schutz der nicht-infizierten Tiere. Untersuchungsmaterial Tonsillen, Lymphknoten, Milz, Niere, Gehirn, Rückenmark; Blut. Labordiagnose Virus-/ Antigennachweis: Immunfluoreszenz am Gewebeschnitt; PCR möglich; Virusisolierung in Zellkultur (dauert jedoch Tage). Antikörpernachweis: ELISA, SNT. Seite 56 Kapitel, Herpes, BKF BKF Autoren: Uwe Müller-Doblies, Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405b.doc BKF Bösartiges Katarrhalfieber Das bösartige Katarrhalfieber ist eine sporadisch auftretende, hoch fieberhaft verlaufende, systemische Erkrankung von Rindern, Wasserbüffeln, domestizierten Hirschen und verschiedenen wildlebenden Wiederkäuern. Die klinischen Erscheinungen und pathologisch-anatomischen Befunde sind immer ähnlich, obwohl 2 Ätiologien unterschieden werden. In Afrika und bei Zootieren wird häufig die Gnu-originäre Form von BKF (GO-BKF) beobachtet, welche durch das alcelaphine Herpesvirus 1 (AlHV-1) verursacht wird. Das BKF unserer Hauswiederkäuer wird nicht durch AlHV-1 verursacht, sondern durch das Ovine Gammaherpesvirus Typ 2 (OvHV-2). Da man nachweisen konnte, dass dieser Erreger von Schafen auf das Rind übertragen wird, bezeichnet man diese Form auch als Schaf-assoziiertes BKF (SA-BKF). Schweine, Hirsche und andere wildlebende Wiederkäuer, inklusive Zootiere, können ebenfalls an SA-BKF erkranken. Besonderheiten Während bei GO-BKF der Erreger isoliert werden kann, ist die beim OvHV-2 bisher nicht gelungen. Der Nachweis eines DNA-Abschnittes mit grosser Homologie zur DNA von Gamma-Herpesviren bei erkrankten Tieren führte schliesslich zur Klonierung und Sequenzbestimmung von OvHV-2 und schliesslich auch zur lückenlosen Beweisführung der Herpesvirusätiologie. Verschiedene Wirtsspezies sind für die Infektion mit den BKFAgentien empfänglich. Man unterscheidet Reservoirwirte (produktive Infektion, keine Krankheit) und Indikatorwirte (auch Fremdwirt genannt, erkranken an BKF, übertragen aber die Infektion nicht oder nur ineffizient) Geschichte BKF ist seit über 100 Jahren in Zentraleuropa unter dem Namen "Kopfkrankheit" bekannt. Der Erreger des GO-BKF wurde 1960 zum erstenmal auf Thyreoideazellen von Kälbern gezüchtet und beschrieben (Plowright, 1960). Verbreitung Weltweit. Im Süden Afrikas kommt vorwiegend GO-BKF, aber auch SA-BKF vor. In Europa und Amerika beobachtet man SA-BKF. Pro Jahr werden in der Schweiz um die 100 SABKF Fälle diagnostiziert. Meistens handelt es sich um Einzelfälle, gelegentlich sind mehrere Tiere gleichzeitig betroffen. Seite 57 Kapitel, Herpes, BKF Erreger Die zwei wichtigsten Erreger von BKF gehören zur Unterfamilie der Gammaherpesvirinae innerhalb der Familie der Herpesviridae. Innerhalb der Unterfamilie gehören sie zur Gattung Rhadinovirus, welche verschiedene Lymphozytenassoziierte Herpesviren umfasst. GO-BKF: Alcelaphines Herpesvirus Typ 1 (AlHV-1). Dieses Virus wurde bereits 1960 von Sir Walter Plowright isoliert. SA-BKF: Ovines Herpesvirus Typ 2 (OvHV-2). Bisher konnte OvHV-2 nicht isoliert werden. Mittels molekularbiologischer Methoden wurde bis 2004 die gesamte virale DNA kloniert und sequenziert (Ackermann, 2005). Aufgrund dieser Untersuchungen wurde der Erreger, ohne dass er jemals in Zellkulturen gezüchtet werden konnte, in der Unterfamilie Gammaherpesvirinae eingeordnet. Epidemiologie GO-BKF: Reservoirwirt ist das Gnu. Gnukälber werden meistens früh infiziert und scheiden danach Virus aus, erkranken aber nicht. Auch eine transplazentare Infektion ist möglich. Der Indikatorwirt ist das Rind, welches an BKF erkrankt. In Südafrika entstanden durch BKF so grosse wirtschaftliche Schäden, dass die Haltung von Gnus in Gebieten mit Rinderproduktion bis vor wenigen Jahren verboten war. Es findet keine nachweisbare Übertragung von BKF zwischen Indikatorwirten statt. SA-BKF: Die Beweise für eine Herpesvirus-Ätiologie haben sich in jüngster Zeit vervollständigt. Schafe und Ziegen sind die Reservoirwirte, während Rinder, Hirsche und andere Wildwiederkäuer sowie Schweine als Indikatorwirte zu betrachten sind. Bei circa 90% der gesunden Schafe kann mittels PCR die Virus DNA nachgewiesen werden. Die gleiche DNA wird bei an BKF erkrankten Rindern, Schweinen und Hirschen gefunden. Eine Häufung von BKF-Fällen wird im Frühjahr und Sommer (April bis August) beobachtet. Eine vertikale Übertragung wurde bislang nicht beobachtet. Die Lämmer kommen Virus-frei zur Welt und stecken sich erst im Lauf der ersten Lebensmonate an. Vor kurzem ist es erstmals gelungen, das Virus experimentell zu übertragen (Taus, 2005). Natürlich infizierte Lämmer schieden während einer sehr kurzen Zeit (wenige Stunden) infektiöses Virus über Nasensekret aus. Damit konnte die Infektion auf andere Lämmer sowie auf amerikanische Bisons übertragen werden. Die Lämmer blieben völlig gesund, während die Bisons an BKF eingingen. Virus DNA wird überdies regelmässig im Ejakulat von Schafböcken gefunden, was zur Vermutung der sexuellen Übertragungsmöglichkeit geführt hat. Eine Übertragung zwischen den Indikatorwirten ist jedoch nicht nachgewiesen. Seite 58 Kapitel, Herpes, BKF Desinfektion GO-BKF: wie bei anderen Herpesviren SA-BKF: (Noch) keine Empfehlungen. Pathogenese Proliferation von grossen lymphoblastoiden Zellen und Infiltration in verschiedene Gewebe und besonders in Gefässwände. Angiitis (Venenentzündung). Bei den Rindern sind die CD8-positiven Lymphozyten infiziert, während man beim Schaf das Virus in den CD4-positiven Lymphozyten findet. Klinik Die Inkubationszeit beträgt bei GO-BKF Wochen bis Monate (1-3), bei SA-BKF ist sie nicht bekannt. Es werden 3 Verlaufsformen der Krankheit unterschieden, wobei die Hämaturie bei allen Formen ein gutes Leitsymptom darstellt: • Akut (v.a. bei Hirschen) bis subakut. Das klinische Bild ist geprägt von hohem Fieber (>41°C), Mattigkeit, Anorexie und Lymphknotenschwellung. Gelegentlich ausgeprägte Dyspnoe (Obstruktion der Atemwege). Die Letalität (Zahl der Todesfälle pro Krankheitsfälle) der akuten bis subakuten Form ist mit etwa 90% sehr hoch. Der Tod tritt beim akuten Verlauf plötzlich, beim subakuten Verlauf innerhalb von 1 - 2 Wochen ein. • Kopf-Augen-Form mit schleimig-eitrigem Nasenausfluss, Erosion der Schleimhäute und bilaterale Keratokonjunktivitis mit Korneatrübung und starkem Tränenfluss. • Bei der Darmform dominiert wässrig-blutiger Durchfall. Abb. 1. An BKF erkrankter Stier2 Histopathologie 2 Lymphozytäre Vasculitis und Infiltration des ZNS und anderer Organe. Bild verdankenswerter Weise von Prof. U. Braun, Universität Zürich, zur Verfügung gestellt Seite 59 Kapitel, Herpes, BKF Prophylaxe GO-BKF: kein Kontakt mit Gnus, Impfung nicht möglich. SA-BKF: da nicht bekannt ist, wie der Erreger vom Schaf als Reservoirwirt auf die Indikatorwirte übertragen wird, können keine sicheren Empfehlungen abgegeben werden. Durch Absonderung von normalen Schafherden können Schafe jedoch problemlos Virus-frei gehalten werden. Eine Impfung ist noch nicht möglich. Diagnose GO-BKF: klinisch, pathologisch-anatomisch. Für die Labordiagnose stehen PCR und serologische Tests zur Verfügung. SA-BKF: klinisch, pathologisch-anatomisch. Eine real-timePCR zum Erregernachweis sowie ein SA-BKF-spezifischer ELISA zur Antikörperbestimmung stehen zur Verfügung. Differentialdiagnose Mucosal Disease, IBR/IPV, MKS, (Rinderpest), bakterielle Weidekeratoconjunctivitis (Moraxella bovis und Mycoplasma conjunctivae), fütterungsbedingte Photosensibilisierung • Zentralnervöse Erkrankungen, z.B. BSE, BHV-5, Listeriose. • Darmform: an Salmonellen, Rotaviren, Coccidien denken. • Kopf-Augen-Form: es kommt auch zu Pneumonien, bei denen man an BRSV und PI-3 denken sollte. Bei Verdacht Virologisches Institut, Vetsuisse Fakultät Zürich, 044 635 8718 Untersuchungsmaterial EDTA-Blut, Serum, Gehirn, Kopflymphknoten, Milz, Darm Therapie Symptomatisch. Literatur Ackermann, M. (2005). "Virus im Schafspelz". Schweiz. Arch. Tierheilk. 147, 155-164. Plowright, W., Ferris, R.D., Scott, G.R. (1960). "Blue wildebeest and the aetiological agent of bovine malignant catarrhal fever." Nature, 188:1167-9. Taus, N. S., Traul, D. L., Oaks, J. L., Crawford, T. B., Lewis, G. S., Li, H. (2005). "Experimental infection of sheep with ovine herpesvirus 2 via aerosolization of nasal secretions." J. Gen. Virol. 86, 575-579. Seite 60 Kapitel, Herpes, EHV EHV Autoren: Monika Engels, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc EHV Rhinopneumonitis; Stutenabort; Paralytisches Syndrom; Coitalexanthem Drei verschiedene equine Herpesviren (EHV) sind verantwortlich für die obgenannten Krankheiten: EHV-1 für den Stutenabort, EHV-4 für die Rhinopneumonitis und EHV-3 für das Coitalexanthem (äusserer Genitaltrakt). EHV-1 führt bei Jungtieren ebenfalls zu Rhinopneumonitis und EHV-4 kann sporadisch Abort auslösen. EHV-1 verursacht zudem ZNS-Störungen. Besonderheiten Latenz : Grundsätzlich wie bei BoHV-1. Unterschied: latente Viren nicht nur in Ganglien, sondern auch in lymphoidem Gewebe und peripheren Blutlymphozyten. Antigenverwandtschaft: Aufgrund kreuzreagierender neutralisierender Antikörper nur zwischen EHV-1 und EHV-4. Gelegentlich wurden mittels Immunfluoreszenz, KBR und Immundiffusion auch Antigengemeinsamkeiten zwischen EHV-1 und BoHV-1, EHV-3 u.a. Herpesviren gefunden. Staatliche Massnahmen: Keine; z.T. Vorschriften (Impfungen) durch Pferdeverbände. Geschichte Der Stutenabort wurde erstmals 1936 in den USA beschrieben; 1941 dann auch in Ungarn, wobei auch respiratorische Symptome beobachtet wurden. Virusaetiologie: Übertragungsversuche in den 50er Jahren; als Herpesviren in den 60er Jahren erkannt. Das Coitalexanthem ist schon sehr lange bekannt; die Virusaetiologie wurde aber erst 1968 gezeigt. Verbreitung weltweit; Durchseuchungsraten z.T. bis 85% (auch in Schweiz scheinbar hoch; genaue Abklärungen fehlen jedoch). Erreger EHV-1, EHV-3 und EHV-4 gehören zur Subfamilie Alphaherpesvirinae (Familie Herpesviridae), wobei EHV-3 zum Genus Simplexvirus gehört, aber EHV-1 und 4 zum Genus Varizellovirus. Morphologie, Genomstruktur und Kodierkapazität des Genoms der Varizelloviren sind vergleichbar mit BoHV-1 (s.dort). Die Genome von EHV-1 (NC_001491, 150'224 Basenpaare) und EHV-4 (NC_001844, 145'597 Basenpaare) wurden sequenziert. Die vollständigen Sequenzen sind unter den angegebenen Accession codes auf Genbank verfügbar. Seite 61 Kapitel, Herpes, EHV Früher (z.T. noch in Lehrbüchern) wurde EHV-1 als EHV-1 Subtyp 1 und EHV-4 als EHV-1 Subtyp 2 bezeichnet, da sie eine sehr enge serologische Verwandtschaft aufweisen. Aufgrund der Genomunterschiede (Restriktionsmuster, Basensequenzhomologie von nur ca. 17%) wurden sie als zwei verschiedene Typen klassifiziert. Insgesamt sind 9 verschiedene EHV (EHV-1 - EHV-9) bekannt: EHV-2 und EHV-5 sind apathogene Gammaherpesvirinae, EHV-6, 7 und 8 sind Esel-spezifische, mit EHV-1, 2 und 3 vergleichbare Viren. Heute werden die Herpesviren der Esel auch als Asinine Herpesviren bezeichnet (AsHV-1 bis 3). EHV-9 wurde erst kürzlich isoliert. Es verursacht Enzephalitis beim Pferd. Die Tenazität der EHV ist vergleichbar mit derjenigen von BoHV-1; bleibt in eingetrocknetem Zustand relativ lange infektiös (v.a. an Pferdehaar 2-6 Wochen). Virusvermehrung und Genexpression Im wesentlichen wie BoHV-1 (s.dort). Epidemiologie EHV-1 und EHV-4: Virusausscheidung oronasal bzw. via Fruchtwasser, Plazenta und Fötus. Übertragung aerogen oder durch direkten/indirekten Kontakt. Virusreservoir: zur Hauptsache latent infizierte Tiere; empfänglich sind alle Equiden. Epidemiologie stark beeinflusst durch Häufigkeit des Auftretens von latenten Infektionen, Umgebungsbedingungen (z.B. Absetzen, Fohlenweide, Transport, Sportveranstaltungen etc.) und Immunstatus der Population. EHV-3: Übertragung in meisten Fällen nur beim Decken, wenn bei einem Partner Läsionen vorliegen. Experimentelle Übertragung auch via Respirationstrakt möglich. Desinfektion s. BoHV-1 Pathogenese a) Lytisch EHV-1 und EHV-4 gelangen aerogen in den Nasopharynx, wo die erste Virusvermehrung stattfindet. Zweite Station sind die regionären Lymphknoten und die Epithelien des oberen Respirationstraktes, was zur Rhinopneumonitis führt. Die EHV-4-Infektion bleibt eher lokal. EHV-1 verbreitet sich via Lymphozyten-assoziierte Virämie im ganzen Organismus. Zielorgane: Plazenta und Fötus und/oder ZNS (selten: Genitaltrakt --> Exanthem). EHV1 scheint auch einen Tropismus für Endothelzellen zu besitzen; so liegen z.B. den ZNS-Störungen hauptsächlich Vaskulitis und Thrombose zugrunde. EHV-3 wird normalerweise beim Decken übertragen; die Infektion bleibt lokalisiert; die Läsionen werden verursacht durch Infektion des Stratum germinativum des äusseren Genitaltraktes. Seite 62 Kapitel, Herpes, EHV b) Latenz Wie bei andern Herpesviren eine Folge der lytischen Infektion. EHV etablieren die Latenz jedoch vor allem in lymphoiden Geweben des oberen Respirationstraktes und in peripheren Blutlymphozyten. Vorteil für Virus bei Reaktivierung: rasche Verbreitung im Organismus via Blut-/Lymphbahnen. Klinik EHV-1: • Rhinopneumonitis gefolgt von Stutenabort: Meist im letzten Drittel der Trächtigkeit; Inkubationszeit 14-120 Tage; Abort spontan, meist komplikationslos. Typische pathologische Veränderungen bei Föten: petechiale Blutungen in verschiedenen Organen, Lungenödem, (blutige) Transsudate in Brusthöhle, Nekrosen in Leber, Milz und Lunge; z.T. massive Lebervergrösserung. Histopathologisch v.a. Nekrosen und intranukleäre Einschlusskörperchen zu beachten (pathognomonisch). • Perinatale Sterblichkeit: Geburt lebensschwacher Fohlen (z.T. respiratorische Symptome); saugunfähig; Tod innert Stunden oder wenigen Tagen. Pathologie ähnlich wie bei abortierten Föten. • Paralytisches Syndrom: von leichtgradiger Ataxie bis hochgradiger Paralyse mit Festliegen und Tod alles möglich. Bei Festliegen ungünstige Prognose. Histopathologie: Vaskulitis (pathognomonisch). EHV-4: • Rhinopneumonitis, selten gefolgt von Stutenabort und ZNS Störungen: Tritt v.a. bei Jungtieren (bis 2 J.) in Erscheinung; bei älteren meist subklinisch. Inkubationszeit 3-10 Tage. Symptome: plötzlich auftretender Katarrh, Fieber, Depression, Anorexie, Rhinotracheitis. Bei ca. 30% der Tiere auch untere Atemwege betroffen mit Dyspnoe und Husten (Achtung bakt. Sekundärinfektionen!). EHV-3: • Coitalexanthem: Verlauf meist mild und gutartig. Betroffen sind: Haut und Schleimhaut von Vulva, Präputium, Penis. Beginn mit Schwellung und Juckreiz, gefolgt von Bläschen-/Papelbildung, die zu Pusteln werden und verkrusten. Möglich sind auch entstehende Ulzera und hämorrhagische Erosionen. Bei der Abheilung: Leukozyteninfiltration, Epithelabschilferung. Dauer: 1-2 Wochen; Spontanheilung; u.U. zurückbleibende depigmentierte Flecken ("Mosaikflecken"). Immunreaktion Eine EHV Infektion induziert sowohl humorale (z.B. neutralisierende AK) als auch zellvermittelte Immunantwort. Diese hilft einerseits die Krankheit ohne wesentliche Symptome zu überwinden, andererseits vor Reinfektionen zu schützen. Seite 63 Kapitel, Herpes, EHV Typisch ist jedoch, dass die Immunantwort nur sehr kurze Zeit persistiert (neutralisierende AK ca. 4 Monate), so dass Reinfektionen immer wieder möglich sind. Kolostrale Antikörper persistieren 2-4 Monate und bieten Schutz während dieser Zeit. Prophylaxe Expositionsprophylaxe bzw. konsequenter Impfschutz. Cave: Immunantwort sehr schlecht; gilt auch für Impfung! Nach Grundimmunisierung ist Booster alle 6 Monate - zumindest bei gefährdeten Tieren (s. Sportpferde, Zuchttransporte etc.) - sehr zu empfehlen. Achtung: Problem der Allergie! In der Schweiz zugelassene Impfstoffe (= Totimpfstoffe): Duvaxyn EHV1,4 (EHV-1 und EHV-4, bivalent); Equilis Resequin (3 Influenzavirusstämme, EHV-1, EHV-4, polyvalent). Diagnose Verdacht bei Auftreten von Respirationstrakterkrankungen, Aborten und ZNS-Störungen, v.a. wenn gehäuft bzw. äussere Umstände mit in Betracht gezogen werden können (s. Transport, Sportveranstaltungen, Fohlenweide etc.). Differentialdiagnosen Rhinopneumonitis: Influenza, Pferdehustenkomplex, Arteritis. Stutenabort: Aborte infolge Bakterien- bzw. Pilzinfektionen; Arteritis (EAV). Paralytisches Syndrom: Borna, Vergiftungen, Trauma, Tetanus, Listeriose, ev. FSME. Coitalexanthem: EHV-1, Streptokokkeninfektionen. Bei Verdacht Kontaktaufnahme mit Untersuchungslabor: Institut für Veterinär-Virologie, Vetsuisse Fakultät Bern. 031 631 2505. Untersuchungsmaterial einsenden gemäss Absprache. Womöglich Hygiene-, Managementmassnahmen im Betrieb; Impfprogramm erstellen. Untersuchungsmaterial Für Virusnachweis: Nasentupfer (ev. auch Konjuktivaltupfer); Plazenta, Fötus; Vaginaltupfer, Präputialspülprobe. Für Antikörpernachweis: Serumpaar. Aber: bei Abort nicht sinnvoll, weil die Infektion der Stute schon sehr lange zurückliegen kann. Labordiagnose Virusnachweis: Isolierung auf Zellkultur, Charakterisierung mittels Elektronenmikroskopie und Identifizierung mittels Neutralisationstest. Serologie: Serumneutralisationstest; ev. KBR. Seite 64 Kapitel, Herpes, IBR IBR/IPV Autoren: Monika Engels, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc IBR/IPV Infektiöse bovine Rhinotracheitis / Infektiöse pustulöse Vulvovaginitis Herpesvirus Infektion der Rinder, die in verschiedenen Formen auftreten kann. IBR: mild bis schwergradig verlaufende Infektion des oberen Respirationstraktes; führt bei trächtigen Kühen zu Abort. IPV bzw. IPB (infektiöse pustulöse Balanoposthitis): i.d.R. harmlose Deckseuche; äussert sich in Form eines Bläschenausschlages im Genitalbereich. Andere Krankheitsformen: Meningoenzephalitis und Enteritis als generalisierte und meist tödlich verlaufende Infektionen beim Kalb, Konjunktivitis, Metritis, Mastitis, Dermatitis. Besonderheiten Latente Infektion: regionäre Ganglien (s. unten). Antigenverwandtschaft: IBR und IPV Viren sind serologisch nicht unterscheidbar. Weniger enge Verwandtschaft mit BHV5 (Herpesenzephalitis), dem caprinen Herpesvirus 1 (CapHV1), sowie mit Herpesvirusisolaten aus Rentieren, Damhirschen und Wasserbüffeln. Staatliche Massnahmen: IBR ist eine staatlich bekämpfte Seuche (Anzeigepflicht). Der schweizerische Rinderbestand wird jährlich einmal serologisch untersucht (Stichprobe: 1% aller Betriebe) und seropositive Rinder werden ausgemerzt. Geschichte Die IPV/IPB wurde in der Schweiz und im übrigen Europa schon im letzten Jahrhundert beschrieben. Durch Decksperren und künstliche Besamung konnte die IPV/IPB jedoch gut unter Kontrolle gehalten werden; sie tritt heute praktisch nicht mehr auf, v.a. weil sie im Zusammenhang mit der IBR ebenfalls ausgerottet worden ist. Die IBR wurde1950 erstmals in den USA beschrieben. Ab den 1960er Jahren kam es in verschiedenen europäischen Ländern zu eigentlichen IBR-Seuchenzügen; 1978/79 auch in der Schweiz. Dank radikaler Bekämpfungsmassnahmen gilt die Schweiz wieder als IBR-frei. Mit vereinzelten Neuausbrüchen muss allerdings gerechnet werden. So wurden z.B. zwischen 1997 und 2000 fünf neue Fälle verzeichnet. Wahrscheinlich sind diese auf direkten Kontakt von Tieren der betroffenen Bestände mit IBR-positiven Tieren im Ausland zurückzuführen, oder der Erreger wurde, z.B. via Samen, eingeführt. Seite 65 Kapitel, Herpes, IBR Bei früheren Einzelausbrüchen konnte ein Zusammenhang mit importiertem Stierensamen nachgewiesen werden. Verbreitung Weltweit, mit unterschiedlicher Prävalenz (5-65%). Erreger Bovines Herpesvirus 1 (BHV1); Familie Herpesviridae, Subfamilie Alphaherpesvirinae, Genus Varicellovirus. Behüllt, Kapsid ikosahedral mit 162 Kapsomeren. Duchmesser Kapsid ca.100 nm, mit Hülle 150-200 nm. Genom: lineare dsDNA, infektiös; 136 kbp, mindestens 65 Gene. Das DNA-Molekül (Abbildung) ist typisch für das Genus Varicellovirus und besteht aus einem langen (UL = unique long) und einem kurzen (US = unique short), kovalent gebundenen Teilstück. US ist umgeben von 2 umgekehrt repetierten Sequenzen (IRS/TRS = internal/terminal repeat short): G e n o m v o n B H V 1 (s c h e m a tis c h ) UL 106 IR S 11 US 10 TRS 11 kbp Das vollständig sequenzierte Virusgenom hat die Kodierkapazität für ca. 70 Proteine. 10 Glykoproteine oder deren Gene sind identifiziert; mindestens 4 davon sind Hüllenglykoproteine. Anhand der DNA -, Protein- und Antigenmuster lassen sich zwei "Subtypen" von BoHV-1 (BoHV-1.1 und BoHV-1.2) unterscheiden. Die BoHV-1.1 Vertreter scheinen virulenter zu sein (z.B. verantwortlich für die IBR-Seuchenzüge in Europa). Neuropathogene Virusvarianten, die fast ausschliesslich Meningoenzephalitis verursachen, sind serologisch von BoHV1 kaum zu unterscheiden. Da sie jedoch genetisch signifikant von BoHV-1 verschieden sind, wurden sie als BoHV-5 klassifiziert. Achtung: Auch BoHV-1 kann gelegentlich Meningoenzephalitis verursachen. In der Aussenwelt relativ stabil: das Virus bleibt 5-9 Tage (Sommer, bis 37°C) und bis 30 Tage (Winter) infektiös, besonders bei hoher Luftfeuchtigkeit. Bei 56°C wird das Virus innert 1 Std. inaktiviert. Stabil im pH-Bereich 6.0 - 9.0; labil gegenüber Chloroform. Virusvermehrung BHV1 besitzt ein relativ breites Wirtszellspektrum. Das Eindringen des Virus in die Zelle wird gesteuert durch die Seite 66 Kapitel, Herpes, IBR Hüllenglykoproteine (Fusion zwischen Virushülle und Zellmembran). Die Adsorption erfolgt in zwei Schritten: Zunächst bindet das Hüllenglykoprotein gC locker an Heparansulfat Proteoglycane auf der Zelloberfläche. Danach folgt die feste Bindung von gD an einen spezifischen Rezeptor (Herpesvirus Entry Mediator C, HveC, auch als Nectin-1 bezeichnet). Die Penetration erfolgt v.a. über die Hüllenglykoproteine gB und gH/gL. Im Detail sind die Mechanismen noch nicht genau bekannt. gC ist nicht essentiell für die Virusreplikation. Möglicher Weg der Adsorption bei Fehlen von gC: Rolle der Glykoproteine bei Adsorption und Penetration: gC: Adsorption an den Heparansulfat Proteoglykan Rezeptor gD: feste Bindung an HVEM, einen zellulären Rezeptor, Fusion und Penetration mit gB, gH/gL gC-Deletionsmutante: Infektiosität reduziert, Replikation verzögert, weniger extrazelluläres Virus TP600E/.../gC_adso.pr4 Doppelte Funktion für gC: Stabilität des freien Virus, lockere Adsorption an den Heparan-Rezeptor, der praktisch auf allen Zellen vorkommt. DNA-Replikation und Transkription finden im Zellkern, die Proteinsynthese im Zytoplasma statt. Neu gebildete Viren erhalten ihre Hülle von zytoplasmatischen Membranen (Golgi). Die Viren verlassen die Zelle durch Ausknospung. Seite 67 Kapitel, Herpes, IBR Genexpression Die Virusreplikation/Genexpression ist streng reguliert und erfolgt in drei zeitlichen Phasen: 1. die unmittelbar frühe (IE; "immediate early"; alpha), 2. die frühe (E; "early"; beta) und 3. die späte (L; "late"; gamma) Phase (Abbildung). Regulierung durch viruskodierte Proteine (Aktivatoren/Repressoren) und Enzyme. Die IE Genexpression wird aktiviert durch ein spätes Strukturprotein. Strategie der Herpesvirus Replikation genomische DNA IE mRNA IE Proteine: Regulation Aktivierung Suppression E mRNA E Proteine: L mRNA L Proteine: Enzyme Regulation Struktur DNA Replikation Strukturproteine neue virale DNA Viruspartikel Die Regulation der Genexpression erfolgt über sogenannte "cis-aktive" Stellen auf dem Genom, an welche zelluläre oder virale Transkriptionsfaktoren binden. Diese sind dann für den Beginn und den Umfang des Abschreibevorganges verantwortlich. Andererseits können cis-aktive Elemente auch mit positiven oder negativen Transaktivatoren ("trans-aktiv") interagieren. Die Gesamtheit dieser cis- und trans-aktiven Elemente sorgt für die dosierte Expression der Herpesvirus Gene zu jedem Zeitpunkt der Infektion. Während der Latenz findet keine normale Genexpression statt. Gewisse Herpesviren der Subfamilie Gammaherpesvirinae produzieren "Latenzproteine". Bei den aus veterinärmedizinischer Sicht relevanten Alphaherpesvirinae wurden bisher jedoch nur "Latenz-assoziierte Transkripte" (LAT=RNA) nachgewiesen. Die LAT-RNA wird nach heutigem Wissensstand während der Latenz nicht translatiert. Vermutlich wirkt sie als "antisense RNA" negativ regulierend auf die Expression wichtiger IE-Gene. Seite 68 Kapitel, Herpes, IBR Epidemiologie Virusausscheidung bei IBR : vor allem via Nasen- und Augensekrete. Dauer: 10-16 Tage. Sehr wichtig ist dieVirusausscheidung anlässlich eines Abortes (Fruchtwasser, Plazenta, Fötus) und die Ausscheidung mit dem Samen. Ein infizierter Stier scheidet sein Leben lang sporadisch Virus aus (Reaktivierung)! Eine Ausscheidung mit andern Sekreten und Exkreten ist ebenfalls möglich, je nach Verbreitung des Virus im Organismus. Mit Milch ist die vertikale Übertragung der Infektion experimentell gelungen, dieser Übertragungsweg scheint jedoch in der Natur unbedeutend zu sein. Ebenso ist eine Übertragung via Embryotransfer auszuschliessen, sofern der Embryo ordnungsgemäss gehandhabt wurde. Die Übertragung der IBR erfolgt meist aerogen (Tröpfcheninfektion) oder durch direkten Kontakt; indirekt auch möglich via kontaminierte Futtertröge, Geräte u.ä. Der Mensch kann als mechanischer Vektor eine wichtige Rolle spielen bei der Einschleppung und Weiterverbreitung innerhalb eines Bestandes. Hauptwirt ist das Rind. Andere Paarhufer können jedoch auch empfänglich sein für die Infektion, allerdings meist ohne zu erkranken! Hier sind v.a. Schafe, Ziegen und Schweine zu nennen, bei denen Virus nachgewiesen werden konnte; andere Tierarten, v.a. verschiedene Wildwiederkäuerarten, wurden nur serologisch erfasst. Diese Fremdwirte können u.U. als Virusreservoir dienen. Eine in der Schweiz durchgeführte serologische Abklärung ergab jedoch keine Hinweise für ein Virusreservoir ausserhalb der Rindergattung. Als Hauptinfektionsquelle dienen akut (auch subklinisch) und insbesondere latent infizierte Tiere. Grosse Gefahren bestehen deshalb dann, wenn Tiere ungetestet zugekauft werden oder wenn Tiere von verschiedenen Seiten zusammengebracht werden, wie Märkte, Transport, Alpung u.ä. (Achtung: StressSituationen --> Virusreaktivierung). Bei der IPV/IPB wird das Virus mit den Vaginal- bzw. Präputialsekreten ausgeschieden. Dauer: 8-14 (IPV) bzw. 1422 Tage (IPB). IPV/IPB wird via Deckakt bzw. KB übertragen; daneben können iatrogene und Schmierinfektionen (Schwanzschlagen) vorkommen. Desinfektion Geeignet sind z.B. 0.5% NaOH, 1%-ige Phenol-Derivate, 1%ige quaternäre Ammoniumbasen, 5% Formalin. Seite 69 Kapitel, Herpes, IBR Pathogenese IBR: Virusaufnahme i.d.R. aerogen oder über kontaminiertes Futter (z.B. Maststall), erste Virusvermehrung in der Mukosa des oberen Respirationstraktes. Die lokale Virusvermehrung führt zu den respiratorischen Krankheitssymptomen. Daneben Weiterverbreitung des Erregers im Organismus auf zwei möglichen Wegen: 1. Via Lymphgefässe und Lymphknoten; das Virus gelangt mit Monozyten und andern Leukozyten (leukozyten-assoziierte Virämie) zu seinen Zielorganen. Zielorgane: Fötus, Digestionstrakt, Zentralnervensystem, Euter. Fötale Infektion (generalisiert, perakut) erfolgt via Infektion der Plazenta. Die Virämie ist meist nur schwach und transient (es zirkulieren nur wenige infizierte Leukozyten ). Die Replikationsfähigkeit von BHV1 in Leukozyten ist noch nicht gesichert. 2. Via lokale Nervenendigungen (ausgehend vom Nasopharyngealraum und Tonsillen) ins Zentralnervensystem; dort einerseits Etablierung einer latenten Infektion, andererseits auch möglicher Weg bei Enzephalitis. Allgemein: Lokal ist die Virusvermehrung auf Mukosa und Submukosa des oberen Respirationstraktes beschränkt. Die Infektion führt jedoch zu einer transienten Immunsuppression und damit, zusammen mit den Schleimhautläsionen, zu erhöhter Empfänglichkeit für bakterielle Sekundärinfektionen. IPV: Die Virusaufnahme erfolgt über die Genitalschleimhaut. Die Virusvermehrung bleibt i.d.R. lokalisiert auf die Mukosa von Vulva, Vagina, Penis und Präputium. Latenz Nach ihrer Vermehrung in den Schleimhautzellen können die Viren auch in die lokalen Nervenendigungen eindringen (Fusion). Transport der nackten Nukleokapside intraaxonal zum Nukleus des Neurons im regionären Ganglion (Bsp.: IBR --> Trigeminusganglion, IPV --> Sakralganglien). Dabei sind Neuronendegeneration, Neuronopathie und Ganglionitis möglich, vor allem aber kommt es zur Etablierung der Latenz. Während Latenzphase keine Virionen nachweisbar, wohl aber Virusgenom. Zumindest 1 Gen (sogenanntes LAT-Gen; LAT: Latenz- assoziierte Transkripte) wird während der Latenzphase transkribiert. Die biologische Funktion des LATs ist nicht gesichert. Spekuliert wird über eine mögliche antisense Funktion (?) sowie über den Schutz der Ganglienzellen vor Apoptose. Reaktivierung Stressfaktoren (Transport, Geburt, Krankheit u.a.), aber auch Corticosteroidgaben können zur Reaktivierung der latenten Infektion führen. Es werden wieder infektiöse Viren produziert, die via Nervenbahnen zurück an die Peripherie wandern und dort ausgeschieden werden. Die Reaktivierung kann mit dem Auftreten von milden klinischen Symptomen verbunden sein, verläuft aber meist asymptomatisch. Seite 70 Kapitel, Herpes, IBR Klinik IBR: Inkubationszeit 2- 4 (7) Tage. Hauptsymptome: Fieber bis 42°C, erhöhte Atemfrequenz, Husten, Nasenausfluss (zuerst serös, später mukopurulent), Hyperämie der Nasenschleimhaut ("red nose"), evtl. Konjunktivitis, starkes Speicheln; Anorexie, Leistungs- und Milchrückgang. Pneumonie nach bakterieller Sekundärinfektion. Chronische Abmagerung als Spätfolge. Abort: Nach Inkubationszeit von 3-6 Wochen; meist zwischen 5. und 8. Trächtigkeitsmonat. Ohne spezielle Anzeichen. Meningoenzephalitis (Kalb): Inkoordination, Muskelzittern, Kreisbewegungen, Ataxie, Festliegen; evtl. Erblindung, meist Tod. In Europa selten; in Australien und v.a. Südamerika: Erreger = BHV5. Enteritis (Kalb): generalisierte Erkrankung mit Durchfall; meist Tod innert kurzer Zeit. IPV/IPB: Inkubationszeit 1-3 Tage; erste Anzeichen: häufiges Harnabsetzen, anormale Schwanzhaltung. Genitalschleimhäute hyperämisch und mit kleinen Pusteln versehen. Meist harmlos; akutes Stadium ca. 2-4 Tage, danach Abheilung innert 10-14 Tagen. Immunreaktion Humorale Antikörper erscheinen 8-12 Tage p.i. Bei einer Primärinfektion sind es v.a. IgM und IgG1. Maximale Titer werden erreicht nach 35 Tagen (IgG) beziehungsweise 14 Tagen (IgM). Bei einer Reinfektion werden v.a. IgG2 ausgebildet; die IgM Antwort fällt aus. Die humoralen Antikörper können mehrere Jahre persistieren, brauchen jedoch gelegentliche Stimulation (Booster), was durch Reaktivierung der latenten Infektion oder durch Reinfektionen geschieht. Maternale Antikörper persistieren während 1 bis max. 6 Monaten. Eine Infektion kann dadurch nicht verhindert werden, wohl aber eine schwere Erkrankung und ein tödlicher Ausgang. Humorale Antikörper spielen da eine Rolle, wo Viren sich im Extrazellulärraum bewegen. Sie können aber eine Virusverbreitung im Organismus nicht verhindern, da sich die Viren auch via Interzellulärbrücken und via Nervenbahnen weiterverbreiten können. In Nasen- und Genitalsekreten wurden auch sekretorische Antikörper, IgA, nachgewiesen. Diese haben lokal eine Bedeutung, v.a. im Zusammenhang mit Reinfektionen und Reaktivierung. Die zellvermittelte Immunantwort (Antikörper-unabhängige Zerstörung von infizierten Zellen; beteiligt: T-Lymphozyten, Monozyten/Makrophagen, Lymphokine) ist aber für die Überwindung der Infektion am wichtigsten. Sensibilisierte Lymphozyten konnten schon 5 Tage p.i. nachgewiesen werden; Peak ca. 8-10 Tage p.i. Seite 71 Kapitel, Herpes, IBR Wichtig: Die Immunantwort auf eine Primärinfektion vermag zur Ausheilung der klinischen Symptome beizutragen; sie verhindert jedoch nicht die Etablierung einer Latenz. Ebenso vermag sie Reinfektionen und die Reaktivierung einer latenten Infektion nicht zu verhindern. Sie kann lediglich die klinischen Symptome mildern und die Virusausscheidungsdauer und menge verringern. Impfprophylaxe Es gibt verschiedene Impfstoffe; die Schutzimpfung ist in der Schweiz verboten. Gründe: 1. Schutz unbefriedigend: Die Impfung schützt zwar vor schwerer Krankheit, aber es gibt keinen Schutz gegen Feldvirusinfektion und Latenz. 2. Im Zusammenhang mit dem Bekämpfungsprogramm können geimpfte Tiere nicht von infizierten unterschieden werden. In der EU stehen sogenannte Markervakzinen im Einsatz, denen ein bestimmtes Glykoprotein (gE) fehlt. Tiere, welche eine natürliche Infektion durchgemacht haben, entwickeln Antikörper gegen gE, geimpfte Tiere hingegen nicht. Somit ist eine Unterscheidung möglich. (siehe auch Porträt des Aujeszky Virus) Diagnose Verdacht: wenn Symptome der Rhinotracheitis, Pneumonie, Abort auftreten, insbesondere wenn vorgängig ein Zukauf oder Stress- Situationen zu verzeichnen waren. Meningoenzephalitis und Enteritis mit generalisierter Erkrankung bei Kälbern: Verdacht, v.a. wenn IBR Symptome und/oder Aborte im Bestand. IPV/IPB: Verdacht bei typischem klinischen Bild. Differentialdiagnosen IBR: Rindergrippe; BVD/MD, Rinderpest, Bösartiges Katarrhalfieber; Abort: Brucellose, Listeriose, Vibrionen. Bei Verdacht Virologisches Institut, Vetsuisse Fakultät, Universität Zürich, Winterthurerstrasse, 8057 Zürich benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. 044 635 8718 Definitiver Nachweis nur im Labor möglich. Im Bestand soweit möglich Management- und Hygienemassnahmen ergreifen zum Schutz der nicht-infizierten Tiere. Seite 72 Kapitel, Herpes, IBR Untersuchungsmaterial Für Virusnachweis: Sekrete (z.B. Nasen/Rachen- und Konjunktivaltupfer; Vaginaltupfer; Präputialspülprobe); Placenta, Fötus. Material zum Virusnachweis sollte möglichst frisch sein und gekühlt und rasch ins Labor transportiert werden. Für Antikörpernachweis: Serum. Früher wurde auch Milch (als Sammelmilchprobe) für Massenuntersuchungen verwendet. Zur Abklärung von Seuchenausbrüchen ist auch die Reaktivierung latent infizierter Tiere mittels Cortisontherapie möglich. Zwei bis zwölf Tage nach Beginn der Therapie beginnen die Tiere Virus auszuscheiden, welches dann isoliert werden kann. Eine vergleichende Restriktionsenzymanalyse (REA) der Virus DNA mit den REA-Mustern von Virusisolaten bekannter Herkunft kann wichtige Hinweise auf die Infektionsquelle ergeben. Labordiagnose Virusnachweis: Virusisolierung in Zellkultur, Charakterisierung mittels Elektronenmikroskopie und Identifizierung mittels Neutralisationstest. Immunfluoreszenztest mit Ausstrichen von Tupferproben. Taqman PCR und konventionelle PCR. Antikörpernachweis mittels ELISA (Serum, Milch) oder Serumneutralisationstest (Serum). Seite 73 Kapitel, Influenza Influenza Autoren: Martin Schwyzer, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc Influenza Influenza A Viren Influenza (Grippe) ist eine hochansteckende, fieberhafte, akut verlaufende Viruserkrankung des Respirationstraktes bei Menschen, Primaten, Pferden, Schweinen, Geflügel, Wasservögeln sowie Meeressäugetieren. Besonderheiten Influenza ist eine Zoonose. Reservoir in Wassergeflügel. Besondere Rolle der Schweine bei der Übertragung auf den Menschen. Das Virus-Genom besteht aus acht Segmenten (einzelsträngige RNA), für 10 Proteine codierend. Ein Segment codiert für das Hämagglutinin (HA), welches für die Bindung des Virus an den Zellrezeptor verantwortlich ist, und gegen welches sich die Immunantwort in erster Linie richtet. Bei gleichzeitiger Infektion einer Zelle mit zwei verschiedenen Virus-Subtypen können Nachkommenviren mit reassortierten Segmenten entstehen. So kann ein Virus mit neuem HA in Umlauf geraten, gegen das die Bevölkerung nicht immun ist. Es kommt zu einer weltweiten Grippe-Epidemie (Pandemie). Geschichte Erste Beschreibung einer Influenza-Pandemie durch Hippokrates 412 v.Chr. Im Mittelalter dem Einfluss (Influenza) der Sterne zugeschrieben. Die Pandemie von 1918/19 (spanische Grippe) forderte mit circa 20 Millionen Toten mehr Opfer als der vorangegangene Weltkrieg. Virus erstmals isoliert 1933 (H1N1), Viruspassagen in Frettchen, Mäusen, Hühnerembryonen. Die 1940 entdeckte Hämagglutination ermöglicht die Titration des Virus. 1997 konnten die Sequenzen des Influenzavirus von 1918 (H1N1) aus Formalin-fixiertem Lungengewebe bestimmt werden (Molekulare Archäologie). 1997: "Hühnergrippe" in Hong Kong (H5N1). 1999 Geflügelpest in Italien: 13 Millionen Hühner und Truten getötet. 2003/04 Geflügelpest in ganz Südost-Asien, gegen 100 Millionen Vögel getötet, über 20 menschliche Todesfälle in Thailand und Vietnam. Erreger Die Influenzaviren bilden zusammen die Familie Orthomyxoviridae und sind deren einzige Vertreter. Influenza A, B, und C unterscheiden sich in den inneren Strukturproteinen (Nukleoprotein NP und Matrixprotein M1). Influenza B ist nur beim Menschen bekannt; Influenza C wurde ausser beim Menschen auch beim Hund und beim Schwein beobachtet, scheint aber klinisch inapparent. Seite 74 Kapitel, Influenza Thogoto-artige Viren (Dhori, Thogoto), die von Zecken gelegentlich auf Menschen übertragen werden, wurden früher den Bunyaviridae zugeordnet, danach auch als Influenza D bezeichnet. In der Folge wird nur Influenza A als das wichtigste Grippevirus beschrieben. Hülle deformierbar, pleomorph, 80-100 nm, darin eingelassen Glykoprotein-Spikes HA und Neuraminidase (NA), innen M1 angelagert. Genom einzelsträngige RNA negativer Polarität, Basensequenz bekannt (12,588 Nukleotide), aufgeteilt in 8 Segmente von 500 bis 2500 Nukleotiden. Segmente verpackt mittels Nukleoprotein (NP) in helikale Nukleokapside, an den Enden RNA-Replikase-Komplexe (PB2, PB1, PA). Virusvermehrung und Genexpression Rezeptoren sind zelluläre Glykoproteine mit exponierter Neuraminsäure (Zucker mit saurer Gruppe), woran sich HA bindet. Influenzaviren des Geflügels und der Pferde machen Gebrauch vom "aviären" Rezeptor (NeuAc2,3Gal), der sich vom "humanen" Rezeptor (NeuAc2,6Gal) unterscheidet. Schweine verfügen über beide Rezeptoren und sind deshalb für die Infektion mit aviären und humanen Influenzaviren empfänglich. Virus gelangt durch rezeptorvermittelte Endozytose in Lysosomen. Saures Milieu (pH<5) induziert einerseits die Fusion von HA der Virushülle mit der Lysosomenmembran, was zum Ausstoss des Nukleokapsids ins Zytoplasma führt. Andererseits strömen Ionen durch den aktivierten M2-Kanal ein, zersetzen das Nukleokapsid und sorgen so für die Freisetzung der RNA. RNA-Synthese: Im Gegensatz zu den meisten anderen RNA-Viren geschieht die RNA-Synthese im Zellkern. Jedes in den Zellkern transportierte Influenza RNA-Segment trägt einen RNA-Polymerase-Komplex (PB2, PB1 und PA). Die Endonuklease PB2 schneidet von den 5'Enden zellulärer mRNA 10-13 Nukleotide samt 5'Cap ab und stellt sie der Polymerase PB1 als Primer (Starthilfe) zur Verfügung. Dieser Influenza-spezifische Trick wird als "Cap snatching" oder "Kappe stehlen" bezeichnet. Mit den RNA-Segmenten als Vorlage werden die Primer zur viralen mRNA verlängert. Die Segment-Enden werden in dieser Phase unvollständig kopiert. Vollständige genomische RNA-Segmente zur Verpackung in Nachkommen-Viren werden erst in der folgenden Phase produziert. Die Polymerase PB1 benötigt jetzt PA und NP für einen Start ohne PB2 und ohne Primer. Zuerst werden RNASegmente positiver Polarität gebildet, die dann als Vorlage für die Synthese neuer RNA negativer Polarität dienen. Seite 75 Kapitel, Influenza Proteinsynthese: Sechs RNA-Segmente spezifizieren je eine mRNA für die Virusproteine HA (Hämagglutinin), NA (Neuraminidase), NP (Nukleoprotein), PB1, PB2, PA (drei grosse Proteine, die den RNA-Replikase-Komplex bilden). Die anderen zwei RNA-Segmente spezifizieren je zwei verschieden gespleisste mRNAs für M1 (Matrixprotein) und M2 (Membranprotein auf der Zelloberfläche, aber nur wenig in der Virushülle), sowie für NS1 (Nichtstrukturprotein) und NS2 (bindet M1; früher als Nichtstrukturprotein angesehen). Aufbau des Influenza A Virus Segment 1 2 3 RNA Länge (nt) 2341 2341 2233 4 Protein PB2 PB1 PA Protein Länge (aa) 759 757 716 Anzahl pro Virion 30-60 30-60 30-60 1778 HA 566 500 5 1565 NP 498 1000 6 1413 NA 454 100 7 1027 gespleisst M1 M2 252 97 3000 20-60 8 890 NS1 230 0 gespleisst NS2 121 130-200 Funktion (siehe "Virusvermehrung") Endonuklease, "Cap stehlen" für virale mRNA RNA Polymerase (Replikase) Unterstützt Synthese genomischer Virus RNA (zusammen mit NP) Hämagglutinin; nach Spaltung in HA1 und HA2 auch Fusionsprotein Nukleokapsid-Protein, fördert Transport der RNASegmente in den Zellkern, später Synthese und Verpackung der neuen Virus RNA Neuraminidase für Freisetzung. Zielmolekül für die antiviralen Neuraminidasehemmer. Matrixprotein bildet Schicht innen an Virus-Envelope Protonenkanal in Zell- und Virusmembran zur pHSenkung. Zielmolekül für das Medikament Amantadin. Einziges Nichtstrukturprotein, bindet RNA, fördert VirusProteinsynthese durch Bindung an eIF4GI (Initiationsfaktor) Bindet an M1, wirkt auf NS1 Synthese HA, NA und M2 gelangen via Golgi in die Zellmembran, die anderen werden in den Zellkern transportiert. HA wird von einer zellulären Protease in HA1 und HA2 gespalten, die aber miteinander assoziiert bleiben. Viren mit ungespaltenem HA können im nächsten Zyklus nicht mit der Lysosomenmembran fusionieren und sind nicht infektiös Neue Nukleokapside entstehen im Kern aus RNA, NP, M1 und dem Replikase-Komplex. Sie wandern ins Zytoplasma und knospen an der Zellmembran unter Mitnahme von HA und NA. In dieser Phase ist die enzymatische NA Aktivität wichtig für die Ablösung der Viren von den infizierten Zellen. Hier greifen die neuen NA-Hemmer an (siehe Therapie). Rekonstituierung von infektiösem Influenza A Virus. Das rasch wachsende Wissen über die Replikationsmechanismen machten sich zwei Forschungsgruppen zunutze: sie berichteten 1999 über die Rekonstituierung von infektiösem Influenza A Virus ausgehend von 12 rekombinanten DNA-Plasmiden (J.Virol. 73:9679 und PNAS 96:9345). Dies öffnet neue Wege zur gezielten Einführung von Mutationen, z.B. im Hinblick auf Impfstoffe. Seite 76 Kapitel, Influenza Replikation HA, NA Spikes Adsorption Virusrezeptor ein Viruspartikel Penetration U Lysosom pH<5 8 Minus-RNA-Segmente Uncoating (Fusion) c Replikation (-) ->(+) ->(-) 8 RNA+Protein Assembly Budding Cap c Zell mRNA virale mRNA c c c c c c 10 c c c c PB1, PB2, PA NS1, NS2, NP, M1 in den Kern c c Translation Virale Proteine (mit Signal-Sequenzen) HA, NA, M2 via ER-Golgi in Zellmembran 104 Viruspartikel Subtypen, Reassortierung Serologisch werden Virus-Subtypen bestimmt durch zurzeit 15 unterscheidbare HA (numeriert H1 bis H15) sowie 9 verschiedene NA (N1 bis N9). Durch Reassortierung kann im Prinzip jede beliebige Kombination von HA und NA entstehen, auch wenn im Feld längst nicht alle realisiert sind. Nomenklatur: Wirt/Ort und Nummer der Isolation/Jahr (Subtyp). Beispiele: Eq/Miami/1/63 (H3N8) oder Sw/Iowa/15/30 (H1N1). Pathogenese Eintritt in den Respirationstrakt durch Tröpfcheninfektion. Tröpfchen von 1µm gehen bis in die unteren Luftwege. Erste Haftung an Mukoproteinen (enthalten Neuraminsäure) im Schleim. NA baut den Schleim ab. Dies verhindert Austreiben des Virus durch Zilienbewegung und setzt Zellrezeptoren für HA auf den Zilien frei. Virusvermehrung in den Zielzellen (respiratorische Epithelzellen), grossflächige Zellzerstörung. Die Vermehrung bleibt auf die Epithelzellen beschränkt, kaum je Virämie, nach einigen Tagen beginnt von der Basalschicht her die Regeneration des Epithels. Seite 77 Kapitel, Influenza Grund für unterschiedliche Virulenz (vor allem beobachtet bei Vogel-Influenza H7 oder H5) Spaltstelle von HA gespalten durch Folgen virulent R-X-R/K-R Furin: Protease im Alle HA gespalten vor Golgi-Apparat vieler Zusammenbau -> Zellen generalisierte Infektion weniger virulent X-X-X-R Extrazelluläre HA nur zum Teil und Protease (Factor X erst nach Knospung like), nur von gespalten -> Infektion speziellen Zellen bleibt lokalisert sezerniert R=Arginin K=Lysin X=andere Aminosäure Abbildung unten: Strukturschema des Hämagglutinins von Influenza A Virus. Die Zahlen kennzeichnen die Position in der Aminosäurensequenz. Die ersten 16 Aminosäuren werden schon während der Biosynthese entfernt (Signalpeptid). Nr. 1 ist das resultierende N-terminale Ende. Bei der Spaltung in HA1 und HA2 wird Arginin Nr. 329 entfernt. Über eine S-S Brücke bleiben HA1 und HA2 kovalent verbunden. Die Region um 330-350 ist für die Fusion verantwortlich. -16 1 14 N Signalpeptid Klinik S-S 330 350 HA1 460 514 540 550 HA2 Spaltstelle fusogene Region Transmembranregion Mensch: Inkubationszeit 1-3 Tage. Klinisches Bild reicht von asymptomatischer Infektion bis zur primären viralen Pneumonie mit Todesfolge. Abrupter Beginn mit Kopfweh, trockenem Husten, gefolgt von Myalgie, Nasen- und Augenausfluss, Rötung der Schleimhäute. Hohes Fieber (3841°C) von durchschnittlich 3 Tagen Dauer, zugleich maximale Virusausscheidung. Das klinische Bild geht einher mit erhöhter Produktion von Zytokinen (IL-1, IL-6, IFN, TNF-alpha). Die Primärinfektion zeigt geringe Letalität (<1%), aber sie bahnt den Weg für Sekundärinfektionen wie Mittelohrentzündung (vor allem bei Kindern), Konjunktivitis, bakterielle Pneumonie. Seite 78 Kapitel, Influenza Bei Tieren sind grundsätzlich dieselben Symptome zu beobachten. Spezielle Bemerkungen - Schwein: Fieber 4142°C, schwere Erkrankung 3-6 Tage, die Tiere liegen wie tot herum, dann schnelle Gesundung. Pferd: Prodromalphase Augen- und Nasensymptome, Schwellung der Kehlgangslymphknoten. Hauptphase Fieber 40°C, hohler trockener Husten. Heilung ohne Behandlung innert 2-3 Wochen. Geflügel: klassische Geflügelpest; stärker generalisierte Erkrankung mit erheblich höherer Letalität als bei anderen Spezies. Fieber bis 44°C, zusätzlich zu respiratorischen Symptomen Kopfödeme, Kammnekrosen, ZNS-Symptome, Durchfall. Subtypen H5 und H7 besonders virulent (Mutation im Bereich der Spaltstelle zwischen HA1 und HA2; dadurch Spaltung bereits im Golgi-Apparat durch ubiquitäre Endoproteasen. Die anderen Subtypen werden durch extrazelluläre, weniger weit verbreitete Enzyme erst während oder nach der Knospung gespalten). Wasservögel: hier ist Influenza endemisch, meist inapparente enterale Infektion (Virusreservoir). Immunreaktion Die erste Abwehrlinie ist Induktion von Interferon; (erste Zelle sezerniert Interferon, zweite Zelle reagiert darauf mit Synthese eines schützenden Mx Proteins). Die zweite Abwehrlinie sind Antikörper gegen HA und NA, die etwa 4 Tage nach Krankheitsbeginn auftreten und zur Elimination des Virus beitragen. Die IgA sind für eine bleibende Immunität besonders wichtig. Zelluläre Immunabwehr hat Entzündung, T-Zell-Infiltration, Hyperämie, Ödeme zur Folge. Epidemiologie Charakteristisch für Influenzaviren sind zwei klassische Phänomene, Shift und Drift, welche die Epidemiologie bestimmen. Antigen-Drift (Treiben) beruht auf der hohen Mutationsrate des Virusgenoms. So wird die im Grunde sehr langlebige Immunität (Mensch: 20 Jahre) durch Antigen-Drift in HA und NA innert weniger Jahre überspielt. Antigen-Shift (Verschiebung) beruht auf der eingangs erwähnten Reassortierung von RNA-Segmenten und kann durch sprunghaftes Erscheinen eines neuen Subtyps eine Pandemie auslösen. Reassortierung kann gelegentlich zwischen Influenzaviren verschiedener Wirtsspezies vorkommen und zu Wirtswechsel führen. Das eigentliche Reservoir der Influenzaviren ist in Wasservögeln beheimatet. Solche Zugvögel mit extrem weiten saisonalen Flugwegen tragen die Viren rund um die Erde. Die Infektkette geht weiter über lokales Wassergeflügel, danach domestiziertes Geflügel und/oder Schweine zum Menschen. Dies besonders in Gegenden, wo verschiedene Wirte eng zusammenleben (z. B. China). Seite 79 Kapitel, Influenza Die Annahme, dass das Schwein als "Mischgefäss" dient, in dem die Reassortierung hauptsächlich stattfindet, wurde durch die Beobachtung bestätigt, dass Schweine sowohl Rezeptoren für humane als auch für aviäre Influenzaviren haben. Die Rezeptoren unterscheiden sich in der Art der chemischen Bindung der Neuraminsäure (2>3 oder 2>6 Position). Im Jahr 2001 (Science 293, 1842) wurde das Influenzavirus von 1918 nochmals genauer analysiert. Überraschend zeigte es sich, dass anstelle von Reassortierung eine Rekombination im HA-Segment zwischen Schwein- und Mensch-spezifischen Abschnitten zur Pandemie geführt haben könnte. Durch Zirkulation unter den Schweinen können sich die aviären Influenzaviren auch ohne Reassortierung an den humanen Rezeptor adaptieren. Dadurch entsteht ein weiterer Weg zur Übertragung der aviären Influenzaviren auf den Menschen. Beim Ausbruch der sogenannten Vogelgrippe in Hong Kong (1997) wurde zudem festgestellt, dass bestimmte Genom-Segmente ausser denjenigen für H und N sehr wichtige Grundlagen für die "Humanisierung" und Virulenz der Influenzaviren in sich tragen. Die Influenzaviren des Pferdes (2 Subtypen: H7N7 und H3N8) evolvieren erheblich langsamer, vielleicht weil infolge des schlechten immunologischen Gedächtnisses der Selektionsdruck kleiner ist oder weil eine Wirtsrestriktion besteht (vgl. Porträt Equine Influenza). Verbreitung Auf Grund der hohen Kontagiosität sind die Influenzaviren bei mobilen Spezies (Mensch, Pferd, Wasservögel) weltweit verbreitet, während sie beim Schwein und Geflügel durch seuchenpolizeiliche Massnahmen (Keulung, Quarantäne) eingeschränkt werden können. Schweineinfluenza vor 1970 besonders in USA und im fernen Osten, seither auch in Europa. Klass. Geflügelpest in CH seit Jahren kein Problem, aber in Holland, Italien, Deutschland, Irland neue Fälle aufgetreten. Diagnose Bei hohem Fieber und respiratorischen Symptomen, besonders im Winterhalbjahr und während einer Epidemie, an Influenza denken. Der eindeutige Nachweis ist nur im Labor möglich. Antikörpernachweis: gepaarte Seren nötig für den Nachweis einer akuten Infektion. Hämagglutinations-Hemmtest, ELISA oder Komplementbindungsreaktion. Virusnachweis: Nasenoder Rachentupferproben; direkte Immunfluoreszenz; Virusisolierung in Amnionhöhle des bebrüteten Hühnereis; auch möglich in Allantoishöhle sowie in primären Nierenzellkulturen (braucht ev. Adaptation, Blindpassagen). Nachweis durch Hämadsorption, Hämagglutination, RT-PCR. Seite 80 Kapitel, Influenza Für humane Influenzaviren existiert ein nationales Referenzlabor in Genf zur Typenbestimmung (für den Patienten kommt der Test zu spät, aber er ist wichtig für die epidemiologische Abklärung). Für Schweineinfluenza: Virologisches Institut, Vetsuisse Fakultät, Universität Zürich, Winterthurerstrasse, 8057 Zürich benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. 044 635 8718 (PD Dr. M. Engels). Geflügelinfluenza: Abteilung für Geflügelkrankheiten, Institut für Veterinärbakteriologie, Vetsuisse Fakultät, Universität Zürich, Winterthurerstrasse, 8057 Zürich. 044 635 8631 (Prof. R. Hoop). Differentialdiagnosen Viele andere respiratorische Erkrankungen tragen den volkstümlichen Namen "Grippe". Beim Pferd kommen z. B. EHV4, Adeno- Rhino- und Reoviren in Frage. Schwein: PRRS, Aujeszky, Schweinepest. Mensch: Paramyxo-, Corona-, Adeno- und Rhinoviren; Mykoplasmen. Desinfektion Die üblichen Desinfektionsmittel sind wirksam. Influenzaviren sind relativ labil gegenüber Wärme und Sonnenlicht (deshalb gehäuftes Auftreten im Winter), sowie tiefem pH (deshalb keine Passage in den Digestionstrakt). Vögel beherbergen resistentere Influenzaviren (Anpassung an erhöhte Körpertemperatur, Ausscheidung mit dem Kot von Wasservögeln möglich). Möglicherweise können ausgeschiedene Viren in gefrorenen Seen überwintern. Prophylaxe Hauptproblem ist die Variabilität (ausser beim Pferd): aus neu auftretendem Subtyp muss raschmöglichst ein neuer Impfstoff hergestellt werden; die Herstellung eines Lebendimpfstoffes würde zu lange dauern. In Entwicklung: gezielte Reassortierung mit attenuiertem Impfstamm (temperaturempfindlich). Die Wirksamkeit der inaktivierten Vakzinen ist nicht völlig befriedigend: unvollständiger Schutz; keine lokale Immunität. Jedenfalls sollten alle Subtypen vertreten sein. Dies ist bei den in der CH zugelassenen PferdeImpfstoffen der Fall. Seite 81 Kapitel, Influenza Pferd: Seuchen trotz Impfung (A equi 1, H7N7; A equi 2, H3N8) nicht ausgeschlossen. Impfplan ist einzuhalten Erstimpfung 5, 6 und 12 Monate, dann jährliche Wiederholung. Kombination mit Tetanus eher vermeiden (Konkurrenz: Tetanus zu gutes Antigen). Schwein: In der CH werden keine Impfstoffe gegen Schweineinfluenza vertrieben (zuwenig Interesse). In D: neue Spaltvakzine H1N1 und H3N2. Geflügel: Impfung in der Schweiz aus seuchenpolizeilichen Gründen verboten. Mensch: Influenzavakzine besser als ihr Ruf (ca. 90 % Effizienz). 1977 Guillain-Barré-Syndrom (Polyneuritis mit Lähmungen) 6/100'000 nach Impfung statt nur 1/100'000, heute Problem behoben. Die Impfung wird besonders für Leute über 65 sowie für im Gesundheitsdienst Tätige empfohlen. Im Jahre 2000 wurde ein neuer, auf Virosomen basierender Impfstoff für den Menschen eingeführt, der als Nasenspray verabreicht werden kann (Nasalflu, Berna). Allerdings trat bald nach der Einführung der Verdacht auf, dass der Impfstoff als unvorhergesehene Nebenwirkung eine einseitige, vorübergehende Gesichtslähmung (Facialisparese) auslösen könnte. Bis zur genauen Abklärung verzichtet die Firma deshalb vorderhand auf den Einsatz dieses Impfstoffes. Therapie Schwein: Ruhigstellen, viel Streu, reichlich Wasser, ev. Antibiotika, Antipyretikum, Kreislaufmittel, Expektorans. Pferd: Ruhigstellung unerlässlich, weitere Massnahmen ähnlich wie oben. Klass. Geflügelpest: keine Therapie, sondern Eradikation. Es gibt antivirale Mittel (beim Tier unwirtschaftlich): • Amantadin wirkt spezifisch gegen Influenzaviren, indem es den durch M2 gebildeten Protonenkanal blockiert. • Die kürzlich entwickelten und 1999 in der Schweiz zugelassenen Neuraminidase-Hemmer Tamiflu (Roche) und Relenza (Glaxo/Wellcome) richten sich gegen die Freisetzung von Influenza A und B Viren. Sie verkürzen die Krankheitsdauer und wirken lindernd, aber nur wenn sie innerhalb von 24 bis 36 Stunden nach Auftreten der ersten Symptome genommen werden. Vermutlich werden viele Leute die teuren Medikamente (ca. Fr. 80.-) beim erstbesten Schnupfen nehmen. Zur Zeit tragen die Krankenkassen diese Kosten nicht und empfehlen stattdessen die Impfung. Seite 82 Kapitel, Influenza, Equine Influenza Influenza equi Autoren: Monika Engels, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc Equine Influenza Virus Orthomyxoviridae, Genus: (equines) Influenza Virus A Subtyp 1: Prototyp = A / equi 1 / Prag / 56 (H7N7) Subtyp 2: Prototyp = A / equi 2 / Miami / 63 (H3N8) Besonderheiten • • • Anders als die Influenzaviren beim Menschen sind die Pferdeinfluenza Subtypen antigenetisch relativ stabil. Deshalb müssen die Impfvirusstämme nur in relativ langen Abständen angepasst werden. Die Equine Influenza wird im Unterschied zu Schweineinfluenza nicht auf den Menschen übertragen. Der Grund liegt wohl darin, dass unterschiedliche Rezeptoren benützt werden, die wohl beim Pferd, nicht aber beim Menschen vorkommen. Im Jahre 2005 wurde erstmals beschrieben, dass ein H3N8 Virus des Pferdes sich bei Rennhunden ausbreitet. Das Virus wurde anlässlich eines Ausbruchs in Florida isoliert, wo 22 Greyhounds typische Grippesymptome zeigten und 8 davon starben. Offensichtlich gelang dieser Wirtswechsel ohne vorgängige Reassortierung. Serologische Studien bezeugen eine starke Ausbreitungstendenz des neuen Virus. Vorkommen Weltweit. Subtyp 2 ist heute dominant. Es werden eine europäische und eine amerikanische Linie unterschieden. Innerhalb der Linien gibt es wiederum verschiedene Varianten. Empfänglichkeit Equiden Klinik Inkubationszeit 2-3 Tage; Nasen-, Augenausfluss; hohes Fieber; trockener Husten; Lymphknotenschwellung Pathogenese s. Influenza allg. Epidemiologie Übertragung aerogen; Ansteckungsquelle: infizierte Tiere; zur Verbreitung (ev. Epidemien!) tragen vor allem Massenveranstaltungen bei. Diagnose Nasentupferproben: Virusnachweis im embryonierten Hühnerei oder in Zellkulturen Serologie (Serumpaar): Hämagglutinationshemmtest Kontrolle Impfung: Grundimmunisierung und Booster (1-2x jährlich). ISCOM-Vakzine verfügbar mit Antigenen von Virusstämmen aus den Jahren 1977, 1979, 1991. Andere Impfstoffe Seite 83 Kapitel, Influenza, Equine Influenza verwenden Viren aus den Jahren 1956, 1963, 1989, 1993. Beipackzettel studieren!!! Vier Impfstoffe werden in Kombination mit Tatanustoxoid, einer mit EHV-1 und EHV-4 angeboten. Literatur Crawford, P.C. et al. (2005). Transmission of Equine Influenza to Dogs. Science 310, 482-485. Seite 84 Kapitel, MKS MKS Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc MKS MAUL- UND KLAUENSEUCHE MKS ist eine akute, hochkontagiöse Viruserkrankung der Wiederkäuer und der Schweine. Charakteristisch (Name) sind Aphten (Blasen) und Erosionen im Bereich der Maul- und Nasenschleimhaut und am Kronsaum. Fieber nur im Prodromalstadium. Nach Generalisierung der Aphten kein Fieber mehr, sofern keine Sekundärinfektion. MKSV weist hohe Tenazität auf in Gewebematerial. Besonderheiten Variabilität: Sieben Serotypen (O, A, C, Asia1, SAT-1, SAT2, SAT-3) mit zahlreichen Subtypen. Tenazität: Austrocknung, Kälte, hohe Salzkonzentration beeinflussen die Infektiosität nicht. Im Stallschmutz, Mist, Jauche hält sich das Virus bis 2 Wochen. In Milch und nicht erhitzten Produkten, sowie Gefrier- und Pökelfleisch bleibt es monatelang infektiös. Rasche Inaktivierung erfolgt bei pHWerten unter 6.5 (Fleischreifung! Ausnahmen: Lymphknoten, Knochenmark, Fett, Blut) und bei Temperaturen über 50 Grad. Geschichte Als erstes animales Virus identifiziert (Loeffler und Frosch, 1898). Seit Jahrhunderten gefürchteter Seuchenerreger. Waldmann (1937) entwickelte einen ersten Impfstoff gegen MKS. Dabei wurden Rinder mit MKS Virus angesteckt und nach Auftreten der Krankheitssymptome geschlachtet. Aus den Zungenepithelien wurde dann ein Formalin-inaktivierter Impfstoff produziert. Frenkel (1947) modifizierte die Virusproduktion, indem er Epithelstücke von normal geschlachteten Rindern in Kultur hielt und infizierte. 1959 wurden BHK Zellen (Hamster Nieren) als Substrat für die Virusproduktion eingeführt. In der Schweiz standen seit 1944 Waldmann Vakzinen zur Verfügung, die im Eidgenössischen Vakzine Institut in Basel produziert wurden. 1966 wurde die obligatorische Impfung des gesamten Rinderbestandes in der Schweiz eingeführt. 1991 wurde die Impfung, nach langjähriger Seuchenfreiheit und der vollständigen Elimination des Virus aus der Schweiz, verboten. Anlässlich des Seuchenzuges von 2001 in Europa, geriet diese Strategie des Nicht-Impfens in die Kritik. Seite 85 Kapitel, MKS Verbreitung Vor 2001 Weltweit (Ausnahmen: USA, Japan, Australien, Neuseeland, Grossbritannien, Irland). Je nach Region bestimmte vorherrschende Serotypen, Europa ist sporadisch mit O, A, oder C verseucht (Italien 1984-87 und 1993). Der letzte Fall in der Schweiz trat 1980 auf. Dabei handelte es sich mit grosser Wahrscheinlichkeit um einen sogenannten "Impfdurchbruch" (ungenügend inaktivierte Vakzine). Abb 1. MKS Reservoir Asien: Kaukasus, Arabien China Indien, Indochina, Philippinen Südamerika: Kolumbien, Bolivien, Ecuador, Venezuela, Brasilien, (Argentinien, Uruguay) Afrika Seit dem 23. Februar 2001 (aktuelle Info über folgenden URL: http://www.defra.gov.uk/footandmouth/) Grosser Seuchenzug in Grossbritannien (bis Mittwoch 3. Oktober 2001, 17:00, gab es 2'030 Ausbrüche in England, wobei der bislang letzte Fall am 30. September gemeldet wurde). Einschleppung des Virus in einen Schweinebetrieb, vermutlich als Folge der Verfütterung unerhitzter Küchenabfälle, welche illegal aus dem asiatischen Raum importiert worden waren. Unerkannte Verbreitung über Viehmärkte. Unbemerkte Übertragung in die Schafpopulation. Verschleppung vor allem über Schaftransporte nach Irland und Frankreich. Einschleppung in die Niederlande durch Kälber, welche aus England kamen, jedoch in Frankreich einen Quarantänestall belegten, in dem zuvor die Schafe gestanden hatten, welche die Seuche von England nach Frankreich gebracht hatten. Erreger Familie Picornaviridae, Gattung Aphtovirus. Kleinste RNA Viren, Ø 25-30 nm, unbehüllt, icosahedrale Symmetrie, 32 Kapsomeren. Infektiöse ssRNA mit positiver Polarität, nicht segmentiert, 7.2-8.4 kb. Synthese eines Polyproteins aus der genomischen RNA, proteolytische Spaltung. 4 Strukturproteine (VP1-4). Das RNA-Polymerase Protein kann VIA (virus infection-associated) Antikörper erzeugen. Seite 86 Kapitel, MKS Virusvermehrung und Genexpression Adsorption über zelluläre Rezeptoren (Integrin) mittels "loop"Struktur in VP1. Translokation durch Zellmembran mittels unbekannter Mechanismen. Der Milieuwechsel beim Eintritt ins Zytoplasma macht die Verbindungsstücke zwischen den einzelnen Virusproteinen den zellulären Proteasen zugänglich, sodass der Viruspartikel zerfällt und die RNA freigesetzt wird. Die (+)ssRNA wird von der Zelle als mRNA behandelt und in ein Polyprotein translatiert. Abb. 2. Replikation (+)ssRNA Polyprotein (-)RNA (+)RNA Viruspartikel Abb. 1. Strategie der MKSV Replikation. Die ikosahedrale Struktur des Virus wird durch 3 Strukturproteine (VP1, VP2 und VP3 gebildet. VPg bindet an die neu synthetisierte genomische RNA und wird mit in den Partikel verpackt. Durch die Spaltung von VP0 in VP2 und VP4 wird die Partikelbildung abgeschlossen. Die Freisetzung der Viren erfolgt über die Zerstörung der infizierten Zelle. Durch Zellzerstörung sind auch die Läsionen im infizierten Tier erklärbar. Abb. 3. Genexpression und Translation Seite 87 Kapitel, MKS Abb. 2. Synthese eines Polyproteins, Spaltung in finale Produkte durch virale Proteasen (Pfeile) Fehler bei der Transkription der genomischen RNA: natürliche Variabilität der MKS Viren. Epidemiologie Infizierte Tiere sind die wichtigste Ansteckungsquelle. Virusausscheidung bereits während der Inkubationszeit (2-14 Tage). Virusübertragung vor allem direkt über Speichel, Kot, Urin, Milch. Indirekte Übertragung durch Transportfahrzeuge, Personen, Schlachtprodukte etc. Auch aerogene Übertragung ist bekannt. Abb. 4. Epidemiologie Bis 200 km übers Meer Transportwege Abfälle 12-24h vor Klinik Molkerei Desinfektion Lauge, Säure, Hitze. (vgl. Besonderheiten) Pathogenese Übertragung direkt oder indirekt (extreme Kontagiosität). Aufnahme des Virus durch Inhalation. Erste Virusvermehrung im Pharynx und in den tieferen Luftwegen. Aphtenbildung an der Zunge und auf der gesamten Maulschleimhaut. Virämie und Generalisierung der Infektion. Sekundäre Läsionen hauptsächlich an den Klauen (Kronsaum, Zwischenklauenspalt), an den Pansenpfeilern, Herzmuskulatur, sowie Euterdrüsengewebe (Mastitis). Virusausscheidung in allen Sekreten und Exkreten. Insbesondere in der Milch kann Virus 12 bis 24 Stunden vor dem Auftreten erster, klinischer Symptome festgestellt werden. Nach der Überwindung der akuten Infektion wird das Virus meist völlig aus dem Organismus eliminiert. Einige Tiere können jedoch eine persistente Infektion entwickeln, wobei auch nach 2 Jahren noch mittels "Probang" Technik infektiöses Virus nachgewiesen werden kann. Seite 88 Kapitel, MKS Abb. 5. Pathogenese Infektion Erste Virusvermehrung im Pharynx, Aphtenbildung auf Zunge und Maulschleimhaut. Zelltod -> Läsionen Virämie und Sekundäre Virusvermehrung an Klauen, Pansenpfeilern, Herzmuskulatur, Euterdrüsengewebe Immunreaktion Bei MKS spielt die humorale Immunität, im Gegensatz zu vielen anderen Virusinfektionen, eine sehr wichtige, ja sogar tragende Rolle. Tatsächlich kann ein Tier durch die Gabe von neutralisierenden und opsonisierenden Antikörpern (passive Immunität) vor einer generalisierenden MKS geschützt werden. Die wichtigsten neutralisierenden Antikörper sind gegen das Rezeptorprotein VP1 gerichtet. Schutzinduzierende, opsonisierende Antikörper gelten den Kapsidproteinen VP1, 2 und 3. Aus diesen Gründen funktioniert die aktive Schutzimpfung mit inaktivierten Impfstoffen sehr gut. Moderne Impfstoffe enthalten gereinigte Viruspartikel, sodass die Antikörperproduktion auf VP1, 2 und 3 ausgerichtet ist. Bei der natürlichen Infektion entstehen nicht nur Antikörper gegen die Strukturproteine, sondern gegen alle viralen Produkte. Man kann den Nachweis von Antikörpern gegen Nicht-Struktur Proteine (z.B. VIA Antigen) deshalb ausnützen zur Unterscheidung von Antikörperbildung nach natürlicher Infektion und nach Impfung. In der Praxis kommt dem Nachweis von VIA-Antikörpern allerdings eine untergeordnete Rolle zu, weil in Europa, USA und Japan heute auf die Impfung völlig verzichtet wird. Dem Grundprinzip der Unterscheidung wird jedoch im Zusammenhang mit gentechnologischen Impfstoffen grosse Bedeutung beigemessen. Die zelluläre Immunität wird selbstverständlich bei einer akuten Infektion auch stimuliert und hilft bei der Elimination der Viren aus dem Organismus mit. Impfprophylaxe In der Schweiz ist die prophylaktische Schutzimpfung seit 1991 verboten, in der Europäischen Gemeinschaft seit 1992. Die Vakzination spielt jedoch immer noch eine wichtige Rolle in endemisch verseuchten Gebieten, sowie in Ländern, welche erst am Beginn der Tilgung von MKS stehen. Das internationale Tierseuchenamt (O.I.E.) in Paris sorgt zudem für einen randständigen Impfgürtel, der Europa vor Wiedereinschleppung von MKS aus asiatischen Ländern schützen soll. Seite 89 Kapitel, MKS Klinik Das klinische Bild kann je nach Tierart variieren: Rind: Inkubationszeit von 2 bis 5 Tagen. Zuerst hohes Fieber, Somnolenz, Inappetenz, Einbruch der Milchleistung. Wenige Stunden später kommt es zur Aphtenbildung im Maulbereich (Zunge, Lippen, Zahnfleisch, Backen) und im Klauenbereich (Kronsaum, Zwischenklauenspalt). Durch die Läsionen im Maulbereich kommt es zu Kauschwierigkeiten und starker Salivation verbunden mit typischen Schmatzgeräuschen. Die Aphten platzen nach 2 bis 3 Tagen und heilen dann rasch ab. In unkomplizierten Fällen erholen sich die Tiere wieder. Ausgedehnte Klauenläsionen können zu Abspaltungen des Hornes vom darunterliegenden Gewebe und zum Ausschuhen führen. Weitere Komplikationen durch Aphtenbildung im Pansenbereich und durch Affektion der Herzmuskulatur. Schwein: Symptome oft weniger stark ausgeprägt als beim Rind. Klauenbereich stärker als Maulbereich betroffen. Zu den typischen Symptomen gehören plötzliche akute Lahmheit und häufiges Liegen. Plötzliche Todesfälle infolge von Schädigungen der Herzmuskulatur werden öfter als beim Rind gesehen. Kleiner Wiederkäuer: Verlängerte Inkubationszeit gegenüber den anderen Tierarten (bis 21 Tage). Die Krankheit verläuft oft sehr milde. Aphtenbildung weniger ausgeprägt als beim Rind. Gliedmassenbereich stärker betroffen als Maulbereich. Mensch: In seltenen Fällen kann es zur Übertragung von MKS auf den Menschen kommen. Die Infektion verläuft jedoch auch dann äusserst milde, meist lokal begrenzt und gutartig. Selbst bei immungeschwächten Patienten sind keine Komplikationen beschrieben. Bei MKS-Verdacht stellt sich meist heraus, dass es sich um eine Infektion mit dem Enterovirus Coxsackie B5 handelt, welches beim Menschen zu MKS-ähnlicher Aphtenbildung führt. Diagnose Beim Auftreten von Blasen an Zunge, Maulschleimhaut oder Kronsaum immer an MKS denken. Akute Lahmheiten und Todesfälle beim Schwein sollten ebenfalls Anlass geben, an MKS zu denken. Für eine Untersuchung ist es wichtig die Klauen der Schweine zu waschen! Seite 90 Kapitel, MKS Abb. 6. Ausgedehnte Klauenläsionen Differentialdiagnosen Vesikulärkrankheit der Schweine (SVD), ferner: Vesikulärstomatitis, Mucosal Disease (BVDV), Katharrhalfieber (BKF), Ecthyma, IBR. Beim Menschen: Enterovirus Coxsackie B5. Bei Verdacht Institut für Viruskrankheiten und Immunprophylaxe (IVI) 031 848 9211 benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. Untersuchungsmaterial Frische Aphten, grosszügig ausgeschnitten, in sterilen Blutröhrchen so schnell wie möglich (Auto, Express) nach Absprache an das Institut für Viruskrankheiten und Immunprophylaxe, 3147 Mittelhäusern bringen. Labordiagnose Komplementbindungsreaktion, RT-PCR und ELISA erlauben Typendiagnose innert Stunden. Virusisolation in Zellkulturen dauert mehrere Tage. Seite 91 Kapitel, Nidovirales, (Corona- und Arteriviren), Equine Arteritis Nidovirales (Arteri- und Coronaviren) EAV Autorin: Monika Engels File Info: TPT22:\Vorlesung\Portrats0203.doc EAV Equine Arteritis; Pferdestaupe; Rotlaufseuche;"pink eye" Das equine Arteritis Virus (EAV) verursacht verschiedene klinische Krankheitssymptome, wobei respiratorische Symptome, Konjunktivitis ("pink eye"), Oedeme und Abort im Vordergrund stehen. Die Infektion verläuft jedoch in der Mehrheit der Fälle asymptomatisch. Besonderheiten Epidemiologie: Hengste als Langzeitausscheider und hauptsächliches Virusreservoir. Geschichte Die Krankheit ist unter verschiedenen Namen schon lange Zeit bekannt. Die Virusätiologie wurde 1953 anlässlich einer Anhäufung von Krankheitsausbrüchen in Ohio, USA, erkannt. In der Schweiz trat EAV erstmals 1964 in der EMPA und im Tierspital Bern auf. Weil zu spät an die mögliche Diagnose gedacht worden war, kam es zu einem legendären Ausbruch mit 400 erkrankten Tieren. Nach erneuten Ausbrüchen in den USA in den 80er Jahren wurden intensive Kontrollmassnahmen eingeführt. In anderen Ländern, in denen die equine Arteritis auftritt, erlangte die Infektion vorwiegend wegen Import- und Exportrestriktionen eine Bedeutung. Der letzte Krankheitsfall in der Schweiz datiert zurück auf 1994. Serologische Befunde, die im Rahmen des Equinella Programms erfasst werden, zeigen jedoch zunehmende Verbreitung des Virus in der Schweiz. Verbreitung Weltweit, jedoch mit regionalen Unterschieden. Vor allem aktuell in den USA sowie England, Spanien, Dänemark und Schweden. Bekannt u.a. in Polen, Österreich, Italien, Frankreich. In der Schweiz sind ca. 4.3% der Pferde seropositiv. In Europa scheint die Infektionsrate zuzunehmen. Deshalb wurde im August 1999 ein EU-Projekt „International control of EAV“ gestartet. Informationen dazu: http://www.eaveu.org/ Seite 92 Kapitel, Nidovirales, (Corona- und Arteriviren), Equine Arteritis Erreger Wurde früher als Genus Arterivirus der Familie Togaviridae zugeordnet. Aufgrund der Genomorganisation, Replikationsstrategie und Genexpression wurden nun die Arteriviren als Arteriviridae zusammen mit den Coronaviridae in der neugeschaffenen Ordnung Nidovirales eingeteilt. Das EAV ist behüllt, hat einen Durchmesser von 45-70 nm und besitzt eine unsegmentierte, polyadenylierte ssRNA mit positiver Polarität. Es exisitiert nur 1 Serotyp; bei verschiedenen Isolaten mit unterschiedlicher Virulenz wurden jedoch antigene und genetische Variabilitäten beobachtet. Die Tenazität von EAV ist relativ gering. Virusvermehrung Auf der genomischen RNA, Länge 12.7 kb, wurden 8 sich überlappende offene Leseraster (ORF, open reading frame) identifiziert. Bei der Vermehrung werden, so wie beim PRRS Virus, subgenomische RNAs mit gemeinsamer Leadersequenz am 5'- und poly-A-Schwanz am 3'-Ende abgeschrieben. Die 5'Seite des Genoms kodiert für die RNA Polymerase; die 3'Seite vorwiegend für Strukturproteine. Genexpression s. PRRS Epidemiologie Virusreservoir: persistent infizierte Hengste (Dauerausscheider). Empfänglich sind Pferde und Esel. Während der akuten Krankheitsphase (v.a. Fieberphase) wird das Virus mit Augen- und Nasensekret, Speichel, Urin, Kot und Sperma ausgeschieden; bei Abort: mit Fötus und Fruchtwasser. Die Ausscheidung via respiratorische Sekrete dauert ca. 16, via Urin ca. 21 Tage. Das Virus wird grundsätzlich auf zwei Wegen übertragen: aerogen oder via Deckakt (ev. KB). • Eine aerogene Übertragung kommt praktisch nur während der akuten Krankheitsphase bei engem Kontakt vor. • Übertragung via Deckakt: Infizierte Hengste scheiden Virus mit dem Sperma aus, wobei die Ausscheidungsdauer verschieden sein kann. Ein Teil der Hengste scheidet Virus nur während der Akutphase aus, mit einer Transmissionsrate von 85-100%. Andere Hengste werden zu Virusträgern, entweder als Kurzzeit- (einige Wochen) oder als Langzeit- (Monate bis Jahre) Ausscheider; die Transmissionsrate in diesen Fällen beträgt 25-50%. Aufgrund experimenteller Infektionen wird angenommen, dass 30-60% der Hengste zu Virusträgern werden können. Die Viren persistieren v.a. in Samenvesikeln, Samenleiter und Prostata und sind nicht Spermien-assoziiert. Während der Viruspersistenz können Virusvarianten gebildet werden, deren Einfluss auf die Epidemiologie jedoch noch nicht geklärt ist. Seite 93 Kapitel, Nidovirales, (Corona- und Arteriviren), Equine Arteritis Pathogenese Eintrittspforte: oberer Respirationstrakt Abort Makrophagen Oedeme Gefässepithel (Media) Gefässendothelien Muskel, Organe, Plazenta Lunge (24 hpi) Lymphknoten (2 dpi) Lymphoretikuläres Gewebe (4 dpi) Eintrittspforten sind der obere Respirations- bzw. der Genitaltrakt. Respirationstrakt: Infektion von Makrophagen; mit diesen Transport in die Lunge (innert 24 Std. p.i.), in die regionären Lymphknoten (innert 2 Tagen) und danach ins gesamte lymphoretikuläre Gewebe (innert 4 Tagen p.i.). Genitaltrakt: Genauer Ablauf unbekannt, Art der Virusverbreitung im Organismus jedoch wie oben. Eigentliche Zielorgane sind die Gefässendothelien in Muskeln und verschiedenen Organen (abhängig vom Virusstamm). Folge: entzündliche Infiltrationen der Arterienwände; später auch Infektion der Tunica media; Oedeme infolge Gefässschädigung. Abort: Bedingt durch Gefässschädigungen in Plazenta (Oedeme im Endometrium und Nekrosen im Myometrium; Ablösung der Plazenta. Klinik Inkubationszeit 3 - 4 Tage. Symptome einzeln oder in Kombination: Fieber (bis 4l°C). Anorexie, Apathie. Konjunktivitis ("pink eye"), Tränenfluss, ev. Photophobie, Rhinitis; Oedeme, v.a. an Gliedmassen, perioder suborbital, Präputium, Skrotum. Bei Fohlen ev. akute Pneumonie oder Pneumoenteritis. Abort (3.-10. Trächtigkeitsmonat) oft ohne andere Symptome 2 - 4 Wochen p.i. Die Fertilität bleibt bei Stuten ungestört; bei Hengsten kann sich nach Primärinfektion eine transiente Verschlechterung der Samenqualität einstellen. Bei Ruhigstellen erholen sich die erkrankten Tiere spontan innert 1-2 Wochen. Eventuell symptomatische Therapie mit entzündungshemmenden und diuretischen Mitteln. Seite 94 Kapitel, Nidovirales, (Corona- und Arteriviren), Equine Arteritis Immunreaktion Die Infektion induziert einen guten, vermutlich lebenslänglichen Immunschutz. Zu Beginn werden allerdings hauptsächlich nicht neutralisierende Antikörper gebildet. Neutralisierende Antikörper erscheinen erst einige Wochen p.i. und sind vorwiegend gegen das Hüllenglykoprotein GL gerichtet. Fohlen: Schutz durch maternale Antikörper in ersten Lebensmonaten. Prophylaxe Am wichtigsten ist die Expositionsprophylaxe, insbesondere in Gestüten (z.B. Zucht nur mit seronegativen Hengsten). In den USA, in England und in Irland werden Lebend- bzw. inaktivierte Impfstoffe mit relativ gutem Erfolg eingesetzt. Diagnose Verdacht aufgrund der Klinik. Bestätigung durch Labordiagnose. Differentialdiagnose Oedeme: infektiöse Anämie Abort: EHV-1, Bakterien-, Pilzinfektionen Bei Verdacht Einsenden von Untersuchungsmaterial; Untersuchungslabor: Institut für Veterinär-Virologie der Vetsuisse Fakultät Bern 031 631 2505. Untersuchungsmaterial Zum Virusnachweis: bei akuter Erkrankung Nasentupfer, Rachentupfer, EDTA-Blut; bei Abort: Plazenta und fötale Organe. Zum Antikörpernachweis: Vollblut oder Serum. Labordiagnose Virusnachweis: Virusisolierung in Zellkultur. Antikörpernachweis: Serumneutralisationstest; für Diagnose allerdings nur bedingt brauchbar wegen des späten Auftretens von neutralisierenden Antikörpern. Seite 95 Kapitel, Nidovirales, (Corona- und Arteriviren), EVD EVD Autoren: Alfred Metzler, Mathias Ackermann File Info: nw8000:\Vorlesung \Portrats0405.doc EVD Epizootische Virusdiarrhoe Akut verlaufende, virusbedingte Gastroenteritis bei Ferkeln und älteren (Mast-) Schweinen. Besonderheiten Vermehrung in Zellkulturen besonders schwierig. Neuerdings AK gegen EVDV in Katzenseren gefunden. Geschichte Erstmals 1971 in Grossbritannien festgestellt. Auffallend war und ist, dass Ferkel im Alter von weniger als 4-5 Wochen nicht erkrankten ≠ TGE. Heute weltweite Verbreitung. 1988 gelang es erstmals das EVD Virus in Zellkultur zu vermehren (Hofmann und Wyler). Es dauerte dennoch bis 2001 bis die gesamte Genomsequenz bestimmt war (Kocherhans et al.). Bedeutung CH Zusammenhang zwischen Seroprävalenz des Virus und Klinik nur unvollständig geklärt. In 3'000 untersuchten Beständen fanden sich 48 (1.6%) seropositive Tiere. EVDV eher Kofaktor im Zusammenwirken mit enteropathogenen E. coli. Erreger EVDV ist ein typisches Coronavirus. Einheitlicher Serotyp, der serologisch von anderen Coronaviren klar abgrenzbar ist (vgl. TGE). Engste Verwandtschaft mit dem humanen Coronavirus HCV229E. Virusvermehrung wie TGEV Epidemiologie wie TGE Desinfektion wie TGE Pathogenese wie TGE Klinik Mit einer geringen Ausnahme wie TGE. Enterozyten älterer Tiere scheinen für EVDV empfänglicher als jene bei Ferkeln. Immunreaktion wie TGE Impfprophylaxe Zur Zeit kein Impfstoff verfügbar Therapie Verfütterung von geeignetem Kolostrum Pathologie wie TGE Seite 96 Kapitel, Nidovirales, (Corona- und Arteriviren), EVD Diagnose Analog wie bei TGE unter Verwendung virusspezifischer monoklonaler Antikörper für den Antigennachweis. Virusisolierung in Zellkulturen schwierig. RT-PCR. Indirekter Virusnachweis (ELISA, IF) unter Verwendung eines Zellkultur-adaptierten Virusstammes. Differentialdiagnosen siehe TGE Bei Verdacht siehe TGE Untersuchungsmaterial Caudales Jejunum, Ileum für Immunhistochemie, Kot für ELISA Labordiagnose Immunhistochemie, Antigen-ELISA, RT-PCR. Staatliche Massnahmen Keine Literatur Hofmann, M. & Wyler, R. (1988). Propagation of the virus of porcine epidemic diarrhea in cell culture. J Clin Microbiol 26, 2235-9. Kocherhans, R., Bridgen, A., Ackermann, M. & Tobler, K. (2001). Completion of the porcine epidemic diarrhoea coronavirus (PEDV) genome sequence. Virus Genes 23, 137-44. Seite 97 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS FIP Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc FIP Feline Infektiöse Peritonitis FIP ist eine chronische, progressive, meist fatal verlaufende immunbedingte Erkrankung der Felidae, die durch ein Coronavirus hervorgerufen wird. Im typischen Fall ist eine markante Umfangsvermehrung des Bauches, einhergehend mit zunehmender Apathie und Verwahrlosung der Katze charakteristisch. Besonderheiten Erreger: Unterscheidung von enteralen Coronaviren und FIP Viren. Pathogenese: Krankheitsform stark von Immunitätslage abhängig. Negative Auswirkungen der humoralen Immunität. Vermehrte Infektion von Makrophagen, wenn Antikörper gegen virale Oberflächenstrukturen vorhanden sind (ADE = antbody-dependent enhancement of FIPV infection of macrophages). Diagnostik: Zur Zeit gibt es keinen FIP Test, der in vivo zuverlässige Resultate liefert . Impfstoffe: Zur Zeit existieren keine wirksamen Impfstoffe zur Prävention von FIP. Geschichte Das Krankheitsbild der FIP wurde erstmals 1963 (Holzworth) und 1966 (Wolfe und Griesemer) exakt beschrieben und man zweifelt, ob die Krankheit vor den 1950er Jahren überhaupt existierte. Mitte der 1970er Jahre stellte sich heraus, dass die FIP durch ein Coronavirus verursacht wurde. Erst gegen Ende der 1970er Jahre (Pedersen, 1976) konnte das Virus in vitro gezüchtet und als Krankheitserreger weiter übertragen werden. Damit wurde erst ein ernsthaftes Studium der Pathogenese möglich. Noch immer sind viele unbekannte Faktoren bei der Entstehung und Epidemiologie der FIP im Spiel. In den Jahren 1998 und 1999 ergaben sich neue Erkenntnisse zur Pathogenese, welche die alten Vorstellungen zum Teil als falsch entlarvten. Verbreitung Weltweit mit regionalen und saisonalen Unterschieden. Erreger Coronavirus der Antigengruppe I. Details siehe TGE. Feline enterale Coronaviren (FeCV) sind antigenetisch von den FIP Viren (FIPV) nicht unterscheidbar. Seite 98 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Virusvermehrung und Genexpression siehe TGE. FeCV vermehren sich vorwiegend lokal in den enteralen Epithelzellen sowie in den entsprechenden regionalen Lymphknoten. Mittels RT-PCR kann das Genom der FeCV jedoch auch im Blut gefunden werden. FIPV verursacht eine systemische Infektion und vermehrt sich in Monozyten und Makrophagen. Epidemiologie Viele Unklarheiten. Sporadisches Auftreten bei Einzeltieren mit familiärer Häufung. Man nimmt heute an, dass durch Mutationen im Wirtstier aus enteralen Coronaviren die FIP Viren entstehen. Virusreservoir sind wahrscheinlich gesund erscheinende, persistent infizierte Katzen, möglicherweise aber auch andere Tierarten (Hund, Schwein, Wildfeliden?). Vertikale und horizontale Übertragung nachgewiesen. Desinfektion siehe TGE Pathogenese Es bestehen noch sehr viele Unklarheiten. Im klassischen Fall geschieht die Infektion über den Nasen/Rachenraum. Die Viren vermehren sich zunächst in den Epithelzellen des Pharynx, in respiratorischen oder enteralen Epithelzellen, sowie in den entsprechenden, regionalen Lymphknoten. Mit der Infektion von Monozyten und Makrophagen kommt es zu einer Virämie, wobei das Virus zu seinen Zielorganen (Leber, Peritonäum, Pleura, Uvea, Meningen, Ependymzellen des Gehirns und des Rückenmarks) verschleppt wird. Ein entsprechend abgekürzter Weg wird beschritten, wenn die Infektion parenteral oder in utero erfolgt. Viele Faktoren beeinflussen den weiteren Infektionsverlauf. Eine wichtige Rolle spielt das Immunssystem. Ausgeprägte zelluläre Immunität übt einen günstigen, humorale Antikörperbildung einen ungünstigen Einfluss aus: •Parenterale Aufnahme •In utero •Viruselimination •Latenz •Reaktivierung Orale Aufnahme Intestinales Epithel Fäkale Ausscheidung Regionale Lymphknoten Immunantwort Dissemination mit Phagozyten Stark (H+Z): Keine Krankheit H+++;Z+/-: Trockene FIP H+++;Z-: Klassische FIP H = humorale Immunität Z = zelluläre Immunität Seite 99 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Die Tatsache, dass seropositive Tiere fulminanter erkranken als Tiere ohne Antikörper gegen Coronaviren, verursacht bei oberflächlicher Betrachtung Unverständnis. Die Theorie der ADE (antibody-dependent enhancement) gibt zwar eine vernünftig klingende Erklärung für dieses Phänomen, wird heute aber nicht mehr als zentral erachtet: Durch Opsonisierung von Oberflächenantigenen werden die FIP Viren effizient in Monozyten und Makrophagen aufgenommen. Anstatt dass die Viren in den infizierten Zellen vernichtet werden, kommt es sogar zur Virusvermehrung und die Zellen werden ihrerseits geschädigt und abgetötet. Da es sich bei den Makrophagen und Monozyten um wichtige Komponenten des Immunsystems handelt, tragen bei FIP die Antikörper indirekt zur Schwächung der Immunabwehr bei. Infolgedessen sieht der Tierarzt ein fulminanteres Krankheitsbild, wenn lediglich Antikörper gegen virale Oberflächenstrukturen da sind, als wenn überhaupt keine Immunantwort vorliegt. Die fruchtlose Immunantwort schädigt den Organismus noch weiter durch Bildung und Ablagerung von Immunkomplexen, zum Beispiel in der Niere. Seit Ende der 90er Jahre geht man davon aus, dass eine persistente Infektion mit enteralen Coronaviren eine essentielle Voraussetzung für FIP ist. Es bestehen Anhaltspunkte für immunologische Toleranz. Mutationen und Rekombinationen sind dann entscheidend für die Evolution von echten FIP-Viren aus den enteralen Coronaviren. Seite 100 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Immunreaktion Das Immunsystem ist sowohl an der Krankheitsentstehung als auch an der Überwindung der Infektion und am Schutz vor einer Neuinfektion beteiligt. Als Faustregel kann man annehmen, dass Schutz vor Krankheit mit der Stärke der zellulären Immunität korreliert, während die humorale Immunität eher zu den krankmachenden Faktoren zählt. Während Schutzinduktion stark stammspezifisch zu sein scheint, ist die Induktion des ADE-Phänomens auch mit nahe verwandten Viren, z.B. enteralen felinen Coronaviren oder TGE möglich. Neben Antikörpern und zytotoxischen T-Zellen spielen auch Komplement und Immunkomplexe eine wichtige Rolle bei der Entstehung, bzw. der Verhinderung der Krankheit. Gleichzeitig vorliegende Infektionen mit anderen Viren, z.B. FeLV oder FIV, können die Immunreaktion ebenfalls modulieren und damit den Krankheitsverlauf mitbestimmen. Impfprophylaxe Seit 1994 ist ein mlv Impfstoffe verfügbar. Wirksamkeit? Klinik Man unterscheidet neben der klassischen FIP (nasse oder effusive Form) eine sogenannte trockene (nicht efffusive) und eine gemischte Form. Alle Formen können auch nach langen Inkubationszeiten (3 - 4 Monate bis mehrere Jahre) auftreten. Obwohl das Alter von FIP-Katzen variieren kann, sind meist jüngere Tiere betroffen (jünger als 12 Monate>jünger als 4 Jahre>ältere Tiere). Epidemiologische Abklärungen sind deshalb besonders schwierig. Klassische FIP: Apathie, hohes Fieber, stark dilatiertes Abdomen, struppiges Fell. Die Punktion der Bauchhöhle ergibt eine geruchlose, gelbe, visköse Flüssigkeit, die sich meist als zellarmes Exsudat präsentiert. In etwa einem Drittel der Fälle ist der Pleuralraum mitbetroffen, nur selten jedoch ZNS und Augen. Krankheitsdauer 1 bis 6 Wochen. Letalität 100%. Trockene FIP: Vielfältige und inkonstante Symptomatik. Oft keine abnormale Umfangsvermehrung des Abdomens. Häufige Frühsymptome sind Inappetenz, Apathie, Abmagerung, sowie chronisches, fluktuierendes, therapieresistentes Fieber. ZNS und Augen in etwa der Hälfte der Fälle mitbetroffen. Krankheit schleppt sich oft wochenlang (bis 12 Wochen) dahin, endet aber praktisch immer tödlich. Gemischte Form: Alle Abstufungen zwischen klassischer und trockener Form denkbar. Seite 101 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Diagnose Histologische Untersuchung einer Biopsieprobe mit Antigennachweis unter Berücksichtigung der Anamnese, der klinischen Symptome und der Labortests. Falls der Antigennachweis negativ verläuft, besteht immer noch eine Unsicherheit, weil unter Umständen die Probe aus einem antigenfreien Bezirk einer FIP-erkrankten Katze stammt (Sensitivität des Tests). Der Antikörpernachweis ist sehr problematisch, da Anti-FIPV-Antikörper auch bei Infektion mit FeCV entstehen (Spezifität des Tests). Klassische FIP kann eher leicht diagnostiziert werden, während die Diagnose der trockenen FIP intra vitam sehr schwierig zu stellen ist. Differentialdiagnosen Chylothorax, Pyothorax, Tumore, Herzinsuffizienz, Hypoproteinämie, Leberzirrhose, Zwerchfellshernie, bakterielle Peritonitis, Pansteatitis (Entzündung der Fettgewebe). Bei der nicht effusiven FIP-Form spielt das Lymphom/Lymphosarkom die wichtigste differentialdiagnostische Rolle. Bei Beteiligung der Augen am Krankheitsbild muss zusätzlich an Toxoplasmose, Mykosen oder Lymphosarkom gedacht werden. Bei Verdacht Sorgfältige Erhebung der Anamnese und der klinischen Parameter. Hämatologische Untersuchung (Lc: Leukozytose und/oder Lymphopenie? Ec: Normochrome normozytäre Anämie mit erniedrigten Werten von Ec, Hk, Hb und normalen Werten von MCHC und MCV; Fibrinogen: erhöht; Plasmaprotein: erhöht). Klinische Chemie: (Hyperbilirubinämie; erhöhte Werte von AP und GOT, Serumlipase, Serumamylase. Totalprotein im Serum erhöht bei gleichzeitiger Erniedrigung der Albuminwerte und Zunahme der Globulinwerte). Bauchhöhlen- und/oder Brusthöhlenpunktion. Eventuell Probelaparatomie mit Entnahme einer Biopsieprobe. Virologische und serologische Abklärungen. Ausschluss anderer Krankheitsursachen. Untersuchungsmaterial Intra vitam: Punktat, eventuell Biopsieprobe (unter Sichtkontrolle während explorativer Laparotomie zu entnehmen). EDTA-Blut, sowie Serum für hämatologische, klinischchemische, virologische und serologische Untersuchungen. Post mortem: Ganze Katze für pathologische und histopathologische Untersuchungen. Labordiagnose Nachweis der viralen RNA mittels RT-PCR (Taqman). Antigennachweis mittels Immunfluoreszenz. Antikörperbestimmung mit Vorsicht interpretieren. Seite 102 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS PRRS Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc PRRS PORCINE RESPIRATORY AND REPRODUCTIVE SYNDROME (Syn.: Seuchenhafter Spätabort der Schweine; Mystery Swine Disease; Porcine Epidemic Abortion and Respiratory Syndrome, PEARS) Hochansteckende, akut und chronisch verlaufende, grippeähnliche Virusinfektion der Schweine, mit schweren (transienten?) Folgen für die Reproduktionsleistung in Zuchtbetrieben. Charakteristisch ist ein vorübergehendes Fieber und Beeinträchtigung der Atmung (interstitielle Pneumonie). Kurzzeitig können cyanotische Veränderungen an Bauch, Extremitäten und Ohren auftreten. In Zuchtbetrieben treten in der akuten Phase in bis zu 50% der Würfe erhöhte Verluste auf; durch Aborte in der letzten Trächtigkeitswoche, Früh- oder Spätgeburten mit toten (normal, mazeriert oder mummifiziert) oder lebensschwachen Ferkeln. Die Absetzrate ist daher deutlich vermindert. (Mast) Ferkel zeigen deutliche Atembeschwerden und verminderte Mastleistung. Besonderheiten Hohe Kontagiosität; neue Impfstoffe Komponente des "porcine dermatitis and nephropathy syndrome" (PDNS)(siehe Porträt CIRCOCIRCO) Infos auf dem Internet: http://www.prrs.com Geschichte "Neue" Virusinfektion, erstmals 1987 in USA, 1990 in Europa aufgetreten. Verbreitung USA (unter dem Namen "Mystery Disease" seit 1987). Kommt in den meisten europäischen Ländern vor. Enzootisch in UK und Malta. Sporadisch in Oesterreich, Dänemark, Frankreich, Deutschland, Niederlande, Spanien. Vorkommen gemeldet aus Belgien, Griechenland, Italien, Luxemburg, Polen. Im Zusammenhang mit illegalen Importen von Schweinen aus Frankreich kam es 1997 zum Erstenmal zu einem Nachweis von PRRS in der Schweiz. Nach der Ausmerzung der betroffenen zwei Betriebe gilt die Schweiz weiterhin als frei von PRRS. Es werden trotz hoher Seroprävalenz kaum mehr Krankheitsausbrüche aus der EU gemeldet. Seite 103 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Erreger PRRSV ist dem Genus Arterivirus innerhalb der Familie Arteriviridae zugeordnet. Aufgrund der Eigenschaften des Genoms und der Virusreplikation erfolgte gegen Ende der 1990iger Jahre die Aussonderung der Arteriviren (inklusive PRRS) aus den Togaviridae und die Zuordnung zur Ordnung Nidovirales. Struktur: Kleines bis mittelgrosses RNA Virus, Ø 45-65 nm, behüllt, ikosahedrale Symmetrie. ssRNA mit positiver Polarität, nicht segmentiert, circa 15 kb. Virusvermehrung Erreger lässt sich ausserhalb des Organismus nur in (Alveolar)Makrophagen von 6 bis 10 Wochen alten Schweinen vermehren. Nur wenige Details sind zur Zeit bekannt. Auf der genomischen RNA wurden 7 sich überlappende Leseraster (ORF, open reading frame) beschrieben. Bei der Vermehrung werden von der genomischen RNA mindestens 6 subgenomische RNAs abgeschrieben, welche (ähnlich wie die Coronaviren) ein gemeinsames 3'-Ende mit einem poly-ASchwanz aufweisen. Auch am 5'-Ende weisen alle RNAs eine gemeinsame Sequenz, die "leader"-Sequenz auf. Jeweils das erste ORF auf jeder positiv orientierten RNA wird in ein einziges Protein translatiert. Genexpression Im Unterschied zu "echten" Togaviren wird also das Genom des Erregers von PRRS nicht zuerst als Polyprotein translatiert, das dann wiederum proteolytisch gespalten wird. Vielmehr erfolgt die Genexpression ähnlich wie bei den Coronaviren. PRRSV Gene und Genprodukte a) Genom ORF4 Frame1 Polymerase ORF3 Membranprotein Frame2 Frame3 b) RNAs 5' "leader" ORF2 ORF5 Nucleocapsid 3' Poly-A Wie stark die einzelnen subgenomischen RNAs exprimiert werden, hängt mit von der Struktur derjenigen Sequenzen ab, an die der "leader" bindet. Details sind noch nicht bekannt. Seite 104 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Epidemiologie Hauptverbreitung über Tierverkehr. Lokale Verbreitung (max. 3 km) unter günstigen atmosphärischen Bedingungen mit Wind möglich. Die Übertragung durch den Samen, Fleisch, Fahrzeuge soll keine Rolle spielen. Desinfektion Relativ geringe Tenazität, Desinfektionsmittel mit Detergentien wirksam. Erfolgreich eingesetzt wurden zum Beispiel "Vircon S" (Mischung aus Peroxyd, organischen Säuren und Lösungsmitteln), sowie "Farm fluid S" (bestehend aus organischen Säuren, Detergentien und Bioziden). Beide Mittel werden von Antec International, Sudbury, Suffolk, U.K. vermarktet. Pathogenese Die Übertragung kann direkt erfolgen oder auch über Aerosol geschehen. Auch transplazentare Infektion wurde schon beschrieben. Bei experimentellen Infektionen konnte das Virus ab dem zweiten Tag p.i. bis zwei Monate p.i. aus Lungengewebe isoliert werden. Virale Antigene wurden in den Epithelzellen der Bronchien, den Alveolarzellen, sowie in den Milzzellen gefunden. Immunreaktion Die meisten Tiere entwickeln eine belastbare Immunität nach der Überwindung der Infektion. Weil das Virus noch lange nach der Abheilung in den betroffenen Beständen gefunden wird, vermutet man, dass sich bei einigen Tieren eine persistente Infektion entwickeln kann. Genaueres ist noch nicht bekannt. Impfprophylaxe In der Schweiz nicht verfügbar. Es wurden sowohl inaktivierte, wie auch mlv Impfstoffe entwickelt. Für die inaktivierte Vakzine werden PRRSV auf primären Alveolarmakrophagen vermehrt. Dieser Impfstoff hat weder bezüglich Wirksamkeit noch bezüglich Sicherheit (extraenous agents) einen guten Ruf. Von der mlv Vakzine wurden im ersten Jahr 16 Millionen Dosen allein in den USA verkauft. In Europa erfolgt der Einsatz zurückhaltender, weil PRRS eine anzeigepflichtige Seuche darstellt. Deshalb wird abgewägt, ob sich eher die Impfung oder die Eradikation lohnt. Klinik Bei jungen Tieren treten bereits zwei Tage nach Kontakt mit infizierten Schweinen Krankheitssymptome auf; bei älteren Tieren erst nach 4 bis 7 Tagen. Von Tier zu Tier und von Hof zu Hof werden unterschiedliche Symptome festgestellt. Primäre Krankheitszeichen sind grippeartig, mit Fieber, Fressunlust, blaue (haemorrhagische) Extremitäten. Sekundär stellt man erhöhte Mortalität infolge von Pneumonie fest. Erst später werden die Folgen der intrauterinen Infektionen bemerkt. Zwei bis sieben Wochen nach der Infektion treten Aborte, Totgeburten, Frühgeburten und Umrauschen auf. Manchmal sieht man auch Mummifikationen, Anoestrus, lebensschwache Ferkel. Seite 105 Kapitel, Nidovirales (Corona- und Arteriviren), PRRS Verdacht, Diagnose Wenn zwei der drei folgenden Kriterien erfüllt und andere Abortursachen (KSP, ASP, Aujeszky, Brucellose, Leptospirose) ausgeschlossen sind, handelt es sich mit grosser Wahrscheinlichkeit um PRRS: 1) Totgeburten >20%. 2) Aborte und Frühgeburten >8%. 3) Mortalität bei Saugferkeln >25%. Heute Reproduktionsproblematik im Hintergrund gegenüber Respirationsproblemen. Differentialdiagnosen Andere Abortursachen (siehe Verdacht), Respirationserkrankungen anderer Genese. Folgende Infektionen sollten unbedingt ausgeschlossen werden: Aujeskzy, Schweinepest (ASP und KSP), Influenza, EMC, Leptospiren. Bei Verdacht Kontakt mit Institut für Viruskrankheiten und Immunprophylaxe (IVI) 031 848 9211 aufnehmen, wegen Materialeinsendung. Kantonstierarzt benachrichtigen. Untersuchungsmaterial Infizierte Gewebe. Weisungen der Untersuchungsstelle. Labordiagnose Antigennachweis aus Blut- und Körperflüssigkeit von lebensschwachen bzw. frischtoten Ferkeln in Zellkultur und mit PCR. Antikörpernachweis im Serum zwei Wochen nach Infektion (Doppelproben! Serokonversion). Über die Hälfte der Tiere serokonvertieren im Bestand, d.h. fünf Proben aus einer epidemiologischen Einheit genügen. Information http://www.thepigsite.com Seite 106 Kapitel, Nidovirales (Corona- und Arteriviren), SARS SARS Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0304.doc SARS Severe acute respiratory syndrome Schwere und akute Erkrankung des Respirationstrakts beim Menschen mit relativ hoher Letalität. Verursacht von einem im Winter 2002/03 neu aufgetretenen Coronavirus. Besonderheiten Neues Coronavirus, welches nicht klar von einem bisher charakterisierten Virus abstammt. Natürliches Reservoir in asiatischen Wildtieren, möglicherweise u.A. in der Zibetkatze und in Fledermäusen. Es wird vermutet, die Infektion sei über den Konsum von Fleisch dieser Tiere auf den Menschen übertragen worden. In China werden beide Tierarten auf Märkten zum Verkauf angeboten. Geschichte SARS als Krankheit trat erstmals im Herbst 2002 in der südchinesischen Provinz Guangdong auf. Die neue Infektion wurde zunächst nicht als solche erkannt und eingedämmt. Deshalb konnte sie sich im Laufe des Winters unerkannt ausbreiten. Erst am 11. Februar 2003 wurde die Weltgesundheitsorganisation (WHO) eingehend informiert und konnte eine bislang beispiellose Campagne gegen diese Infektionskrankheit eröffnen. Aufgrund dieser Anstrengungen wurde SARS im Laufe des Sommers 2003 als besiegt, bzw. "unter Kontrolle" erklärt. Verbreitung SARS breitete sich über die ganze Welt aus und erfasste bis zum 15. August 2003 alle sechs Kontinente und 31 Länder. Am stärksten betroffen war China, gefolgt von Hong Kong, Singapore und Kanada. Es wurde eine Gesamtzahl von 8'422 Fällen erfasst. 916 Patienten, also über 10% (case fatality rate 11%), starben an dieser Krankheit. Erreger Nach heutigen Erkenntnissen wird SARS von einem "neuen" Coronavirus verursacht. "Neu" heisst in diesm Fall "neu entdeckt", nicht "neu entstanden", wobei die beiden Begriffe auch ineinander übergehen können, weil sich ein "neues" Virus natürlich an seinen neuen Wirt anpasst und innerhalb weniger Passagen auf genetischer Ebene verändern kann. Seite 107 Kapitel, Nidovirales (Corona- und Arteriviren), SARS Obwohl das Genom des SARS Coronavirus extrem schnell sequenziert werden konnte, ist die Einteilung des Virus bis heute umstritten. Aufgrund der Aminosäure Sequenz des SGlykoproteins passt das Virus am ehesten in die Gruppe II der Coronaviren. Demgegenüber fehlt dem Virus ein Gen für die Hämagluttinin Esterase (HE), welches die Gruppe II charakterisiert. Aufgrund der Reihenfolge seiner Gene auf der RNA könnte man das SARS Coronavirus in die Gruppe III einteilen. Andererseits fehlt diesbezüglich antigenetische Verwandtschaft. Die Di- und Trinukleotid Sequenzanalyse schliesslich, welche die genomische Verwandtschaft in ihrer Gesamtheit betrachtet, gruppiert das SARS Coronavirus in die nächste Nähe zum TGE Virus und den anderen Viren der Gruppe I. Bemerkenswert ist zudem eine serologische Verwandtschaft zu den Gruppe I Coronaviren. Abbildung (Tobler, 2003). Verwandtschaft der verschiedenen Coronaviren gemäss Di-Nukleotid Analyse. Die Abstände korrelieren mit dem relativen Verwandtschaftsgrad. 229E: humanes Coronavirus 229E; EVDV: Virus der Epizootischen Virusdiarrhoe des Schweins; IBV: infektiöses Bronchitis Virus des Geflügels; MHV: Maushepatitis Virus. Virusvermehrung und Genexpression Epidemiologie Siehe TGE. Reservoir in Fledermäusen (Chinese Horseshoe Bat) und Zibetkatzen. Direkte und indirekte Übertragung. Als Hauptgrund für die rasche Verbreitung ist die zögerliche Haltung der chinesischen Behörden und der Flugreiseverkehr anzusehen. Dabei verschleppten Patienten in der Inkubationszeit die Infektion über den ganzen Globus. Seite 108 Kapitel, Nidovirales (Corona- und Arteriviren), SARS Bilder: links Horseshoe Bat; rechts Zibetkatze. Desinfektion Siehe TGE. Pathogenese Noch nicht vollständig geklärt. Immunreaktion Antikörper entwickeln sich offensichtlich langsam. Patienten sind häufig bis 28 Tage nach der Infektion seronegativ. Ob der Erkrankung auch eine immunpathologische Komponente zugrunde liegt ist bislang nicht genau geklärt (siehe FIP). Impfprophylaxe Impfstoffe stehen noch nicht zur Verfügung. Klinik Es handelt sich um eine Erkrankung des Respirationstrakts. Inzwischen werden 3 klinische Formen unterschieden: Asymptomatische oder milde Form. Mittelgradige Form: Körpertemperatur über 38°C sowie eines oder mehrere folgender Symptome: Husten, Atemnot, Schweratmigkeit, Sauerstoffmangel. Schwere Form: zusätzlich zu Symptomen der Mittelgradigen Form: radiologischer Nachweis einer Pneumonie oder Nachweis einer Pneumonie unbekannter Genese anlässlich der Autopsie. Es herrschen Anzeichen von Lungenentzündung vor. Pathologie Seite 109 Kapitel, Nidovirales (Corona- und Arteriviren), SARS Abbildung (Kziasek, 2003). Makrophagen überwuchern das Lungengewebe. Infizierte Zellen verschmelzen zu vielkernigen Synzytien. Diagnose Zur Diagnosestellung werden sowohl klinische als auch epidemiologische und labortechnische Daten (siehe unten) herangezogen. Klinik (wie oben beschrieben) plus zusätzlich: • Reise innerhalb der letzten 10 Tage vor Ausbruch der Krankheit in ein von SARS betroffenes Gebiet (insbesondere China, Hong Kong, Hanoi, Singapore, Toronto, Taiwan). • Enger Kontakt innerhalb der letzten 10 Tage mit einer Person, die an SARS erkrankt war. Die klinische Diagnostik im Verdachstsfall umfasst zudem die Erhebung der Körpertemperatur, Puls, Sauerstoffmessung, Röntgen des Brustkorbes, Gramfärbung von Sputum, bakteriologische Kultivierung von Sputumproben, virologische Untersuchung auf Influenza A und B sowie Respiratorisches Syncytialvirus (RSV). Labordiagnose Bestätigter Fall: • Nachweis von Antikörpern gegen das SARS Coronavirus oder • Nachweis von SARS Coronavirus RNA mittels RTPCR, bestätigt in zwei unabhängigen Tests unter Verwendung separater Proben oder • Isolation des SARS Coronavirus in Zellkultur Negativer Fall: Keine Antikörper gegen das SARS Coronavirus im Serum eines rekonvaleszenten Patienten, mindestens 28 Tage nach Beginn der Krankheit. Seite 110 Kapitel, Nidovirales (Corona- und Arteriviren), SARS Differentialdiagnose Alle Krankheiten des Respriationstraktes anderer Genese, insbesondere bakterieller oder viraler Natur (Influenza, RSV). Untersuchungsmaterial Proben vom Respirationstrakt (immer beide Nasenlöcher beproben): • Katheter in Nase einführen und spülen mit 2-3 ml physiologischer Kochsalzlösung. Waschflüssigkeit in einem sterilen Röhrchen auffangen sowie • Sterilen Tupfer in die Nase einführen und ein paar Sekunden liegen lassen sowie • Mit sterilem Tupfer in die Mundhöhle fahren ohne die Zunge zu berühren. Ein paar Sekunden im Bereich des Pharynx und der Mandeln liegen lassen. Tupfer steril verpacken und nach Absprache mit dem Bundesamt für Gesundheit (BAG, 031 323 8706; http://www.bag.admin.ch) an ein Diagnostiklabor einsenden. Normale Bakteriologietupfer oder Wattestäbchen auf Holz NICHT verwenden (Störung der RT-PCR durch Zusatzstoffe). Bekämpfung Das Bekämpfungskonzept basiert auf Expositionsprophylaxe und Diagnostik sowie weltweiter Koordination durch die WHO. Literatur und Links Tobler et al., 2003. SARS, mögliche Zoonose im Spannungsfeld tierpathogener Coronaviren. Schweiz. Arch. Tierheilk. 145, 316-322. Ksiazek et al., 2003. A novel coronavirus associated with severe acute respiratory syndrome, N. Engl. J. Med. 2003. Li, W. et al., 2005. Bats are natural reservoirs of SARS-like Coronaviruses. Science 310, 676-679. http://www.who.int/csr/sars http://www.cdc.gov/ncidod/sars Seite 111 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE TGE Autoren: Alfred Metzler, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc TGE Transmissible Gastroenteritis Akut verlaufende, virusbedingte Gastroenteritis bei Saugferkeln, die in neu infizierten Beständen mit hoher Morbidität und Letalität einhergeht. Besonderheiten Das Virus der Transmissiblen Gastroenteritis (TGEV) ist enteropathogen. Eine apathogene Deletionsmutante, Porcines Respiratorisches Coronavirus (PRCV), zeigt Prädilektion für den Respirationstrakt. Geschichte Die TGE wurde 1946 erstmals in den USA festgestellt und als eigenständige Viruserkrankung beschrieben. In infizierten Beständen können die Verluste enorm sein. Um 1985 trat in Europa eine nahezu apathogene Virusmutante in Erscheinung (PRCV), die durch folgende Charakteristika gekennzeichnet ist: Prädilektion für den Atemtrakt und wirksame aerogene Ausbreitung. Antigenetisch/serologisch fast identisch mit TGEV. Dies bewirkt einerseits im Feld eine gewisse Immunität gegenüber TGEV, andererseits ist mit dem Auftreten von PRCV die seroepidemiologische Kontrolle von TGE viel schwieriger geworden. Dies wirkt sich nachteilig auf den Handel aus, da häufig "frei von TGE" gefordert wird. Verbreitung Weltweit . In der Schweiz bisher nur zwei isolierte TGEAusbrüche (1985). PRCV ist demgegenüber auch bei uns weit verbreitet. Prävalenz seropositiver Tiere rund 75%. Erreger TGEV ist ein typischer Vertreter der Familie Coronaviridae. Seite 112 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE S M E (HE) Lipid Bilayer N RNA Abb. 1. Schema eines Coronavirus. Nomenklatur der viralen Proteine: S = Surface glycoprotein; M = Membranprotein; E = Envelope protein; N = Nucleoprotein. CAVE: HE = Hämagglutinin-Esterase kommt nur bei Coronaviren der Gruppe II vor. Behüllt, pleomorph, 80-160 nm messende Virionen (Abb. 1). Die Hülle enthält charakteristische Protrusionen, sogenannte Spikes oder Peplomeren in Form eines Multimers aus dem Virus-spezifischen Glykoprotein S. Dieses bildet die Grundeinheit der Peplomeren und vermittelt die Virusadsorption. N - Protein steht in direktem Kontakt mit dem viralen Genom und sorgt für den helikalen Aufbau. Cryoelektronenmikroskopische Studien postulieren neuerdings auch einen icosahedralen Aufbau der Coronaviren. Die Funktionen von M und E sind noch nicht genau bekannt. Die meisten Coronaviren der Antigengruppe II (siehe Tab. 1) verfügen zusätzlich noch über eine Hämagglutinin-Esterase (HE-Protein). Die einzelsträngige, 27 - 30 kb umfassende (riesig!) RNA hat positive Polarität, d.h. die Nukleinsäure ist infektiös -> (+)ssRNA. Seite 113 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Tabelle 1 Antigengruppe I II (mit HE) III Virus/Wirt Organspezifität HCV 229E/Mensch TGEV/Schwein PRCV/Schwein EVDV/Schwein CCV/Hund FeCV/Katze FIPV/Katze Respirationstrakt Darm Lunge Darm Darm Darm Lunge, Leber, ZNS, Gelenke, u.a. SARS-CV/Mensch* Respirationstrakt HCV OC42/Mensch Darm MCV/Maus Lunge, Darm, Leber, ZNS RCV/Ratte Lunge HEV/Schwein Darm, ZNS BCV/Rind Darm, Lunge** TCV/Truthahn*** Lunge, Darm IBV/Huhn Bursa fabricii HCV = Humanes Coronavirus; TGEV = Transmissibles Gastroenteritis Virus; PRCV = Porcines Respiratorisches Coronavirus; EVDV = Epizootisches (Epidemisches) Virusdiarrhoe Virus; CCV = Canines Coronavirus; FeCV = Felines enterales Coronavirus; FIPV = Felines Infektiöses Peritonitis Virus; MCV = Maus Coronavirus; RCV = Ratten Coronavirus; HEV = Hämagglutinierendes Enzephalomyelitis Virus; BCV = Bovines Coronavirus; IBV = Infektiöses Bursitis Virus; TCV = Truthahn Coronavirus. *Eineilung noch nicht definitiv in Gruppe I. **BCV kann auch aus der Lunge isoliert werden. ***aufgrund von Nukleinsäure Analysen wird TCV (früher Gruppe IV) heute der Antigengruppe II zugeordnet, obwohl keine serologische Verwandtschaft besteht. Coronaviren verhalten sich nicht immer streng wirtsspezifisch, d.h. das Wirtsspektrum kann mehrere Tierarten umfassen. Die Viren zeigen eine spezifische Prädilektion für einzelne oder mehrere Organe. Auf Grund der Antigenität unterscheidet man 3 (früher 4) eigenständige Serogruppen (Tab. 1). Beim TGEV kommt nur ein Serotyp vor. Das PRCV, eine Virusmutante, unterscheidet sich von TGEV durch einen Antigenverlust auf S, der bei TGEV mit einem einzelnen, nicht neutralisierenden monoklonalen Antikörper erfasst werden kann. Seite 114 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Virusvermehrung und Genexpression Die Virusvermehrung erfolgt ausschliesslich im Zytoplasma. (Abb. 2) 1. Das Virus adsorbiert vermittels Protein S an die Wirtszelle. 2. Protein S induziert weiter die Penetration des Virus in die Wirtszelle Merke: Antikörper gegen S können das Virus neutralisieren, d.h. sie verhindern die Adsorption und/oder die Penetration. 3. Im Zellinnern erfolgt die Bildung eines primären Translationsproduktes. Dieses ist eine Polymerase und an der nachfolgenden RNA-Replikation sowie an der Synthese von mRNA beteiligt. 4. Bildung eines (-)ssRNA-Stranges und Synthese von subgenomischer (mRNA) und genomischer RNA. Alle (+)RNA-Stränge besitzen sowohl eine identische 5'Leadersequenz, als auch gleiche 3'-Enden. 5. Translation der mRNA an ER-ständigen (M und S werden kotranslational glykosyliert), bzw. an freien Ribosomen (nicht glykosylierte Proteine). Bildung von (+)ssRNA. Replikat ion und Genexpression D:\ Vi_ port r\ Coro_ Rep.PRS Abb. 2. Schema der Virusvermehrung 6. Nukleokapside sprossen an Membranen des ER dort, wo die Glykoproteine M und S eingelagert sind. 7. Die noch unreifen, nicht infektiösen Viruspartikel gelangen vom ER in den Golgi-Apparat, wo die sog. sekundäre Glykosylierung stattfindet, die vorwiegend bei den Coronaviren der Antigengruppe II nachgewiesen wurde. Schliesslich sprossen vom Golgi-Apparat virushaltige Vesikel, die nach Fusion mit der Zellmembran die reifen Virionen entlassen. Das auf der Zelloberfläche in Erscheinung tretende Glykoprotein S ist für die in Zellkulturen bei vielen Coronaviren zu beobachtende Synzytienbildung, d.h. die Bildung mehrkerniger Riesenzellen verantwortlich. Die Strategie der Virusvermehrung ist in Abb. 3 nochmals stark vereinfacht dargestellt. Seite 115 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE (+)ssRNA Polymeraseprotein(e) (-)RNA (+)RNA aus: mRNA genomische RNA sekundäre Translationsprodukte Viruspartikel Abb. 3. Strategie der Virusvermehrung Epidemiologie TGEV-Infektionen werden durch Virusträger, die inapparent Viren ausscheiden, aufrechterhalten und in andere Bestände verschleppt. Keine transplazentare Übertragung. Vor dem Auftreten von PRCV konnte die Einschleppung von TGEV wirksam verhindert werden, wenn man nur seronegative Tiere aus TGE-freien Beständen zukaufte. Akut infizierte Schweine scheiden das Virus während rund 2 Wochen, in Einzelfällen bis zu 8 Wochen mit dem Kot aus. Der Virusnachweis gelingt oft über Tage auch im Lungengewebe. Wahrscheinlich ist PRCV aus einer Subpopulation von TGEV entstanden, die sich im Lungengewebe vermehren kann. Bei laktierenden Tieren findet sich das Virus auch in der Milch. TGE tritt vornehmlich im Winterhalbjahr auf. Eine Temperatur-abhängige Erhöhung der Virustenazität wird als möglicher Grund angesehen. Einzelne Beobachtungen deuten darauf hin, dass TGEV durch Vögel passiv verschleppt werden kann. Hunde, Katzen und Füchse werden als mögliches Virusreservoir diskutiert. Experimentell können die genannten Spezies mit TGEV infiziert werden. Dabei scheiden die subklinisch infizierten Tiere das Virus während Wochen mit den Faezes aus. Die praktische Bedeutung dieser Beobachtung ist unklar. Desinfektion Bei Raumtemperatur ist TGEV, wie bei Coronaviren üblich, relativ stabil. Bei 37°C beobachtet man innerhalb von 24 Std. eine Titerreduktion um den Faktor 10. In gefrorenem Zustand behält das Virus seine Infektiosität mehr als ein Jahr lang. Die rein thermische Inaktivierung wirkt sich unterhalb von 45°C auf die Nukleinsäure, oberhalb von 45°C zusätzlich auf die strukturelle Integrität aus. Sonnenlicht entfaltet eine starke viruzide Wirkung. Lipidlösungsmittel sind potente Virusinaktivatoren. Seite 116 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Die meisten Stämme von TGEV werden durch Trypsin nur unwesentlich beeinträchtigt. Auch niedrige pH-Werte (>3) werden gut ertragen. Diese Eigenschaften begünstigen die Magenpassage und den Transport im Dünndarm. Für die chemische Desinfektion eignen sich NaOCl (Natrium Hypochlorit, Chavel), NaOH, Formaldehyd (inkl. Dämpfe), Iod, Phenol- und Phenolderivate sowie quaternäre Ammoniumverbindungen. Pathogenese TGEV gelangt auf fäkal-oralem Weg in den Körper und wird abgeschluckt. Der aerogen möglichen Infektion mit TGEV kommt im Gegensatz zu PRCV eine untergeordnete Bedeutung zu. Wenn das Virus dem im Magen und Dünndarm herrschenden Milieu (pH-Wert, Proteasen, Gallensalze) widersteht, wird es schliesslich an Enterozyten des Dünndarmes adsorbieren. Entsprechend lässt sich folgern, dass TGEV v.a. für neugeborene Ferkel eine Gefährdung darstellt. Die Infektion kulminiert in einem Maladsorptionssyndrom, das durch einen massiven Verlust an Enterozyten, und damit einhergehend, eine Zottenatrophie gekennzeichnet ist. Beim ungeschützten Ferkel tritt der Tod als Folge von Dehydratation, metabolischer Azidose sowie einer induzierten Hyperkaliämie ein. Virus-infizierte Enterozyten lassen sich fluoreszenzserologisch oder immunhistochemisch nachweisen. Im akuten Krankheitsfall ist praktisch der gesamte Dünndarm von Enterozytenverlust und Zottenatrophie betroffen. Die durch das Virus zerstörten Enterozyten werden relativ schnell durch proliferierende Zellen aus den Darmkrypten ersetzt. Dieser Vorgang verläuft bei älteren Tieren schneller als bei jüngeren. Die Regenerationszellen sind jedoch zunächst metabolisch wenig aktiv, sodass der Maladsorption nicht entgegengewirkt wird. Indessen sind diese Zellen vorerst wenig empfänglich für das Virus, sodass bei älteren Tieren eine gewisse Resistenzentwicklung resultieren dürfte. Der Schweregrad der Krankheit wird durch verschiedene Faktoren beeinflusst. Hierzu gehören Zinkmangel, Anämie, niedrige Umgebungstemperatur oder Infektionen mit anderen Infektionserregern. Der wichtigste Faktor ist jedoch das Fehlen oder Vorhandensein einer laktogenen Immunität, welche die Ferkel bis zum Absetzen wirksam zu schützen vermag. Seite 117 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Immunreaktion A k t i v e I m m u n i t ä t . Eine belastbare Immunität setzt die Ausbildung einer lokalen Darmimmunität voraus. Diese kommt dann zustande, wenn das Virus (Feld- oder Impfvirus) im Darm eine Vermehrung erfährt. Das wirksame Prinzip sind sekretorische Immunglobuline (IgA), wobei auch zelluläre Immunmechanismen zum Tragen kommen (Details unklar). Die komplikationslose Genesung geht mit einer prompt einsetzenden Immunantwort einher. Nach einer akuten Darminfektion treten auch Serum-IgA auf. Nur bedingt jedoch nach parenteralen Impfungen. Der Nachweis von IgA im Serum kann demzufolge diagnostisch ausgewertet werden. Nach natürlicher Infektion ist die Dauer der belastbaren Immunität relativ kurz (6 - 18 Monate). In verseuchten Beständen kommt es immer wieder zu Reinfektionen, so dass der Antigenstimulus (Booster-Effekt) aufrechterhalten bleibt. l a k t o g e n e I m m u n i t ä t . Muttersauen, die 3-5 Wochen ante partum eine TGE durchmachen, weisen nachfolgend in der Milch hohe Titer von IgA- (und IgG-) gegen TGEV auf. Diese gewährleisten beim Saugferkel eine kolostrale/laktogene Immunität. Für einen wirksamen Schutz ist notwendig, dass die Ferkel mehrmals täglich antikörperhaltige Milch aufnehmen können. Der Ursprung der auffallend hohen Antikörpertiter in der Milch ist damit zu erklären, dass im Darm sensibilisierte B-Lymphozyten über den Kreislauf in die Milchdrüsen gelangen. Impfprophylaxe Kommerziell erhältliche Lebendimpfstoffe vermögen nicht zu befriedigen. Infektion mit PRCV induziert experimentell zwar keine zuverlässsige Darmimmunität gegen TGEV, es zeigt sich aber im Feld, dass mit dem Aufkommen von PRCV die Anzahl und der Schweregrad der TGE Ausbrüche stark zurückgegangen ist. In stark betroffenen Ländern ohne staatliche Bekämpfung der TGE werden neu infizierte Bestände mittels "Notimpfung" (-infektion) trächtiger Sauen ca. 4-5 Wochen ante partum durch Verfütterung virushaltiger Därme oder Exkremente geschützt. Ziel dieser pragmatischen Massnahme ist eine laktogene Immunisierung der Ferkel. Klinik Die Inkubationszeit beträgt zwischen 18 Stunden und 3 Tagen. Der Schweregrad der Krankheit, deren Dauer und die Letalität nehmen mit zunehmendem Alter ab. Bei ungeschützten neugeborenen Ferkeln erreicht die Mortalität annähernd 100%. Bei mehr als 3 Wochen alten Ferkeln nur vereinzelte Abgänge, ausser es wirken zusätzliche Noxen (Kälte, Zweitinfektionen). Die Symptomatik umfasst vorübergehendes Erbrechen und nachfolgende Diarrhoe (wässriger, gelblich gefärbter Kot). In der Folge treten Dehydratation und Gewichtsverlust sowie zunehmend Schwäche auf. Der Geruch von Kot und Erbrochenem soll charakteristisch für TGE sein. Tod tritt nach 2-7 Tagen ein. Seite 118 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Bei älteren, ungeschützten Tieren (Absatzferkel, Masttiere, Elterntiere) verzeichnet man Inappetenz, kurzdauernden Durchfall, selten Erbrechen. In neu infizierten Beständen hat man vereinzelt auch Abgänge bei älteren Tieren beobachtet (Fieber, Erbrechen, Durchfall, Inappetenz, Agalaktie). Pathologie Dehydratation, Abmagerung und makroskopisch erkennbare Magen- und Darmdilatation sind nicht pathognostisch. Im Magen häufig unverdaute, geronnene Milch. Im Dünndarm grünlich-gelbe, schaumige Flüssigkeit. In den Nieren fallweise degenerative Veränderungen sowie Ureat-Ablagerung im Nierenbecken. Histologisch ist das Bild durch EnterozytenVerlust, d.h. Zottenatrophie gekennzeichnet. Da beispielsweise Rotaviren gleiche Veränderungen hervorrufen, ist dies nicht pathognostisch. Diagnose Beim Auftreten von ansteckenden, schweren Diarrhoen mit hoher Verlustrate bei Ferkeln an TGE denken. Differentialdiagnosen Andere infektiöse Diarrhoen, z.B. enteropathogene E. coli, EVDV, Rotaviren, Kokzidien. Bei Verdacht Institut für Veterinärpathologie ( 044 635 8584) oder Virologisches Institut ( 044 635 8716), Vetsuisse Fakultät, Universität Zürich, benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. Untersuchungsmaterial Nach Absprache. Labordiagnose Direkter Virusnachweis. (Immun-) Elektronenmikroskopie, Antigennachweis in Enterozyten mit Hilfe der Immunfluoreszenz oder Immunperoxidase-Technik (nur frisches Material von probegeschlachteten, akut erkrankten Tieren geeignet). Virusisolierung in Schweinezellkulturen und nachfolgende Viruscharakterisierung mit Hilfe spezifischer Antiseren; Hybridisation mit markierten Gensonden grundsätzlich möglich; RT-PCR. Für die Vermehrung von TGEV eignen sich verschiedene Schweine-Zellkulturen: Niere, Schilddrüse sowie die permanente Hoden-Zellinie ST. In ST-Zellen induziert TGEV einen deutlichen zytopathischen Effekt. Bei den übrigen Zellen bedarf es hierfür mehrerer Zellkultur-Passagen (Adaptierung). Seite 119 Kapitel, Nidovirales, (Corona- und Arteriviren), TGE Indirekter Virusnachweis. Nachweis einer Serokonversion, bzw. eines signifikanten Anstiegs der Serumantikörper. Bei Jungtieren verwischen allenfalls vorhandene maternale Antikörper das serologische Bild. Bei der Diagnose von TGE darf zudem nicht vergessen werden, dass sich PRCV serologisch fast wie TGE verhält und dass beim Schwein Infektionen mit Felinen- oder Caninen Coronaviren grundsätzlich möglich sind (experimentell bestätigt, unter Praxisverhältnissen jedoch nicht beobachtet). TGEV und PRCV unterscheiden sich in einem auf S lokalisierten Epitop, das nur bei TGE vorkommt und dessen Deletion wahrscheinlich eine Rolle bei der Entstehung von PRCV gespielt hat. Möglichkeit zur Differenzierung mit kompetitivem ELISA. Bekämpfung Da die TGE dazu neigt, endemische Formen anzunehmen, würde man in der Schweiz bei einem akuten Krankheitsausbruch die betroffenen Bestände mit Vorteil sperren und ausmerzen. Diese Massnahme wird gegebenenfalls durch den Kantonstierarzt veranlasst. Seite 120 Kapitel, Papilloma, Warzenviren Papilloma Autoren: Martin Schwyzer und Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405b.doc Papilloma Warzenviren Papillomaviren erzeugen Warzen und gutartige Epitheltumore bei Mensch, Rind, Pferd, Hund und anderen Spezies. Einige Typen von Papillomaviren können in Zusammenwirkung mit Kofaktoren Karzinome hervorrufen. Besonderheiten Spezifität: Jede Tierart hat ihre eigenen Papillomaviren. Die Speziesbarriere wird meist nicht überschritten (Ausnahme: bovine Papillomaviren -> Pferd). Variabilität: z. B. sechs verschiedene Typen boviner und über 100 Typen humaner Papillomaviren. Eindringen: durch kleine Hautläsionen, nicht intakte Haut. Molekularbiologie: kleines, zirkuläres Genom, Induktion der Zellteilung Geschichte Warzen wurden schon im Altertum unter den Namen ficus (Feige), verruca (Hügel) u. a. beschrieben. Probate Mittel, um sich von Warzen zu befreien, wurden seit jeher empfohlen. Neben Einreiben mit Kuhmist etc. war die "Weitergabe" der Warzen an belebte oder unbelebte Objekte populär. So empfiehlt der Philosoph Francis Bacon (1561-1626), eine Speckseite auf die Warzen zu legen, sie nachher einige Wochen an die Sonne zu hängen, bis das Fett geschmolzen sei, dann seien auch die Warzen weg. Die infektiöse Natur der Warzen wurde 1907 durch Ciuffo erstmals nachgewiesen. In den 1930iger Jahren konnte Shope deren Übertragbarkeit belegen. 1997 wurden die modernen Regeln zur Klassifikation der Papillomaviren eingeführt. Erreger Die Papillomaviren waren früher zusammen mit den Polyomaviren in der Familie Papovaviridae zusammengefasst. Aufgrund von Genomanalysen bilden sie heute eigene Familien Papillomaviridae und Polyomaviridae. Letztere Familie ist veterinärmedizinisch wenig bedeutend, spielt jedoch eine grosse Rolle in der experimentellen Tumorforschung (Polyomaviren bei Mäusen, Wellensittichen und Rindern sowie das Affenvirus SV40). Seite 121 Kapitel, Papilloma, Warzenviren Papillomaviren bestehen aus einem unbehüllten ikosahedralen Kapsid (55 nm Ø, 60 Hexone und 12 Pentone mit 2 verschiedenen Virion-Proteinen) sowie einem zirkulären, doppelsträngigen DNA Genom von 6.7 kb (BPV3) bis 8.2 kb (canines PV) Länge. Im Unterschied zu den Polyomaviren laufen bei den Papillomaviren alle Gene in die gleiche Ableserichtung. Von vielen Papillomaviren sind vollständige Nukleotidsequenzen bekannt, als erste diejenige von BPV1 (7945 bp). Typen BPV1, BPV2 Rind Warzen (kutanes Fibropapillom) BPV1, BPV2 BPV3 BPV4 BPV5, BHV6 equines PV Pferd Rind Rind Rind Pferd humane PV Mensch HPV6 & 11 HPV16, 18, 31, 33, 39 Sarcoid (subkutanes Fibrosarkom) flache Warzen Papillom im Verdauungstrakt Zitzenpapillom kleine Warzen, meist um Lippen, Nüstern nahezu 100 Typen, z. B. benigne Condylome (Genitalwarzen) Korrelation mit Karzinomen Virusvermehrung und Genexpression Warzen sind vermutlich meist klonalen Ursprungs, d. h. ein Papillomavirus infiziert eine einzelne Basalzelle und regt sie zu fortwährenden Teilungen an. Das Virusgenom wird darin als Episom (replikationsfähige zirkuläre DNA) mitvermehrt. Erst in den nach oben dringenden, verhornenden, nicht mehr teilungsfähigen Zellen findet Virusproduktion statt. Wegen der funktionellen Trennung von Infektion und Virusproduktion konnten Papillomaviren bis anhin nicht in Zellkultur vermehrt werden. (Abbildung 1, links) Nach dem Uncoating gelangt die Virus-DNA in den Kern, wo sie in einer frühen und einer späten Phase transkribiert wird. Die frühe RNA kodiert für 6 bis 8 Nichtstrukturproteine, mit E1-E8 benannt, wovon E1 und E7 die Replikation des Virusgenoms steuern (optimale Anzahl Episomen pro Zelle), E2 die virale Transkription, während E5 und E6 die Zellteilung stimulieren. Die späte RNA kodiert für die beiden VirionProteine L1 und L2. (Abbildung 1, rechts) Seite 122 Kapitel, Papilloma, Warzenviren Abbildung 1. Schematische Darstellung des Genoms (rechts) und der Zellreifungs-abhängigen Genexpression (links) von Papillomavirus. Pathogenese Nach Infektion einer einzelnen Basalzelle (s.o.) Zellproliferation, Bildung verhornender Zellhaufen. Benignes Wachstum weil Zellschichtung erhalten bleibt, keine Metastasen (nur Weiterinfektion). Klinik Rinder: Papillomatose kann bei allen Altersstufen vorkommen, jedoch gehäuft bei Jungtieren (6 Monate - 2 Jahre). Stellen mit viel Abrasion und Kontakt zu anderen Tieren sind vorwiegend betroffen, z. B. Kopf, Hals, Schulter, Gelenkbeugen, Unterbauch, Genitalien, Zitzen. Kleine grauschwarze Knoten bis grosse blumenkohlartige Gebilde, oft verhornt. Grosse Papillome können aufreissen und bluten. Pferde: Warzen infolge EPV regredieren meist innert einiger Monate. Sarkoide infolge BPV1 oder BPV2 metastasieren nicht, aber sind invasiv und müssen operativ entfernt werden (oft mehrmals). Hunde: beginnt meist auf den Lippen, kann sich ausbreiten (Mundschleimhaut, Zunge, Gaumen, Pharynx). Oft spontane Regression, manchmal Operation oder Euthanasie nötig. 2004/05 wurden erstmals neue Papillomaviren beim Hund in Zusammenhang mit verschiedenen Formen von squamösem Zellkarzinom (SCC) entdeckt (Abbildung 2). Seite 123 Kapitel, Papilloma, Warzenviren Abbildung 2. Mit Papillomaviren assoziiertes invasives squamöses Zellkarzinom (SCC) beim Hund. (Bild: C. Favrot, Universität Zürich, 2004). Immunreaktion Antikörper werden meist gebildet aber ihr Vorhandensein korreliert kaum mit Regression. Epidemiologie Übertragung durch direkten Kontakt oder durch kontaminierte Halfter, Gerätschaften, Pfosten wo sich die Tiere reiben etc. Verbreitung weltweit Diagnose Das klinische Bild ist so klar, dass sich eine Labordiagnose i. a. erübrigt. Typisierung kann mit PCR erfolgen. Nachweis von Papillomaviren bei SCC mittels sogenannter broad-range PCR, welche ein weites Spektrum von Papillomaviren erfasst. Desinfektion wie für andere unbehüllte Viren z. B. MKS. Die Papillomaviren verfügen jedoch über eine erhebliche Tenazität. Prophylaxe Hygiene ist die beste Prophylaxe. Autologe Vakzinen werden vielenorts empfohlen, für ihre Wirksamkeit gibt es aber wenig Evidenz. Therapie Warten auf Selbstheilung (Regression). Versuch der Entfernung durch ätzende Mittel (z. B. Salicylsäure). Operative Entfernung. Herstellung einer inaktivierten Autovakzine aus Warzengewebe. Seite 124 Kapitel, Papilloma, Warzenviren Literatur Ciuffo, G.: Innesto positivo con filtrato di verruca volgare. Giorn. Ital. Mal. Vernereol., 1907, 48: 12-17. Shope, R.E.: Infectious papillomatosis of rabbits (with a note on the histopathology by E.W. Hurst). J. Exp. Med., 1933, 58: 607-624. De Villiers, E.M.: Papillomavirus and HPV typing. Clin. Dermatol., 1997, 15: 199-206. Zaugg, N., Nespecca, G., Hauser, B., Ackermann, M., Favrot, C.: Detection of novel papillomaviruses in canine mucosal, cutaneous, and in situ squamous cell carcinomas. (Zur Publikation eingereicht 2005) Seite 125 Kapitel, CPV und FePV Parvovirosen der Fleischfresser Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc CPV, FePV Parvovirosen der Fleischfresser Das Krankheitsbild der Parvovirosen der Fleischfresser kann am besten mit dem Bild der Strahlenkrankheit verglichen werden. Charakteristisch sind alle Anzeichen von Immunsuppression zusammen mit enteralen Symptomen, wie Erbrechen, Durchfall, Kolik. Im Gegensatz dazu verursachen die porcinen Parvoviren hauptsächlich Fruchttod (Mumien). Besonderheiten Extrem hohe Tenazität. Ausserhalb des Wirtes bleiben die Viren monate- bis jahrelang infektiös. Resistent gegen Hitze (bis 80°C), Säure, Chloroform, Trypsin, sowie gegen die meisten Desinfektionsmittel. Geschichte Die feline Panleukopenie (Felines Parvovirus, FePV; Virus der Katzenseuche) stellt eine der bedeutendsten Virusinfektionen der Katze dar und wurde schon um die Jahrhundertwende beschrieben (Zschokke, 1900). Im Gegensatz dazu trat die Parvovirose der Hunde (Canines Parvovirus, CPV) erst 1976/77 auf und verbreitete sich mit rasender Geschwindigkeit über alle Länder und Kontinente. Ähnliches gilt auch für die Ausbreitung des Nerz-Parvovirus (MEV), das erstmals 1947 beobachtet wurde. FePV, MEV und CPV sind serologisch nahe verwandt. CPV ist aus einem anderen Parvovirus hervorgegangen, vermutlich aber nicht aus FePV, sondern eher vom Parvovirus des Rotfuchses. Die Parvoviren der Fleischfresser verfügen über ein relativ breites Wirtsspektrum und können deshalb auch für nicht-domestizierte Fleischfresser ein Gefahrenpotential darstellen. Verbreitung Weltweit. Regelmässig Fälle in der Schweiz. Grosse Probleme in Hunde- und Katzenzuchten, sowie Tierheimen und sammelstellen. Seite 126 Kapitel, CPV und FePV Erreger Kleines DNA Virus, Familie Parvoviridae, Genus Parvovirus. Das Parvovirus der Katze (felines Parvovirus) wird als FePV bezeichnet; dasjenige der Hunde (canines Parvovirus) als CPV; jenes der Nerze (engl. "mink parvovirus") als MPV. Ø 18-22 nm, unbehüllt, ikosahedrale Symmetrie (Abbildung 1). ssDNA (meistens negative Polarität), circa 5 kb mit palindromischen Sequenzen an den Genomenden, nicht segmentiert. Das Genom enthält zwei offene Leseraster (ORF, open reading frame). Das eine kodiert für virale Enzyme zur Transkription und DNA-Replikation, das andere für die Kapsidproteine, die überlappende Aminosäure Sequenzen besitzen. Abbildung 1. Tsao et al., 1991, Science, 251, 14561464. Virusvermehrung Nicht alle Zellen sind für die Replikation der Parvoviren empfänglich und permissiv. Adsorption über neuraminsäurehaltige, zelluläre Rezeptoren. Wie das Genom dann in den Zellkern gelangt ist bislang sehr schlecht dokumentiert. Eine Virusvermehrung erfolgt nur in empfänglichen Zellen, welche die S-Phase des Zellzyklus durchlaufen. Es wird zur Zeit angenommen, dass die Überführung des einsträngigen viralen Genoms in eine ds DNA die Voraussetzung für die mRNA-Transkription ist. Die DNA-Synthese geht dabei von einem Self-PrimingMechanismus an den Palindromstrukturen aus und verläuft über die Bildung eines an einem Ende kovalent geschlossenen DNA-Moleküls. Als Replikations-Zwischenstufe treten auch konkatemere Strukturen auf. Aus diesen Zwischenformen werden schliesslich mit Hilfe der Nichtstrukturproteine die reifen einzelsträngigen Genomeinheiten generiert. Genexpression Aus dem sogenannten "linken" ORF (rep) entstehen durch Spleissen die mRNAs für Nichtstrukturproteine (blau). Der rechte ORF (cap) kodiert für drei Strukturproteine (rot). VP1 und VP2 (Hauptprotein) sind dabei bis auf die Aminoenden identisch. VP3 geht möglicherweise erst im fertigen Kapsid durch proteolytische Spaltung aus VP2 hervor. Seite 127 Kapitel, CPV und FePV Abbildung 2. Genomorganisation und Genexpression. (Bildquelle: C. Fraefel, Universität Zürich) Epidemiologie Obwohl CPV, FePV und MEV antigenetisch sehr nahe verwandt sind, infizieren die einzelnen Virusstämme vornehmlich entweder Tiere der Familie Canidae oder aber der Familie Felidae. Wirtswechsel kommen sporadisch vor, wie das plötzliche Auftreten der MEV und der CPV Pandemie vermuten lassen. CPV entstand vermutlich um 1970 herum und machte danach einige wichtige evolutionäre Änderungen durch. In der Mitte der 70iger Jahre entstand CPV Typ 2 (CPV-2), welches die erste Pandemie verursachte. Daraus entwickelten sich die Subtypen CPV-2a und CPV2b. Diese Subtypen verdrängten das ursprüngliche CPV-2, wohl weil sie besser an den neuen Wirt angepasst waren. Diese beiden Subtypen können sich zudem sowohl in Hunden, wie auch in Katzen vermehren. Die Virusausscheidung erfolgt in erster Linie mit dem Kot während der akuten Phase der Infektion. Infolge der aussergewöhnlichen Resistenz der Parvoviren gegenüber Umwelteinflüssen muss auch mit erfolgreicher indirekter Übertragung gerechnet werden. Auch persistent infizierte Tiere, die chronisch oder periodisch Virus ausscheiden, sind beschrieben worden. Abbildung 2. Llamas-Saiz et al., Virology 225, 1996 Abbildung 3. Überlagerung der Elektronendichte und Atommodelle von CPV-Alabama (rot) und der davon abgeleiteten Ala300 ->Asp (A->D) Mutante CPV-d (blau). Die Punktmutation verursacht eine Konformationsänderung in der Bogenstruktur (loop) der einen Untereinheit durch die Bildung einer Salzbrücke zwischen Asp300 (D300) mit dem Arg81 einer benachbarten Untereinheit. Diese Mutation ist für eine Änderung der Wirtsspezifität verantwortlich. Seite 128 Kapitel, CPV und FePV Desinfektion Sehr schwierig; Umgebung, Zwinger, Schlafstätten miteinbeziehen. 3-5%ige Formalinlösungen, 2% Natronlauge, 0.175% Na-Hypochlorit, Holzteile verbrennen. Pathogenese Infolge der hohen Tenazität der Parvoviren ist ein direkter Kontakt für die Übertragung nicht notwendig. FePV und CPV werden während der akuten Infektion, sowie noch lange Zeit danach mit dem Kot ausgeschieden. Auch chronische Virusausscheidung asymptomatischer Träger über Kot und Oropharynx wird beschrieben. Die Virusaufnahme erfolgt in der Regel oral. Die primär betroffenen Zellen sind nicht bekannt. Die Virusvermehrung beschränkt sich jedoch auf mitotisch aktive Zellen (S-Phase). Deshalb ist unter anderem das Alter des Wirtstieres für den weiteren Verlauf der Infektion entscheidend. Hauptsächlich betroffen sind Zellen des Immunsystems, Darmepithelien, sowie Zellen des Myokards bei Föten und neugeborenen Hundewelpen und Zellen des Cerebellums und der Retina bei Katzenföten und neugeborenen Katzen. Bei der Vermehrung in Lymphozyten kommt es zu einer starken Virämie, wobei das Virus im ganzen Organismus verteilt wird. Die Replikation in den Krypten der Darmepithelien erfolgt erst in einer zweiten Phase. Virus kann bereits ab dem dritten Tag der Infektion mit dem Kot ausgeschieden werden. Die Krankheitssymptome sind erklärbar durch die Vernichtung der Zielzellen durch die Virusreplikation, z.B. Darmepithelzellen, Myokardzellen, Zellen des Kleinhirns, sowie von B- und T-Lymphozyten. Abbildung 4. Kleinhirnatrophie (links) infolge pränataler Infektion mit FePV. Vergleich mit einem normalen Kleinhirn (rechts). (Bildquelle: Prof. Ehrensperger, Veterinärpathologie, Universität Zürich) Seite 129 Kapitel, CPV und FePV Klinik Es werden akute und subakute Krankheitsformen, sowie inapparente Infektionen unterschieden. Katze: Perakute Form bei jungen Kätzchen, oft mit Vergiftungen verwechselt. Akuter Verlauf charakterisiert durch Kolik, Depression, Anorexie, Erbrechen, Diarrhoe. Tod innerhalb weniger Tage infolge Dehydratation. Subakuter Verlauf mit milderen Symptomen und anhaltendem Durchfall. Bei intrauteriner Infektion tritt zuweilen eine Kleinhirnatrophie auf, welche zu charakteristischen Ausfallserscheinungen mit Bewegungsstörungen bei neugeborenen Kätzchen führt. Hund: Krankheitsbild ähnlich wie bei der Katze. Bei der Infektion frischgeborener Welpen, deren Mütter keine antiParvovirus Antikörper mit dem Kolostrum übermitteln, tritt zuweilen eine Myokardform der Krankheit auf. Es kommt dabei zu Dyspnoe, Schreien und Erbrechen, sowie zu plötzlichen Todesfällen. Besonders gefährdet sind Welpen bis zum Alter von etwa 8 Wochen. Später geht die DNA Synthese Tätigkeit zurück und es erfolgen immer seltener Mitosen in den Myokardzellen. Abbildung 5. Junger Hund mit Parvovirose. Immunreaktion Unglaublich rasches Auftreten von Antikörpern im Gefolge der Infektion. Auch in offensichtlich immunologisch naiven Tieren werden Antikörper so schnell synthetisiert, dass man unwillkürlich eher an eine anamnestische als an eine primäre Immunreaktion denkt. Die Antikörper spielen eine wichtige Rolle bei der Überwindung der Infektion. Passive Immunisierung gewährt Schutz und der Schutz ist abhängig vom Antikörpertiter. Über die Rolle der zellulären Immunität ist wenig bekannt. Seite 130 Kapitel, CPV und FePV Impfprophylaxe Nachdem zunächst nur mlv Vakzinen verfügbar waren, wurden in der Schweiz lange Zeit nur noch inaktivierte Impfstoffe zugelassen. Aufgrund der "Rotfuchs-Hypothese" wurden erneut mlv Impfstoffe gegen CPV registriert. Insbesondere bei inaktivierten Impfstoffen ist eine mehrfache Impfung zur Grundimmunisierung notwendig. Problematik der maternalen Antikörper, die den Aufbau eines Impfschutzes stören können. Diagnose Bei Enteritiden der Fleischfresser muss grundsätzlich an eine Parvovirusinfektion gedacht werden. Plötzliche Todesfälle (Myokarditis) bei Hundewelpen und Ataxien bei neugeborenen Kätzchen sind weitere Leitsymptome für Parvovirose. Differentialdiagnosen Enteritiden, bzw. Ataxien und Myokarditiden anderer Genese, Vergiftungen. Bei Verdacht Da auch chronische Virusausscheider vorkommen, genügt der Virusnachweis im Kot alleine für die Diagnose nicht. Vollständige anatomisch-pathologische Untersuchung, sowie Histologie ist zur Diagnose-Sicherung notwendig. Da die Tiere meist infolge einer Dehydratation eingehen, ist eine symptomatische Behandlung in jedem Falle angezeigt. Untersuchungsmaterial Frisch verendete Tiere, Kot in Ausnahmefällen. Labordiagnose Histologische Veränderungen erlauben i.d.R. eine eindeutige Diagnose. Erregernachweis in veränderten Organen mittels Immunhistochemie oder in situ Hybridisation in speziellen Fällen, z.B. bei Verdacht auf Impfdurchbrüche oder bei wenig ausgeprägten Veränderungen. Antigennachweis mittels ELISA stützt die Diagnose. Seite 131 Kapitel, PPV Parvovirose der Schweine Autor: Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405b.doc PPV Parvovirose der Schweine Die Parvovirose der Schweine ist in erster Linie als Fruchtbarkeitsstörung gekennzeichnet. Ungewöhnlich daran ist, dass diese nicht als Abort, sondern durch Mumifizierung auffällt. Normalerweise erscheinen die infizierten Tiere als völlig gesund (subklinischer Verlauf). Im Gegensatz dazu treten die Parvovirosen der Fleischfresser als schwere systemische Krankheiten auf. Besonderheiten Subklinische Infektion. Mumifizierung der Foeten (Mumienleiter). Extrem hohe Tenazität (wie CPV und FePV). Geschichte Verbreitung Weltweit. Regelmässig Fälle in der Schweiz. Erreger Siehe CPV. Virusvermehrung Siehe CPV Genexpression Siehe CPV Epidemiologie Das Schwein ist der einzige bekannte Wirt für PPV. Die Epidemiologie ist schwierig zu beschreiben, da die postnatale Infektion der Tiere normalerweise subklinisch verläuft und nur ein Serotyp des Virus bekannt ist. Aufgrund der Tenazität der Viren ist das Reservoir jedenfalls mit in der Umwelt zu suchen. In individuellen Herden werden meist nur Erstinfektionen überhaupt bemerkt. Abbildung 1. Infektionszyklus bei PPV (Bildquelle: MA, Universität Zürich) Seite 132 Kapitel, PPV Desinfektion Sehr schwierig; Umgebung, Auslauf, Ställe miteinbeziehen. 35%ige Formalinlösungen, 2% Natronlauge, 0.175% NaHypochlorit, Holzteile verbrennen. Pathogenese Die Übertragung von PPV kann sowohl direkt als auch indirekt erfolgen. Das Virus wird lange Zeit, zum Teil chronisch, mit dem Kot ausgeschieden. Die Virusaufnahme erfolgt oral. PPV vermehrt sich in lymphatischen Geweben wie Tonsillen, Lymphknoten, Thymus und Milz, aber auch in Lunge, Speicheldrüse sowie in mitotisch aktive Epithelzellen (SPhase) in den Krypten des Darmtrakts. Vermehrt sich PPV bei seronegativen Tieren in peripheren Lymphozyten, wobei es diese zur Prolipheration stimuliert, so erreichen die Viren den Geschlechtstrakt, und damit die Foeten in der Gebärmutter, über eine Zell-assoziierte Virämie. Je nach Gestationsstadium hat dies unterschiedliche Folgen, wobei die Phase zwischen dem 15. und dem 70. Tag der Trächtigkeit besonders kritisch ist: 1. Bei einer Infektion zwischen 15. und circa 35. Tag der Trächtigkeit kommt es zum embryonalen Fruchttod gefolgt von der Resorption der Embryonen. 2. Infektion zwischen dem circa 35. und dem circa 70. Tag verursacht Absterben der Foeten und Mumifikation. 3. Ab 60. Tag kann Antikörperbildung beim Foeten beobachtet werden; ab dem 70. Tag tritt intrauterine Immunität auf. Je später die Infektion geschieht, desto besser ist die Prognose für den Foeten. Allerdings können auch spät infizierte Foeten Schäden erleiden, sodass sie lebensschwach zur Welt kommen. Es ist wichtig zu verstehen, dass die Früchte beim Absterben nicht ausgestossen werden. Deshalb spricht man NICHT von einem Abort. Der Bauer erfährt erst zum Geburtstermin, dass die PPV-Infektion erfolgt ist. Seite 133 Kapitel, PPV Abbildung 2. Infektion des ersten Foeten durch Virämie (links). Danach breitet sich die Infektion intrauterin von Foet zu Foet aus (rechts). Deshalb sterben die betroffenen Foeten zu unterschiedlichen Zeitpunkten ab, was die sogenannte "Mumienleiter" erklärt (Bildquelle: Video, "Parvovirus Infection of Pigs", The Scottish pig industry initiative) Klinik Keine. Die postnatale Infektion der Tiere verläuft subklinisch. Für den Bauern macht sie sich in Form des SMEDI-Syndroms bemerkbar. SMEDI steht für "Stillbirth" (Totgeburt), "Mummification" (Fruchtversteinerung), "Embryonic death" (Embryonaler Tod) und "Infertility" (Unfruchtbarkeit). Abbildung 3. Mumienleiter. (Bildquelle: Video, "Parvovirus Infection of Pigs", The Scottish pig industry initiative) Immunreaktion Siehe CPV. Impfprophylaxe Impfstoffe verschiedener Hersteller sind verfügbar; Wirksamkeit zumindest nicht unumstritten. Diagnose Die Mumienleiter gilt als pathognomonisch. Bei mumifizierten Foeten, kleinen Würfen und lebensschwachen Ferkeln immer an PPV denken. Differentialdiagnosen Mumifikationen anderer Genese; PRRS. Bei Verdacht Ganze mumifizierte Früchte einsenden. Untersuchungsmaterial Mumifizierte Früchte. Labordiagnose Messung der Scheitel-Steiss-Länge. Ist diese kleiner als 14 cm, so liegt ein PPV-Verdacht nahe. Ist die Mumie grösser, dann ist PPV nahezu ausgeschlossen. Für Foeten, die vor dem 60. Tag abgestorben sind, eignet sich der Virusnachweis, z. B. mittels Immunfluoreszenz oder PCR. Bei älteren Foeten werden Antikörper nachgewiesen (ELISA oder IIF). Information http://www.thepigsite.com/DiseaseInfo/Default.asp http://www.agvax.com/animal_health/pigs/porcine_parvac/ Seite 134 Kapitel, PPV Seite 135 Kapitel, Pestiviren Pesti Autor: Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405.doc Pesti Pestivirus Infektionen Infektionen mit Pestiviren sind beim Rind, Schwein und Schaf von grosser Bedeutung. Die Bovine Virus Diarrhöe/ Mucosal Disease (BVD/MD) verursacht eine verwirrende Vielzahl von Krankheiten beim Rind. Charakteristisch sind Fieber, Diarrhöe, Mukosa Läsionen, Abort, Missbildungen, respiratorisch-enterische Probleme, chronisches Kümmern und Todesfälle. Die Infektion kann aber auch völlig symptomlos ablaufen. Klassische Schweinepest (KSP)(auch Europäische Schweinepest, ESP oder Hog Cholera) kann perakut, akut, chronisch oder inapparent verlaufen. Beim perakut-akuten Verlauf hat das klinische Bild den Charakter einer Septikämie und geht einher mit typischen durch Hämorrhagien verursachten, zyanotischen Veränderungen verschiedener Hautpartien (Ohren, Bauch, Extremitäten). Die klinische Unterscheidung zu ASP ist nicht möglich. Border Disease (BD, auch Hairy Shaker Krankheit der Lämmer) wird meist als Fruchtbarkeitsproblem in der Herde erkannt. Unfruchtbarkeit, Aborte, Geburt von lebensschwachen und missgebildeten Lämmern. Typisch sind unterschiedliche Grade von Tremor, abnormale Fellentwicklung bei der Geburt, sowie disproportionierte Extremitäten ("Camel-legged lambs"). Die betroffenen Lämmer sterben meist sehr früh, können aber auch nach anscheinender Erholung später an virusbedingten Diarrhöe- und Respirationskrankheiten eingehen. Besonderheiten Horizontale und vertikale Übertragung. Persistierende Infektion durch Immuntoleranz möglich. Seite 136 Kapitel, Pestiviren Geschichte Die KSP gilt als die älteste Pestivirusinfektion. Sie wurde erstmals um 1830 in Ohio, U.S.A. beschrieben. Im Gegensatz dazu sind BVD/MD (erstmals 1946 beschrieben) und BD (seit 1959 bekannt) relativ neue Infektionskrankheiten. Über die volkswirtschaftliche Bedeutung von BVD/MD ist man sich heutzutage zwar einig, es fehlte jedoch bislang das notwendige Wissen, der Mut und/oder die Finanzkraft diese Infektion mit dem Ziel der Tilgung zu bekämpfen. KSP wurde schon bald als volkswirtschaftlich bedeutende Seuche erkannt. Deshalb wird sie in vielen Ländern von Staates wegen bekämpft. Je nach Durchseuchungsrate werden dabei Impfstrategien oder direkte Tilgungsprogramme herangezogen. Alle drei Viren verfügen über ein genügend breites Wirtsspektrum um nicht nur die angestammte Spezies, sondern auch andere Paarhufer erfolgreich infizieren zu können. Verbreitung Weltweit. BVD/MD: In der Schweiz weisen circa 80% der Rinder Antikörper auf. KSP: Epizootien in der EU bis 1987. 1990 erneut Fälle in Belgien. Entwicklung von Enzootien in Wildschweinpopulationen (Italien und Kanton Tessin, BRD, Frankreich). Letzte klinisch beobachtete Ausbrüche in der Schweiz 1974/1975. Schweinepest im Emmental, 1993 !! Border Disease kommt in der Schweiz vor. Über die tatsächliche Verbreitung ist wenig bekannt. Erreger Die Pestiviren waren bis vor kurzem aufgrund ihrer Morphologie und Grösse bei den Togaviridae eingeteilt. Aufgrund der Genomsequenz, werden sie heute zu den Flaviviridae gezählt. Struktur: Ø 30-50 nm, behüllt, icosahedrale Symmetrie, ssRNA (positive Polarität), circa 12'500 Basen, nicht segmentiert. Das Genom enthält ein einziges offenes Leseraster (ORF, open reading frame), das für ein Polyprotein kodiert, welches in virale Enzyme und Strukturproteine gespalten wird. Virusvermehrung und Genexpression Pestiviren vermehren sich in verschiedenen Arten von Zellkulturen ihrer Wirtsspezies. Interessanterweise gibt es zytopathogene (cp) Virusstämme, welche die Wirtszellen im Verlaufe der Infektion abtöten, während andere, nicht zytopathogene (ncp) Isolate sich vermehren ohne die Zelle zu schädigen. Die Infektion erfolgt über Bindung an Rezeptoren und adsorptive Endozytose. Nach der Freisetzung aus dem Kapsid wird die ssRNA, die in positiver Polarität vorliegt, im Zytoplasma als mRNA behandelt und in ein Polyprotein translatiert, welches dann wiederum co- und posttranslational durch proteolytische Vorgänge in die kleineren Enzyme und Strukturproteine gespalten wird. Seite 137 Kapitel, Pestiviren Strategie der Pestivirus Replikation (+)ssRNA Polyprotein Enzym(e) (-)RNA Enzym(e) (+)RNA Strukturproteine neue Virusgeneration Bei den cp-Virusstämmen, nicht aber bei den ncp-Isolaten wird eines der Vorstufenproteine (p125) in zwei weitere Bruchstücke (p54 und p80) gespalten. Ein markanter Unterschied zwischen den pathogenetisch wichtigen viralen Biotypen besteht also in der Spaltung eines einzigen Proteins (Pfeil in der nachfolgenden Abbildung). Eine Erklärung für dieses Phänomen bietet die Hypothese unserer Berner Kollegen (Prof. Peterhans), die postulieren, dass p125 ein virales Protein sei, welches die Apoptose der infizierten Zelle verhindere. Bei der proteolytischen Spaltung von p125 muss die Zelle deshalb absterben. Rand 5' (+)ssRNA (12573 b) 3' Polyprotein N p20 gp116 p125 p54 p80 C p133 p58 p75 gp48/25/53 keine Spaltung bei ncp Stämmen Seite 138 Kapitel, Pestiviren Epidemiologie Die Pestiviren verfolgen zwei alternative Strategien um sich in der Natur zu erhalten. Die erste Strategie ist hohe Kontagiosität und damit rasche Ausbreitung in einer immunologisch naiven Population. Die zweite Strategie basiert auf der Bildung von lebenden Virusreservoirs in der Form von immuntoleranten Tieren. Auf diese Art können sich die Pestiviren jahrelang in einer immunen Population halten und sich blitzschnell erneut ausbreiten, wenn die Herdenimmunität nicht mehr genügt. Pestiviren können auch wildlebende Wiederkäuer infizieren. Die epidemiologische Bedeutung dieser Tatsache ist jedoch noch unklar. Die Einschleppung der Pestivirusinfektionen erfolgt in der Regel durch Handel mit infizierten Tieren. Bei KSP spielen zusätzlich die Verfütterung von ungenügend erhitzten Abfällen, bei KSP und BVD die iatrogene Übertragung eine wichtige Rolle. Desinfektion Tenazität gering. Detergentien (Hülle), Wärme, Säure, UV Strahlung, proteolytische Enzyme inaktivieren die Pestiviren rasch. Auffallende Resistenz von KSP Viren gegenüber alkalischen pH Bereichen (pH9-11). In Tierkörpern und Fleischprodukten (Fett, Knochenmark) monatelang infektiös. Desinfektion mit allen handelsüblichen Mitteln. Pathogenese Pestiviren werden oral und/oder nasopharyngeal aufgenommen. Parenterale Infektion mittels Injektabilia, welche bovines, porcines oder ovines Gewebe enthalten (zum Beispiel Impfstoffe). Primäre Vermehrung in den epithelialen Zellen in den Krypten der Tonsillen. Phagozyten verschleppen die Pestiviren in die lymphoiden Organe. Später Vermehrung in weissen Blutzellen und Aussaat im ganzen Körper (Virämie). Virusausscheidung in allen Sekreten und Exkreten. Seite 139 Kapitel, Pestiviren Die Folgen der Infektion hängen mit dem Immunstatus des betroffenen Tieres zusammen. Besitzt ein Tier genügend hohe Titer neutralisierender Antikörper, so verläuft die Infektion abortiv. Bei immunologisch naiven Tieren kommt es nach einer Inkubationszeit von etwa einer Woche zur Ausbildung von mehr oder weniger ausgeprägten klinischen Symptomen. Dabei wird das Immunsystem stimuliert, die Viren werden aus dem Organismus eliminiert und das Tier ist später vor einer Reinfektion geschützt. Beim Auftreten einer Virämie kann es bei trächtigen Tieren zur Infektion des Foetus kommen. Der Zeitpunkt der Gestation bestimmt dann das weitere Schicksal des Foeten. Die folgende Abbildung illustriert das Beispiel BVD/MD: Foeten, welche die intrauterine Infektion überleben, können seropositiv und normal oder missgebildet sein oder seronegativ und immuntolerant zur Welt kommen. Immuntolerante Tiere bilden ein wichtiges Virusreservoir. Äusserlich ist die Immuntoleranz nicht ohne weiteres erkennbar. Einige Tiere fallen schon früh als Kümmerer auf, andere können lebenslänglich, symptomlos Virus ausscheiden und wieder andere erkranken an Mucosal Disease (MD). Da die Rinder die längste Lebenserwartung unter den von Pestiviren betroffenen Tieren aufweisen, tritt MD am häufigsten bei Rindern und Kühen auf, während sie bei Schafen und Schweinen ein fast unbekanntes Krankheitsbild darstellen. Werden diese Tierarten möglicherweise vor der Ausbildung des Syndromes geschlachtet? Die Genese der MD hängt wiederum mit den immunologischen und biologischen Eigenschaften des Virusstammes zusammen. Solange der persistierende ncp Virusstamm innerhalb des antigenetisch tolerierten Spektrums bleibt, wird er nicht aus dem Organismus eliminiert. Seite 140 Kapitel, Pestiviren Solange der tolerierte ncp Virusstamm den Organismus nur geringgradig oder überhaupt nicht schädigt, bleiben die Tiere mehr oder wenig gesund und leistungsfähig. Erfolgt jedoch eine Superinfektion mit einem antigenetisch sehr nahe verwandten cp Virusstamm oder wenn der ncp Stamm plötzlich zum cp Stamm mutiert, ohne dass das Antigenspektrum gleichzeitig betroffen ist, dann entwickelt sich Mucosal Disease. Die Hypothese besagt, dass das neue Virus die Wirtszellen abtötet, ohne vom Immunsystem gehindert zu werden. Aus diesem Grund verläuft MD fast immer fatal. Erfolgt jedoch eine Superinfektion mit einem antigenetisch vom tolerierten Stamm unterschiedlichen Virus, dann kommt es zu einer normalen Immunantwort gegen die Superinfektion. Das betroffene Tier entwickelt nachweisbare, neutralisierende Antikörper gegen Pestiviren, ist jedoch trotzdem nicht vor Mucosal Disease geschützt. Klinik Es gilt in jedem Fall die Folgen einer pränatalen Infektion und die Krankheit akut infizierter Tiere von der Krankheit der immuntoleranten, persistent infizierten Tiere zu unterscheiden. Virusdiarrhoe der Rinder (BVD): Verläuft oft sehr milde oder sogar subklinisch. Falls Symptome auftreten, sind profuse Durchfälle infolge der akuten Gastroenteritis, sowie respiratorische Symptome, wie Nasenausfluss und Husten charakteristisch. Mehr oder weniger ausgeprägt sind allgemeine Symptome, wie Fieber, Müdigkeit und Anorexie. Infolge der Vermehrung der BVD Viren in den Leukozyten, kann es zu Immundepression kommen, was das Auftreten von Folgekrankheiten, zum Beispiel Pneumonien, begünstigt (Pneumo-Enteritis-Komplex). Aborte und Missbildungen: Abhängig vom Virusstamm, vom Immunstatus des Elterntiers und vom Graviditätszeitpunkt bei der Infektion, kann die Pestivirusinfektion zu Aborten oder Missbildungen führen. Bei der in utero Infektion des Kalbes werden folgende Missbildungen beobachtet: Zerebelläre Hypoplasie, defektive Myelinisierung des Rückenmarks, mandibuläre Brachygnatie, Wachstumsretardation, Anomalien der Augen, z.B. Atrophie der Retina. Ganz ähnliche Missbildungen treten auch bei Lämmern und Ferkeln auf. Zusätzlich sind bei BD noch die Spezialformen wie "hairy shaker" und "Kamelbeinigkeit" zu nennen. Missbildungen infolge Infektion mit KSP Virus betreffen die viszeralen Organe, sowie das zentrale Nervensystem und äussern sich in Tremor und Lebensschwäche. Die wichtigste "Missbildung", ein Hauptcharakteristikum der Pestivirusinfektion überhaupt, die aber leider keinen zuverlässigen phänotypischen Marker aufweist, ist natürlich die Immuntoleranz. Seite 141 Kapitel, Pestiviren Mucosal Disease (MD): Akute MD verläuft fieberhaft, mit Depression, Schwäche und Anorexie. Mucopurulenter Nasenausfluss wird als Folge der erosiven Schleimhautläsionen in Maul- und Nasenbereich beobachtet. Auch Augenausfluss tritt häufig auf. Erosive Veränderungen am Kronsaum und in den Zwischenzehenspalten führen zu Lahmheiten und zur differentialdiagnostisch wichtigen Frage, ob nicht etwa eine MKS Infektion vorliege. Sehr stark betroffene Tiere sterben bereits wenige Tage nach Krankheitsbeginn. Andere entwickeln nach etwa drei Tagen einen profusen, wässrigen, faulig riechenden, zum Teil blutigen und unstillbaren Durchfall. Vielfach wird die Krankheit durch sekundäre bakterielle Infektionen verschlimmert. In der Regel führt MD zum Tod der betroffenen Tiere. Nur in Ausnahmefällen entwickelt sich eine chronische Krankheit mit Inappetenz, zunehmender Auszehrung, intermittierendem Durchfall und chronischen, ulzerativen Veränderungen im Maulbereich und auf der Haut. Alopezie und Hyperkeratisierungen werden in der Regel im Nackenbereich beobachtet. Therapeutische Massnahmen sind in jedem Fall unfruchtbar und deshalb nicht angezeigt. Schweinepest: Das Ausmass klinischer Symptome ist sowohl von der Virulenz des Virusstammes, als auch von Determinanten des Wirtstieres abhängig. Die akute Verlaufsform ist gekennzeichnet durch Fieber, Anorexie, Depression, Diarrhöe oder Obstipation, Erbrechen, Konjunktivitis, Nasenausfluss, Lähmungserscheinungen und rötlich-blaue Verfärbungen der Haut (Hämorrhagien). Die Tiere sterben meist 8 bis 20 Tage nach Beginn der Krankheit. Die Todesursache liegt vermutlich in Störungen der Gefässwände und des Gerinnungssystems. Weniger virulente Virusstämme verursachen zunächst generell mildere Krankheitssymptome mit Depression, Fieber und Anorexie. Betroffene Tiere erholen sich vorübergehend, fallen später jedoch oft einer terminalen Exazerbation zum Opfer. Der Tod tritt trotz einsetzender Immunreaktion nach 1 bis 3 Monaten ein. Geschieht die Infektion intrauterin oder perinatal, kommt es ähnlich wie beim Rind bei einem Teil der Tiere zu Immuntoleranz und persistierender Infektion mit chronischer Virusausscheidung. Ein klassisches Gegenstück zur Mucosal Disease existiert nicht, obwohl bei persistent infizierten Ferkeln eine spät einsetzende, sich konstant verschlimmernde Krankheit mit leichtem Fieber, chronischen Durchfällen, Konjunktivitis, Dermatitis und Bewegungsstörungen beobachtet wird. Solche Tiere sind in der Regel Kümmerer, die entweder von selbst eingehen oder aus wirtschaftlichen Gründen eliminiert werden. Seite 142 Kapitel, Pestiviren Border Disease: Die Diagnose wird meistens in der Ablammzeit gestellt. Adult infizierte Tiere erkranken nur sehr mild. Von Bedeutung ist hingegen die intrauterine und neonatale Infektion. Erste Anzeichen der Infektion innerhalb einer Herde sind gehäufte Aborte und die Geburt von missgebildeten Lämmern. Sehr charakteristisch sind lebensschwache Neugeborene mit unterschiedlich ausgeprägtem Tremor und abnormal rauhem Vlies ("hairy shaker"). Manchmal treten auch "Kamel-artig" deformierte Beine, sowie Erblindung als Folge der intrauterin erfolgten Infektion mit Border Disease Virus auf. Ein grosser Prozentsatz der erkrankten Tiere stirbt im Verlaufe der ersten zwanzig Lebenswochen. Überlebende Tiere sind oft schwächlich, krankheitsanfällig und werden oft von respiratorischen und/oder enteralen Krankheiten befallen. Insgesamt erinnert die Krankheit stark an die Mucosal Disease der Rinder. Immunreaktion Grundsätzlich sind Pestiviren stark immunogen. In einem immunkompetenten Tier erfolgt deshalb eine sehr erfolgreiche Immunantwort auf die Infektion. Sowohl humorale, als auch zelluläre Komponenten tragen zur Elimination der Pestiviren aus dem Organismus bei. Nach der Infektion können meistens hohe Titer neutralisierender Antikörper nachgewiesen werden. Die einzelnen Pestiviren weisen starke Kreuzreaktionen auf. Eine serologische Unterscheidung ist deshalb nur bedingt möglich. Erfolgt eine Infektion mit einem ncp Stamm vor dem Erreichen der Immunkompetenz, in einer Phase wo sich die Immunzellen des Körpers in der Ausbildung zur Unterscheidung von "selbst" und "fremd" befinden, dann kann es vorkommen, dass die Stammzellen, die eigentlich zur Vernichtung des eingedrungenen Virusstammes vorgesehen waren, eliminiert werden. Das Immunsystem lernt irrtümlicherweise, dass die eingedrungenen Pestiviren zum "selbst" gehören, also toleriert werden müssen. Der Organismus wird infolgedessen immuntolerant gegenüber diesem speziellen Virusstamm. Impfprophylaxe Sowohl inaktivierte, wie mlv Impfstoffe zur Prophylaxe von BVD/MD sind zugelassen. Bei immuntoleranten Tieren ist die Vakzination wirkungslos zur Prävention von MD. Im Gegenteil, MD kann sogar ausgelöst werden. Impfstoffe zur Prophylaxe von KSP sind in der Schweiz verboten. Border Disease: zur Zeit keine Impfstoffe verfügbar. Seite 143 Kapitel, Pestiviren Diagnose Für BVD/MD fallen diagnostische Untersuchungen im Zusammenhang mit Verdacht auf Mucosal Disease, Abortproblemen und Pneumoenteritiden bei Mastkälbern an. KSP: Bei septikämischen Krankheitsbildern an Schweinepest denken. Bei klassischer Border Disease kann meist schon klinisch eine treffende Verdachtsdiagnose gestellt werden. Beim Auftreten von Kümmerern und Todesfällen bei Lämmern sollte jedoch vermehrt an "atypische" BD gedacht werden. Für endgültige Diagnosen ist der Virusnachweis erforderlich. Differentialdiagnosen Rind: MKS, BKF, andere Aborterreger, andere Infektionserreger des Pneumoenteritis Komplexes. Schwein: ASP. Andere Septikämien (E.Coli, Salmonellen, Mannheimien) aber auch Vergiftung (Aflatoxin). Schaf: Ataxien wegen Demyelinisierung infolge von Kupfermangel. Bei Verdacht Einsendung von Untersuchungsmaterial grundsätzlich mit dem entsprechenden Labor absprechen. BVD/MD: Institut für Veterinär-Virologie der Vetsuisse Fakultät Bern 031 631 2505. KSP: INSTITUT FUER VIRUSKRANKHEITEN UND IMMUNPROPHYLAXE (IVI). Border Disease: Institut für Veterinärpathologie, Vetsuisse Fakultät Zürich 044 635 8584. Untersuchungsmaterial BVD/MD: Mucosal Disease: 10 ml EDTA Blut, ev. zusätzlich Serum. Hautproben für Immunhistochemie bei Verdacht auf persistente Infektion oder bei MD. Abortprobleme: ganze Foeten. Pneumoenteritis Komplex: 10 ml EDTA Blut, ev. Nasentupfer. KSP: Tonsillen, Lymphknoten, Milz, Niere, Gehirn und Blut. BD: ganze Lämmer. Labordiagnose Antigennachweis in "buffy coat" Zellen mittels ELISA. Erregernachweis in Hautproben (in vivo für persistent BVDinfizierte Tiere) sowie in veränderten Organen (post mortem) mittels Immunhistochemie. Eventuell ELISA zum Nachweis von Antikörpern gegen "interne" Proteine im Serum. RT-PCR-Technik für BVD und KSP. Virusisolation in Zellkulturen dauert mehrere Tage. Bestandesserologie bei Verdacht auf KSP. Seite 144 Kapitel, Poxviren, Pocken, Mensch Poxviren Pocken Autor: Martin Schwyzer File Info: TPT22:\Vorlesung\Portrats0203.doc Pocken Eradikation der Menschenpocken (Variola) Menschenpocken (Smallpox, Variola major) war eine hochvirulente Infektionskrankheit mit 5-40 % Mortalität, seit 1977 dank konsequentem Impfprogramm der World Health Organization (WHO) aus der ganzen Welt ausgerottet. Das hierzu verwendete Impfvirus (Vaccinia Virus) ist seit zwei Jahrhunderten im Einsatz; es wurde vermutlich von Kuhpocken hergeleitet. Besonderheiten Ausrottung von Variola war vor allem aus folgenden Gründen möglich: • Wirksame Vakzine • Kein animales Virusreservoir (ausser Affen- und Büffelpocken) • Keine Persistenz • Schwerwiegende und gut erkennbare Krankheit. Die Kuhpocken ist für die Veterinärmedizin wenig bedeutend, aber Vaccinia Virus ist sehr bedeutend als: 1. Erste Vakzine überhaupt (daher der Name), 2. Vektor für Expression fremder Gene in animalen Zellen (u. a. auch für Impfungen). Geschichte Menschenpocken beschrieben im Altertum in China und Indien. Die Mumie von Ramses V (ca. 1’000 v. Chr.) wies Pockennarben auf. Nach dem 6. Jh. Pocken in Arabien, nach dem 16. Jh. weltweit. Pockennarben, Erblindung, Tod. Nicht so epidemisch wie Pest aber ständige Bedrohung. Bekämpfung Frühe Tradition in China: Variolation - Pockenkrusten zu Pulver mahlen, dieses schnupfen. Oft erfolgreich, aber gefährlich, gelegentlich zu neuen Pockenfällen führend. In Europa später auch i.v. oder i.d., etwa seit 1840 illegal. Seite 145 Kapitel, Poxviren, Pocken, Mensch Jenner 1798 - Impfung mit Kuhpocken (Vaccinia) statt Variolation. Daher der Name Vakzination. Rasche Verbreitung in Europa. Jenner sagte 1801 die Ausrottung der Pocken voraus. Dank dem Einsatz der WHO wurde dies 1977 Wirklichkeit. Sechs Voraussetzungen erfüllt: • Sichere und wirksame Vakzine verfügbar • Kein animales Virusreservoir. Hier bestehen Ausnahmen, indem Affenpocken auf den Menschen übertragbar sind (nur sporadisch im afrikanischen tropischen Regenwald), ebenso Büffelpocken (mit Vaccinia verwandt; nur Indien). • Keine Viruspersistenz, keine subklinischen Fälle • Krankheit äusserlich erkennbar • Die Schwere der Erkrankung bot Motivation für Impfung und Quarantäne • Bekämpfung weltweit akzeptiert, kein Verstecken wie bei Lepra oder Geschlechtskrankheiten. Die Kosten für die ganze Aktion beliefen sich auf 300 Mio $ für 400 Mio Vakzine-Dosen inklusive Logistik (zu vergleichen mit der Milliarde $, welche Pockenprophylaxe jährlich im Westen allein gekostet hatte). Alle 6 Voraussetzungen sind zur Zeit leider nur bei wenigen Humanviren gegeben, am besten zur Zeit bei Poliovirus (WHO-Aktion im Gang). Bei animalen Viren besteht als zusätzliche Möglichkeit die Ausmerzung betroffener Tiere (MKS, IBR, Rabies). Variola major wird noch in zwei Gefrierschränken in Atlanta und Moskau gelagert (Überrest des kalten Krieges). Nach 1977 gab es noch einen Pockenfall in einem Labor in England (Sterilbank via Lüftung). 1997 war eine starke Zunahme der Affenpocken in Zaïre zu verzeichnen (170 Fälle beim Menschen). Erreger Vaccinia und Variola major sind zwei Spezies des Genus Orthopoxvirus; über andere Mitglieder der Familie Poxviridae siehe Pox (animal). Grosses behülltes Virus, "backsteinförmig" (Oval mit abgeflachten Seiten) 120x300 nm, bestehend aus Nukleokapsid, 2 Seitenkörperchen, äussere Membran, Hülle. Genom doppelsträngige DNA mit kovalent verbundenen Enden. DNA Sequenz von Vaccinia bekannt (191,737 Basenpaare), über 250 Gene. Seite 146 Kapitel, Poxviren, Pocken, Mensch Uncoating I intermediäre mRNA intermediäre Proteine Transkriptionsfaktoren Uncoating II frühe mRNA frühe Proteine DNA Replikation Transkriptionsfaktoren späte mRNA Strukturproteine Virion-Enzyme für folgenden Zyklus Golgi Virusvermehrung und Genexpression Kern Assembly Poxviren (sowie ASP) sind die einzigen DNA-Viren, welche sich im Zytoplasma vermehren. Viele der dazu benötigten Funktionen sind Virus-kodiert (DNA-abhängige RNAPolymerase, DNA-Polymerase, Enzyme für RNAProzessierung). Das grosse Genom dieser Viren bewirkt weitgehende Autonomie gegenüber der Zelle. Über Adsorption und Penetration ist wenig bekannt. Ungewöhnlich ist, dass sowohl behüllte als auch unbehüllte Viren infektiös sind. Uncoating in zwei Schritten: 1. Zelluläre Enzyme entfernen die äussere Membran; mitgebrachte virale Enzyme beginnen mit der frühen Transkription im Nukleokapsid. 2. Translation der frühen Virus-RNA; eines der neugebildeten Virusproteine bewirkt Freisetzung der DNA aus dem Nukleokapsid. Biosynthese in drei Phasen ähnlich wie bei Herpesviren: frühe Phase (siehe oben), intermediäre und späte Phase. In jeder Phase werden virale Transkriptionsfaktoren synthetisiert, welche die nächste Phase aktivieren (die späten Transkriptionsfaktoren werden für den folgenden Infektionszyklus ins Virion verpackt). Seite 147 Kapitel, Poxviren, Pocken, Mensch In der frühen Phase werden ausserdem Enzyme synthetisiert für die virale DNA-Replikation, welche die intermediäre Phase einleitet. In der späten Phase werden die VirusStrukturproteine gebildet. Zusammenbau in speziellen Bezirken des Zytoplasmas ("Virusfabriken"). Die Viren erhalten zum Teil eine doppelte Hülle im Golgi-Apparat; nach Knospung durch die Zellmembran bleibt nur die innere Schicht als Virushülle. Subtypen Wegen der jahrhundertelangen, ungenau dokumentierten Geschichte gibt es zahlreiche Vaccinia-Stämme. Keine Einteilung in Subtypen. Neben Variola major gab es Variola minor mit bedeutend geringerer Mortalität (1 %). Serolog. Kreuzreaktionen zwischen Orthopoxviren. Rekombinante VacciniaImpfstoffe Ein Gen von Rabies-Virus wurde in Vaccinia-Vektor eingebaut und zur Freiland-Immunisierung von Füchsen gegen Tollwut verwendet. Schritte im einzelnen: Rabies-Gen für GProtein in bakterielles Plasmid eingebaut, flankiert von Segmenten eines nichtessentiellen Vaccinia-Markergens. Plasmid in Vaccinia-infizierte Zellen eingeschleust (Transfektion). Durch doppelte homologe Rekombination (übereinstimmende Vaccinia-Sequenzen im Plasmid und im Virus) wurde das Vaccinia- durch das Rabies-Gen ersetzt. Gewünschte Rekombinanten anhand Abwesenheit des Vaccinia-Markergens selektioniert. Pathogenese Mögliche Eintrittspforten Respirationstrakt, Läsionen in der Haut, oral. Nach transienter Virämie Transport in regionäre Lymphknoten, Verbreitung durch lymphatische Organe, generalisierte Virämie und Infektion epidermaler Zellen. Klinik Die Menschenpocken wurden meist via Respirationstrakt übertragen. Dort Replikation; Transport zu Lungen, Milz, Leber etc; 10 - 12 Tage später Virämie, Fieber, Kopfweh, toxischer Schock. In den folgenden 4 Tagen traten die typischen Eruptionen (Pocken) auf. Virus wurde via Respirationstrakt und in grossen Mengen aus Eruptionen ausgeschieden. Immunreaktion Die Variolation, "Mutter der Immunologie", gründete auf der Beobachtung, dass pockennarbige Personen nicht erneut an Pocken erkrankten. Entsprechend dem grossen Poxvirusgenom und den vielen Genprodukten wird eine Vielfalt verschiedener humoraler Antikörper (z. T. neutralisierend) gebildet. Zelluläre Immunreaktion wichtig für Impfschutz wie auch für das Überstehen der natürlichen Infektion. Seite 148 Kapitel, Poxviren, Pocken, Mensch Epidemiologie und Tenazität Variola war immer endemisch in Eurasien. Kolonisierung von Amerika, Afrika und Australien führte zu Epidemien, die wesentlich zur Dezimierung der Urbevölkerung beitrugen. Das Virus ist sehr resistent gegen Umwelteinflüsse (Lyophilisation des Vaccinia-Impfstoffes). Prophylaxe Vaccinia gehört zu den vergleichsweise weniger harmlosen Impfviren. Normalerweise verhindert die einsetzende fieberhafte Immunreaktion eine Ausbreitung, aber bei immundefizienten Personen sowie bei Trägern von Ekzemen kann Vaccinia eine generalisierte Virämie und Pockenähnliche Erkrankung auslösen. Eine seltene aber fatale Impfkomplikation ist Enzephalopathie mit Hirnödem bei Kindern <2 Jahre und Encephalitis mit Demyelinisierung bei älteren Personen. Die hohe Komplikationsrate (höher als bei jedem anderen Impfvirus) wirkte eher motivierend auf die Eradikationskampagne, da die inzwischen bestätigte Hoffnung bestand, in Zukunft auf diese Impfung verzichten zu können. Solange aber derartige Komplikationen nicht ausgeschlossen werden können, wird der Einsatz von rekombinanten VacciniaImpfstoffen beim Menschen fragwürdig bleiben. Staatliche Massnahmen Viele Länder (z. B. USA) verlangten bei der Einreise den Nachweis der Pockenimpfung. 1980 erklärte die WHO Variola für ausgerottet; es wird nicht mehr geimpft und die Bevölkerung wird nun zunehmend seronegativ. Sequenzanalyse des Genoms von Variola major wurde 1994 abgeschlossen. Danach war vorgesehen, auch die letzten Virusvorräte zu vernichten, wurde noch nicht durchgeführt (warum wohl nicht?). Seite 149 Kapitel, Poxviren, Pockenviren bei Tieren Animale Poxviren Autor: Martin Schwyzer File Info: TPT22:\Vorlesung\Portrats0203.doc Pockenviren bei Tieren Pox Pockenviren verursachen je nach Virus und Tierart verschiedenartige Läsionen der Haut. Die klinisch wichtigen Viren führen auch zu Virämie und schwerer generalisierter Infektion. Besonderheiten Sehr grosse, komplexe Viren. Vermehrung im Zytoplasma. Erreger Die Familie Poxviridae umfasst zwei Subfamilien, Chordopoxvirinae (Poxviren bei Vertebraten) und Entomopoxvirinae (bei Insekten). Die Chordopoxvirinae umfassen acht Genera. Für die Veterinärmedizin am wichtigsten sind: Genus Orthopoxvirus Parapoxvirus Capripoxvirus Suipoxvirus Leporipoxvirus Avipoxvirus Virus Vaccinia Virus Wirt Verbreitung Rind, Büffel, Schwein, Kaninchen, Weltweit Nagetiere, Mensch Affenpocken Affen, Eichhörnchen, Mensch tropisches Afrika Orf Virus Schaf, Ziege, Mensch Weltweit Schafpocken Schaf, Ziege Afrika, Asien Schweinepocken Schwein; durch Läuse übertragen Weltweit Myxoma Virus Kaninchen Amerika, Europa, Australien Geflügelpocken Huhn, Truthahn Weltweit Virusvermehrung und Genexpression Alle Poxviren vermehren sich im Zytoplasma nach dem Muster von Vaccinia und Variola (siehe Abbildung unter "Pocken"). Verschiedene Poxviren sind vollständig sequenziert, zB. Myxoma, Geflügelpocken, Molluscum contagiousum Pathogenese Nach Eindringen des Virus durch Läsionen in Haut oder Schleimhaut lokale Vermehrung und transiente Virämie. Weitere Vermehrung in regionären Lymphknoten (ev. auch Milz, Knochenmark, Leber), erneute Virämie. Befall epidermaler Zellen, ein viraler Wachstumsfaktor lässt die Zellen proliferieren. Führt zu den typischen Pusteln mit Hyperplasie, Zell-Lyse, entzündlicher Infiltration, Ödembildung. Seite 150 Kapitel, Poxviren, Pockenviren bei Tieren Klinik Immunreaktion Orf (Schaf und Ziege): Läsionen können an Lippen, Kronsaum, Euter, ev. Genitalien auftreten. Anfänglich Bläschen und Pusteln, die dann verkrusten und nach etwa 2 Wochen abfallen. Bei Lämmern auch bösartige Form mit Wucherungen im Maul, Pharynx und Ösophagus. Orf (Mensch): Melkerknoten - blaurote Knoten vor allem an Fingern, bis kirschsteingross, später verkrustend. Sekundärinfektionen möglich. Schweinepocken: An Ohren, Bauch, Schenkeln und Rüssel Erytheme, die zu Pusteln reifen und dann verkrusten. Geringe Letalität. Myxoma (Kaninchen): Zu Beginn geschwulstartige Verdickungen an Augenlidern, Nase, Lippen, dann Übergriff auf den ganzen Körper (löwenähnliches Aussehen) und Tod innert etwa 10 Tagen. Geflügelpocken: Anfangs rötliche Flecken an Kamm, Ohrund Kehllappen, Nasenausgang und Schnabel, später Pusteln und Krusten. Bei der Schleimhautform sind auch Mund, Pharynx und Larynx betroffen; dann ist die Prognose ungünstig. Bei allen diesen Viren sind auch klinisch inapparente Verlaufsformen möglich (Virusreservoir). Poxviren induzieren wegen ihrer Komplexität vielerlei Antikörper. Sie verfügen jedoch auch über vielfältige Evasionsstrategien. Sie bilden Proteine, welche Komplement inaktivieren, die Wirkung von Interferon verhindern, ZytokinRezeptoren imitieren etc. Epidemiologie Übertragung durch direkten Kontakt oder über abgefallene Krusten (Orf), aerogen (Schafpocken), oder durch Insekten (Schweinepocken). Diagnose Nach klinischem Bild. Ausserdem Elektronenmikroskopie, Erregerisolierung, Restriktionsenzymanalyse der DNA. Desinfektion Poxviren sind gegen Umwelteinflüsse sehr resistent. In Krusten können sie mindestens ein Jahr überleben. Prophylaxe Hygiene ist die beste Prophylaxe. Gegen Orf steht eine Lebendvakzine zur Verfügung. Therapie Ausser Desinfektion der Läsionen (Verhinderung von Sekundärinfektionen) wenig Therapiemöglichkeiten. Seite 151 Kapitel, Prionen, BSE Prionen BSE Autoren: Monika Engels, Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405.doc BSE Bovine Spongiforme Enzephalopathie Seit 1985 bei Kühen neu aufgetretene Erkrankung des Zentralnervensystems. Die Krankheit ist Scrapie-ähnlich; Grund: es handelt sich um eine auf das Rind übertragene Scrapie-Infektion (s. Epidemiologie). Besonderheiten In einem Bestand sind meist nur ein oder wenige Tiere von der Krankheit betroffen. Vertikale Übertragung von untergeordneter Bedeutung. Verdacht der zoonotischen Übertragung von BSE auf den Menschen (vCJD) durch Nahrungsmittel, die Prionen-haltiges Gewebe enthalten (vgl. Risikorgane). Weitere Besonderheiten der Prionen inkl. Antigenverwandtschaft und Spongiforme Enzephalopathien anderer Tierarten und des Menschen: s. Porträt von Scrapie. Staatliche Massnahmen In der Schweiz gelten seit dem 1. Dezember 1990 die "Sofortmassnahmen gegen die spongiforme Enzephalopathie der Wiederkäuer"; Änderung der Tierseuchenverordnung vom 29. Nov. 1993. a) vorsorgliche Massnahmen b) Massnahmen bei Auftreten der Krankheit und c) Allgemeines d) Weitere Vorschriften wurden rechtskräftig mit den Sofortmassnahmen vom 13. September 1996 und den e) Anpassungen vom 1. Juli 1998 f) UP BSE (Überwachungsprogramm BSE) g) Anpassungen Juli 1999 h) Allgemeines Tiermehlverbot (1. Januar 2001) i) Änderungen im Schlachtprozess (Frühjahr 2001) h) UP TSE (Überwachungsprogramm TSE, kleine Wiederkäuer) Seite 152 Kapitel, Prionen, BSE ad a): "feed-ban" = Meldepflicht / Fütterungsverbot (Fleisch/Knochenmehl u.ä. an Wiederkäuer) / Lebendviehuntersuchung (bei allen > 6 Monate alten Rindern, Ziegen und Schafen) / Entfernen und Verbrennen der folgenden Risikoorgane: Gehirn, Augen, Rückenmark mit Dura mater, Thymus, Milz, Därme, Spinalganglien sowie sichtbares Lymph- und Nervengewebe von > 6 Monate alten Rindern sowie von Schafen und Ziegen, die >12 Monate alt sind oder bei denen ein bleibender Schneidezahn durchgebrochen ist. Milz und Ileum von Schafen und Ziegen jeden Alters. ad b): Klärung des Verdachts (Tierarzt, KT; solang Verdacht, darf Milch nicht abgeliefert werden) / gesamter Körper kranker Tiere muss verbrannt werden / bei Scrapie muss der gesamte Bestand geschlachtet und die Tierkörper verbrannt werden (danach 2-jährige Zuchtsperre); bei BSE ist nur das erkrankte Tier zu schlachten und zu verbrennen. ad c): Die Kantone entschädigen die Tierverluste und tragen Kosten für Untersuchungen und Verbrennen der Tierkörper. Nachkommen von BSE Kühen müssen bezeichnet werden (Ohrtätowierung "BSE"; Exportverbot). BVet verschärft Einfuhrbedingungen für Futtermittel tierischer Herkunft. Die Interkantonale Kontrollstelle für Heilmittel (IKS) entscheidet über Restriktionen bei der Medikamentenherstellung. Zum Beispiel wurden 1991 10 Medikamente wegen zu grossem Risiko aus dem Handel gezogen. ad d) "Sofortmassnahmen": Sind nach dem 1. Dezember 1990 geborene Tiere betroffen (sogenannte BAB-Fälle), so werden alle Tiere der Rindergattung des Bestandes eliminiert. ad e) "Anpassung": Wirbelknochen von Kühen (>18 Monate) sowie von Schafen und Ziegen (>6 Monate) sind von der menschlichen Ernährung ausgeschlossen. Alle umgestandenen Klauentiere müssen gemeldet werden. Obligatorium der Lebenduntersuchung für alle Betriebe. ad f) "UP BSE": seit 1999 laufendes, zeitlich befristetes Programm; es werden alle verendeten, getöteten und notgeschlachteten Kühe sowie eine Stichprobe von ca. 13'500 normal geschlachteten Kühen mit dem Prionics-Check® Test untersucht (siehe Labordiagnose). ad g) Ersatz der Herdenkeulung durch Kohortenkeulung ad h) Allgemeines Tiermehlverbot: Verfütterungsverbot von Tiermehlen und Extraktionsfetten an alle Nutztiere. Verfütterungsverbot von Fischmehl an Wiederkäuer. Verbot von Import und Export von Fleischabfällen sowie daraus hergestellten Zwischenprodukten. ad i) Änderungen im Schlachtprozess: Pressluftbetäubung und "Rüteln" verboten. Seite 153 Kapitel, Prionen, BSE ad j) "UP TSE": Von Juli 2004 bis Juli 2005 wird neu auch ein Überwachusprogramm TSE bei kleinen Wiederkäuern durchgeführt. Untersucht werden alle Schafe mit zwei oder mehr Schaufeln, die geschlachtet oder getötet wurden oder umgestanden sind. Alle Ziegen, die umgestanden sind oder nicht zur Fleischgewinnung getötet wurden sowie möglichst viele Schlachtziegen, die > 12 Monate alt sind werden auf freiwilliger Basis mit einbezogen. Massnahmen in der EU 3 1994: Verfütterungsverbot von Fleischmehlen an Wiederkäuer (Schweiz: 1990) 1996: Mindestparameter für die Behandlung von Tierabfällen (Schweiz 1993) 2000: Entfernung der Risikoorgane aus der menschlichen Ernährungskette (Schweiz: seit 1990!!) 2001: Allgemeines Tiermehlverbot Die BSE wurde 1985 zum ersten Mal in Grossbritannien beobachtet und 1986 als SE erkannt. Seit 1986 massive Ausbreitung der BSE in ganz Grossbritannien. Durch Export von Tieren bzw. Fleisch-/ Knochenmehl ist die BSE auch in verschiedene andere Länder weiterverbreitet worden, allerdings in verhältnismässig geringem Ausmass. Seit 1994 statistisch signifikanter Rückgang der BSE Fälle in England. Zurückzuführen auf den anfangs 1989 in Kraft getretenen "feed-ban" für Wiederkäuerprotein. Geschichte BSE in Grossbritannien Stand 11. September 2002 in Tausend 40 30 "feed-ban" 20 10 0 1984198519861987198819891990199119921993199419951996199719981999200020012002 Fälle 0 0.004 0.016 0.644 2.185 7.13614.17925.01334.71836.2723.94414.2988.016 4.311 3.235 2.157 1.326 1.202 0.687 Aptiva\BSEnews.PR4 3 Quelle: NZZ vom 22. Januar 2001, Seite 10 sowie http://www.admin.ch/bvet (BSE) Seite 154 Kapitel, Prionen, BSE Verbreitung Grossbritannien (inkl. Schottland, Nordirland und Inseln): von 1986 bis 14. Oktober 2005 wurden 184'124 Fälle registriert. Einführung des "feed-ban" am 8. Juli 1988. Rückgang der Anzahl gemeldeter Fälle pro Woche von 670 (Juni 1993) auf 39 (Durchschnitt 1999). Inzidenz: Milchviehherden 53.3%, Mast/Aufzuchtherden 14.7%, insgesamt 33.8%. (Bei ca. 85% der Verdachtsfälle wird BSE bestätigt.) 2003: 549 Fälle, bis Juli 2004: 158 Fälle. Aus der obenstehenden Abbildung (Quelle: BVet) geht die Gesamtzahl der BSE Fälle hervor sowie das Jahr, in dem in verschiedenen Ländern bislang erstmals BSE gemeldet wurde. Deutschland meldete bis Mitte 2000 nur gerade 6 Fälle von BSE, wobei allein Importtiere betroffen waren. Aufgrund der Importzahlen hätten allerdings 243 Fälle bei Importtieren registriert werden müssen. Deutschland und andere europäische Länder mussten deshalb schwere Vorwürfe der Briten wegen "underreporting" entgegennehmen. Der erste "native" BSE-Fall bei einem deutschen Rind im Herbst 2000, der zudem zeitgleich mit dem ersten Verdachtsfall von vCJD bei einem Deutschen Staatsbürger auftrat, erzeugte deshalb einen handfesten Skandal. Bis Juli 2001, also innerhalb von 6 Monaten, stieg die Anzahl diagnostizierter Fälle auf 87. Stand Oktober 2005: 351 gemeldete Fälle. Seite 155 Kapitel, Prionen, BSE Schweiz. Die Jahresstatistik für 2005 belief sich bis zum 14. Oktober auf 3 Fälle. Zwischen Ende November 1990 und 14. Oktober 2005 wurden 458 Fälle gezählt. Die höchste Zahl an BAB-Fällen wurde beim Jahrgang 1994 entdeckt, gefolgt vom Jahrgang 1995. Mit dem UP Programm wurden zwischen 1999 und Oktober 2005 insgesamt 85 BSE positive Tiere entdeckt. Die freiwilligen Untersuchungen von privater Seite brachten bislang 22 Fälle zu Tage. Trotz aller Gegenmassnahmen wurden mehrfach Fälle mit Geburtsjahr von 1996 oder jünger registriert. BSE Schweiz Stand 16. August 2002 Sofortmassnahmen 500 400 300 420 TiermehlUP99 verbot "feed-ban" Anpassung 200 63 100 1 0 15 9 68 29 45 38 50 14 33 42 13 0 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 Summe bsenews.pr4 Stand 14. Oktober 2005: Total 458 Fälle. Erreger s. Scrapie "Virusvermehrung und Genexpression" s. Scrapie Epidemiologie Nach dem Auftreten der BSE in Grossbritannien wurden dort grosse Anstrengungen unternommen, um die Herkunft dieser neuen Krankheit herauszufinden. In Betrieben, in denen BSE auftrat, wurden minuziöse Datenerhebungen gemacht und mittels Computersimulationssystemen ausgewertet. Einziges gemeinsames Merkmal aller Betriebe: Verfütterung von Fleisch-/Knochenmehl als Kraftfutterzusatz. Zusammen mit der typischen Symptomatik fiel der Verdacht auf eine Kontamination dieses Futters mit dem Scrapie-Erreger. Folgende Ereignisse unterstützten diesen Verdacht: Seite 156 Kapitel, Prionen, BSE • Die Schafpopulation in GB stieg in den 70er Jahren stark an - und damit auch die Scrapiefälle. • Die Kadaver der toten Tiere konnten nicht mehr begraben werden (Beschränkung der Wasenplätze), weshalb sie der Verwertung zu Fleisch-/Knochenmehl zugeführt wurden. • Zur selben Zeit wurde die Aufarbeitungsmethode insbesondere die Fettextraktionsmethode - abgeändert, was u.a. die Folge hatte, dass die Masse nicht mehr gleich stark erhitzt wurde. So gelangten also zum einen mehr Scrapieerreger in das Material und zum andern wurden diese ungenügend inaktiviert. Folge: es konnte eine orale Übertragung auf das Rind stattfinden. Nach Überwinden der Speziesbarriere kam es dann in den ersten Jahren zu einem eigentlichen Recycling des "Rinder-adaptierten Scrapie-Erregers", da die an BSE erkrankten Kühe zunächst auch in die Wiederverwertung kamen. Eine neuere Hypothese geht allerdings davon aus, dass BSE spontan im Rind entstanden und direkt in den Fleisch/Knochenmehl-Kreislauf gelangt sei. Offen bleibt die Frage, ob das Rind grundsätzlich ein Endwirt ist, oder ob eine horizontale und/oder vertikale Übertragung vorkommen könnte. Gemäss bisheriger Beobachtungen könnte eine vertikale Übertragung tatsächlich vorkommen. Die Wahrscheinlichkeit nimmt gegen Ende der Trächtigkeit sogar zu. Hinweise dafür liefern neben wissenschaftlichen Studien auch die sogenannten BAB-Fälle (Born after Ban: Geboren nach der Einführung des "feed-ban"). Andererseits wurden in der Schweiz BAB-Fälle vermehrt auf Betrieben festgestellt, in denen neben Rindern auch Schweine gehalten wurden. Bekanntlich galt der "feed ban" bis Ende 2000 nicht für die Fütterung von Schweinen! Hinweise auf horizontale Übertragung gibt es nicht (Zunahme der Anzahl Fälle in GB hätte anders verlaufen müssen). Bislang war nur ein einheitlicher BSE-Stamm bekannt (siehe verschiedene Stämme bei Scrapie). Kürzlich wurden jedoch "atypische" BSE Fälle in Frankreich, Italien und Japan beschrieben. Die entsprechenden Tiere waren klinisch unauffällig und wurden mittels staatlicher Überwachungsprogramme erfasst. Mittels biologischer und biochemischer Untersuchungen fand man heraus, dass die Erreger der Fälle in Frankreich Ähnlichkeiten zum Scrapieerreger aufwiesen, während die Erreger der italienischen Fälle eher dem klassischen CJD Erreger glichen. Letzteres widerspiegelte sich auch in der Histopathologie, wo man bei den betroffenen Tieren typische Plaques (wie bei CJD) anstelle der für BSE typischen Vakuolen fand. Diese Fälle werfen neue Fragen zum Ursprung der BSE auf. Seite 157 Kapitel, Prionen, BSE BSE als Zoonose. In GB traten erstmals 1996 bei jungen Menschen (<40 Jahre alt, anstatt >50 Jahre, wie bei klassischer CJD) eine neue Variante der Creutzfeldt-Jakob Krankheit (vCJD) auf, von der angenommen wird, dass sie aufgrund einer genetischen Disposition durch den BSE-Erreger verursacht wird. Bis Mitte 2004 wurden circa 160 solcher Fälle bekannt, 150 in England sowie Einzelfälle in Frankreich, Irland und Italien. Bei den Betroffenen wurde eine genetische Disposition festgestellt (M129V). Es wird vermutet, dass die Übertragung durch Konsum von Lebensmitteln, die Rinderhirn enthielten, stattgefunden hat. Aufgrund eines Falles im Jahre 2003 wird auch die Übertragung von Mensch zu Mensch via Bluttransfusion nicht mehr ausgeschlossen. Als Risikoorgane (Erreger darin nachgewiesen) gelten: Gehirn, Rückenmark inklusive Wirbelknochen und Ganglien, Thymus, Milz, Därme von > 6 Monate alten Tieren (= Schlachtabfälle); beim Zerlegen sichtbares Lymph- und Nervengewebe, sowie Lymphknoten (= Metzgereiabfälle). Die folgende Tabelle fasst nähere Angaben zusammen. Risikoorgane Risikoorgane BSE Vademecum 16.10.1998 Hoher Anteil an Infektiosität Hirn, Augen, Rückenmark, spinale Lymphknoten, dura mater (Rd), Hypophyse (Rd), Schädel- (Rd), Wirbelknochen, Lungen, Milz (Schaf, Ziege) Mittlerer Anteil Magen- Darmtrakt, Tonsillen, Milz (Rd), Plazenta, Uterus, foetale Gewebe, Nebennieren, Zerebrospinalflüssigkeit, Lymphknoten Geringer Anteil Leber, Pakreas, Thymus, Knochenmark, andere Knochen, Nasenschleimhaut, periphere Nerven Keine Infektiosität nachgewiesen Skelettmuskeln, Herz, Nieren, Milch, Fettgewebe, Speicheldrüsen, Speichel, Eutergewebe, Schilddrüse, Ovarien, Hoden, andere Geschlechtsdrüsen, Knorpel, Bindegewebe, Haut, Haar, Blutkoagula, Serum, Urin, Kot, Galle Seite 158 Kapitel, Prionen, BSE Sofern nicht anders angemerkt sind die Organe von Rind, Schaf und Ziege gemeint. Zum Teil sind einzelne Gewebe, z.B. Wirbelknochen, in eine höhere Risikostufe eingereiht, weil eine Kontamination beim Schlachtprozess möglich ist. Die Lunge ist erwähnt, weil bei der Betäubung der Schlachttiere Hirnmaterial aspiriert werden könnte. Infektiosität nicht nachgewiesen bedeutet, dass Mäuse mit 10 bis 100 mg Gewebe intrazerebral inokuliert wurden und danach nicht erkrankten. Neuere Untersuchungen deuten darauf hin, dass die BLymphozyten eine wichtige Rolle bei der Pathogenese spielen. Aus diesem Grund ist die Plazierung der Blutkoagula umstritten. Desinfektion s. Scrapie. Anpassung 1998: Zur sicheren Inaktivierung von BSE Material wird empfohlen, eine Temperatur von 140°C bei 3.6 bar während 30 Minuten einzuhalten. (Bis dato lautete die Empfehlung: 133°C, 3 bar, 20 Minuten.) Pathogenese Kenntnisse noch unvollständig. Die mittlere Inkubationszeit beim Rind beträgt 4 Jahre. Es wird angenommen, dass die Scrapie-Pathogenese auch für BSE zutrifft. Ein wichtiger Unterschied: bisher konnte der BSE-Erreger in der Plazenta nicht nachgewiesen werden (cave Scrapie: Plazenta hochinfektiös!). Histopathologie Abbildung links. Immunhistologische Darstellung von PrionProtein in einer schwammartig veränderten Läsion im Gehirn. Solche Läsionen kommen meist in der grauen Substanz, bilateral und symmetrisch vor. Betroffen sind oftmals Hirstammregionen. Die dunkel angefärbten Bezirke enthalten massenhaft PrionProtein. Von der zytoplasmatischen Vakuolisierung sind besonders Neuronen betroffen. Cave: atypische Fälle in Italien! Seite 159 Kapitel, Prionen, BSE Klinik Die Krankheit verläuft nach einer sehr langen Inkubationszeit progressiv (über Monate) und endet immer tödlich. Symptomatik -> drei ineinander überfliessenden Phasen: 1. Ängstlichkeit, Überempfindlichkeit, leichtgradige Koordinationsstörungen. 2. Zunahme der Verhaltensstörungen (Schreckreaktionen, Ausschlagen, ev. Aggression). 3. Zunahme der Bewegungsstörungen ( (Inkoordination, Muskelzittern, Umfallen). Allgemein können Abmagerung und Milchrückgang beobachtet werden; z.T. auch Juckreiz. Symptomatik ist sehr individuell! Immunreaktion keine! Prophylaxe Expositionsprophylaxe (s. Fütterung) Diagnose s. Scrapie Differentialdiagnosen Erwachsene und ältere Tiere Magnesiummangel u.a. Stoffwechselstörungen, sowie Alterserscheinungen; Jungtiere: v.a. andere ZNS-Infektionen, z.B. Listeriose, Tollwut, Borna; Traumata und angeborene Abnormalitäten. Bei Verdacht s. Scrapie Untersuchungsmaterial s. Scrapie Labordiagnose Histopathologie s. Scrapie. In der Schweiz zugelassene Diagnostiktests: • Prionics-Check® Test: Westernblot • Platelia BSE: ELISA Aktuell Informationen zu BSE und anderen Prionenkrankheiten sind auch auf dem Internet erhältlich, z.B. http://www.bvet.admin.ch/ oder http://www.vetvir.unizh.ch/bse99/frame_bse.html Seite 160 Kapitel, Prionen, Scrapie SCRAPIE Autoren: Monika Engels, Mathias Ackermann File Info: nw8000:\Vorlesung\Portrats0405.doc SCRAPIE Traberkrankheit, Tremblante (frz.) Progressiv verlaufende Erkrankung des Zentralnervensystems, die mit spongiformen Veränderungen einhergeht. Daher die Bezeichnung transmissible spongiforme Enzephalopathie (TSE). Scrapie kommt vor allem bei Schafen, gelegentlich auch bei Ziegen vor. Besonderheiten Infektions- und Krankheitsverlauf: Sehr lange Inkubationszeit (durchschnittlich 4 Jahre); Krankheitsverlauf progressiv und immer tödlich; Infektion verursacht keine Entzündungsreaktionen; es werden keine Antikörper produziert. Erreger: ist äusserst resistent gegenüber den meisten Desinfektions-/Inaktivierungsmethoden; es handelt sich um ein unkonventionelles infektiöses Agens (kein Virus im klassischen Sinn); Hypothese: Prion; Gen für Prionprotein ist wirtseigen -> Infektionskrankheit, die unter genetischer Kontrolle steht (Vererbbarkeit). Antigenverwandtschaft: s. Priontheorie; verschiedene "Scrapiestämme" können aufgrund ihres unterschiedlichen biologischen und pathologischen Verhaltens unterschieden werden. Staatliche Massnahmen: s. BSE; seit 1. Dezember 1990 gelten die "Sofortmassnahmen gegen die spongiforme Enzephalopathie der Wiederkäuer". Änderung der Tierseuchenverordnung vom 29. Nov. 1993. Bei Auftreten von Scrapie wird der gesamte Bestand gekeult; 2-jährige Zuchtsperre. Im Juli 2004 wurde ein zeitlich befristetes Überwachungsprogramm TSE bei kleinen Wiederkäuern eingeführt. Details und weitere Massnahmen s. BSE. Ü Scrapie als Erkrankung der Schafe ist in Europa schon seit über 200 Jahren bekannt. Erster echter Übertragungsversuch von infiziertem Schafhirn auf andere Schafe und der Nachweis der Filtrierbarkeit des Erregers gelang 1936 (Cuillé und Chelle). Der Scrapie-Erreger ist der bestuntersuchte SEErreger. Seite 161 Kapitel, Prionen, Scrapie Andere SEs: (siehe auch unter folgendem Internet Link: http://www.vetvir.unizh.ch/bse99/frame_bse.html ) • Beim Menschen Kuru (Entdeckung 1957 bei einem Volksstamm in Papua-Neuguinea - 1966 Übertragbarkeit und Scrapie-Ähnlichkeit bewiesen); Creutzfeldt-Jakob Krankheit (CJK oder CJD; Beschreibung anfangs Jahrhundert durch Creutzfeldt bzw. Jakob - unabhängig voneinander; 1968 Übertragbarkeit und ScrapieÄhnlichkeit bewiesen), Gerstmann-SträusslerScheinker-Syndrom (GSS; als Variante der CJK bekannt geworden; vererbbar!); familiäre fatale Insomnie (seit kurzem als Prionerkrankung erkannt). Neue Variante der Creutzfeldt-Jakob Krankheit (nvCJD) mit grosser Wahrscheinlichkeit handelt sich dabei um die zoonotische Form der BSE beim Menschen. • Beim Tier: Transmissible Nerzenzephalopathie (TNE; 1947 erstmals in einer Nerzfarm in Wisconsin USA beobachtet; später weitere Ausbrüche in Kanada und Finnland); "Chronic wasting disease" (CWD; chronische Verfallskrankheit bei Elch- und Hirscharten - erstmals 1978 in Colorado USA beobachtet); bovine spongiforme Enzephalopathie (BSE; bekannt seit 1986 in Grossbritannien); feline spongiforme Enzephalopathie (Hauskatzen und bisher 1 Puma, England; Juli 2001: erste Katze in der Schweiz) und SE bei verschiedenen Wildwiederkäuerarten in englischen Zoos (seit wenigen Jahren - nach Auftreten der BSE). Im Juli 2004 erkrankte weltweit erstmals nachweislich ein Zebu an einer TSE (Basler Zoo). Verbreitung Fast weltweit; In Europa seit langem endemisch in England, Frankreich, Irland, Island; Einzelfälle in letzter Zeit in Deutschland, Norwegen, ehem. Tschechoslowakei, Israel, Schweiz (letzter Fall im Juli 2004 im Kanton Zürich). Frei von Scrapie sind heute Australien und Neuseeland (intensive Bekämpfungverfahren in 50er Jahren). Erreger Unkonventionell; 2 hypothetische Agentien: Virino bzw. Prion (Prionen werden allgemein als wahrscheinlicher betrachtet). Def.: 1. Virino = unkonventionelles Virus; Nukleinsäure vorhanden, aber sehr klein und nicht translatiert, umgeben von zelloriginärem Protein. 2. Prion = kleine, infektiöse Proteinpartikel, resistent gegen Inaktivierung durch Nukleinsäure-zerstörende Behandlungen; enthalten eine abnorme Isoform eines zellulären Proteins, die ein wichtiger und notwendiger Bestandteil des infektiösen Partikels ist (abnorm = Protease-resistent). Priongen (Hamster; nach Prusiner): Seite 162 Kapitel, Prionen, Scrapie Exon I Exon II Intron ORF 5' DNA ORF An mRNA 2 Exons, 1 Intron (ca. 10kb); ORF (open reading frame, offener Leseraster) liegt ganz auf Exon II und kodiert für ein 254 Aminosäuren-Protein; durch Splicing wird Intron ausgeschnitten und es kommt zur Verbindung zwischen der ca. 60 - 80 Nukleotide langen Leadersequenz (5') und der eigentlichen kodierenden Sequenz. Transkription zu 2.1 kb PrP-mRNA (Konzentration nimmt im Verlauf der Scrapie-Infektion nicht zu!). Prionprotein (PrPc): X SiS X GPI S-S C SiS: Signalsequenz; X: Stellen für N-glykosidische Bindungen; S-S: intramolekulare Disulfidbrücke (Cysteinreste an Codons 179 und 214) --> Schleife, die auch die Oligosaccharide enthält; GPI: Glykosyl-Phosphatidylinositol Anker --> wird angehängt nach Abspaltung der C-terminalen 20 Aminosäuren (schraffiert); <--C: Abspaltung des N-terminalen Anteils, Rest = Protease-resistentes PrPsc (ohne Protease-Behandlung aber wie PrPc). Die 3D- Struktur Prionproteine von Maus, Hamster, Mensch und Rind wurde inzwischen entschlüsselt. "Virusvermehrung und Genexpression" Prion-/Virino-Hypothese; Schema modifiziert nach Weissmann: Molecular Biology of Prion Diseases, Trends in Cell Biology (1994), pp10-14. Normale Zelle Prion-infizierte Zellen PrP Gen PrP Gen PrP mRNA PrPc PrP Gen PrP mRNA PrP mRNA PrPc PrPc PrPsc “crystal” “Protein only” Prion-spezifische Nukleinsäure Virino Virino Modell Seite 163 Kapitel, Prionen, Scrapie Abbildung. Modell zur Vermehrung des Scrapie Agens: (a) Normales PrPc wird in einer Zelle synthetisiert, an die Oberfläche transportiert und metabolisch umgesetzt. (b) Das "Protein only" Modell setzt voraus, dass PrPsc und PrPc identisch sind. Exogene Prionen verursachen die Umwandlung von PrPc in PrPsc. Dies geschieht vermutlich im Innern der Zelle, wobei PrPsc zu kristall-ähnlichen Strukturen aggregiert. Für die Umwandlung in die krankhafte Isoform wird u.a. die Mitwirkung eines "Protein X" (Chaperone?) postuliert. (c) Das "Virino" Modell geht davon aus, dass sich das infektiöse Agens mit einer Scrapie-spezifischen Nukleinsäure assoziiert bzw. dass diese in PrPsc eingepackt wird. Diese Nukleinsäure vermehrt sich dann in der infizierten Zelle und assoziiert erneut mit PrPc, wobei dieses in PrPsc umgewandelt wird. Abbildung. Zwei Modelle zur Bildung von infektösem PrPsc. Das "Refolding"-Modell nach Prusiner (oben) geht davon aus, dass bereits ein einzelnes PrPsc Molekül einer infektiösen Einheit entspricht. Das "Seeding"Modell nach Gajdusek (unten) hingegen nimmt an, dass erst die Anhäufung von PrPsc die Infektiosität vermittelt. (Aguzzi, Bioworld 6, 15, 2000) Epidemiologie Scrapie kann endemisch vorkommen und kann sowohl horizontal als auch vertikal übertragen werden (im Gegensatz vermutlich (s.BSE) - zu andern SEs). Wege: vertikal v.a. während/nach Geburt via Plazenta und Fruchtwasser; horizontal v.a. durch Auffressen der hochinfektiösen Plazenta bzw. Fressen von kontaminiertem Gras. Trächtige Auen und Ziegen scheiden den Erreger schon vor der Geburt aus. Übertragung auch via kontaminiertes Futter (z.B. Fleischmehl; evtl. Heu). Genetische Prädisposition (siehe Pathogenese). In den letzten Jahren wurden in Europa vermehrt "atypische" Scrapie Fälle beobachtet. Aufgrund von Hirnanalysen gehört auch der jüngste Fall in der Schweiz dazu. Während Scrapie normalerweise mehrere Tiere einer Herde erfasst, tritt die atypische Form nur bei Einzeltieren auf. Es wird postuliert, dass es sich bei dieser Art Scrapie allenfalls um BSE handeln könne. Bisher wurde BSE bei Schafen und Ziegen in Form einer natürlichen Infektion noch nie nachgewiesen, experimentell ist sie jedoch auf Schafe übertragbar. Die neuen Überwachungsprogramme sollen auch dieser Frage nachgehen. Seite 164 Kapitel, Prionen, Scrapie Desinfektion Alle üblichen Methoden vermögen den Erreger nicht (vollständig) zu inaktivieren. Empfohlen wird: Dampfautoklavieren mind. 30 Min. bei 140°C und 3.6 bar; Räume etc. desinfizieren mit NaOH 4% bzw. Natriumhypochlorit 2% (Javellewasser) bei Einwirkzeit von mind. 1 Stunde (dabei zu beachten: eher Verdünnungs- als Inaktivierungsprozess; Metalle -> Korrosion). Pathogenese Hinweise für Priongen als Grundlage der SE's: • bei Maus und Schaf entdeckt: ein "Inkubationszeitkontrollierendes Gen" (Sinc-Gen bei Maus, Sip-Gen bei Schaf), das Einfluss hat auf die Länge der Inkubationszeit • Resistenz, wenn Inkubationszeit natürliche Lebenszeit überdauert. Nach heutigem Kenntnisstand ist sinc/sipidentisch mit dem PrP-Gen; ausserdem typische Mutationen im PrP-Gen. • Typische Mutationen im PrP-Gen auch bei familiärer CJK, GSS, familiärer Insomnie. • Transgene Tiere : 1. Mäuse mit Hamster PrP-Gen -> verhalten sich bei Scrapie-Infektion wie Hamster; 2. Mäuse mit humanem PrP-Gen, das GSS-Mutation enthält -> spontane Erkrankung; 3. Mäuse ohne PrP-Gen -> erkranken nach exp. Infektion nicht! Die Versuche mit transgenen Tieren lassen vermuten, dass: • die Empfänglichkeit durch die Homologie zwischen aufgenommenem Prion und wirtseigenem Priongen mitbestimmt wird und • das Vorhandensein natürlicher Mengen an zellulärem Prionprotein für die Erkrankung essentiell ist. Die normale Aufnahme des Erregers geschieht vermutlich oral. Gemäss entsprechender Versuche mit Labortieren (Maus, Hamster) werden zunächst die lymphatischen Gewebe des Pharynxbereichs besiedelt; von da Weiterverbreitung in Lymphknoten, Milz und lymphatische Gewebe des Darmes. In Milz u.a. lymphatischen Geweben Vermehrung des Erregers. Weiterverbreitung, vermutlich unter Hilfestellung der BLymphozyten, via Nervenbahnen ins Rückenmark und Hirn, wo die eigentliche Vermehrung des Erregers stattfindet. Seite 165 Kapitel, Prionen, Scrapie Abbildung. Modell des Transportes von PrPsc von der Peripherie ins Gehirn. (Aguzzi, Nature Medicine 7, 289, 2001) Die Rolle der B-Lymphozyten in dem Geschehen scheint darin zu bestehen, dass sie durch Ausschüttung von Lymphotoxin die Reifung von follikulären dendritischen Zellen (fDC) stimulieren. Reife fDC ihrerseits beherbergen Prionen. Vermutlich findet die Prionenvermehrung in den lymphoiden Geweben auch zur Hauptsache in fDC statt. Diesen kommt wohl eine Rolle als Langzeitreservoir für zirkulierende Prionen zu. Abbildung. Modell zur Komplement-abhängigen Aufnahme von PrPsc und anderen TSE-Agentien in die fDCs (FDC). Komplement Faktoren binden ans TSE-Agens, worauf die entstandenen Komplexe werden mit Hilfe der Komplement-Rezeptoren (CR) aufgenommen werden. Das Modell geht weiter davon aus, dass PrPsc sich in den fDCs vermehrt, von diesen weiter ans periphere Nervensystem, z.B. Nervus splanchnicus, gereicht werden und auf diesem Weg langsam das Zentralnervensystem erreichen. (Cardone und Pochiari, Nature Medicine 7, 411, 2001) Seite 166 Kapitel, Prionen, Scrapie Kürzlich wurde diese Theorie weiter unterstützt durch die Erkenntnis, dass das Fehlen von Komplementkomponenten bzw. Rezeptoren die Erkrankung stoppen oder zumindest verzögern kann. Dies kann durch die Vermutung erklärt werden, dass normalerweise Prion-Komplement-Komplexe via Komplementrezeptoren von den fDC aufgenommen werden. Cave: Nachweis des infektiösen Agens nur via experimentelle Infektion von Versuchstieren mit Testmaterial (z.B. Hirnsuspension) von kranken Tieren möglich. Nachweis von sc PrP im Gewebe ist auch mittels Immunhistochemie möglich. Kürzlich wurde mittels experimenteller Übertragung auf Mäuse und direkter immunhistochemischer Analyse der Scrapie Erreger auch in Muskelgewebe von Schafen nachwiesen. Die Konzentration war im Vergleich zum Gehirn etwa 5'000 mal geringer. Dieser Befund erfordert erweiterte Analysen der pathogenetischen Vorgänge und allenfalls weitere Anpassungen der Bekämpfungs- und Vorsorgemassnahmen. Klinik Verlauf subakut bis chronisch; progredient; mit dem Tod endend. a)Verhaltensstörungen: Unruhe, Erregbarkeit, starrer/unruhiger Blick, Ohrenzittern. b) Bewegungsstörungen: abnorme Kopfhaltung, Traben, plötzliches Niederstürzen, Muskelzittern. c) Sensibilitätsstörungen: starker Juckreiz (typisch), dadurch Scheuern und Vliesverlust; "gnubbern" (Lippenspiel, reflexartig). d) Allgemeinstörungen: Gewichtsverlust und Leistungsabfall (bei lang dauernder Krankheitsphase). Immunreaktion keine! Mögliche Erklärung durch Priontheorie: Prionprotein ist nicht "fremd". Prophylaxe Expositionsprophylaxe: keine Verfütterung von Tiermehlen; keine Importe aus Ländern, in denen Scrapie endemisch ist. Diagnose Verdachtsdiagnose bei entsprechenden Symptomen; unterstützt durch Art des Futters, der Haltung, Importe etc. Differentialdiagnosen andere ZNS-Infektionen (Borna, Tollwut); Trauma; Stoffwechselstörungen Bei Verdacht Meldung an Kantonstierarzt. Auf dessen Anordnung hin wird das erkrankte Tier abgesondert und weiter beobachtet oder geschlachtet (Diagnose nur am toten Tier möglich!). Untersuchungsmaterial (gemäss Anweisung) an eines der beiden Untersuchungslabors: 1. Institut für Tierneurologie der Vetsuisse Fakultät Bern 031 631 2525; 2. Institut für Veterinärpathologie der Vetsuisse Fakultät Zürich 044 625 8584. Seite 167 Kapitel, Prionen, Scrapie Untersuchungsmaterial Hirn (Einsendung des Kopfes nach Anweisungen des Bundesamts für Veterinärwesen). Labordiagnose Histologische Untersuchung des Hirns (pathognomonisch) -> typische spongiforme Veränderungen (Vakuolisierung in Neuropil der grauen Substanz und Neuronen), Nervenzelldegeneration, Astrozytose in bestimmten Hirnregionen. Abklärungen dauern wegen aufwendigem Fixationsverfahren des Hirns mehrere Wochen. Weitere Methoden siehe BSE. Ansätze zur Frühdiagnostik Da bisher die Diagnose nur am toten Tier und nur gegen Ende der Inkubationszeit gestellt werden kann, sind weltweit Bestrebungen im Gang, Tests für eine Frühdiagnose, möglichst am lebenden Patienten zu entwickeln. Zu den versprechenden Ansätzen gehören: • Urin: kürzlich wurde eine abnorme PrP Isoform im Urin infizierter Hamster, Kühe und Menschen entdeckt. Bei intrazerebral mit Scrapie infizierten Hamstern war das Protein auch lange vor Krankheitsausbruch nachweisbar. • PMCA (protein-misfolding cyclic amplification): ähnlich wie DNA Moleküle in der PCR werden mit dieser Methode PrPsc Moleküle und deren Aggregate spezifisch im Reagenzglas zur Vermehrung gebracht. Damit lassen sich kleinste Mengen abnormer PrP Isoformen nachweisen. • SIFT (scanning for intensely fluorescent targets): Die normale Isoform PrPc hat nur eine Bindungsstelle für fluoreszierende Antikörper gegen PrP. An von PrPsc gebildete Agglomerate hingegen binden viele Antikörper, was eine verstärkte Fluoreszenz hervorruft. • PrPsc, nicht aber PrPc haftet an Plasminogen, welches an Magnetkügelchen gebunden ist. • EDFR (erythroid differentiation-related factor): die Expression dieses Faktors scheint nach der Infektion mit einem SE-Erreger signifikant abzusinken. Dies ist im Blut messbar. Seite 168 Kapitel, Retroviren, CAE Retroviren CAE Autorin: Monika Engels File Info: TPT22:\Vorlesung\Portrats0203.doc CAE Caprine Arthritis - Enzephalitis; "dicke Knie" ("Big Knee") CAE ist ein Krankheitskomplex, der Ziegen jeden Alters betrifft. Bei Jungtieren steht eine Enzephalitis im Vordergrund, die durch eine progressive Parese / Paralyse gekennzeichnet ist. Bei erwachsenen Ziegen äussert sich die Infektion vor allem in Form von chronischer Arthritis und Mastitis. Besonderheiten Infektion von Zellen des Immunsystems (s. Pathogenese). Horizontale und vertikale Übertragung; am wichtigsten ist die vertikale Übertragung via Milch, was für eine erfolgreiche Prophylaxe bzw. Bekämpfung sehr günstig ist (s. Prophylaxe). Lange Inkubationszeit von Monaten bis Jahren; chronischprogrediente Krankheit, über Monate bis Jahre; unheilbar. Antigenverwandtschaft: Mit dem Maedi-Visna-Virus der Schafe: Kreuzreaktion stark; Nachweis von Antikörpern gegen CAEV kann mit Maedi-Visna-Antigen erfolgen. Gewisse Antigenverwandtschaft auch mit HIV und EIAV (Virus der equinen infektiösen Anämie), ohne jedoch zu immunologischen Kreuzreaktionen zu führen. Staatliche Massnahmen: Seit 1. Januar 1998 ist die CAE eine auszurottende Tierseuche im Sinne der Tierseuchenverordnung. Geschichte Die CAE wurde beschrieben als Carpalgelenk-Arthritis, Encephalomyelitis granulomatosa, Visna bei der Ziege u.a., erstmals in der Schweiz (1959), gefolgt von Deutschland (1969) und den USA (1974). Der Erreger wurde 1980 als nicht-onkogenes Retrovirus identifiziert. Verbreitung Weltweit mit regionalen Unterschieden; Durchseuchungsrate zum Teil bis 80%. Situation in der Schweiz: In den 1980er Jahren wurde eine seroepidemiologische Untersuchung durchgeführt. Es wurde eine durchschnittliche Durchseuchungsrate von 83% ermittelt. Ein Drittel der infizierten Ziegen zeigten eines oder mehrere der typischen Krankheitsbilder. Zu verzeichnen waren auch verminderte Durchseuchungsraten im Kanton Tessin (< 20%) und bei Ziegen der Walliser Schwarzhalsrasse (ca. 7%). Seite 169 Kapitel, Retroviren, CAE Trotzdem besteht keine Rassenprädisposition. Betroffen waren Tiere aller Altersklassen. In den untersuchten Beständen fand man 0 -100% seropositive Tiere (nur 10% aller Bestände waren frei von der Infektion). Die Enzephalitis ist selten, obwohl eine Häufung dieser Krankheitsform in einzelnen Beständen beobachet wurde. Dank der staatlichen Massnahmen und des Sanierungsprogramms des Ziegengesundheitsdienstes ist die Verbreitung in der Schweiz auf circa 1% gesunken. Erreger Das CAE-Virus ist ein Vertreter der Lentiviren in der Familie Retroviridae. Es ist ein behülltes Virus mit einem Durchmesser des Virions von 80 - 120 nm. Morphologisch unterschiedlich zu EBLV: keulenförmiges anstatt icosahedrales Kapsid. Genom: ssRNA in 2 identischen Molekülen, positive Polarität. Die Anordnung der Gene ist typisch für Retroviren: 5’-gagpol-env-3’. Sogenannte Zusatz- oder Hilfsgene (viv, tat, rev) sind zwischen pol und env lokalisiert, jedoch kein Onkogen (vgl. Porträt von EBL). CAEV ist eng verwandt mit dem Maedi-Visna Virus. Heute spricht man deshalb eher von Lentiviren der kleinen Wiederkäuer, mit den Prototypen CAEV und MVV. In beiden Gruppen existieren verschiedene Varianten. Die Homologien verteilen sich auf dem Genom unterschiedlich: Auf der Aminosäure Ebene beträgt die Homologie der gag-pol Genprodukte um die 75%, im Bereich der Hüllenproteine (env) nur circa 60%. Die Gene für interne Proteine sind sich also ähnlicher als das Hüllenglykoprotein-Gen. Dieses weist Gewebs (Wirts)Spezifität auf (Ausknospung aus infizierter Zelle). Viren der CAE Gruppe haben ein enges Wirtsspektrum und sind nicht cytopathogen. Das Genom kodiert für folgende Proteine: 1. Wie alle Retroviren: a) gag (Gruppen-spezifische Antigene): Matrixprotein (p15), inneres Coreprotein (p25, Hauptstrukturprotein; ca. 75% des Cores), RNA-assoziiertes Protein (p14). b) pol (Gen für Polymerasen u.a. Enzyme): Reverse Transkriptase, Endonuklease/Integrase, Protease. c) env (Hüllenproteine): Regulatorisches Protein (p19), Peplomerprotein (gp 130, Trimer), Transmembranprotein (gp40). 2. Zusätzliche Gene bei Lentiviren: Seite 170 Kapitel, Retroviren, CAE d) vif (für "viral infectivity factor", ein das pol-Gen überlappender offener Leseraster): ein Protein, das Zusammenbau und Ausschleusung der Viren beeinflusst und für die Infektiosität notwendig ist. tat (transaktivierender Faktor, der Genexpression stimuliert) rev Regulator der für den Transport der viralen mRNA zu den Ribosomen wichtig ist. Ein weiterer offener Leseraster ist zuständig für die negative Regulation der Genexpression. Das CAEV ist in der Aussenwelt labil. Erhitzen auf 56°C inaktiviert das Virus innert 10 Minuten. Es muss jedoch berücksichtigt werden, dass eher infizierte Zellen als freie Viren ausgeschieden werden. Die Zellen sind widerstandsfähiger. Virusvermehrung und Genexpression Der Replikationszyklus sowie die einzelnen Schritte der Virusvermehrung sind im wesentlichen gleich für alle Vertreter der Familie Retroviridae (s. BLV). Zell-Rezeptoren für die Virusadsorption sind kaum bekannt; Ausnahme: für HIV (humanes Immundefizienzvirus) dient das CD4-Molekül zusammen mit CCR5 als Rezeptor. Quelle der Graphik: Dr. Rober Doms. Epidemiologie Virusausscheidung in Sekreten und Exkreten; meist Zellassoziiert. Die wichtigsten Ansteckungsquellen sind Kolostrum/Milch und Samen. Horizontale und intrauterine (vertikale) Übertragung sind möglich, jedoch von untergeordneter Bedeutung. In manchen Beständen sind bis 100% der Tiere infiziert. Dies wird unterstützt durch die persistente Infektion mit lebenslänglicher Virusausscheidung, durch den subklinischen Verlauf über lange Zeit und durch Verabreichung von Kolostrum/Milch infizierter Ziegen. Die Virusaufnahme erfolgt oronasal bzw. genital. Hauptwirt ist die Ziege. Schafe können experimentell infiziert werden; ob eine natürliche Übertragung der Infektion von der Ziege auf das Schaf erfolgen kann bzw. ob das Schaf evtl. ein zweites Virusreservoir darstellen könnte steht zur Diskussion. Neuere Beobachtungen weisen auf eine solche Möglichkeit hin. Andere Wirtsspezies gibt es nicht. Seite 171 Kapitel, Retroviren, CAE Desinfektion Pathogenese Geeignet sind übliche Desinfektionsmittel; z.B. Detergentien / Seifenlösungen, phenolische und quaternäre AmmoniumVerbindungen, Formalin und Hypochlorit. Blutstrom Gewebe Makrophage Monozyt Monozyten Lymphozyten Chemotaxis Fc-Fragment Fc-Rezeptor Lymphozyt Provirus Entzündung Zytokine Nicht-neutralisierende Antikörper Lymphokine Immunsystem Im Gefolge der oronasalen Ansteckung steht eine persistente Infektion im Vordergrund. Diese beruht vor allem auf drei Eigenschaften des CAEV: 1. Integration des Provirus ins Wirtszellgenom. 2. Bevorzugte Replikation in Makrophagen. 3. Es werden i.d.R. nur nicht-neutralisierende Antikörper induziert. Alle diese Faktoren führen zu der chronisch-produktiven Infektion, da das Virus zumindest der humoralen Immunantwort entgeht. Den Schädigungen hingegen liegen vorwiegend immunpathologische Vorgänge zugrunde. Mechanismen: a) Persistenz: Monozyten / Makrophagen verhalten sich wie "Trojanische Pferde". Zunächst erfolgt eine Infektion der lokalen Makrophagen im oronasalen Bereich. Die Makrophagen tragen die Viren in die regionalen Lymphknoten, von wo sie dann im Organismus verbreitet werden. Im Blut kommt es zur Infektion von Monozyten, in denen jedoch keine Virusreplikation stattfindet (Latenz in proviraler Form über längere Zeit möglich). Erst nach der Auswanderung der Monozyten in die Gewebe und der Reifung zu Makrophagen wird Virus produziert. Die Viren können sich auch direkt von Zelle zu Zelle ausbreiten und auf diesem Weg das Immunsystem umgehen. Freie Viren werden von nicht-neutralisierenden Antikörpern gebunden und erleichtern so die Infektion neuer Monozyten/Makrophagen (Eintritt via Fc-Rezeptor).Virus wird in verschiedenen geschädigten Geweben gefunden; vermutlich sind es jedoch auch da die Makrophagen, in denen sich das Virus repliziert. Seite 172 Kapitel, Retroviren, CAE b) Schädigung: Das CAEV ist selbst nur schwach zytopathogen, deshalb kommt es nicht zu einem typischen ADE (vgl. Porträts zu FIP und ASP). Es sind vorwiegend immunpathologische Vorgänge, die zu chronischen, entzündlichen Läsionen führen. Einerseits können durch die Infektion Funktionen der Monozyten/Makrophagen verändert werden. Andererseits scheint aber vor allem die zellvermittelte Immunantwort eine wesentliche Rolle zu spielen. Beobachtungen: in den geschädigten Organen/Geweben bestehen die Läsionen vor allem in Infiltration und Proliferation von mononukleären Zellen, sowie Nekrosen bei den Gewebs-eigenen Zellen (z.B. Oligodendroglia, Synovialzellen). Da eine medikamentell verursachte Immunsuppression zur Verminderung der Schäden führt, wird angenommen, dass die Viren mit den Monozyten zu ihren Zielorganen gelangen und dort die lokalen Zellen infizieren. Diese Zellen exprimieren Virusantigen auf ihrer Oberfläche, dies induziert eine zellvermittelte Immunantwort, die ihrerseits Gewebsschädigung verursacht. Klinik Chronisch progredienter Verlauf. Das klinische Bild ist sehr unterschiedlich; auch der Schweregrad der jeweiligen klinischen Manifestation. Lentivirusinfektionen sind gekennzeichnet durch sehr lange Inkubationszeiten (Monate bis Jahre). Im wesentlichen gibt es vier klinische Manifestationen der CAEV Infektion: 1. Arthritis: in >90 % aller Fälle; erkrankte Tiere einjährig oder älter; Leitsymptom: "dicke Knie"; Beginn meist mit Verdickung und Anfüllung der Bursa praecarpalia, diffuse Gewebszubildung, evtl. Flüssigkeitsansammlung im Gelenk und in den Sehnenscheiden. Lahmheit erst im Spätstadium deutlich. Dann auch Abmagerung und Milchleistungsabfall trotz gutem Appetit. 2. Enzephalitis: in <10% aller Fälle; betroffen sind Gitzi im Alter von ca. 2-4 Monaten; bei Erwachsenen sehr selten. Zu Beginn Schwäche und Koordinationsstörungen, später Lähmung der Hintergliedmassen, danach auch der Vordergliedmassen, was zum Festliegen führt. Bis zum Endstadium sind die Tiere jedoch munter und zeigen Appetit. Dauer der Krankheit ca. 1-3 Wochen; partielle Erholung wird gelegentlich beobachtet. 3. Mastitis: wird selten als solche bemerkt; auffallend ist jedoch eine schlechte Milchleistung während ganzer Laktationszeit, wobei die Milchqualität allerdings i.d.R. nicht verändert ist. 4. Pneumonie: ganz selten, aber möglich. Seite 173 Kapitel, Retroviren, CAE Immunreaktion Bei experimenteller Infektion erscheinen Virus-spezifische, nicht-neutralisierende Antikörper nach einigen Wochen. Die Titer fluktuieren mit der Zeit, aber sie persistieren lebenslänglich. Es handelt sich zum grossen Teil um IgG1, mit Spezifität für das innere Coreprotein (p25). Lokal können in geschädigtem Gewebe ebenfalls Antikörper nachgewiesen werden, es ist aber nicht bekannt, ob es sich dabei evtl. um Immunkomplexe handelt, die eine Rolle im Krankheitsprozess spielen könnten. Antikörper werden auch im Kolostrum und mit der Milch ausgeschieden (aber: diese sind nichtneutralisierend!). Wie erwähnt, führt die zellvermittelte Immunantwort zu den Schädigungen. Anhand des in vitro Lymphozyten-Proliferations-Testes konnte gezeigt werden, dass die Proliferationsaktivität mit dem Auftreten der Enzephalitis bzw. Arthritis zusammenfällt. Prophylaxe Infektkette unterbrechen; am erfolgreichsten ist die Trennung von neugeborenen Zicklein von der Mutter und Aufzucht mit Kuh-Kolostrum/Kuhmilch in einer vollständig abgetrennten Herde. Für die Zucht nur CAEV-freie Böcke verwenden. In der Schweiz bestand seit 1985/86 ein freiwilliges Sanierungsprogramm. In einigen Kantonen waren alle Ziegenhalter involviert. Seit 1998 ist das Programm in der Schweiz obligatorisch. Es besteht in der serologischen Überwachung sowie der Ausmerzung von infizierten Tieren und der getrennten Aufzucht der Neugeborenen mit Kuhmilch. Impfung ist sinnlos (s. Immunreaktion und Pathogenese). Diagnose Verdacht bei Auftreten von typischen Symptomen, inklusive Leistungsabfall, Abmagerung ohne andere Symptome. Da jedoch die Infektion über lange Zeit subklinisch verläuft, werden infizierte Tiere oft nur über gezielte serologische Untersuchungen erfasst. Differentialdiagnosen Arthritis: Vitamin E -Mangel, septische Arthritiden, Trauma; Enzephalitis: Scrapie, Listeriose, Toxoplasmose, Borna, Polioenzephalomalazie. Bei Verdacht Blutprobe einsenden; Untersuchungslabor und virologische Beratung: Institut für Veterinär-Virologie der Vetsuisse Fakultät Bern 031 631 2505. Untersuchungsmaterial Für Virusnachweis (nicht routinemässig!): Synovialmembran (krankes Gelenk), Leukozyten. Für Antikörpernachweis: Blut (Serum) Seite 174 Kapitel, Retroviren, CAE Labordiagnose Virusnachweis: wird routinemässig nicht durchgeführt, da sehr langwierig und nur im positiven Fall aussagekräftig. Virus kann aus Explantatkulturen von Synovialmembranen oder aus Leukozyten erkrankter Tiere, in Kokultur mit gesunden caprinen Synovialzellen, isoliert werden. Antikörpernachweis: mittels ELISA; Antigen = MaediVisna-Antigen. Bestätigungstest: Westernblot. Zu beachten: Zwischen Infektion und Serokonversion können bis 8 Wochen verstreichen! Ausserdem gibt es Tiere, die nie deutlich serokonvertieren (Resultat im Bereich "fraglich"). Seite 175 Kapitel, Retroviren, EBL EBL Autor: Martin Schwyzer File Info: TPT22:\Vorlesung\Portrats0203.doc EBL (BLV) Enzootische Bovine Leukose Die enzootische bovine Leukose (EBL) ist eine persistente, meist langsam verlaufende Viruskrankheit der Rinder. Sie äussert sich in einer lymphatischen Leukämie (Blutkrebs), die in ein Lymphosarkom (Lymphknoten-Tumor) übergehen kann. Besonderheiten Das Virus wird fast nur via infizierte Zellen übertragen, d. h. durch direkten (Verletzungen) oder indirekten (Instrumente, gebrauchte Spritzen) Blutkontakt zwischen Tieren. Die Durchseuchungsrate in CH ist entsprechend niedrig (<0.1%; "EBL-frei" gemäss EU-Kriterium). Durch Identifikation und Ausmerzung seropositiver Tiere und durch Beachtung hygienischer Grundsätze sollte sich Europa ohne grosse wirtschaftliche Verluste von der EBL befreien können. Geschichte Erste Beschreibungen lymphatischer Leukämie bei Rindern um 1870 in Deutschland, von wo aus die Krankheit allmählich zunahm und sich weltweit verbreitete. Erst 1972 gelang der Nachweis des Erregers und dessen experimentelle Übertragung auf Versuchstiere. Erreger Die EBL wird durch ein Rinder-spezifisches Retrovirus, das bovine Leukosevirus (BLV) verursacht (Familie Retroviridae, Genus Deltaretrovirus (früher BLV-HTLV Retrovirus). Behülltes Virus, 80-120 nm, mit Peplomeren bestehend aus Transmembran-Glykoprotein (gp30) und daran verankertem Oberflächen-Glykoprotein (gp51). Genom einzelsträngige RNA positiver Polarität, bestehend aus zwei Segmenten mit identischer Basensequenz (je 8,400 Nukleotide), je flankiert von LTR (long terminal repeat). Genom verpackt in ikosaedrischem Nukleokapsid unter Beteiligung von drei Proteinen (p15, p24, p12) sowie einer viralen Protease (p14). Die Retrotranskriptase (RT), kombiniert mit RNaseH und Integrase, ist ein essentieller Bestandteil des Virions. Der Aufbau eines typischen Retrovirus ist unten skizziert. Seite 176 Kapitel, Retroviren, EBL Genstruktur: Zusätzliche Gene bei Lentiviren, z.B. CAE. LTR gag pol env x LTR env (envelope) SU (Surface) gp51 TM (Transmembrane) gp30 gag (group specific antigens) MA (Matrix) CA (Capsid) NC (Nucleocapsid) PR (Protease) p15 p24 p12 p14 pol(polymerase) RT (Reverse transcriptase) bindet Innenseite der Hülle Kapsidprotein bindet RNA Protease zur Spaltung von gag und gag-PR-pol Polyproteinen 70 kDa RNA- und DNA-abhängige DNA Polymerase Entfernung der RNA nach DNA-Synthese Integration der DNA ins Zellgenom RNaseH IN (Integrase) gemeinsam mit RT 30 kDa X (regulation) tax rex R3 G4 34-38 kDa 16-19 kDa 6-8 kDa 17 kDa Oberflächen-Glykoprotein, an TM verankert Transmembran-Glykoprotein, in Hülle eingelassen Transkriptions-Aktivator Export viraler mRNA Funktion noch unbekannt Onkogenes Potential im Schaf Seite 177 Kapitel, Retroviren, EBL Subtypen Nicht bekannt. Verwandtschaft mit humanen Retroviren HTLV-I und HTLV-II. Virusvermehrung und Genexpression Vermehrung vorwiegend in B-Lymphozyten. Adsorption an ein dem Clathrin verwandtes Rezeptorprotein. Penetration und Uncoating sind bei BLV wenig studiert worden. BLV adsorbiert via gp51-Spike an B-Lymphozyten; das Nukleokapsid gelangt durch Fusion oder Endozytose ins Zytoplasma; die RNA wird in den Kern transportiert. Dort beginnt der entscheidende Schritt: RT synthetisiert auf RNAVorlage komplementären DNA-Strang, wobei eine zelluläre transfer-RNA als Primer eingesetzt wird. RNaseH (H=Hybrid) entfernt die ursprüngliche RNA, und RT ergänzt die DNA zur Doppelhelix. Integrase sorgt für Einbau der DNA in Zellchromosomen an zufälligen Stellen. Der Einbau wird gefördert durch repetierte Enden LTR (long terminal repeat). Die eingebaute DNA, Provirus genannt, bleibt in der Zelle und kann sich mit ihr teilen. Normale Transkription (BLVmRNA) und Translation (BLV-Proteine) durch Zelle. 5' LTR dient als Transkriptionspromoter für die in der Tabelle oben angegebenen Genprodukte gag, pol, env und X. 3' LTR kann als Promoter für zufällig benachbarte zelluläre Gene dienen (mögliche Erklärung für Tumorbildung). Zusammenbau: je 2 BLV-mRNA-Moleküle (samt Poly A) werden zusammen mit Enzymen in neue Nukleokapside verpackt. Ausschleusung durch Knospung an der Zellmembran ohne Zellzerstörung. Pathogenese Durch direkten oder indirekten Blutkontakt werden persistent infizierte B-Lymphozyten von Tier zu Tier übertragen. Die knospenden BLV-Partikel infizieren neue B-Lymphozyten. Infektion von T-Zellen und Monozyten ist in geringerem Mass ebenfalls möglich. In den Fällen, die zu persistenter Lymphozytose und Tumorbildung progredieren, infiltrieren die Lymphozyten verschiedene Organe (Lymphknoten, Milz, Leber etc.). Mit der abnormen Vermehrung der B-Lymphozyten geht auch eine erhöhte Antikörperproduktion einher. Die virusspezifischen Ak binden im Blutstrom freie Viruspartikel. Diese Immunkomplexe können sich an den Gefässwänden ablagern und durch die Bindung von Complement zu einer Immunkomplexkrankheit führen. Seite 178 Kapitel, Retroviren, EBL Retrovirus RNA: Replikation (vereinfacht) 1) 5'LTR Virion RNA 3'LTR (links und rechts neues DNAje ein halber LTR) Stück 3' tRNA 3' 2) Abbau der RNA 3' 3) 3' 3' RNA-Zirkularisierung und Verschiebung der DNA zum anderen LTR 4) Synthese der MinusStrang-DNA durch RT 3' Abbau der RNA durch RNaseH ausser neben LTR (als Primer für neues DNA-Stück) 3' 5) 3' 6) bis 9) 5' Wiederholung der Schritte 2) bis 5) für Abbau der RNA-Primer und Synthese der Plus-Strang-DNA 5'LTR neue ds DNA 3'LTR 3' 10) 5' (links und rechts je ein ganzer LTR) Integration ins Zellgenom durch IN Seite 179 Kapitel, Retroviren, EBL Klinik Inkubationszeit Monate bis Jahre; Symptome zunächst wenig apparent, rund die Hälfte der Tiere bleibt asymptomatisch. Zuerst auffällig sind Inappetenz, Leistungsminderung, ev. Augenverfärbungen oder Exophthalmus wegen Wachstum der orbitalen Lymphknoten. Persistente Lymphozytose (bei über 2 Jahre alten Tieren sind Lymphozytenzahlen unter ca. 7,000 pro µl als normal, über ca. 10,000 pro µl als leukotisch zu betrachten). Milz- und Leberschwellungen. Immunkomplexkrankheiten als Spätfolge. Lediglich bei 0.1% bis 10% der infizierten Tiere bilden sich nach längerer Zeit Lymphosarkome. Starke Vergrösserung der Lymphknoten ist überall möglich und ruft je nach Lage verschiedene Beschwerden hervor (Atmung, Verdauung, Herzfunktion etc.). Die Krankheit führt - falls überhaupt so lange zugewartet wird - zum Tod der betroffenen Tiere. Immunreaktion Obwohl B-Lymphozyten infiziert sind, ist die Antikörperproduktion kaum beeinträchtigt. Umgekehrt vermögen die Antikörper die Virusproduktion auch nicht zu hemmen. Charakteristisch für BLV ist also eine starke Antikörperproduktion gleichzeitig mit chronischer Virusausscheidung. Dies kann zu Immunkomplexkrankheiten führen. Die Antikörper ermöglichen aber auch eine sichere Identifikation infizierter Tiere. Epidemiologie Horizontale und vertikale Übertragung. Neben der erwähnten Übertragung durch infiziertes Blut (Spritzen, rektale Palpation, Enthornen) ist auch die transplazentare Infektion möglich (ca. 15% der Fälle) sowie vaginale Ansteckung (hauptsächlich Natursprung) und Übertragung durch Insekten (nur in den Tropen). Im Prinzip stellt auch die künstliche Besamung ein Risiko dar, besonders bei Verwendung unverdünnten Frischsamens. In CH schliessen gute Kontrollen diesen Übertragungsweg praktisch aus. Verbreitung Weltweit verbreitet, niedrige Prävalenz, die aber von Land zu Land stark variieren kann. CH galt bis 1989 als EBL-frei; eine Untersuchung von 250,000 Rindern ergab dann 55 EBLpositive Tiere in 23 Beständen und lieferte den Anreiz für ein erfolgreiches Bekämpfungsprogramm. Seite 180 Kapitel, Retroviren, EBL Diagnose Neben klinisch eindeutigen EBL-Fällen sind immer auch asymptomatische Virusträger zu erwarten. Der Antikörpernachweis ist deshalb für die Diagnose unerlässlich. Bis vor kurzem war der AgargelImmunodiffusionstest (Leukassay B Pitman-Moore) vorgeschrieben, er wird jetzt zunehmend durch ELISA ersetzt (Chekit Rinderleukose Bommeli). Tiere bis 6 Monate können maternale Antikörper aufweisen. Von gesetzlicher Seite vorgeschrieben ist, dass auffällig vergrösserte Lymphknoten, die bei der Schlachtung festgestellt werden, auf EBLV untersucht werden. Differentialdiagnosen u. a. Tuberkulose, Aktinomykose, Nekrobazillose, Höhenkrankheit. Vermutlich ebenfalls nicht durch BLV hervorgerufen wird die sporadische bovine Leukose (beim Kalb, betrifft vor allem den Thymus). Desinfektion BLV ist wie alle Retroviren labil und durch die üblichen Desinfektionsmittel leicht zu inaktivieren. Die Übertragung ist allzu oft dem völligen Verzicht auf Hygiene zuzuschreiben. Prophylaxe Ein Impfstoff existiert nicht und wäre auch nicht sinnvoll, da die Ausmerzung eine viel bessere Bekämpfungsmöglichkeit darstellt. Impfung von Schafen mit rekombinantem gp51 wurde beschrieben (Tiermodell für anvisierte Impfung des Menschen gegen HTLV-I und -II, Schafe entwickeln nach experimenteller Infektion mit BLV häufiger Tumoren als Rinder). Therapie nicht sinnvoll. Staatliche Massnahmen In vielen Ländern sind Tilgungsprogramme im Gang. Für Importe werden Zertifikate über EBL-Freiheit verlangt. CH: In Verbindung mit dem Stichprobentest auf IBR (siehe Kapitel Herpes) werden Tiere auch auf EBL geprüft. Auffällig vergrösserte Lymphknoten, die bei der Schlachtung festgestellt werden, müssen obligatorisch auf EBLV untersucht werden. In positiven Fällen muss der Herkunftsbestand weiter untersucht werden. Seropositive Tiere werden ausgemerzt und der Halter entschädigt. Seite 181 Kapitel, Retroviren, EIA EIA Autorin: Monika Engels File Info: TPT22:\Vorlesung\Portrats0203.doc EIA Equine Infektiöse Anämie Virus Vorkommen Empfänglichkeit Klinik Retroviridae, Genus: Lentivirus weltweit, regional verschieden Equiden Verlauf akut, subakut, chronisch, inapparent Inkubationszeit 5-30 Tage akut: hohes Fieber, Apathie; Anämie, Thrombozytopenie; subakute Oedeme; Abmagerung typisch: Verlauf in Krankheitsschüben, die mit der Zeit zum Tod führen Hämorrhagien, blasse Schleimhäute; vergrösserte Organe (Milz bis 10x vergrössert); Glomerulonephritis Pathologie Pathogenese Varianten Selektionsdruck Eintrittspforte Nächster Schub Nicht-neutralisierende Ak: Virus-Ak-Komplexe (Virus infektiös!) Neutralisierende Ak: Virusinaktivierung Genesung • • • • Immunität • • • Virämie (zell-assoziiert) Makrophagen Lymphozyten Immunantwort Verbreitung im Organismus (Gewebe-Makrophagen, Sekrete, Exkrete) Virus: Affinität zu Lymphozyten, Makrophagen; lebenslängliche Zell-assoziierte Virämie; Viren verbreiten sich im ganzen Organismus und können auch in verschiedenen Geweben persistieren; Viren in Zellen verschiedener Sekrete und Exkrete Schübe: Varianten durch Selektionsdruck Persistenz: Integration des Virusgenoms Anämie: • Virus-Ec-Antikörper-Komplexe -> Phagozytose und Complementbindung • Knochenmarksuppression Thrombozytopenie: wie Anämie Glomerulonephritis: Immunkomplex-Ablagerungen begrenzte Wirkung (s. Varianten) Seite 182 Kapitel, Retroviren, EIA • maternale Antikörper via Kolostrum (Schutz: nur bedingt!) Epidemiologie • • Reservoir: infizierte Pferdepopulation Übertragung: 1. blutsaugende Insekten (mechanisch!) 2. direkter oder indirekter Kontakt • ev. vertikal (transplazentar oder Kolostrum/Milch) • iatrogen Diagnose Antikörpernachweis: Agargeldiffusionstest (Coggins-Test), ELISA Kontrolle • • Endemiegebiete: serologische Kontrolle und Ausmerzung Expositionsprophylaxe; serologische Kontrolle (Handel, Reisen); Quarantäne Seite 183 Kapitel, Retroviren, FeLV FeLV Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc FeLV Katzenleukose, Felines Leukosevirus Die Katzenleukose ist eine der wichtigsten Infektionskrankheiten unserer domestizierten Katzen. Sie betrifft Katzen aller Altersgruppen und kann mit den unterschiedlichsten Symptomen und Verlaufsformen einhergehen. Die Inkubationszeit kann sehr lange andauern. Tritt die Krankheit aber einmal auf, so ist eine ungünstige Prognose zu stellen. Besonderheiten Horizontale und vertikale Übertragung. Der wichtigste Übertragungsweg (direkt und indirekt) geht über den Speichel. Die verschiedenen Wege der vertikalen Übertragung sind im Hinblick auf die Prophylaxe wichtig. Rolle scheinbar gesunder Katzen als Dauerausscheider. Infektionsverläufe: Entwicklung einer Immunität; persistente Infektion; latente Infektion. Primäre und sekundäre Infektionsfolgen sind von Bedeutung. Hervorragende Impfstoffe sind verfügbar. Geschichte Im Jahre 1964 erfolgte erstmals die Beschreibung von Retroviren bei Hauskatzen mit Lymphosarkomen. 1973 wurde FeLV mittels Immunfluoreszenz in Blutzellen infizierter Katzen nachgewiesen. In den 1980iger Jahren wurden erste Impfstoffe entwickelt. Gentechnologische Methoden führten dann zur Entwicklung von sehr gut wirksamen Vakzinen. Verbreitung Weltweit. Situation in der Schweiz: Weit verbreitet mit regionalen Unterschieden. Besonders Katzenheime und grössere Zuchtbetriebe sind stark betroffen. Erreger FeLV gehört zum Genus Gammaretrovirus und hat die Morphologie der "Typ C Retroviren der Säugetiere". Typische Morphologie mit nur schwach erkennbaren Spikes an der Oberfläche und einem zentral gelegenen dichten Core. Der Zusammenbau der Virionen geschieht an der Zelloberfläche, zeitgleich mit dem "budding". Man unterscheidet 3 Subtypen von FeLV, nämlich A, B und C. Subtyp A weist typischerweise kein echtes Onkogen im retroviralen Genom auf. Während der langen Inkubationszeit kann es aber zu Rekombinationen mit zellulären Protoonkogenen kommen, z.B. myc, wodurch Subtyp B FeLV entstehen. Diese sind mit einem hohen Risiko zu Lymphosarkomen assoziiert. Seite 184 Kapitel, Retroviren, FeLV Mutationen in der hypervariablen Region des env-Gens führen zur Entwicklung von Subtyp C FeLV, welche vorwiegend in Zusammenhang mit spezifischen Anämien gefunden werden. Weitere Informationen im Porträt über EBL sowie in der Beilage Taxonomie und Familienalbum. Das FeLV ist in der Aussenwelt labil. Freies Virus kann selbst unter besten Bedingungen nicht länger als 3 Tage infektiös bleiben. Virusvermehrung und Genexpression Vgl. Porträt EBL. Epidemiologie In der Natur zirkulieren fast ausschliesslich Subtyp A FeLV Stämme. Treten in bestimmten Zuchten oder Heimen jedoch andere Subtypen auf, so kann es auch damit zur Ansteckung kommen. • Horizontale Übertragung: Ausscheidung im Speichel persistent infizierter Katzen. Direkte Übertragung mit Biss sowie bei intensivem sozialem Kontakt bei der Fellpflege. Indirekte Übertragung geschieht vor allem mit kontaminierten Trink- und Fressgefässen. • Vertikale Übertragung: Transplazentar oder mit der Milch; Fellpflege der Kätzchen durch das Muttertier. Das Virusreservoir ist in scheinbar gesunden, persistent infizierten Katzen lokalisiert. Etwa 30% aller angesteckten Katzen entwickeln eine solche persistente Infektion. Je dichter die Katzenpopulation ist, desto erfolgreicher ist FeLV: Stadt > Land; Mehrkatzenhaushalt > Einzelhaltung Desinfektion Geeignet sind übliche Desinfektionsmittel; z.B. Detergentien / Seifenlösungen, phenolische und quaternäre AmmoniumVerbindungen, Formalin und Hypochlorit. Fress- und Trinkgeschirr unbedingt bei der Desinfektion mit einbeziehen. Pathogenese Im Gegensatz zu den meisten anderen Retroviren scheint FeLV durch das Immunsystem vollständig eliminiert zu werden. Dies stimmt natürlich so nicht. Es bleiben praktisch immer latent mit Provirus infizierte Zellen zurück, welche vom Immunsystem nicht erkannt werden können. Nach direkter Übertragung vermehrt sich das Virus zunächst in den Tonsillen und lokalen Lymphknoten. Nach wenigen Tagen erfolgt eine erste Virämie mit einer Vermehrung in mononukleären Zellen und einer Streuung der Infektion in die Milz, verschiedene Lymphknoten und lymphatisches Gewebe im Intestinaltrakt. Entscheidend ist die Infektion von Zellen des Knochenmarks, wo alle sich bildenden Blutzellen angesteckt werden können. Danach zirkuliert Virus andauernd im Blut und wird über Speichel und Urin ausgeschieden. Von der Ansteckung bis zur Wiederausscheidung von Virus dauert es in der Regel etwa 8 Wochen. Seite 185 Kapitel, Retroviren, FeLV Man unterscheidet drei unterschiedliche Verlaufsformen der Infektion, welche stark vom Alter und anderen Faktoren abhängig sind, z.B. Virusstamm, infektiöse Dosis, Immunstatus, genetische Faktoren: • Entwicklung einer Immunität: Etwa 40% der infizierten Katzen können die Infektion dank einer starken Immunreaktion fast vollständig überwinden. Der Anteil dieser Katzen steigt mit zunehmendem Alter bei der Erstinfektion. • Persistente Infektion: Etwa 30% der angesteckten Katzen bleiben persistent infiziert und scheiden dauernd Virus aus. Bis zu 80% der Welpen unter 16 Wochen werden persistente Virusausscheider. Bei den erwachsenen Katzen sinkt der Anteil unter 15%. In der Regel bricht die Krankheit bei diesen Katzen innerhalb eines Zeitraums von etwa 3.5 Jahren auf. • Latente Infektion: Etwa 30% der Katzen überwinden die Infektion nur scheinbar. Sie behalten die provirale Form des Virus latent in sich. Stress, Krankheit, Immunsuppression, etc. können nicht nur zu einer Reaktivierung und Wiederausscheidung von Virus führen, sondern auch die Krankheit auslösen. Klinik Mit FeLV assoziierte Krankheiten können sich äusserst unterschiedlich manifestieren. Häufig kommt es zu krebsartigen Erkrankungen, meist unter Beteiligung lymphatischer Gewebe, also Leukämie und Lymphosarkom. Oft kommt es aber auch zu Anämie, T-Zell Aplasie, Immundefizienz mit Folgekrankheiten, Enteritis, Reproduktionsstörungen. Typische Symptome für Katzenleukose sind: Bleiche Schleimhäute (Anämie), Gelbsucht, Abmagerung, Appetitlosigkeit, Diarrhöe oder Verstopfung, Blut im Kot, vergrösserte Lymphknoten, erhöhte Anfälligkeit für Atemwegserkrankungen, verminderte Vitalität, übermässiger Durst, zu häufiger Harnabsatz, Fruchtbarkeitsstörungen, Geburt lebensschwacher Welpen. Im Prinzip sollte bei allen chronischen Krankheitsverläufen mit an FeLV gedacht werden. Immunreaktion Bei gesunden, adulten Katzen kann eine sehr erfolgreiche Immunreaktion auftreten, die von einer starken Antikörperproduktion begleitet ist. Die meisten Antikörper sind gegen das Oberflächenglykoprotein gp70 und die Membranproteine p15E sowie p12E gerichtet. Interessanterweise treten nur in Ausnahmefällen Antikörper gegen das Hauptkapsidprotein p27 auf. Seite 186 Kapitel, Retroviren, FeLV Bei Katzen, die eine persistente Infektion entwickeln, ist die Immunreaktion deutlich abgeschwächt, manchmal sogar nur vorübergehend. Diese Tiere scheinen jedoch eine besondere Reaktion gegenüber p15E zu entwickeln. Die Bedeutung dieses Phänomens ist zur Zeit nicht klar. Prophylaxe Mit Hilfe von Kombinationen hygienischer Massnahmen und Impfungen kann FeLV erfolgreich bekämpft werden. Es existieren hervorragende Impfstoffe und Diagnostika. Ein positiver Antigennachweis von FeLV im Blut oder im Speichel von Katzen deutet auf das Vorliegen einer Virämie bzw. auf eine Virusausscheidung hin. Ob diese Virämie/Virusausscheidung vorübergehend oder andauernd ist, sollte unbedingt durch eine Wiederholung mit einer neuen, ein paar Wochen später erhobenen Probe abgeklärt werden. Ein negatives Resultat kann folgende Bedeutungen haben: 1. Bisher kein Kontakt mit FeLV gehabt. 2. Katze ist in der Inkubationszeit. 3. Katze ist zwar latent infiziert, aber immun und deshalb vorübergehend nicht virämisch. Sie hat also die Infektion soweit überwunden, dass nur noch ein minimales Risiko für die Ansteckung anderer Katzen besteht. Auch die Gefahr selbst zu erkranken ist damit geringer. Eine persistent FeLV virämische Katze ist als wandelndes Virusreservoir und Infektionsquelle für alle anderen Katzen zu betrachten. Eine solche Katze kann noch monate- oder jahrelang unbeschwert weiter leben. Man sollte sie jedoch unbedingt von anderen Katzen fernhalten (Quarantäne). Es sollten nur FeLV negative Katzen geimpft werden, obwohl die Vakzination einer positiven Katze normalerweise nicht schadet. Sie ist aber auch nicht in der Lage eine persistente Infektion zu terminieren. In der Schweiz sind zwei Arten "gentechnologischer" Subunit-Impfstoffe zugelassen. Die eine Art enthält von E. coli produziertes rekombinantes gp70. Die zweite Art wird unter bestimmten Bedingungen von Zellkulturen gewonnen, welche gp70 sezernieren. Therapie Leider sind heute noch keine wirksamen Therapeutika verfügbar. Experimentelle Arbeiten gaben jedoch schon Hinweise auf die Wirksamkeit von AZT und Interferon. Beim Auftreten von soliden Tumoren wurden auch schon Zytostatika erfolgreich eingesetzt. Versuche zur Reduktion empfänglicher Zellen mit Hilfe hoher Dosen von Kortikosteroid (induzierte Immunsuppression), hatten einen ungünstigen Effekt. Seite 187 Kapitel, Retroviren, FeLV Diagnose Verdacht bei Auftreten von typischen Symptomen, inklusive Leistungsabfall, Abmagerung ohne andere Symptome. Bei chronischen Krankheiten immer an Katzenleukose denken. Differentialdiagnosen Tumoren, Anämien, chronische Krankheiten anderer Genese. Immunsuppression infolge von FIV. Bei Verdacht Blut- oder Speichelproben für Antigennachweis entnehmen. Viele diagnostische Laboratorien bieten die Durchführung des Tests an. Es gibt jedoch auch recht zuverlässige Testkits für die Praxis. Untersuchungsmaterial Speichel, Vollblut, EDTA-Blut, Buffy coat, Serum, Tränenflüssigkeit für Antigennachweis. Labordiagnose Antigennachweis: kommerziell verfügbare ELISA verschiedener Hersteller. Auch erhältlich in Kombination mit einem Nachweis von Antikörpern gegen FIV. Seite 188 Kapitel, Retroviren, FIV FIV Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc FIV Felines Immundefizienz Virus, Felines Immunschwäche Virus FIV wurde 1986 in einem grossen Bestand von Findlingskatzen in Petaluma, Kalifornien erstmals entdeckt. Nachdem ein neues Tier in die Kolonie eingebracht worden war, litten mehrere Katzen über einen Zeitraum von vier Jahren hinweg an chronischen Darm- und Respirationstrakterkrankungen. Sie magerten ab und zeigten charakteristischerweise Gingivitiden. Es besteht keine Verwandtschaft zum HIV. Besonderheiten Die FIV-Infektion ist nicht mit einem klassischen Krankheitsbild im Sinne der Koch'schen Postulate assoziiert. Vielmehr führt FIV nach einer mehrere Jahre dauernden asymptomatischen Phase zu Immunschwäche und zum Tod durch opportunistische Infektionen. Geschichte In Petaluma konnte FIV aus 10 von 25 kranken, aber nur aus einer von 18 gesunden Katzen des Bestandes isoliert werden. Wurde Vollblut oder Plasma von kranken Katzen auf SPFJungkatzen intraperitoneal übertragen, so entwickelten diese nach einer Frist von vier bis sechs Wochen Lymphadenopathie, Leukopenie und vorübergehende Fieberschübe. Die Virusisolation erfolgte aus Blutlymphozyten und das Virus zeigte in vitro einen Tropismus für TLymphozyten. Zunächst wurde das Virus mit FTLV (Feline Tlymphotropes Virus) bezeichnet. Erst aufgrund einer besseren Charakterisierung erfolgte die Umbenennung in FIV. Verbreitung Weltweit. In der Schweiz sind etwa 1% der Hauskatzen mit FIV infiziert. Männliche Tiere sind zwei- bis dreimal häufiger betroffen als weibliche Tiere. Katzen mit Auslauf sind stärker gefährdet als reine Stubenkatzen. Erreger FIV gehört zum Genus Lentivirus der Familie Retroviridae. Es weist die typische Morphologie der Lentiviren auf und trägt prominente Spikes auf der Lipidhülle. Der Durchmesser des Viruspartikels beträgt ca. 120 nm. FIV besitzt ein ellipsoides Kapsid aus viralen Proteinen, welches die genomische RNA umschliesst. Die integrierte provirale DNA von FIV besteht aus 9472 Basenpaaren und kann in die drei Hauptabschnitte gag, pol und env gegliedert werden. Siehe auch Porträts CAEV und EBLV. Seite 189 Kapitel, Retroviren, FIV Wie andere Retroviren ist FIV in der Aussenwelt labil. Selbst bei Raumtemperatur erfolgt die Inaktivierung innerhalb von wenigen Minuten. FIV Genom und Proteine rev LTR gag p7 = NC p15 = MA p25 = CA pol p13 = PR p61 = RT p13 = IN p14 = PLP vif env LTR gp120 = SU gp41 = TM DarkwingG3:/…/FIV.ppt Legende zur Abbildung 1 (vgl. Auch Porträt CAEV): NC: Nukleokapsidprotein; MA: Matrixprotein; CA: Kapsidprotein; PR: Protease; RT: Reverse Transkriptase; IN: Integrase; PLP: Proteaseähnliches Protein; SU: Externe Komponente des Hüllproteins; TM: Transmembrankomponente des Hüllproteins. Virusvermehrung und Genexpression Vgl Porträt EBL. Epidemiologie Übertragung: Ausscheidung im Speichel virämischer Katzen. Wichtig sind aggressive soziale Interaktionen wie Beissen und Kämpfen. Ebenso muss an die iatrogene Übertragung gedacht werden. Eher selten kommt eine laktogene Übertragung vor, während die Ansteckung in utero offensichtlich keine Rolle spielt. Im Gegensatz zu HIV wurde die venerische Übertragung bislang nicht festgestellt. Das Virusreservoir ist in asymptomatischen Virusträgern lokalisiert. Desinfektion Geeignet sind alle üblichen Desinfektionsmittel. Pathogenese Die Mehrzahl der FIV infizierten Zellen sind lymphatischen Ursprungs. Bevor es zu klinischen Symptomen kommt, sind vor allem die T-Lymphozyten betroffen. Während der akuten Krankheit werden vermehrt auch infizierte Makrophagen festgestellt. FIV weist auch Neurotropismus auf, was zu Verhaltensänderungen bei der Katze führen kann. Die Infektion von Endothelzellen im Gehirn führt massgebend zu einer Störung der Blut-Hirn-Schranke. Seite 190 Kapitel, Retroviren, FIV Die längerfristigen Krankheitserscheinungen sind erklärbar durch einen progressiven Verlust der T-Zell-vermittelten Immunität. Bei der Virusvermehrung gehen insbesondere die CD4+ Zellen (Helfer T-Zellen) zugrunde, wodurch das CD4+:CD8+ Verhältnis der Lymphozyten ins Bodenlose fällt. Der Abfall der CD4+ Lymphozyten wird begleitet von einem Anstieg der CD8+ T-Zellen. Das B-Zell System bleibt mehrheitlich normal, sodass die Gesamtzahl der Lymphozyten über lange Zeit nicht vermindert erscheint. Aufgrund des Verlusts des CD4+-abhängigen Immunsystems bekommen opportunistische Erreger (Viren, Bakterien, Pilze, Protozoen, Ekto- und Endoparasiten) ihre Chance. Klinik Man unterscheidet in Anlehnung an HIV und AIDS fünf verschiedene Phasen der Infektion: • Akute Phase: Charakterisiert durch zyklische Neutropenie, Fieber und Lymphadenopatie (Wochen bis Monate). • Asymptomatische Carrier (AC) Phase: Symptomlos und kann Jahre andauern. • Persistierende, generalisierte Lymphadenopathie (PGL): Kann sich über Monate hinziehen. • AIDS-related complex (ARC): Gewichtsverlust, chronische Diarrhöe, Stomatitis, Gingivitis, Lymphadenopathie sowie chronische Erkrankungen des oberen Respirationstraktes und der Haut. Dauert Monate bis ein Jahr. • AIDS-ähnliche Phase: Symptome wie während ARC, zusätzlich: Auszehrung, Anämie oder Panzytopenie, opportunistische Infektionen. Abbildung 2. ARC einer Katze im Gefolge der FIV-Infektion. Seite 191 Kapitel, Retroviren, FIV Immunreaktion Innerhalb von vier bis sechs Wochen nach der Infektion kommt es zur Serokonversion. Es erfolgt keine sterilisierende Immunität. Etwa 5% der infizierten Katzen bilden Antikörper erst im Verlaufe von bis zu 14 Monaten. Kolostrale Antikörper werden auf die Welpen übertragen. Ihre Wirkung bezüglich Schutz vor einer Infektion ist jedoch unklar. Sie verschwinden wieder innerhalb von wenigen Wochen nach der Geburt. Prophylaxe Es gibt keine wirksamen Impfstoffe gegen FIV. Stubenkatzen sowie sehr friedliebende Tiere sind wenig gefährdet. Therapie Die Wirksamkeit von AZT konnte experimentell nachgewiesen werden. Es traten jedoch rasch FIV-Mutanten auf, die eine Resistenz gegenüber AZT aufwiesen. Ansonsten richtet sich die Therapie erstrangig gegen die opportunistischen Infektionserreger. Diagnose Verdacht bei Auftreten von ähnlichen Symptomen wie bei FeLV. Bei chronischen Krankheiten nicht nur an Katzenleukose sondern auch an FIV denken. Doppelinfektionen können besonders schwerwiegend verlaufen. Gefährdung des Menschen Es gibt keinen Hinweis darauf, dass FIV auf den Menschen übertragen werden kann. Bei Verdacht Es gibt recht zuverlässige Testkits für den Antikörpernachweis in der Praxis. Untersuchungsmaterial Vollblut, Serum, EDTA-Blut. Labordiagnose Antikörpernachweis: kommerziell verfügbare ELISA verschiedener Hersteller. Auch erhältlich in Kombination mit einem Nachweis von FeLV Antigen. Bestimmte Laboratorien bieten auch Western Blot sowie RIPA für zusätzliche Abklärungen in Spezialfällen an. Informationen http://www.lbah.com/Feline/fiv.htm http://www.poose.de/fiv/fiv.html Seite 192 Kapitel, Retroviren, Maedi Visna Maedi Autorin: Monika Engels File Info: TPT22:\Vorlesung\Portrats0203.doc MAEDI Maedi / Visna der Schafe Maedi / Visna ist - ähnlich der CAE - ein Krankheitskomplex bei Schafen. In > 90% der Fälle ist die Lunge betroffen (Maedi), bei < 10% das Zentralnervensystem (Visna). Chronische Mastitis kommt vor, wird aber selten bemerkt und chron. Arthritis kann, selten, vorkommen. Besonderheiten Sehr ähnlich der CAE der Ziegen, wobei die Symptomatik anders gewichtet ist, s. CAE: Arthritis >> Enzephalitis > Mastitis > Pneumonie. Maedi-Visna: Pneumonie >> Enzephalitis > Mastitis > Arthritis. Bei Maedi-Visna spielt die Übertragung via Milch zwar auch eine Rolle, Sekrete aus dem Respirationstrakt sind als Virusreservoir jedoch ebenso wichtig. Antigenverwandtschaft: Mit CAEV (s. dort). Staatliche Massnahmen: Keine; freiwilliges Programm in Planung. Ein Versuchsprogramm im Wallis führte zu einer Reduktion der Prävalenz von 36% auf 1%. Geschichte Wurde als progressive Pneumonie schon in den 1920er Jahren beschrieben (USA, Südafrika). Erforscht wurden die beiden Krankheitsformen vor allem in Island (von da stammen auch die Namen: Maedi = "schwere Atmung"; Visna = Verfall, Schrumpfung) von Sigurdsson, der davon die Theorie der "slow virus diseases" ableitete. Maedi wurde erstmals 1939, Visna sporadisch zwischen 1935 und 1951 in Island beobachtet. Durch intensive Keulungsmassnahmen konnte die Erkrankung in Island getilgt werden und tritt heute nur noch sehr selten auf. Seit den1960er Jahren wurde die Infektion in verschiedenen Ländern nachgewiesen. Verbreitung Weltweit mit regionalen Unterschieden. Kommt auch in der Schweiz vor: Eine seroepidemiologische Untersuchung zeigte eine durchschnittliche Seroprävalenz von 9% mit Schwankungen zwischen den Schafrassen von 0.4 bis 36%. Klinisch manifeste Infektionen wurden bisher in der CH nur selten beobachtet. Seropositive Auen zeigen jedoch eine tiefere Reproduktionsrate. Erreger Enge Antigenverwandtschaft zwischen CAEV und MVV (s. CAE). Viren der Maedi Visna Gruppen besitzen ein breites Wirtsspektrum und sind zytopathogen. Seite 193 Kapitel, Retroviren, Maedi Visna Virusvermehrung und Genexpression Epidemiologie s. CAEV Desinfektion s. CAE Pathogenese s. CAE. Auch bei Maedi / Visna spielen die Monozyten/Makrophagen als "Trojanische Pferde" die wichtigste Rolle. Lunge und Zentralnervensystem sind hier die hauptsächlichen Zielorgane; dabei dienen die Alveolärmakrophagen und die Mikroglia als Virusreplikationsort. Im Gegensatz zu CAE wird durch die MVV Infektion auch die Produktion von neutralisierenden Antikörpern (neben nicht-neutralisierenden) induziert. Diese sind jedoch sehr Stamm-spezifisch. Sie spielen vermutlich eine Rolle bei der Selektion von Antigenvarianten, die nicht neutralisiert werden können. Verschiedene Varianten können in einem Tier persistieren. Klinik Die Infektion ist durch eine sehr lange Inkubationszeit (einige Monate bis 5-6 Jahre) gekennzeichnet. In der Regel tritt kein Fieber auf. 1. Maedi: (90% der Fälle) Erstes Anzeichen ist Kümmern. Die Pneumonie äussert sich mit angestrengter Atmung als Kardinalsymptom; dazu kommen trockener Husten, leichter Nasenausfluss und starker Leistungsabfall. Bronchopneumonie infolge bakterieller Sekundärinfektion möglich. 2. Visna: (<10% der Fälle) Meist bei > 2 Jahre alten Tieren. Erstes Anzeichen ist ein unsicherer Gang, gefolgt von Ataxie vor allem in den Hinterbeinen. Charakteristisch ist ein rhythmisches, beidseitiges Einknicken. Es kommt zu einer progressiven Parese / Paralyse, die schliesslich zum Festliegen und zum Tod führt. Die Dauer ist sehr unterschiedlich: bei einigen Tieren tritt die Paralyse sehr rasch auf, bei andern kann sich die Krankheit über Monate oder sogar Jahre erstrecken. Die Schafe verlieren kontinuierlich an Gewicht, das Sensorium bleibt jedoch unbeeinträchtigt. 3. Mastitis: wird selten bemerkt; Milchrückgang; Milch grobsinnlich unverändert. Hinweise, dass eine gewisse Rassenprädisposition betreffs Empfänglichkeit und Schweregrad der Erkrankung besteht. • Als Hauptinfektionsquelle gelten infizierte Mutterschafe: vertikale Übertragung mit Kolostrum und Milch. Eine transplazentare Übertragung wird eher ausgeschlossen. • Wichtig bei Maedi: horizontale Übertragung durch direkten Tierkontakt ist ebenfalls möglich. Dies vor allem dann, wenn durch Haltungsbedingungen lang andauernde, enge Kontakte unvermeidbar sind. • Übertragung mit Samen wurde bisher nur ausnahmsweise beobachtet. • Hauptwirt ist das Schaf. Ziegen lassen sich experimentell infizieren. Eine natürliche Übertragung kann nicht ausgeschlossen werden. Seite 194 Kapitel, Retroviren, Maedi Visna 4. Arthritis: sehr selten. Immunreaktion s. CAE und Pathogenese Prophylaxe Expositionsprophylaxe (z.B. nur Zukauf negativer Tiere). Eradikationsprogamme (regelmässige serologische Untersuchung; Ausmerzen seropositiver Tiere). Diagnose Verdacht bei Auftreten von typischen Symptomen, inkl. Kümmern und Leistungsabfall. Differentialdiagnosen 1. Maedi: Lungenadenomatose (Erreger = Retrovirus; nicht verwandt mit MVV). 2. Visna: Scrapie, Borna, Aujeszky, Tollwut, Louping-ill. Bei Verdacht Untersuchungsmaterial einsenden; Untersuchungslabor und virologische Beratung: Institut für Veterinär Virologie der Vetsuisse Fakultät Bern 031 631 2505. Untersuchungsmaterial Für Virusnachweis (nicht routinemässig!): EDTA-Blut (Leukozytenfraktion, "buffy coat"). Für Antikörpernachweis: Blut (Serum). Labordiagnose Virusnachweis: wird selten gemacht, da langdauernd: Kokultivierung des "buffy coat" oder Alveolarmakrophagen mit Chorioidzellkulturen des Schafes. Virusinfizierte Makrophagen bilden Synzytien mit Schaffibroblastenzellen. Antikörpernachweis: mittels ELISA (s.CAE). Seite 195 Kapitel, Rindergrippe: PI-3/BRSV Rindergrippe PI-3/BRSV Autorin: Monika Engels File Info: TPT22:\Vorlesung\Portrats0203.doc PI-3 / BRSV "Rindergrippe"; shipping fever Es handelt sich um eine multifaktorielle Infektion des Respirationstraktes mit unterschiedlichem Schweregrad ("Grippe"). Spektrum von leichter katarrhalischer Entzündung des oberen Respirationstraktes bis zur schwersten Bronchopneumonie. Die Rindergrippe ist auch unter dem Namen Enzootische Pneumonie bekannt; um eine Verwechslung mit der EP (Mycoplasma hyopneumoniae) der Schweine zu vermeiden, sollte dieser Name jedoch nicht verwendet werden. Besonderheiten An der Entstehung der Rindergrippe sind verschiedene infektiöse und nicht-infektiöse Ursachen beteiligt = Multifaktorenkrankheit. Die Rindergrippe tritt saisonal (gehäuft im Winter) und v.a. bei Jungtieren auf. Im Vordergrund der infektiösen Ursachen stehen folgende Viren und Bakterien (-> Sekundärinfektion): Parainfluenzavirus Typ 3 (PI-3), bovines respiratorisches Synzytialvirus (BRSV), Adenoviren (9 Serotypen, beim Rind v.a. 1, 3 und 4 von Bedeutung), Reoviren (3 Serotypen), Rhinoviren; auch das bovine Virusdiarrhöevirus (BVDV), das infektiöse bovine Rhinotracheitisvirus (IBRV) sowie das bovine Coronavirus (BCV) können an diesem Krankheitskomplex beteiligt sein; Bakterien, v.a. Manneheimia hämolytica. Im Vordergrund der nicht-infektiösen Ursachen stehen Stress, Hygienebedingungen und Management, Temperatur u.ä. Antigenverwandtschaft: PI-3: Verwandtschaft zwischen PI-3 Vertretern verschiedener Spezies. BRSV: mit dem humanen RSV. Geschichte Die Rindergrippe hat sich als problemreiche Erkrankung vor allem mit der Zunahme der Massentierhaltung entwickelt. Da es sich um eine multifaktorielle Erkrankung handelt, tritt sie vor allem dort auf, wo durch Stress (immun)geschwächte Tiere zusammenkommen, wobei immer auch ein Spektrum von Erregern vorhanden ist und ausgetauscht wird. Die Rindergrippe wurde zuerst in Amerika bekannt, wo sie häufig nach dem Umstellen von Kälbern (in Massen!, sehr lange Reisen!) auftrat/tritt und grosse Schäden anrichtet(e). Daher kommt auch der Name "shipping fever". Seite 196 Kapitel, Rindergrippe: PI-3/BRSV Verbreitung weltweit. Erreger Für die Ätiologie der Rindergrippe am wichtigsten sind die beiden Vertreter aus der Familie der Paramyxoviridae, PI-3 und BRSV, weshalb hier nur diese Erreger besprochen werden. Adeno-, Rhino- und Reoviren sind allein wenig pathogen; sie begünstigen und/oder verstärken jedoch die Paramyxovirusinfektionen. Die Paramyxoviridae werden in zwei Subfamilien, Paramyxovirinae und Pneumovirinae, eingeteilt (vgl. Taxonomie). PI-3 ist ein Vertreter des Genus Paramyxovirus (aus der Subfamilie Paramyxovirinae). BRSV gehört zum Genus Pneumovirus (Subfamilie Pneumovirinae) Beide Viren sind behüllt, Durchmesser 120-150 nm, helikales Nukleokapsid. Genom: unsegmentierte ssRNA mit negativer Polarität; 16 - 20 kb. Wichtigste Virusproteine: 3 Hüllen-Glykoproteine, die Spikes bilden: Hämagglutinin und Neuraminidase (HN, 1 Spike) und Fusionsprotein (F Protein); Matrixprotein (M). Nukleokapsid aus RNA, Nukleoprotein (NP), und Proteinen L ("large") und P ("Phosphoprotein"). Daneben einzelne zusätzliche Proteine, je nach Genus. Bei den Pneumoviren entspricht das Protein G (84K) dem HN-Protein. Nukleoproteinkomplex: RNA (genomische) Nukleoprotein (N) "Hilfs"-Nukleoproteine (L, P) Hülle, bestehend aus: Lipiddoppelmembran Hämagglutinin-Neuraminidase (HN) - Spikes (G-Protein und SH* bei BRSV) Fusionsprotein (F) - Spikes Membranprotein (M) *SH=small hydrophobic Seite 197 Kapitel, Rindergrippe: PI-3/BRSV Differenzierung der Genera: Antigenverwandtschaft innerhalb eines Genus; Differenzen bezüglich Hämagglutinin- und Neuraminidase-Aktivität: Paramyxoviren besitzen beide, Morbilliviren nur Hämagglutinin-Aktivität und Pneumoviren weder noch. Diese ursprünglichen Kriterien werden unterstützt durch genetische Analysen. Das Virusgenom kodiert für mindestens 6 Proteine, bei Pneumoviren für 10. Protein C (s. P/C), ein Nichtstrukturprotein, wird vom gleichen Gen wie Protein P kodiert, benützt aber einen alternativen Leseraster. 3' NP P/C 1682 0 M Fo 1894 1173 1846 2 4 5' HN L 1891 6799 6 8 Kilobasen 10 12 14 Die Paramyxoviridae sind in der Aussenwelt wenig stabil. Werden durch Hitze, UV-Licht und Lipidlösungsmittel (Aether, Chloroform) rasch inaktiviert. Resistenz in Aussenwelt bei verschiedenen Genera etwas unterschiedlich. Relativ stabil bei hoher bzw. tiefer Luftfeuchtigkeit und labil bei hohem und tiefem pH. Wirts(zell)spektrum beschränkt. Zu Virusvermehrung und Genexpression sei auch auf das Virusporträt "CDV" (Staupe) verwiesen. Die Hüllenglykoproteine HN (PI-3) bzw. G (Abbildungen im Kapitel Staupe) (BRSV) und F sind verantwortlich für Adsorption und Penetration. Adsorption via Bindung von Hämagglutinin an Zellrezeptor (=Neuraminsäure). Penetration: Fusion Virushülle - Zellmembran (vermittelt durch F Protein) und anschliessende Einschleusung des Nukleokapsids ins Zytoplasma. Das Genom wird transkribiert (für jedes Gen eigene mRNA) und auch repliziert. Nach der Translation der mRNAs in die entsprechenden Proteine folgt - alles im Zytoplasma - das Assembly und dieVirusausschleusung via Ausknospung. Einbau der Spikes-Glykoproteine in Zellmembran. Fusionsprotein - wenn durch Trypsin oder Trypsin-ähnliche Protease gespalten - vermittelt auch sog. "fusion from within": noch intrazellulär wird Fusion von benachbarten Zellen bewirkt (Bildung von Synzytien) Î direkte Virusausbreitung von Zelle zu Zelle. Virusvermehrung und Genexpression Seite 198 Kapitel, Rindergrippe: PI-3/BRSV Epidemiologie Die Übertragung erfolgt via Tröpfcheninfektion (direkter Kontakt); daneben auch indirekte Übertragung möglich (kontaminierte Geräte, Krippen, Tränken etc.). Es handelt sich um (eine) Infektion(en) mit hoher Kontagiosität, wobei oft der ganze Bestand erfasst wird. Die Durchseuchungsrate (beteiligte Viren) ist mit 70-85% sehr hoch. Betroffen sind vor allem Kälber ab dem Alter von 2 Wochen bis zu 18 Monaten (sowohl Mast- wie Aufzuchtbetriebe), wobei das Einstallen vieler Kälber von verschiedener Herkunft eine besonders bedeutende Rolle spielt. Zusätzlich haben Räumlichkeit und Luftzirkulation grossen Einfluss. Da es sich um eine saisonal auftretende Infektion handelt, spielt auch die Temperatur eine entscheidende Rolle. PI-3: Wird im Respirationstrakt zu hohen Titern repliziert und ausgeschieden (während ca. 8 - 10 Tagen). PI-3 ist in Aerosol bei tiefen Temperaturen sehr stabil. BRSV: Infektion kann in einem Betrieb endemisch werden (vermutlich gibt es Virusträger). Betroffen sind v.a. 3 - 9 Monate alte Tiere. Tritt nicht so streng saisonal auf wie PI-3 Infektion. Desinfektion Übliche Desinfektionsmittel (NaOH, Formalin etc.). Pathogenese (vgl. Folien in Allg. Virologie, Pathogenese) Eintrittspforte ist der Nasen-Rachen-Raum. PI-3: Neuraminidase wird gebraucht, um Mucus zu verflüssigen und die neue Virusgeneration freizusetzen: Mucus enthält viel N-Acetyl-Neuraminsäure; dient als "Rezeptor"; Neuraminidase spaltet Neuraminsäure ab; neue Viren frei für Bindung an frische Zelle. Die erste Virusvermehrung erfolgt lokal. Virusausbreitung i.d.R. beschränkt auf den Respirationstrakt (vorübergehende Virämie und Folgen wie Splenitis oder Enteritis möglich). Virus vermehrt sich aber hauptsächlich im oberen und unteren Respirationstrakt, sowie in den Alveolarmakrophagen. Epithelschädigung: v.a. Zilienverlust, Zellen: Hyperplasie und Nekrosen. Stark erhöhte Anfälligkeit für Sekundärinfektionen durch verminderte Abwehr: s. Zilienverlust, infizierte Makrophagen: eingeschränkte Funktionstüchtigkeit. BRSV: Pathogenese vergleichbar mit PI-3. Trotzdem Unterschiede, die noch nicht im Detail geklärt sind (exp. Infektionen verlaufen milder als natürliche; z.T. inapparent). Zilienaktivität nicht wesentlich beeinträchtigt. Alverolarmakrophagen sind wenig empfänglich für BRSV. Ablagerungen von Zelltrümmern und Exsudat: begünstigt Sekundärinfektionen. Lokale (Nasenschleimhaut) neutralisierende Antikörper von höchstem Schutzwert. Seite 199 Kapitel, Rindergrippe: PI-3/BRSV Bakterielle Sekundärinfektionen erfassen immer den unteren Respirationstrakt -> z.T. schwerwiegende Bronchopneumonie; diese jedoch auch beeinflusst von der Infektionsdosis, vom physiologischen Zustand des Respirationstraktes und vom funktionellen Zustand des Immunsystems. Mannheimia hämolytica --> zusätzlich Leukotoxin - Produktion: schädigt Leukozyten u.a. und beeinträchtigt Makrophagenfunktion. Klinik Abhängig von mitbeteiligten Erregern. Allgemein: Die Krankheit setzt sehr plötzlich ein mit vermindertem Appetit, Fieber, Nasen- und Augenausfluss, Husten und erhöhter Atemfrequenz; z.T. Atemgeräusche und Pumpen. Später, v.a. bei bakteriellen Sekundärinfektionen, Lungenemphysem und Dyspnoe (z.T. höchstgradig), Bronchopneumonie, mukopurulenter (schleimig-eitriger) Nasenausfluss, Husten, hohes Fieber, Salivation, Apathie. Bei Jungtieren Schweregrad meist höher (Mortalität bis 10%) als bei älteren Tieren (bei diesen i.d.R. sehr milder Verlauf). Immunreaktion PI-3: Schutzwirkung v.a. durch lokale, sekretorische Antikörper (AK); Serumantikörper vermögen Schweregrad der Erkrankung zu reduzieren. Exp. Infektion: Neutralisierende Antikörper (Serum und sekretorisch) erscheinen ab 6 Tagen p.i. Persistenz: Serum-AK: 3-5 Monate; sekret. AK: 6-8 Wochen. Nach Reinfektion anamnestische Reaktion; Persistenz der sekret. AK: 5 Monate (Serum-AK länger). Maternale Antikörper können Schweregrad der Erkrankung reduzieren. Sie interferieren jedoch auch mit dem Aufbau einer aktiven Immunantwort. Persistenz abhängig vom maternalen AK-Titer: 10 - 20 Wochen. BRSV: Neutralisierende Serum-AK ab ca. Tag 7 p.i. nachweisbar; Titermaximum 3 Wochen p.i. Sekretorische AK ab 1 Woche p.i. nachweisbar, Persistenz ca. 3 Monate. Schutzwirkung - wie bei PI-3 - v.a. durch sekretorische AK. Maternale AK kein Schutz vor Infektion (nur mildere Symptomatik). Teilweise starke AK-Antwort gegen Proteine F, G und NP. Antikörper gegen F bieten einen relativ guten, andere jedoch einen ungenügenden Schutz (bezüglich Reinfektion und Genesung). Besonderheiten Mannheimia hämolytica: 1. unspezifisch: mukoziliärer Apparat; Komplement (Ablösung von Bakterien, Opsonisierung, Phagozytose; Entzündung). 2. Humorale Immunantwort: Antikörper in Alveolen (Opsonisierung verstärkt, Phagozytose verstärkt Neutralisation des Leukotoxins). Achtung: zu viel Antikörper können auch schädlich sein, z.B. Impfung mit Bakterin. Grund: zu viel Antikörper führen zu massiver Phagozytose, wobei jedoch die Erreger nicht mehr abgetötet werden; daneben Stimulation der Komplementproduktion und damit verstärkte Entzündung. 3. Zellvermittelte Immunantwort: wichtig; unterstützend (Mechanismen unklar). Seite 200 Kapitel, Rindergrippe: PI-3/BRSV Prophylaxe Expositionsprophylaxe: Aufstallung und Lüftungsverhältnisse optimieren; womöglich Stress vermeiden; keine Überbelegung; evtl. Separierung oder nur Zukauf geimpfter Tiere (Wirtschaftlichkeit? / Realisierbarkeit?). Impfprophylaxe: In der Schweiz sind monovalente (BVDV, BRSV) und polyvalente (BRSV und PI-3 in Kombination mit Mannheimia hämolytica) Vakzinen zugelassen. Ziel: Schutz vor allem gegen immunsuppressiv wirkende Primärinfektion. Probleme: a) idealerweise müsste gegen alle beteiligten Viren immunisiert werden, was nicht oder nur bedingt möglich ist; b) erwünscht wäre ein lokaler Immunschutz, der nach parenteraler Applikation aber nur schlecht ausgebildet wird. Ausserdem behindern maternale Antikörper den aktiven Aufbau einer Immunantwort. Trotzdem ist Immunprophylaxe, neben möglichen Managementregelungen, die beste existierende Prophylaxemöglichkeit. Diagnose Verdacht bei saisonalem Auftreten von respiratorischen Symptomen bei Jungtieren in Aufzucht-/Mastbetrieben; besonders nach Einstallen von zugekauften Tieren. Differentialdiagnosen BVD/MD, BCV, IBR, Adeno-, Reo-, Rhinoviren, Mannheimien, Corynebakterien, Streptokokken, Staphylokokken, Mikrokokken, Pneumokokken. Bei Verdacht Virologisches Institut ( 044 635 8718), Vetsuisse Fakultät Zürich, Winterthurerstrasse, 8057 Zürich. Untersuchungsmaterial gemäss Abmachung einsenden; Planung Bekämpfungsmassnahmen im Betrieb. Untersuchungsmaterial Für Virusnachweis: Nasentupferproben. Für Antikörpernachweis: Serumpaar! Labordiagnose Direkter Virusnachweis in Nasentupferproben mittels Immunfluoreszenz. Serologie: Antikörpertiteranstieg (Serumpaar) mittels ELISA. Es ist immer auch auf Antikörper gegen die andern an der Rindergrippe beteiligten Viren zu untersuchen. Staatliche Massnahmen keine. Seite 201 Kapitel, Rotaviren Rotaviren Autor: Alfred Metzler File Info: TPT22:\Vorlesung\Portrats0203.doc Rota Rotaviren (RV) Ubiquitär verbreitete Pathogene, die bei jungen Nutz-, Hausund Wildtieren sowie bei Kleinkindern und älteren Personen für akute, nicht fieberhaft verlaufende Durchfallerkrankungen verantwortlich sind. Besonderheiten RV verhalten sich weitgehend Spezies-spezifisch. Ausnahmen werden indessen zunehmend häufig festgestellt (Zoonose?). Dies ist von Interesse, da teilweise enge antigenetische/serologische Gemeinsamkeiten bestehen. RV besitzen ein segmentiertes Genom (11 dsRNS Segmente), so dass die Bildung von Reassortanten möglich ist (Genaustausch zwischen unterschiedlichen RV). Das Phänomen des Antigenshift hat bei RV nicht die gleiche Bedeutung wie bei den Influenzaviren. Gewisse Virusreassortanten manifestieren eine reduzierte Virulenz, die eine Verwendung als Lebendimpfstoff möglich macht. Andererseits vermutet man, dass dieses Phänomen im Einzelfall auch mit einer Virulenzsteigerung einhergehen kann. Geschichte und Verbreitung RV wurden erstmals in den 70er Jahren als Durchfallerreger bei Tier und Mensch erkannt. Sie sind weltweit die wichtigsten Erreger von nicht-bakteriell verursachten Gastroenteritiden. Einer Schätzung zufolge sterben weltweit jährlich etwa 850'000 Personen an den Folgen einer RV-Infektion. In Entwicklungsländern gehen bei Kindern 20% aller durchfallbedingten Todesfälle auf das Konto von RV. In industrialisierten Ländern sind RV die Hauptursache für Hospitalisationen infolge Gastroenteritis bei Kindern und Greisen. In den USA verzeichnet man jährlich 50 bis 90 Todesfälle und rund 65'000 Hospitalisationen. In der Schweiz herrschen ähnliche Verhältnisse. Bei Nutztieren, insbesondere bei Rindern und Schweinen, verursachen RV grosse, jedoch schwierig abzuschätzende ökonomische Verluste. Bedeutung Schweiz Prävalenz seropositiver Tiere annähernd 100%. Die tatsächliche klinische Bedeutung und das Ausmass der wirtschaftlichen Verluste wird nicht erfasst. Das Fehlen spezifischer therapeutischer Massnahmen erklärt den Umstand, dass die Nachfrage für einen Erregernachweis (Diagnostik) gering ist. RV werden häufig in Gesellschaft mit anderen Infektionserregern, insbesondere mit enteropathogenen E. coli, Kokzidien und Cryptosporidien festgestellt. Seite 202 Kapitel, Rotaviren Erreger Familie Reoviridae, Gattung Rotavirus. Durchmesser 65-75 nm (1 nm entspricht 1/1000 µm), zweischichtiges, ikosaederförmiges Kapsid, keine Hülle, trotzdem ein glykosyliertes Strukturprotein (gVP7), Core (= Innenkörper) enthält alle Enzyme für die virusspezifische Transkription und RNS-Replikation. Das Virusgenom besteht aus 11 Segmenten einer doppelsträngigen RNS. Diese können in Polyakrylamidgelen aufgetrennt und diagnostisch/epidemiologisch (spezifische Bandenmuster) ausgewertet werden (Abb. 1). Die 11 RNSSegmente kodieren für je ein Protein: 6 Struktur- und 5 Nichtstrukturproteine (Tab. 1). Das Strukturprotein VP6 weist ein gruppenspezifisches Antigen auf (wichtig für die Diagnostik). Die Virusadsorption erfolgt durch VP4. VP4 und VP7 induzieren neutralisierende Antikörper. Die räumliche Struktur (Konformation) von VP7 beeinflusst jene von VP4 und umgekehrt. Man geht davon aus, dass ein mit VP7 reagierender neutralisierender Antikörper die Virusadsorption durch Änderung der Konformation von VP4 bewirkt. VP4 und VP7 beeinflussen zahlreiche Pathogenitätsmechanismen: Wirtsspezifität und Gewebetropismus, Kinetik der Virusvermehrung, die Ausbildung einer postinfektiösen oder postvakzinalen Immunität ist gleichbedeutend mit der Bildung von virusneutralisierenden Antikörpern. Die Tatsache, dass gewisse Virusstämme keinen zytopathischen Effekt (auch keine Gastroenteritis) verursachen, konnte bis heute nicht befriedigend erklärt werden. Seite 203 Kapitel, Rotaviren <- Abb. 1. Bandenmuster der RNS-Segmente dreier Rotavirusisolate: Serogruppe A (links, 1), B (mitte, 2), bzw. C (rechts, 3). Tab. 1. Die Proteine von Rotaviren RNSSegment 1 2 3 4 5 6 7 8 9 10 11 Protein VP1* VP2 VP3 VP4** NS1 VP6 NS2 NS3 gVP7 gNS4 gNS5 Mol.-Gew. (gerundet) 125 94 88 88 53 41 34 35 38 28 26 Lokalisation Core Core Core äusseres Kapsid (nur Zelle) inneres Kapsid (nur Zelle) (nur Zelle) äusseres Kapsid (nur Zelle) (nur Zelle) * VP, Virion- oder Strukturprotein; NS, Nichtstrukturprotein; g, glykosyliert ** Durch proteolytische Spaltung entstehen VP5 und VP8 (ausbleibende Spaltung geht mit einer abortiven Infektion einher). Die Lokalisation der Virusproteine ergibt sich aus morphologischen (EM) und gelelektrophoretischen Untersuchungen an chemisch veränderten Viruspräparaten (Abb. 2). Die Behandlung mit 10 mM EDTA entfernt VP4 und VP7. Es entstehen einschichtige Kapside. Weitergehende Behandlung mit 1.5 M CaCl2 entfernt VP6. Es resultieren sogenannte Core-Partikel, bestehend aus VP1, VP2 und VP3. Diese sind mit den 11 RNS-Segmenten verbunden. Mit EDTA behandelte Viruspräparate eignen sich in vitro für die Synthese von markierter viraler mRNS (wird für molekulare Untersuchungen des Virusgenoms verwendet). Doppeltes Capsid Einfaches Capsid Core Abb. 2. Lokalisation der Strukturproteine bei Rotaviren Seite 204 Kapitel, Rotaviren Es gibt eine überaus grosse Anzahl serologisch unterscheidbare RV. Auf Grund der Antigenität von VP6 unterscheidet man 6 Serogruppen (A bis F), die untereinander keine serologischen Gemeinsamkeiten aufweisen. Die bei Mensch und Tier bekannten Rotaviren gehören zumeist der Serogruppe A an. Über die Bedeutung der Virusgruppen B bis G ist vergleichsweise wenig bekannt. Vertreter der Serogruppen B und C finden sich sowohl bei Mensch und Tier, während solche der Gruppen D bis F bisher nur bei Tieren festgestellt wurden. Nachdem auf VP6 ein gruppenspezifisches Antigen lokalisiert ist, kann der Virusnachweis in Stuhl- und Kotproben z.B. unter Verwendung monoklonaler Antikörper, leicht und schnell geführt werden. Heute sind kommerziell erhältlich ELISA-kits für den Nachweis von RV der Serogruppe A weit verbreitet. Innerhalb der Serogruppe A können genetisch und serologisch 14 (Sero-/Geno-) Typen unterschieden werden. Die Zugehörigkeit zu einem bestimmten Serotyp wird durch die Antigenität von VP7 geprägt (nachdem VP7 glykosyliert ist bezeichnet man die Serotypen auch als G-Typen). Die einzelnen G-Typen werden im Neutralisationstest oder übereinstimmend durch Sequenzanalyse des zugehörigen Gens ermittelt (vgl. Notizen zur allgemeinen Virologie: "Virusdiagnostik"). Nachdem auch VP4 virusneutralisierende Antikörper induziert, gestaltet sich die serologische Charakterisierung der RV relativ schwierig; dies gehört indessen nicht zur Routine, ist jedoch von Bedeutung, wenn es um die Entwicklung von Impfstoffen geht (ein guter Impfstoff sollte die lokal verbreiteten Virustypen abdecken). Auf Grund von charakteristischen Unterschieden der Nukleotidsequenz im Gen für VP4 wurden bisher 20 sogenannte P-Genotypen definiert (P steht für das Gen von VP4, das proteolytisch gespalten wird). Die P-Serologie ist schwierig. Für (molekular-) epidemiologische Abklärungen ist die Zuordnung der prävalenten Virustämme zu bestimmten G- und P-Typen wichtig (Tab. 2). Tab. 2. Bisher bei Mensch und Tier festgestellte G- und PTypen (Gruppe A-RV). Die Hauptwirte für die einzelnen Gund P-Typen sind fett gedruckt. Abkürzungen: Hu, human; Po, porcine; Bo, bovine; Ov, ovine; Si, simian; Mu, murine; Ca, canine; Fe, feline; Eq, equine; La, lapine; Av, avian. Merke: es wird davon ausgegangen, dass beispielsweise die als G8P10 identifizierten menschlichen Isolate Reassortanten humanen und bovinen Ursprungs darstellen. Seite 205 Kapitel, Rotaviren Serotyp Genotyp G1 P6 P6 P5 P1 P2 P3 P1B P7 P2 P4 P5 P6 Hu P9 P1A P3 P7 P8 P9 Po Hu Hu P4 P8 P3 P10 P11 P12 P13 P14 P10 P11 P15 P16 P17 P18 P19 P20 Vermehrung G2 G3 G4 G5 Ov Si Hu Si Mu Ca Fe G6 G7 G8 Bo Bo Bo Bo G9 G10 G11 G12 G13 G14 Hu Hu Hu Hu Po Hu Hu Fe Hu Po Po Hu Bo Hu Po Po Hu Hu Hu Hu Bo Hu Bo Eq Eq Hu La Hu Hu Hu Ov Mu Av Bo Eq Po Mu Die Virusvermehrung erfolgt ausschliesslich im Zytoplasma (Abb. 3 und 4). Virion-Enzyme dsRNS Zellkern mRNS Strukturproteine Nichtstrukturproteine ssRNS dsRNS Virionen Abb. 3. Strategie der Virusreplikation (Rotaviren) 1. Adsorption des Virus an die Wirtszelle mittels VP4. Merke: Gegen VP4 und VP7 gerichtete Antikörper können die Adsorption verhindern. -> Virusneutralisation. Seite 206 Kapitel, Rotaviren 2. Penetration. Sofern VP4 proteolytisch gespalten vorliegt (VP5 und VP8) kommt es zu einer Fusion des äusseren Kapsids mit der Zellmembran, in deren Folge das einschichtige Kapsid (mit den dsRNS Segmenten) in das Zellinnere gelangt. Liegt VP4 in nicht gespaltener Form vor, gelangen die adsorbierten Virionen mit dem äusseren Kapsid (VP4 und VP7) via Endozytose in das Zellinnere. In diesem Fall kommt die Virusreplikation zum Erliegen, da keine Transkription stattfinden kann. Mit RV infizierte Zellen werden i.d.R. mit einem Nährmedium inkubiert, dem Trypsin beigesetzt ist. Damit wird gewährleistet, dass VP4 der Nachkommenviren proteolytisch gespalten wird. 3. Die durch die viruseigenen Transkriptasen gebildete mRNS verlässt die einschichtigen Kapside durch Poren, die in VP6 vorhanden sind. Im Zytoplasma werden die Transkripte an freien und an ER-gebundenen (VP7, gNS4) Ribosomen translatiert. Abb. 4. Vermehrung von Rotaviren, schematisch 4. Nach erfolgter Translation und RNS-Replikation folgt die Virusreifung (Morphogenese und Freisetzung) durch Knospung an Membranen des ER. Dabei spielt das glykosylierte Nichtstrukturprotein gNS4 eine entscheidende Rolle (zeitweilig trägt das reifende Viruspartikel eine Hülle, in der gNS4 integriert ist). Die Virusfreisetzung erfolgt schliesslich durch Lyse der Wirtszelle. Merke: Soweit bekannt, kommt dem Golgi-Apparat bei der Virusreplikation keine Bedeutung zu. Das virale Glykoprotein gVP7 trägt demzufolge nur N-glykosidisch gebundene Zucker. Seite 207 Kapitel, Rotaviren Die Isolierung und weitergehende Züchtung von RV gelingt nicht regelmässig. Insbesondere konnten Viren der Gruppen B und C nur vereinzelt und solche der Gruppen D bis F noch nie isoliert werden. Bei der Isolierung von RV der Gruppe A fällt auf, dass dies beispielsweise mit bovinen Stämmen häufiger als mit humanen Stämmen gelingt. Die Gründe für diese Tatsache sind unklar. Eine minimale Voraussetzung für die erfolgreiche Isolierung und Vermehrung von RV in Zellkulturen ist ein Zusatz von Trypsin zum serumfreien Nährmedium. Epidemiologie Erkrankte Individuen scheiden mit dem Kot während 1-3 7 9 Wochen grosse Virusmengen aus (10 -10 infektiöse Partikel pro Gramm). Die horizontale Virusausbreitung geschieht fäkal-oral durch direkten Kontakt oder indirekt über unbelebte Vektoren. Viruskontaminierte Stallungen und Gerätschaften, einschliesslich Fahrzeuge, werden meist unzulänglich desinfiziert, da die Viren eine hohe Tenazität aufweisen. In infizierten Beständen gibt es immer Individuen, die einerseits Viren ausscheiden und andererseits für eine Infektion empfänglich sind. Empfänglich sind v.a. Jungtiere, die keine ausreichende kolostrale (passive) Immunität aufweisen. Unter unhygienischen Bedingungen sind Tiere beim Absetzen gefährdet, da bei hoher Infektionsdosis die Infektion leichter haftet. Infektionen mit RV verzeichnet man über das ganze Jahr. In gemässigten Zonen treten Erkrankungen im Winterhalbjahr gehäuft auf: Witterung, niedrige relative Luftfeuchtigkeit, beeinträchtigter Wärmehaushalt der Jungtiere). Der Verlauf einer Infektion wird durch verschiedene Faktoren beeinflusst: altersabhängige Resistenz, Immunitätslage, Virustyp, Infektionsdosis). Wiederholte Infektionen mit/ohne Erkrankung sind möglich, da passiv und aktiv erworbene Immunität zeitlich beschränkt sind. Zudem existieren Serotypen, die keine Kreuzimmunität induzieren. Desinfektion Die Tenazität der RV ist vergleichsweise gross (gilt generell für unbehüllte Viren). Hohe Temperatur und hohe relative Luftfeuchtigkeit beschleunigen die Virusinaktivierung. Gegenüber Sonnenlicht (UV-A-Strahlung) verhalten sich die Viren relativ labil. Demgegenüber überleben die Viren bei niedrigen Temperaturen und in Dunkelheit über Monate. Dies trifft insbesondere für Vollgülle zu, wo ein D-Wert von mehr als 6 Monaten ermittelt wurde. Bei 55°C werden die Viren innerhalb von 60 min zu 99.9% inaktiviert. Die Infektiosität wird durch pH-Werte von 3-10 nicht wesentlich beeinträchtigt. Im physiologisch sauren Magenmilieu (pH-Wert < 3.0) geht die Infektiosität schnell verloren. Seite 208 Kapitel, Rotaviren Als chemische Desinfektionsmittel sind Iodophor und NaHypochlorid (NaHClO = eau de javelle) nur bedingt wirksam. Empfohlen werden 4.5% Formaldehyd (cave: nur bei Temperaturen oberhalb 10°C wirksam!), 2% Glutaraldehyd, 70-90% Aethanol oder 1-5% Chloramin-T. Pathogenese Gefährdet sind Jungtiere ohne ausreichenden kolostralen Schutz. Mit zunehmendem Alter verlaufen die Infektionen mehr und mehr subklinisch. Nach oraler Aufnahme gelangen die Viren durch das mehr oder weniger saure Magenmilieu in den Dünndarm. Lokal wirksame Proteasen aktivieren das Virus, das dann bei nicht immunen Tieren die Enterozyten der Dünndarmzotten befällt und zerstört (Zottenatrophie und Maladsorption). Die Virusvermehrung erfolgt schnell, so dass bereits 6-12 Stunden nach Virusaufnahme eine Freisetzung von Nachkommenvirus beginnt. Nach weiteren 6 Stunden kann man mikroskopisch den Beginn der Zottenatrophie feststellen (vgl. Notizen zur allgemeinen Virologie, "Pathogenese"). Die mit einiger Verzögerung aus den Krypten nachwachsenden Enterozyten sind metabolisch zunächst unreif, so dass die Maladsorption auch bei regeneriertem Epithel zeitweilig anhält (Proteine und Milchzucker werden weder metabolisiert noch resorbiert, so dass durch osmotische Wirkung eine sekundäre Dehydratation resultiert. Die Virusausscheidung dauert 1-3 Wochen. Nach neueren Befunden kann das glykosylierte Nichtstrukturprotein gNS4 (auch bei nicht zytopathogenen Virusstämmen) für sich alleine Durchfall verursachen, wobei der zugrundeliegende Mechanismus jenem des Choleratoxins entspricht (cAMP). Klinik Die Inkubationszeit dauert 1-2 Tage. Beim nicht geschützten Jungtier (fehlende oder verspätete Kolostrumaufnahme sowie bei frühzeitigem Absetzen) prägen Durchfall und Dehydratation, Anorexie und gelegentlich auch Erbrechen das klinische Bild. Betroffene Tiere magern ab und bleiben allenfalls "Kümmerer". In endemisch infizierten, jedoch hygienisch einwandfreien Beständen verlaufen die Infektionen häufig subklinisch. Die Morbidität wird durch zahlreiche Faktoren beeinflusst: Alter, Immunstatus, Virustyp, Infektionsdosis, Fütterung in der Absetzphase, Stallklima sowie gleichzeitige Infektionen mit anderen Pathogenen. Die wirtschaftliche Bedeutung von RVInfektionen wird im allgemeinen hoch eingeschätzt. Seite 209 Kapitel, Rotaviren Immunreaktion Rotaviren führen zu lokalen Darminfektionen. Immunität bedeutet lokale Immunität: aktive und passive Immunisierung. Im Verlauf der Infektion werden Lymphozyten des Darmes (Peyer'sche Platte) aktiviert. Diese produzieren u.a. sekretorische Immunglobuline (IgA). Zellvermittelte Immunmechanismen laufen ebenfalls ab. Über deren Bedeutung ist indessen wenig bekannt. Die Dauer der humoralen Immunität ist mit einigen Wochen kurz. Reinfektionen sind demzufolge häufig. Kürzlich wurde die immunologisch interessante Beobachtung publiziert, wonach VP6-spezifische IgA beim Transport durch infizierte Enterozyten mit dieser Viruskomponente reagieren und dadurch die Virusreifung verhindern können. Da die meisten Bestände endemisch verseucht sind, sind Muttertiere einem dauernden Antigenstimulus ausgesetzt. Dieser führt zu einer regelmässigen aktiven Immunisierung, in deren Folge eine befristete laktogene Immunisierung der Jungtiere sichergestellt werden kann. Immunprophylaxe Im Handel erhältliche attenuierte Impfstoffe vermögen nicht zu befriedigen. Eine Erklärung hierfür liegt vermutlich darin, dass die Impfstoffe das prävalente Virusspektrum nicht abzudecken vermögen. Hinweise hierfür ergeben sich aus molekularepidemiologischen Untersuchungen. Allgemeine Hygienemassnahmen im Betrieb reduzieren die Infektionsdosis und damit das Krankheitsrisiko. Eine ausreichende Versorgung der Jungtiere mit Kolostrum wirkt sich immer günstig aus. Pathologie Die makroskopisch erkennbaren Veränderungen sind unspezifischer Natur, d.h. nicht pathognostisch. Festgestellt werden allgemeine Dehydratation, dünnwandiges Jejunum und Ileum, erweiterter Dickdarm sowie mit gelblichen Massen gefüllter Darm. Histologisch lässt sich eine Zottenatrophie feststellen. Diese kommt durch den Verlust der apikal liegenden Enterozyten zustande. Diagnostik Klinisch kann nur eine Verdachtsdiagnose gestellt werden. Die Labordiagnose ist, sofern frühzeitig gewonnene Kotproben zur Untersuchung gelangen, leicht und schnell durchführbar. Der Antigennachweis wird zumeist mit kommerziell erhältlichen ELISA-kits geführt (nur für RV der Gruppe A erhältlich). Alternativ können die Proben elektronenmikroskopisch untersucht werden (erfasst auch nicht der Gruppe A zugehörige Rotaviren). Eine weitere Möglichkeit zur Diagnostik ergibt mit den dsRNA Segmenten: diese können in geeigneten Gelen elektrophoretisch dargestellt werden. Hier kann man relativ sicher zwischen den einzelnen Virusgruppen unterscheiden (charakteristisches Bandenmuster). Innerhalb einer gegebenen Serogruppe lassen sich epidemiologisch nicht zusammenhängende Virusstämme häufig unterscheiden. Seite 210 Kapitel, Rotaviren Beim toten Tier können in Kryostatschnitten virale Antigene fluoreszenzmikroskopisch oder mit anderen Enzymtests nachgewiesen werden (vgl. Notizen zur allgemeinen Virologie: "Virusdiagnostik"). Der indirekte Virusnachweis (Antikörper) bringt wenig verwertbare Informationen. Allenfalls kann ein Antikörpertiteranstieg ermittelt werden. Differentialdiagnostisch müssen TGE, EVD, Infektionen mit E. coli sowie Kokzidien und Kryptosporidien ausgeschlossen werden. Therapie Es gibt keine virusspezifische Therapie. Symptomatisch wird man den Elektrolythaushalt unterstützen. Gelegentlich wird empfohlen, erkrankten Tieren Kolostrum zu verabreiche. Staatl. M'nahmen Keine. Seite 211 Kapitel, Staupe Staupe Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc CDV Staupe, Canine Distemper Staupe ist eine weltweit verbreitete, akut oder subakut verlaufende, kontagiöse, systemische Viruskrankheit der Hunde und anderer Carnivoren. Oft ist das ZNS vom Krankheitsgeschehen mitbetroffen. Charakteristische Spätfolgen sind "Hartballenkrankheit" und "old dog encephalitis". Besonderheiten Enge antigenetische Verwandtschaft mit anderen Morbilliviren, z.B. Rinderpest, Masern (wird z.T. als heterologer Impfstoff verwendet) und phocid distemper. Etablierung persistierender Infektionen mit besonderen Mechanismen in der Pathogenese. Gute Wirksamkeit von Lebendimpfstoffen (mlv). Geschichte Staupe ist eine seit mehr als 200 Jahren bekannte Krankheit. Sie wurde unter anderem schon von Edward Jenner (1809) beschrieben. Carré, dessen Name in der der französischen Bezeichnung der Krankheit verewigt ist, zeigte bereits 1905, dass es sich beim Staupeerreger um ein filtrierbares Virus handelte. Die Einführung der mlv-Impfstoffe in den Jahren zwischen 1950 und 1960 und deren konsequente Anwendung führten zu einem dramatischen Rückgang der Staupefälle. Verbreitung Weltweit. Erreger Familie Paramyxoviridae, Gattung Morbillivirus. (-)ssRNA Viren, Ø 120-150 nm, pleomorph-rundliche Gestalt, behüllt mit 2 "spikes"-bildenden Glykoproteinen (HA und F), HA Glykoprotein mit hämagglutinierender Aktivität und F Glykoprotein mit fusionierender Aktivität; helikales Nukleokapsid, Virion assoziierte Transkriptase. Genom aus ssRNA mit negativer Polarität, nicht segmentiert, 16-20 kb, Kodierungskapazität für 6 Strukturproteine (N, P, L, M, HA, F). Die virale Transkriptase schreibt zuerst subgenomische mRNAs ab, die zu Proteinen translatiert werden und die weitere Synthese von Genomkopien und viralen Strukturproteinen ermöglichen. Seite 212 Kapitel, Staupe Virusvermehrung Adsorption über zelluläre, Neuraminidase-resistente Rezeptoren via Hüllprotein (HA). Translokation ins Zytoplasma nach Fusion der Virushülle mit der Zellmembran mittels F-Protein. Die freigesetzte RNA mit negativer Polarität hat zwei unterschiedliche Funktionen. (i) Vorlage zur Transkription subgenomischer mRNA und (ii) Vorlage zur Transkription von RNA mit genomischer Länge, aber positiver Polarität, die dann wiederum als Vorlage für genomische RNA mit negativer Polarität dient. Strategie der Staupevirus Replikation virale Enzyme (-)ssRNA (+)mRNA Proteine (+)RNA (-)RNA Viruspartikel Genexpression Durch die Ausbildung eines Transkriptionsgradienten steuert das Virus seine Genexpression. Die Menge synthetisierter Proteine entspricht offensichtlich dem Bedarf zur Bildung von neuen Virionen. Die Gesamtheit der Strukturkomponenten geben dem Viruspartikel seine Form. Die genomische RNA bildet zusammen mit dem Nukleoprotein (N) das Nukleokapsid (auch RNP, Ribonukleoprotein). Seite 213 Kapitel, Staupe Auch enzymatisch aktive Proteine wie P/C und L sind mit dem RNP assoziiert und im Viruspartikel vorhanden. Das Matrixprotein (M) stellt die Anordnung der Hüllproteine HA und F, sowie den Kontakt zum RNP sicher. Funktionstüchtiges F-Protein entsteht durch proteolytische Spaltung des Vorläuferproteins Fo. Epidemiologie Mit der Einführung von mlv-Vakzinen in den 1950er Jahren ging die Inzidenz von Staupefällen weltweit stark zurück. Allerdings zirkuliert Staupe auch bei vielen Wildcarnivoren, sodass eine erfolgreiche Eradikation nicht erwartet werden kann. Die meisten Fleischfresser, zum Beispiel die Mitglieder der Familie canidae (Hund, Dingo, Fuchs, Koyote, Wolf, Schakal) mustelidae (Marder, Wiesel, Nerz, Stinktier, Dachs, Otter) und procyonidae (Panda, Waschbär, etc.) können an Staupe erkranken und eingehen. Eine interessante Stellung nehmen die felidae ein, welche wohl infiziert werden, mit wenigen Ausnahmen (z.B. chronische Staupeenzephalitis beim Bengaltiger) aber nicht erkranken. Gegen diese Annahme spricht allerdings das kürzlich beobachtete Auftreten von Staupe bei Löwen in der Serengeti. Infizierte Tiere sind die wichtigste Ansteckungsquelle. Übertragung der Infektion vor allem direkt über Aerosol. Indirekte Ansteckung unbedeutend, weil das Virus sehr empfindlich gegenüber Umwelteinflüssen ist. Virusausscheidung mit allen Exkreten und Sekreten unabhängig von klinischen Symptomen ab ca. 7 Tagen p.i.. Bei akut infizierten Tieren hört die Virusausscheidung normalerweise mit dem Abklingen der klinischen Symptome auf. Chronisch infizierte Tiere können Virus übertragen, auch wenn der diagnostische Virusnachweis nicht gelingt. Desinfektion Alle gängigen Desinfektionsmittel sind genügend wirksam. Pathogenese Natürliche Übertragung durch direkten Kontakt. Aufnahme des Virus durch Inhalation. Erste Virusvermehrung in den lymphatischen Geweben des Respirationstraktes. Replikation in Makrophagen, sowie B- und T- Lymphozyten. Ausbreitung in alle lymphatische Gewebe, inklusive Milz, Thymus, Lymphknoten, Knochenmark, Lamina propria des enteralen Traktes, Kupfer'sche Sternzellen der Leber. 7-14 Tage p.i. Einsetzen der Immunmechanismen mit zwei möglichen Folgeverläufen. (i) Vollständige Erhohlung und Elimination des Virus aus dem Organismus. (ii) Ungenügende Immunantwort mit Todesfolge oder Entwicklung einer persistierenden Infektion. Dabei werden die Viren durch infizierte Lymphozyten und Makrophagen in epitheliale Gewebe verschleppt, wodurch es zur Invasion der Epithelien des alimentären, urogenitalen und respiratorischen Traktes, von exokrinen und endokrinen Drüsen, sowie des ZNS kommt. Seite 214 Kapitel, Staupe Kommt es zu einer verzögerten Immunantwort, so verschwindet das Virus mit der Zeit aus den meisten Organen mit Ausnahme des ZNS. Zuweilen können auch Augen, Lunge und bestimmte Hautbezirke (Pfoten) chronisch infiziert bleiben. Bei der ZNS-Infektion erscheint das Virus zuerst in den perivaskulären Lymphozyten, später in den meningealen Makrophagen, den Ependymzellen, Gliazellen und schliesslich den Neuronen. Solche Hunde entwickeln i.d.R. eine akute oder subakute Enzephalitis. Bei der akuten Form ist eher die graue Substanz betroffen, während es bei der chronischen Form eher zu Demyelinisierung infolge von immunpathologischen Vorgängen kommt. Ähnlichkeit dieser Krankheitsform mit der subakuten, sklerotisierenden Panenzephalitis (SSPE) beim Menschen durch Infektion mit Masernvirus. Immunreaktion Die Immunreaktion nach Infektion mit Staupevirus hängt sowohl vom infizierenden Virusstamm, als auch von Eigenschaften des Wirtsorganismus ab. In der Frühphase der Infektion sind die Hunde infolge der Infektion der Immunzellen stets lymphopenisch und immunsupprimiert. Tiere, welche die Infektion rasch überwinden, entwickeln entsprechend rasch eine heftige humorale und zelluläre Immunantwort. Maximale Titer neutralisierender Antikörper sowie zirkulierender zytotoxischer T-Zellen werden bereits 10 bis 20 Tage p.i. gemessen. Während die humorale Immunantwort bei genesenen Hunden sehr lange andauert, verschwindet eine messbare zelluläre Immunität relativ rasch. Protrahierte Infektion und Entwicklung von chronischen Krankheitsbildern beobachtet man in der Regel bei Hunden mit ungenügender oder verzögerter Immunantwort. Inaktivierte Vakzinen induzieren keinen Schutz vor Krankheitssymptomen und vor möglichen Komplikationen und Spätfolgen. mlv-Impfstoffe hingegen gewähren einen sehr guten Schutz. Impfprophylaxe Impfung mit mlv-Vakzinen. Heterologe Impfung mit Masernvirus möglich. Guter Schutz der Welpen durch Aufnahme maternaler Antikörper. Schutzwirkung kann durch Gabe spezifischer Antikörperpräparate gesteigert werden. Klinik Staupe manifestiert sich mit sehr unterschiedlichen Verlaufsformen, die von Virusstamm, Alter des infizierten Tieres und von individueller Resistenz abhängen. Seite 215 Kapitel, Staupe Klassischer Verlauf: Die Krankheit beginnt mit einer zweigipfligen Fieberphase, wobei der erste Fieberanstieg, 3 bis 6 Tage nach der Infektion, oft unbemerkt verläuft. Die zweite Fieberphase, die einige Tage nach der ersten auftritt, geht dann mit Nasenausfluss (zunächst serös), Konjunktivitis und Anorexie einher. Später stellen sich noch respiratorische und/oder gastro-intestinale Symptome ein, die oft durch Sekundärinfektionen (begünstigt durch die Lymphopenie) noch akzentuiert werden. Die Konjunktivitis kann in eine Keratokonjunktivits sicca übergehen und zu Ulzerationen und sogar Perforation der Kornea führen. Abbildung 1. Fortgeschrittene Staupe beim Hund mit Keratokonjunktivitis und eitrigem Nasenausfluss. Zentralnervöse Form: Diese Verlaufsform der Staupe kann entweder im Zuge oder nachfolgend auf die klassische Form auftreten, aber auch einer subklinischen, systemischen Infektion folgen. Inkoordination und konvulsive Krämpfe sind die häufigsten Symptome. Daneben können Tremor, Paresen, Torticollis, Nystagmus, Hyperästesie einzeln oder gemeinsam auftreten. Spezialformen: Hyperkeratose der Fussballen (hard pad disease) und "old dog encephalitis" (ODE) sind Folgekrankheiten von Staupe, die heute eher selten auftreten. Die Pathogenese dieser Formen ist nicht völlig geklärt. ODE ist durch progressive motorische und mentale Ausfallserscheinungen gekennzeichnet und verläuft in der Regel fatal. Diagnose Bei fieberhaften Allgemeinerkrankungen der Fleischfresser an Staupe denken, speziell wenn Respirationstrakt, Darmtrakt, ZNS (u.U. Wesensveränderungen) mitbetroffen sind. "hard pat disease" und "old dog encephalitis" verlaufen oft recht typisch. Seite 216 Kapitel, Staupe Differentialdiagnosen Toxoplasmose, HCC, Parvovirose, Leptospirose, Mannheimien, Salmonellose, Tollwut. Bei Verdacht Einsendung von Untersuchungsmaterial absprechen mit: Institut für Veterinärpathologie, Vetsuisse Fakultät Zürich, Wintherturerstrasse 268, 8057 Zürich, 044 635 8552 (Prof. Pospischil) oder Institut für Tierneurologie, Vetsuisse Fakultät Bern, Bremgartenstrasse 109a, 3012 Bern, 031 631 2525 (Prof. Vandevelde). Untersuchungsmaterial Konjunktivalabstriche. Tiefgefrorenes Organmaterial. Labordiagnose Antigennachweis mittels Immunfluoreszenz von Abstrichen der Konjunktiven oder post mortem von Lymphknoten, Blasenepithelien. Im ZNS ist das Zerebellum am besten geeignet. Virusisolation ist sehr schwierig. Wildstämme vermehren sich schlecht auf konventionellen Zellkulturen. In protrahierten Fällen können neutralisierende Antikörper die Anzucht der Viren erschweren. Seite 217 Kapitel, SVD SVD Autor: Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc SVD Swine vesicular disease SVD wird durch das porcine Enterovirus Typ 9 verursacht und ist eine akute, hochkontagiöse Viruserkrankung der Schweine. Sie stellt eine der wichtigsten Differentialdiagnosen zu MKS dar. Charakteristisch sind, wie bei MKS, Aphten und Erosionen im Bereich der Maul- und Nasenschleimhaut sowie an den Klauen. Besonderheiten Tenazität: extrem hoch Übertragung: Infolge der hohen Tenazität ist auch die indirekte Übertragung wichtig, z.B. mit Gemüse und Salate, welche mit Schweinejauche gedüngt worden sind. Nur Schweine betroffen. Geschichte Erstmals 1966 in Italien beschrieben. Später traten Fälle in Hong Kong und verschiedenen Ländern Europas auf. 1973, bisher einziger Ausbruch in der Schweiz. Heute gilt die Schweiz als amtlich frei von SVD. Verbreitung Sporadisch in verschiedenen europäischen Ländern Erreger Porcines Enterovirus Typ 9. Familie Picornaviridae, Gattung Enterovirus. Verwandtschaft mit dem Coxsackie B5 Virus des Menschen. Struktur wie MKSV Virusvermehrung und Genexpression Vgl. MKS Epidemiologie Das eigentliche Virusreservoir ist nicht bekannt. Von unseren Haustieren ist nur das Schwein empfänglich. Virusausscheidung über aufbrechende Aphten sowie in Kot und Urin während mindestens 20 Tagen. Hauptübertragung durch indirekten Kontakt, kontaminierte Futtertröge, Transportfahrzeuge, Geräte, Verfütterung von erregerhaltigen Fleischabfällen oder kontaminierten Gemüsen und Salaten. Desinfektion Extrem hohe Tenazität. Das Virus bleibt in kühler und feuchter Umgebung mehrere Monate infektiös, in tiefgekültem Fleisch sogar jahrelang. Es sind pH Werte >12.5 oder <2.5 für die Desinfektion notwendig. Pathogenese Vgl. MKS. Inkubationszeit: 2-7 Tage. Seite 218 Kapitel, SVD Immunreaktion Vgl. MKS Prophylaxe und Bekämpfung Es existiert kein Impfstoff. Falls doch einer erhältlich wäre, wäre er aufgrund seuchenpolizeilicher Bestimmungen in der Schweiz trotzdem verboten. Die Prophylaxe erfolgt durch Importkontrollen und Meldepflicht. SVD wird als hochansteckende Tierseuche bekämpft. Es wird kein Unterschied zu MKS gemacht. Die ganzen Schlachtkörper gelten als ungeniessbar und werden unschädlich beseitigt. Klinik Klinisch nicht von MKS unterscheidbar. Die Hauptsymptome sind hohes Fieber, Aphten am Kronsaum, im Zwischenklauenspalt, auf der Maulschleimhaut, der Rüsselscheibe, seltener auf der Zunge. Je nach Schweregrad der lokalen Läsionen kommt es zu Lahmheit und Problemen bei der Futteraufnahme. Abheilung der Läsionen innert zwei bis drei Wochen. Bei Muttersauen wird auch ein sehr milder, nahezu symptomloser Verlauf beobachtet. Im Unterschied zu MKS tritt SVD nur beim Schwein, nicht aber bei anderen Paarhufern auf. Diagnose Beim Auftreten von fieberhaften Erkrankungen bei Schweinen mit Blasen an Zunge, Maulschleimhaut oder Kronsaum und Zwischenklauenspalt immer sowohl an MKS wie auch SVD denken. Differentialdiagnosen MKS, Vesikuläre Stomatitis (Rhabdoviridae), Vesikuläres Exanthem (Calicivirus). Bei Verdacht Institut für Viruskrankheiten und Immunprophylaxe (IVI) 031 848 9211 benachrichtigen und Einsendung von Untersuchungsmaterial absprechen. Siehe auch Internet homepage des Bundesamtes für Veterinärwesen unter folgendem URL: http://www.bvet.admin.ch/tiergesundheit/00178/00180/00398/i ndex.html?lang=de Untersuchungsmaterial Frische Aphten, grosszügig ausgeschnitten, in sterilen Blutröhrchen, Aphtenflüssigkeit auch in Glycerin-PhosphatPuffer pH 7.5; Blutproben für Serologie: 5 ml Serum oder 10 ml antikoaguliertes Blut. So schnell wie möglich (Auto, Express) nach Absprache an das Institut für Viruskrankheiten und Immunprophylaxe, 3147 Mittelhäusern bringen. Labordiagnose KBR, RT-PCR und ELISA. Virusisolation in Zellkulturen dauert mehrere Tage. SNT und ELISA für Serologie. Seite 219 Kapitel, Tollwut Tollwut Autoren: Alfred Metzler, Mathias Ackermann File Info: TPT22:\Vorlesung\Portrats0203.doc Rabies Tollwut / Rabies / Lyssa / Hydrophobie Die Tollwut (TW) ist eine seit Jahrhunderten bekannte und, da meist tödlich verlaufend, gefürchtete Viruskrankheit des zentralen Nervensystems (ZNS). Sie kommt bei warmblütigen Tieren und als Zoonose auch beim Menschen vor. Je nach Kontinent und Region sind verschiedene Carnivoren (allen voran Hunde und Füchse, in Zentralamerika auch blutsaugende Fledermäuse) als das natürliche Virusreservoir bekannt. Besonderheiten Die Virusübertragung erfolgt in aller Regel durch Bisse tollwütiger Tiere, deren Speichel das Virus enthält. Zinke wies diesen Sachverhalt bereits 1804 nach, indem er das Krankheitsbild durch Übertragung von infektiösem Speichel experimentell reproduzieren konnte. Die Besonderheiten der Pathogenese (lange Inkubationszeit) werden beim Menschen zur Durchführung postexpositioneller Impfungen genutzt. Seit Mitte der 80er Jahre weiss man bei europäischen Fledermäusen über die Existenz von Tollwutvirusähnlichen Vertretern, die beim Menschen bisher zu zwei Krankheitsfällen geführt haben. Der gebräuchliche Tollwutimpfstoff deckt diese Erregertypen nicht ab. Die in Europa vorherrschende Fuchstollwut (silvatische TW) wird mit grossem Erfolg durch orale Impfung des Fuchsbestandes eingedämmt. In der Schweiz verzeichnete man den letzten Fall von Fuchstollwut im Frühjahr 1996. Nach den Richtlinien der WHO (keine Fälle seit mindestens 2 Jahren) gilt die Schweiz heute offiziell als "frei von Tollwut". Dieser Status wurde im Sommer 2002 vorübergehend aufgehoben (siehe Bedeutung Schweiz, Fall 3). Geschichte Verbreitung Die TW kommt mit Ausnahme von Australien und der Antarktis auf allen Kontinenten vor. In Europa ist Grossbritannien dank rigoroser Quarantäne-Massnahmen von der aktuellen Epidemie verschont geblieben (Ausnahme: 1 Fall von Fledermaustollwut). Die epidemiologische Besonderheit Übertragung des Erregers durch Biss tollwütiger Tiere- ist schon lange bekannt. Seite 220 Kapitel, Tollwut Einer der frühesten Hinweise auf diesen Sachverhalt stammt aus dem 3. Jahrtausend v. Chr. (Eshnunna-Kodex). Dieser besagt, dass die Behörden gehalten sind, vom Besitzer eines tollwütigen Hundes zu verlangen, dass das Tier eingesperrt werde. Falls dem Gebot nicht Folge geleistet würde und der Hund die Krankheit weiter verbreitete, müsste mit einer Busse gerechnet werden: 40 Schekel Silber für einen freien Mann und 15 Schekel Silber für einen Sklaven. Im Mittelalter war die TW mit viel Aberglauben verbunden. In Europa begann die Ausbreitung der TW gegen Westen an der Grenze zwischen Russland und Polen. 1967 verzeichnete man die ersten Fälle in der Schweiz und 1982 erreichte die Seuchenfront die französische Kanalküste. 1989 war in Europa das Jahr mit der grössten Anzahl gemeldeter Tollwutfälle. 1978 führte die schweiz. Tollwutzentrale die ersten Feldversuche zur oralen Immunisierung der Füchse durch, und von 1983 - 1989 bauten alle von der Seuche betroffenen westeuropäischen Länder eine Bekämpfungsstrategie auf, deren zentrale Massnahme die Immunisierung der Füchse mittels Impfködern ist. Fast überall erzielte man mit dieser Methode spektakuläre Anfangserfolge, aber etliche Länder (darunter auch die Schweiz) mussten in den frühen 90er Jahren mit hartnäckigen Reinfektionen in stark angestiegenen Fuchspopulationen kämpfen. Inzwischen hat sich der Erfolg der oralen Immunisierung dank methodischer Anpassungen wieder eingestellt. Mit der Entwicklung wirksamer Impfstoffe ist die Inzidenz der Krankheit in den betroffenen Ländern deutlich zurückgegangen. Nachdem die Schweiz frei von Tollwut ist, interessiert besonders die Situation im Ausland. In der Nähe der Grenze sind seit 1997 keine Tollwutfälle mehr aufgetreten. Italien ist tollwutfrei. In Österreich ist der letzte Tollwutfall im Tirol im ersten Quartal 1997 diagnostiziert worden; seither sind die Fälle nur noch entlang der Grenze zur Tschechischen Republik und zu Ungarn aufgetreten. Die am nächsten zur Schweiz liegenden Tollwutherde in Deutschland waren 1997/98 im Saarland, etwa 200 km von der Schweiz entfernt. In Frankreich sind in den vergangenen zwei Jahren lediglich vereinzelte Fälle im Grenzgebiet zum Saarland und zu Belgien vorgekommen. Unsere Nachbarländer dürften in absehbarer Zeit ebenfalls tollwutfrei werden. In zahlreichen Entwicklungsländern stellt die TW nach wie vor ein volksgesundheitlich schwerwiegendes Problem dar. Man nimmt an, dass der Krankheit jährlich >25'000 Menschen zum Opfer fallen. Die Fälle treten zumeist als Folge von Bissen durch tollwütige Hunde auf (urbane TW). In Zentralamerika führt die TW bei Rindern noch immer zu namhaften Verlusten (500'000 Abgänge pro Jahr), wobei das Virus dort v.a. durch blutsaugende Fledermäuse übertragen wird. In Europa stellt der Fuchs (V. vulpes) das natürliche Erregerreservoir dar (silvatische TW). Seite 221 Kapitel, Tollwut Bedeutung Schweiz Seit dem Frühjahr 1996 sind bei Füchsen keine Krankheitsfälle mehr aufgetreten. Hingegen gab es drei Fälle von Tollwut beim Hund sowie einen folgenschweren Fehlalarm. Die Besonderheiten dieser drei Fälle, einschliesslich des Fehlalarms, sollen kurz dargestellt werden. Fall 1. 7 Mte. alter Dobermannrüde, der fachgerecht gegen TW geimpft worden war. Zeigte ab Mitte Dezember 1996 reduzierte Futteraufnahme und zunehmende Aggressivität. Biss 3 Angehörige der Besitzerfamilie. Wurde am 20. Dez. euthanasiert. Am 10. Januar wurde definitiv TW diagnostiziert. Warum versagte die Impfung? Wo infizierte sich das Tier? Warum liess die Diagnose so lange auf sich warten? -> der Immunfluoreszenztest verlief negativ. Da jedoch Personen gebissen worden waren, wurde eine Virusisolierung in Zellkulturen angesetzt. Diese verlief schliesslich nach 3 Passagen (4 Wochen) positiv. Es wurden rund 50 Personen eruiert, die mit dem Hund während der Krankheit Kontakt gehabt hatten; darunter auch mehrere Kinder einer Spielgruppe. Bei den exponierten Personen wurde eine postexpositionelle Impfung veranlasst. Insgesamt wurden 25 Hund-Hund-Kontakte ermittelt. Es wurden spezifische Massnahmen anberaumt: Impfung, 30 Tage dauernde Quarantäne. Fall 2. Ein aus Marokko stammender Hund wurde ohne sichere Impfanamnese am 19. Oktober 1997 in die Schweiz gebracht. Zwei Tage später erste Krankheitszeichen. Der behandelnde Tierarzt stellte den Patienten unter Quarantäne und informierte das kant. Veterinäramt über den bestehenden Tollwutverdacht. Nach der Euthanasie des Tieres bestätigte die anschliessende Untersuchung den Tollwutverdacht. Konsequenzen: 15 postexpositionell geimpfte Personen sowie zahlreiche Nachimpfungen bei Hunden. Folgerung: Bei aus Drittweltländern importierten Hunden und Katzen muss insbesondere bei nicht gesicherter Impfanamnese mit dem Auftreten von TW gerechnet werden. Fall 3. Im Jahr 2003 wurde in Genf ein Findlingshund, der nahe der französischen Grenze gefunden worden war, von einer Familie adoptiert. Im Juli wurde beim Tier Tollwut festgestellt. Die molekulare Analyse des Virusisolates ergab den Hinweis, dass das Virus und damit der Hund selber aus Nordafrika stammen mussten (Mitteilungen BVet, 20/03 vom 2.10.2003). Mit diesem Fall verlor die Schweiz zeitweilig die offizielle Anerkennung als "frei von Tollwut". Seite 222 Kapitel, Tollwut Fehlalarm. Am 22. Oktober 1997 wurde eine Katze in schlechtem Allgemeinzustand aus Vorarlberg in die Schweiz zu einer tierärztlichen Untersuchung gebracht. Die histologische Untersuchung ergab Tollwutverdächtige intrazytoplasmatische Einschlusskörperchen, die später als nicht TW-spezifische Löwentalkörperchen (?) eingestuft wurden. Die weitergehende Untersuchung in der Tollwutzentrale verlief ohne TW-Bestätigung. Konsequenzen: ca. 30. vorsorglich geimpfte Personen. Erreger Die nachstehende Abbildung veranschaulicht den strukurellen Aufbau eines Rhabdovirus (oben) sowie die Anordnung der Gene in der einzelsträngigen Negativstrang-RNS (unten). Das Virusgenom besteht aus einer einzelsträngigen, 11-12 kb umfassenden RNS mit negativer Polarität -> (-)ssRNS. Es umfasst die Gene für 5 Strukturproteine sowie am 3'-Ende eine sogenannte Leadersequenz von rund 50 Basen, der bei der Transkription eine Initiatorfunktion zukommt. Rhabdoviren sind bei warm- und kaltblütigen Vertebraten sowie bei Arthropoden und im Pflanzenreich weit verbreitet (Tab. 1). Mit Ausnahme des Rabiesvirus weisen die meisten Lyssaviren ein enges Wirtsspektrum auf. Die bei Warmblütern bekannten Rhabdoviren werden 3 Gattungen zugeordnet: Lyssavirus (Tollwut- oder Rabiesvirus), Vesikulovirus (Vesikulärstomatitisvirus = VSV) und Ephemerovirus. Abb. 1. Struktureller Aufbau and Anordnung der Gene in der (-)ss RNS eines Rhabdovirus. Das bei uns relevante Tollwutvirus (Serotyp 1) reagiert serologisch einheitlich, obwohl Antigenvarianten mit monoklonalen Antikörpern identifiziert werden können. Es ist nicht bekannt, ob Epitopdifferenzen beim Wildtypvirus (Strassenvirus) auch unterschiedliche Pathogenität für Mensch und Tier zeigen. Seite 223 Kapitel, Tollwut Als enge Verwandte des Tollwutvirus gelten das Lagos bat virus (Serotyp 2), das Mokola virus (Serotyp 3), das Duvenhage virus (Serotyp 4) sowie die europäischen Fledermaustollwutviren 1 (Serotyp 5) und 2 (Serotyp 6). Seit kurzem kennt man einen 7. Serotyp (Australian bat virus). Die einzelnen Serotypen weisen auf dem Nukleoprotein N •80% Aminosäurehomologien auf. Das G-Protein zeigt serotypenspezifische Unterschiede, so dass keine wirksame Kreuzimmunität zustande kommt. Genus Lyssavirus Serotyp 1 2 3 4 5 6 7 Vesikulovirus Ephemerovirus Cytorhabdovirus Nucleorhabdovirus Bezeichnung Rabies Lagos bat Mokola Duvenhage Europ. bat 1 Europ. bat 2 Austr. bat Wirte Vertebraten Fledermäuse Fledermäuse, Nager Fledermäuse Fledermäuse Fledermäuse Fledermäuse* Vertebraten Wiederkäuer Pflanzen Pflanzen Tab. 1. Rhabdoviridae: Taxonomischer Status des Tollwutvirus. *vereinzelt Fälle beim Menschen beschrieben. Vermehrung Die Virusvermehrung erfolgt ausschliesslich intrazytoplasmatisch (Abb. 2). 1. Das Virus adsorbiert mit Hilfe des Membranglykoproteins G an die Wirtszelle. Es kommt zur Fusion von Virus- und Zellmembran. 2. Nach erfolgter Penetration des Nukleokapsids in das Zytoplasma induzieren die Virion-assoziierten Proteine des Polymerasekomplexes (P, N und L) die Bildung von 5 mRNSSpezies, die ihrerseits in die 5 Strukturproteine N, P, M, G und L translatiert werden. 3. Die Translation der mRNS erfolgt mit Ausnahme des Glykoproteins G an frei im Zytoplasma liegenden Ribosomen. Die Translation von Protein G verläuft an ER-ständigen Ribosomen. Protein G wird kotranslational glykosyliert (Nglykosidische Bindung von Zuckerresten) und im GolgiApparat posttranslational modifiziert (Trimmung der erstgebundenen Zucker und O-glykosidische Bindung weiterer Saccharide). Seite 224 Kapitel, Tollwut Virion-Enzyme (RNS-Polymerasen) (-)ssRNS Zellkern mRNS Strukturproteine dsRNA (-)ssRNS Virionen Abb. 2. Strategie der Virusvermehrung (Rhabdoviridae). Die Neubildung viraler RNS beinhaltet die Bildung eines komplementären (+ sense) Ribonukleoproteinkomplexes, der seinerseits in Ribonukleoproteinkomplexe mit negativer Polarität (- sense = Virion-RNS) umgeschrieben wird. Die RNS-Vermehrung setzt uneingeschränkte Synthese der Proteine N, P und L voraus. 4. Protein G wird mit Golgi-Vesikeln zur Zellmembran und/oder zu intrazytoplasmatischen Membranen transportiert und dort in dieselben integriert. Die übrigen Virusproteine verbinden sich mit neugebildeter Virus-RNS. Die resultierenden Viruskapside sprossen anschliessend dort an Zellmembranen, wo Protein G angereichert vorliegt. Die Virusreplikation verläuft protrahiert zytolytisch. Epidemiologie Das Tollwutvirus wird in erster Linie durch den Biss erkrankter Tiere mit Speichel übertragen. Das Virus dringt nicht durch die intakte Haut. Die Schleimhäute des NasenRachenraumes stellen eine Infektionspforte dar (wichtig bei der oralen Immunisierung der Füchse). Beim Hund ist bekannt, dass das Virus bis zu 2 Wochen vor Auftreten klinischer Symptome ausgeschieden werden kann. Umgekehrt scheidet nicht jedes tollwütige Tier Virus mit dem Speichel aus. Da das Virus generell in verschiedenen Organen verbreitet ist, muss dies bei der Ausweidung/Sektion getöteter oder verendeter Tiere berücksichtigt werden. Bei tollwütigen Rindern kann klinisch ein verstärkter Geschlechtstrieb oder auch Verdacht auf Fremdkörper bestehen. Bei der manuellen Untersuchung der Maulhöhle ist deshalb Vorsicht geboten. Die Hauptwirte sind immer auch Opfer der TW, da die Infektion auch hier tödlich endet. Je nach Hauptreservoir werden drei epidemiologische Formen der Tollwut unterschieden: Seite 225 Kapitel, Tollwut • • • Urbane Tollwut: Bei dieser Form sind Hunde das wichtigste Virusreservoir. Weltweit gesehen ist dies die für den Menschen gefährlichste und bedeutendste Form. In vielen wenig entwickelten Ländern bildeten sich grössere Populationen wild lebender Hunde, die sich von Abfällen ernähren und sowohl in der Stadt (-> urban) als auch in ländlichen Gegenden vorkommen. Silvatische Tollwut: Das Virusreservoir besteht in frei lebenden Wildtieren. In Nord- und Zentralamerika sind (Polar-) Fuchs, Stinktiere, Waschbären als natürliches Erregerreservoir anzusehen. In den Steppen des asiatischen Raumes kommt dem Wolf diese Rolle zu. In Europa ist es der Rotfuchs. Ausgehend vom natürlichen Virusreservoir wird die Infektion auf andere Wildtiere (Reh, Marder, Dachs etc.), dann aber auch auf Haustiere übertragen. Bei uns erfolgte die Übertragung auf den Menschen zumeist durch infizierte Haustiere (Fuchs -> Katze > Rind >> Hund). Fledermaustollwut: Auch in blutsaugenden (Südamerika) sowie Insekten-fressenden (Nordamerika, Afrika, Europa) Fledermäusen kann das Tollwutvirus ein Reservoir etablieren. Diese scheiden das Virus möglicherweise mit dem Kot oder Urin aus, welcher in dunklen, trockenen Höhlen zu Staub zerfällt, der das infektiöse Virus über lange Zeit enthalten kann. Aufgrund dieser Spezialität sind aerogene Infektionen bei Höhlenforschern bekannt geworden. In der Schweiz wurden bislang 3 Fälle von Fledermaustollwut registriert, der jüngste am 17. September 2002 in Genf. Schliesslich ist spezielle Aufmerksamkeit beim Umgang mit dem Virus in Laboratorien geboten (Aerosole, Verletzungen). Der Vollständigkeit halber sei erwähnt, dass Tollwut iatrogen, anlässlich von Hornhauttransplantationen von Mensch zu Mensch übertragen worden ist. Desinfektion Tollwutviren zeigen gegenüber Umwelteinflüssen geringe Tenazität. Bei Temperaturen um 23°C und in Dunkelheit geht die Infektiosität in Abhängigkeit vom Ausgangstiter innerhalb weniger Tage verloren. Temperaturen von mehr als 50°C übersteht das Virus nur während Minuten. UV-Strahlen (Sonnenlicht) wirken stark viruzid. An Gras angetrocknet bleibt das Virus weniger als 24 Stunden infektiös. In Kadavern bleibt die Infektiosität indessen auffallend lange erhalten (bis zu 90 Tage beobachtet). Organische Lösungsmittel zeigen starke viruzide Eigenschaften. Ebenso Aldehyde und Phenole. Für die Wunddesinfektion sind Seifen, Detergentien (Desogen), 80% Aethanol oder Invertseifen geeignet. Seite 226 Kapitel, Tollwut Pathogenese Die Inkubationszeit dauert zwischen 3 und 9 Wochen, gelegentlich auch länger. Als Regel gilt: um so länger, je weiter die Eintrittsstelle des Virus vom Gehirn entfernt ist. An der Bissstelle kommt es zunächst zu einer lokal begrenzten Virusvermehrung in Muskel- und Bindegewebe. Diese Phase kann mehrere Wochen dauern. Da nur wenig Virus produziert/freigesetzt wird, bleibt eine Immunantwort zunächst weitgehend aus. Das Virus gelangt schliesslich in lokale Nervenendigungen und erfährt nunmehr einen auffallend schnellen axonalen Transport (3 mm/hr) zu den Ganglien des Rückenmarks und von dort weiter ins Gehirn. In den Neuronen von Rückenmark und Gehirn erfolgt eine zweite Phase der Virusvermehrung. Die Beeinträchtigung der neuronalen Funktionen führt zur Ausbildung klinischer Symptome. Grössere Virusmengen, die eine Immunantwort provozieren, werden erst spät freigesetzt. Über efferente Nervenbahnen gelangt das Virus schliesslich in verschiedene Organe, namentlich in Speicheldrüsen und Kornea. Hier erfolgt eine dritte Phase der Virusvermehrung, wobei das in den Speicheldrüsen freigesetzte Virus mit dem Sekret in die Maulhöhle gelangt. Durch die virusbedingten Wesensveränderungen bei tollwütigen Karnivoren (sie verlassen den angestammten Lebensraum und werden somit in Revierkämpfe verwickelt) ist gewährleistet, dass die Infektionskette geschlossen wird. Klinik Zunächst manifestiert sich die Infektion mit wenig charakteristischen, je nach Spezies etwas unterschiedlichen Früh- oder Prodromalsymptomen: Niedergeschlagenheit, Mattigkeit, Wesensveränderungen, Fieber, Anorexie, Übelkeit, Erbrechen sowie Parästhesien an der unter Umständen bereits verheilten Bisswunde. In der akut verlaufenden neurologischen Krankheitsphase unterscheidet man die rasende und die stille Wut. Erstere ist durch Erregungszustände, Hyperaktivität, nicht provoziertes Beissen, allenfalls Verschlingen von Gegenständen geprägt. Beim Wild entfällt die natürliche Scheu vor dem Menschen und seiner Umgebung. Beim Menschen ist eine Hydrophobie oftmals ausgeprägt (beim Versuch, Wasser zu trinken, treten Schlundkrämpfe auf). Es ist bekannt, dass das Sensorium in diesem Stadium nicht beeinträchtigt ist. Die Betroffenen erleben ihr Schicksal bewusst. Bei Rindern verzeichnet man häufig eine stille Wut, die zunächst nicht an TW denken lässt. Im letzten Krankheitsstadium, der paralytischen Phase, treten Lähmungserscheinungen, Beeinträchtigung des Sensoriums und schliesslich Koma ein. Bei Haustieren tritt der Tod innerhalb von 10-14 Tagen ein. Die Prognose ist stets ungünstig, da die Letalität auch bei einsetzender Immunantwort nahezu 100% beträgt. Über vereinzelte Fälle spontaner Heilung ist bei Mensch und Hund berichtet worden. Seite 227 Kapitel, Tollwut Immunreaktion Zu Beginn der Erkrankung sind die meisten Tiere, aber auch der Mensch, ohne nachweisbare Serumantikörper. Eine Serokonversion tritt erst nach 8-10 Krankheitstagen auf. Die nunmehr auftretenden hohen Antikörpertiter vermögen den letalen Ausgang der Krankheit jedoch nicht mehr zu verhindern. Immunprophylaxe F u c h s t o l l w u t . Die TW kann durch Eradikation des Erregers beim natürlichen Virusreservoir wirksam unter Kontrolle gebracht werden. Bei uns geht es also darum, die Fuchstollwut zu bekämpfen. In den 60er und zu Beginn der 70er Jahre versuchte man, allerdings ohne den erhofften Erfolg, den Fuchsbestand durch Abschuss und Begasung der Fuchsbauten auf eine für die TWAusbreitung kritische Dichte zu reduzieren (< 1 Fuchs/2 km2). Seit 1983 setzt man europaweit sehr wirksame attenuierte Lebendimpfstoffe oder Vaccinia-Rekombinanten ein. In verseuchten Gebieten werden 2 mal jährlich virushaltige Köder ausgelegt. Das Impfvirus wirkt über eine Infektion der lymphatischen Gewebe im Rachenraum. Dem Impfstoff zunächst zugesetzte Tetrazykline wurden resorbiert und in der Knochenmatrix eingelagert. Hierdurch ergab sich ein zusätzlicher Marker, anhand dessen bei erlegten Tieren auf die Aufnahme des Impfstoffes geschlossen werden konnte. H a u s t i e r t o l l w u t . Prophylaktisches Impfobligatorium für Hunde: Vakzination im 2-Jahresrhythmus mit inaktiviertem Impfstoff. In TW-Schutzzonen Leinenzwang. Streunende Hunde können erlegt werden. Inaktivierte Impfstoffe für Katzen, Wiederkäuer und andere Haustiere sind verfügbar. T o l l w u t b e i m M e n s c h e n . Prophylaktische Impfung beruflich exponierter Personen mit inaktivierten ZellkulturImpfstoffen (heute insbesondere TierärztInnen, die importierte Haustiere betreuen). Pathologie Nicht spezifisch. Histologisch findet man alle Anzeichen einer nicht-eitrigen Meningoenzephalitis. In rund 80% der Fälle finden man im histologischen Präparat intrazytoplasmatische Einschlusskörperchen, die in Neuronen lokalisiert sind. Diese werden nach Negri benannt, der diese Veränderung erstmals beschrieben hatte. Diagnostik Wegen des protrahierten Auftretens virusspezifischer Serumantikörper kann die Diagnose bei lebenden Individuum (indirekter Virusnachweis) meist nicht bestätigt werden. Verdächtige Tiere wird man allenfalls unter Quarantäne stellen, bis die Krankheit ausgeprägt ist, danach euthanasieren und den (direkten) Virusnachweis immunhistologisch oder mit Hilfe von RT-PCR führen. Die Einschlusskörperchen können, wie das beim 3. Beispiel (Bedeutung für die Schweiz) deutlich wurde, auch irreführen. Beim Menschen wurde Virusantigen gelegentlich an Kornea-Abklatschpräparaten und in Hautbiopsien festgestellt. Seite 228 Kapitel, Tollwut Virusnachweis und/oder Virusisolierung werden am schnellsten und sichersten mit Gewebe aus Ammonshorn, Cortex, Kleinhirn oder Medulla oblongata sowie aus Speichel und Speicheldrüsen geführt. Tollwutvirusspezifische Antikörper lassen sich am besten mit Hilfe eines modifizierten Serumneutralisationstests ermitteln: Fluoreszenzfokus-Hemmtest. Hier wird die neutralisierende Eigenschaft von Antikörpern daran bemessen, dass die Anzahl fluoreszierender (infizierter) Zellen im Vergleich zu einer Viruskontrolle reduziert ist (damit umgeht man die Schwierigkeit, die mit der geringen zytopathischen Wirkung von TW-Virus verbunden ist). Heute sind ELISA's für den Nachweis TW-virusspezifischer IgG und IgM im Handel erhältlich. Differentialdiagnostisch müssen alle Enzephalitiden anderer Genese ausgeschlossen werden. Therapie Bei Tieren sind Therapieversuche verboten. Postexpositionelle Impfung ist heute beim Menschen etabliert. Die zur Verfügung stehenden inaktivierten Impfstoffe haben gegenüber älteren Produkten den Vorteil, dass mit einer sehr geringen Anzahl von Injektionen eine belastbare Immunität induziert werden kann und Impfkomplikationen nur selten sind. Die postexpositionelle Immunisierung soll von einer adäquaten Wundversorgung sowie der lokalen Applikation eines spezifischen Antikörperpräparates begleitet sein. Staatl. M'nahmen Tollwut ist anzeigepflichtig. Im Verdachtsfall Meldung an Kantonstierarzt. Gegebenenfalls den Kopf getöteter Tiere einsenden an die schweizerische Tollwutzentrale, Institut für Veterinärvirologie, Vetsuisse Fakultät Bern, Länggass-Str. 122, 3012 Bern. Für Rückfragen und Auskunft: 031 631 2378 oder Fax 031 631 2534. Seite 229 Seite 230