Zerebrale Zirkulation
Werbung

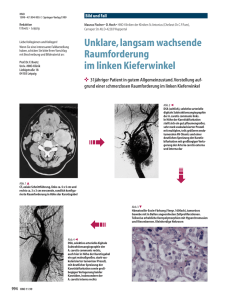
Zerebral Zirkulation / HIRNSCHLAG (Schlaganfall / STROKE) PATHOPHYSIOLOGIE DER HIRNKREISLAUF (Epidemiologische Daten) In der westlichen Welt stehen die zerebrovaskularen Erkrankungen an dritter Stelle der Todesursachen nach den Koronaerkrankungen und den malignen Erkrankungen (Krebs), und die sind die häufigste Ursachen für im Erwachsenenalter erworbene Behinderung. Die Inzidenz beträgt hier etwa 150 Falle/100 000 Einwohnern/Jahr. Die in Folge eines Gefäßverschlusses im Gehirn auftretende verschiedene ischämische Hirnparalyse-Formen („ischämisches Stroke”), gehören hierher („Hirnschlag” = „Schlaganfall” oder „Schlägli”) aber auch eine der Formen der Hirnblutung – „hämorrhagisches Stroke” (Apoplex) - gehört auch hierher. Etwa 84% sind ischämisch und etwa 16% sind hämorrhagisch bedingt, davon 10% sind intrazerebral, 6% sind subarachnoidal. Dauern die Symptome weniger als 24 Stunden, spricht man von einer transitorischen ischämischen Attacke (TIA), dauern sie länger als 24 Stunden von einem Stroke / Hirnschlag / Schlaganfall / zerebraler Infarkt. Die Mortalität variiert von Land zu Land von 20 bis zu 250 / 100.000 pro Jahr. Innerhalb Europas ist die Mortalität des Hirnschlages am tiefsten in den Niederlanden, in skandinavischen Ländern und in der Schweiz, am höchsten in Osteuropa. Eine epidemiologische Studie in Deutschland errechnete in einer populationsgestützten Kohortenstudie eine Inzidenz für den ersten Hirnschlag von 2/1000 für Männer und 1,7/1000 für Frauen. Die Letalität nach 28 Tagen betrug 19,4% für alle Hirnschlagarten, am tiefsten war sie für ischämische Hirnschläge mit 11,5 %. Die Inzidenz nimmt mit steigendem Lebensalter zu, etwa die Hälfte der Schlaganfall-patienten ist über 70 Jahre alt. Männer sind in fast allen Altersstufen etwa 30% häufiger betroffen, nur in der Altersgruppe über 85 Jahre erkranken und sterben mehr Frauen am Schlaganfall und seinen Folgen. Gefäßversorgung des Gehirns (Anatomische Umstände): Kollaterale Verbindungen zwischen den Blutgefäßen schützen das Gehirn, wenn ein Teil des vaskulären Systems des Halses blockiert ist. Im Circulus arteriosus Willisii: sind die beiden Aa. Cerebri durch die A. communicans anterior und die Aa. cerebri posteriores mit den Aa. carotis internae über die Aa. communicantes posteriores verbunden. Dieser Circulus ist in mehr als 20 % der Bevölkerung inkomplett angelegt. Bei Patienten, die einen SchlaganfalI erleiden ist dies häufiger der FalI als in der Gesamtbevölkerung. Da sind andere Verbindungen zwischen die A. A. comm. A. c. ant. ophthalmica mit Ästen der A. carotis externa in der ant. Orbita und auch die Ästen der Zerebrale Arterien im Meninx aber die sind funktionell nicht wichtig. A. c. media Grenz- und Endzonen: Verbindungen zwischen A. cerebri media, A. cerebri ant. & A. carotis int. A. cerebri post. an den Gehirnoberflächen A. comm. A. c. post. post. sichern die Blutversorgung der sog. Grenzzonen/ „Wasser-scheide" zwischen den einzelnen A. carotis externa A. Gefäßversorgungen. Die kleinen Gefäße, die vom Basil. Circulus Willisii und von proximalen großen Gehirn-arterien abstammen, haben keine Aa. Vert. Anastomosen. Die durch sie versorgten tiefer liegenden Gehirn-regionen werden als Endzonen bezeichnet. Regulation der Gehirngefäße (Physiologie) Gehirngefäße können ihren Eigendurchmesser verändern. Man unterscheidet 2 Formen der Autoregulation. Die erste Autoregulation ist vom systemischen Blutdruck abhängig, die zweite hängt vom arterieIlen Blutgasdruck und pH-Wert ab. 1. Autoregulation über den Blutdruck: Gehirnarteriolen konstringieren, wenn der systemische Blutdruck steigt und dehnen sich, wenn er sinkt. Beide Formen der Anpassung helfen, eine optimale zerebrale Durchblutung (Cerebral Blood Flow: CBF) zu sichern. Bei einem arteriellen Mitteldruck von 50-60 bis 150-160 Hgmm ist das CBF stabil. Das bedeutet, dass selbst bei einem arteriellen Mitteldruck von 60-70 Hgmm ein akzeptabler Kreislauf funktioniert, vorausgesetzt, dass der Patient sich in einer horizontalen Körperosition befindet. (Bei der Berechnung des arteriellen Mitteldrucks muß man außer den Druckwerten auch die Zeiten für Systole und Diastole in Betracht ziehen). Über- oder unterhalb dieser Blutdruckwerte steigt oder fallt die zerebrale Durchblutung linear. Ein extrem hoher arterieller Blutdruck durchbricht die Autoregulation. CBF(ml/100g/min) Der auf 100 g Gewebe bezogene Durchfluss ist 60ml/100g/min (Die Strömung der Rinde beträgt 80 ml/100g/min). Wenn dieser Wert auf 20 ml/100g/min sinkt, kann mit funktionellen Störungen gerechnet werden. Elektrische Stille wurde beim Primaten mit einer Durchblutungsverminderung auf 15 ml/100g/min erzeugt, bei einem Rückgang auf 10 ml/100g/min bilden sich irreversible strukturelle Veränderungen. Art. Mitteldruck (Hgmm) 2. Autoregulation über die Blut- / Gewebegase & die Wasserstoffionenkonzentration (pH): Bei Hypokapnie/pC02↓ (z.B. im Rahmen einer Hyperventilation) verengen sich die Gefäße und die zerebrale Durchblutung nimmt ab. Steigt der arterielle pC02↑ (Hyperkapnie), erweitern sich die Arteriolen und der zerebrale Blutfluss steigt an. Diese Regulation ist sehr empfindlich: Eine Inhalation von 5% C02 erhöht die zerebrale Gefäßdurchmesser um 50%, die von 7% verdoppelt sie. Eine Änderung des arteriellen p02 führt zu einer entgegengesetzten, jedoch geringer ausgeprägten Antwort: Einatmen von Sauerstoff verringert die zerebrale Durchblutung um etwa 13 %. Ein nur 10%-iger Sauerstoffanteil in der Atemluft bedingt einen Anstieg der Hirndurchblutung um 35%. Wichtige vasodilatorische Wirkung haben noch die metabolische produkte:H+(Azidose) K+, Adenosin & NO (Stickstoffmonoxide), weil Alkalose ist vasokonstriktiv. Diese Regulationsvorgänge schützen das Gehirn, indem sie das Sauerstoffangebot erhöhen und gleichzeitig im Rahmen der Hypoxie und Ischamie entstandene sauere Metabolite abtransportieren helfen. So kann sich das Gehirn an die lokale veränderlichen Funktionen durch Umstrukturierung des hirninternen Kreislaufs anpassen (Roy-Sherrington-Prinzip). Weil die gesamte Durchblutung des ganzen Gehirns ziemlich stabil bleibt, Areale Heterogenität im Blutfluss spiegelt regionale Differenzen in der Gehirnaktivität. Aus den Abweichungen des Kreislaufs kann man Rückschlüsse auf die Funktion ziehen. Die Infrakamera nimmt die aktiven Regionen mit einem gesteigerten Kreislauf wärmer war (Tier-experimente), auch das PET (PozitronEmissions-Tomographie) signalisiert die Regionen mit einer gesteigerten Strömung (klinische Setzung). !! Merke !!: Bei der Regulierung des Hirnkreislaufs spielt das sympathische bzw. das parasympathische Nervensystem kaum eine Rolle. (Ausser Migrain?) Die Gehirnmasse (~ 1,5 kg) beträgt gerade einmal 2 % der Gesamtkörpermasse, demgegenüber macht der Hirnkreislauf 15 % des Herzminutenvolumens aus, 25 % des gesamten Sauerstoffverbrauchs und 70 % des Glukoseverbrauchs entfallen auf das Hirn. Der Sauerstoffverbrauch des Hirngewebes beträgt im Durchschnitt 3,5-4 ml/100g/min (der Verbrauch der grauen Substanz ist höher, der Verbrauch der weißen Substanz etwas niedriger). Die Sauerstoffextraktion des Gehirns ist relativ stabil. Im Falle von Epileptischen Krämpfen (sog. „Grand-mal Attacke”) oder in der frühen Phase nach einer Kopfverletzung ist der Stoffwechsel (und Durchblutung) des gesamten Gehirns gesteigert, bei einer Schlafmittelvergiftung oder im Koma sinkt er. Die Nervenzellen enthalten keine Energiespeicher, daher verursacht ein Stillstand des Kreislaufs von 4 - 6 Sekunden eine Ohnmacht und führt innerhalb von 2 – 3 Minuten zu irreversiblen Schädigungen in der Hirnrinde. Hier ist die ischämische Präkondition nicht von Vorteil! Die Nervenzellen nutzen nicht nur die Glukose, sondern auch das von Glia-Zellen präsentierte, aus der Glukose entstehende Laktat. (das an der Peripherie entstehende Laktat gelangt nicht zu den Nervenzellen). Auch das weist auf die wichtige Rolle der (Astro)-Glia im Zentralnervensystem hin: es macht das Glutamate (GLU), der excitatorischen Neurotransmitter unwirksam (wird zu Gln umgewandelt), speichert Glykogen, produziert Wärme und versieht die Immunfunktion. Die Hälfte des Gehirns beim erwachsenen Menschen besteht aus Glia-Zellen, ihre Zahl verhält sich etwa 10:1 zur Zahl der Neuronen. (Die Neuronen sind groß, das erklärt das Gewichtsverhältnis von 1:1.) Hirnischämie (und ischämische Apoplexie) = STROKE Die Einteilung der Hirnischämie entsprechend ihrer Lokalisierung: 1. Global (das ganze Hirn ist hypoxisch) a. Herzstillstand: Adams-Stokes-Syndrome: III.Grade Sinoauriculäre- oder A-V Blockformen, Sinus arrest, Kammerfillibration. b. Späte Phase eines Kreislaufschocks, z. B. starke Blutung, kardiogener Schock (Merke!:der Hirnkreislauf hat auf Grund der Redistribution das Herzminutenvolumen lange erhalten). 2. Lokal (Regional) (ein teil des Hirns ist hypoxisch) a. Atherosklerose: Verschluß großer i.z. Arterien (Territorialinfarkt) bzw. 1 oder mehrere Hirngefäße ( Zweig der a. carotis interna oder der a. vertebralis) und eine starke > 50-60% überschreitende – Verengung. (Hier kann mann bemerken das seltene Steal-Syndrom*) b. Hirnembolie (Quellen der Embolie) I: Arterio – arteriale II: Kardiale >>>>>> Im Verlauf einer chronischen Hypertonie verschieben sich die Grenzwerte der Autoregulation stufenweise nach oben, dann kann auch bei einem erhöhten arteriellen Mitteldruck das CBF normal sein. In einem solchen Fall besteht Gefähr eher bei einem plötzlichen drastischen Absinken des Blutdrucks, da der arterielle Mitteldruck leicht unter den Unterwert der erhöhten Autoregulations-schwelle sinken und dadurch eine ischämische Attacke verursachen kann. Circ. art. Willisii. A. Basil. *Steal-Syndrom in den großen Halsgefäßen: Wenn die linke Subclavia direkt an ihrem Ausgang der Carotis distal verengt ist, dann kann bei der Bewegung des linken Arms der erhöhte Bedarf nach Blutversorgung auf der selben Seite durch die a. vertebralis (der Strom wird umgekehrt) zu Lasten des Hirnkreislaufs gedeckt werden (zumindest teilweise). „Vertebralis stiehlt Blut Vom Hirn” I: Arterio-arterielle Embolie Ein großes, von z.B. der Plaque der Carotis interna abgetrenntes Thrombus •Ausgangspunkt: - Aorta ascendens - Arteria carotis interna Abgang - Arteria vertebralis Abgang •Embolisches Material: - Plättchenthromben - Gerinnungsthromben - Bestandteile von Plaques Angiographie: Die rechte A. carotis communis mit Verschluss der A. carotis interna II: Kardiale Embolie (Gerinnungsthromben im Herzen) Beim Herzen ein bei einer Wandthrombose oder Vorhofkugelthrombose abgetrenntes Stück. Ursachen: - Absolute Arrhythmie mit Vorhofflimmer - Myokardinfarkte (die sog. Wandthrombus) - Aneurysmen des linken Ventrikels - Rheumatische Herzklappenerkrankung - Künstliche Herzklappe - Kardiomyopathie, Myokarditis, - Offenes foramen ovale (PFO: Persistende Foramen Ovale) Die Emboli können von der venösen Seite in die systemischen Arteriellen des Kreislaufs entkommen. Elektrokardiogramm des Vorhofflimmers Andere Ursachen der Ischemie Lakunäres Syndrom •Arterielle Hypertonie •Diabetes mellitus •Stenose kleiner Marklagerarterien Andere seltene Ursachen • Grenzzoneninfarkt • lokale Thrombosierung • Vaskulitis und Kollagenosen • Störungen des Gerinnungssystems • u.a. Eine kleine (100µm) arterie der Hirnparenchyma zeigt typicshe pathologische Veränderungen verursacht vom hohen Blutdruck. Die Höhle des Gefäßes ist fast Völlig verschlossen von der sich verdickerten Media u. selbst das Gefäß ist viel vergrößert. Lakunäre Infarkte sind typisch im pons und in der „basal ganglia” putamen, globus pallidus, thalamus Grenzzonen(bzw Grenzscheiden-) infarkt Grenzscheiden-Infarkt im Versorgungsgebiet der A. cerebri media und A. cerebri anterior rechts. MR-Untersuchung Die Klinische Formen der Hirnischämie: 1. Transiente ischämische Attacke (TIA): eine zwischen 5 Minuten und 24 Stunden andauernde reversible, mit vorübergehenden Symptomen einhergehende Hirnischämie. Im Hintergrund steht vermutlich ein schnell rekanalisierender Verschluss eines kleineren Hirngefäßes. Das Risiko eines innerhalb von 2 Jahren nach der TIA auftretenden mit Dauerfolgen behafteten ischämischen Stroke ist groß. 2. Chronische Ischämie (Hirninfakt): eine schnell oder langsam entstehende, aber progredierend irreversible, mit Dauerfolgen einhergehende Veränderung. Die Folgen der Hirnischämie: 1. Das Hirn toleriert nur sehr schwer eine Ischämie. Im Hirn kann man lediglich einen Stillstand des gesamten Kreislaufs von 1,5 Minuten als vollkommen reversible Funktionsstörung betrachten. Die Funktionen der Hirnrinde können auch bei einem innerhalb von 4 – 5 Minuten wiederhergestellten Kreislauf wieder aufgenommen werden. 2. Die Ischämie-Toleranz des Hirns wird noch dadurch verschlechtert, dass bei einer Ischämie der excitatorische Glu- (Glutamat) Spiegel steigt (das Release sinkt leicht und das energieintensive enzymatische Zurücknehmung(Reuptake) wird schwer geschädigt), was den Sauerstoffbedarf des Hirns steigert und die Zellschädigung verstärkt. Hoches Glu erhöht die Ca++-Aufnahme der Zellen, erhöht den Na+-Einstrom und steigert den extrazellulären (EC) K+-Spiegel und verlängert damit die Depolarisationszeit der Neuronen. NMDA-abhängige Die Inhibierung der GluCa-Einstrom Kainat und AMPA verursachten Na-Einstrom Merke: NMDA Kainat und AMPA sind syntetisch Glu- Analogen Rezeptoren (indem der NMDA-abhängige Ca++Einstrom, sowie die durch Kainat und AMPA verursachten monovalenten Kation-Ströme, d. h. der Na+Einstrom und der K+Ausstrom inhibiert werden) verbessert das Überleben der Zellen. Der Acetylcholinspiegel sinkt schnell, der Dopamin- und der Noradrenalispiegel sinken später. Die Ischämietoleranz des Hirnstammes ist wesentlich höher, er kann selbst einen Kreislaufstillstand von 20 – 30 Minuten noch überleben. 1. Induktion Der Prozess der Schädigung: Die Glukoseversorgung sinkt, pO2 sinkt, die Glu-Aktivität steigt auf Grund der in hohem Maße verminderten Reuptake. In Folge der Aktivität der NMDA- (N-methyl-D-Aspartate) Rezeptoren öffnen sich die Ca++-Kanäle, als Ergebnis der Aktivität der Kainatrezeptoren werden die monovalenten Kationkanäle aktiviert. Na+ strömt in die Zellen, K+ sickert in den EC-Raum. Diese Prozesse lösen eine erhöhte Reizbarkeit der Neuronen aus. 2. Amplifikation Der Ca++-Einstrom steigt weiter, das IP3- (Inositol-Triphosphat), DAG (Diacyl-Glycerin) System wird aktiviert, die Funktion des Enzyms Glutaminase wird gesteigert. Es entstehen Schädigungen an den Phospholipiden und der DNS. Zellenschwellung (Zellenödem bzw. Hirnödem) entsteht und dadurch volgen weitere Hinderungen in der Durchblutung. 3. Expression Der Prozess verbreitet sich und progrediert. Diese Phase ist durch die Schädigung der DNS, der Proteine und Phospholipide charakterisiert. Der Stoffwechsel der Arachidonsäure wird beschleunigt, die Aktivität der freien Radikale steigt, es entstehen Schädigungen der Membran, Verschlüsse verschlimmern den Prozess, der zu weiteren Schädigungen führt. 4. Reparation Die Funktion der nur teilweise von der Ischämie betroffenen Regionen kann sich verbessern. Ein Großteil der Penumbra* kann sich regenerieren, bzw. der Zustand der bisher ödemischen umliegenden Regionen kann sich verbessern, möglicherweise kann eine thrombolytische Behandlung den Zustand des Patienten positiv beeinflussen. Langfristig können bestimmte Funktionen auch von anderen Hirnregionen übernommen werden. (Neuron-Plastizität) „ZEIT IST HIRN” *Penumbra (Halbschatten): Ein an den bei einer Sonnenfinsternis auftretenden „Mondhof” erinnerndes Phänomen. Hier dieses Termin meint: die in der Umgebung einer nekrotischen Region (Kern: CORE) zu findende geschädigte Region. Während des fortschreitenden Prozesses wächst die Region der zentralen Nekrotisierung, die Penumbra dagegen verringert sich. Insgesamt ist im Laufe der Zeit eine Verbesserung der Funktion zu erwarten. Faktoren, die die Regeneration (Überleben) der Penumbra beeinflussen: 1. Glu-Rezeptorantagonisten (die Untersuchungen befinden sich im Versuchsstadium): sie können sich positiv auf den Sauerstoffbedarf auswirken, sie können beim Überleben der Penumbraregion helfen. 2. „Kalter Kopf”: mit einem Absenken der Gewebetemperatur sinkt auch der Stoffwechsel und damit gleichzeitig der Sauerstoffbedarf. Man experimentiert mit der Verwendung von Kühlmützen, allerdings entsprechen die Versuchsergebnisse bis jetzt nicht den Erwartungen. Ein Absenken des möglicherweise auftretenden Fiebers ist in solchen Fällen jedoch wünschenswert. 3. Beruhigungs- und Schlafmittel können auf Grund ihrer stoffwechselsenkenden Wirkung von positiver Wirkung sein. 4. Osmotische Zelldehydrierung (mit Mannitol). Die einzelne erfolgreiche Therapie Kampfen die Ödembildung (sehe unten) Strukturelle Erscheinungen Hirninfarkt Stadium I Frische Nekrose (< 12 h) • Makroskopisch: keine sichtbaren Veränderungen, leichte Verfärbung • Mikroskopisch: Neuronaler Zelluntergang beginnendes Ödem einige Granulozyten • Selektive Vulnerabilität verschiedener Strukturen (Neuronen>>Gefäße>Glia) Hirninfarkt Stadium II Erweichungstadium (ca. 24h-4Tagen) Makroskopisch: • Ödem raumfordernde Schwellung, (weichung) • Shift der Mittellinienstrukturen Mikroskopisch: • Makrophageneinwanderung, (Schaumzellen, Fettkörnchenzellen) • Ödem • nekrotische Neuronen, Gliazellen und Gefäße Phagozytose / Schwellung durch Entzündung Hirninfarkt Stadium III Resorptionsstadium (> 2 Wochen) • Makroskopisch: Pseudozystischer Defekt oder Encephalomalazie • Mikroskopisch: zellarm, einzelne Makrophagen am Rand reaktive Astrozyten nekrotische Gefäße im Zentrum Randständig kollagenfaserreiche Blutgefässe Entzündung im Hirninfarkt Exzitotoxische Mechanismen oder die Hypoxie selbst und freie oxidative Radikale (ROS) können zum akuten Zelltod (Nekrose), zum verzögerten Zelltod (Apoptose), aber auch zur Expression proinflammatorischer Gene führen. Die neu synthetisierten proinflammatorischen Faktoren umfassen Transkriptionsfaktoren wie Nuclear-factor-κB (NFκB), hypoxia-inducible factor 1 (HIF-1), interferon-regulatory-factor 1 und STAT3. Die geschädigten Zellen produzieren daraufhin platelet-activating-factor (PAF), Tumornekrosefaktor-α (TNFα) und Interleukin-1ß (IL-1ß). Diese Faktoren leiten die Expression von Adhäsionsmolekülen (z.B. interceIlular adhesion molecule-1(ICAM-1) P-Selectine und E-Selectine) auf der endothelialen ZeIloberflache ein Entzündungsreaktion. Diese Adhäsionsmoleküle reagieren mit den korrespondierenden Rezeptoren auf der Oberflache von neutrophilen Leukozyten. Die weißen BlutzeIlen werden somit an das Endothelium angeheftet, durchwandern die Gefäßwand und dringen in das Gehirnparenchym ein. Monozyten folgen den Neutrophilen und aktivieren sich zu Makrophagen. Chemokine wie IL-8 und Monocyte Chemoattractant Protein 1 (MCP-1) werden im geschadigten Hirngewebe hergestelIt und leiten die Wanderung der aus dem Blut stammenden EntzündungszeIlen zum ischamischen Gebiet, in dem nach 5 - 7 Tagen die Makrophagen und Monozyten dominieren. Die Typen des Hirnödems 1: Vasogen: Im Hintergrund steht eine Störung der Blut-Liquor-Schranke (blood-brain-barrier = BBB): auf Grund der gesteigerten Permeabilität sammeln sich Na, Wasser und Proteine im EC-Raum. Im Klinikum kann man unter den Ursachen z. B. eine lokale Ischämie oder eine Tumor finden. 2: Zytotoxisch: Es gibt sehr unterschiedliche Erscheinungsformen. Im Hintergrund steht eine Stoffwechselstörung. In deren Folge ist die Funktion der Na/K ATP-ase ungenügend, infolge eines konsekutiven Na- und Wassereinstroms schwellen die Zellen an, bzw. werden die Ca-Kanäle aktiviert. Eine andere Ursache für den Na-Einstrom ist eine auf Grund der Ischämie/Hypoxie entstehende Azidose, die durch die Aktivierung des Na/H-Austauschmechanismus den IC Na-Spiegel steigert. Unter den Ursachen finden sich am häufigsten Ischämie, sonstige Hypoxien, Toxine, Stoffwechselstörungen (z. B. Hypo- und Hyperglykämie, Urämie, Leberinsuffizienz). 3: Osmotisch: Der osmotische Gradient verändert sich. Im EC Raum bildet sich eine Hyptotonizität. Im Falle einer Hypotonizität im EC strömt Wasser in die Zellen. Ursachen können sein: z. B. „Wasser vergiftung”, SIADH (= eine unverhältnismäßig starke ADH-Wirkung). Im Verlauf der Behandlung von schweren hyperglykämischen Zuständen (diabetische Komata) kann es zu einem Ödem kommen, wenn bei einem schnellen Absinken der EC Tonizität (Volumenergänzung durch Infusion und Insulinbehandlung) die osmotische Konzentration im IC hoch bleibt (der Abbau der idiogenen osmotischen Molekülen verläuft langsam). 4: Hydrostatisch: Im Hintergrund stehen pathologische Veränderungen einzelner Druckgradienten. So übersteigt z. B. im Verlauf einer hypertonischen Krise der arterielle Mitteldruck die Obergrenze der Autoregulation. Die Hirnperfusion steigt, der Salz- und Wassergehalt des EC Raums steigt, es kommt zu einem Ansteigen des Hirndrucks. Die zytotoxischen und osmotischen Ödeme entsprechen nicht vollständig der Ödemdefinition, da der größte Teil des Flüssigkeitsüberschusses sich in der Zelle (IC) und nicht im EC ansammelt. In ihren Folgen allerdings sind die unterschiedlichen Hirnödeme ähnlich. Da sich die Hirnödeme in geschlossenen Räumen bilden, muss man in jedem Fall auch mit einer Steigerung des Hirndrucks (Monroe-Kelly Prinzip) rechnen. Deren Symptome: Kopfschmerz, Brechreiz, Erbrechen, Sehestörungen, Koordinationsschwierigkeiten, Cushingreflex (Bradycardie und Ansteigen des Blutdrucks)*, pathologische Atemmuster (z. B. Apneusie), Verwirrtheit, Krämpfe, Bewusstlosigkeit, Koma. In extrem schweren Fällen kann die Todesursache ein Ependym Einkeilung, eine konsekutive Atem- und Kreislaufinsuffizienz sein (z.B.: Das Kleinhirn komprimiert die Medulla) Die Typen und Eigenschaften eines HIRNÖDEMS Typ Pathogenese ÖdemLokalisation Ursachen Flüssigkeit Vasogen BBB-Störung Wasser, Na, EC fokale Läsion Eiw. Zytotoxisch gestörter Zell- Wasser, Na IC Anoxie, Gifte Stoffwechsel Osmotisch Osmotischer Wasser, Na IC & EC Wasservergiftung Gradiens Hypotonizität Hydrostat. Druckgradiens Wasser, Na EC (CSF) Hypertension Hydrocephalus Zerebraler intrazellulärer Raum (80%) ICF, K Ionkanäle, Ion-Pumpen Ionenaustauschmechanismen Zerebraler extrazellulärer Raum (1%) ECF, Na Blut-Hirn-Schranke (BBB) Intravaskulärer Raum (9%) Blut, Na Blut-CSF -Schranke Zerebrospinale Flüssigkeit (10%) CSF, Na Eine Liquor (CSF) -Akkumulation führt ebenfalls zu einem hydrostatischen Hirnödem. In diesem Fall ist in der Regel der Liquorabfluss behindert, es kommt zu einem Hydrocephalus und einer Steigerung des Hirndrucks. HIRNVERLETZUNG Blut-Hirn-Schranke Verletzung vasogenes Ödem funktionelle Schädigungen Koma Nekrose zytotoxisches Ödem zerebraler Energieverbrauch ↓ Hypoxie Vasomotorenlähmung SCHWELLUNG DES HIRNGEWEBES Intrakranielle Druck steigt Hirnperfusion ↓ (Ischämie) Erniedrigung des Perfusionsdruckes Atemstörungen Bradykardie Hernien bildung Kopfschmerzen Erbrechen Sehstörung hydrostatisches Ödem Blutdruck↑ Der gesteigerte intracraniale Druck behindert die Hirnperfusion. Die Reaktion darauf ist ein Anstieg des Blutdrucks. Das könnte die erfolgreiche Antwort auf die hypovolämische CBF-Senkung sein. Das Hirn ist aber leider nicht in der Lage, die verschiedenen Ursachen des Strömungsrückgangs zu unterscheiden und der durch den Anstieg des intrakranialen Drucks verursachte CBF-Rückgang löst hier kein Anstieg der Durchblutung aus. Zeit bedeutet Hirn! Map of area of prolonged MTT (yellow) superimposed on DWI infarct core (red) demonstrates multiple infarcts that are most likely embolic from thrombus in the proximal MCA. The penumbra appears to be relatively large, suggesting the presence of a substantial volume of tissue at risk, which may be amenable to thrombolysis or administration of neuroprotective pharmaceuticals. *Penumbra (Halbschatten): Ein an den bei einer Sonnenfinsternis auftretenden „Mondhof” erinnerndes Phänomen. Hier dieses Termin meint: die in der Umgebung einer nekrotischen Region (Kern: CORE) zu findende geschädigte Region. Während des fortschreitenden Prozesses wächst die Region der zentralen Nekrotisierung, die Penumbra dagegen verringert sich. Insgesamt ist im Laufe der Zeit eine Verbesserung der Funktion zu erwarten. Faktoren, die die Regeneration (Überleben) der Penumbra beeinflussen: 1. Glu-Rezeptorantagonisten (die Untersuchungen befinden sich im Versuchsstadium): sie können sich positiv auf den Sauerstoffbedarf auswirken, sie können beim Überleben der Penumbraregion helfen. 2. „Kalter Kopf”: mit einem Absenken der Gewebetemperatur sinkt auch der Stoffwechsel und damit gleichzeitig der Sauerstoffbedarf. Man experimentiert mit der Verwendung von Kühlmützen, allerdings entsprechen die Versuchsergebnisse bis jetzt nicht den Erwartungen. Ein Absenken des möglicherweise auftretenden Fiebers ist in solchen Fällen jedoch wünschenswert. 3. Beruhigungs- und Schlafmittel können auf Grund ihrer stoffwechselsenkenden Wirkung von positiver Wirkung sein. 4. Osmotische Zelldehydrierung (mit Mannitol). Kampfen die Ödembildung Die einzelne erfolgreiche Therapie (Papillenödem) Die Folgen des Hirninfarkts Amaurosis fugax (Blindheit) Die MRI zeigt kein Blutfluss in der rechten Arterie Cerebri Media in einem Patient mit akuter linksseitigen Hemiparese (Lähmung) und Neglect. (14-18%) Hämorrhagisches STROKE (Apoplexie) Formen: - 1. Markenblutung (Häufigste in der dünnwandigen thalamischen Arterien der hypertensiven Patienten) - 2. Subarachnoideale Blutung (SAB: Aneurysma ruptura): wird teilweise durch eine durch eine Gewebezerstörung charakterisiert. In etwa 85% sitzen die Aneurysmen am vorderen, in 15% am hinteren Teil des Circulus arteriosus. Aus hämodynamischen Gründen bilden sich die Aneurysmen bevorzugt an den Gabelungsstellen der Arterien aus. In etwa 15% sind sie multipel Die beiden Stroke-typen treten häufig miteinander kombiniert auf und in beiden Fällen kommt es häufig zur Ausbildung eines Hirnödems. a) Die Blutung zerstört das Gewebe, die hier freigesetzten Stoffe verursachen in der Umgebung eine Vasokonstriktion oder Ischämie. b) Bei der ischämischen Stroke kann es auf Grund des guten kollateralen Kreislaufs oder im Verlauf einer thrombolytischen Behandlung oft zu Blutungen kommen. Eine Subarachnoidalblutung (SAB) ist meist die Folge der Ruptur eines intrakraniellen Aneurysmas. Im Gegensatz zum ischämischen Hirnschlag, der eher bei älteren Patienten auftritt, trifft die SAB oft jüngere, beruflich voll aktive Menschen. Die Leitsymptome der SAB sind akut einsetzende Kopf- und Nackenschmerzen oder eine akute Bewusstseinsstörung. Nackensteife, Übelkeit, Erbrechen, Lichtschau und Atemstörungen sind weitere häufige Symptome, die jedoch erst Stunden nach der Blutung auftreten können. Eine schwere SAB kann sich ereignen, nachdem zuvor Prodromalerscheinungen, wie plötzliche Kopfschmerzen (Warnblutung*) aufgetreten sind. Sie kann aber auch plötzlich und ohne Vorboten, aus voller Gesundheit einsetzen. Sie tritt nicht vermehrt nach körperlicher Anstrengung mit Erhöhung des Blutdrucks auf, sondern häufig auch spontan, oft selbst in völliger Ruhe. Hypertoniker haben häufiger Subarachnoidalblutungen. Entweder entwickeln sie mehr Aneurysmen oder sie ruptieren leichter. * Die Warnblutung wird leider in vielen Fällen nicht richtig gewertet. Die Patienten berichten über plötzliche, starke Nackenkopfschmerzen (»wie noch nie vorher«), die dann rasch in einen dumpfen, störenden, aber meist nicht mehr alarmierenden Dauerkopf- und Nackenschmerz übergeht. Die Patienten haben eine geringe Nackensteifigkeit. Innerhalb der nächsten Tage bis etwa 2 Wochen kann es dann zu einer schweren (Rezidiv)-SAB kommen. Hauptrisiko nach eingetretener Warnblutung aus einem Aneurysma ist die mit großer Wahrscheinlichkeit eintretende Rezidivblutung, die mit einer hohen Mortalität von über 70% einhergeht. Ursache ist in erster Linie die Lyse des Thrombus verursacht von dem aktivierenden Fibrinolytischen System im Aneurysmainneren. STROKE Langzeitige Rehabilitation ist sehr wichtig! Sekundäre Prevention (Lebensstil, Diät, Blutdruck verminderung, Anticougulanten usw.) ist sehr wichtig! Therapieoptionen Akute kausale Therapie: nur unmittelbar nach dem Ereignis Primärprävention: verhindert einen Infarkt bei Therapie der Risiken Sekundärprävention: verhindert einen Rezidivinfarkt Therapie, Präventiv Carotis-Chirurgie Angioplastie 1 2 3 4 5 6 7 8 9 Schneidet Fibrinopeptide A von Fibrinogen Desmondus salivary plasminogen activator ROS scavenger Widersteht glutamate wirkung Der Grund der Langzeitigen Anti-Thrombozyten Therapie