400 Jahre Chemie und Pharmazie in Marburg
Werbung
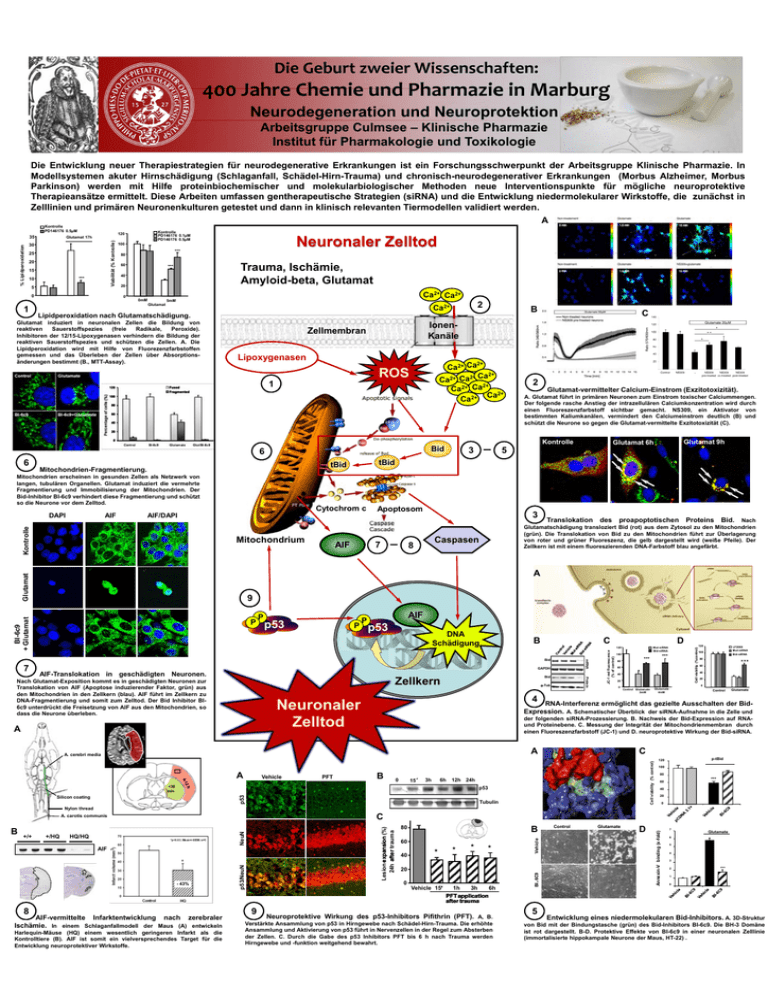
Die Geburt zweier Wissenschaften: 400 Jahre Chemie und Pharmazie in Marburg Neurodegeneration und Neuroprotektion Arbeitsgruppe Culmsee – Klinische Pharmazie Institut für Pharmakologie und Toxikologie Die Entwicklung neuer Therapiestrategien für neurodegenerative Erkrankungen ist ein Forschungsschwerpunkt der Arbeitsgruppe Klinische Pharmazie. In Modellsystemen akuter Hirnschädigung (Schlaganfall, Schädel-Hirn-Trauma) und chronisch-neurodegenerativer Erkrankungen (Morbus Alzheimer, Morbus Parkinson) werden mit Hilfe proteinbiochemischer und molekularbiologischer Methoden neue Interventionspunkte für mögliche neuroprotektive Therapieansätze ermittelt. Diese Arbeiten umfassen gentherapeutische Strategien (siRNA) und die Entwicklung niedermolekularer Wirkstoffe, die zunächst in Zelllinien und primären Neuronenkulturen getestet und dann in klinisch relevanten Tiermodellen validiert werden. A Kontrolle PD146176 0.5µM 30 25 20 15 *** 10 5 0 1 Kontrolle PD146176 0.1µM PD146176 0.5µM 120 Glutamat 17h Viabilität (% Kontrolle) % Lipidperoxidation 35 Neuronaler Zelltod 100 *** 80 60 Trauma, Ischämie, Amyloid-beta, Glutamat *** 40 20 0 0mM Ca2+ Ca2+ 5mM Glutamat 2 Ca2+ B Lipidperoxidation nach Glutamatschädigung. Glutamat induziert in neuronalen Zellen die Bildung von reaktiven Sauerstoffspezies (freie Radikale, Peroxide). Inhibitoren der 12/15-Lipoxygenasen verhindern die Bildung der reaktiven Sauerstoffspezies und schützen die Zellen. A. Die Lipidperoxidation wird mit Hilfe von Fluorezenzfarbstoffen gemessen und das Überleben der Zellen über Absorptionsänderungen bestimmt (B., MTT-Assay). Zellmembran Lipoxygenasen Ca2+ Ca ROS 120 2+ 2+ Ca2+ Ca 2+ Ca2+ Ca Ca2+ Ca2+ Ca2+ 1 Fused Fragmented C IonenKanäle 100 80 60 40 2 Glutamat-vermittelter Calcium-Einstrom (Exzitotoxizität). A. Glutamat führt in primären Neuronen zum Einstrom toxischer Calciummengen. Der folgende rasche Anstieg der intrazellulären Calciumkonzentration wird durch einen Fluoreszenzfarbstoff sichtbar gemacht. NS309, ein Aktivator von bestimmten Kaliumkanälen, vermindert den Calciumeinstrom deutlich (B) und schützt die Neurone so gegen die Glutamat-vermittelte Exzitotoxizität (C). 20 0 Kontrolle Bid 6 AIF Cytochrom c Apoptosom 3 AIF/DAPI Kontrolle DAPI tBid tBid Mitochondrien-Fragmentierung. Mitochondrium AIF 7 Translokation des proapoptotischen Proteins Bid. Nach Glutamatschädigung transloziert Bid (rot) aus dem Zytosol zu den Mitochondrien (grün). Die Translokation von Bid zu den Mitochondrien führt zur Überlagerung von roter und grüner Fluoreszenz, die gelb dargestellt wird (weiße Pfeile). Der Zellkern ist mit einem fluoreszierenden DNA-Farbstoff blau angefärbt. Caspasen 8 Glutamat A P P p53 P P AIF p53 DNA Schädigung B C mRNA GAPDH Bid Zellkern Nach Glutamat-Exposition kommt es in geschädigten Neuronen zur Translokation von AIF (Apoptose induzierender Faktor, grün) aus den Mitochondrien in den Zellkern (blau). AIF führt im Zellkern zu DNA-Fragmentierung und somit zum Zelltod. Der Bid Inhibitor BI6c9 unterdrückt die Freisetzung von AIF aus den Mitochondrien, so dass die Neurone überleben. α-Tub Mut-siRNA Bid-siRNA 100 *** 80 60 40 20 0 B 0 15´ 3h 6h *** 60 40 20 Control Glutamate C 12h 24h <30 min p53 p53 Silicon coating 80 0 Glutamate 4mM Control Glutamate 3mM Cell viability (% control) PFT LF2000 Mut-siRNA Bid-siRNA 100 der folgenden siRNA-Prozessierung. B. Nachweis der Bid-Expression auf RNAund Proteinebene. C. Messung der Integrität der Mitochondrienmembran durch einen Fluoreszenzfarbstoff (JC-1) und D. neuroprotektive Wirkung der Bid-siRNA. A Vehicle 120 RNA-Interferenz ermöglicht das gezielte Ausschalten der BidExpression. A. Schematischer Überblick der siRNA-Aufnahme in die Zelle und A. cerebri media A *** 4 Neuronaler Zelltod A Protein AIF-Translokation in geschädigten Neuronen. D 120 Cell viability (%control) BI-6c9 + Glutamat 9 Bid 7 Glutamat 9h Glutamat 6h 5 JC-1 red fluorescence (% of control) 6 Mitochondrien erscheinen in gesunden Zellen als Netzwerk von langen, tubulären Organellen. Glutamat induziert die vermehrte Fragmentierung und Immobilisierung der Mitochondrien. Der Bid-Inhibitor BI-6c9 verhindert diese Fragmentierung und schützt so die Neurone vor dem Zelltod. 3 Tubulin p-tBid 120 100 80 *** 60 40 20 0 Nylon thread - 43% 8 AIF-vermittelte Infarktentwicklung nach zerebraler Ischämie. In einem Schlaganfallmodell der Maus (A) entwickeln Harlequin-Mäuse (HQ) einem wesentlich geringeren Infarkt als die Kontrolltiere (B). AIF ist somit ein vielversprechendes Target für die Entwicklung neuroprotektiver Wirkstoffe. p53/NeuN AIF 80 40 * * * * 20 0 9 B 60 Vehicle HQ/HQ Vehicle 15‘‘ 1h 6h 3h PFT application after trauma Neuroprotektive Wirkung des p53-Inhibitors Pifithrin (PFT). A, B. Verstärkte Ansammlung von p53 in Hirngewebe nach Schädel-Hirn-Trauma. Die erhöhte Ansammlung und Aktivierung von p53 führt in Nervenzellen in der Regel zum Absterben der Zellen. C. Durch die Gabe des p53 Inhibitors PFT bis 6 h nach Trauma werden Hirngewebe und -funktion weitgehend bewahrt. BI - 6C9 +/HQ Lesion expansion (%) 24h after trauma +/+ NeuN B 5 Control Glutamate D Annexin-V binding (x-fold) C A. carotis communis 7 Glutamate 6 5 4 3 2 *** 1 0 Entwicklung eines niedermolekularen Bid-Inhibitors. A. 3D-Struktur von Bid mit der Bindungstasche (grün) des Bid-Inhibitors BI-6c9. Die BH-3 Domäne ist rot dargestellt. B-D. Protektive Effekte von BI-6c9 in einer neuronalen Zelllinie (immortalisierte hippokampale Neurone der Maus, HT-22) .











