Thermodynamik I
Werbung

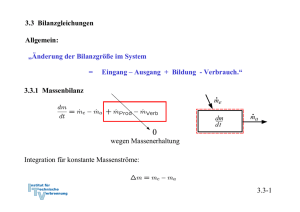
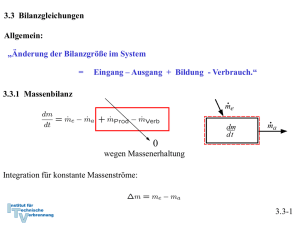
Thermodynamik I Sommersemester 2012 Kapitel 3, Teil 2 Prof. Dr.-Ing. Heinz Pitsch Kapitel 3, Teil 2: Übersicht 3 Energiebilanz 3.3 Bilanzgleichungen 3.3.1 Massebilanz 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 3.3.3 Spezifische Wärmekapazitäten 3.3.4 Kreisprozesse und Zustandsgrößen 3.3.5 Bewertung thermodynamischer Prozesse 3.3.6 Stationärer Fließprozess 3.3.7 Energiebilanz bei Mischung feuchter Luft 2 3.3 Bilanzgleichungen • Allgemein: Änderung der Bilanzgröße im System = Eingang – Ausgang + Bildung - Verbrauch 3.3.1 Massenbilanz wegen Massenerhaltung 0 • Integration für konstante Massenströme: 3 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 0 wegen Energieerhaltung oder 1. Hauptsatz der Thermodynamik Integration von 1 nach 2: Änderung im System 4 Flüsse: • Arbeit • Wärme • Energie mit Massenstrom Verschiedene Schreibweisen • Integrale Form: • Ratenform: • Massenbezogene integrale Form: • Massenbezogene differentielle Form: Merke: Unterschied zwischen vollständigem Differential (d) und infinitesimaler Menge Energie (d) - • Formulierung der Energiebilanz: 1. Geschlossenes oder offenes System 2. Absolut- oder Ratenform 3. Spezifisch oder Massenform 5 Energiebilanz in geschlossenen Systemen • Zustandsänderung • Zustandsänderung 1 2 oder bzw. 6 Beispiel 1: Wasserdampf in Zylinder m = 5 kg p1 = 500 kPa, J1 = 200 oC p2 = p1 = 500 kPa, J2 = 120 oC Fragen: 1. Wie groß ist die ausgetauschte Wärmemenge Q12? 2. Skizze im T,v – Diagramm! • Lösung 7 1. Geschlossenes oder offenes System? Geschlossen 2. Absolut- oder Ratenform? Absolut 3. Spezifisch oder Massenform? Massenform Beispiel 1: Wasserdampf in Zylinder 1. Hauptsatz: • Es ist: DEkin = DEpot = 0 • [E] : • Arbeit bei isobarer Zustandsänderung: • Einsetzen • Für Q12 folgt Volumenänderungsarbeit 8 Stoffdaten Zustand 1 (500 kPa, 200oC) überhitzt Zustand 2 (500 kPa, 120oC) unterkühlt 9 Tabelle Überhitzter Dampf Inkompressible Flüssigkeit, Sättigungstabelle Skizze im T,v - Diagramm 10 Zustand 2 Näherung: u’ (J2) = 503,5 kJ/kg, v’ (J2) = 0,00106 m3/kg ( h’(J2) = 503,71 kJ/kg ) Sättigungsenthalpie gute Näherung, h2 (J2) = 504,03 kJ/kg aber oft nicht genau genug! 11 Zustand 1 h1 = 2855,4 kJ/kg Q12 = m (h2-h1) = 5 kg (504,03 kJ/kg - 2855,4 kJ/kg) - 11757 kJ 12 Kapitel 3, Teil 2: Übersicht 3 Energiebilanz 3.3 Bilanzgleichungen 3.3.1 Massebilanz 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 3.3.3 Spezifische Wärmekapazitäten 3.3.4 Kreisprozesse und Zustandsgrößen 3.3.5 Bewertung thermodynamischer Prozesse 3.3.6 Stationärer Fließprozess 3.3.7 Energiebilanz bei Mischung feuchter Luft 17 3.3.3 Spezifische Wärmekapazitäten Spezifische Wärmekapazitäten bei konstantem Volumen: cv •Änderung der Inneren Energie u = u(T,v): •Definition der spezifischen Wärmekapazität bei konstantem Volumen: •Wir betrachten die Änderung der inneren Energie auf Grund der Temperaturänderung für den isochoren Prozess •Dann gilt 18 und Isochorer Prozess 1. Hauptsatz für isochoren Prozess V = const Mit folgt • cv ist die spezifische Wärme, die zugeführt werden muss, um die Temperatur für ein Kilogramm des Stoffes im System bei konstantem Volumen um 1 K zu erhöhen 19 Spez. Wärmekapazität bei konstantem Druck: cp • Änderung der Enthalpie h = h(T,p) • Definition der spezifischen Wärmekapazität bei konstantem Druck: • Wir betrachten die Änderung der Enthalpie auf Grund einer Temperaturänderung für einen isobaren Prozess • Dann gilt 20 und Isobarer Prozess 1. Hauptsatz für isobaren Prozess Mit folgt und • cp ist die spezifische Wärme, die zugeführt werden muss, um die Temperatur für ein Kilogramm des Stoffes im System bei konstantem Druck um 1 K zu erhöhen 21 Spezifische Wärmekapazitäten idealer Gase • Bei idealen Gasen sind die innere Energie und die Enthalpie ausschließlich Funktionen der Temperatur • Daher gilt für ideale Gase immer • Daher müssen auch die spezifischen Wärmekapazitäten idealer Gase reine Temperaturfunktionen sein • Mit und damit 22 folgt durch Ableitung Spezifische Wärmekapazitäten idealer Gase • Verhältnis der spezifischen Wärmen: k *) • Daraus ergibt sich • Aus Diagramm - Einatomige Gase: cp/R ≈ 5/2 k ≈ 5/3 = 1,66 - Zweiatomige Gase: cp/R ≈ 7/2 k ≈ 7/5 = 1,4 Verhältnis der spezifischen Wärmen k spielt eine besondere Rolle. Wir werden sehen, dass für die idealen Gase k gleich dem sogenannten Isentropenxponenten k ist. *) Das 23 Spezifische Wärmekapazitäten idealer Flüssigkeiten • Annahme: Inkompressibel, d. h. konstantes Volumen: dv = 0 • Aus vollständigem Differential • folgt, dass , und damit dass die innere Energie eine reine Temperaturfunktion ist • 1. Hauptsatz liefert mit pdv = 0: 24 Folgerung für Enthalpie idealer Flüssigkeiten und cp • Definition der Enthalpie: • Vollständiges Differential: • Vergleich: Wärmekapazitäten cp und cv sind gleich für ideale Flüssigkeiten • Enthalpie für ideale Flüssigkeiten hängt also von Temperatur und Druck ab • Kalorische Zustandsgleichung lautet Integration 25 Kapitel 3, Teil 2: Übersicht 3 Energiebilanz 3.3 Bilanzgleichungen 3.3.1 Massebilanz 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 3.3.3 Spezifische Wärmekapazitäten 3.3.4 Kreisprozesse und Zustandsgrößen 3.3.5 Bewertung thermodynamischer Prozesse 3.3.6 Stationärer Fließprozess 3.3.7 Energiebilanz bei Mischung feuchter Luft 26 3.3.4 Kreisprozesse und Zustandsgrößen • Definition: Ändert ein System Zustand so, dass es vom Anfangszustand 1 über Zwischenzustände wieder zum Anfangszustand zurückkehrt 2=1, hat das System einen Kreisprozess durchlaufen • Für jede Zustandsgröße z = f(z1,z2) gilt: • Umgekehrt: Verschwindet das Umlaufintegral Zustandsgröße , so ist z eine Darstellung von Kreisprozessen mit quasistatischen Zustandsänderungen rechtslaufender Kreisprozess linkslaufender Kreisprozess (Arbeit wird an Umgebung abgegeben) (Arbeit wird von Umgebung zugeführt) •Umlaufintegrale verschwinden nicht •Volumenänderungsarbeit ist also keine Zustandsgröße sondern eine Prozessgröße! Zustands- und Prozessgrößen • Zustandgrößen z besitzen ein vollständiges Differential: dz zum Beispiel: Volumen V: dV , Druck p: dp , innere Energie U: dU • Genauso wie Volumenänderungsarbeit ist auch die ausgetauschte Wärme keine Zustandsgröße, sondern vom Prozessverlauf abhängig • Wärme Q und Volumenänderungsarbeit WV besitzen kein vollständiges Differential Kleine Menge Wärme, Arbeit: dQ und dWV = - p dV • Erster Hauptsatz in differentieller Form: • Unterscheidung zwischen Zustands- und Prozessgrößen auch in der Indizierung bei integraler Schreibweise: Gesamtbilanz Kreisprozess Erster Hauptsatz n+1 Einzelschritte: 0-1: 1-2: 2-3: . . . . n-0: S insgesamt: aber: Kapitel 3, Teil 2: Übersicht 3 Energiebilanz 3.3 Bilanzgleichungen 3.3.1 Massebilanz 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 3.3.3 Spezifische Wärmekapazitäten 3.3.4 Kreisprozesse und Zustandsgrößen 3.3.5 Bewertung thermodynamischer Prozesse 3.3.6 Stationärer Fließprozess 3.3.7 Energiebilanz bei Mischung feuchter Luft 31 3.3.5 Bewertung thermodynamischer Prozesse • Generell: Vergleich von Nutzen zu Aufwand • bei Arbeitsmaschinen thermischer Wirkungsgrad hth • bei Kühlprozessen und Wärmepumpen: Leistungszahl e 32 Beispiel: Otto-Motor • Viertaktmotor (schematisch) 33 Der idealisierte Otto-Prozess (Gleichraumprozess) • Ideales Gas mit konstanten Wärmekapazitäten • Luft als Arbeitsmedium • Vernachlässigung von Verlusten ↔ Annahme reversibler Prozesse • Massenaustausch mit Umgebung (Ein- und Ausschieben) bleibt unberücksichtigt Geschlossenes System • Ladungswechsel durch Wärmeabfuhr ersetzt • Verbrennung wird durch Wärmezufuhr ersetzt • Kompression und Expansion werden als reversibel-adiabate Prozesse aufgefasst • Wärmezufuhr und Wärmeabfuhr erfolgen bei konstantem Volumen 34 Darstellung im p,V-Diagramm 12 Adiabate & reibungsfreie Kompression 23 Isochore Wärmezufuhr: Verbrennung 34 Adiabate & reibungsfreie Expansion: Arbeit 41 Isochore Wärmeabfuhr: Ladungswechsel Wirkungsgrad: 35 Bilanz des Kreisprozesses • Wirkungsgrad: • 1. HS Gesamtsystem • Analyse • Für adiabate und reibungsfreie Zustandsänderungen folgt 1 2: 3 4: Bilanz des Kreisprozesses • Verbrennung 2 3 1. HS 2 3 : Mit folgt • Wärmeabfuhr 4 1 1. HS 4 1 : Mit Thermischer Wirkungsgrad: folgt 37 Thermischer Wirkungsgrad • Thermischer Wirkungsgrad • Bestimmung der Temperaturverhältnisse: analog . . . 38 Thermischer Wirkungsgrad: Idealisierter Otto-Prozess • Aus folgt mit pVk = C oder p = C/Vk und • Wirkungsgrad steigt mit Verdichtungsverhältnis ɛ an . *) Werden Wärmeverluste bei Kompression und Expansion und andere Verluste berücksichtigt, so kann statt des Isentropenexponenten k auch ein adäquater Polytropenexponent n verwendet werden 39 Kapitel 3, Teil 2: Übersicht 3 Energiebilanz 3.3 Bilanzgleichungen 3.3.1 Massebilanz 3.3.2 Energiebilanz und 1. Hauptsatz der Thermodynamik 3.3.3 Spezifische Wärmekapazitäten 3.3.4 Kreisprozesse und Zustandsgrößen 3.3.5 Bewertung thermodynamischer Prozesse 3.3.6 Stationärer Fließprozess 3.3.7 Energiebilanz bei Mischung feuchter Luft 40 3.3.6 Stationärer Fließprozess in offenen Systemen • Annahmen: Stationär Masse und Gesamtenergie im System konstant: 41 Bilanz am stationären offenen System • 1. Hauptsatz Energie mit Massenstrom • Einsetzen der Totalenthalpien • Spezifisch mit Arbeit und Wärmestrom auf Massenstrom bezogen 42 Beispiel: Kühlschrank • 1. Hauptsatz geschlossenes System, stationär: Gesamtsystem • Prozessbewertung durch Leistungszahl: Bestimmung von Arbeit- und Wärmestromes an geeigneten (Teil)-Systemen 43 Bilanz am Kompressor System Kompressor • 1. Hauptsatz offenes System, stationär und adiabat: • Annahme Dekin = Depot 0: 44 Bilanz am Verdampfer System Verdampfer • 1. Hauptsatz offenes System, stationär: • Annahme Dekin = Depot 0 : Leistungszahl: 45 Bilanz am Kondensator Gesamtsytem System Kondensator •1. Hauptsatz, offenes System, stationär, Δekin = Δ epot 0: •Oder aus Bilanz am Gesamtsystem, stationär ( Es folgt: 46 ) Bilanz an der Drossel System Drossel • 1. Hauptsatz offenes System, stationär, adiabat, Δekin = Δepot 0: Adiabate Drossel ist isenthalp! 47 T,v - Diagramm • Drücke p1 und p2 werden so gewählt, dass T3 > TRaum T4 < TKühlschrank • In der Drossel soll mit Druck auch Temperatur absinken - Mit Joule-Thomson-Koeffizient (siehe Thermo II) Kühlmittel μ > 0 • Regeneration zur Erhöhung der Kapazität 48 p,h-Digramm zur Analyse von Kältemaschine/Wärmepumpe p2 p1 49 3 4 2 1 Leistungszahl • Aus Tabellen (aus h-p Diagramm) für Kältemittel R134a: h1 = 231,4 (380) kJ/kg h2 = 280,2 (430) kJ/kg h3 = h4 = 105,3 (255) kJ/kg e = 2,58 • Kühlleistung ist damit um Faktor 2,58 höher als eingesetzte Leistung! • Energie wird zur Verschiebung der thermischen Energie eingesetzt! 50 Beispiel: Elektrische Heizung • 1. Hauptsatz geschlossenes System • Leistungszahl: • Heizen mit Strom ineffizient, da Wirkungsgrad der Stromerzeugung im Kraftwerk hKW 40 %, so dass Gesamtleistungszahl 51 Beispiel: Konventionelle Heizung • Wärmeleistung Energie • 1. Hauptsatz geschlossenes System aus chemischer für stationäre Verhältnisse im Haus • (In der Heizung wird gespeicherte chemische Energie in Wärme überführt dEH/dt ≠ 0) • Leistungszahl: 52 Beispiel: Heizung mit elektrischer Wärmepumpe Prinzip: • Umgekehrter Kühlschrank - Eisfach draußen - Kondensator im Haus • Eisfachtemperatur muss kälter sein als Außentemperatur Analyse: • 1. Hauptsatz geschlossenes System für stationäre Verhältnisse im Haus 53 Beispiel: Heizung mit elektrischer Wärmepumpe • Leistungszahl: • Mit Zahlenwert für Kühlschrank: • Berücksichtigung der Stromerzeugung: • Wärmepumpe sehr viel effizienter als konventionelle Heizung, aber kompliziertere Gerätetechnik 54