MEKC - Uni Marburg
Werbung

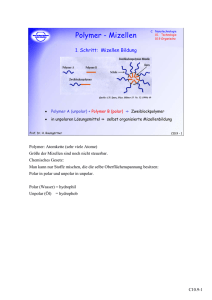
-1- Zur Mizellaren Elektrokinetischen Chromatographie: Die Mizellare Elektrokinetische Chromatographie kann als Variante der Kapillarelektrophorese (CE) betrachtet werden. Abgesehen von Verfahren, bei denen die zu trennenden Substanzen durch Komplexierung oder Derivatisierung in Verbindungen mit effektiver elektrophoretischer Beweglichkeit überführt werden, kann die CE prinzipiell nur zur Trennung geladener Komponenten eines Gemisches herangezogen werden. Diese methodische Begrenzung wurde durch Arbeiten von TERABE et al. [1,2] aufgehoben, die mit Hintergrundelektrolyten arbeiteten, die ein in Ionen dissoziierendes Tensid in einer Konzentration oberhalb der kritischen mizellaren Konzentration (CMC) enthalten. Diese Methode wird heute als Mizellare Elektrokinetische Chromatographie (MEKC) oder auch als Mizellare Elektrokinetische Kapillar-Chromatographie (MECC) bezeichnet. Die in Trennelektrolyten der MEKC vorhandene mizellare Phase ist aufgrund ihrer elektrophoretischen Beweglichkeit gegenüber der elektroosmotisch erzeugten Strömung in der Kapillare verzögert. Auch ungeladene Komponenten eines Gemisches können aufgrund unterschiedlicher Verteilungskonstanten (bezogen auf die Verteilung zwischen der mizellaren und der wäßrigen Phase) in Zonen aufgetrennt werden. Das der MEKC zugrundeliegende Trennprinzip ist somit vergleichbar mit dem Trennprinzip in der Verteilungschromatographie. Daher zählt die MEKC zu den chromatographischen Methoden, obwohl unter bestimmten Voraussetzungen auch Elektrophorese als Trennprinzip wirken kann [3]. Die Mizellare Elektrokinetische Chromatographie unterscheidet sich von der Kapillarelektrophorese durch die Zusammensetzung des Trennelektrolyten. Der apparative Aufbau ist hingegen bei beiden Methoden identisch. Abb.1 zeigt schematisch den Aufbau eines zur CE und MEKC geeigneten Geräts. Thermostatisierung Abb. 1: Aufbau eines zur CE und MEKC geeigneten Geräts Trennkapillare (schematisch) Detektor Hochspannungsversorgung Gefäß 2 Gefäß 1 Eine mit Trennelektrolyt gefüllte Kapillare (die Trennkapillare) Elektrolyt -2- taucht mit beiden Enden in mit Trennelektrolyt gefüllte Gefäße ein. Als Trennelektrolyt wird eine wäßrige Lösung eines Tensids mit einer Konzentration oberhalb der kritischen mizellaren Konzentration (CMC) verwendet. Der Trennelektrolyt ist in der Regel durch Zusatz weiterer Komponenten gepuffert. Die Zusätze haben außerdem die Funktion, die Ionenstärke zu erhöhen. Unter CMC wird die Konzentration verstanden, oberhalb welcher das gelöste Tensid Aggregate, die Mizellen, ausbildet. Die CMC ist nicht nur abhängig von der Temperatur, sondern auch vom Lösungsmittel und der Konzentration weiterer gelöster Komponenten. Für den Trennmechanismus in der MEKC sind folgende Phänomene von Bedeutung: Elektroosmose, Elektrophorese und Verteilung zwischen zwei Phasen. Unter Elektroosmose wird bei einem mit Flüssigkeit gefüllten Kapillarsystem die Wanderung der Flüssigkeit im elektrischen Feld aufgrund einer Aufladung der Flüssigkeit gegenüber der Wandung verstanden [4]. Elektroosmose bewirkt unter konstanten Bedingungen (Zusammensetzung des Trennelektrolyten, pH-Wert, Temperatur) eine konstante Flüssigkeitsströmung. Die Geschwindigkeit des so erzeugten elektroosmotischen Flusses (EOF) in einer mit Flüssigkeit gefüllten Kapillare ergibt sich aus der HELMHOLTZ-SMOLUCHOWSKIGleichung (Gl.1). v eo = veo εFζ 4π η (1) = elektroosmotische Strömungsgeschwindigkeit außerhalb des Bereichs der elektrischen Doppelschicht ε = elektrische Durchlässigkeit (ε = 4 π ε0 DK ε0 = elektrische Feldkonstante DK = Dielektrizitätskonstante) F = elektrische Feldstärke ζ = elektrokinetisches Potential (ζ-Potential) η = Viskosität Zur Berechnung der Geschwindigkeit der Flüssigkeitsströmung wird eine Potentialverteilung in der elektrischen Doppelschicht an der Wandung der Kapillare vom Typ STERN-GRAHAME (Abb.2) zugrundegelegt. Es wird dabei angenommen, daß sich an der Oberfläche der Wandung eine festanhaftende Flüssigkeitsschicht von der Dicke eines oder mehrerer Moleküldurchmesser des Solvens befindet (0 ≤ x ≤ x 0 s.Gl.2). In der festhaftenden Flüssigkeitsschicht fällt das elektrische Potential Φ linear ab. An die festhaftende Flüssigkeitsschicht grenzt eine diffuse Schicht (x > x 0) mit geringerem Ordnungsgrad. In dieser fällt das elektrische Potential exponentiell ab. Zwischen der festhaftenden Schicht und der bewegten Flüssigkeit tritt am Ort x = x0 eine Gleitebene auf. -3- Abb.2: Modell der elektrischen Doppelschicht an der Wandung der Kapillare (Gl.2) − Φ( x ) = ζ ⋅ e x − x0 δ Φ(x) = elektrisches Potential am Ort x ζ = elektrokinetisches Potential (ζ-Potential) x = Abstand von der Oberfläche x0 = Abstand der Gleitebene von der Oberfläche δ = Abstand von der Gleitebene, an dem Φ(x) = ζ ⋅ e-1 („DEBYE-Länge“) (2) Wenn das äußere Feld angelegt wird, bewegt sich jede Flüssigkeitsschicht nach einer kurzen Anlaufzeit mit konstanter Geschwindigkeit parallel zur Grenzfläche (laminare Strömung). Die durch das elektrische Feld auf den Ladungsüberschuß ausgeübte Kraft und die Reibungskräfte mit den benachbarten Schichten verschiedener Geschwindigkeit kompensieren sich im stationären Zustand. Die Bedingungen für die HELMHOLTZ-SMOLUCHOWSKI-Gleichung (Gl.1) sind nur dann erfüllt, wenn der Radius der betrachteten Kapillare groß ist im Vergleich zur DEBYE-Länge δ. Diese Vorgabe ist unter den Bedingungen, die üblicherweise im Bereich der MEKC gegeben sind, erfüllt. Gl.1 ist zu entnehmen, daß die elektroosmotische Strömungsgeschwindigkeit veo außerhalb des Bereichs der -4- elektrischen Doppelschicht unabhängig ist vom Radius r der Kapillare; denn r ist keine in Gl.1 enthaltene Größe. Wichtig für chromatographische und elektrophoretische Trennungen unter Ausnutzung des EOF ist das Strömungsprofil der elektroosmotisch mobilisierten Flüssigkeit. Unter Strömungsprofil wird die Abhängigkeit der Geschwindigkeit eines Flüssigkeitspakets vom Abstand zum Mittelpunkt des Strömungskanals verstanden. Bei elektroosmotisch erzeugter Stömung ist das Strömungsprofil stempelförmig, d.h. die Geschwindigkeit des Füssigkeitspakets ist in erster Näherung unabhängig vom Abstand zum Mittelpunkt des Strömungskanals [5]. Es ist daher davon auszugehen, daß durch elektroosmotisch erzeugte Strömung keine Zonenverbreiterung bewirkt wird. Ein weiteres für die MEKC bedeutsames elektrokinetisches Phänomen ist die Elektrophorese. Unter Elektrophorese wird die Wanderung geladener Teilchen im elektrischen Feld verstanden. Auf geladene Teilchen wirkt bei angelegtem äußerem Feld eine Kraft. Für Elektrophorese gilt ebenso wie für Elektroosmose, daß sich die durch das elektrische Feld auf die Ladung wirkende Kraft und die Reibungskräfte mit den benachbarten Schichten geringerer Geschwindigkeit im stationären Zustand kompensieren. Das geladene Teilchen erreicht nach einer kurzen Anlaufzeit eine konstante Geschwindigkeit vep . Für vep gilt Gl.3. Für die Herleitung dieser Gleichung gelten die gleichen Überlegungen, wie für Gl.1 skizziert. v ep = εFζ 6π η (3) Bei Gl. 3 ist vorausgesetzt, daß die Konvektionsleitfähigkeit des Teilchens so gering ist, daß das äußere homogene elektrische Feld dadurch nicht beeinflußt wird. Die elektrophoretische Beweglichkeit µep ist definiert als vep, normiert auf die wirkende Feldstärke F (Gl.4). Analog wird die elektroosmotische Beweglichkeit µeo definiert als veo, normiert auf F. µ ep = v ep F (4) In den bei der MEKC verwendeten Trennelektrolyten befinden sich neben gelösten Bestandteilen Aggregate aus Tensidmolekül-Einheiten. Diese Aggregate (Mizellen) tragen im Fall anionischer Tenside eine negative, im Fall kationischer Tenside eine positive Ladung. Durch das angelegte elektrische Feld erreichen die Mizellen unabhängig von ihrer Ladung in Gegenrichtung zum EOF die Wanderungsgeschwindigkeit vep(Mizelle); denn bei Verwendung eines kationischen Tensids tritt das Phänomen der Umkehrung der Richtung des EOF auf als Folge einer Anlagerung von Tensidmolekülen an der Kapillar-Innenwand. Abb.3 zeigt schematisch die Verhältnisse für einen -5- Trennelektrolyten, der ein anionisches Tensid enthält. Dargestellt ist ein Ausschnitt aus der Trennkapillare. - - - - - - - - - - - - - - Abb. 3: Modellhafte Betrachtung eines Ausschnitts aus der Trennkapillare (MEKC mit anionischem Tensid) In der MEKC wird in der Regel so gearbeitet, daß der Betrag der elektrophoretischen Geschwindigkeit der Mizellen kleiner ist als der Betrag der elektroosmotischen Geschwindigkeit, d.h. die resultierende Wanderungsrichtung der Mizellen ist mit der Bewegungsrichtung des EOF identisch. Die beobachtbare Geschwindigkeit der Mizellen ist jedoch gegenüber veo verzögert. Dieser Elutionsmodus (|veo| > |vep(Mizelle)| ) wird als Normalmodus (normal mode) bezeichnet [6,7]. Ein Grenzfall des Normalmodus ist erreicht, wenn gilt |veo| = |vep(Mizelle)|. Für den Fall, daß |veo| < |vep(Mizelle)|, wird in Abhängigkeit von der Arbeitsrichtung vom begrenzten Elutionsmodus (restricted elution mode) oder vom Umkehrmodus (reversed direction mode) gesprochen. Im Trennelektrolyten bilden die Mizellen eine von der wäßrigen Phase unterscheidbare zweite Phase, die mizellare Phase, welche im Normalmodus bei angelegtem elektrischem Feld gegenüber der wäßrigen Phase verzögert ist. In Analogie zur Terminologie der Chromatographie wird die wäßrige Phase daher auch als mobile Phase und die mizellare Phase als pseudostationäre Phase bezeichnet. Der Begriff pseudostationäre Phase wurde von TERABE et al. [1,2] geprägt. Analyte mäßiger Polarität werden gemäß ihrer Verteilungskonstanten KV zwischen beiden Phasen verteilt, d.h. die beobachtbare Geschwindigkeit dieser Analyte bei angelegtem elektrischem Feld ist abhängig von KV. Die Verteilungskonstante KV ist definiert als Quotient aus Konzentration des Analyten in der pseudostationären Phase durch Konzentration des Analyten in der mobilen Phase in einem differentiellen Volumensegment (im thermodynamischen Gleichgewicht). Das bei der MEKC wirkende Trennprinzip ist daher vergleichbar mit dem der Verteilungschromatographie. Die -6- Elutionsreihenfolge der Komponenten eines Gemisches wird, wenn die Komponenten keine elektrophoretische Beweglichkeit besitzen, durch die Verteilungskonstanten der Komponenten festgelegt. Im Normalmodus ist die Wanderungszeit durch die Kapillare umso größer, je größer KV ist. Wenn jedoch die zu trennenden Analyte, gelöst im Trennelektrolyten, über eine elektrophoretische Beweglichkeit µep verfügen, dann ist die Elutionsreihenfolge nicht mehr ausschließlich durch Unterschiede in KV festgelegt, sondern wird ebenfalls durch Unterschiede in µep mitbestimmt. Neben dem Trennprinzip der Verteilungschromatographie ist in diesem Fall auch das Trennprinzip der Elektrophorese wirksam. Der Übergang von der MEKC zur CE ist fließend. Bestimmung chromatographischer Kenngrößen in der MEKC Der entscheidende Unterschied zwischen Verteilungschromatographie und MEKC ist darin zu sehen, daß in der MEKC die pseudostationäre Phase nicht wie in der Chromatographie immobilisiert ist, sondern sich entweder (im Normalmodus) während der Trennung ebenso wie die mobile Phase in Richtung Detektor oder (im Umkehrmodus) während der Trennung in Gegenrichtung zur mobilen Phase bewegt. Die folgenden Überlegungen gelten ausschließlich für den Normalmodus und Analyte mit vernachlässigbarer elektrophoretischer Beweglichkeit µep. Der Retentionsfaktor k für einen Analyten ist definiert als Quotient aus Masse des Analyten in der stationären Phase durch Masse des Analyten in der mobilen Phase (betrachtet für ein differentielles Segment der Trennstrecke). Er ist identisch mit dem Quotienten aus Aufenthaltsdauer in der stationären Phase tstat und Aufenthaltsdauer in der mobilen Phase tmob während einer chromatographischen Trennung. Die Gesamtaufenthaltsdauer (t stat + t mob) wird als Retentionszeit tR bezeichnet. Durch Umformung wird Gl.5 erhalten. k= t R − t mob t mob (5) In der Chromatographie mit immobilisierter stationärer Phase kann tmob mit der Totzeit t0 gleichgesetzt werden. In der MEKC ist diese Gleichsetzung jedoch nicht gestattet, weil der Analyt auch mit der pseudostationären Phase Richtung Detektor transportiert wird. Um tmob zu berechnen, muß Gl.6 herangezogen werden. vM = t mob v eo tR + ( tR − t mob ) vMC tR (6) -7- vM = mittlere Geschwindigkeit des Analyten veo = elektroosmotische Geschwindigkeit, Geschwindigkeit der wäßrigen Phase vMC = Geschwindigkeit der mizellaren Phase Die Geschwindigkeit der wäßrigen Phase veo kann durch einen Marker ermittelt werden, der sich ausschließlich in der wäßrigen Phase aufhält (k = 0). veo ist gleichzusetzen mit der Länge L der Kapillare bis zum Detektor dividiert durch die Wanderungszeit dieses Markers ( = Totzeit t0). Die Geschwindigkeit der mizellaren Phase kann durch einen Marker ermittelt werden, der sich ausschließlich in der mizellaren Phae aufhält (k → ). vMC ist gleichzusetzen mit der Länge L der Kapillare bis zum Detektor dividiert durch die Wanderungszeit des Mizellenmarkers tMC. Durch Einsetzen und Umformen wird Gl.7 erhalten [1,2]. k= tR − t0 t t 0 (1− R ) tMC (7) Zur Erfassung des Retentionsfaktors k für einen Analyten (elektrophoretische Beweglichkeit µep des Analyten vernachlässigbar) ist es daher immer erforderlich, sowohl die Wanderungsszeit des Analyten als auch die Totzeit als auch die Wanderungszeit der Mizellen zu bestimmen. Wird Gl.7 nach tR aufgelöst, so wird Gl.8 erhalten. tR = 1+ k t0 t0 1+ k tMC (8) Gl.8 kann entnommen werden, daß tR nur Werte zwischen t0 (k = 0) und tMC (k → ) annehmen kann. Die Differenz tMC - t0 wird daher auch als Elutionsfenster bezeichnet. Wenn die elektrophoretische Beweglichkeit µep des Analyten nicht vernachlässigbar ist, so muß zur Ermittlung des wahren Retentionsfaktors k (gemäß Definition oben) neben der Totzeit, der Wanderungszeit des Analyten und der Wanderungszeit der Mizellen auch die elektrophoretische Beweglichkeit µep des Analyten für den jeweiligen Trennelektrolyten ermittelt werden. Es ist zu berücksichtigen, daß die mittlere Geschwindigkeit des Analyten vM und damit die Aufenthaltsdauer in der mobilen Phase (Gl.6) nicht nur durch veo, vMC und k sondern auch durch µep bestimmt wird (Gl.9). vM = t mob ( veo + µ ep F) tR + ( t R − t mob ) vMC tR (9) -8- Wird (µep F) durch L/tep ersetzt (L = Länge der Kapillare bis zum Detektor, tep = Wanderungszeit aufgrund des elektrophoretischen Effekts), Gl.9 nach tmob aufgelöst und in Gl.5 eingesetzt, wird nach weiterer Umformung Gl.10 erhalten. t 0 t ep t 0 + t ep k= t 0 t ep t (1 − R ) t 0 + t ep tMC tR − (10) Der Term [t0 tep/(t o + t ep)] ist gleich der Wanderungszeit t0M des betrachteten Analyten bei Abwesenheit von Mizellen. Gl.10 geht in Gl.7 über, wenn tep → , d.h. wenn der betrachtete Analyt eine vernachlässigbare elektrophoretische Beweglichkeit µep aufweist. Für Analyte mit zu beachtendem µep ist tR nicht auf das Elutionsfenster beschränkt. Wenn tep → (vernachlässigbare elektrophoretische Beweglichkeit µep) und k = 0, so ist t0 = t R. Alle Analyte mit vernachlässigbarer elektrophoretischer Beweglichkeit µep werden bei Abwesenheit der pseudostationären Phase mit dem Totzeitmarker eluiert. Aufgrund der skizzierten Überlegungen ist der wahre Retentionsfaktor k nur dann zu ermitteln, wenn die elektrophoretische Beweglichkeit µep für den jeweiligen Analyten unter den Bedingungen der chromatographischen Trennung bekannt ist. Im Falle eines zu beachtenden µep kann daher der wahre Retentionsfaktor k auch bei Zugabe eines Totzeitmarkers und eines Mizellenmarkers zur Probe nicht direkt aus den Daten eines Chromatogramms ermittelt werden. Daher werden Pseudo-Retentionsfaktoren (apparent retention factors, Berechnung unter der Annahme der Gültigkeit von Gl.9) [8] und pseudoeffektive Beweglichkeiten (pseudo-effective mobilities) [9] als Kenngrößen in der MEKC verwendet. Auch das Konzept des Retentionsindex wurde bereits in der MEKC angewendet [10]. -9- Beeinflussung der Auflösung benachbarter Analytzonen Für die Auflösung R zweier Analytzonen gilt Gl.11. R= 2 ( t R,2 − tR ,1 ) w1 + w 2 (11) tR,2 = Retentionszeit für Analyt 2 tR,1 = Retentionszeit für Analyt 1 w1 = Peakbreite für Analyt 1 w2 = Peakbreite für Analyt 2 Wenn für tR Gl.8 eingesetzt (Annahme vernachlässigbarer elektrophoretischer Beweglichkeiten), die Peakbreite aus der Trennstufenzahl N berechnet und zusätzlich berücksichtigt wird, daß der Selektivitätskoeffizient α = k 2/k 1 (k 2 = Retentionsfaktor für Analyt 2, k1 = Retentionsfaktor für Analyt 1) ist, wird für die Auflösung zweier Analytzonen Gl.12 erhalten. Bei der Herleitung von Gl.12 wird k2 mit dem mittleren Retentionsfaktor km (k m = (k 1 + k2)/2) angenähert, während für k1 der Quotient km/α eingesetzt wird. t0 N α − 1 km tMC R= ⋅ ⋅ ⋅ t 4 α 1 + km 1 + 0 k m tMC 1− (12) Ebenfalls wird für N ein für beide Analyte gemittelter Wert eingesetzt. Wird Gl.12 mit der für die Chromatographie gültigen Gl.13 R= N α − 1 km ⋅ ⋅ 4 α 1 + km verglichen, so ist zu erkennen, daß für 0 < tMC < (13) bei ansonsten gleichen Werten für N, α und km die in der MEKC erreichbare Auflösung gegenüber der in der Chromatographie erreichbaren verringert ist, wenn berücksichtigt wird, daß der Quotient t0/tMC nur Werte zwischen 0 und 1 annehmen kann. Die erreichbare Auflösung hängt vom Verhältnis t0/tMC ab. Je kleiner dieses Verhältnis ist, um so größer ist die erreichbare Auflösung. Gl.12 ist zu entnehmen, daß in der MEKC folgende Größen die Auflösung R zweier Zonen beeinflussen: • die Trennstufenzahl N - 10 - • der Selektivitätsfaktor α • der mittlere Retentionsfaktor km • das Verhältnis t0/tMC Die von km abhängigen Terme in Gl.12 werden als f(k m) in Gl.14 zusammengefaßt. t0 km tMC f (k m ) = ⋅ t 1 + km 1 + 0 k m tMC 1− (14) Bereits TERABE et al. [1,2] wiesen darauf hin, daß f(k m) nicht stetig mit km größer wird, sondern einen Maximalwert erreicht. Durch Bildung der ersten Ableitung von f(k m) nach km (Annahme α und N konstant) und Gleichsetzen mit 0 läßt sich zeigen, daß maximale Auflösung erreicht wird, wenn km = t MC / t 0 [11]. Literatur 1 S. Terabe, K. Otsuka, K. Ichikama, A. Tsuchia, T. Ando: Electrokinetic Separations with Micellar Solutions and Open Tubular Capillaries Anal. Chem. 56 (1984) 111-113 2 S. Terabe, K. Otsuka, T. Ando: Electrokinetic Chromatography with Micellar Solution and Open-Tubular Capillary Anal. Chem. 57 (1985), 834-841 3 J. Vindevogel, P. Sandra: Introduction to Micellar Electrokinetic Chromatography, Hüthig Verlag (1992) 4 G. Kortüm: Lehrbuch der Elektrochemie Verlag Chemie (1972) 5 C.L. Rice, R. Whitehead: Electrokinetic flow in a narrow cylindrical capillary J. Phys. Chem. 69 (1965) 4017 - 11 - 6 P. Gareil: Migration time and resolution in micellar electrokinetic chromatography; Chromatographia 30 (1990) 195 7 K. Ghowski, J.P. Foley, R.J. Gale: Micellar elektrokinetic capillary chromatography theory based on electrochemical parameters: optimization for three modes of operation Anal. Chem. 62 (1990) 2714 8 U. Pyell, U. Bütehorn: Optimization of resolution in micellar electrokinetic chromatography via computer-aided simultaneous variation of concentrations of sodium dodecyl sulfate and urea as modifier J. Chromatogr. A 716 (1995) 81-95 9 M.T. Ackermans, F.M. Everaerts, J.L. Beckers: The pseudo-effective mobility as a parameter for screening J. Chromatogr. 585 (1991) 123-128 10 P.G.H.M. Muijselaar, H.A. Claessens, C.A. Cramers: Application of the Retention Index Concept in Micellar Electrokinetic Capillary Chromatography Anal. Chem. 66 (1994) 635-644 11 J.P. Foley Optimization of micellar electrokinetic chromatography Anal. Chem. 62 (1990) 1302-1308