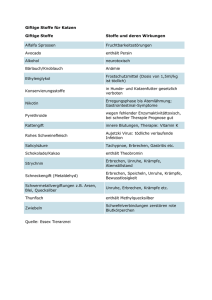
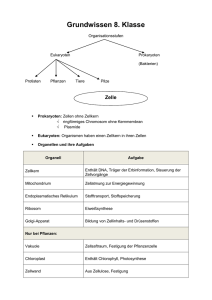
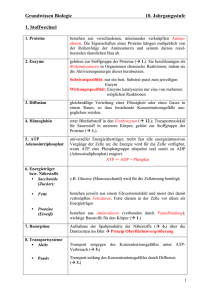
Kompaktinformation zentraler Inhalte
Werbung
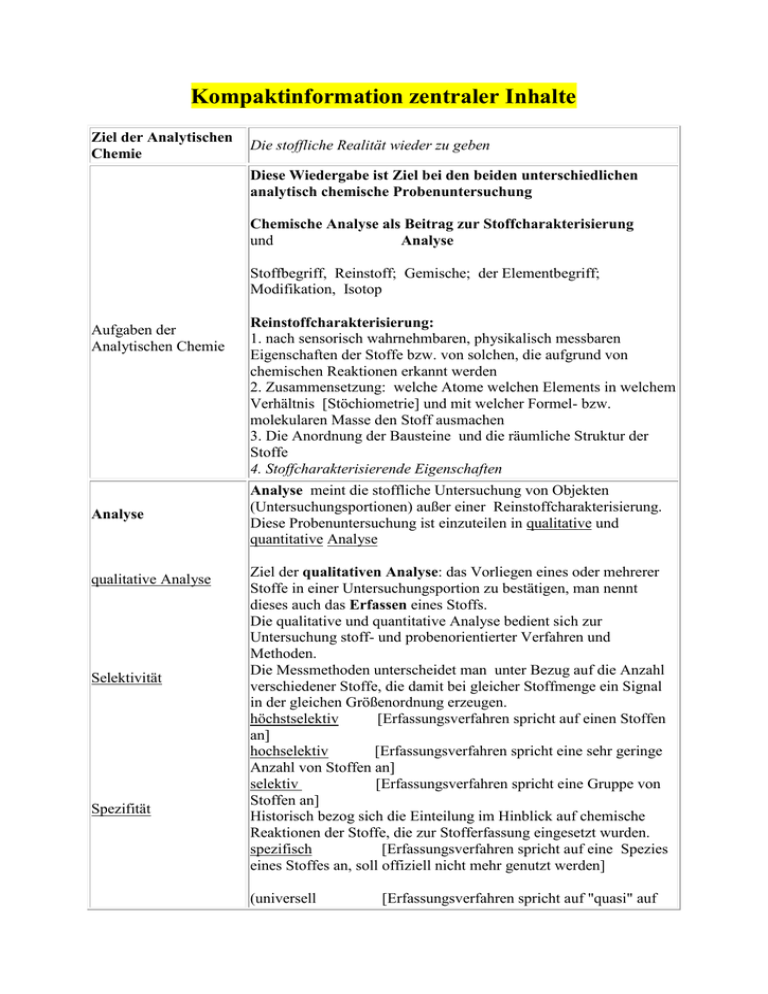
Kompaktinformation zentraler Inhalte
Ziel der Analytischen
Chemie
Die stoffliche Realität wieder zu geben
Diese Wiedergabe ist Ziel bei den beiden unterschiedlichen
analytisch chemische Probenuntersuchung
Chemische Analyse als Beitrag zur Stoffcharakterisierung
und
Analyse
Stoffbegriff, Reinstoff; Gemische; der Elementbegriff;
Modifikation, Isotop
Aufgaben der
Analytischen Chemie
Analyse
qualitative Analyse
Selektivität
Spezifität
Reinstoffcharakterisierung:
1. nach sensorisch wahrnehmbaren, physikalisch messbaren
Eigenschaften der Stoffe bzw. von solchen, die aufgrund von
chemischen Reaktionen erkannt werden
2. Zusammensetzung: welche Atome welchen Elements in welchem
Verhältnis [Stöchiometrie] und mit welcher Formel- bzw.
molekularen Masse den Stoff ausmachen
3. Die Anordnung der Bausteine und die räumliche Struktur der
Stoffe
4. Stoffcharakterisierende Eigenschaften
Analyse meint die stoffliche Untersuchung von Objekten
(Untersuchungsportionen) außer einer Reinstoffcharakterisierung.
Diese Probenuntersuchung ist einzuteilen in qualitative und
quantitative Analyse
Ziel der qualitativen Analyse: das Vorliegen eines oder mehrerer
Stoffe in einer Untersuchungsportion zu bestätigen, man nennt
dieses auch das Erfassen eines Stoffs.
Die qualitative und quantitative Analyse bedient sich zur
Untersuchung stoff- und probenorientierter Verfahren und
Methoden.
Die Messmethoden unterscheidet man unter Bezug auf die Anzahl
verschiedener Stoffe, die damit bei gleicher Stoffmenge ein Signal
in der gleichen Größenordnung erzeugen.
höchstselektiv
[Erfassungsverfahren spricht auf einen Stoffen
an]
hochselektiv
[Erfassungsverfahren spricht eine sehr geringe
Anzahl von Stoffen an]
selektiv
[Erfassungsverfahren spricht eine Gruppe von
Stoffen an]
Historisch bezog sich die Einteilung im Hinblick auf chemische
Reaktionen der Stoffe, die zur Stofferfassung eingesetzt wurden.
spezifisch
[Erfassungsverfahren spricht auf eine Spezies
eines Stoffes an, soll offiziell nicht mehr genutzt werden]
(universell
[Erfassungsverfahren spricht auf "quasi" auf
alle Stoffen an])
Die Klassifizierungszuordnung wird aussagekräftig, wenn man das
Ansprechen des Signals noch mit der Signalstärke bei gleicher
Stoffmenge verknüpft.
{Der günstigste Fall liegt bei einem hochselektiven
Erfassungsprozess dann vor , wenn der Erfassungsprozess nur eine
Spezies des Analyten anzeigt (Biologisch gesteuerte
Erfassungsprozesse kommen einer solchen spezifischen
Signalgebung nahe). }
Bei jeder Signal-Erfassung muss man die systembedingten
Begrenzungen beachten, die immer dann bedeutungsvoll werden,
wenn die in der Untersuchungsportion vorliegende Stoffmenge an
Analyt sehr niedrig ist [nämlich, wenn a) der Analyt als Spur
vorliegt, bzw. b) die Probenmenge selbst in entsprechend geringer
Menge vorliegt.]
Ziel der quantitativen Analyse: die Menge, Stoffmenge bzw.
Konzentration eines vorliegenden Stoffs anzugeben, man nennt es
auch eine Bestimmung vornehmen.
quantitative Analyse
Die quantitative Analyse bedient sich ebenfalls einer Methoden- und
Verfahrensvielfalt, um einen Einzelstoff oder gar viele Stoffe in
einer Untersuchungsportion zu bestimmen
minimale Stoffmengen
Zur Festlegung der unteren Konzentrations- oder
Stoffmengengrenze einer Messmethode bzw. eines
Erfassungsverfahrens dient die Bestimmung der
Standardabweichung einer Leerwertprobe.
Die Erfassungsgrenze {eng.LOD limit of detektion} wird als das
Dreifache der Standardabweichung des Leerwerts, man spricht von
dem 3Sigma-Kriterium, festgelegt
Minimalkonzentrationen Die Bestimmungsgrenze {LOQ} ergibt sich auf Grundlage der
Leerwert- Standardabweichung, in Abhängigkeit ob des sich bei
dem Analyten um eine Spur- bzw. Ultraspur handelt oder um eine
Analyse in einem geringen- bzw. sehr geringen Stoffeinsatz Mikrobzw. Ultramikroprobe} ergeben sich die Zahlenfaktoren n für die
Berechnung über das Produkt n * Sigma mit n = 6, 8 und 10
=> untere Grenzen die zu beachten sind
Als Leerwertprobe zur Bewertung des Messprozesses oder des gesamten
Bestimmungsverfahrens:
Leerwertprobe
Untersuchungsmaterial gleichartiger Zusammensetzung mit den gleichen
Behandlungsschritten, die bei der Probebearbeitung eingesetzt wurde,
erhalten wurde, jedoch den Analyten nicht enthalten soll. =>Leerwert
das Leerwertsignal setzt sich aus zwei Komponenten zusammen: dem
Blindwertanteil und dem Rauschen.
Blindwert bezeichnet man den durch andere Analyten in dem
Leerwertmaterial und vom Analyten selbst, der in der
Leerwert-Signal
Materialuntersuchung auftritt, verursacht wird.
Rauschen nennt man den Signalanteil, der durch den appartiven
instrumentellen Gebrauch für Signalbildung sorgt, er hat mehrheitlich
messtechnische (elektrische und elektronische) Ursachen.
Bei der praktischen Bearbeitung von Proben, beginnend mit der
Probeauswahl, Probenahme, Probentransport, Probelagerung,
Probenvorbereitung, bis hin zur Untersuchung mit dem abschließenden
Bestimmungsprozess und der Auswertung
könnten Fehler folgender Kategorien auftreten
grob (Schlamperei) ,
systematisch,
zufällig
Fehler der ersten Kategorie sind durch notwenige Sorgfalt auszuschließen,
sie dürfen nicht auftreten!!!!
Fehler und
Abweichung
Systematische Fehler, die in einer Fehlerhaftigkeit der eingesetzten
Ausstattung, Methodik und Verfahren begründet sind, lassen sich
erkennen und minimalisieren.
Systematische Fehler sind gerichtet, der sich dabei ergebende Beitrag
erhöht oder erniedrigt den Analysenwert bzw. den bei wiederholter
Messung erhalten Mittelwert. Die einzelnen systematischen Fehler und
addieren sich vektoriell.
Die Lage des Analysenwerts / Mittelwerts zum wahren Wert {tatsächlich}
bzw. Sollwerts {ein bekannter zu erreichender Wert} wird durch die
systematischen Fehler bedingt.
Der Abstand von Wert/(Mittelwert zu wahrem Wert / Sollwert bezeichnet
man als RICHTIGKEIT (engl.: truness)
Der dem Zufall zuzurechnenden -zufällige- Fehler führen zu
Werteschwankungen sie ungerichtet und nicht auszuschließen sind, er
macht sich in der Schwankung um den häufigsten Wert bemerkbar.
Die Schwankung der Einzelwerte bezogen auf den Mittelwert bezeichnet
man als Präzision
Genauigkeit versteht man heute als Oberbegriff in dem die Gesamtheit
von Richtigkeit und Präzision ausgedrückt wird.
Richtigkeit
trueness)einer Analyse ist die Abweichung des festgeselten Ergebnisses vom "wahren Wert". Einen
"wahren Wert" setzt am auch mit einem "Sollwert" gleich ,der dadurch bekannt ist, dass jemand durch
Einwaage eine bestimmte Analytmenge vorgegeben hat. Als dem "wahren Wert" entsprechend
werden
solche
Stoffgehalte
angesehen,
deren
Beträge
durch
übereinstimmende
Untersuchungsergebnisse verschiedener kompetenter Labore mit gleichen und unterschiedlichen
Untersuchungsmethoden und Bestimmungsverfahren erhalten wurde. Diese Referenzgehalte
ersetzen die "wahren Werte"
Das Ausmaß der Abweichung eines Mittelwertes von dem "Sollwert" ist gewöhnlich auf systematische
Fehler zurückzuführen. Es hat nicht an Versuchen gefehlt, aus Messwerten auf die Richtigkeit des
Analysenergebnisses, sprich des Mittelwertes, zu schließen.
Der Idealzustand von Analysenmittelwerten ist gegeben, wenn die Richtigkeit groß ist, d.h. die
Übereinstimmung zwischen wahrem Wert und Mittelwert klein bei gleichzeitig geringster Streuung der
Einzelwerte gegenüber dem Mittel wert. Eine geringe Streuung, besagt auf jeden Fall, dass die
Analyse sehr sorgfältig bearbeitet wurde, d.h. die Wiederholbarkeit ist als sehr gut einzuordnen.
Da man den wahren Wert eines Analytengehalts in einer Probe nicht kennt, weshalb man ihn
bestimmt, stellen wir das Vorgehen vor, durch das man versucht sicher zu stellen, dass ein
Analysenergebnis
richtig
ist.
Eigenvalidierung, Qualitätssicherung
durch
Qualitätskontrolle
Zur einfachsten Kontrolle führt man die gesamte Anlysenprozedur wiederholt mit einer bekannten
Stoffmenge des Analyten durch und vergleicht das Ergebnis.
Als nächsten Kontrollschritt setzt man eine definierte Menge des zu bestimmenden Analyten der zu
untersuchenden (analytfreien) Probematrix zu (In der Praxis mangelt es an solchen realen
Leerwertproben.). Alternativ setzt man den Analyten in bekannter Menge der Probe zu (Siehe
Aufstocken). Sofern keine Störungen auftreten muss die Signalzunahme der zugesetzten
Analytmenge entsprechen.
Als Hilfsmittel zu Eigenkontrolle für Analyte im niedrigen Konzentrationsbereich (Spurenanalyse)
dienen Standardreferenzmaterialien (SRM). Dabei handelt es sich um Realprobenmaterial, welches
von kompetenten Arbeitsgruppen mit unterschiedlichen Verfahren, abweichenden Verfahrensschritten
und Methoden untersucht wurde, wobei für die einzelnen Analyte übereinstimmend die Gehalte
festgestellt wurden. Man kann solche SRM mit einem zertifizierten Gehalt kaufen und daran die
Qualität seiner eigenen Bearbeitung überprüfen.
Standardreferenzmaterialienren (SRM) sind die geeignesten Untersuchungsobjekte mit denen
einerseits die Richtigkeit wie die Genauigkeit gemessen werden kann. .
In vielen Fällen werden nur zertifizierte Labore zur Durchführung von bestimmten
Analysen zugelassen (Lebensmittelüberwachung, Doping). Diese Labors mussten
sich bei Ringversuchen qualifizieren.
Qualitätseinschätzung der Schwankung einer quantitativen Analyse, die
Genauigkeit, Präzision
Genauigkeit
(eng.: accuracy)
Genauigkeit ist der Sammelbegriff für Richtigkeit und Präzision und
beschreibt damit die Auswirkungen systematischer und zufälliger
Einflüsse auf die Messergebnisse und die sich daraus ergebenen
Schwankung - auch als Unsicherheit angegeben der Ergebnisse
[Übereinstimmungsumfang von Analysenwert und richtigen Wert.
Präzision
(eng.: precision)
Präzision ist das Übereinstimmungsmaß von unter definierten
Bedingungen jeweils unabhängig genmessenen Analysenwerten
Daraus ergeben sich die Qualitätskennzahlen: Wiederholpräzision,
Langzeitpräzison, Vergleichpräzison
Wiederholpräzision: Übereinstimmungsmaß von Ergebnissen
wiederholter Messungen einer Größe unter identischen
Bedingungen
=> Überprüfung der Arbeit an einen
Wiederholpräzision
Messtag eines Labors
(eng.:repeatability)
Langzeitpräzision: Übereinstimmungsmaß von Ergebnissen
Langzeitpräzision
wiederholter Messungen einer Größe unter identischen
(eng.: intermediate
Bedingungen
=> Überprüfung einer über mehrere
precision)
Tage erfolgenden Messkampagne eines Labors
Wiederholpräzision
Wiederholpräzision: Übereinstimmungsmaß von Ergebnissen
(reoproducibility)
wiederholter Messungen einer Größe unter verschiedenen
Bedingungen
=> Überprüfung/Vergleich der Arbeit
eines Labors oder verschiedener Labors
Die Beachtung der GLP (gute Laboratoriumspraxis {in Anlehnung an;
good laboratory praxis}) ist im Chemikaliengesetz für entsprechende
Untersuchungen festgelegt. {Die Qualtitätssicherung der Richtigkeit
s.o.} Die GLP fordert eine statistisch ausreichende
Untersuchungswiederholung -und diese auch noch mit der Probe
beginnend. Für die Präzisionssangabe bestehen unterschiedliche
Möglichkeiten, die damit einhergehende Aussagequalität reicht von der
statistischer Kenngröße Standardabweichung (s) bis zum einfachen
Zahlenwert wie Größtfehler (GF) oder Streubreite (SB) (=> Formel
und Gleichungsanhang 1)
Präzisionsangaben
Sollte die ausreichende Mehrfachwiederholung - das sind mindestens
6/8 Durchführungen - zur Auswertung kommen, dann kann die
Präzisionssangabe durch die Standardabweichung s erfolgen
s (entspricht dem Abstand der Wende(punkts)tangente zum häufigsten
Wert aus der Gauss-Verteilung) ergibt als zweite Wurzel der Summe
aller Abweichungsquadrate geteilt durch den Freiheitsgrad (die Anzahl
der zugrunde liegenden Ereignisse minus 1).
Formel aufstellen, nachschauen und Inhalt verstehen.
Sofern nur wenige Durchführungen erfolgt sind, ist nicht auf die
Päzisionssangabe im Bestimmungsergebnis zu verzichten. Sie erfolgt
dann durch andere Angabegrößen: wie die Streubreite, den Größtfehler
uund dgl.
Streubreite entspricht Betrag zwischen den Extremwerten (Minimalund Maximalwert),Grundsätzlich kann die Präzisionssangabe als
Größtfehler erfolgen. Größtfehler ist die zweite Wurzel der Summe
aller möglichen und festgestellten Abweichungen.
Das Analysenergebnis
Jede Analyse (qualitative und quantitative Untersuchungen) ist mit
einem Ergebnis abzuschließen.
Wurde lediglich beabsichtigt einen Stoff oder mehrere Stoffe in
einem Probematerial zu erfassen, dann ist im Falle einer geringen
Konzentration // Stoffmenge folgendes zu beachten: - wenn diese
kleiner/gleich der Erfassungsgrenze (LOD) festgestellt wird- man hat
dann diesen Sachverhalt unter Nennung der Erfassungsgrenze
mitzuteilen.
Analysenergebnis
Darstellung in
Standardform
Sofern bei einer quantitativen Analyse, das Ergebnissignal geringer
als die Bestimmungsgrenze festgestellt wird, ist dieser Sachverhalt
unter Angabe der zu beachtenden Bestimmungsgrenze (LOQ)
mitzuteilen.
Ist der Stoff in ausreichender Menge festzustellen, dann hat die
Ergebnisangabe in der Standardform zu erfolgen.
Die Standardform eines quantitativen Ergebnisses:
Analyt:
Wert//Mittelwert + Päszisionsangabe
{Geben Sie zutreffende Einheiten an.}
Beispiel: Essigsäure in einer Lösung
10,0 + 0.2 mgl-1
Alternative: die Präzisionsangabe kann auch relativ, beispielsweise
prozentual im Hinblick auf den Wert bzw. Mittelwert angegeben sein,
dann muss die Dimensionsangabe nach dem Werteangabe erfolgen,
und Hinweis auf Prozent, Promille Präzisionsangabe ergänzen, im
vorgenannten Beispiel ergibt sich Darstellungsalternative: 10,0
mgl-1 + 2%
Wünschenswert sind quantitative Ergebnisse, die sich auf einen
einzelnen Stoff beziehen. Das ist immer möglich, wenn andere Stoffe
nicht zum Signal beitragen.
Äquivalentangabe
In Abhängigkeit von der Probenzusammensetzung und der der
Selektivität des quantifizierenden Messprozesses kann bei der
Untersuchung von Realproben ohne die Anwendung von
Hochleistungstrennungen nicht notwendigerweise davon
ausgegangen werden, dass nur der ein konkreter Stoff das Signal
erzeugt hat.
(gruppenselektive
Beispiele: 1. Bei Säure- Base-Titrationen wird der Verbrauch bis zum
Bestimmungsprozesse)
Äquivalenz- oder Endpunkt der Titration auf das Auftreten von
Hydroniumionen auf der Grundlage der Neutralisationsreaktion mehrheitlich unter Anwendung einer Indikation durch S-B-I bzw.
oder einer Glaselektrode (bei potentiometrischer Detektion)
festgesetllt.
2. Redoxtitration entscheidet das Halbzellenpotential der
Bestimmungshalbzelle, welcher Verbrauch resultiert.
In solchen Fällen ist es angemessen die quantifizierende Angabe
durch Hinweis auf den Summencharakter aussagekräftig zu machen.
Bestimmungsverfahren
Bestimmungsverfahren ist der Oberbegriff aller eingesetzten
Messprozesse einschließlich der dahinführenden Schritte und
anzuwendenden Methoden, um einen oder mehrere Stoffe zu
quantifizieren.
Solche Verfahren beruhen notwendigerweise auf einem auswertbaren
Signal im Bestimmungsprozess. Bestimmungsverfahren werden zwei
Klassen zugeordnet
Verfahrensklassen
Anwendungsvoraussetzung
Klassifizierung
Absolutverfahren
Relativverfahren
Die Klasseneinteilung erfolgt danach, ob das erhaltene Signal zur
Berechnung der Stoffmenge verwendbar ist. Gemeinsame Erkennung
liefert das Wort "Metrie".
Unabhängig von der Klassenzugehörigkeit müssen die
Bestimmungsverfahren folgendes erfüllen: der Messprozess muss auf
einer vollständigen, eindeutigen Basis beruhen.
Bei Absolutverfahren ist der Messgrößenbetrag direkt einer Stoffmenge
zurechenbar.
In der einfachen Praxis sind es die Messgrößen: Masse und Ladung
Absolutverfahren
{dazu zählt auch die Messgröße der Radioaktivität: Zerfälle pro
Zeiteinheit (die direkt mit der Stoffmenge eines zerfallenden Kerns
korreliert.}
Zugehörige Bestimmungsverfahren:
Relativverfahren
Messgröße: Masse
Elektrozementation {Milligramm}
=> die Gravimetrie und die
Messgröße: übertragene elektrische Ladung => die Coulometrie {in
der Größenordnung um 1 C}
Relativverfahren basieren auf Messgrößen wie: Volumen,
Strahlungsintensität, Absorption, Potenzialbeträgen
Von der Messgröße sich ergebende Bestimmungsverfahren
Volumen:
=> die Volumetrie (Maßanalyse)
Absorption
=> die Photometrie
{Milliliter}
{ max 1 bis 0.002 }
Potenzialbetrag => die Potentiometrie
{Millivolt}
Die mit einem Relativverfahren erhaltene Messgröße reicht jedoch
nicht aus, um den Analytengehalt zu berechnen, man benötigt das
Ergebnis einer weiteren experimentellen Maßnahme.
Klasseneigenschaft
Selektivität der zu den Bestimmungs- und Messverfahren führenden
Signalgebungsprozesse
Volumetrie
Die Maßanalyse bedient sich der Titration als praktischer Maßnahme
Volumetrie
(Maßanalyse)
Der Begriff Volumetrie fasst alle Relativverfahren zusammen, bei
denen die Bestimmung als Titration** erfolgt, somit sind Volumina die
Messgröße, die selbstverständlich aufgrund einer reproduzierbaren,
eindeutigen und vollständigen Reaktion zwischen Analyt und einem
Titrator bekannten Gehalts die Quantifizierung ermöglicht.
Die Säure-Base-Titration ist die bekannteste Gruppe volumetrischer
Bestimmungen, verbreitet sind die Komplexometrie und die
Redoxtitration, seltener die Fällungstitration.
{Während Gravimetrievon wenig geübtenm Laborpersonal vorwiegend im
Milligrammbereich eingesetzt wird, können volumetrisch deutlich geringere Massen
(handwerklich einfach bis in den Mikrogrammbereich) bestimmt werden, wenn
Mikroliterbüretten und apparative Detektion genutzt wird.}
Durchführung als direkte Titration bedeutet: der Titrator wird aus einer
Bürette zu dem gelösten Analyten so lange hinzugefügt, bis eine
aussagekräftige Reaktion zwischen dem Analyten und dem eigentlichen
Reagenz zu keinem weiteren Umsatz führt. Das Zugabevolumen bis zur
vollständigen Umsetzung ist die Messgröße. Eine Stoffmenge und
Analytenkonzentration in der Messportion kann man berechnen, wenn
der Titer des Titrator vorliegt.
Urtiter //
Titerstellung
Standardisierung
Endpunkt
Bei der Rücktitration setzt man der Lösung, die den Analyten enthalten
soll, eine bekannte Stoffmenge des geeigneten Titrators im Überschuss
zu. Nach der vollständigen Reaktion, wird der unverbrauchte Anteil des
Titrators mit einem weiteren Ergänzungstitrator (kann die Lösung des
Analyten sein) umgesetzt. Aus der Volumen- und Stoffmengendifferenz
(bei notwendigerweise bekannte Stöchiometrie sowohl der
Stoffumsetzung als auch bei der Rücktitration wird die
Analytstoffmenge berechnet.
Als indirekte Titration bezeichnet man eine Bestimmung bei der durch
eine Hilfsmaßnahme der Analyt in stöchiometrisch bekanntem Umfang
vollständig umgesetzt wurde und daran anschließend an seiner Stelle
ein aus der Anwendung hervorgehender Stoff bestimmt wird.
Die Menge bzw. Stoffmenge von Analyten läst sich aus dem
Verbrauchvolumen berechnen, wenn z.B.: die Konzentration des
Titrators => genannt Titer (üblicherweise als Molarität moll1
angegeben) bekannt ist. (Siehe Urtitermaterial, Standardisierung
von Lösungen, Titerstellung, externe und interne Standards)
Wann ist die Titration abgeschlosssen? - ist doch klar, nämlich wenn
kein Umsatz mehr erfolgt. Wie erkennt man das Eintreten dieser
Situation?
Als Titration bezeichnet man die praktische Maßnahme, bei der die Zugabe der benötigten
Lösung(en) [bekannten Titers] aus einer Bürette (auch automatisch arbeitender
Volumendosierer) in eine, den Analyten enthaltende Lösung erfolgt.
Endpunkt und Äquivalenzpunkt keine Begriffsvermehrung
Möglichkeiten der Erkennung einer vollständigen Umsetzung (Stoffmengenumsatz
entsprechend der zugrunde liegenden Reaktions-Stöchiometrie). Zur Berechnung eines
zutreffenden Analytgehalts unverzichtbar.
In der Analytischen Chemie ist als Vollständigkeit im Regelfall ein mindestens 99,9 %iger
bzw. 99.99 %iger Umsatz gemeint (Sonderbetrachtung: im Falle extrem kleiner Stoffmengen
in der Untersuchungsportion kann dieser Anteil für die Gesamtanalyse geringer ausfallen.).
Zur Anzeige können charakteristische Eigenschaften des Titrators genutzt werden, die durch
die Umsetzung mit dem Analyten aufgehoben werden und sich bemerkbar machen, wenn die
Titratorzugabe nicht mehr zur Umsetzung führt.
Bei einer Titration könnte das Signal zum Erkennen der Vollständigkeit von einer
Systemkomponente stammen, wie beispielsweise der Eigenfarbe oder, Trübung (Auftreten,
Verschwinden, herrühren.
=> also einer Produkt- bzw. Edukteigenschaft,
wenn beispeilsweise kein weiteres Ausfallen eines Reaktionsproduktes oder ein
erster Überschuss des Titrators erkannt wird
=> Verhalten oder Reaktion eines Hilfsstoffs (z.B. Adsorptionsindikator) mit
überschüssigen bzw. verschwindendem Titrator
Signalerzeugung eines systemkongrunenten zugesetzten Stoffs solche Stoffe sind die eigentlichen Indikatoren (Säure-Base-Indikator, Komplexindikator,
Redoxindikator)
es ist nach der Art der Wahrnehmung des Signals zu unterscheiden
sensorisch (bei Titrationen kommen praktisch nur visuell erkennbare
in Frage)
besonders häufig systemkongruente Indikatoren
apparativ (zunehmend bedeutungsvoll, weil die instrumentelle
Verfolgung des Titrationsvorganges, die Titration damit einfach zu
automatisieren ist.)
Ausführungsformen der Titration
Direkte Titration bezeichnet eine volumetrische Bestimmung bei der Titrator (in einem
Lösemittel gelöst) direkt bis zur äquivalenten Umsetzung hinzugefügt wird und man aus
dem
Volumenverbrauch + Titer - unter Einbeziehung der Stöchiometrie- die Stoffmenge
des Analyten berechnen kann.
Rücktitration
bezeichnet man eine volumetrische Bestimmung bei der zunächst der
eigentliche Titrator in einer bekannten überschüssigen Menge zugesetzt wird und nach der
Umsetzung des Analyten mit einem Hilfstitrator - der nicht benötigte Überschuss umgesetzt
wird - (man sagt auch rücktitriet) Berechnung setzt die entsprechenden Verbrauchsvolumen
(und damit die Stoffengen) sowie die Kenntnis der Stöchiometrien voraus.
Indirekte Titration
bezeichnet man die volumetrische Bestimmung eines Analyten, für
den ersatzweise ein anderer Stoff nach einer Hilfsmassnahme titriert wird. Selbstverständlich
setzt die indirekte Titration einen vollständigen und bekannten Ersatzprozess voraus.
Substitutions Titration bezeichnet eine komplexometrische Bestimmung bei der man der
Lösung des Metallions (hier Analyt) eine überschüssige -insgesamt bekannte Stoffmengeeines instabileren Metallchelatkomplexes zusetzt, wodurch das Analyt-Metallion das im
Komplex eingebrachte Metallion verdrängt,. Dieses freie Substitutions-Metallion wird dann
ersatzweise mit dem komplexbildenden Titrator rücktiriert.
GRAVIMETRIE-Grundfakten kompakt
Geringe Löslichkeit von Salzen als Voraussetzung für ein Trenn- und
Bestimmungsverfahren
(Zur Befassung mit der Löslichkeit im Hinblick auf die Einheit A 10 (praktische
Durchführung der Gravimetrie in der 4 KW 2008) sollten Sie auf jeden Fall die Seiten
nachlesen.
Gravimetrie
Als Gravimetrie bezeichnet man Bestimmungen, bei denen ein
gelöster Analyt (mehrheitlich ein in Wasser gelöstes Ion) durch ein
Fällungsreagenz vollständig in eine geringlösliche Fällungsform
überführt wird, die nach dem Abtrennen, Waschen und einer
thermischen Behandlung als stöchiometrisch einheitlich und bekannte
Wägeform durch Massenfeststellung den Analyten bestimmen läst..
{Man unterscheidet die Gravimetrie nach der Form wie das
Fällungsreagenz angeboten wird, in Bestimmung nach direkter bzw.
Fällung aus homogener Lösung.}
heutige
Bedeutung
Bei den geringlöslichen Fällungsformen handelt es sich mehrheitlich
um Neutralsalze, die Analyten sind demnach die Metallkationen- bzw.
Salzanionen der Salze. Die Gravimetrie ist das aufwendigste klassische
Bestimmungsverfahren, die von erfahrenen Bearbeitern mit ihr zu
erhaltenen Ergebnisse waren im Halbmikrobereich unschlagbar. Wegen
des großen Gesamtaufwands (handwerkliche Geschicklichkeit neben
beträchtlichem Zeitaufwand) und der Verfügbarkeit alternativer
Bestimmungsverfahren hat sie heute eine geringere Bedeutung,
während die Bildung geringlöslicher Salze als einfacher und wirksamer
Trennschritt häufig eine optimale Möglichkeit darstellt.
Direkte Fällung
(ionisches
Fällungsreagenz
liegt bereits gelöst
vor und setzt sich
mit dem ionischen
Analyten in der
Lösung unvermittelt
um)
Mit Vorliebe setzt man für die Fällung von Metallkationen
chelatbildende organische anionische Liganden ein. Damit nutzt man
folgenden Vorteile:
- Die große Auswahl möglicher Chelatliganden führt zur
Selektivitätssteigerung bis zu höchstselektiver Abtrennung unter
Ausnutzung der Milieu-Einflusses der Komplexbildung
- Die sich bildenden Chelatkomplexe werden häufiger in gröberer Form
erhalten, weshalb sie sich besser filtrieren lassen
- Die gewöhnlich größere molare Masse der organischen Liganden
führt nach Chelatisierung zu einem günstigen gravimetrischen Faktor
[Verhältnisse von Analytanteil zur gesamten-molaren Masse bzw.
Formelmasse] was sich wegen der viel größeren Masse der Wägeform
bei gleicher Stoffmenge in einer Empfindlichkeitssteigerung auswirkt.
Die Gravimetrie ist eine handwerklich sehr anspruchsvolle Methode,
deren heutige Anwendung bereits angesprochen wurde. Wegen der
Qualität zur vollständigen Abtrennung von Analyten hat sie noch eine
Bedeutung, was eine Beschäftigung mit Fakten der Fällung und den
möglichen Störungen rechtfertigt.
1. Fällung durch Bildung eines schwerlöslichen Salzes
durch Zugabe des ebenfalls gelösten Fällungsreagenzes oder nach
dem Freisetzen des Reagenzes - in der Untersuchungslösung (wenn
Reagenz erst in Lösung aus einem Vorläuferstoff gebildet wird.!!.).
=> direkte Fällung
=> Fällung aus
homogener Lösung
Fällung aus
homogener Lösung
Man setzt der
Lösung dazu einen
Vorläuferstoff zu,
der auf
unterschiedliche
Weis, sich oft unter
Temperaturerhöhung
zersetzt, einer
Hydrolysereaktion
unterworfen, auch
Milieu gesteuert in
der Lösung zur
Bildung des
Fällungsreagenzes
führt, das dann mit
dem Analytion
reagiert!
Beispiele: Umsetzung von gemeinsam in Lösung befindlichen
Metallkationen mit einigen Reagenz-Anionen kann in Form einer
direkten Fällung zu geringlöslichen
Sulfaten (durch Zugabe von schwefelsauren Lösungen und
Sulfat(VI)-Lösungen,
Oxalaten durch Zugabe von oxalsauren Lösungen, Oxlalat
Fluoriden durch Zugabe von Fluorid(I)
Phosphaten durch Zugabe von phosphorsauren Lösungen,
Phosphaten
Ca(II) würde ausgefällt
Umsetzung indirekte Bildung durch Freisetzen von
Fällungsreagenzien infolge von
pH-Wert bedingten Hydrolysen, zB. Hannstoff zersetzt sich unter
Freisetzung von Hydroxid-Ionen
(bezeichnet als Fällung aus homogener Lösung
Fe(II/ III), Al(III) fallen ggf als gelartige Hydoxide aus.
Probleme infolge von Mitfällung
Okklusion (unselektiver Einschluss)
Absorption (Oberflächenanlagerung)
Mischkristallbildung
siehe auch Löslichkeit und Löslichkeitsproduktkonstante >>
Ursache der Mitfällung
Übersättigung
Löslichkeit und Löslichkeitsproduktkonstante von Salzen und das zugehörige
Löslichkeitsprodukt
Löslichkeit: Bezeichnet das Ausmaß in dem sich ein Stoff in einem anderen (zu einer
homogenen Phase) löst (Legierung, Lösung, Umgebungsluft). Wenn die Löslichkeit erreicht
wird, man spricht von Sättigung , beim Überschreiten von Übersättigung (praktisches
Beispiel: Wasser in Luft).
Löslichkeit überschritten bei: Wolken und Regen, Emulsion, Suspension, Nebel, Aerosol
(heterogene Systeme)
Löslichkeit wird durch das Symbol L (engl. S) abgekürzt. Die Angabe der Löslichkeit kann
in allen absoluten oder relativen Konzentrationsgrößen erfolgen.
ideale Lösungen (molekular dispers), kolloidale Löungen [Chrakterisierung durch
Streulichtbeobachtung, Tyndal-Effekt]
Sonderfall (in Wasser) nur in geringem Umfang lösliche Salze {bezeichnet als
schwerlösliche Salze} in der Regel liegt das gelöste Salz in Form seiner aquatisierten Ionen
vor.
Das MWG beschreibt das dynamische Gleichgewicht zwischen dem Bodenkörper AnBm
und den Salzionen Am+ und Bn- . Erfolgt die Beschreibung des Gleichgewichts
thermodynamisch korrekt mit den Aktivitäten , dann führt diese Behandlung zur
Löslichkeitsproduktkonstanten K(AnBm) . Verbreitet ist es wegen der Aktivität des festen
Bodenkörpers, die 1 ist, wegen der bei geringlöslichen Salzen niedrigen Konzentration die
Aktifität durch die Konzentration aus zu drücken, da wegen dem bei 1 liegenden
Aktivitätskoeffizienten, dieses eine vertretbare Maßnahme darstellt. So gelangt man zu einer
verbreiten Konzentrationsform für die Konstante. Unter sucht man andererseits Lösungen, die
in Wasser dadurch entstehen, indem, ein geringlösliches Salz überschüssig zu Wasser
gegeben wird und bestimmt die Ionenkonzentrationen über dem Bodenkörper, dann kann man
die Konzentrationen in einer gleichen Weise anordnen wie man sie bei der formalen
Behandlung nach dem Massenwirkungsgesetz erhält. Das Ergebnis ist als Ionen- oder
Löslichkeitsprodukt zu bezeichnen! Nach der äußerlichen Form sehen beide Ausdrücke gleich
aus.
(Anhang 2)
Löslichkeit L eines gering löslichen ionischen Stoffes verknüpft die
Löslichkeitsproduktkonstante mit den auftretenden Ionenkonzentrationen.
Löslichkeit und das dynamische Gleichgewicht
Der gleichionische Zusatz (gleichionische Wirkung). Als solches bezeichnet man das
Hinzufügen eines Stoffes, der ionische Komponente eines Salzes geringer Löslichkeit ist.
Ein solches wird bei jeder Niederschlagbildung als fällendes Ion überschüssig
vorhanden sein. Nach dem MWG führt dieser Überschuss zu einer weiteren Ausfällung
des Analyt-Ions.
Der fremdionische Zusatz. Man bezeichnet damit die Wirkung, die von anderen Stoffen
aus gehen, die neben dem Analyten in der Untersuchungsportion gelöst sind während
die Fällung erfolgt.
Man unterscheidet fremdionischen Zusatz nach dem Wirkmuster.
Über die Lösungszusammensetzung und ihren Einfluss auf die Aktivität hat man das die
Löslichkeit vermehrende Wirkung.
Das andere Muster ergibt sich, wenn einer der Ionen der Fällungsform neben dem
Löslichkeitsgleichgewicht über die gelösten Ionen zugleich einem weiteren
Gleichgewicht angehören. Als konkurrierende Gleichgewichte zu betrachten wären
Säure-Base-Gleichgewichte, die pH-abhängig sind, oder eine Komplexbildung. ´
Für die Praxis ist die Löslichkeit bedeutungsvoll.
Tabelliert sind die Löslichkeitsproduktkonstante (Abgekürtzt als Löslichkeitsprodukt,) woraus
sich Löslichkeiten berechnen lassen, die nur beim Vorliegen eines einzelnen geringlöslichen
Salzes in verdünnter Lösung streng zutreffen und ansonsten als Grobwert anzusehen sind.
Die effektive Löslichkeit kann die die Realität auch in komplexer Lösungszusammensetzung
wiedergeben.
Komplexe - Komplexbildung in der Analytischen Chemie
Komplex ist ein in der Cehmuie breit genutzter Begriff für eine Vielzahl
unterschiedlicher Stofftypen
Komplexe
Wir beschränken uns auf solche Komplexionen und
Komplexverbindungen, bei denen ein zentrales Metallkation
(grundsätzlich auch Metallatom) von einem oder mehreren Liganden
(Anion bzw. Neutralmolekül) unter Bindung durch ein oder mehrere
Elektronenpaare umgeben ist. Liganden sind dabei immer LewisBasen. Man bezeichnet die dabei entstehende Bindung als koordinativ.
(Der Bindungscharakter reicht in Abhängigleit bon Zentralteil und
Ligand von kovalent bis ionisch.
Bindung erfolgt nach dem Donator-Acceptor-Konzept des Lewis SäureBase-Modells
Metallkomplexe
Man bezeichnet die Anzahl dieser koordinativen Bindungen in der
ersten Sphäre als Koordninationzahl
Definition: Metallkomplex besteht aus einem Zentralteil und
koordinativ bindenden Liganden!
Einteilung nach
Ladungszustand
Bei der Reaktion von Metallionen (Men+) mit den Liganden (L
Neutralligand oder Lj- Anion) oder in Lösung zu Metallkomplexen
handelt es sich selbstverständlich um ein dynamisches Gleichgewicht.
Bei der Reaktion in wässriger Lösung bilden sich aus den aquatisierten
Metallionen entweder geladene (kationische bzw. anionische) oder
Neutralkomplexe.
Neutralkomplexe sind gewöhnlich in Wasser gering löslich, ionische
Komplexe eher löslich.
Einteilung nach
Koordination
NichtchelatKomplexe
Chelatkomplexe
Man teilt Metallkomplexe auch danach ein, ob ein Ligand mit einer
oder mehreren koordinativen Bindungen mit dem Zentralteil verknüpft
ist.
Einfache Metallkomplexe entstehen, wenn jeweils nur ein
Elektronenpaar eines Atoms des Liganden zur koordinativen Bindung
mit dem Zentralteil reagiert
Als Chelat bezeichnet man solche Matallkomplexe bei denen mehrere
freie Elektronenpaaren verschiedner Atome im Liganden koordinativ
binden. (Zwischen dem Metall als Zentralteil und dem Liganden
werden bestehen dann mehre Bindungen, als eine cyclische Anordnung.
Die Bildung vom löslichen Metallkomplexen war ein frührer häufig
genutzte Reaktion, um störende Metallionen zu maskieren.
Die Bildung von Neutralkomplexe, vornehmlich von Chelaten nutzt
man wwegen der großen Auswahl an Liganden zu
selektivitätsgesteuerten Abtrennung vieler Metallionen.
Anwendungsfelder
in der
Analytischen
Chemie
Ihren Siegeszug hat die chelatisierende Komplexierung mit der Bildung
geringlösliche Salze begonnen. Mit der vollständigen Überführung der
Metallionen in einen sich bildenden Niederschlag, war der Stoff in der
Fällungsform entahlten und lannso durch einen Filtrationsvorgang
abgetrennt werden. Aus diesem Niederschlag kann bei ausreichender
Analyt-Stoffmenge nach weiterer Konditionierung die Wägeform
erhalten werden. [Gravimetrie]
Bildung dieser geringlöslichen Niederschläge eröffnet die Möglichkeit
zu anderen Bestimmungsverfahren. Dann folgt der Stoffabtrennung die
Auflösung.
Heute verknüpft man die Bildung der Neutralchelatkomplex besonders
verbreitet mit ihrer Extraktion. Die Erhaltenen nicht wässrigen Extrakte
nutzt man im Falle gefärbter Produkte direkt zu photometrischen
Bestimmung der umgesetzten Metallionen.
Verbreiteter setzt man auf eine Chelatisierieung mit gereingerer
Komplexometrie - Grundfakten kompakt
Der Namen des Verfahrens deutet auf die Anwendung der Komplexbildung zur Bestimmung
hin. Die Komplexstabilität ist die zentrale Nutzgröße aller komplexometrischen Methoden
und Verfahren.
Komplexometrie
Definition: Als Komplexometrie bezeichnet man volumetrische
Bestimmungen, bei denen im Bestimmungsprozess ein gelöster Stoff
(mehrheitlich ein in Wasser gelöstes Metallion) durch eine
chelatisierende Komplexbildung vollständig in einen löslichen Chelat
überführt wird.
Die geeigneten Titratoren werden (von den Produktherstellern
gefördert) auch als Komplexone oder Titriplexe bezeichnet.
Der verbreiteste Vertreter dieser chelatrisierenden Titratoren ist das als
EDTA bezeichnete "Ethylendiamnintetraacetat" mit deutlichem
Abstand gefolgt vom NTA "Nitrilotriacetat", den Komplexbildnern (mt
einer konzeptionell gleichartigen Bindungsstruktur) kommen nur
Spezialanwendungen zu.
Die chelatbildenden Liganden der Komplexometrie umhüllen das
Zentralkation
Titrator in der
Komplexometrie
EDTA
Die Vorzüge des EDTA: alle Metallkomplexe liegen in einer 1:1
Stöchiometrie mit oktaedrische Anordnung der
elektronpaardonierenden Atome. ES werden nahezu mit allen
Metallionen EDTA-Metall-Komplexe gebildet. Alle metall-EDTAKomplexe sind farblos.
Die Bildung der EDTA-Komplex ist wie mit allen anderen
Komplexonen pH-abhängig. Bei einem pH-Wert von 12 lassen sich
lediglich die Metallkationen mit sehr geringer Bildungskonstante
(Alkali und solche mit der Wertigkeit +1 nicht merklich bilden.)
Zur Umsatzkontrolle eignen sich für die Komplexometrie visuelle
Metallionenindikatorsysteme, die ebenfalls auf der Chelatisierung der
metallionen beruhen.
Indikatoren
Die Farblosigkeit der EDTA-Komplexe der begünstigt den
Einsatz der Metallkomplexe mit Zusammenspiel mit den als
Metallindkatoren bezeichneten Liganden, deren freie eine andere
Farbe in Lösung zeigt als der metallindikatorkomplex.
Verwendbar sind die Systeme in Abhängigkeit ihre Bildungs(Stabilitäts)-Konstanten. Sie müssen nämlich eine geringe haben
als die der Metallionen-Komplexon Komplexe, (deren
Stabiltitätskonstate sollte andererseits nur angemessen geringer
sein.
Ausführungsformen {Als volumetrische Bestimmungen werden bei der Komplexometrie die
der Titration
verschiedenen Durchführungenformen gewäht.}
Direkte Titration
Rücktitration
Als direkte Komplexometrie bezeichnet man den Bestimmungsprozess,
bei dem in der Regel das gelöste Metallkation mit einem Chelatbildner
vollständig umgesetzt wird. Diese einfachste Ausführung wird selten in
Man setzt der
Lösung dazu einen
Vorläuferstoff zu,
der auf
unterschiedliche
Weis, sich oft unter
Temperaturerhöhung
zersetzt, einer
Hydrolysereaktion
unterworfen, auch
Milieu gesteuert in
der Lösung zur
Bildung des
Fällungsreagenzes
führt, das dann mit
dem Analytion
reagier
umgekehrter Reihenfolge eingesetzt.
Die Rücktitration, bei der das Komplexon in bekannter Stoffmenge und
garantiert überschüssig der Untersuchungsportion zugefügt wird, ist
recht häufig. Der unverbrauchte Überstuss an Komplexon wird mit
einer eingestellten Metallsalzlösung zurück titriert. (Gründer vor dies
Ausführung sind chemisch begründete Störungen und das Fehlen eines
geeigneten visuellen Indikators
Die Substitutionstitration ist eine komplexometrieeigene
Ausführungsform. Bei ihr setzt man der Probe eine bekannte
überschüssige Menge eines Metall-Kompexon-Komplexes zu. Sofern in
der Lösung metallionen vorliegen, die eine höhere Bildungskonstante
als das chelatgebundene Metall haben, verdrängen sie dieses. Inder
Substitutionstitration Lösung erfolgt die Bestimmung über "Titration" dieses frei gesetzten
Metallions mit der Komplexonlösung.
Das elektrische Potenzial - Potentiometrie und potentiometrische Detektion
elektrisches
Potential
Historie
Nernst-Gleichung
apparative
Komponenten
zur
Potentialmessung
Historisch waren das Verhalten von Metallen gegenüber sauren
wässrigen Lösungen und von auftretenden elektrischen
Spannungsbeträgen bei galvanischen Zellen die grundlegenden
experimentellen Befunde,
für die Aufstellung der Spannungsreihe
zur Auswahl der Standardwasserstoff-Halbzelle
zur Beschreibung aller Halbzellenreaktionen durch die
Nernst-Gleichung der Elektrochemie führt
Anordnung erfordert als Messobjekt (mindestens) eine wässrige
Lösung,
in die sowohl eine Mess- als eine Vergleichselektrode eintaucht,
wobei diese elektrisch über ein stromlos die Spannung messendes
Voltmeter verbunden sind.
Einstab-Ausführung
Bei der potentiometrischen Detektion, erkennt man häufig auf den
ersten Blick diese Komponenten nicht, wenn die Referenzelektrode in
die Messelektrode {als Einstabmesskette konfiguriert} integriert ist.
Eine solche Anordnung hat man bei der verbreiteten Einstabversion zur
"pH-Messung".
"pH-Elektrode"
Die Messelektrode (Glaselektrode) für die Feststellung der in wässriger
Lösung vorliegende Hydroniumkonzentration, zählt zu den sensitive
Elektroden. {Über einen breiten Konzentrationsbereich spricht die
Elektrode weitgehend nur auf den Analyten an - erst bei
Absolutpotentiale
nicht messbar
Konzentrationen über 10-11 M wird die Störungsanfälligkeit groß.}
Für die mögliche Abbildung der herrschenden Milieubedingungen sind
Prozesse verantwortlich, in denen der Glasmembran die entscheidende
Funktion zukommt.
Wegen der experimentellen Unmöglichkeit Absolutpotentiale zu
messen, bedarf es einer Gegenelektrode, deren Potenzial sich zum
Vergleich eignet.
Bei der Potentiometrie muss die Referenzelektrode, um die
Vergleichbarkeit sicher zu stellen, ein konstantes Potential haben, diese
Konstanz muss in der Regel auch bei der potentiometrischen
Detektion gewährleistet sein.
Die potentiometrische Detektion hat bei den Säure-Base-Titrationen
die visuelle S-B-Indikatoren-Erkennung verdrängt. Überdies wird sie
wegen der breiten H3O+- Selektivität der Glaselektrode auch zur
Bestimmung in wässriger Lösung von Proben eingesetzt.
Während die Potentialempfindlichkeit bei der
H3O+-Glaselektrode, etwas aufwendiger zu erklären ist, ist
es logisch, dass beim Vorliegen eines Redoxpaares, das sich einstellende Potenzial aufgenommen werden
kann.
Potentiometrische
Detektion unter Bildung Verwendet man beispielsweise als Messelektrode einen Silberdraht und taucht dieser in eine
silbersalzhaltige Lösung, dann wird notwendigerweise das Halbzellenpotenzial messbar.
von Redoxpaaren
Taucht andererseits ein Platindraht in die Lösung eines Halbzellenpaares , so bildet sich das Potenzial des
Redoxpaares dort ab und kann ebenfalls stromlos mit einem Referenzpotential einen Messwert liefern.
Verändern sich die Potential bildenden Stoffmengenverhältnisse, verändert sich der Messwert als Signal.
Redoxtitrationen - eine analytisch chemische Anwendung der
Elektronenübertragungsprozesse
Elektronenaustauschvorgänge bezeichnet man als
Redoxreaktionen. Deren komplementäre Teilreaktionen
die Reduktion und die Oxidation sind.
Oxidation und Reduktion
komplementäre Prozesse
Wobei Oxidationsmittel Stoffe sind, die bei einem
Redoxprozess ein oder mehrere Elektronen aufnehmen
und dabei selbst reduziert werden. Den
Elektronenlieferanten nennt man Reduktionsmittel, weil
sie Elektronen spendeen (abgeben) und selbst dabei
oxidiert werden. Der reduzierte Zustand ist immer ein
elektronenreicherer, der oxidierte Zustand ein
elektronenärmerer. eines
Alle Redoxvorgänge lassen sich in die zugrunde
liegenden Halbzellenreaktionen aus Oxidations- und
Redcktionsvorgang zergliedern. Formuliert man die
Gesamtumsetzung oder diese Teilgleichungen sind neben
der Massenbilanz die der Ladung zu berücksichtigen.
Potentialdarstellung von
Halbzellenreaktionen stets als
Reduktion
Zur quantitativen Beschreibung der Potentiale aller
Halbzellen und Gesamtreaktionen, wie zur Ermittlung der
Größe im Gleichgewicht bedient man sich der
Nernstgleichung. Dabei ist es Konvention alle
Elektronenübertragungen als Reduktion zu behandeln.
Wobei wenn man die quantitative Behandlung
Spannungsreihe
zur Auswahl der StandardwasserstoffHalbzelle
Wegen der Komplementarität von Oxidation und
Reduktion ist der Gesamtvorgang zur Bestimmung dann
nutzbar, wenn der Unterschied zwischen den
Ausreichende Potentialdifferenz
Reduktionspotentialen ausreichend groß ist. Under dieser
Voraussetzung ist die vollständige Umsetzung zu den
Voraussetzung für eine Nutzung
gemeinsamen Produkten zu erwarten.
von
Elektronenübertragungsvorgängen
Ausreichend große Potentialdifferenz bedeutet, dass unter
den in die Potentialbildung eingehenden Bedingungen ein
Redoxtitrationen
in der Regel ein Differenzbetrag von 150 mV besteht.
Eine solche Potentialdifferenz zwischen zwei Halbzellen
kann man immer dann zur Bestimmung nutzen, wenn die
Stöchiometrie bekannt und gleichartig ist. Eingesetzt wird
sie in Form von volumetrischen Bestimmungen, die als
Redox-Titrationen bezeichnet werden. Der gelöste Analyt
wird dabei durch den Titrator, der meistens ein
Oxidationsmittel ist in einer bekannten Redoxreaktion
umgesetzt.
Wie bei allen Titrationen, müssen Redoxtitrationen auf
einer bekannten eindeutigen und wiederholbaren
vollständigen Umsetzung beruhen. Als Relativverfahren
muss der Titer des Titrators bekannt sein oder die
Quantifizierung durch eine andere Standardisierung
gegeben sein.
Die bekanntesten Redoxtitrationen sind die
Manganometrie, die Cerimetrie und die Iodometrie
Ihre Namen verdanken die Methoden den genannten
Elementen, die in den Titratoren auftreten
Manganometrie
Cerimetrie
Bei der Manganometrie ist der wirksame Titrator das
Manganat(VII), wobei in Abhängigkeit von der
Hydroniumionenkonzentration unterschiedliche
Halbzellenpaare und damit Potentiale genutzt werden
Iodometrie
In der Cerimetrie dominiert das Ce(IV)
In der Iodometrie ist es eine mögliche Form des gelösten
Iods
Lösungen der Titratoren sind deshalb geeignet, weil das
Manganat(VII) gezielt entweder in Mangandioxid oder
Mn2+ überführt wird.
Cer(IV) Lösungen haben ebenfalls oxidierenden Charakter
und werden zu Ce(III)
Iod wird bei der direkten Umsetzung unter
Elektronenaufnahme zu Iodid.
Die verbreiteten Redoxtitrationsmethoden kann man mit
der potentiometrischen Detektion verfolgen und aus der
Auftragung des Potentialverlaufs den Titrationsendpunkt
ermitteln.
Immer noch eingesetzt werden die herkömmlichen
visuelle Erkennungsmethoden
Bei der Manganometrie nutzt man das das erste Auftreten
überschüssigen Oxidationsmittels, da man infolge der
intensiven Violettfärbung von gelöstem der
Manganat(VII) MnO4- dessen Auftreten in geringer
Menge bereits erkennt.
Äquivalenzpunkt-Erkennung
Um den Äquivalenzpunkt einer Cerimetrie mit einem
Rexoidikator anzuzeigen, muss das Übergangspotential
des ausgesuchten korrespondierenden Redoxpaars mit
dem im Bestimmungssystem vertretbar übereinstimmen,
so dass die unterschiedliche Farbigkeit der Paarpartner
genutzt werden kann.
Die Iodometrie ist ein Beispiel für die Nutzung eines
Hilfsstoff zur Äquivalenzpunkt anzeige. Die Eignung
beruht darauf, dass in Lösung vorhandenes Iod sich in die
Helix der Stärke einlagert was mit einer intensiven
Blaufärbung einhergeht. Verbraucht man Iod bei einer
Titration, dann führt die Gleichgewichtsverschiebung zu
einen Herauswandern der eingelagerten Iodspezies, was
man als Entfärbung beobachtet.
Materie und Licht
Licht wird zunächst als Strahlung von der Sonne wahrgenommen
Licht
elektromagnetische
Felder
Künstlich erzeugtes Licht kennen wir von Glühlampe und sonstigen
Lichtspenden. Glühende Objekte verändern nicht nur die Temperatur
in ihrer Umgebung, sondern sie senden oft auch von uns
wahrnehmbares Licht aus.
Experimetelle Befunde unterstützen den dualen Charakter des Lichts.
So ist er korpuskular zu interpretieren aber auch als Welle zu
verstehen. Seine unglaubliche Ausbreitungsgeschwindigkeit erstaunt
bereits und führt dann außerhalb wahrnehmbarer Sachverhalte zu den
Vorstellungen der Quantelung von Energie
Gleichgültig ob wir die durch Licht übertragene Energie mit seinem
Massencharakter E= 1/2 mv2 verbinden oder auf seinen
Schwingungsverhalten E=hv verweisen, faszinieren
Weißes Licht,
Lichterscheinungen wie Regenbogen oder die durch Zerlegung erzeugte
Farbigkeit
komplementärfarben spektrale Farbenvielfalt die uns zu Johann Wolfgang Göther und seiner
Farbenlehre führen.
Weißes Licht, Farbigkeit und komplementäre Farben sind längst
Alltagsbegriffe
Unterschiedlich gefärbtes Licht nehmen wir auch mit seiner
Temperaturwirkung wahr, was hilft die Energieverknüpfung zu
verstehen.
In der Praxis
Bei der als Flammenfärbung bezeichneten Lichterscheinung handelt es
sich um das Aussenden von Lichtquanten bestimmter Energien. Das
Einbringen
Aussenden können wir heute erklären, es ist die beim "Abregen"
bestimmter Stoffe in isolierter Elektronen ausgesandte (emittierte Energie) die zuvor
eine Flamme
angeregt wurden. Darunter verstehen wir die Aufnahme von
erkennen wir an
bestimmten Energiemenge durch Elektronen die von ihrem
einer oft
Ausgangszustand in einen höheren "Angeregten
charakteristischen
{energiereicheren]Zustand" überführt wurden und diesen nach sehr
Verfärbung, nämlich kurzer Zeit wieder verlassen und dieses Licht dann aussenden wenn sie
natriumhaltiges
nach sich in einem ebenso diskreten Zustand wieder finden (es kann
Material färbt immer der ursprüngliche sein.).
intensiv gelb.
Die systematischen Untersuchung der Emissionen bestätigt die Modelle
für den Aufenthaltsort von Elektronen,. die zu einem Atom gehören und
von denen man zunächst annahm, dass sie sich die Elektronen in
Umlaufbahnen (Bohr-Modell) aufhielten . Die vorgenannten
spektroskopischen Befund haben unser Modelle verfeinert, und
viele gelöste Stoffe nunmehr sprechen wir nicht länger von Bahnen sondern von Zuständen
führen zu gefärbten die durch diverse (Haupt, Neben, magnetische Quantenzahlen und den
Spin anzugeben sind.) Heute sind Messverfahren entwickelt ,die
Lösungen
sowohl die Anregung der Elektronen z.B. AAS wie deren Emission
z.B. AES nutzt, man spricht von atomspektroskopischen oder
atomspektrometrischen Verfahren.
Das Auftreten gefärbter Stoffe und insbesondere von farbigen
Lösungen muss man abweichend erklären. Als gemeinsame Merkmale
aller gefärbten Stoffe, hat man Elektronenpaare ausgemacht und zwar
solche von Molekülen oder molekularen Ionen. Elektronenpaare der
Arten pi (also alle mehrfach bindenden Elektronenpaare), die nicht
bindenden als n abgekürzten und die für Einfachbindungen und als auch
die in einer Mehrfachbindung auftretenden Atombindungen zwischen
Atomen der molekularen Anordnungen die als sigma bezeichnet
werden und durch das s als Symbol dargestellt werden.
Durch Wechselwirkung mit elektromagnetischen Wellenfeldern wie
dem Licht im sichtbaren Energiebereich bzw. im benachbarten
Ultravioletten können die drei Elektronenpaararten angeregt werden.
Dabei werden die durch Energieaufnahme auftretenden Übergänge als
pi-pi*, n-pi* oder s-s* und n-s* bezeichnet. Die Elektronenpaar liegen
dann in einem angeregten (antibindenen) MO Molekülorbital vor.
s-s* und n-s* werden gewöhnlich eher im fernen UV angeregt, die
Anregungen zu pi* beobachtet man schon im Sichtbaren.
Begrenzungen für die störungsfreie Signaldetektion
Realproben mit einer möglichen Vielzahl von Einzelstoffen, die aus der
Probematrix selbst stammen oder ansonsten wie der Analyt oder die
Analyte in der Probe auftreten, können ggf, wegen eines Mangels an
Detektionselektiviität die Quantifizierung verhindern. Zu einer Die
störungsfreie Detektion ist möglich, wenn der Analyt isoliert in der
Messportion vorliegt oder die störenden Stoffen zu keiner
Signalentfaltung kommen können.
Störungen der
Detektion
Physikalische
Eigenschaften von
Stoffen di
Letzteres erreicht man beispielsweise dadurch, dass man die störende
Stoffe an der Signalentfaltung in Derivate überführt, die mit der
gewählten Methode kein Signal verursachen oder man sorgt dafür dass
sie während des Signalerzeugungsprozesse nicht anwesend sind. Im
ersten Fall spricht man von Maskierung, wobei das Derivat weiter in
der Untersuchungslösung vorliegt.
Ein andere Situation liegt dann vor, wenn der Stoff entweder vor der
Detektion abgetrennt wurde oder man dafür sorgt, dass Analyt und
störende Stoffe nicht gleichzeitig mit dem Analyten detektiert werden
kann oder wird.
Sofern man Messverfahren zur Detektion einsetzt, bei dem die
natürlichen Gegebenheiten keine direkte Störung des Messsignals zur
Folge haben, ist man in der Regel bestrebt, zumindest die Matrix und
möglichst auch noch hohe Konzentrationen von andren auftretenden
Stoffen zu minimalisieren, da diese nahe zu immer zu unspezifischer
Störung beitragen.
Bestimmungsbeeinträchtigung durch: erhöhte Bestimmungsgrenzen
und geringere lineare Messbereiche
Abtrennen und Trennen
Abtrennen und Trennen ist deshalb in Analysenverfahren bei denen mit
den mit klassischen Messmethoden detektiert wird unerlässlich.
In Analysenverfahren genutzte Stoffeigenschaften zum Abtrennen:
Bei Feststoffen ihre Korngröße: z.B. Aussieben / Filtrieren, {in der
Technik Windsichten}
Dichte:
Sedimentieren
Verhalten in Feldern
elektrische +
Eigenschaften zum
magnetische Eigenschaft
Abtrennen von
Stoffen
Verhalten gegenüber Temperatur. Schmelzen , Sieden
Sublimieren, Ausfrieren
Löslichkeit im Mehrphasenraum , Flüssig-FlüssigVerteilung; Extraktion
Absorption an Oberflächen
Das Verteilungsverhalten: Extraktion, wiederholte Extraktion, Rückextraktion und
multiple Extraktion
Experiment zum Verhalten von Stoffen in einem Zweiphasensystem:
Verteilungskoeeffizient
K
Gibt man zu einer wässrige Lösung, die man in einem
Scheidetrichter vorgelegt hat, und in der die drei unterschiedlichen
Stoffe A, B und C in gleicher Stoffmenge gelöst vorliegen, zwei
deutlich verschiedene, sich mit Wasser "nicht mischbare Lösemittel"
Verteilungsverhältnis hinzu, schüttelt die geschlossenen Scheidetrichter (unter sorgsamen
D
Entlüften) danach kräftig, wobei es zu einer merklichen
Durchmischung der beiden Flüssigkeiten kommen sollte, dann
entmischen sich danach die beiden Lösungen. Man bezeichnet ein
solches Vorgehen als eine Exktraktion!
e
Untersucht man danach in den Lösungen die "Konzentration der
Stoffe A, B , C, dann stellt man für die drei eine von dem
Extraktionslösemittel abhänge Situation fest.
Die Extraktionspraxis in diesem System zweier flüssiger Phase wird
auch Flüssig-Flüssig-Verteilung genannt. Man hat solche System
gründlich untersucht und bestätigt, dass das
Konzentrationsverhältnis der einzelnen Stoffe im System Wasser/
Lösemittel I und Wasser zu Lösemittel II jeweils eine
charakteristische Größe ist, die die dynamische Gleichgewichtslage
quantitativ beschreibt.
Sofern man alle Stoffspezies der gelösten Stoffe A, B und C in dem
Zwei-Phasen-System erfasst dan nennt man die Konstante D, es ist
Verteilungsverhältnis, in der Praxis der Analytischen Chemie greift
man auf diese Größe zurüch, weil gewöhnlich man am den
Stoffengen des Stoffes und nicht differenziert nach einzelnen Spezies
interessiert ist.
Eine andere Grundlage liegt in den selteneren Fällen vor, wenn eine
Bestimmung mit dem Ziel durch geführt wird quantitative Aussagen
über einzelne Stoffspezies zu treffe, In diesen Fällen, d.h. wenn das
Verteilungsverhalten nur einer bestimmte einzelnen Spezies in
diesem dynamischen Gleichgewicht interessiert, dann greift man auf
Betrag zurück, den K der Verteilungskoeffizient nach Nernst, hat.
{Auf dieser Grundlage behandeln Physikochemiker das
Gleichgewicht thermodynamische exakt, wenn sie die
Gleichgewichtslage mit den Aktivitäten ausdrücken.}
Die Extraktion als Massnahme Stoffe durch die Anwendung eines
Extraktiosmiltels aus ihrer bisherigen Umgebung herauszulösen ist
natürlich nicht auf flüssige Proben beschränkt. In der Praxis der
Analytischen Chemie stellt sie häufig den ersten eigentlichen
Behandlungsschritt im Analytischen Prozess dar. [Die
vorangehenden Maßnahmen der Probenahme, usw. bis zum Erzeugen
einer Bearbeitungsportion seinen als vorbereitende Schritte
zusammengefasst.]
Rolle der Extraktion
Entscheidendes: Ziel der extraktiven Behandung einer Probe ist es
den Analyten vollständig aus seiner Ursprungsumgebung heraus zu
lösen [Richtigkeit].
Außerdem setzt man die initiale Extraktion, wie die entsprechende
andere Verteilungsschritte in einem Analysenverfahren mit der
Absicht ein, möglichst vie der Matrix und weiterer, den Analytiker
in der Probe nicht interessierender Stoffe möglicht dabei auch
abzutrennen.
Ergebnis der
Weil die Extraktion selber stets zu endlicher Verteilung führt, muss
man häufig wiederholt (erschöpfend) extrahieren, um den Analyt
vollständig in der Bearbeitungslösung zu erhalten.
wiederholten Extration In der Folge einer vollständigen Extraktion werden aber auch stets
andere, die bekanntlich ebenfalls der dynamischen Verteilung
unterworfen Stoffe mit extrahiert.
Anwendung der
Rückextraktion
multiplikative
Verteilung
Kombination von
erschöpfender
uExtraktion und
Rückextration aller
Extrakte
Nehmen wir für die drei vorgenannten Stoffe im System
Wasser/Hexan folgende Verteilungsverhältnisse zugunsten der
nichtwässrigen Phase an DA = 10, DB = 1 und Dc = 0.1
Dann ergibt sich: Extrahiert man die wässrige Lösung der drei Stoffe
A, B und C wieder holt, dann hkann von in der vorgelegten Lösung C
durch häufig wiederholte Extraktion rein erhalten, allerdings mit
einer kleinen Stoffmenge.
Es ist logisch, dass man A dann rein erhält, wenn man einen den
nichtwässrigen Extrakt wiederholt mit Wasser rückextrahiert.
Selbstverständlich gibt auch für die wiederholte Rückextraktion,
man kann A rein erhalten, allerdings bei diesem Vorgehen ebenfalls
nur in einer deutlich kleiner Stoffmenge, als sie in der wässrigen
Ausgangslösung vorlag. Präparative Chemiker waren früher damit
häufig zufrieden, denn sie konnten so einen Stoff rein erhalten
Führt man eine quantitative Analyse, dann ist man häufig an der
Erfassung bzw. Bestimmung von mehreren Stoffen in einer Probe
interessiert.
Setzt man die Erkenntnis aus den Experimenten von wiederholter
Extraktion und Rückextraktion folgerichtig zusammen ergibt sich das
Vorgehen, um beide Ziele gemeinsam zu erreichen, nämlich eine
simultante Stofftrennung, die Quantifizierung mehrere Stoffe
ermöglicht. Vertretbar einfach ist sie in dem Zweiphasensystem, das
auf die Flüssig-Flüssig-Verteilung zurück greift, zu realisieren.
Man kombiniert dazu die wiederholte erschöpfende Extraktion mit
einer Rückextraktion aller erhaltenen Extrakte. Durchgeführt wird
das in einer Batterie (Serie) von zur Flüssig-Flüssig-Verteilung
geeigneten Gefäßen, bei der es möglich ist a) die Extraktionslösung
nach dem Verteilungsschritt den nächsten Trennbehälter zu
überführen , der zunächst nur mit dem Lösemittel befüllt ist aus dem
die Analyte zu extrahieren waren. Außerdem muss man nach jeder
Extraktion in das erste Trennbehältnis neues Extraktionslösemittel
einfüllen, damit die erschöpfende Extraktion erfolgen hkann.
Die beschriebene Vorgehensweise bezeichnet man als multiplikative
oder multible Vetreilung. Sie wurde ua. von Craig apparativ
realisiert. So gelang es Stofftrennungen von gelösten Analyten
erfolgreich vor zu nehmen. Die multiple Verteilung stellt einen
Vorläufer-Ansatz für alle chromtographischen Trennverfahren dar.
Die multiple Verteilung unterscheidet sich jedoch in einem zentralen
Sachverhalt von den chromatographischen Verfahren: bei der
multiplen Verteilung stellt sich das Verteilungsverhältnis nur jeweils
einmal ein, die Trennung kommt durch die Addition der einzelnen
Verteilungsschritte zustande.
Verhalten von Stoffen in einem sich an einander vorbei bewegenden Phasenpaar