Elektroanalytik - papa
Werbung

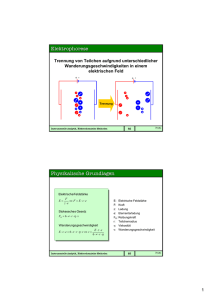
Instrumentelle Analytik SS 2008 1. Elektroanalytik-I (Elektrochemie) M. Gey: Instrumentelle Analytik, Elektroanalytik-I 1 1. Elektroanalytik-I 1. Begriffe/Methoden (allgem.) 1.1 Elektroden 1.2 Elektrodenreaktionen 1.3 Galvanische Zellen M. Gey: Instrumentelle Analytik, Elektroanalytik-I 2 1. Elektroanalytik-I 2. Spezielle Metoden 2.1 Elektrogravimetrie 2.2 Coulometrie 2.3 Konduktometrie 2.4 Elektrophorese 2.5 Potentiometrie 2.6 Amperometrie 2.7 Voltammetrie 2.8 Polarographie M. Gey: Instrumentelle Analytik, Elektroanalytik-I 3 Elektroanalytik - Definitionen ¶ Ausnutzung elektrochemischer Messungen für die Lösung von Analysenproblemen. ¶ An den Elektroden laufen physikalische oder chemische Vorgänge ab, die durch Messung È der Zellspannung È der Stromstärke È des elektrischen Widerstandes È der elektrischen Ladung oder ¶ der Wanderung v. Teilchen im elektrischen Feld ausgenutzt werden können. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 4 1. Elektroanalytik-I 1. Begriffe/Methoden (allgem.) 1.1 Elektroden sind sich berührende Phasen, bei denen neben elektronenleitenden Phasen in mindestens einer Phase Ionenleitung möglich ist. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 5 1. Begriffe/Methoden (allgemein) 1.2 Elektrodenreaktionen sind heterogene Reaktionen zwischen Bestandteilen zweier sich berührender Phasen, in deren Verlauf ein Durchtritt von Ionen oder Elektronen und damit ein Stromfluß durch die Phasengrenzfläche stattfindet. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 6 Aufbau der Phasengrenzschicht einer Elektrode 7 1. Begriffe/Methoden (allgemein) 1.3 Galvanische Zelle ist ein mehrphasiges System, das aus wenigstens 2 Elektroden besteht und dessen Elektrolytphasen elektrolytisch miteinander verbunden sind. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 8 Galvanische Silber-Zink-Zelle 9 Galvanische Silber-Zink-Zelle 10 1. Elektroanalytik-I 2. Spezielle Metoden 2.1 Elektrogravimetrie ist eine Methode, bei der die Masse einer elektrolytischen Abscheidung benutzt wird, um die Analyte zu bestimmen. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 11 2. Spezielle Methoden 2.2 Coulometrie Methode, bei der die Menge des Analyten bestimmt wird, in dem die Anzahl von Coulomb für eine vollständige Analyse ermittelt wird. 1 Coulomb ist die Ladungsmenge pro Sec., die durch jeden Punkt eines Stromkreises fließt, wenn die Stromstärke 1 Ampere beträgt. (1 Mol Elektronen entspricht einer Ladungsmenge von 96485,309 Coulomb. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 12 2. Spezielle Methoden 2.3 Konduktometrie ist eine physikalische Analysemethode, die die elektrische Leitfähigkeit einer Probe zur Bestimmung ihrer Inhaltsstoffe und deren Konzentration ausnutzt. ♦ Bei dem Bestimmungsverfahren wird die Leitfähigkeit über den elektrischen Widerstand in einer Leitfähigkeitsmeßzelle gemessen. ♦ Die Konzentration wird anhand von Eichkurven bestimmt. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 13 2. Spezielle Methoden 2.4 Elektrophorese ♦ Elektrophorese bezeichnet die Wanderung elektrisch geladener Teilchen durch einen als Trägermaterial dienenden Stoff in einem elektrischen Feld. ♦ Siehe Vorlesungen/Praktika Bioanalytik-I M. Gey: Instrumentelle Analytik, Elektroanalytik-I 14 2. Spezielle Methoden 2.5 Potentiometrie Es werden Stoffmengenkonzentrationen durch die Messung von Spannungsdifferenzen zwischen einer Meßelektrode (Indikatorelektrode) u. einer Bezugselektrode (Referenzelektrode) in einer elektrochemischen Zelle stromlos ermittelt. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 15 2. Spezielle Methoden 2.6 Amperometrie die Messung er elektrischen Stromstärke für analytische Zwecke M. Gey: Instrumentelle Analytik, Elektroanalytik-I 16 2. Spezielle Methoden 2.7 Voltammetrie Wortschöpfung aus Volt und Amperometrie, ♦ Voraussetzung für einen Stromfluß ist das Vorhandensein einer Spannung. ♦ Auswertung von Strom-Spannungs-Kurven. ♦ VM: eine analytische Methode, bei der die Beziehung zwischen U und I während einer elektrochemischen Reaktion (z.B. an Elektroden) beobachtet wird. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 17 2. Spezielle Methoden 2.8 Polarographie W ist ein elektrochemisches Verfahren zur qualitativen und quantitativen Analyse von Ionen in einer Lösung. W Sie beruht auf der Messung des Polarisationswiderstandes an einer HgTropfelektrode. M. Gey: Instrumentelle Analytik, Elektroanalytik-I 18 1. Elektroanalytik-I 3. Elektroden (spezielle) 1.1 Polarisierbare vs. unpolarisierbare Elektroden 1.2 Redoxelektroden 1.3 Ionenelektroden 1.4 Elektroden 1. Art 1.5 Elektroden 2. Art 1.6 Kalomel-Elektrode 1.7 Silber-Silberchlorid-Elektrode M. Gey: Instrumentelle Analytik, Elektroanalytik-I 19 3.1 Polarisierbare vs. unpolarisierbare Elektroden • Polarisation einer Elektrode: – Elektrode läßt trotz anliegender Spannung keinen Strom durch. • Polarisierbare Elektroden: – Alle Elektroden sind nur in einem bestimmten Bereich polarisierbar. – Festelektroden (Glas, Graphit, Pt, Au) von ca. -1V bis +1V polarisierbar. – Hg-Elektrode von ca. -2V bis +0,2V polarisierbar. • Unpolarisierbare Elektroden: – Trotz Stromfluß Gleichgewicht der Elektrode unverändert. – Kalomelelektrode (E = const. = 0,24 V) – Ag/AgCl-Elektrode (E = const. = 197 V) 20 3.2 Red-Ox-Elektroden ⇒ Elektroden, bei denen als Ladungsträger Elektronen durch die Phasengrenzfläche hindurchtreten. eten. einem korrespondierenden Red-Ox-Paar verwendet. ndet. ösung ösung ösung 21 3.3 Ionnenelektroden ⇒ Elektroden, bei denen als Ladungsträger Ionen durch die Phasengrenzfläche hindurchtreten. ⇒ Durchtrittsreaktion: Ag+Metall ⇔ Ag+Lösung 22 3.4 Elektroden 1. Art Elektroden, die aus der Kombination Metallion/Metall bestehen. z.B.: Zn/Zn2+ - Ionenelektrode 1. Art. 23 3.5 Elektroden 2. Art Messung der Aktivität eines Anions, d. mit d. Metallion ein schwer lösliches Salz oder einen stabilen Komplex bildet. z.B.: Kalomelelektrode (Hg, das mit Hg2Cl2 (Kalomel) überzogen ist und in eine gesättigte KCl-Lösung eintaucht. Silber/Silberchlorid-Elektrode 24 3.6 Kalomel-Elektrode • Besteht aus Hg, das 1. mit Kalomel (Hg2Cl2) überzogen ist und 2. in eine gesättigte KCl-Lösung eintaucht. • Potentialbestimmende Elektrodenreaktion: Hg2Cl2 + 2e- ↔ 2 Hg + 2Cl- • Ermitteltes Potential über – Löslichkeitsgleichgewicht, – Löslichkeitsprodukt, – NERNST´sche Gleichung beträgt : E = 0,2412 V. 25 3.6 Gesättigte Kalomel-Elektrode 26 3.7 Silber/Silberchlorid-Elektrode • Besteht aus metallischen Silber (Draht oder Stab), das 1. mit mit einer Schicht aus AgCl bedeckt ist und 2. in eine Chloridlösung bekannter Konzentration eintaucht, die wiederum mit AgCl gesättigt ist. • Potentialbestimmende Elektrodenreaktion: AgCl + e- ↔ Ag + Cl- • Ermitteltes Potential beträgt : E = 0,197 V. 27 3.7 Silber/Silberchlorid-Elektrode 28 Elektroanalytik- Ende der Vorlesung 29