Deutsches Ärzteblatt 1985: A-3601
Werbung
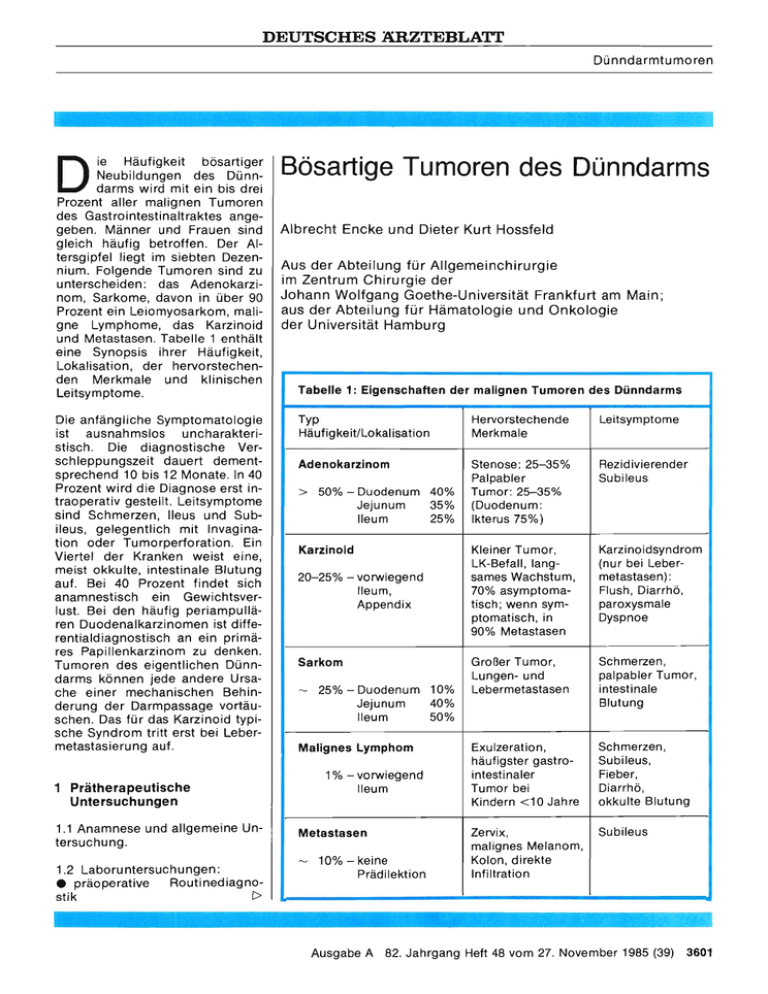
DEUTSCHES ÄRZTEBLATT Dünndarmtumoren 1111111111111MINIMMIMAIMMeedäMäaiiiit:, D ie Häufigkeit bösartiger Neubildungen des Dünndarms wird mit ein bis drei Prozent aller malignen Tumoren des Gastrointestinaltraktes angegeben. Männer und Frauen sind gleich häufig betroffen. Der Altersgipfel liegt im siebten Dezennium. Folgende Tumoren sind zu unterscheiden: das Adenokarzinom, Sarkome, davon in über 90 Prozent ein Leiomyosarkom, maligne Lymphome, das Karzinoid und Metastasen. Tabelle 1 enthält eine Synopsis ihrer Häufigkeit, Lokalisation, der hervorstechenden Merkmale und klinischen Leitsymptome. Die anfängliche Symptomatologie ist ausnahmslos uncharakteristisch. Die diagnostische Verschleppungszeit dauert dementsprechend 10 bis 12 Monate. In 40 Prozent wird die Diagnose erst intraoperativ gestellt. Leitsymptome sind Schmerzen, Ileus und Subileus, gelegentlich mit Invagination oder Tumorperforation. Ein Viertel der Kranken weist eine, meist okkulte, intestinale Blutung auf. Bei 40 Prozent findet sich anamnestisch ein Gewichtsverlust. Bei den häufig periampullären Duodenalkarzinomen ist differentialdiagnostisch an ein primäres Papillenkarzinom zu denken. Tumoren des eigentlichen Dünndarms können jede andere Ursache einer mechanischen Behinderung der Darmpassage vortäuschen. Das für das Karzinoid typische Syndrom tritt erst bei Lebermetastasierung auf. Bösartige Tumoren des Dünndarms Albrecht Encke und Dieter Kurt Hossfeld Aus der Abteilung für Allgemeinchirurgie im Zentrum Chirurgie der Johann Wolfgang Goethe-Universität Frankfurt am Main; aus der Abteilung für Hämatologie und Onkologie der Universität Hamburg Tabelle 1: Eigenschaften der malignen Tumoren des Dünndarms Typ Häufigkeit/Lokalisation Hervorstechende Merkmale Leitsymptome Adenokarzinom Stenose: 25-35% Palpabler Rezidivierender Subileus > 50% — Duodenum 40% Jejunum 35% Ileum 25% Tumor: 25-35% (Duodenum: Ikterus 75%) Karzinoid Kleiner Tumor, LK-Befall, langsames Wachstum, 70% asymptomatisch; wenn symptomatisch, in 90% Metastasen Karzinoidsyndrom (nur bei Lebermetastasen): Flush, Diarrhö, paroxysmale Dyspnoe Großer Tumor, Lungen- und Lebermetastasen Schmerzen, palpabler Tumor, intestinale Blutung Exulzeration, häufigster gastrointestinaler Tumor bei Kindern <10 Jahre Schmerzen, Subileus, Fieber, Diarrhö, okkulte Blutung Zervix, malignes Melanom, Kolon, direkte Infiltration Subileus 20-25% — vorwiegend Ileum, Appendix Sarkom — 25% — Duodenum 10% 40% Jejunum Ileum 50% Malignes Lymphom 1% — vorwiegend 1 Prätherapeutische Untersuchungen 1.1 Anamnese und allgemeine Untersuchung. 1.2 Laboruntersuchungen: Routinediagno• präoperative stik Ileum Metastasen 10% — keine Prädilektion Ausgabe A 82. Jahrgang Heft 48 vom 27. November 1985 (39) 3601 DEUTSCHES ÄRZTEBLATT Dünndarmtumoren • Serotonin- oder 5-Hydroxyindolessigsäure im 24-Stunden-Urin (bei Karzinoidverdacht). 1.3 Röntgenuntersuchungen: • Doppelkontrastdarstellung mittels Enteroklysma nach Sellink • Lunge in zwei Ebenen • bei stärkeren Blutungen abdominelle Angiographie. 1.4 Endoskopische Untersuchungen: • bei Verdacht auf Duodenaltumor Duodenoskopie. 1.5 Sonographie zum intraabdominellen Tumornachweis und Ausschluß von Lebermetastasen. Gegebenenfalls zur weiteren Abklärung Computertomographie. 2 Pathologisch-anatomische Diagnostik 2.1 Prätherapeutisch: Sicherung der Malignitätsdiagnose und histologischen Artdiagnose allenfalls bei Duodenaltumoren möglich. In der Regel Abklärung erst durch intraoperative Schnellschnittuntersuchung. 2.2 Postoperativ: Erfassung der makroskopischen und mikroskopischen Tumorausdehnung (pT, pN, ggf. M Leber)• 2.3 Das histologische Grading ist bisher ohne therapeutische Konsequenz. 3 Therapeutische Empfehlungen 3.1 Chirurgische Therapie 3.1.1 Potentiell kurativ operable Tumoren (mit und ohne Befall der regionalen Lymphknoten) a) Ausgedehnte Darmresektion unter keilförmiger Mitnahme des Mesenteriums bis an den Haupt- 3602 stamm der Mesenterialgefäße. Isolierte Entfernung der Lymphknoten im Bereich des Hauptstammes der A. mesenterica superior. Keine paraaortale Lymphadenektomie. b) Bei Duodenaltumoren Duodenopankreatektomie (Whipple). Bei hohem Operationsrisiko und keinem, papillennahem Tumor gegebenenfalls lokale Tumorexzision und Papillenplastik. 3.1.2 Nur palliativ operable Tumoren: Wenn immer möglich, Resektion des Primärtumors (Heusprophylaxe). Dies gilt auch für Patienten mit Peritonealkarzinose, wenn die Anastomose in einem tumorfreien Darmabschnitt hergestellt werden kann. 3.1.3 Lokal inoperable Tumoren: Prinzip: Umgehungsanastomose Duodenum: Gastroenterostomie Jejunum-Ileum: Entero-Enterostomie distales Ileum: Ileotransversostomie Verschlußikterus: Biliodigestive Anastomose (Cholezysto-/Choledocho-Jejunostomie). 3.1.4 Lokal regionales Rezidiv: Behandlung entsprechend 3.1.1 bis 3.1.3. Wenn möglich erneute Darmresektion, andernfalls Wiederherstellung der Darmpassage durch Umgehungsoperation. Eine Ileostomie sollte stets vermieden werden. 3.1.5 Synchrone und metachrone Leber- oder Lungenmetastasierung: Es liegen bisher keine Befunde vor, die eine chirurgische Entfernung von Leber- oder Lungenmetastasen bei Adenokarzinomen des Dünndarms rechtfertigen. Bei isolierten Sarkommetastasen in Lunge und Leber mag eine Resektion indiziert sein. Bei in die Leber metastasierten, dann in der Regel mit systemischen Symptomen (40) Heft 48 vom 27. November 1985 82. Jahrgang Ausgabe A (Flush, Durchfälle) einhergehenden Karzinoiden zunächst Erwägung operativer Verfahren: Partielle Hepatektomie bei auf einen Leberlappen beschränkter Metastasierung, Enukleation bei bilateraler Metastasierung. Durch Reduktion von serotoninproduzierendem Gewebe wird damit in Einzelfällen eine beträchtliche Minderung der Symptome erreicht. Bei Inoperabilität systemische oder besser intraarterielle Chemotherapie, gegebenenfalls mit temporärer Okklusion oder Embolisierung der Arteria hepatica (Bengmark). — Bei malignen Lymphomen ist die Chemotherapie die Methode der Wahl. 3.2 Strahlentherapie Die Ergebnisse der additiven und palliativen Strahlentherapie beim Adenokarzinom des Dünndarms sind bisher enttäuschend. Die Strahlentherapie befindet sich hier allenfalls im klinisch experimentellen Stadium. Bei Sarkomen erreicht man gelegentlich eine gute Rückbildung, weshalb sie von einzelnen Autoren als additive und palliative Maßnahme empfohlen wird. Beim malignen Lymphom ist die Strahlentherapie bei ausgedehntem, inoperablem Primärtumor als palliative Lokalbehandlung indiziert. Karzinoide sprechen auf die alleinige Radiotherapie nicht an. Durch die Kombination mit „radiosensibilisierenden" Zytostatika können die Resultate möglicherweise verbessert werden. 3.3 Chemotherapie Eine etablierte, effektive Chemotherapie als palliative Maßnahme bei inoperablem Adenokarzinom gibt es nicht. Daher ist eine adjuvante Chemotherapie bei in kurativer Absicht operierten Pa- DEUTSCHES ÄRZTEBLATT Dünndarmtumoren tienten nicht indiziert. Beim metastasierten Karzinoid ist eine Chemotherapie gerechtfertigt, wenn es sich um einen erwiesenermaßen schnell wachsenden, inoperablen und erheblich symptomatischen Prozeß handelt. Vorübergehende partielle Tumorrückbildung mit teils beträchtlicher Milderung der Symptomatik bei 20 bis 50 Prozent der Patienten. Zur Chemotherapie des inoperablen Leiomyosarkoms existieren keine größeren Erfahrungen. Die unvollständig resezierbaren Hodgkinoder Non-Hodgkin-Lymphom-Patienten werden auf der Grundlage der histopathologischen Klassifikation und der Ausdehnung der Erkrankung entsprechend den Richtlinien der primär nodalen Lymphome behandelt. Der Wert einer adjuvanten Chemotherapie bei malignen Lymphomen des Dünndarms ist derzeit nicht abzuschätzen. 5 Prognose, Risikofaktoren Angesichts der späten klinischen Symptomatik und Diagnosestellung ist die Prognose eingeschränkt. Beim Adenokarzinom von Duodenum, Jejunum und Ileum werden durchschnittliche Resektionsraten von 72 Prozent, 76 Prozent und 82 Prozent und Fünfjahresüberlebensraten bei Radikaloperation von ca. 20 Prozent für alle drei Darmabschnitte angegeben. Bei palliativen Eingriffen und Umgehungsanastomosen liegt die durchschnittliche Überlebenszeit unter sechs Monaten. Karzinoide treten in 30 Prozent multipel auf und sind bei Auftreten der klinischen Symptomatik schon bis zu 90 Prozent metastasiert. Dennoch liegt die Fünfjahresüberlebenszeit aller Erkrankten bei 20 Prozent. Prozent) ein relativ langsames Wachstum. Nach Diagnosestellung beträgt die Fünfjahresüberlebensrate dementsprechend etwa 50 Prozent. Das maligne Lymphom tritt in 20 Prozent als multiple Darmläsion auf. Beim histologisch nodulären Typ beträgt die Fünfjahresüberlebensrate aller Patienten etwa 50 Prozent, beim diffusen Typ ca. 25 Prozent. Bei chirurgischer oder radiologischer Behandlung des lokalisierten Non-Hodgkin-Lymphoms (Stadium I) werden Heilungsraten von 70 bis 80 Prozent erreicht. Als allerdings sehr seltene Risikoerkrankungen für einen malignen Dünndarmtumor gelten die Zöliakie, der Morbus Crohn, das PeutzJeghers-Syndrom. Literatur Unter den Sarkomen zeigt das häufigste Leiomyosarkom (ca. 90 4 Nachuntersuchungen I Untersuchungstermine nach Radikaloperation (Monate) Intervallanamnese Klinische Untersuchung Labor: BSG, Hb, Leukozyten, Gesamteiweiß, alkalische Phosphatase, CEA, GPT, GammaGT, Haemoccu lt. 1. Jahr 2. Jahr 3 6 9 12 15 18 21 24 X X X X 4. Jahr 5. Jahr 36 48 60 x x x x x x X X X X X X X 3. Jahr X x x Bei Karzinoid 5-Hydroxyindolessigsäure im Urin (Malignes Lymphom siehe speziellen Beitrag) Lebersonogramm Abdominelle CT x x x x x x x x x x x x x x x x «NJ 3604 (42) Heft 48 vom 27. November 1985 82. Jahrgang Ausgabe A x x (1) Barclay, T. H. C.: Shapira, D. V.: Malignant Tumors of the small intestine, Cancer 51 (1983) 878-881 — (2) Bengmark, S.; Ericsson, M.; Lunderquist, A.; Martensson, H.; Nobin, A.; Sako, M.: Temporary liver dearterialisation in patients with metastatic carcinoid disease. World J. Surg. 6 (1982) 46-53 — (3) Hollender, L. F.; Meyer, Ch.: Tumoren des Dünndarms in: Chirurgische Gastroenterologie, Band 2, Springer Berlin/Heidelberg/New York (1981) 640-643 — (4) Sindeler, W. F.: Cancer of the small intestine. In: V. de Vita, S. Hellmann, S. Rosenberg: Cancer, Principles and Practice of Oncology. — Lippincott — Philadelphia (1982) 629-642 — (5) Wilson, J. M.; Melvin, D. B.; Gray, C. F.; Thorbjarnarson, B.: Primary malignancies of the small bowel. Ann. Surg. 180 (1974) 175-179 — (6) Winawer, S. J.; Sherlock, P.: Malignant Neoplasms of small and large intestine in: Gastrointestinal Disease (Hrsg. M. H. Slesinger, J. S. Fordtran) Saunders Philadelphia (1983) 1235-1247 — (7) Winkler, R.: Die malignen Tumoren des Dünndarms. (Empfehlungen der Dt. Ges. f. Chirurgie) — Beilage zu Mitteilungen d. Dt. Ges. f. Chir. Heft 5 (1980) Anschrift für die Verfasser: Professor Dr. med. Albrecht Encke Abteilung für Allgemeinchirurgie der Universität Frankfurt Theodor-Stern-Kai 7 6000 Frankfurt am Main











