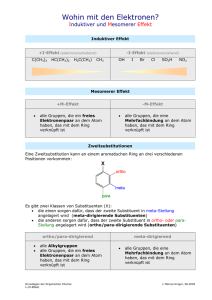
Sonstige β
Werbung

Sonstige β-Lactame Struktur der A-Kette der Metallo-Beta-Lactamase mit Inhibitor (blau) und Zn2+ im aktiven Zentrum 1-Oxacephalosporine I O HO MeO H CH C NH COOH O N N N S O COOH N N Me Struktur und Eigenschaften: Oxazin Ring, die Konfiguration ist ähnlich. Die Austausch O- S bedeutet eine grössere Spannung, die Lactam Gruppe ist reaktiver und hat grössere Hydrophilizität. Kinetik: Plasmabindung: ist niedrig, 40 %, es geht besser durch die grampositive Membrane. Die OH Gruppe erhöht die Halbwertzeit 1-Oxacephalosporine II β-Lactamase Stabilität: hoch wegen der 7-α-Metoxy Gruppe und der 7-β-Seitenkette (Carboxyl-Gruppe). Antibakterielles Spektrum Latamoxef* ist ähnlich wie Cefotaxim. Es ist besser gegen einige gramnegativen Keime (Bacteriodes fragilis, Enterobacter cloacae, Citrobacter freundi, usw.) Anderseits ist es weniger wirksam gegen die grampositiven Keime (Staphylococcus aureus, Streptococcus viridans). *in Deutschland nicht im Handel 1-Oxacephalosporine III Indikation: gynäkologische Infektionen, abdominale Infektionen. Carbapeneme I HO H H H3C 6 7 O R H H-C=NH 5 12 4 N 3 S NHR C OH O INN Thienamycin Imipenem Thienamycin (Kahan, 1979) aus Streptomyces cattleya. Struktur: Konfiguration H-5 und H-6 in trans Konfiguration. (keine Acylamino-Gruppe) Wegen der hohen Ringspannung geringe chemische Stabilität (Deaktivierung in einer Ringspaltung bei pH=6-7) Carbapeneme II Antibakterielles Spektrum: (R=H) hat ein breites Spektrum (grampositive, gramnegative, aerob- und anaerobe Keime) wirksam gegen die Serratia und Pseudomonas Keime. β-Lactamase Stabilität: es ist lactamasestabil (wegen der α-OH-Ethyl Gruppe). N-Acetyl-thienamicin, R=Acetyl ist wirksam noch gegen die P. aeruginosa Keime. Thienamycin hat einen grossen Nachteil, es wird rasch im menschlichen Organismus durch Dehydropeptidase (DHP-I) Enzyme abgebaut. Carbapeneme III Imipenem (Iminomethyl-derivate von Thienamycin, R = H-C=NH, chemische Stabilität. Antibakterielles Spektrum: es besitzt ein sehr breites Spektrum, aktiv sowohl gegen die grampositive, als auch die gramnegative Keime. Es ist wirksamer gegen die P. aeruginosa Keime als die Aminoglycoside. Es hat höhere Aktivität gegen die anaeroben Keime als Clindamycin und Metronidazol. Carbapeneme IV Kinetik: Plasmabindung: ist niedrig, 25 %. Halbwertzeit 60 min. Metabolismus: in der Nieren. (nur 5-30 % unverändert), nephrotoxische Wirkung. Darum ist es in einer Kombination mit einem kompetitiven Inhibitor Cilastatin- als Zienam im Handel. Cilastatin hemmt die Dihydropepetidase im Bürstensaum der Nierentubuli, die für die Abbau von Imipenem verantwortlich ist. Nebenwirkungen: gastrointestinale Probleme and allergische Reaktionen. Carbapeneme V OH H H H3C N O CH3 CON S H COOH CH3 CH3 x 3H2O H NH Meropenem -synthetische Verbindung- (Meronem) Struktur: ist unterschiedlich bei C-1-Methyl Gruppe und bei C-2-Substituent. Es ist stabil gegen Dehydropeptidase-I. Es wirkt auch gegen die Cephalosporin resistente Pneumokokken und Enterobakterien. Monocyclische β−Lactame O HO C C NH H OH 3 N OH N O H C OH O Nokardicin-A Nokardicine waren die ersten bekannten Vertreter der monocyclischen β-Lactamen (1976). Nokardicin-A besitzte niedrigere Aktivität (nur gegen gramnegative Keime.) Struktur: β-Lactam Ring mit Acylamino Seitenkette und einer Oxim Funktion. Monobactame I Monobactame: produziert durch Bacterien. Natürliche Monbactam: Sulfazecin (aus Agrobacterium raciobacter, Chromobacterium violaceum) Struktur: eine Sulpho- Gruppe ist mit dem lactam Ring verknüpft. Diese Gruppe ist verantwortlich für die erhöhte Stabilität des Ringes. Monobactame II N + H3N S N O Me COOH H Me Me C NH N O O SO3- Synthetisches Monobactam: Aztreonam -aus dem billigen L-Threonin- (Azactam) Struktur: eine Sulpho- Gruppe (erhöhte Stabilität des Ringes). Antibakterielles Spektrum: es ist sehr aktiv gegen gramnegative Keime, aber es ist nicht wirksam gegen grampositive Bakterien. Monobactame III β-Lactamase Stabilität: es ist lactamasestabil (höhere Dosen, 0.25-1 g). Klinische Anwendung: in Kombination mit Gentamicin, so ist es wirksam gegen die Aztreonam resistenten Bakterien. Kinetik: Plasmabindung: ist niedrig, 56%. Halbwertzeit 1,7 h. Nebenwirkungen: Nierentoxicität, gastrointestinale Probleme, allergische Reaktionen. β-Lactamase-Inhibitoren I Das Ziel der Verwendung von Beta-LactamaseInhibitoren ist es, das Bakterium funktionell „BetaLactamase-negativ“ zu machen und es im Wachstum zu hemmen bzw. abzutöten. Sie reagieren mit den Enzymen ähnlicherweise wie das Substrat. β-Lactamase-Inhibitoren II H 6 7 5 4 N O OH 9 O 1 8 2 3 H 10 C OH O Clavulansäure: aus Streptomyces clavurigeus ATCC 27064. Struktur: Oxapenamgerüst ohne Aminoacyl Seitenkette. β-Lactamase-Inhibitoren III Clavulansäure II Antibakterielles Spektrum: es hat sehr niedrige antibakterielle Aktivität, aber es hemmt die β-Lactamase Enzyme (Typ II-V) von grampositiven und gramnegativen Mikroben (S. aureus und E. coli, SuizidInhibitoren). Sie werden in Kombination benutzt. Bei der Kombination (zum Beispiel Augmentin) erfahren wir Synergismus (MHK ist 500 mal niedriger). Kombination: Amoxicillin + Kaliumclavulanat = Augmentan, Amoclav, Amoxidura β-Lactamase-Inhibitoren IV O CH CH2OH N O COOH Clavulansäure OH CH2 O O N O H CH2 CH2 COOH NH CH CO NH CH CO β-Lactamase Die Wirkung: Acylierung des Enzyms. (Die Esterverbindung wird nur langsam hydrolysiert.) CH2 OH β-Lactamase-Inhibitoren V Antibakterielles Spektrum: diese Kombination ist ist wirksam gegen die Amoxicillin resistent Keime (Staphylococcus aureus, Haemophilus influenzae, E. coli, Proteus mirabilis, Bacteroides fragilis), die β-Lactamase produzieren. Aber diese Kombination bewahrt nicht das Amoxicillin vor den β-Lactamasen von Pseudomonas aeruginosa, Serratia marcescens. Indikationen: Infektionen des Atemwegs. β-Lactamase-Inhibitoren VI Andere Kombination: Kaliumclavulanat+ Ticarcillin= Betabactyl Diese Kombination wird in der Therapie der Harnweginfektionen, der unteren Atemweginfektionen, der Septicämie verwendet als Injektion. (die Infektionen der Verbindungen und Knochen.) Antibakterielles Spektrum: E. coli, Pseudomonas spp., Citrobacter, Enterobacter spp., S. aureus, usw. Kinetik: Halbwerzeit: 1 h, Plasmabindung: 22-30%. β-Lactamase-Inhibitoren VII H SO2 N O CH3 CH3 H COOH Sulbactam Struktur: Sulphonpenicillin (SO2 Gruppe), oder 1,1Dioxopenicillansäure (synthetisch). Antibakterielles Spektrum: es hat sehr niedrige Aktivität aber bewirkt als ein gutes Inhibitor des βLactamase Enzyms. β-Lactamase-Inhibitoren VIII Kombination: Sulbactam-Natrium + Ampicillin (Natrium Salz) = Unacyd. Breites antibakterielles Spektrum: wirksam gegen die S. aureus, E. coli, Klebsiella pneumoniae Keime, die gegen Ampicillin resistent sind. Kinetik Sulbactam-Natrium wird im Gastrointestinaltrakt kaum resorbiert und wird im allgemeinen parenteral gegeben. Halbwerzeit: 1 h, Plasmabindung: 38%. β-Lactamase-Inhibitoren IX HO O S N O N N N CH3 COOH Tazobactam Struktur: Penicillinsäuresulphon wie Sulbactam mit einer heterocyclischen Seitenkette (synthetische Verbindung) Antibakterielles Spektrum: es hat sehr niedrige Aktivität aber bewirkt als ein gutes Inhibitor des β-Lactamase. β-Lactamase-Inhibitoren X Kombination: wirkt Tazobactam mit bestimmten Penicillinen synergetisch, das Wirkungsspektrum von βLactamen wird erweitert. Tazobactam-Natrium + Piperacillin-Natrium (8/1)= Tazobac Die Kombination ist wirksam gegen die Piperacillin resistent S. aureus, E. coli, Serratia, Klebsiella pneumoniae, Pseudomonas aeruginosa, usw. Keime. Kinetik: Halbwertzeit: 0,35-0,63 h, Plasmabindung: 20 %. Sultamicillin (Unacid PD oral) O CH C NH NH2 S O O S CH3 H3C CH3 H3C N O N C O O C O CH2 O O O CH C NH NH2 S N O Ampicillin CH3 H3C CH3 H3C COOH O O S HOOC N O Sulbactam Nachweis von β-Lactamase Produktion (Nitrocefin) S CH2 S CO NH N CH O CH NO2 COONO2 gelb β-Lactamase S CH2CONH H H 1' 2 S 1 HOO C N 3 4 H HOO C H 6 5 rot H NO2 NO2
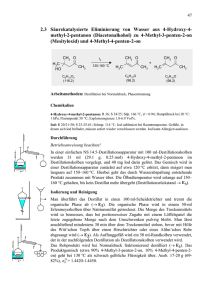
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)