Atome mit mehreren Elektronen
Werbung

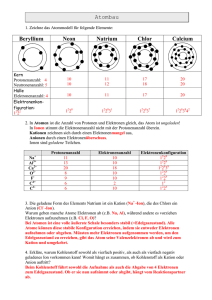
Atome mit mehreren Elektronen In diesem Kapitel wollen wir uns in die “reale” Welt stürzen und Atome mit mehr als einem Elektron untersuchen. Schließlich besteht sie Welt nicht nur aus Wasserstoff. Die wesentlichen Bauteile haben wir bereits kennengelernt: • Die Schrödingergleichung • Den Elektronenspin • Das Pauliprinzip Im Prinzip müsste es also nun möglich sein, jedes Atom zu beschreiben. Leider wird dies aber mathematisch sehr anspruchsvoll, ja es kann gar nicht geschlossen durchgeführt werden. Es existiert keine geschlossene Lösung der Schrödungergleichung für ein so komplexes Gebilde, wie einen Kern und zwei Elektronen! Eigentlich ist es zwar nicht erstaunlich - wir hatten in der Mechanik ja auch gesehen, dass das Dreikörperproblem nicht geschlossen gelöst werden kann. Das Pauliprinzip in seiner striktern Form sagt uns, dass die Situation nur durch eine Wellenfunktion beschrieben werden kann, die insgesamt antisymmetrisch ist, 1 ψA = √ [ψα(1)ψβ (2) − ψβ (1)ψα(2)] , 2 wo α und β die Raum- und Spinkomponenten indizieren. Dies ist auf zwei Arten möglich: ψA = ψRaum, antisymmetrisch ψSpin, symmetrisch , ψA = ψRaum, symmetrisch ψSpin, antisymmetrisch . oder Die räumlichen Wellenfunktionen sind ψS = ψA = 1 √ [ψa(1)ψb(2) + ψb(1)ψa(2)] , 2 1 √ [ψa(1)ψb(2) − ψb(1)ψa(2)] 2 wo a und b nur die Raumkoordinaten indizieren. Die Spin-Wellenfunktionen sind ψA ψS 1 = √ [(+1/2, −1/2) − (−1/2, +1/2)] , 2 (+1/2, +1/2), √1 [(+1/2, −1/2) + (−1/2, +1/2)] , = 2 (−1/2, −1/2). Austausch”kräfte” Was passiert nun, wenn wir zwei Elektronen in einem endlichen Volumen betrachten? Ist das Raum-Volumen klein genug, so gilt ψa(1) ≈ ψa(2) und ψb(1) ≈ ψb(2) und folglich ψa(1)ψb(2) ≈ ψb(1)ψa(2). Nehmen wir an, die Raumwellenfunktion sei antisymmetrisch, 1 1 ψA = √ [ψa(1)ψb(2) + ψb(1)ψa(2)] ≈ √ [ψb(1)ψa(2) + ψb(1)ψa(2)] ≈ 0. 2 2 die Wahrscheinlichkeitsamplitude, und damit die Wahrscheinlichkeit, die beiden Elektronen am selben Ort zu sehen, verschwindet, wie dies das Pauliprinzip verlangt. Elektronen mit parallelem Spin scheinen sich abzustoßen. Sind die Elektronenspins antiparallel, d. h. die Spin-Wellenfunktion antisymmetrisch, so muss die räumliche Wellenfunktion symmetrisch sein und dann gilt mit den vorigen Überlegungen √ 1 ψA = √ [ψa(1)ψb(2) + ψb(1)ψa(2)] ≈ 2ψa(1)ψb(2) 2 und die Wahrscheinlichkeit, die beiden Elektronen am selben Ort zu treffen, ist doppelt so groß, wie die über das gesamte Volumen gemittelte Wahrscheinlichkeit1. Elektronen mit antiparallelem Spin scheinen sich anzuziehen. Die so wirkende Scheinkraft wird of “Austauschkraft” genannt. Dies ist ein rein quantenmechanischer Effekt, es gibt keine klassische Analogie. 1 Dies kann man einfach sehen: Das Integral von ψa∗ (1)ψb∗ (2)ψa (1)ψb (2) über das gesamte Volumen muss eins sein, wie auch die symmetrische Wellenfunktion so normiert wird. Zwei Elektronen im Potentialkasten Als einfachstes Zweielektronensystem betrachten wir zwei Elektronen im Potentialkasten. Wir machen die veeinfachende Annahme, dass sie nicht miteinander wechselwirken aber dem Pauliprinzip gehorchen. Dann lauten die ? räumlichen Wellenfunktionen √ · ¸ πx1 2πx2 2πx1 πx2 2 cos sin + sin cos , x = −a/2 x = a/2 ψS = a a a a a √ · ¸ 2 πx1 2πx2 2πx1 πx2 ψA = cos sin − sin cos , a a a a a wo −a/2 ≤ x ≤ a/2. Zwei Elektronen im Potentialkasten II Die beiden ersten Terme in ψ+ sind links dargestellt. Um die beiden Elektronen darzustellen, brauchen wir also einen zweidimensionalen Raum, pro Teilchen eine Dimension. Die x1Koordinate läuft nach rechts hinten, die x2-Koordinate nach links hinten. Offensichtlich ist Teilchen 1 im Grundzustand (ein Wellenbauch), während Teilchen 2 im ersten angeregten Zustand ist. Zwei Elektronen im Potentialkasten III Hier sind die beiden Terme des zweiten Produktes in ψ+ zu sehen. Die beiden Teilchen sind gegenüber der vorherigen Darstellung vertauscht. Offensichtlich ist Teilchen 2 im Grundzustand (ein Wellenbauch), während Teilchen 1 im ersten angeregten Zustand ist. Zwei Elektronen im Potentialkasten IV Hier ist die antisymmetrische Wellenfunktion ψ− zu sehen. Sie besteht aus der Differenz der vorigen Darstellungen und wurde noch richtig normiert. Diese Wellenfunktion müsste also angewendet werden, wenn ich einen Tripplett-Zustand beschreiben will. Offensichtlich verschwindet die Wahrscheinlichkeitsamplitude entlang der Geraden x1 = x2 und die Wahrscheinlichkeit, dort beide Elektronen gleichzeitig zu treffen verschwindet. Zwei Elektronen im Potentialkasten V Hier ist die symmetrische Wellenfunktion ψ− zu sehen. Sie besteht aus der Summe der beiden ersten Darstellungen und wurde noch richtig normiert. Diese Wellenfunktion müsste also angewendet werden, wenn ich einen Singulett-Zustand beschreiben will. Offensichtlich wird die Wahrscheinlichkeitsamplitude entlang der Geraden x1 = x2 maximal und die Wahrscheinlichkeit, dort beide Elektronen gleichzeitig zu treffen ebenso. Das Heliumatom 0 -50 Singulett Triplett Singulett Triplett n = 1, l = 0; n = 2, l = 0 n = 1, n = 2 n = 1, l = 0; n = 2, l = 1 -60 -70 -80 -90 Singulett n = 1, l = 0; n = 1, l = 0 -100 -110 n = 1, n = 1 Im zwei-Elektronen Heliumatom wird die Austauschkraft eine Rolle spielen, wie auch die gegenseitige Wechselwirkung der Elektronen und die Anziehung durch den Kern. Die gegenseitige Abstoßung der Elektronen wird dazu führen, dass die Energieniveaux etwas erhöht werden. Die vorher (in V8) berechnete Energie von ca. -109 eV (Energieniveaux links) für den Grundzustand wird entsprechend erhöht auf knapp über -80 eV (Energieniveaux in der Mitte). Beim ersten angeregten Zustand tritt ein neuer Effekt auf, das Niveau wird aufgespalten - entartet. -50 Der Grund dafür liegt in den ran = 1, l = 0; n = 2, l = 1 Singulett Triplett dialen Aufenthaltswahrscheinlich-60 Singulett keiten der Elektronen. Für QuanTriplett n = 1, l = 0; n = 2, l = 0 -70 tenzahlen n = 1, l = 0 für das n = 1, n = 2 erste und n = 2, l = 0 für das -80 Singulett zweite Elektron sind die Elektronen n = 1, l = 0; n = 1, l = 0 -90 ein wenig weiter auseinander als für n = 1, l = 0 und n = 2, l = 1, wie -100 man in der Diskussion des Wasserstoffatoms sehen kann. Damit wird -110 sich also die gegenseitige Wechseln = 1, n = 1 wirkung der Elektronen je nach Quantenzahlen in einer leicht verschiedenen 0 Energiedifferenz äußern. 0 -50 Singulett Triplett Singulett Triplett n = 1, l = 0; n = 2, l = 0 n = 1, n = 2 n = 1, l = 0; n = 2, l = 1 -60 -70 -80 -90 Singulett n = 1, l = 0; n = 1, l = 0 -100 -110 n = 1, n = 1 Die Austauschkaft führt zu einem weiteren Aufspalten der Linien des ersten angeregten Zustandes (rechte Energieniveaux). Im TriplettZustand ist die Wahrscheinlichkeit dafür, dass die Elektronen sich nahe beieinander aufhalten größer, als im Singulett-Zustand. Dabei werden sie sich aufgrund der Coulombkraft stärker abstoßen, was zu einer Erhöhung der Energieniveaux im Triplett-Zustand führt. Das Heliumatom • Grundzustand: Zustand minimaler Energie, n1 = n2 = 1, l1 = l1 = 0, m1 = m2 = 0, also ms1 = +1/2 und ms2 = −1/2 oder vice-versa, denn weil die räumliche Wellenfunktion (n, l, m) symmetrisch ist, muss die Spinwellenfunktion antisymmetrisch sein. • Grundzustand ist 11S0 • Allgemein: n 2S+1 X J , wo X = s, p, d, f, g, h, . . . ist. • 2S + 1: Multiplizität. Bsp. S = 0: Singulett, S = 1: Triplett, etc. Energiezufuhr Bei Energiezufuhr kann eines der Elektronen in ein höheres Energieniveau gebracht werden, z. B. n = 2. Dann hat es schon eine andere Quantenzahl (n1 = 1, n2 = 2) und die anderen Quantenzahlen dürfen gleich sein. Für Elektron 2 sind also mit Elektron 1 im “Grundzustand” 11S0 (l1 = 0; ml1 = 0; ms1 = + 21 ; J = 0) die folgenden Zustände möglich: 21 S 0 21 P0 23 S 0 23 P0 23 P1 23 P2 (l2 (l2 (l2 (l2 (l2 (l2 = 0; = 1; = 0; = 1; = 1; = 1; ml 2 ml 2 ml 2 ml 2 ml 2 ml 2 = 0; ms2 = − 12 ; J = 0) = 0, ±1; ms2 = − 21 ; J = 1) = 0; ms2 = + 12 ; J = 1) = −1; ms2 = + 12 ; J = 0) = 0; ms2 = + 12 ; J = 1) = 1; ms2 = + 12 ; J = 2) Das Heliumspektrum • hνik = Ei − Ek =⇒ λik = h·c Ei −Ek • Übergänge nur möglich für ∆l = ±1 mit ∆j = 0, ±1 außer ∆s = 0. (Auswahlregeln) ∆ml = 0, ±1, Tausch von j = 0 mit j = 0, • Weil sich bei Anregung eines Elektrons die Quantenzahlen des anderen nicht ändern, gelten für den gesamten Bahndrehimpuls, Spin und Totaldrehimpuls ~ =L ~1 + L ~ 2, S ~=S ~1 + S ~2 und J~ = J~1 + J~2, dieselben Auswahlregeln L ∆L = ±1, ∆M = 0, ±1, ∆S = 0 wie für das Wasserstoffatom. • Komplizierte Übergänge möglich, Bsp. 3D −→ 3P. Elektronenhüllen Größerer Atome Zwei Prinzipien vermögen den Aufbau der Elektronenhüllen großer Atome zu erklären: 1: Das Pauliprinzip 2: Minimierung der Energie aller Elektronen im Grundzustand des Atoms Wegen 1 können in einem Atom mit drei Elektronen nicht alle im Zustand 11S0 sein. Ein Elektron muss n = 2 aufweisen. Es kommt zur Ausbildung von elektronenschalen, in denen genau 2n2 elektronen Platz haben. Begründung: Radiale Aufenthaltswahrscheinlichkeit gegeben durch r2|Rn,l(r)|2, was durch n und l bestimmt wird. Für jedes l gibt es 2l+1 Einstellungsmöglichkei- ten, ferner gilt l ≤ n − 1, bzw. zu jedem n gibt es l Möglichkeiten l = 0, . . . , n − 1. Damit gibt es für ein n n−1 X (2l + 1) = n2 l=0 verschiedene Zustände, die mit maximal 2n2 Elektronen aufgefüllt werden können. Der Faktor 2 kommt von den beiden Einstellungsmöglichkeiten des Spins. Die Kugelschalen für verschiedene n haben Maxima in verschiedenen Abständen vom Kern und auch wieder ihre eigenen Namen: n = 1: n = 2: n = 3: K-Schale L-Schale M-Schale n=4 n=5 N-Schale O-Schale Das Periodensystem der Elemente Wir können nun den Aufbau des Periodensystems der Elemente verstehen, welches in den Jahren 1868 - 1871 von Mendelejew und Meyer unabhängig und ohne Kenntnisse der Atomphysik entwickelt wurde. Sie ordneten alle bekannten chemischen Elemente nach steigenden Atomgewichten und teilten sie in Zeilen und Spaleten, so dass die chemisch ähnlichen Elemente untereinander in einer Spalte stehen. Die sieben Zeilen heissen Perioden. Der Aufbau ist aus heutiger Sicht einfach zu verstehen, wenn man die oben genannten Prinzipien für das Besetzen von Elektronenschalen beherzigt.Für H und He reicht die K-Schale aus. Für Li bis Ne wird sukzessive die L-Schale aufgefüllt (n = 2, 8 Elektronen), wobei zuerst die s-Unterschale vollständig gefüllt wird; für Na bis Ar wird die M-Schale angebraucht (n = 3, Platz für 18 Elektronen), auch hier wieder wird zuerst die s-Unterschale gefüllt. Wenn nicht Prinzip 2 wäre, würde sich das Muster des Schalenfüllens so fortsetzen. Es ist aber energetisch günstiger, vorerst ein paar Elektronen in der N-Schale unterzubringen (K und Ca (4s-Zustand)) und erst dann die M-Schale fertig aufzufüllen. Dies wiederholt sich mit der N-Schale, wo es nach Auffüllen der 4p-Unterschale energetisch günstiger ist, die 5s-Unterschale aufzufüllen, bevor die N-Schale fertiggefüllt wird. Ähnliches geschieht mit der O-Schale. Prinzip 2 sagt uns auch, dass beim Auffüllen die Energie minimiert werden soll. Dies bedeutet, dass die p-Unterschalen und höhere zuerst mit Elektronen mit parallelem Spin afgefüllt werden. Die Hundsche Regel sagt prägnant, dass im Grundzustand des Atoms der Gesamtspin den größtmöglichen mit dem Pauliprinzip verträglichen Wert haben muss. Erste Ionisationsenergie (FIP) 30 Erste Ionisierungsenergie [eV] 25 He Ne 20 Ar 15 Kr Xe (Hg) Ra 10 5 0 Li 0 Na K 20 Rb Cs 40 60 Kernladungszahl Z (Ti) 80 Ac 100 Chemische Eigenschaften Innere Schalen bleiben erhalten. Im neu entstandenen Molekül treten "gemeinsame" Elektronen auf. Molkeülphysik! Typische Bindungsenergien von 1 − 10 eV Elektronen in der äußersten Schale bestimmen die chemischen Eigenschaften eines Atoms. Alkaliatome φ(r ) ∝ 1/r φ(r ) φ(r ) ∝ Z/r φ(r ) ∝ Zeff (r )/r r Die einfachen Alkaliatome haben ein einzelnes Leuchtelektron in der äußersten Schale, welches ein effecktives Potential φ(r) spürt. Dieses Potential entsteht durch die Abschirmung des Kernpotentials durch die elektronen in den abgeschlossenen inneren Schalen. Das einzelne Elektron wird durch Absorption sichtbarer Strahlung in höhere Energiezustände angeregt. Beim Zurückfallen in den Grundzustand emittiert es Licht im sichtbaren Bereich und heisst deshalb Leuchtelektron. −e −Ze < φeff (r) < . 4π²0r 4π²0r Für große Hauptquantenzahlen n werden die Energieniveaux in Alkaliatomen formal immer ähnlicher, wie die des Wasserstoffatoms: Enl = Ry ∗ − n2 eff = Ry ∗ − (n−δ )2 , nl wo δnl der Quantendefekt ist und durch drei Effekte zustandekommt: • Abweichung des effektiven Potentials vom Coulombpotential. Dies führt zu verschiedenen Energien des Leuchtelektrons aufgrund der unterschiedlichen “Eintauchwahrscheinlichkeiten”. • Die Polarisation der Elektronenhülle durch das Leuchtelektron. Diese führt zu einer Abweichung von der Kugelsymmetrie, je nach Drehimpuls des l Leuchtelektrons. • Beim Eintauchen des Leutelektrons in die Elektronenhülle kann ein Austausach stattfinden. Dies führt zu einer Verringerung der Energie Alkali-, Halogen-, Edelgas- und seltene-Erden-Atome • Alkali-Atome haben alle ein s-Elektron in der äußersten Hülle: H, Li, Na, K, Rb, Cs. Große chemische Ähnlichkeit. • Edelgas-Atome haben eine vollbesetzte äußere Elektronenschale. Ihre Ionisation erfordert deshalb besonders viel Energie. • Halogen-Atome haben ein Elektronen-Loch in der äußersten Schale und verhalten sich chemisch ähnlich. Verbindungen mit Alkali-Atomen zu sehr stabilen Molekülen (Ionenbindung). • Seltene-Erden-Atome haben alle dieselbe Anzahl Elektronen in der äußeren P -Schale (und unterscheiden sich nur durch die anzahl Elektronen in den nicht aufgefüllten inneren Schalen). Notation für Mehrelektronenatome Die Notation s, p, d, etc. wird natürlich bei Atomen mit mehreren Elektronen auch angewendet. Oft wird aber dabei die innerste 1s-Schale nicht mehr genannt, weil sie in der Regel gefüllt ist. Die Elektronen werden durch ihre hauptquantenzahlen n und Drehimpulsquantenzahlen l charakterisiert. Einige Beispiele: Ein Atom habe vier Elektronen: 1s2 2s 2p, d. h. die innerste Schale (n = 1, l = 0) ist vollständig gefüllt (zwei Elektronen), die beiden anderen elektronen sind in den Zuständen 2s und 2p. Ein Atom sei durch 2s2 2p3 beschrieben: Die innerste Schale (1s2) ist nicht genannt, weil (fast) immer gefüllt. Das Atom hat also zwei Elektronen in der 1s-Schale, zwei in der 2s-Schale und drei in der 2p-Schale. Wie sich die Bahndrehimpulse und Spins der einzelnen Elektronen zum Gesamtdrehimpuls des Atoms addieren, wird durch die Kopplungsenergie bestimmt. Die Methode von Hartree Weil ein Mehrelektronenatom offensichtlich ein Mehrkörperproblem darstellt, ist es in der Regel nicht möglich, das Potential des Atoms geschlossen zu finden. Man verwendet daher zwei Lösungsmethoden: die numerisch sehr aufwändige Methode der Lösung der exakten Schrödingergleichung, oder eine wesentlich gröbere Vereinfachung, die sog. Hartree-Methode. Diese intuitive Methode zeigt klar den Lösungsweg: 1 Man greife ein einzelnes Elektron heraus, welches sich im kugelsymmetrischen (effektiven) Potential der restlichen Elektronen und des Kerns bewegt. Als erste Schätzung für das effektive Potential dient z. B. φ(r) = − e 4π²0 µ Z − a · e−b·r r ¶ 2 Vernachläßige Wechselwirkungen mit anderen Elektronen. 3 Löse die Schrödingergleichung für die Einteilchenlösungsfunktion ψi und seine Energie Ei. 4 Besetze die Zustände wachsender Energie unter Beachtung des Pauli-Prinzips mit allen zur Verfügung stehenden Elektronen. 5 Berechne das gemittelte (effektive) Potential für ein beliebiges Elektron i e Z φeff (ri) = − − 4π²0 ri XZ j6=i |ψj (~rj )|2 . dτj rij 6 Löse mit dem neuen effektiven Potential die Schrödingergleichung für die Einteilchenlösungsfunktion ψi und seine Energie Ei. 7 Vergleiche mit der vorherigen Lösung. 8 Stimmen die beiden nicht innerhalb einer vorgegebenen Grenze überein, so fahre mit Punkt 3 weiter. Stimmen sie überein, so ist das Ergebnis gefunden. Drehimpuls in Mehrelektronenatomen Neben den Wechselwirkungen zwischen Kern und Elektronen und unter den Elektronen, wirken auch die magnetischen Wechselwirkungen, welche zu weiteren Aufspaltungen der Energieniveaux führen können. Dabei treten zwei Grenzfälle auf: • Die Kopplungsenergien zwischen den magnetischen Bahnmomenten Wli,lj = aij~li ·~lj und zwischen den Spinmomenten Wsi,sj = bij~si ·~sj sind groß gegen die Kopplungenergie Wli,si = cii~li · ~si zwischen dem magnetischen Bahnmoment µli = µB~li und dem magnetischen Spinmoment µsi = gsµB~si. In diesem ~li bzw. ~si zu einem Gesamtdrehimpuls Falle koppeln die einzelnen Drehimpulse p P~ P ~ ~ ~ L = i li und Gesamtspin S = i ~si. Dabei gilt |L| = L(L + 1)h̄ und ~ = |S| p S(S + 1)h̄. Der Gesamtdrehimpuls der Elektronenhülle ist dann ~ +S ~ mit |J| ~ = J~ = L p J(J + 1)h̄. • Die Wechselwirkungsenergie Wli,si = cii~li · ~si zwischen dem magnetischen Bahnmoment µli = µB~li und dem magnetischen Spinmoment µsi = gsµB~si ist groß gegen die Kopplungsenergien zwischen den magnetischen Bahnmomenten Wli,lj = aij~li · ~lj und zwischen den Spinmomenten Wsi,sj = bij~si ·~sj . In diesem Fall koppeln Drehimpuls und Spin der einzelnen Elektronen aneinander zu einem Gesamtdrehimpuls eines einzelnen Elektrons, ~ji = ~li + ~si. Der Gesamtdrehipuls ist dann X ~ ~ji. J= i dieser Fall heisst j-j Kopplung.