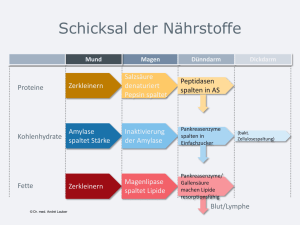
Die Resorption von oral eingenommenen - oparu
Werbung

Zentrum für Innere Medizin, Universitätsklinikum der Universität Ulm Klinik für Innere Medizin I Kommissarischer Ärztlicher Direktor: Prof. Dr. Götz von Wichert Die Resorption von oral eingenommenen Schilddrüsenhormonpräparaten in Abhängigkeit von einer Typ-A-Gastritis Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm Katja Hoss Göppingen 2011 Amtierender Dekan: Prof. Dr. Thomas Wirth 1. Berichterstatter: Prof. B. Böhm 2. Berichterstatter: Prof. C. Haug Tag der Promotion: 10.05.2012 Inhaltsverzeichnis Abkürzungsverzeichnis ...................................................................................... III 1. Einleitung............................................................................................................ 1 1.1 Die Bedeutung der Hypothyreose ................................................................. 1 1.2 Epidemiologische Bedeutung der Thyroxineinnahme ................................... 3 1.3 Hashimoto-Thyreoiditis ................................................................................. 4 1.4 Schilddrüsenhormone ................................................................................... 5 1.5 SD-Hormoneinnahme ................................................................................... 6 1.6 Hypothalamischer-Hypophysärer Regelkreis ................................................ 7 1.7 Einfluss der SD-Hormone auf den Körper ..................................................... 8 1.8 Typ-A-Gastritis .............................................................................................. 8 1.9 Die Resorption von SD-Hormonen .............................................................. 10 1.10 Fragestellung ............................................................................................ 10 2. Material und Methodik ...................................................................................... 13 2.1. Patientenauswahl ....................................................................................... 13 2.2 Erfasste Parameter ..................................................................................... 14 2.3 Statistische Methoden ................................................................................. 17 3. Ergebnisse ....................................................................................................... 19 3.1 Homogenität der Studiengruppen ............................................................... 19 3.2 Altersverteilung der Probanden ................................................................... 19 3.3 Verteilung des Gewichts in beiden Gruppen ............................................... 22 3.4 Verteilung des TSH in beiden Gruppen ....................................................... 24 3.5 Verteilung der Tagesdosis in beiden Gruppen ............................................ 26 3.6 Tagesdosis in Abhängigkeit vom Gewicht ................................................... 27 3.7 Tagesdosis bezogen auf die Körperoberfläche beider Gruppen ................. 29 I 4. Diskussion ........................................................................................................ 32 4.1 Auswertung der vorliegenden Ergebnisse ................................................... 32 4.2 Intestinale Erkrankungen und die Resorption von LT4 ................................ 34 4.3 Einfluss verschiedener Medikamente auf die Resorption von Levothyroxin 36 4.4 der pH-Wert................................................................................................. 38 4.5 Einfluss der Magensäure auf die Resorption von Levothyroxin ................... 40 5. Zusammenfassung ........................................................................................... 42 6. Literaturverzeichnis .......................................................................................... 43 7. Anhang ............................................................................................................. 50 Tabellenverzeichnis .......................................................................................... 50 Abbildungsverzeichnis ...................................................................................... 50 8. Danksagung ..................................................................................................... 52 9. Curriculum vitae ............................................................................................... 53 II Abkürzungsverzeichnis AK Antikörper ATP Adenosintriphosphat BMI Body-mass-Index ECL Enterochromaffin-like-Cells fT3 freies Trijodthyronin fT3E freies Trijodthyronin Äquivalent fT4 freies Thyroxin H+ Proton HP Helicobakter pylori HWZ Halbwertszeit K+ Kalium KG Körpergewicht KOF Körperoberfläche LT4 Levothyroxin mIU milli International Unit Na+ Natrium PCA Parietalzellantikörper PPI Protonenpumpeninhibitor SD Schilddrüse T3 L-3,5,3´- Trijodthyronin T4 Thyroxin TBG thyroxinbindendes Globulin Tg-AK Antikörper gegen Thyreoglobulin TPO Thyreoidperoxidase-Antikörper TPO-AK Antikörper gegen thyreoidale Peroxidase TRH Thyreotropin Releasing Hormon TRAK TSH-Rezeptor-Antikörper TSH Thyreotropin/ Thyroidea stimulierendes Hormon µg Mikrogramm III 1. Einleitung 1.1 Die Bedeutung der Hypothyreose Hypothyreosen entstehen durch einen Mangel an Schilddrüsenhormonen an den Körperzellen durch eine nicht ausreichende Synthese von SD-Hormonen durch die Schilddrüse. SD-Hormone sind für die Körperfunktionen essentiell, so dass eine ausreichende Versorgung mit SD-Hormonen lebensnotwendig ist. Die primäre Hypothyreose ist die häufigste Form der Hypothyreose. Bei Erwachsenen ist die chronisch-autoimmune Thyreoiditis die häufigste Ursache, vor allem die atrophische Hashimoto-Thyreoiditis. Aber auch die totale oder subtotale Thyreoidektomie, Jodmangel, Schilddrüsenmalignome, Radiojodtherapien und Radiatio am Hals von anderen Malignomen können zu einer Hypothyreose führen. Ebenso kann es postpartal oder nach Absetzen einer SD-Hormonsubstitution zu einer vorübergehenden Hypothyreose kommen. Medikamente wie Lithium oder Amiodaron können eine Hypothyreose bedingen. Die erworbene Hypothyreose kommt bei 0,2– 1% der Gesamtbevölkerung vor und wird oft nicht erkannt. Klinik: Die Übergänge zwischen einer normalen SD-Funktion und einer Hypothyreose sind fließend. Durch die langsame Entwicklung der Symptome wird eine Hypothyreose oft nicht rechtzeitig erkannt. Vor allem bei älteren Patienten verläuft sie oligosymptomatisch. Im schlimmsten Fall kann es zum hypothyreoten Koma kommen. Erste Anzeichen sind unspezifisch und äußern sich durch Müdigkeit, Abgeschlagenheit, Denkstörungen und depressive Verstimmung bis zur manifesten Depression. Die Haut ist trocken, die Haare brüchig, die Schweißsekretion vermindert, das Kälteempfinden erhöht. Gewichtszunahme trotz vermindertem Appetit, Obstipation, Bradykardie, Myxödeme, Myopathien und Hyporeflexie sind weitere Symptome. Bei Frauen kann es zu Zyklusstörungen kommen. 1 Diagnose: Die Diagnose erfolgt über die Bestimmung von TSH und den freien T3- und T4Anteilen im Serum. Man findet bei einer Hypothyreose eine TSH-Erhöhung und verminderte T3- und T4-Spiegel. Die Bestimmung von T4 ist sinnvoll, da sich der T3Spiegel durch eine erhöhte Konversion von T4 zu T3 lange im unteren Normbereich halten kann. Zur weiteren Differenzierung Schilddrüsensonografie. Bei der verschiedenen Verdacht einer Ursachen Autoimmungenese erfolgt erfolgt eine die Bestimmung der Schilddrüsenantikörper TRAK und TPO im Serum. Therapie: Die Therapie erfolgt durch eine Substitution von SD-Hormonen. Ziel ist es, wieder eine euthyreote Stoffwechsellage herzustellen, durch Normalisierung der SDHormonwerte und des TSH-Spiegels. Je höher der anfängliche TSH-Spiegel, desto höher die täglich benötigte LT4-Dosis. (Udaya, 1989) Die Therapiedosis liegt beim Erwachsenen durchschnittlich bei 1-2 µg/kg KG pro Tag. (Hennessey, 1986) Sie wird allerdings individuell angepasst, unter Berücksichtigung des Alters, der Begleiterkrankungen, der Symptome und des subjektiven Wohlbefindens. Bei jüngeren, gesunden Patienten kann eine schnellere Steigerung der Hormondosis erfolgen (durchschnittlich 25 µg alle 4 Wochen bei guter Verträglichkeit) als bei älteren oder schwer kranken Patienten oder solchen mit ausgeprägten Symptomen (im Schnitt ca. 12,5 µg alle 4 Wochen). (Rosenbaum, 1981) Berücksichtigt werden muss auch ein erhöhter Bedarf in der Pubertät, der Schwangerschaft und im Klimakterium. Die Substitution kann prinzipiell auch mit T3-Präparaten erfolgen. Sie werden zu 85100% resorbiert. Die Wirkung setzt bei oraler Zufuhr bereits nach 2-3 Tagen ein, bei intravenöser Gabe bereits nach wenigen Stunden. Die Wirkung hält 10 Tage an. Allerdings entstehen unphysiologische Schwankungen der T3-Spiegel, so dass T3 heute nur noch selten eingesetzt wird und dann in Kombinationspräparaten mit T4. Mehrheitlich gilt die Verordnung eines Kombinationspräparats jedoch als obsolet. Verbreiteter ist die Substitutionstherapie mit LT4. Bei Nüchterneinnahme erfolgt eine Resorption von max. 80%. Die Konversion in die wirksame Variante T3 erfolgt in der 2 Peripherie. Die Wirkung setzt nach intravenöser oder oraler Gabe frühestens nach einigen Tagen ein, der maximale Effekt wird nach 10 Tagen erreicht. Die Wirkung hält 4 Wochen an. 1.2 Epidemiologische Bedeutung der Thyroxineinnahme In der 1995 durchgeführten „Colorado Thyroid Disease Prevalence Study“ wurden über 25000 Probanden mittels TSH- und Gesamt-T4-Bestimmung im Serum auf die Prävalenz von Hypo- und Hyperthyreose untersucht. Es fanden sich bei 9,5% erhöhte und bei 2,2% erniedrigte TSH-Spiegel. Bei Frauen fand sich im Vergleich zu Männern eine höhere Prävalenz für Hypothyreosen, welche mit zunehmendem Alter ebenfalls anstieg. Außerdem zeigte die Studie, dass 40% der Probanden, welche Schilddrüsenmedikamente einnahmen, außerhalb des gewünschten Ziel-TSHSpiegels lagen. (Canaris, 2000) In einem nationalen Untersuchungssurvey von 1984 bis 1992 fand sich eine Prävalenz von 4,9% für hypothyreote SD-Erkrankungen und Struma nodosa. Frauen waren fünf Mal so häufig betroffen wie Männer. Gleichzeitig bedeutet dies, dass 5% der deutschen Bevölkerung SD-Hormone einnehmen; sie sind die am häufigsten verordneten und regelmäßig eingenommenen Medikamente in Deutschland. (Melchert, 2001) SD-Hormone weisen eine geringe therapeutische Breite auf, bereits latente Hypooder Hyperthyreosen führen zu relevanten Komplikationen wie z.B. kardialen Arrhythmien. (Dietrich, 2006) Die Framingham-Offspring-Studie mit 2407 Probanden, welche über drei Jahre durchgeführt wurde, zeigte, dass es bei Schwankungen des TSH-Spiegels innerhalb des Normbereichs auch zu Schwankungen des Körpergewichts kam. So stieg das Gewicht bei Frauen um 0,5- 2,3 kg und bei Männern um 0,4 – 1,3 kg an. (Fox, 2008) Diese Untersuchungen machen deutlich, wie stark vertreten die SD- Hormonpräparate im Alltag sind und dass es eines erheblichen Aufwands bedarf, für jeden Patienten die exakte Dosierung zu finden. 3 1.3 Hashimoto-Thyreoiditis Die häufigste Ursache einer Hypothyreose ist die chronisch-autoimmune Thyreoiditis, die Hashimoto-Thyreoiditis. Sie kann mit einer Struma kombiniert sein. Ohne Struma wird sie auch atrophische Thyreoiditis genannt. Benannt wurde die Erkrankung nach ihrem Erstbeschreiber Dr. Hakaru Hashimoto (1881-1934, er arbeitete als Pathologe und Chirurg in Japan). 1912 beschrieb er erstmals seine Entdeckung der „Struma lymphomatosa“, die er bei Thyreoidektomien an 4 Frauen mehrmals in Kombination mit einer Hypothyreose vorgefunden hatte. (Sawin, 2002) Frauen sind 10-mal häufiger betroffen als Männer. Auch die Prävalenz steigt mit zunehmendem Alter, ebenso die Inzidenz, welche einen Erkrankungsgipfel um das 60. Lebensjahr aufweist. (Feldkamp, 2000) Die Schilddrüse wird durch Autoimmunprozesse zerstört oder die Bildung der SDHormone durch Anlagerung von Autoantikörpern gehemmt. Hashimoto-Thyreoitiden kommen familiär gehäuft vor. In der Sonographie zeigt sich eine diffuse Strukturarmut und eine schlechte Abgrenzbarkeit. Im Labor lassen sich zu 90% TPO-AK nachweisen, auch Tg-AK. Bei einer lang bestehenden Autoimmunthyreoiditis ist allerdings auch eine normale Konzentration von TPO-AK möglich. Remissionen der Erkrankung sind selten. Häufig ist die Hashimoto-Thyreoiditis Autoimmunerkrankungen kombiniert. Zu mit diesen weiteren organspezifischen Erkrankungen gehört die Weißfleckenerkrankung (Vitiligo), der Diabetes mellitus Typ 1, die Gastritis Typ A mit nachfolgendem Vitamin B12- Mangel und die Unverträglichkeit des Nahrungseiweißes Gluten (einheimische Sprue, Zöliakie), sehr selten auch die Unterfunktion der Nebennierenrinde (Morbus Addison). (Jenkins, 2002) LT4 muss bei den Betroffenen lebenslang substituiert werden. Bei euthyreoter Stoffwechsellage unter Substitution sind Therapiekontrollen alle 6-12 Monate anzustreben. 4 1.4 Schilddrüsenhormone Das Thyroideastimulierende Hormon (TSH), auch Thyreotropin, ist ein Glycopeptidhormon, welches im Hypophysenvorderlappen produziert wird. Es bindet an extrazelluläre Rezeptoren, welche einen second Messenger aktivieren. TSH stimuliert die Synthese und die Sekretion von T3 und T4 in den Follikeln der Thyroidea. Außerdem stimuliert es das Wachstum der Thyreozyten und kann so zu einer Struma führen. TSH ist der empfindlichste Marker für die Funktion der Schilddrüse. Ein normaler Wert schließt eine primäre Hypothyreose aus. (Lehnert, 2009) Auch zur Kontrolle einer Substitutionstherapie ist die TSH-Bestimmung das Mittel der Wahl. (Wiersinga, 2000) Die SD-Hormone L-3,5,3´-Trijodthyronin (T3) und L-Thyroxin (T4) sind Hormone, welche sich von einer Aminosäure, dem Tyrosin, ableiten. Sie sind wie Steroidhormone membrangängig und binden an intrazelluläre Rezeptoren im Zytosol. Als Rezeptorhormonkomplex werden sie in den Zellkern der Zielzellen transportiert, wo sie die Gentranskription beeinflussen. Die Wirkung der SD-Hormone tritt daher erst innerhalb von Stunden ein. T3 und T4 werden als Thyreoglobulin in den Schilddrüsenfollikeln gespeichert. Der größte Teil der Hormone ist für den Transport im Blut an das thyroxinbindende Globulin (TBG) gebunden, was die lange HWZ der SD-Hormone erklärt. T3 bindet zusätzlich an Präalbumin, T4 an Albumin sowie Transthyretin. Nur der freie Anteil der SD-Hormone ist biologisch wirksam. In freier Form liegen 0,2% des T3 vor, von T4 sind es nur 0,02 Promille. (Feldt-Rasmussen, 2007) Schwankungen der Hormongesamtspiegel Konzentrationsänderungen der Proteinbiosynthese zu führen T3 und Transportproteine. Verschiebung in T4 entstehen Störungen der Synthese durch in der der SD- hormonbindenden Globuline und so zu Veränderungen im Gesamtspiegel der SDHormone. Durch schwere Erkrankungen (z. B. Leberzirrhose) ist die TBG-Synthese vermindert, durch Schwangerschaft oder Östrogentherapie (z.B. die Pille) erhöht. (Arafah, 2001) 5 T3 entsteht zu 85% durch 5´-Dejodination in der Peripherie, vor allem in der Leber aus dem in der Schilddrüse produzierten T4. (Wiersinga, 2000) (Taurog, 1996) (Janssen, 2003) (Klein, 2003) Vor diesem Hintergrund wird empfohlen, die freien Hormone zu bestimmen. (Lehnert, 2009) Die HWZ von T3 beträgt 24 Stunden. T3 entsteht durch Anlagerung dreier Jodatome an Tyrosin. Täglich werden ca. 8 µg produziert. Das Hormon ist fünfmal aktiver als T4 und besitzt eine zehnfach höhere Bindungsaffinität an den nukleären Rezeptoren als Thyroxin. T3 wird nur zu 15% in der Schilddrüse produziert und entsteht durch Konversion über das Enzym Dejodase aus T4 in der Peripherie. (Köhrle, 2003) Die HWZ von T4 beträgt 7 Tage. Von der Schilddrüse werden täglich 90 µg produziert. Die lange HWZ erklärt sich durch die Plasmaproteinbindung. Der Austausch zwischen freier und gebundener Fraktion erfolgt im Falle eines Ungleichgewichts rasch. (Dietrich, 2008) 1.5 SD-Hormoneinnahme Die Substitution erfolgt mit oralen LT4-Präparaten (seit 1950), die in der Peripherie bedarfsgerecht in T3 konvertiert werden. T3 erfordert aufgrund der kurzen HWZ eine zweimalige Gabe am Tag und bewirkt einen Anstieg des Serum-T3-Spiegels über die Norm. Demgegenüber hat die Substitution mit LT4 viele Vorteile: eine lange HWZ, eine einmal tägliche Verabreichung, das gelegentliche Vergessen ruft keine Nachteile hervor und die periphere Konversion in T3 (80% der täglichen T3-Produktionsrate) hat einige schützende Effekte während Krankheiten. Ebenso hält sich der Anstieg des SerumT4-Spiegels nach oraler Einnahme in Grenzen. (Wiersinga, 2000) Die Einnahme der LT4-Präparate sollte nüchtern erfolgen, um eine Resorptionsquote von 80% zu erzielen. (Gärtner, 2008). 6 Nahrungsaufnahme beeinträchtigt die Resorption, so dass die Einnahme 30-60 min vor dem Frühstück erfolgen sollte. Wegen der langen LT4-HWZ von 7 Tagen lassen sich relativ konstante Wirkspiegel erzielen. Nach 10 Tagen ist der maximale Effekt erreicht. Die Wirkung ist frühestens nach 2-3 Tagen zu erwarten. Im Mittel liegt die Therapiedosis bei 1,6 µg/kg KG am Tag, unterliegt jedoch deutlichen individuellen Schwankungen. Es müssen erhöhte fT4-Spiegel erreicht werden, um eine ausreichende periphere Konversion zu erzielen. (Fish, 1987) Nach Dosisanpassungen ist eine Laborkontrolle (TSH) frühestens nach 6 Wochen sinnvoll. Bei stabiler Dosis ist eine jährliche Überprüfung ausreichend. (Mandel, 1993 sowie Helfland, 1990) Zielbereich unter einer LT4-Substitution sind TSH-Werte im unteren Normbereich; Werte kleiner bzw gleich 0,1 mU/l sind zu vermeiden. 1.6 Hypothalamischer-Hypophysärer Regelkreis Die Hormonregulation unterliegt einem komplexen Regelkreis, welcher u.a. über negatives Feedback, das autonome Nervensystem und neurogene Einflüsse (Stress, Temperaturempfinden, Emotionen) und weitere, größtenteils noch unbekannte Faktoren, gesteuert wird. Die Ausschüttung von TRH aus dem Hypothalamus wird über einen zu niedrigen T3/T4-Spiegel gesteigert, über einen zu hohen T3/T4-Spiegel gehemmt. TRH stimuliert die Ausschüttung von TSH im Hypophysenvorderlappen. Auch hier wirken die SD-Hormone je nach Konzentration stimulierend oder hemmend. (Kaufmann, 2006) 7 1.7 Einfluss der SD-Hormone auf den Körper Die SD-Hormone beeinflussen sämtliche unserer Körpersysteme: Erythrozyten Herz Rechtsverschiebung der Steigerung der Herzfrequenz, Sauerstoffdissoziationskurve der Auswurfleistung und der Katecholaminempfindlichkeit Leber Steigerung der Gastrointestinaltrakt Glukoneogenese und Steigerung der Motilität der Glykogenolyse Lipolyse, Cholesterinsynthese Grundumsatz Muskeln Steigerung, Gesteigerter Erhöhung der Körpertemperatur Muskeleiweißumsatz Katabolismus Knochen Erhöhte Kontraktions- und Gesteigerter Umsatz mit Relaxations- erhöhter Resorption der Geschwindigkeit Knochenmasse Vermehrt Betarezeptoren Abbildung 1: Die Wirkungen der Schilddrüsenhormone auf die Zielorgane (modifiziert nach S. Adler, Lübeck, 2004) 1.8 Typ-A-Gastritis Die Typ-A-Gastritis ist eine Autoimmunkrankheit und macht 3-6% aller Gastritiden aus (Stolte, 1990). Sie tritt gehäuft bei Frauen und Nordeuropäern auf und ist mit HLA-B8 und DR3 assoziiert. Die Typ-A-Gastritis ist außerdem zu 40% mit einer Autoimmunthyreoiditis vergesellschaftet. (Lahner, 2009) Die Autoimmungastritis ist symptomlos und breitet sich von der Kardia in Richtung Fundus und Korpus aus. Histologisch findet man eine fokale oder diffuse lymphozytäre Infiltration oder eine pseudopylorische und intestinale Metaplasie. Meist zeigt sich eine progrediente Atrophie des Drüsenkörpers. (Layer, 2008) 8 Zur Diagnose werden bei einer Gastroskopie insgesamt fünf Biopsien entnommen: 2 im Antrum an der großen und kleinen Kurvatur, eine ca. 2-3 cm vor dem Pylorus, eine an der Incisura angularis und 2 im Korpus (ca. 8 cm von der Kardia entfernt). Bei 80% der Patienten wird sie durch HP ausgelöst. Sie gilt als heilbar, solange noch keine Atrophien vorhanden sind. Eine Eradikationstherapie ist in diesem Fall indiziert. Bei 90% der Patienten lassen sich PCA und bei 70% AK gegen Intrinsic factor nachweisen. Im Alter sind die Autoantikörper vermindert nachweisbar. Durch Schwund der Belegzellen entwickelt sich bei PCA-Bildung eine Achlorhydrie (Anazidität). Aufgrund des Intrinsic-factor-Mangels kann sich eine perniziöse Anämie, eine funikuläre Myelose oder eine depressive Störung entwickeln. Beim Vorliegen eines manifesten Vitamin-B-12-Mangels muss dieses parenteral substituiert werden. Des Weiteren steigt die Inzidenz für Polypen, Karzinoide und Adenokarzinome des Magens. Beim Vorliegen einer Autoimmungastritis sind regelmäßige endoskopisch-bioptische Kontrollen zum Ausschluss eines Magenkarzinoms indiziert. Die wesentlichen Unterschiede zwischen A und B-Gastritis: Tabelle 1: Unterschiede zw. Typ-A und B-Gastritis (MALFERTHEINER, 1988) Abkürzungen: AK=Antikörper, PCA=Parietalzellantikörper Typ A-Gastritis Typ B-Gastritis Säuresekretion vermindert bis fehlend Säuresekretion normal Gastrinspiegel erhöht Gastrinspiegel normal AK gegen Intrinsic factor und PCA Keine AK Auftreten Kein endokriner immunologischer, Erkrankungen Hyperthyreose, Diabetes (Hypo-, Auftreten immunologischer, endokriner Erkrankungen mellitus Typ1, M. Addison (STRICKLAND et al, 1973)) Corpusschleimhaut diffus befallen Corpusschleimhaut partiell befallen 9 1.9 Die Resorption von SD-Hormonen Die Resorption der SD-Hormone ist bisher nur unzureichend erklärt. Es wurde gezeigt, dass aufgrund eines ausgeprägten Firstpass-Effekts nur 63-74% des oral eingenommenen LT4 im Gastrointestinaltrakt resorbiert werden, zu 20% im Duodenum, zu 40% im oberen und zu 40% im unteren Jejunum und dem Ileum. (Hays, 1968, 1988, 1991) Die SD-Hormone werden nach intestinaler Glukuronidierung absorbiert und direkt in die mesenteriale Blutbahn aufgenommen. Sie werden aktiv in die Galle sezerniert und über die Darmwand reabsorbiert. (Mayant, 1956) Außerdem unterliegen die Jodothyronine einem enterohepatischen Kreislauf, ihre Bioverfügbarkeit liegt bei 70%. Schwankungen entstehen durch bestimmte Krankheiten sowie durch andere Medikamente oder Nahrungsmittel, die zeitgleich eingenommen werden. (Dietrich, 2008) Die Aufnahme der SD-Hormone in die Zellen ist Na+- und ATP-abhängig, sie stellt also einen aktiven energieabhängigen Prozess dar. (Hennemann, 2001) Es gibt mindestens 10 verschiedene Jodothyronintransporter um die SD-Hormone in die Zellen zu transportieren, sie sind teilweise sekundär oder tertiär aktiv. (Friesema, 2005 sowie Dietrich, 2008) 1.10 Fragestellung Schilddrüsenerkrankungen sind weltweit sehr verbreitete Erkrankungen und auch in Deutschland sind diese mit einer Prävalenz von 5% stark vertreten. Zudem gehören SD-Hormone zu den am häufigsten verordneten Medikamenten, die regelmäßig über längere Lebensphasen eingenommen werden. Aufgrund einer geringen therapeutischen Breite des LT4 muss auf eine exakte Einhaltung des physiologischen Wirkspiegels geachtet werden, da schon geringste Schwankungen Symptome hervorrufen und negative Auswirkungen auf den gesamten Organismus haben können. Deshalb ist es wichtig, regelmäßige Therapiekontrollen durchzuführen, in dem man den TSH-Spiegel bestimmt. (Wartofsky, 2002) Bis zu 40% der Patienten, die LT4 einnehmen, liegen nicht im TSH-Normbereich. (Canaris, 2000) 10 In vielen Studien wurde bereits gezeigt, dass die Resorption von SD-Hormonen durch verschiedene Medikamente wie Antazida, Calciumcarbonat, Cholestyramin, Eisensulfat, Raloxifen und Sucralfat beeinflusst wird. Magenerkrankungen wie Gastritiden kommen ebenfalls häufig unter der Bevölkerung vor, im Alter über 50 Jahren leiden 50% der Menschen an einer HP-Gastritis, welche häufig in eine atrophe Gastritis übergeht, wenn sie unbehandelt bleibt. (Herold, 2010) PPI sind die effektivsten Medikamente zur Hemmung der Magensäuresekretion und werden zur Behandlung von Gastritiden eingesetzt. Es gibt widersprüchliche Daten zum Einfluss von PPI auf die LT4-Resorption. Centanni und Mitarbeiter fanden angestiegene TSH-Spiegel unter einer Therapie mit PPI sowie einen erhöhten LT4Substitutionsbedarf, um die Spiegel wieder zu senken. (Centanni, 2006) In einer ähnlichen Studie, an der allerdings nur gesunde Probanden teilnahmen, konnte Dietrich et al zeigen, dass durch die gleichzeitige Einnahme von SDHormonen und PPI keine Veränderungen der LT4-Spiegel entstehen. Sie konnten jedoch erhöhte Nüchterngastrinspiegel im Blut nachweisen. (Dietrich, 2006) Auch Nahrungsmittel wie Kaffee, Soja, Leberextrakt oder Walnüsse beeinflussen die Resorption nachhaltig. Außerdem ist bekannt, dass es beim Vorliegen einer Hashimoto-Thyreoiditis zum Auftreten weiterer Autoimmunerkrankungen kommen kann, u.a. zu einer atrophischen Gastritis mit perniziöser Anämie, sowie dem Sjögren-Syndrom, der autoimmunhämolytischen Anämie, der Thrombozytopenie, einer rheumatoider Arthritis, einem Diabetes mellitus Typ 1 und 2, Morbus Addison, Zöliakie sowie dem systemischen Lupus erythematodes, einer Sklerodermie oder Vaskulitis. Das Vorhandensein von organspezifischen und nichtorganspezifischen AK nimmt mit dem Alter zu. (Lapcevic, 2005) Bis heute ist jedoch noch nicht vollständig geklärt, wo genau die SD-Hormone resorbiert werden, bisherige Studien zeigten eine Resorption distal des Duodenums. (Hays, 1991) 11 In der vorliegenden retrospektiven Querschnittstudie wurden Patienten untersucht, bei denen sowohl eine Hashimoto-Thyreoiditis als auch eine endoskopisch diagnostizierte Typ-A-Gastritis oder positive PCA vorlagen und mit einer Gruppe von Patienten verglichen, die keine intestinale Inflammation aufwiesen. Bei allen Patienten fand sich eine regelrechte Stoffwechsellage. Benötigen Patienten mit einer Typ-A-Gastritis und LT4-Substitutionspflichtigkeit mehr LT4, um einen TSH-Spiegel im Normbereich oder gering unter der Norm zu erreichen? 12 2. Material und Methodik 2.1. Patientenauswahl Die Patienten, welche in die vorliegende Arbeit eingeschlossen wurden, sind Patienten aus eingeschlossenen dem Einzugsgebiet Patienten sind des an die Universitätsklinikums endokrinologische Ulm. Ambulanz Die der medizinischen Klinik angebunden und befinden sich in einer Langzeitbetreuung. In die Arbeit integriert wurden Patienten, welche zwischen 2002 und 2007 an der Medizinischen Klinik der Universität Ulm wegen einer Schilddrüsenerkrankung in Behandlung waren oder immer noch sind. Es handelt sich hierbei um insgesamt 268 (ehemals 299) Patienten. Die Erkrankungen teilen sich wie folgt auf: Hashimoto-Thyreoiditis Struma nodosa M. Basedow (Hypothyreote Stoffwechsellage) Schilddrüsenresektionen Nicht näher bezeichnete Hypothyreose Das Patientenkollektiv wurde in zwei Gruppen aufgeteilt. Die Referenzgruppe (Gruppe A) enthält alle Patienten mit Schilddrüsenerkrankungen ohne Typ-AGastritis. Dies sind 242 (ehemals 259) Patienten, davon 144 (ehemals149) Frauen und 98 (ehemals110) Männer. 17 Patienten mussten aufgrund unvollständiger Datenlage ausgeschlossen werden. Die zweite Gruppe (Gruppe B) enthält die Patienten mit einer Autoimmunerkrankung, positiven Parietalzellantikörpern und mittels endoskopisch entnommenen Biopsien nachgewiesener Typ-A-Gastritis. Dies sind 40 Patienten, davon sind 31 Frauen und 9 Männer. 6 Patienten (5 Frauen und 1 Mann) wurden aufgrund unvollständiger Datenlage ausgeschlossen, 6 weitere (5 Frauen, 1 Männer) wurden aufgrund fehlender Medikation bzw. Jodideinnahme und eine Probandin und ein Proband wurden wegen Nichtvorliegen einer Euthyreose ausgeschlossen, so dass insgesamt 26 Patienten (21 Frauen, 5 Männer) in die Auswertung einbezogen wurden. 13 Patienten (10 Frauen, 3 Männer) haben eine endoskopisch nachgewiesene 13 Autoimmungastritis, bei allen 26 Patienten wurden positive Parietalzellantikörper nachgewiesen. Tabelle 2: Ein- und Ausschlusskriterien der Probanden in die vorliegende Arbeit Abkürzungen: TSH= Thyroidea stimulierendes Hormon, fT3=freies Trijodthyronin, LT4=Levothyroxin Einschlusskriterien Ausschlusskriterien TSH nicht supprimiert fT3 oder fT3-Index im TSH supprimiert fT3 oder fT3-Index vermindert Normbereich od. erhöht LT4-Substitutionstherapie Keine LT4-Substitution Bei allen Patienten bestand eine regelrechte Stoffwechsellage. Bei der Mehrheit der Patienten lag das TSH im Normbereich, bei einigen war es leicht erniedrigt, jedoch nie maximal supprimiert. Klinisch lag bei allen Patienten eine Euthyreose vor, das fT3 oder fT3E lag im Normbereich. Patienten mit einer Hyperthyreose wurden nicht berücksichtigt. Die Patientendaten wurden sowohl mit Hilfe des klinikinternen Datennetzes der Medizinischen Klinik als auch durch Aktendurchsicht retrospektiv erfasst. Sie wurden in einer extra für diese Arbeit angefertigten Datenbank erfasst und ausgewertet. Anamnesebögen, Verlaufskontrollen und Laborwerte gingen in die Auswertung mit ein. 2.2 Erfasste Parameter 1. Alter Alter des Patienten in Jahren 2. Geschlecht Verteilung des Geschlechts im Patientenkollektiv 3. Körpergröße Körpergröße der Patienten in Meter 4. Körpergewicht Gewicht der Patienten in Kilogramm 14 5. BMI (kg/m²) Der Body-Mass-Index wurde aus Körpergewicht in Kilogramm und Körpergröße in Metern errechnet. Dazu wurde das Körpergewicht durch die Körpergröße im Quadrat dividiert. 6. LT4-Dosis Tägliche Dosierung des eingenommenen Levothyroxinpräparates in µg 7. Laborparameter Sämtliche Laborparameter wurden im Labor der Universitätsklinik Ulm bestimmt. Die Bestimmung erfolgte aus Serumproben. TSH: Thyreoidea Stimulierendes Hormon oder Thyreoglobulin. Der TSH-Wert Patientenserum wird mittels quantitativ immunologischen bestimmt. Es In-vitro-Tests handelt sich aus um dem einen Elektrochemilumineszenz-Immunoassay (ECLIA) der Firma Roche, verwendbar an Elecsys und cobas e Immunoassay-Systemen. Die Sensitivität beträgt 0,005 µIU/ml. Das TSH basal wird in mIU/l angegeben. Der Normwert liegt zwischen 0,465-4,68 mIU/l. fT3: freies Trijodthyronin. FT3 wird in pmol/l angegeben. Der Normwert liegt zwischen 3,92-6,74 pmol/l. Bestimmung mittels immunologischen In-vitro-Tests aus dem Patientenserum über Elektrochemilumineszenz-Immunoassay (ECLIA) der Firma Roche. Die Tests sind an Elecsys und cobas e Immunoassay-Systemen verwendbar. Die Bestimmung des fT3 ist unabhängig von Veränderungen der Konzentration und Eigenschaften der Bindeproteine TBG, Präalbumin und Albumin. Die Sensitivität beträgt 0,400 pmol/L. fT4: freies Thyroxin. FT4 wird ebenfalls in pmol/l angegeben. Der Normwert liegt zwischen 12,8-20,4 pmol/l. Die Bestimmung des fT4 erfolgt ebenfalls mittels immunologischen In-vitro-Tests aus dem Patientenserum über Elektrochemilumineszenz-Immunoassay (ECLIA) der Firma Roche. Die Tests sind an Elecsys und cobas e Immunoassay- 15 Systemen verwendbar. Die fT4-Bestimmung ist ebenfalls unabhängig von Veränderungen der Bindeproteinkonzentration und ihren Eigenschaften. Die Sensitivität beträgt 0,30 pmol/L. TPO-AK: Thyreoidperoxidase-Antikörper mit ELISA-Test bestimmt. Der Normbereich liegt unter 100 U/ml. TRAK: TSH-Rezeptor-Antikörper. TRAK wird mittels Lumineszenzrezeptorassay der Firma BRAHMS bestimmt. Der Test dient der quantitativen Bestimmung von TRAK und hat eine diagnostische Sensitivität von 98,8% bei einer Spezifität von 99,6%. (Costagliola,1999) Der Normbereich liegt bei <1 IU/l (IU = internationale Einheit / Liter). Werte >1,5 IU/l werden als TRAK positiv bezeichnet. PCA: Parietalzellantikörper. Der Normbereich liegt unter 10 U/ml. PCA haben eine Sensitivität von 73% und eine Spezifität von 100%. (Lahner, 2009) fT3E freies T3 Äquivalent. Normbereich 15,00-67,00. fT4E freies T4 Äquivalent. Normbereich 1,53-4,12. 8. Begleitmedikamente Erfasst wurden Medikamente, welche die Resorption von Schilddrüsenhormonen nachweislich beeinflussen. Dies sind: Calciumcarbonat, Östradiol, Hormonersatzpräparate, Eisensulfat, Selektive Östradiolrezeptorblocker, H2Blocker, hormonelle Kontrazeptiva und Protonenpumpenhemmer. 9. Art der Hypothyreose Hierunter wurde vor allem auf Autoimmunthyreopathien geachtet. 10.Dosierung auf die Körperoberfläche berechnet Tagesdosis umgerechnet auf die Dosis pro m² . Die Umrechnung erfolgte mit der vom Patienten eingenommenen Tagesdosis und seiner Körperoberfläche. Die Körperoberfläche wurde mit der Formel nach DuBois berechnet: KOF [m²] = (Gewicht [kg]) x 0,425 x (Größe [cm]) x 0,725 x 0,007184 [m²/kg cm] (DuBois,1916) 16 11.Dosierung auf das Körpergewicht berechnet Umrechnung der vom Patienten eingenommenen Tagesdosis auf sein Körpergewicht. 2.3 Statistische Methoden Sämtliche Daten wurden zunächst in einer eigens dafür erstellten ACCESSDatenbank gesammelt (Microsoft Office Access 2007). Zur weiteren Analyse wurden sie in ein Excel-Dokument umgewandelt (Microsoft Office Excel 2007 für Windows Vista) und mit WinSTAT für Excel 2007 für Windows Version Vista ausgewertet. Die Daten wurden parameterfrei ausgewertet: Es wurden Minimum, Maximum, Median sowie die 25. und 75. Perzentile berechnet. Zusätzlich werden Mittelwert und Standardabweichung angegeben. Die graphische Darstellung der Messwerte erfolgt mittels Boxplots. Der Median teilt eine Verteilung in zwei gleiche Hälften. Extreme Werte (Ausreißer) beeinflussen ihn kaum im Gegensatz zum Mittelwert. Die Standardabweichung ist das Maß für die Streuung der Werte einer Variablen um ihren Mittelwert: Die 25. Perzentile ist ein Wert, unterhalb dessen 25% aller Fälle der Verteilung liegen, unterhalb der 75. Perzentile liegen 75% der Fälle. Der Abstand zwischen beiden Perzentilen umfasst also 50% der Verteilung. Zur Darstellung wurden Boxplots gewählt, weil sie eine gute Methode sind um die wichtigsten Verteilungsmerkmale von Wertausprägungen einer Variablen grafisch darzustellen. Bei Häufigkeitsverteilungen sitzen die meisten Werte oft in der Mitte und streuen in Randbereiche. Mit Boxplots kann man einfach darstellen, wo das Zentrum der Verteilung liegt und wie weit die restlichen Werte darum verteilt liegen. 17 Das wird auch Streuung genannt. Zusätzlich vermittelt die grafische Boxplotdarstellung einen Eindruck von Symmetrie oder Schiefe der Verteilung, sie beinhaltet zudem wichtige Merkmale wie Minimum, Maximum, 25. und 75. Perzentile und den Median. Der mittlere Strich eines Boxplots stellt den Median dar, die „Box“ beinhaltet 50 Prozent der Werte (die Box wird durch die 25. Und 75. Perzentile begrenzt), die „Wiskers“ (Schnurrhaare) schließen sowohl die 10. als auch die 90. Perzentile mit ein. Dies entspricht 80% aller Werte. Die darüber und darunter dargestellten Striche stellen jeweils das Maximum und das Minimum dar. Außerhalb liegende Werte gelten als einfache Ausreißer und werden nicht dargestellt (Dies gilt für alle hier aufgeführten Boxplots). Bei gleichmäßiger Verteilung wurden einfache lineare Regressionen nach Pearson berechnet. In unserem Beispiel ist die LT4-Dosis vom Gewicht oder von der KOF abhängig. Zur Beurteilung verwendet. Bei der Normalverteilung normalverteilten wurde Stichproben der wurde Kolmogorov-Smirnov-Test der Mann-Whitney-Test verwendet, bei nicht normalverteilten Proben der Unpaired t-Test für unabhängige, normalverteilte Proben. Zur Beurteilung der Abhängigkeit metrischer Merkmale wurde explorativ der parameterfreie U-Test von Wilcoxon, Mann und Whitney für unabhängige Stichproben verwendet, als Signifikanzniveau wird ein Alpha von 5% angenommen. Es wird nicht für multiples Testen adjustiert. 18 3. Ergebnisse 3.1 Homogenität der Studiengruppen Beide Studiengruppen unterschieden sich im Wesentlichen nur in der Gruppengröße und im Körpergewicht, jedoch nicht in relevanten weiteren Merkmalen: Tabelle 3: Homogenität der Studiengruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-AGastritis) und Studiengruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, N = Probandenanzahl, SD = Standardabweichung, TSH = Thyroidea stimulierendes Hormon, LT4 = Levothyroxin, mIU = milli International Unit, l = Liter, kg = Kilogramm, KG = Körpergewicht, µg = Mikrogramm, KOF = Körperoberfläche, m² = Quadratmeter Alter Gewicht TSH LT4 LT4/kg KG LT4/KOF (Jahre) (kg) (mIU/l) (µg) (µg/kg) (µg/m²) Gr.A(N=242) 59 74 0,901 75 1,144 45,582 SD Gr.A 13,584 16,443 0,953 37,039 0,492 19,012 Gr.B (N=26) 58,5 65,2 1,185 75 1,343 47,563 SD Gr.B 15,181 12,019 1,234 50,163 0,695 25,993 Es wurde darauf geachtet, dass alle Patienten klinisch eine Euthyreose aufwiesen, das TSH lag mehrheitlich im Normbereich. Bei 34 Patienten der Gruppe A und 5 Patienten in Gruppe B war es im sogenannten „supersensitiven TSH-Assay“ erniedrigt, jedoch nie maximal supprimiert. Zusätzlich wurde darauf geachtet, dass insbesondere fT3 oder fT3E im Normbereich lagen. Insgesamt wurden 31 Probanden aus der Studie ausgeschlossen (15 Frauen, 16 Männer), 23 aufgrund einer unvollständigen Datenlage, 6 aufgrund fehlender Medikation und 2 wegen nichtvorliegender Euthyreose. 3.2 Altersverteilung der Probanden Tabelle 4: Altersverteilung in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, N= Probandenanzahl, J= Jahre 10-19 J 20-29 J 30-39 J 40-49 J 50-59 J 60-69 J 70-79 J 80-89 J Gr.A(N=242) 1 7 26 26 69 71 32 10 Gr.B(N=26) 0 1 2 6 6 8 1 2 19 Das Durchschnittsalter in der Gruppe A lag bei 59 Jahren. Der jüngste Patient war 18 Jahre alt, der älteste 88 Jahre. Die Standardabweichung lag bei 13,584. Das Durchschnittsalter in der Gruppe B lag bei 58,5 Jahren, der jüngste Patient war 22 Jahre, der älteste 83 Jahre alt. Die Standardabweichung lag bei 15,181. Im Vergleich beider Gruppen lag der Altersgipfel in Gruppe A bei 50-70 Jahren, in Gruppe B etwas weiter verteilt bei 40-70 Jahren. Gruppe 35 Kontrolle Gr. A Gr. B 30 Relative Häufigkeit (%) 25 20 15 10 5 0 10 bis 19 20 bis 29 30 bis 39 40 bis 49 50 bis 59 60 bis 69 70 bis 79 80 bis 89 Alter (Jahre) Abbildung 2: prozentuale Altersverteilung in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: Gr = Gruppe 20 100 90 80 70 Alter (Jahre) 60 50 40 30 20 10 0 Kontrolle Gr. A Gr. B Gruppe Abbildung 3: Altersverteilung in den Gruppen A und B (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: Gr = Gruppe Alter 100 80 60 40 20 B pe p ru G G ru p pe A 0 Abbildung 4: Punktewolke der Altersverteilung in Gruppe A und Gruppe B (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, rot dargestellt. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, blau dargestellt), Universitätsklinikum Ulm (20022007) 21 3.3 Verteilung des Gewichts in beiden Gruppen Tabelle 5: Gewichtsverteilung in Kilogramm in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, N = Probandenanzahl, MW = Mittelwert, SD = Standardabweichung, Min = Minimum, Max = Maximum, Perz. = Perzentile MW SD Min Max 25. Perz. Median 75. Perz. Gr.A(N=242) 75,171 16,443 46 150 63 74 85 Gr. (N=26) 67,746 12,019 53 103 58 65,2 73,25 Das Gewicht lag in Gruppe A höher, bei 74 kg. In Gruppe B lag es bei 65,2 kg. Gruppe 35,00 Kontrolle Gr. A Gr. B 30,00 Relative Häufigkeit (%) 25,00 20,00 15,00 10,00 5,00 0,00 40 bis 49 50 bis 59 60 bis 69 70 bis 79 80 bis 89 90 bis 99 100 110 120 130 140 150 bis bis bis bis bis bis 109 119 129 139 149 159 Gewicht (kg) Abbildung 5: prozentuale Verteilung des Gewichts in Kilogramm in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: Gr = Gruppe, kg = Kilogramm 22 160 140 120 Gewicht (kg) 100 80 60 40 20 0 Kontrolle Gr. A Gr. B Abbildung 6: Gewichtsverteilung in Gruppe A und B (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzung: Gr = Gruppe, kg = Kilogramm Gewicht 200 150 100 50 B pe p ru G G ru p pe A 0 Abbildung 7: Punktewolke zur Gewichtsverteilung in Kilogramm in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, rot dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, blau dargestellt), Universitätsklinikum Ulm (20022007) 23 3.4 Verteilung des TSH in beiden Gruppen Tabelle 6: TSH-Verteilung (in mIU/l) in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: mIU= milli International Unit, l = Liter, Gr = Gruppe, N = Probandenanzahl, MW = Mittelwert, SD = Standardabweichung, Min = Minimum, Max = Maximum, Perz. = Perzentile MW SD Min Max 25. Perz. Median 75. Perz. Gr.A(N=242) 1,205 0,953 0,003 4,680 0,528 0,901 1,743 Gr.B(N=26) 1,480 1,234 0,037 4,120 0,450 1,185 2,273 Der mittlere TSH-Wert lag in der Referenzgruppe A bei 0,901 mIU/l, das Maximum lag 4,68 mIU/l und das Minimum bei 0,003 mIU/l. In Gruppe B lag der TSH-Spiegel im Mittel etwas höher bei 1,185 mIU/l, hier lagen das Maximum bei 4,120 mIU/l und das Minimum bei 0,037 mIU/l) Gruppe 40,00 Kontrolle Gr. A Gr. B 35,00 Relative Häufigkeit (%) 30,00 25,00 20,00 15,00 10,00 5,00 0,00 0 bis 0,5 bis 1 bis 1,5 bis 2 bis 2,5 bis 3 bis 3,5 bis 4 bis 4,5 bis 0,49 0,99 1,49 1,99 2,49 2,99 3,49 3,99 4,49 4,99 TSH (mIU/l) Abbildung 8: prozentuale Verteilung TSH in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit TypA-Gastritis, lila dargestellt), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, mIU/l = milli International Units, l = Liter, TSH = Thyroidea stimulierendes Hormon 24 5 4,5 4 3,5 TSH (mIU/l) 3 2,5 2 1,5 1 0,5 0 Kontrolle Gr. A Gr. B Gruppe Abbildung 9: TSH-Verteilung in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis und Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, mIU/l = milli International Units, l = Liter, TSH = Thyroidea stimulierendes Hormon TSH 6 TSH 4 2 B p e p ru G G ru p p e A 0 Abbildung 10: Punktewolke zur Verteilung des TSH in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, rot dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, blau dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: TSH = Thyroidea stimulierendes Hormon 25 3.5 Verteilung der Tagesdosis in beiden Gruppen Tabelle 7: LT4-Dosis-Verteilung (angegeben in Mikrogramm) in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, N = Probandenanzahl, MW = Mittelwert, SD = Standardabweichung, Min = Minimum, Max = Maximum, Perz. = Perzentile MW SD Min Max 25. Perz. Median 75. Perz. Gr.A(N=242) 88,361 37,039 25 200 50 75 103,125 Gr.B(N=26) 97,115 50,163 25 250 68,75 75 125 Bezüglich der eingenommenen Tagesdosis an LT4 wurden die beiden Gruppen ebenfalls verglichen. Hier zeigte sich, dass sich beide Gruppen im Median nicht unterschieden. Gruppe 35,00 Kontrolle Gr. A Gr. B 30,00 Relative Häufigkeit (%) 25,00 20,00 15,00 10,00 5,00 0,00 25 bis 50 bis 75 bis 100 49 74 99 bis 124 125 bis 149 150 bis 174 175 bis 199 200 bis 224 225 bis 249 250 bis 274 LT4-Dosis (µg) Abbildung 11: prozentuale Verteilung der täglichen LT4-Dosis in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: Gr = Gruppe, µg = Mikrogramm, LT4 = Levothyroxin 26 300 250 LT4-Dosis (µg) 200 150 100 50 0 Kontrolle Gr. A Gr. B Gruppe Abbildung 12: LT4-Dosis-Verteilung in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzung: µg = Mikrogramm, LT4 = Levothyroxin, Gr = Gruppe 3.6 Tagesdosis in Abhängigkeit vom Gewicht Tabelle 8: LT4-Dosis bezogen auf das Gewicht (in Kilogramm) in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, N = Probandenanzahl, MW = Mittelwert, SD = Standardabweichung, Min = Minimum, Max = Maximum, Perz. = Perzentile MW SD Min Max 25. Perz. Median 75. Perz. Gr.A(N=242) 1,202 0,492 0,368 3,077 0,8145 1,144 1,563 Gr.B(N=26) 1,445 0,695 0,394 3,571 0,877 1,343 1,875 Hier wurde die täglich eingenommene LT4-Dosis gegen das Gewicht aufgerechnet. Im Vergleich nahm Gruppe B täglich 0,199 µg mehr ein. Gruppe A nahm 1,144 µg pro Kilogramm Körpergewicht ein, Gruppe B dagegen 1,343 µg pro Kilogramm Körpergewicht. Der U-Test ergab einen Wert von p= 0.089. Der Test ist somit nicht signifikant. 27 Gruppe 30,00 Kontrolle Gr. A Gr. B 25,00 Relative Häufigkeit (%) 20,00 15,00 10,00 5,00 0,00 0,25 0,5 0,75 1 bis 1,25 1,5 1,75 2 bis 2,25 2,5 2,75 3 bis 3,25 3,5 bis bis bis 1,24 bis bis bis 2,24 bis bis bis 3,24 bis bis 0,49 0,74 0,99 1,49 1,74 1,99 2,49 2,74 2,99 3,49 3,74 LT4/ kg (µg/kg) Abbildung 13: prozentuale Verteilung der LT4-Tagesdosis pro kg KG in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzung: Gr = Gruppe, LT4 = Levothyroxin, kg = Kilogramm, KG = Körpergewicht, µg = Mikrogramm 4 3,5 3 LT4/ kg (µg/kg) 2,5 2 1,5 1 0,5 0 Kontrolle Gr. A Gr. B Gruppe Abbildung 14: LT4-Tagesdosis pro kg KG in beiden Gruppen (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis. Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzung: Gr = Gruppe, LT4 = Levothyroxin, kg = Kilogramm, KG = Körpergewicht, µg = Mikrogramm 28 LT4/ kg 4 LT4/ kg 3 2 1 B p e p ru G G ru p p e A 0 Abbildung 15: Punktewolke für die Verteilung der Tagesdosis (in Mikrogramm) in Abhängigkeit des Körpergewichts (in Kilogramm) für Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-AGastritis, rot dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-AGastritis, blau dargestellt), Universitätsklinikum Ulm (2002-2007) Abkürzung: LT4 = Levothyroxin, kg = Kilogramm 3.7 Tagesdosis bezogen auf die Körperoberfläche beider Gruppen Tabelle 9: Verteilung LT4-Dosis auf die KOF in beiden Gruppen, angegeben in µg/ m² (Gruppe A: Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis und Gruppe B: Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: µg = Mikrogramm, m² = Quadratmeter, Gr = Gruppe, N = Probandenanzahl, MW = Mittelwert, SD = Standardabweichung, Min = Minimum, Max = Maximum, Perz. = Perzentile MW SD Min Max 25. Perz. Median 75. Perz. Gr.A(N=242) 47,471 19,012 14,105 119,168 30,846 45,582 61,177 Gr.B (N=26) 54,640 25,993 14,446 132,528 37,400 47,563 68,907 Es wurde die Tagesdosis an LT4 auf die Körperoberfläche der Probanden berechnet. Hier nahm Gruppe A 45,582 µg/ m2 ein und Gruppe B nahm 47,563 µg/ m2 ein. Somit nahm Gruppe B 1,981 µg/ m2 mehr ein. Der U-Test ergab einen Wert von p= 0,203. Der Test ist somit nicht signifikant. 29 Gruppe 25,00 Kontrolle Gr. A Gr. B Relative Häufigkeit (%) 20,00 15,00 10,00 5,00 0,00 10 bis 19 20 bis 29 30 bis 39 40 bis 49 50 bis 59 60 bis 69 70 bis 79 80 bis 89 90 bis 99 100 110 120 130 bis bis bis bis 109 119 129 139 µg/KOF (µg/m2) Abbildung 16: prozentuale Verteilung LT4-Tagesdosis bezogen auf die KOF in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, blau dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, lila dargestellt), Universitätsklinikum Ulm (20022007) Abkürzungen: Gr = Gruppe, µg = Mikrogramm, KOF = Körperoberfläche, m² = Quadratmeter 140 120 100 µg/KOF (µg/m2) 80 60 40 20 0 Kontrolle Gr. A Gr. B Gruppe Abbildung 17: LT4-Tagesdosis bezogen auf die KOF (angegeben in µg/m²) in Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis), Universitätsklinikum Ulm (2002-2007) Abkürzungen: Gr = Gruppe, µg = Mikrogramm, KOF = Körperoberfläche, m² = Quadratmeter 30 µg/KOF µg/KOF 150 100 50 B pe ru p G G ru p pe A 0 Abbildung 18: Punktewolke für die Verteilung der Tagesdosis in Abhängigkeit der Körperoberfläche für Gruppe A (Probanden mit Schilddrüsenerkrankung ohne Typ-A-Gastritis, rot dargestellt) und Gruppe B (Probanden mit Schilddrüsenerkrankung und mit Typ-A-Gastritis, blau dargestellt), Universitätsklinikum Ulm (2002-2007) Abkürzungen: µg = Mikrogramm, KOF = Körperoberfläche 31 4. Diskussion 4.1 Auswertung der vorliegenden Ergebnisse Da Schilddrüsenhormone zu den meistverschriebenen Medikamenten gehören, wird viel Aufmerksamkeit auf Ihre Resorption gerichtet. Es wurde über eine Malabsorption von LT4 in Abhängigkeit von Antazida oder PPI berichtet, da die Resorption von einem sauren Milieu im Magen abhängig sei. (Klein, 2003) Allerdings wurde in weiteren Studien gezeigt, dass die Jodothyronine im Jejunum und Ileum resorbiert werden; in diesen Abschnitten liegt bereits kein saures Milieu mehr vor. Zudem sind die SD-Hormontransporter an allen Zellen (einschließlich der im GI-Trakt) dieselben, so dass dies die Annahme, für die Resorption sei ein saurer pH nötig, widerlegt. (Dietrich, 2008) Somit scheint immer deutlicher zu werden, dass für die Resorption der Jodothyronine nicht zwingend ein saures Magenmilieu notwendig ist. Bei anderen Untersuchungen wiederum fiel auf, dass Patienten mit einer Autoimmunthyreoiditis übermäßig oft positive PCA oder eine histologisch gesicherte Typ-A-Gastritis aufweisen. Wir führten eine retrospektive Querschnittstudie durch, welche eine Gruppe von Probanden mit einer Schilddrüsenerkrankung und einer entweder histologisch nachgewiesenen Typ-A-Gastritis, positiven PCA oder beidem (Gruppe B) mit einer Referenzgruppe, die lediglich an einer Schilddrüsenerkrankung litten (Gruppe A), verglich. Es zeigte sich, dass Gruppe B im Schnitt 0,199 µg Thyroxin pro kg Körpergewicht am Tag mehr benötigte als die Referenzgruppe. Des Weiteren konnte gezeigt werden, dass Gruppe B, bezogen auf die KOF, 1,981 µg/m2 Thyroxin täglich mehr einnahm als die Vergleichsgruppe. Bei beiden Tests lag der p-Wert >0,05, sie sind somit nicht signifikant. Unsere Ergebnisse, wenn auch nicht signifikant, sprechen dafür, dass Patienten mit einer Typ-A-Gastritis täglich mehr LT4-Substitution benötigen als Patienten ohne eine Autoimmungastritis. 32 Eine mögliche Ursache könnte sein, dass durch die Entzündung Zytokine oder Wachstumsfaktoren freigesetzt werden, welche die Dejodierung der SD-Hormone beeinflussen. Zum Beispiel könnte lokal Reverse T3 gebildet werden, so dass die SD-Hormone sofort wieder abgebaut werden. Außerdem könnte eine Konjugation durch die Entzündungszellen hervorgerufen werden und die SD-Hormone deswegen nicht resorbiert werden. Denkbar wäre auch, dass durch die lokale Entzündungsreaktion keine SDHormontransporter exprimiert werden können. Diese Entzündungsreaktionen könnten auch der Grund sein, warum Centanni et al 2006 zum Ergebnis kamen, dass Patienten, die aufgrund einer Refluxösophagitis PPI einnahmen, eine höhere Dosis an LT4 benötigten um einen gleichen TSH-Spiegel zu erreichen wie vor der PPI-Therapie. (Centanni, 2006) Das Vorliegen einer Euthyreose bei unseren Probanden wurde klinisch und durch einen TSH-Spiegel im Normbereich (und gering darunter) gesichert, so dass verfälschte Untersuchungsergebnisse aufgrund des Nichtvorliegens einer Euthyreose nahezu ausgeschlossen werden können. Das Gewicht als einer der Haupteinflussfaktoren auf die täglich benötigte ThyroxinMenge wurde ebenfalls in die Auswertung mit einbezogen. Durchschnittlich lag dies in Gruppe B mit 65,2 kg um 8,8 kg niedriger als in der Referenzgruppe A. Mit Berechnungen nach der bisherigen Faustformel (1-2 µg/kg KG/d) (Hennessey, 1986) würde somit die Vergleichsgruppe mit dem höheren Durchschnittsgewicht mehr Levothyroxin benötigen als Gruppe B. Dies ist in unserer Studie nicht der Fall, was die Annahme, dass Patienten mit einer Typ-A-Gastritis mehr LT4-Substitution pro Tag benötigen, unterstützt. Ein limitierender Faktor unserer Studie ist der deutliche Größenunterschied der Probandengruppen. So ist die Vergleichsgruppe (Gruppe A) 9,3-mal so groß wie die Gruppe mit der Typ-A-Gastritis und der Schilddrüsenerkrankung (Gruppe B). Um unsere Aussage zu unterstützen, sollten weitere Studien mit annähernd gleich großen Gruppen erfolgen. 33 Weiterhin limitierend ist die Begleitmedikation (Calciumcarbonat, Östradiol, Hormonersatzpräparate, Eisensulfat, Selektive Östradiolrezeptorblocker, H2-Blocker (Histamin-H2-Blocker), hormonelle Kontrazeptiva und Protonenpumpenhemmer), die manche der Probanden einnahmen und welche bekanntermaßen die Resorption der Schilddrüsenhormone beeinflussen können. Bei Patienten mit einer Autoimmunthyreoiditis sollte besonders auf das Vorliegen einer Typ-A-Gastritis geachtet werden, vor allem vor dem Hintergrund, dass Patienten mit einer Schilddrüsenerkrankung und einer Autoimmungastritis gegenüber Patienten mit alleiniger Schilddrüsenerkrankung einen erhöhten Substitutionsbedarf an LT4 haben und das eine effektive Resorption für eine gute Substitutionstherapie unumgänglich ist. 4.2 Intestinale Erkrankungen und die Resorption von LT4 Viele verschiedene intestinale Erkrankungen wie Helicobacter pylori, atrophische Gastritis, Giardiasis, Sprue und andere entzündliche Erkrankungen können die Resorption von LT4 beeinflussen. (Centanni, 2007) Bei einer Giardia-lamblia-Infektion (Diagnosesicherung mit Jejunalbiopsie) zeigte sich eine ausgeprägte Hypothyreose. Nachdem die Infektion mit Metronidazol erfolgreich behandelt worden war, wies der Patient wieder eine Euthyreose auf. (Seppel, 1996) Auch ein Kurzdarmsyndrom führt zu einer verminderten Resorption von LT4. (Choe, 1995) Wie eine Studie an Ratten zeigte, kommt es beim Vorliegen eines Kurzdarmsyndroms und einer LT4-Substitution zur Anpassung des verbleibenden Darms (Zottenhöhe, Kryptentiefe, Enterozytenproliferation des Ileums passt sich an das Jejunum an). Hier wurden drei Gruppen verglichen, in der ersten wurde kein Darm entfernt, in der einen wurde 75% des Darms entfernt, in der dritten Gruppe erhielten die Ratten zusätzlich zur Darmresektion Trijodthyronin. (Yuksel, 2009). Die Helicobacter-pylori-assoziierte Gastritis ist heutzutage in westlichen Ländern weit verbreitet. Helicobacter pylori beeinflusst über eine verminderte Säuresekretion des Magens die Resorption von LT4. Dies präsentierte eine Analyse, die fünf Studien 34 zusammenfasste. Nach einer Eradikationstherapie sank der TSH-Wert bei 94% der Probanden. (Lahner, 2009) Es wurde zunächst davon ausgegangen, dass auch eine bakterielle Fehlbesiedelung die Resorption von LT4 beeinflusst. In einer diesbezüglichen Studie wurden 50 Patienten, die an einer Autoimmunthyreoiditis litten, auf eine bakterielle Fehlbesiedlung des Dünndarms untersucht. Es fand sich zwar eine erhöhte Rate an Fehlbesiedelungen, die SD-Hormonspiegel blieben jedoch unbeeinflusst. (Lauritano, 2007) Auch beim Vorliegen einer Sprue, wird die Resorption von LT4 vermindert. In einem Fallbericht über einen Patienten mit Sprue wurde eine Malabsorption von LT4 und ein somit erhöhter Bedarf an LT4-Substitution beschrieben. (Grinspoon SK, 1995) Eine weitere Fallstudie kam zu ähnlichen Ergebnissen: Bei einer HypothyreosePatientin wurden aufgrund des Nichterreichens eines normalen TSH unter hoher LT4-Dosis die Antigliadin-AK bestimmt und das Vorliegen einer Sprue bestätigt. Da es beim Vorliegen einer Autoimmunthyreoiditis gehäuft zum Auftreten einer Sprue kommt, sollte bei Patienten, die trotz Substitution keinen normalen TSH-Spiegel erreichen, die Antigliadin-AK bestimmt werden. (d’Esteve-Bonetti, 2002) Eine Studie untersuchte 155 Kinder im Alter zwischen 6 Monaten und 7 Jahren. Bei allen Kindern mit einer Zottenatrophie waren die Serum-T4-Spiegel signifikant niedriger als bei Kindern ohne Zöliakie. Weiterführende Untersuchungen fehlen jedoch. (Karczewska, 1992) Auch schwerwiegende Allgemeinerkrankungen wie schwere Infektionen, Tumore oder ein entgleister Diabetes mellitus gehen mit einer verminderten Resorption von LT4 einher. Allesamt weisen einen katabolen Stoffwechsel auf. Durch Abnahme der Typ-I-Deiodase vor allem in Leber, aber auch in Schilddrüse, Niere und Hypophyse wird vermindert T4 zu T3 dejodiert, es folgt eine Abnahme des T3 im Blut. (Gärtner, 2006) 35 Einflussfaktoren, die die SD-Hormonresorption vermindern: Tabelle 10: Einflussfaktoren auf die SD-Hormonresorption Nahrungsmittel: Kaffee, Espresso, Leberextrakt, Sojaextrakt, Walnüsse, Pflanzenfasern Medikamente: Störung der Reabsorption: Colestyramin Unbekannt: Eisensulfat Adsorption: Sucralfat Aluminium- und Magnesiumhydroxid Calciumcarbonat Medizinische Kohle Krankheitsbilder: Kurzdarmsyndrom Zöliakie (einheimische Sprue) Helicobacter pylori Giardia lamblia- Infektion Schwere Allgemeinerkrankung Morbus Crohn Morbus Whipple Pankreasinsuffizienz 4.3 Einfluss verschiedener Medikamente auf die Resorption von Levothyroxin Bisher wurde großen Wert darauf gelegt, dass Patienten ihre SD-Medikation morgens auf nüchternen Magen einnehmen, da in vielen Studien gezeigt werden konnte, dass Nahrungsmittel und andere Medikamente die Bioverfügbarkeit von LT4 herabsetzen. (Wenzel, 1977) In einer aktuellen Studie von Bolk et al wurde dies aber weitgehend widerlegt. In dieser Doppelblindstudie wurde die morgendliche Nüchterneinnahme mit einer abendlichen Einnahme von LT4 verglichen. Es fanden sich bei der abendlichen Einnahme deutlich niedrigere TSH-Spiegel (um ca. 1,25 mIU/l) und höhere Spiegel für fT4 und Gesamt-T3 im Vergleich zur gewohnten morgendlichen Einnahme. Weitere Parameter wie z. B. der BMI oder der Lipidspiegel im Serum blieben weitestgehend gleich. (Bolk, 2010) 36 Durch Einnahme des LT4 mit Kaffee oder Espresso wird die Resorption von LT4 um 32% vermindert und um 41 Minuten verzögert. (Benvenga, 2008) Auch Calciumpräparate, die zu den am häufigsten eingesetzten Medikamenten zur Prophylaxe oder Therapie einer Osteoporose gehören, senken die Bioverfügbarkeit von LT4. Über ein Dutzend verschiedene Calciumsalze in über 100 Zusammensetzungen werden angewandt. Genauer untersucht wurde bisher nur die Beeinflussung der LT4-Bioverfügbarkeit durch Calciumcarbonat: bei gleichzeitiger Einnahme von Calciumcarbonat und LT4 sanken die fT4-Spiegel und die TSHSpiegel stiegen signifikant an. Nach Beendigung der Calciumcarbonattherapie normalisierten sich alle Spiegel wieder. (Levenson, 1994) Durch In-vitro-Versuche wurde die These aufgestellt, dass Calciumcarbonat in Abhängigkeit des sauren Magen-pH LT4 absorbiert. (Singh, 2000) Die Vermutung wurde laut, dass gastrointestinale Erkrankungen, die mit einer Malabsorption einhergehen, die Resorption von SD-Hormonen beeinträchtigen. Auch Eisenpräparate beeinflussen die Resorption von verschiedenen Medikamenten. Campbell und Mitarbeiter führten einen In-vitro-Versuch durch, der zeigte, dass Eisensulfat und LT4 einen schwer löslichen Komplex bilden und so die Resorption beeinträchtigt wird. Dies konnte in einer kleinen Studiengruppe (14 Patienten), die zu ihrer LT4-Dosis 12 Wochen lang Eisensulfat einnahmen, belegt werden. 9 Probanden entwickelten Symptome einer Hypothyreose. (Campbell, 1992) Auch Raloxifen, ein selektiver Östrogenrezeptor-Modulator, beeinflusst bei gleichzeitiger Einnahme die Resorption von LT4. Raloxifen führt zu erhöhten TBGSerumspiegeln und so zu erhöhten Spiegeln für Gesamt-T3 und -T4. Bei Patienten mit LT4-Substitution führt dies zu einem erniedrigten fT4-Spiegel und einem erhöhtem TSH. Unter gleichzeitiger Einnahme von Raloxifen mit LT4 stieg bei einer Patientin das TSH deutlich an (14,5µU/ml) und die Patientin bot Symptome einer Hypothyreose. Bei um 12 Stunden versetzter Einnahme beider Medikamente blieb der massive TSH-Anstieg aus. Diese Ergebnisse waren reproduzierbar. (Siraj, 2003) 37 Einige Studien untersuchten die Wechselwirkungen mit Antazida. So ließ sich für Aluminiumhydroxid eine unspezifische Malabsorption für LT4 bei gleichzeitiger Einnahme nachweisen. Es kam zu einem deutlichen TSH-Anstieg. Nach Beendigung der Antazidatherapie normalisierte sich das TSH. Je höher die Aluminiumhydroxidkonzentration in den Versuchen war, desto höher war die Absorption von LT4. (Mersebach, 1999) Sperber und Liel dokumentierten einen ähnlichen Fall. (Sperber, 1992) Sie belegten ihre Ergebnisse durch eine kleine Studie. (Liel, 1994) Studien mit Sucralfat stützen die These, dass die Verminderung der Bioverfügbarkeit des LT4 durch eine Adsorption bedingt ist, denn Sucralfat wird so gut wie nicht resorbiert. (Sherman 1994) In einer experimentellen Studie von Havrankova und Mitarbeitern wurde mit radioaktivem LT4 und Sucralfat eine starke Bindungskapazität beider Substanzen nachgewiesen. (Havrankova, 1992) 4.4 der pH-Wert Der pH-Wert des Magens ist offenbar ein wichtiger Faktor bei der Resorption von Nahrung, Spurenelementen und Medikamenten. Es werden viele verschiedene Mechanismen diskutiert, die zu einer Verminderung der Resorption dieser führen können: Ein nicht genügend saurer pH-Wert begünstigt das Wachstum von verschiedenen Bakterienstämmen und die Überwucherung der Mukosa in Magen- und Dünndarm. (Thorens, 1996) So wird die Resorption von Vitaminen, Spurenelementen und Makronutrienten gehemmt. (Saltzmann, 1994) Bakterien dekonjugieren Gallensäuren und vermindern so die Fettresorption. Außerdem ernähren sie sich selbst von Makronutrienten. Das Epithel wird direkt geschädigt und es findet eine verminderte Resorption statt. (Evenepoel, 2001) Zudem wird die Salzsäure für die Abspaltung der Spurenelemente und Mineralstoffe von Proteinen benötigt, damit diese resorbiert werden können. 38 Die Säureregulation: Gastrin reguliert über die Freisetzung von Histamin aus den Enterochromaffin-likeCells (ECL) der Magenmukosa die Magensäurefreisetzung. Nach Ausschüttung des Histamins über peptiderge und vagale Mechanismen gelangt es an die Parietalzellen der Corpusmukosa und stimuliert die HCL-Sekretion.Gastrin wird in den G-Zellen des Antrums produziert. Die Sekretion wird durch den intraluminalen pH-Wert, die Magendehnung und die Nahrung bestimmt. (Höcker, 2002) Der normale pH-Wert des Magens liegt bei 1-1,5. Eine chronisch-atrophische Gastritis oder die Einnahme von PPI, den effektivsten Medikamenten zur Hemmung der Magensäuresekretion, führt zu einer Hypergastrinämie, welche durch eine vermehrte gastrale Histaminsynthese bedingt wird. (Chen, 1994 und Cattan, 1989) In einer Cross-Over-Studie mit gesunden Probanden, in der zu einer hohen LT4Dosis (4µg/kg KG) die Versuchsgruppe PPI einnahm, die Kontrollgruppe nicht, konnten keine Veränderungen in der LT4-Resorption gezeigt werden. Es wurden jedoch ebenfalls als Zeichen eines erhöhten Magen-pHs bei allen Probanden erhöhte Nüchtern-Gastrinspiegel im Blut gemessen. Allerdings könnten die Ergebnisse durch die nicht schilddrüsenkranken Patienten beeinflusst sein. (Dietrich, 2006) Es fanden sich ähnliche Ergebnisse bei einer weiteren Studie mit 30 Probanden, die den Einfluss von einmaliger Ezetimib-Einnahme oder einwöchiger Famotidin- oder Esomeprazoleinnahme auf die LT4-Resorption testete. Es zeigten sich keine signifikanten Schwankungen des Gesamt-T3, -T4 oder des fT4-Spiegels. (Ananthakrishnan, 2008) Die Studien stützen die Hypothese, dass Magensäure höchstwahrscheinlich keine Rolle für die LT4-Resorption spielt. Diese Ansicht wird durch die Tatsache gestützt, dass LT4 in Jejunum und Ileum resorbiert wird und nicht am Hauptwirkungsort der Magensäure, nämlich dem Magen. Widersprüchliche Daten zum Einfluss von PPI auf die LT4-Resorption fanden Centanni und Mitarbeiter. Sie untersuchten Patienten, die wegen einer Refluxösophagitis PPI einnahmen. Es stellte sich heraus, dass der TSH-Spiegel 39 unter PPI-Therapie anstieg und höhere LT4-Dosen benötigt wurden um den TSHSpiegel niedrig zu halten. (Centanni, 2006) Ähnliche Ergebnisse brachten Sachmechi et al hervor: nach 6 Monaten LT4 und Lansoprazol kam es zu einem signifikanten TSH-Anstieg. (Sachmechi 2007) 4.5 Einfluss der Magensäure auf die Resorption von Levothyroxin Mittlerweile gibt es einige Studien, die die Resorption von LT4 in Abhängigkeit der Magensäure untersuchten. Allerdings wurden hier unterschiedliche Ergebnisse hervorgebracht: Eine Studie von Brisseau zeigte einen nicht signifikanten, sehr geringen Einfluss der Magensäure auf die Resorption von LT4. (Brisseau, 2007) Im Gegensatz dazu zeigte die Studie von Centanni et al, dass 22-34 % der Probanden mit einer Knotenstruma einen erhöhten Bedarf an LT4 hatten, wenn sie zusätzlich an einer Gastritis erkrankt waren (Der Ziel-TSH-Bereich lag bei 0,05 – 2,0 mU/l). Zusätzlich wurden 10 Patienten mit einer hypothyreoten Knotenstruma und einer Refluxösophagitis unter PPI-Einnahme und LT4 untersucht. Alle wiesen einen Anstieg des TSH-Spiegels auf, der erst nach Anpassung der LT4-Dosis (Erhöhung um 37%) wieder sank. Die Autoren kamen zu dem Schluss, dass die regelrechte Resorption von LT4 von einer regelrechten Magensäuresekretion abhängig ist. (Centanni, 2006) HP verhindert die Freisetzung von Zytokinen und die Produktion von Fettsäuren, die die H+/K+ ATPase-Aktivität hemmen und so das Feedback zwischen Gastrin und der Säuresekretion stören. Somit wird die Mukosa geschädigt und Ammoniak produziert. Diese Mechanismen erklären den Effekt der HP-Gastritis und der Typ-A-Gastritis auf die tägliche LT4-Einnahme.(Centanni 2006) Probanden von Centanni et al litten an einer Entzündung des oberen Gastrointestinaltrakts, so dass die verminderte Resorption auch auf die Entzündung an sich zurückzuführen sein könnte, wie Hays bereits 1988 untersuchte. (Hays, 1988) Im Vergleich dazu zeigte die Studie von Brisseau mit gesunden Probanden nämlich keine bedeutende Interaktion zwischen der Resorption von LT4 und PPI. 40 Checchi und Mitarbeiter untersuchten 391 Patienten mit einer Autoimmunthyreoiditis auf das Vorliegen von PCA. Bei 155 Probanden (39,6%) konnten diese nachgewiesen werden. Es konnte gezeigt werden, dass bei Patienten mit erhöhten PCA die täglich benötigte LT4-Dosis signifikant höher war (1,24+/- 0,4µg/ kg) als die Dosis bei Patienten ohne PCA (1,06 +/- 0,36 µg/kg). Außerdem fanden sie heraus, dass bei Patienten mit nachgewiesener Gastritis die Dosis höher lag (1,52 +/0,4µg/kg) als bei denen mit nur nachgewiesenen PCA (1,15 +/- 0,33 µg/kg). Erhöhte PCA-Spiegel gingen zudem mit erhöhten LT4-Dosen einher. (Checchi, 2008) Centanni et al untersuchten in einer vorausgegangenen Studie 62 Patienten mit einer Autoimmunthyreoiditis auf das Vorliegen einer Typ-A-Gastritis. Hierzu wurde bei allen Patienten der Gastrinspiegel bestimmt, bei Patienten mit einer Hypergastrinämie erfolgte eine Gastroskopie mit Biopsieentnahme. Bei 32% (22 Studienteilnehmer) ließ sich eine Typ-A-Gastritis nachweisen. Bei lediglich 15 der 22 der Studienteilnehmer konnten positive PCA nachgewiesen werden. (Centanni, 1999) Eine aktuelle Studie von Garcia et al zeigt, dass bei 20% der Patienten mit einer Autoimmunthyreoiditis positive PCA nachweisbar sind und dass nachweisbare SDAK das Risiko für positive PCA erhöhen. (Garcia, 2010) Zusammenfassend werden bei Autoimmunthyreoiditiden gehäuft Typ-A-Gastritiden diagnostiziert. 41 5. Zusammenfassung Schilddrüsenhormone gehören zu den meist verschriebenen Medikamenten. Sie weisen eine sehr geringe therapeutische Breite auf und das Therapiemonitoring ist teuer. Deshalb wird viel Aufmerksamkeit auf die Resorption dieser Medikamente gerichtet. In unserer retrospektiven Querschnittstudie wurden insgesamt 268 Patienten eingeschlossen. Bei 26 Patienten (Gruppe B) handelte es sich um Patienten mit einer Vollsubstitution von LT4 und gleichzeitig vorliegender intestinaler Inflammation, bei 242 Patienten (Gruppe A) handelte es sich um Patienten mit einer Vollsubstitution von LT4, jedoch ohne das Vorliegen einer intestinalen Inflammation. Wir konnten zeigen, dass die Gruppe mit einer Schilddrüsenerkrankung und einer Typ-A-Gastritis durchschnittlich 0,199 µg Levothyroxin pro kg Körpergewicht am Tag mehr einnahm als die Referenzgruppe um eine Euthyreose zu erreichen. Ebenso konnten wir zeigen, dass diese Gruppe, bezogen auf die Körperoberfläche, 1,981 µg/m2 Levothyroxin täglich mehr einnahm als die Referenzgruppe. Beide Tests waren mit einem p-Wert von >0,05 nicht signifikant. Es scheint wahrscheinlich, dass beim Vorliegen einer Autoimmungastritis täglich mehr Levothyroxin eingenommen werden muss, um eine Euthyreose zu erreichen. Unsere Ergebnisse könnten darauf hinweisen, dass der Magen-pH doch eine wichtige Rolle in der Resorption der SD-Hormone spielt. Eine effektive Levothyroxin-Substitution ist bei einer geringen therapeutischen Breite bei Patienten mit intestinaler Inflammation offenbar schwieriger. 42 6. Literaturverzeichnis 1. Ananthakrishnan S, Braverman LE, Levin RM, Magnani B, Pearce EN: The effect of Famotidine, Esomeprazole and Ezetimib on Levothyroxine Absorption. Thyroid 18: 493-498 (2008) 2. Arafah BM: Increased need for thyroxine treatment in women with hypothyreoidism during estrogen therapy. N Engl J Med 344:1743-1749 (2001) 3. Benvenga S, Bartolone L, Pappalardo MA, Russo A, Lapa D, Giorgianni G, Saraceno G, Trimarchi F: Altered intestinal absorption of L-thyroxine caused by coffee. Thyroid: 18:293-301 (2008) 4. Bolk N, Visser TJ, Nijman J, Jongoste IJ, Tijssen JG, Berghout A: Effects of evening vs morning levothytoxine intake: a randomized double-blind crossover trial: Arch Intern Med: 170:1996-2003 (2010) 5. Brisseau KN: Einfluss einer Protonenpumpenhemmung auf die esorption von oral verabreichten Schilddrüsenhormonpr paraten. Med. Dissertation, Universität Ulm (2007) 6. Campbell NR, Hasinoff BB, Stalts H, Rao B, Wong NCW: Ferrous sulfate reduces thyroxine efficacy in patients with hypothyroidism. Ann. Intern. Med. 117: 1010-1012 (1992) 7. Canaris GJ, Manowitz NR, Mayor G, Ridgway EC: The Colorado Thyroid Disease Prevalence Study. Arch Intern Med 160: 526-534 (2000) 8. Cattan D, Roucayrol AM, Launay JM, Callebert J, Charasz N, Nurit Y, Belaiche J, Kalifat R: Circulating gastrin, endocrine cells, histamine content, and histidine decarboxylase activity in atrophic gastritis. Gastroenterol 97: 586-596 (1989) 9. Centanni M, Gargano L, Canettieri g, Viceconti N, Franchi A, Delle Fave G, Annibale B: Thyroxine in Goiter, Helicobacter pylori infection, and chronic gastritis. N Engl J Med 354: 1787-1795 (2006) 10. Centanni M, ;Marignani M, Gargano L, Corleto VD, Casini A, Delle Fave G, Andreoli M, Annibale B: Atrophic Body Gastritis in Patients With Autoimmune Thyroid Disease. Arch Intern Med 159: 1726-1730 (1999) 11. Centanni M, Santaguida M, Gargano L: Malabsorption of T4: New insights on oral levothyroxine treatment. Hot Thyroidology (2007) 43 12. Checchi S, Montanaro A, Pasqui L, Ciuoli C, De Palo V, Chiappetta MC, Pacini F: L-thyroxine requirement in patients with autoimmune hypothyroidism and parietal cell antibodies. J Clin Endocrinol Metab 93: 465-469 (2008) 13. Chen D, Monstein HJ, Nylander AG, Zhao CM, Sundler F, Hakanson R: Acute responses of rat stomach enterochromaffin-like cells to gastrin: secretory activation and adaptation. Gastroenterol 107: 18-27 (1994) 14. Choe W, Hays MT: Absorption of oral thyroxine. The endocrinologist 5: 222228 (Mai 1995) 15. Costagliola S, Morgenthaler NG, Hoermann R, Badenhoop K, Struck J, Freitag D, Poertl S, Weglöhner W, Hollidt JM, Quadbeck B, Dumont JE, Schumm-Draeger PM, Bergmann A, Mann K, Vassart G, Usadel KH: Second generation assay for TSH-receptor antibodies has superior diagnostic sensitivity for Graves´ disease. J Clin Endocrinol Metab 84: 90-97 (1999) 16. Dietrich JW, Böhm BO: Thyroxin in Goiter, H. pylori Infection and Gastritis. New Engl J Med: 35: 1177 (2006) 17. Dietrich JW, Gieselbrecht K, Holl RW, Boehm BO: Absorption kinetics of levothyroxine is not altered by proton-pump inhibitor therapy. Horm Metab Res 38: 57-59 (2006) 18. Dietrich JW, Brisseau K, Boehm BO: Absorption, transport and bioavailability of iodothyronines. Dtsch med Wochenschr 133: 1644-1648 (2008) 19. DuBois D, DuBois EF: A formula to estimate the approximate surface area if height and weight be known. Arch Intern Med 17: 863-871 (1916) 20. d’Esteve-Bonetti L, Bennet AP, Malet D, Hoff M, Louvet JP, Caron P: gluten-induced enteropathy (coeliac disease) revealed by resistence to treatment with levothyroxine and alfacalcidol in a sixty-eight-year-old patient: a case report. Thyroid 12: 633-636 (2002) 21. Evenepoel P: Alteration in digestion and absorption of nutrients during profound acid suppression. Best Pract Res Clin Gastroenterol 15: 539-551 (2001) 22. Feldkamp, J: Schilddrüse. In: Klinische Endokrinologie und Stoffwechsel; Nawroth P. und Ziegler R. (Hrsg.) 1. Auflage, Springer Berlin: 114-119 (2000) 44 23. Feldt-Rasmussen U, Rasmussen ÅK: Thyroid Hormone Transport and Actions. In: E. KG, Rivkees SA, W. K, eds. Diseases of the Thyroid in Childhood and Adolescence 11. Karger Basel S.80-103 (2007) 24. Fish LH, Schwartz HL, Cavanaugh J, Steffes MW, Bantle JP, Oppenheimer JH: Replacement dose, Metabolism and bioavailability of levothyroxine in the treatment of hypothyreoidism. N Engl J Med 316: 764-770 (1987) 25. Font L, Lew LQ, Kupferman F, Rapaport S: Incidence of congenital hypothyroidism and congenital adrenal hyperplasia at Flushing Hospital Medical Center. Bol Asoc Med P R. 99: 13-7 (2007) 26. Fox CS, Pencin MJ, D’Agostino RB, Murabito JM: Relations of Thyroid Function to Body Weight. Arch Intern Med 168: 587-592 (2008) 27. Friesema EC, Jansen J, Visser TJ: Thyroid hormone transporters. Biochem Soc Trans 33: 228-32 (2005) 28. Garcia Garcia B, Gimeno Orna JA, aguillo Gutierrez E, Altemir Trallero J, Cabrejas Gomez C, Ilundain Gonzalez A, Lazaro Puente F, Ocon Breton J, Faure Nogueras E: Prevalence and predictive factors of parietal cell antibody positivity in autoimmune thyroid disease: Endocrinol Nutr. 57: 49-53 (2010) 29. Gärtner R, Reincke M: Schilddrüse. In: Siegenthaler W, Blum HE (Hrsg): klinische Pathophysiologie. 9.Auflage, S.275 (2006) 30. Gärtner R, Reincke M: Substitution of thyroid hormones, Internist (Berlin), 49: 538, 540-4 (2008) 31. Grinspoon SK, Daniels GH: Case report: increased levothyroxine requirement in a patient with cryptic celiac-sprue disease: Endocr Pract.1: 8890 (1995) 32. Havrankova J, Lahaie R: Levothyroxine binding by sucralfate. Ann Intern Med 117: 445-446 (1992) 33. Hays MT: Absorption of oral thyroxine in man. J Clin Endocrinol Metab 28: 749-756 (1968) 34. Hays MT: Thyroid hormone and the gut. Endocrine Research 14: 203-24 (1988) 35. Hays MT: Localization of human thyroxine absorption.Thyroid 1: 241-248 (1991) 45 36. Helfland M, Capro LM: Monitoring therapy in patients taking levothyroxine. Ann Intern Med; 113: 450-454 (1990) 37. Hennemann G, Docter R, Friesema EC, de Jong M, Krenning EP, Visser TJ: Plasma membrane transport of thyroid hormones and its role in thyroid hormone metabolism and bioavailability. Endocr Rev 22: 451-76 (2001) 38. Hennessey JV, Evaul JE, Tseng YC, Burman KD,Wartofsky L: L-thyroxine dosage: a reevaluation of therapy with contemporary preparations. Ann Intern Med 105: 11-15 (1986) 39. Herold, G: Innere Medizin, Köln (2010) 40. Höcker M: Differentielle Regulation von Schlüsselgenen der gastralen Säuresekretion durch Gastrin, oxidativen Stress und Helicobacter pylori: Identifikation und Transkriptionsfaktoren Charakterisierung und regulatorischer beteiligter Signalwege, Promotorelemente. Berlin, Humboldt-Univ., Medizinische Fakultät, Habilitationsschrift (2002) 41. Janssen OE: Schilddrüsenhormonwirkung. In: Schilddrüsenerkrankungen. Roland Gärnter (Hrsg.): Wissenschaftliche Verlagsgesellschaft Stuttgart, S. 52-67 (2003) 42. Jenkins RC, Weetman AP: Disease associations with autoimmune thyroid disease. Thyroid. 12: 977-988 (2002) 43. Kabadi UM: Optimal Daily Levothyroxine Dose in Primary Hypothyroidism, Arch Intern Med 149: 2209-2212 (1989) 44. Karczewska K, Lukas W, Lukasik M, Kasner J, Dyduch A, Sliwa F: Serum triiodthyronine and thyroxine levels in children with celiac disease: Poly Tyg Lek 47: 86-88 (1992) 45. Kaufmann SK: Establishment of a Real -Time - PCR assay of thyroglobulin mRNA in peripheral blood. (2006) 46. Klein I, Danzi S: Evaluation of the therapeutic efficacy of different levothyroxine preparations in the treatment of human thyroid disease. Thyroid 13: 1127-1132 (2003) 47. Köhrle J, Schmutzler C: Jodstoffwechsel, SD-Hormonsynthese und sekretion. In: Roland Gärtner (Hrsg.): SD-Erkrankungen. Wissenschaftliche Verlagsgesellschaft Stuttgart, S. 16-51 (2003) 48. Lahner E, Annibale B: Pernicious anemia: new insights from a gastroenterological point of view. World J Gastroenterol 15: 5121-5128 (2009) 46 49. Lahner E, Annibale B, Delle Fave G: systematic review: Helicobacter pylori infection and impaired drug absorption. Aliment Pharmacol Ther 29: 379-386 (2009) 50. Lapcevic M: Autoimmune thyroid disease and associated diseases. Srp Arh Celok Lek 133 vol 1: 84-7 (2005) 51. Lauritano EC, Bilotta AL, Gabrielli M, Scarpellini E, Lupascu A, Laginestra A, Novi M, Sottili S, Serricchio M, Cammarota G, Gasbarrini G, Pontecorvi A, Gasbarrini A: Association between Hypothyroidism and Small Intestinal Bacterial Overgrowth: J Clin Endocrinol Metab. 92: 4180-4184 (2007) 52. Layer P, Rosein U: Autoimmungastritis. In: Praktische Gastroenterologie, 3. Auflage, Urban & Fischer, Elsevier, München Jena, S.188-189 (2008) 53. Lehnert H: Rationelle Diagnostik und Therapie in Endokrinologie, Diabetologie und Stoffwechsel. Deutsche Gesellschaft für Endokrinologie (Hrsg), 3. Auflage, Thieme-Verlag Stuttgart (2009) 54. Levenson DI, Bockmann RS: A review of calcium preparations. Nutr Rev: 52: 221-32 (1994) 55. Liel Y, Sperber A, Shany S: Nonspecific Intestinal Absorption of Levothyroxine by Aluminium Hydroxide. Am J Med 97: 363-365 (1994) 56. Mandel SJ, Brent GA, Larsen PR: Levothyroxine therapy in patients with thyroid disease. Ann Intern Med;119: 492-502 (1993) 57. Mayant NB: Enterohepatic circulation of thyroxine in humans. Clin sci 15: 551555 (1956) 58. Melchert H-U, Görsch Gesundheitsberichtserstattung B, Thierfelder des Bundes: W: Beiträge SD-Hormone und zur SD- Medikamente bei Probanden in den nationalen Gesundheitssurveys, RobertKoch-Institut Berlin (2001) 59. Mersebach, H. Rasmussen AK, Kirkegaard L, Feldt-Rasmussen U: Intestinal Absorption of Levothyroxine by Antacids and Laxantives: Case Stories and in vitro Experiments. Pharmacology & Toxicology, 84: 107-109 (1999) 60. Rosenbaum RL, Barzel US: Clinical Hypothyroidism in the elderly: a preventable disorder? J Am Geriatr Soc 29: 221-223 (1981) 47 61. Sachmechi I, Reich DM, Aninyei M; Wibowo F, Gupta G, Kim PJ: Effect of proton-pump inhibitors on serum thyroid-stimulating hormone level in euthyroid patients treated with levothyroxine for hypothyroidism. Endocr Pract 13: 345349 (2007) 62. Saltzmann JR, Kowdley KV, PEdrosa MC, Sepe T, Golner B, Perrone G, Russell RM: Bacterial overgrowth without clinical malabsorption in elderly hypochlorhydric subjects. Gastroenterology 106: 615-623 (1994) 63. Sawin CT: The Heritage of Dr. Hakaru Hashimoto, Endokrine Journal: 49: 399-403 (2002) 64. Seppel T, Rose F, Schlaghecke R: chronic intestinal Giardiasis with isolated levothyroxine malabsorption as reason for severe hypothyroidism– Implications for localization of thyroid hormone absorption in the gut. Exp Clin Endocrinol Diabetes: 104: 180-182 (1996) 65. Sherman SI, Tielens ET, Ladenson PW: Sucralfate causes malabsorption of L-Thyroxine. Am J Med 96: 531-535 (1994) 66. Singh N, Singh PN, Hershman JM: Effect of Calcium Carbonate on the Absorption of Levothyroxine. J Am Med Assoc 283: 2822-2824 (2000) 67. Siraj ES, Gupta MK, Sethu S, Reddy K: Raloxifene causing malabsorption of levothyroxine. Arch Intern Med 163: 1367-1369 (2003) 68. Sperber, AD; Liel, Y: Evidence for interference with the intestinal absorption of Levothyroxine Sodium by Aluminium Hydroxide. Arch Intern Med 152: 183184 (1992) 69. Stolte M, Bethge B, Ritter M, Lauer F, Eidt H: Praxis der GastritisKlassifikation. Endoskopie Heute 4: 228-230 (1990) 70. Taurog A: Hormone Synthesis and Secretion. In: Werner and Ingbar´s The Thyroid. Braverman L, Utiger R (Hrsg.), Lipincott-Raven, Philadelphia, New York, 7. Auflage, S. 47-81 (1996) 71. Thorens J, Froehlich F, Schwizer W, Sagara E, Bille J, Gyr K, Duroux P, Niclet M, Pignatelli B, Blum AL, Gonvers JJ, Fried M: Bacterial overgrowth during treatment with omeprazole compared with cimetidine: A prospective randomised double blind study. Gut 39: 54-59 (1996) 72. Wartofsky L: Levothyroxine: therapeutic use and regulatory issues related to bioequivalence. Expert Opin Pharmacother 3: 727-732 (2002) 48 73. Wenzel KW, Kirschsieper HE: Aspects of the absorption of oral L-thyroxine in normal man. Metabolism. 26: 1-8. (1977) 74. Wiersinga WM: Thyroid hormone replacement therapy. Horm Res: 56 Suppl 1: 74-81 (2000) 75. Yuksel O, Tatlicioglu E, Poyraz A, Sahin T, Pasaoglu H, Ekinci O, Salman B, Yilmaz U: effects of thyroid hormone on the adaption in short bowel syndrome. J Surg Res 155: 116-124 (2009) 49 7. Anhang Tabellenverzeichnis Tabelle 1: Unterschiede zw. Typ-A und B-Gastritis (MALFERTHEINER, 1988) ......... 9 Tabelle 2: Ein- und Ausschlusskriterien .................................................................... 14 Tabelle 3: Homogenität der Studiengruppen A und B .............................................. 19 Tabelle 4: Altersverteilung in Gruppe A und Gruppe B ............................................. 19 Tabelle 5: Gewichtsverteilung in beiden Gruppen .................................................... 22 Tabelle 6: TSH-Verteilung in beiden Gruppen .......................................................... 24 Tabelle 7: LT4-Dosis-Verteilung in beiden Gruppen ................................................. 26 Tabelle 8: LT4-Dosis bezogen auf das Gewicht in beiden Gruppen ......................... 27 Tabelle 9: Verteilung LT4-Dosis auf die KOF in beiden Gruppen ............................. 29 Tabelle 10: Einflussfaktoren auf die Hormonresorption ............................................ 36 Abbildungsverzeichnis Abbildung 1: Die Wirkungen der Schilddrüsenhormone auf die Zielorgane ................ 8 Abbildung 2: prozentuale Altersverteilung in beiden Gruppen .................................. 20 Abbildung 3: Altersverteilung in den Gruppen A und B ............................................. 21 Abbildung 4: Punktewolke der Altersverteilung in Gruppe A und Gruppe B ............. 21 Abbildung 5: prozentuale Verteilung des Gewichts in Gruppe A und Gruppe B ...... 22 Abbildung 6: Gewichtsverteilung in Gruppe A und B ................................................ 23 Abbildung 7: Punktewolke zur Gewichtsverteilung in Gruppe A und Gruppe B ........ 23 Abbildung 8: prozentuale Verteilung TSH in Gruppe A und Gruppe B ..................... 24 Abbildung 9: TSH-Verteilung in beiden Gruppen ...................................................... 25 Abbildung 10: Punktewolke zur Verteilung des TSH in Gruppe A und Gruppe B ..... 25 Abbildung 11: prozentuale Verteilung der täglichen LT4-Dosis in Gruppe A und Gruppe B .................................................................................................................. 26 Abbildung 12: LT4-Dosis-Verteilung in beiden Gruppen ........................................... 27 Abbildung 13: prozentuale Verteilung der LT4-Tagesdosis pro kg KG in Gruppe A und in Gruppe B ....................................................................................................... 28 Abbildung 14: LT4-Tagesdosis pro kg KG in beiden Gruppen.................................. 28 Abbildung 15: Punktewolke für die Verteilung der Tagesdosis in Abhängigkeit des Körpergewichts für Gruppe A und Gruppe B ............................................................ 29 50 Abbildung 16: prozentuale Verteilung LT4-Tagesdosis bezogen auf die KOF in Gruppe A und Gruppe B ........................................................................................... 30 Abbildung 17: LT4-Tagesdosis bezogen auf die KOF in beiden Gruppen ................ 30 Abbildung 18: Punktewolke für die Verteilung der Tagesdosis in Abhängigkeit der Körperoberfläche für Gruppe A und Gruppe B ......................................................... 31 51 8. Danksagung Mein besonderer Dank gilt Herrn Professor Dr. Böhm für die Überlassung des Promotionsthemas, seine kontinuierliche Betreuung und seine freundliche Unterstützung bei der Ausarbeitung. Sämtliche Fragen wurden stets ausführlich und schnell beantwortet. Ich danke Frau Dr. Rosinger für das Erstellen der Datenbank und ihre Geduld bei der Einweisung. Ebenso danke ich Frau Dr. B. Danner für Ihre Hilfe bei der statistischen Auswertung. Meinen Eltern danke ich von Herzen, da ohne sie ein Studium nicht möglich gewesen wäre. Sie haben immer an mich geglaubt und mich jederzeit bei allem unterstützt. Außerdem möchte ich mich bei meinen Freunden bedanken, die mich nicht nur tatkräftig während meines Studiums und der Doktorarbeit unterstützt haben, sondern mich stets aufbauten, antrieben und für ausreichend Abwechslung sorgten. 52 9. Curriculum vitae Der Lebenslauf wurde aus Gründen des Datenschutzes in der Elektronischen Version entfernt. 53 54 55