Akute virale Gastroenteritis
Werbung

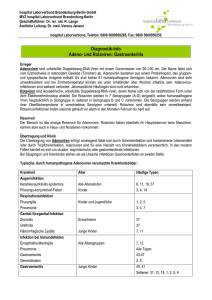
Infektionen im Gastrointestinaltrakt Akute virale Gastroenteritis M. Günther, O. Wichmann, T. Jelinek Zusammenfassung Akute Gastroenteritiden gehören zu den häufigsten Erkrankungen des Menschen. Oft sind es virale Erreger, die für Magen-DarmInfekte verantwortlich sind. Zu der Hauptrisikogruppe gehören vor allem Kinder, aber auch ältere Menschen und Immunsupprimierte. Seitdem das Norwalk-Agens erstmalig als virale Ursache einer Gastroenteritis nachgewiesen wurde, sind eine Vielzahl von Viren entdeckt worden, die beim Menschen Durchfallerkrankungen auslösen können. Vor allem Rotaviren, die häufigste Ursache heftiger Diarrhöe bei Kindern unter fünf Jahren, sind von globaler Bedeutung. Weitere bedeutende Erreger sind humane Caliciviren, enterische Adenoviren und Astroviren. Auch andere, zum Teil noch wenig bekannte Erreger aus der Familie der Coronaviren sowie Toroviren und Picobirnaviren werden zunehmend häufig als Auslöser akuter Gastroenteritiden nachgewiesen. In den vergangenen Jahren wurde eine große Anzahl diagnostischer Tests etabliert. Enzymimmunoassays und Untersuchungen mittels PolymeraseKettenreaktions-Technik (PCR) erlauben heute den spezifischen Nachweis zahlreicher Viren und Virussubtypen sowie deren exakte Klassifizierung. Für die Zukunft wird die Entwicklung sicherer und hocheffektiver Impfstoffe gegen Rotaviren erwartet. Diese Impfstoffe könnten dazu beitragen, die Morbidität und Mortalität durch schwere akute virale Gastroenteritiden weltweit zu senken. Schlüsselwörter Akute Diarrhöe, virale Gastroenteritis Summary Acute viral gastroenteritis Gastroenteritis is one of the most important diseases in humans. Viruses are a very common cause of this disease, especially in children, but also in elderly and immunocompromised people. The first virus recognized as causal agent was the norwalkvirus. Since then, an increasing number of viruses causing acute gastroenteritis have been detected. Rotaviruses are the most common cause of gastroenteric disease in children under 5 years of age. Human caliciviruses, enteric adenoviruses and astroviruses are also important etiological factors of acute gastroenteritis. Other viruses, such as coronavirus, torovirus and picobirnavirus are increasingly detected as causative factors of diarrhea. In recent years new diagnostic tests, mainly enzyme-linked immunoassays and polymerase-chain-reaction (PCR) techniques, allow a specific detection and classification of viruses. The future deve- 380 lopment of safe and highly effective vaccines against rotaviruses is exspected and may reduce worldwide morbidity and mortality from severe acute viral gastroenteritis. Key words Gastroenteritis, norwalkvirus, rotaviruses, causal agents, new diagnostic tests, vaccines Einleitung Die akute Gastroenteritis ist eine der häufigsten Erkrankungen des Menschen. Die Hauptrisikogruppe sind Kinder unter fünf Jahren mit weltweit schätzungsweise 700 Millionen Fällen jährlich. Insbesondere in ärmeren Ländern sind durch Gastroenteritiden bedingte Todesfälle bei Kindern nicht selten. Schätzungen zufolge sterben jährlich zwischen 3 und 5 Millionen Menschen an den Folgen einer akuten Gastroenteritis. In den Industrieländern zeigt sich die Bedeutung von akuten Darminfektionen weniger in einer hohen Mortalität als in einer hohen Zahl von Erkrankungen, die eine stationäre Einweisung erforderlich machen. Seit den 40er Jahren des vorigen Jahrhunderts wurden Viren als eine mögliche Ursache akuter Gastroenteritiden vermutet. Jedoch erst im Jahr 1972 gelang Kapikian (1) bei einer epidemisch aufgetretenden Diarrhöe der Nachweis von Viren (Norwalk-Agens) im Stuhl von Patienten. Im Jahr 1973 wurden von Bishop und Mitarbeitern (2) elektronenmikroskopisch Viruspartikel (Rotaviren) in der Duodenalschleimhaut von an akuter Gastroenteritis erkrankten Säuglingen nachgewiesen. Middleton und Kollegen (3) konnten 1974 zeigen, dass Patienten Antikörper gegen die neu entdeckten Viren bildeten; auch der Nachweis der Infektiosität durch Infektion eines Freiwilligen konnte von diesen Autoren geführt werden. Enterische Adenoviren und Astroviren Matthias Günther Institut für Tropenmedizin Spandauer Damm 130, D-14050 Berlin E-Mail: [email protected] Z. Allg. Med. 2003; 79: 380–383. © Hippokrates Verlag in MVS Medizinverlage Stuttgart GmbH & Co. KG, Stuttgart 2003 Infektionen im Gastrointestinaltrakt wurden 1975 im Stuhl von Säuglingen mit akuter Diarrhöe nachgewiesen. Seit dieser Zeit wird eine kontinuierlich steigende Anzahl neuartiger Viren identifiziert, die als Auslöser für virale Gastroenteritiden in Frage kommen und Gegenstand zahlreicher Studien sind. Tabelle 1: Erreger viraler Gastroenteritiden Häufige virale Gastroenteritiserreger Seltenere virale Gastroenteritiserreger Rotavirusgruppe A, B, C Picornavirus Adenovirus Typen 40, 41 Torovirus Astrovirus Serotypen 1–8 Coronavirus Norwalk-ähnliche Caliciviren Cytomegalievirus Sapporo-ähnliche Caliciviren HIV Picobirnaviren Aichivirus* Parvo-ähnliche Viren * Die Bezeichnung »Aichivirus« beinhaltet verschiedene Erreger aus der Familie der Calici- und Picornaviren Rotaviren Bei Rotaviren handelt es sich um nicht umhüllte, doppelsträngige RNA-Viren aus der Familie der Reoviridae. Charakteristisch ist ihre icosahedrische Struktur bei einem Durchmesser von 70 nm. Nach Negativkontrastierung im elektronenmikroskopischen Bild ähnelt das Virion einem Rad mit großer Nabe und kurzen Speichen, woraus sich auch die Bezeichnung Rotavirus ableitet (rota, lat. Rad). Es existieren sieben Gruppen (A–G), jedoch nur die Rotaviren der Gruppen A, B und C sind humanpathogen. Eines von zwei Glykoproteinen der Oberfläche bestimmt die »G-Typ-Spezifität«. Es existieren 15 verschiedene G-Typen humanpathogener Rotaviren, die Typen G1, G2, G3 und G4 dominieren weltweit. Die einzig bekannte Infektionsquelle ist der Mensch. Die Übertragung erfolgt in erster Linie fäkal-oral, jedoch werden auch andere Infektionsrouten (z. B. über Aerosol) vermutet. Sporadische Fälle sind während des ganzen Jahres möglich, die Mehrzahl der Erkrankungen in den gemäßigten Breiten tritt jedoch im Winter und Frühjahr auf. Epidemisches Auftreten wird vor allem in Kindergärten und Kinderkliniken beobachtet. Die Inkubationszeit beträgt meist 48–72 Stunden, kann jedoch zwischen einem und vier Tagen variieren. Die Infektion älterer Personen verläuft in der Regel asymptomatisch. Auch Neugeborene erkranken im Allgemeinen nicht. Die höchste Suszeptibilität für eine Rotavirus-Infektion besteht im Alter zwischen 6 und 24 Monaten. Bei den klinisch relevanten Infektionen im Kindesalter finden sich massive Durchfälle, Erbrechen und Fieber. Die Rotaviren besitzen einen ausgeprägten Tropismus für die Enterozyten der Darmschleimhaut und führen zu einer Atrophie der Mikrovilli des Dünndarms. Dem gegenüber steht eine sekundäre Hyperplasie der Krypten, was zu einem Überwiegen der sekretorischen gegenüber den resorptiven Zellen führt (4). Auch eine Stimulation des enteralen Nervensystems begünstigt die Sekretion von Wasser und Elektrolyten in das Darmlumen. Symptome einer Rotavirus-Infektion bestehen selten länger als vier bis sechs Tage. Humane Caliciviren Es handelt sich um 27–40 nm große, nicht umhüllte Viren mit Einzelstrang-RNA. Zur Familie der humanpathogenen Caliciviren gehört das klassische Norwalkvirus, die Gruppe der Norwalk-ähnlichen Viren (neuere Bezeichnung: Noroviren) sowie die Sapporo-ähnlichen Viren (neuere Bezeichnung: Sapoviren). Die Viren der verschiedenen Gruppen unterscheiden sich in ihrer Größe. Innerhalb der einzelnen Gruppen wird eine große Anzahl morphologisch ähnlicher, aber genetisch abweichender Erreger (»Desert Storm-Virus«, »SouthhamptonVirus«, »Snow Mountain-Virus«, »Parkville-Virus« und andere) subsummiert. In der Elektronenmikroskopie zeigt die Oberfläche des Virions 32 tassenähnliche, nach außen gerichtete Vertiefungen (calyx, lat. Kelch). Infektionsquelle ist der erkrankte Mensch, der die Erreger mit dem Stuhl in großen Mengen ausscheidet. Ein Nachweis von Norwalkviren gelang auch im Erbrochenen (Übertragung durch Aerosol möglich!), nicht jedoch in den Nasopharyngealsekreten Erkrankter. Die Übertragung erfolgt zunächst indirekt über den Verzehr fäkal kontaminierter Lebensmittel. So sind oft verunreinigte Salate, Muscheln oder Krabben Ausgangspunkt von Epidemien. Für die direkte Weiterverbreitung von Mensch zu Mensch sind Schmierinfektionen von Bedeutung. Die Erreger sind weltweit verbreitet und verantwortlich für etwa 40 % der nicht-bakteriellen Gastroenteritiden (5). Ein wichtiges Merkmal der Norwalk-Gastroenteritis ist, dass Erkrankungen kaum in den ersten Lebensjahren vorkommen, sondern erst bei Jugendlichen und Erwachsenen auftreten (6). Typisch sind kleinere, lokal begrenzte Epidemien, zum Beispiel in Familien, Schulen oder Heimen sowie die Häufung der Erkrankung in der kalten Jahreszeit (»winter vomiting disease«). Die Inkubationszeit beträgt 10–72 Stunden. Die Erkrankung äußert sich in der typischen Diarrhöe, die jedoch seltener als bei Rotavirus-Infektionen mit Erbrechen, abdominellen Schmerzen und Fieber verbunden ist. Pathophysiologisch findet sich keine Schädigung des Darmepithels, jedoch eine Verringerung der intestinalen Mikrovilli. Z. Allg. Med. 2003; 79: 380–383. © Hippokrates Verlag in MVS Medizinverlage Stuttgart GmbH & Co. KG, Stuttgart 2003 381 Infektionen im Gastrointestinaltrakt Eine weitere Ursache für den Durchfall könnte die verzögerte und damit großlumigere Entleerung des Magens durch den Pförtner sein. Die Stühle sind wässrig, es finden sich keine Blut- oder Schleimbeimengungen. Häufiger wird eine Malabsorption von Fett und D-Xylose beobachtet (4). Zwar konnten in der jejunalen Schleimhaut IgA-Antikörper nachgewiesen werden, jedoch scheint die mukosale Immunität gegen Reinfektion nur etwa zwei Monate anzudauern. Enterale Adenoviren Adenoviren vom Typ 40 und 41, aber auch die Typen 12, 18 und 31 können Ursache von Gastroenteritiden sein. Es handelt sich um DNA-Viren ohne Hülle, die einen Durchmesser von etwa 80 nm aufweisen. Die Erreger kommen nur beim Menschen vor und werden von akut Erkrankten mit dem Stuhl ausgeschieden. Die Übertragung erfolgt fäkal-oral. Adenoviren können bei bis zu 12 % aller Stuhlproben von Kindern mit akuter Gastroenteritis nachgewiesen werden. Die Infektionen kommen ganzjährig vor und betreffen vorwiegend Säuglinge und Kleinkinder; bei Jugendlichen und Erwachsenen sind Erkrankungen seltener (8). Die Inkubationszeit beträgt fünf bis zehn Tage. Als Leitsymptom findet sich Diarrhöe, seltener Erbrechen und Fieber. Gelegentlich treten zusätzlich respiratorische Symptome auf. Die enterischen Adenoviren replizieren sich vorwiegend auf den Schleimhäuten des Gastrointestinaltraktes, jedoch ist auch eine Vermehrung auf den Schleimhäuten der Luftwege möglich. Im Bereich des Darmepithels vollzieht sich ein ähnlicher Pathomechanismus wie im Falle der Rotavirusinfektion: Es kommt zu einer Atrophie der Mikrovilli von Enterozyten bei gleichzeitiger kompensatorischer Hyperplasie der Krypten (4). Eine Dehydratation tritt im Krankheitsverlauf nur selten ein. Der Durchfall kann bis zu zehn Tage andauern. Astroviren Bei Astroviren handelt es sich um etwa 40 nm große icosahedrische einsträngige(+) RNA-Viren. In der Elektronenmikroskopie erscheinen sie bei hohen pH-Werten als sternförmige Partikel (astron, griech. Stern). Astroviren wurden hauptsächlich in den Stuhlfiltraten durchfallkranker Kinder und Erwachsener gefunden. Die Übertragung erfolgt wahrscheinlich in erster Linie durch Schmierinfektion. Astroviren können auch kleinere Gastroenteritis-Ausbrüche auslösen. Postinfektiöse Anstiege von Serumtitern sprechen für eine ätiologische 382 Beteiligung. Eine aktuelle Untersuchung fand Astroviren als die zweithäufigste Ursache (11,4 %) der akuten Gastroenteritis bei spanischen Kindern (7). Bei älteren Kindern und Erwachsenen lassen sich in etwa 75 % spezifische Antikörper nachweisen. Der Pathomechanismus beim Menschen ist noch ungeklärt, jedoch wurde im Tierexperiment ein entzündliches Infiltrat der Lamina propria nachgewiesen, welches eine osmotische Diarrhöe induzierte (1). Die sehr milde Durchfallsymptomatik der akut Erkrankten liefert jedoch nur sehr selten einen Grund zur Durchführung einer aufwändigen Diagnostik. Virale Gastroenteritis bei Immunsupprimierten Die bedeutendsten Erreger der schweren Gastroenteritis bei immunsupprimierten Patienten sind das Cytomegalie-Virus (CMV) und das Epstein-Barr-Virus (EBV). Betroffen sind meist Patienten im Vollbild AIDS sowie Organund Knochenmark-/Stammzell-Transplantierte. Seit der Einführung der modernen antiretroviralen Therapieschemata werden CMV-induzierte Diarrhöen auch bei AIDS-Patienten mit CD4(+) < 100/µl seltener beobachtet. Andere Viren, die HIV-assoziiert zu Gastroenteritiden führen können, sind insbesondere Astroviren, Picobirnaviren, Calici- und Adenoviren. Bei Kindern und Erwachsenen mit Gastroenteritis nach allogener Knochenmarktransplantation wurden mehrfach Astro- und Adenoviren nachgewiesen. In ähnlicher Weise wurde das Torovirus bei immunsupprimierten Kindern mit Durchfallerkrankung gefunden. Aufgrund neuerer Untersuchungen erscheint auch ein Träger- bzw. Ausscheiderstatus bei Personen mit Defekten in der angeborenen und erworbenen Immunität als möglich (8). Diagnostik Eine spezifische Diagnostik ist meist nicht erforderlich. Der klassische Weg zum Nachweis viraler Gastroenteritiserreger ist die Elektronenmikroskopie. Die Anzucht in der Zellkultur ist meist zu schwierig und langwierig. In denletztenJahren wurde eine größere Anzahl von Enzymimmunoassays etabliert, die einen Antigennachweis in Stuhlproben (Koproantigen-ELISA) erlauben. Antikörper werden ebenfalls mittels ELISA-Technik bestimmt. Auch PCR-Protokolle stehen für zahlreiche Erreger zur Verfügung, gehören jedoch nicht zur Routinediagnostik. Reverse-Transkriptase-PCRs werden insbesondere zum Nachweis und zur Genotypisierung humaner Caliciviren und Rotaviren der Gruppe A herangezogen (4). Z. Allg. Med. 2003; 79: 380–383. © Hippokrates Verlag in MVS Medizinverlage Stuttgart GmbH & Co. KG, Stuttgart 2003 Infektionen im Gastrointestinaltrakt Therapie Eine spezifische Therapie der viralen Gastroenteritiden existiert nicht. Die symptomatische Behandlung folgt den allgemeinen Richtlinien. Wie bei allen akuten Durchfallerkrankungen ist der rasche Ersatz von Flüssigkeit und Elektrolyten vorrangig. Je nach Grad der Dehydratation kommt man mit der oralen Zufuhr einer Glukose-Elektrolytlösung aus oder muss die Exsikkose mit einer parenteralen Gabe von Flüssigkeit/Glukose/Elektrolyten über einen venösen Dauertropf ausgleichen. Der orale Flüssigkeitsersatz erfolgt mit 3,5 g Natriumchlorid, 2,5 g Natriumbikarbonat (entspricht einem gestrichenen Teelöffel Backsoda), 1,5 g KCl (entspricht zwei Bananen oder einer Tasse frischen Orangensafts) und 20 g Glukose. Alle diese Bestandteile werden in einem Liter sauberem Trinkwasser aufgelöst. Von dieser Lösung erhalten Kinder bis zwei Jahre 50– 100 ml und Kinder zwischen dem zweiten und zehnten Lebensjahr 100–200 ml nach jedem Durchfall (9). Zum Teil ist die Korrektur einer Azidose erforderlich. Muttermilch und humanes Immunglobulin A können gegeben werden, um einem schweren Krankheitsverlauf bei Neugeborenen oder immunsupprimierten Kindern vorzubeugen. Im Falle von Rotavirus-Infektionen ist gelegentlich eine vorübergehende Disaccharidintoleranz infolge einer reduzierten Aktivität der intestinalen Disaccharidase zu beobachten. Dies sollte beim Nahrungsaufbau berücksichtigt werden. Je jünger der Patient ist und je schwerer die Erkrankung, umso eher sollte eine stationäre Behandlung erfolgen. Die Prognose ist unter adäquater medizinischer Betreuung sehr gut. Die wenigen tödlich verlaufenden Fälle, die in den Industriestaaten beschrieben wurden, kamen erst im Endstadium einer Dehydratation mit Schocksymptomatik in die Klinik. Prävention Durchfallkranke sollten den Besuch von Gemeindeeinrichtungen (Schulen, Heime, Kindergärten) meiden. In der Klinik ist eine relativ strenge Isolierung sinnvoll, um nosokomialen Infektionen vorzubeugen. Im Vordergrund der Hygienemaßnahmen bei Krankheitsausbrüchen steht die Unterbrechung der Transmissionsketten. Hygienemaßnahmen müssen in betroffenen Einrichtungen verstärkt zur Anwendung kommen, insbesondere sollten alle Oberflächen (zum Beispiel Türgriffe!) mit wirksamen Desinfektionsmitteln behandelt werden. Kommerzielle Impfstoffe gegen gastroenteritische Viren stehen bislang nicht zur Verfügung. Erste Studien mit Impfstoffen gegen Rotaviren der Gruppe A begannen im Jahr 1982. Untersucht wurde ein tetravalenter Impfstoff, der gegen die vier wichtigsten Rotavirustypen G1–G4 gerichtet war. Die Impfung von Kindern in den USA ergab eine Reduktion von Rotavirus-induzierten Gastroenteritiden zwischen 69 und 91 % (10). Nachdem der Impfstoff 1998 für den US-amerikanischen Markt zugelassen wurde, wurde er bereits ein Jahr später wieder aus dem Handel genommen, da in der Gruppe der geimpften Kinder eine auffällige Häufung von Dünndarminvaginationen registriert wurde. Zum jetzigen Zeitpunkt werden ein Plasmidimpfstoff sowie verschiedene Impfstoffe mit unterschiedlichen Rotavirus-spezifischen Antigenen in Studien erprobt. Ein Erfolg versprechender Impfstoff müsste insbesondere die Vielzahl verschiedener zirkulierender Geno- und Serotypen von Rotaviren der Gruppe A berücksichtigen. Literatur 1. Kapikian AZ, Wyatt RG, Dolin R, Thornhill S, Kalica AR, Chanock RM: Visualization by immune electron microscopy of a 27 nmparticle associated with acute infectious nonbacterial gastroenteritis. J Virol 1972; 10: 1075–1081 2. Bishop RF, Davidson GP, Holmes IH, Ruck BJ: Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. Lancet 1973; 2: 1281–1283 3. Middleton PJ, Szymanski MT, Abbott GD, Bortolussi R, Hamilton JR: Orbivirus acute gastroenteritis of infancy. Lancet 1974; 1: 1241–1244 4. Wilhelmi I, Roman E, Sánchez-Fauquier A: Viruses causing gastroenteritis. Clin Microbiol Infect 2003; 9: 247–262 5. Koopmans M, von Bonsdorff C-H, Vinjé J, de Medici D, Monroe S: Foodborne viruses. FEMS Microbiology Reviews 2002; 26: 187–205 6. Lopman BA, Brown DW, Koopmans M: Human caliciviruses in Europe. Journal of Clinical Virology 2002; 24: 137–160 7. Dalton RM, Roman ER, Negredo AA, Wilhelmi ID, Glass RI, Sánchez-Fauquier A: Astroviruses acute gastroenteritis among children in Madrid, Spain. Pediatr Infect Dis J 2002; 21: 1038–1041 8. Karst SM, Wobus CE, Lay M, Davidson J, Virgin HW: STAT1-dependent innate immunity to a norwalk-like-virus. Science 2003; 299: 1575–1578 9. Meyer CG: Tropenmedizin-Infektionskrankheiten. Landsberg: Ecomed Verlagsgesellschaft 2000 10. Centers for Disease Control and Prevention: Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1999; 48: 1–23 Zur Person Matthias Günther, ärztlicher und wissenschaftlicher Mitarbeiter im Institut für Tropenmedizin, Berlin. Tätigkeit als Medical Consultant für die TropenMedicus GmbH, Duisburg. Schwerpunkte: Vakzinologie, Reisemedizin sowie Phase I–IV Studien. Z. Allg. Med. 2003; 79: 380–383. © Hippokrates Verlag in MVS Medizinverlage Stuttgart GmbH & Co. KG, Stuttgart 2003 383