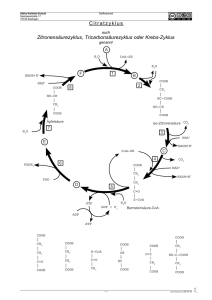
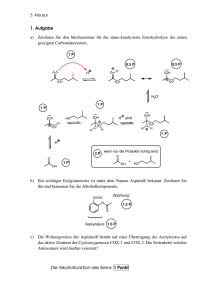
Lösung
Werbung
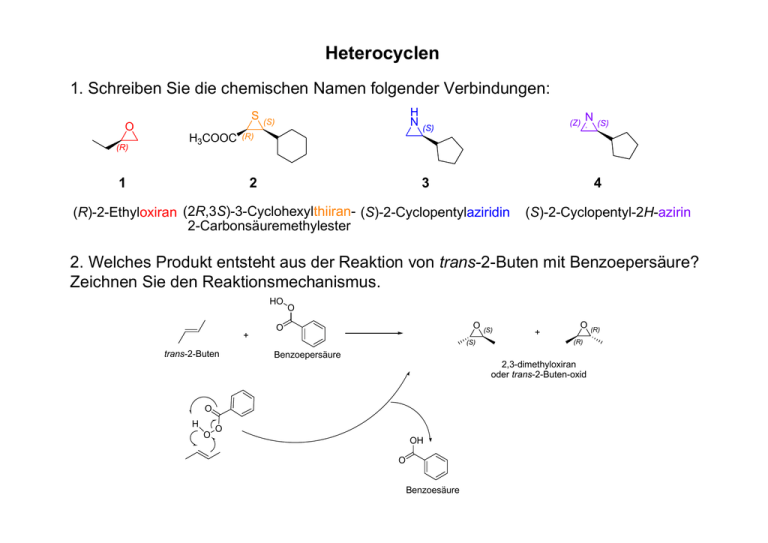
Heterocyclen 1. Schreiben Sie die chemischen Namen folgender Verbindungen: S O (R) H3COOC H N (S) (Z) (S) N (S) (R) 1 2 3 4 (R)-2-Ethyloxiran (2R,3S)-3-Cyclohexylthiiran- (S)-2-Cyclopentylaziridin 2-Carbonsäuremethylester (S)-2-Cyclopentyl-2H-azirin 2. Welches Produkt entsteht aus der Reaktion von trans-2-Buten mit Benzoepersäure? Zeichnen Sie den Reaktionsmechanismus. HO + trans-2-Buten O O O (S) (S) + O (R) Benzoepersäure 2,3-dimethyloxiran oder trans-2-Buten-oxid O H O O OH O Benzoesäure (R) 3. Was ist Polyethylenglykol? Zeichnen Sie die Strukturformel. HO O nH (Polymer aus der Säure-Katalysierten Ringöffnung von Oxiran) 4. Zeichnen Sie das SN2 Produkt folgender Reaktion: O OH CH3OH + H H3CO (S)-2-Methoxy-1-phenylethanol 5. Glycerol, Phosphat, Linolsäure und Cholin sind die Bausteine wessen Moleküls? Schreiben Sie die Formel. O H2C O C C17H31 O HC O C C17H31 O H2C O P O (CH2)2N(CH3)3 O Phosphatidylcholin 6. Der Neurotransmitter X kann im menschlichen Organismus aus den Aminosäuren Phenylalanin bzw. Tyrosin synthetisiert werden. Im ersten Schritt der X-Biosynthese wird das Tyrosin-Molekül am C3-Atom mit einer zweiten Hydroxygruppe ausgestattet und liegt damit als 3,4-Dihydroxyphenylalanin (DOPA) vor. Danach decarboxyliert das Enyzm DOPA-Decarboxylase das entstandene Molekül zum biogenen Amin Dopamin. Durch die Hydroxylierung der Seitenkette am C-β β mit Hilfe der Dopamin-Hydroxylase entsteht schließlich X; bei diesem Reaktionsschritt ist Ascorbinsäure als Cofaktor beteiligt. Zeichnen die Formel von DOPA, Dopamin und X, und benennen Sie X. HO HO H2N NH2 COOH HO HO HO NH2 HO OH L-DOPA Dopamin Noradrenalin 7. Warum sind Aflatoxine Krebserreger? Aflatoxine verursachen die DNA-Hydrolyse durch Öffnung des Epoxides und Alkylierung der Nukleinbasen (speziell von N7-Guanin). 8. Zeichnen Sie die Strukturformel von (R)-Oxetan-2-carbonsäuremethylester (1), 3(N-Methylamin)-azetidin (2) und 3-Ethylazetidin (3), und schlagen Sie eine Synthese für 3 vor. O NH NH (R) COOCH3 H3CHN 1 2 (R)-Oxetan-2carbonsäuremethylester 3 3-(N-Methylamin)-azetidin 3-Ethylazetidin Br NH2 50 % KOH, 100 °C 9. Schreiben Sie die chemischen Namen folgender Verbindungen: HO OH O N H (S) (S) N O 1 3-Hydroxy-1H-pyrrol-2Carbonsäuremethylester O S O 2 (2S,4S)-4-Hydroxy-1methylpyrrolidin-2Carbonsäuremethylester 3 2,4-Dimethylthiophen 10. Welche proteinogene Aminosäure enthält einen Pyrrolidin-Ring? Zeichnen Sie die Strukturformel dieser Aminosäure. O C OH HN Prolin 11. Furfural kann aus der Dehydratation (-3 Moleküle Wasser) von Xylose (einem Pentose) hergestellt werden. Zeichnen Sie die Strukturformeln von Xylose und Furfural und beschreiben Sie den Reaktionsmechanismus. H H HO H O H O OH O H H+ H H OH - H2O H OH CH2OH CH2OH Xylose H O O H+ H H H OH - H2O CH2OH H O O + HO CHO H CHO + H O H H O - H2O CH2OH Furfural 12. Beschreiben Sie die Synthese von 2,3-Dimethyl-thiophen nach Paal-Knorr. P2S5 H O ∆T O S 13. Reihen Sie die folgenden Verbindungen nach steigender Säurestärke (NHAcidität) und begründen Sie Ihre Zuordnung: H N pKa N H N H 1 2 5,3 0,4 N N H N H 3 4 5 11,2 7,0 14,5 H N H 5<3<4<1<2 5: Aromatisches System. Der Ring ist elektronreich. 3: Sekundäres Amin, sp3-Hybridisierung. Piperidin ist eine stärkere Base als Imidazol, Pyridin und Pyrrol 4: Resonanzstabilisierte protonierte Form vom Imidazol. Imidazol ist eine stärkere Base als Pyridin und Pyrrol, aber schwächer als Piperidin 1: sp2-Hybridisierung. Pyridin ist eine stärkere Base als Pyrrol, aber schwächer als Imidazol und Piperidin 2: Rearomatisierung. Pyrrol ist eine schwächere Base als Pyridin, Imidazol und Piperidin 14. Warum ist die elektrophile Substitution auf Pyrrol in Position-2 bevorzugt? N H + E + H E N H H E N H H E N H E E E N H N H E bevorzugt H H N H N H 15. Beschreiben Sie den Säure-katalysierte Polymerisierungsprozess von Furan. H2SO4 O O H H O H Elektrophil NH3 O O O H n O O O H H O O O 16. Mit welcher Verbindung (1a, 1b, 1c) findet die folgende Diels-Alder Reaktion statt, und warum? X O X + NH 90 °C O NH O 1a: X=O 1b: X=N 1c: X=S O Nur mit 1a, weil Pyrrol und Thiophen eine hohe Aromatizität zeigen. 17. Die Strukturformel von Vitamin H (Biotin) ist folgende: H N X O N H Nennen Sie den Heteroatom X. Biotin COOH X=S 18. Wie ist Eisen (II) im Hämoglobin koordiniert? Globin His HN N N N Fe2+ N N HOOC O2 19. Aus welchen Strukturelementen besteht Chlorophyll? Dihydroporphyrin Mg2+ cyclo-β-Ketoester Propionat Phytyl-Rest N N Mg2+ N N H H O O H O O O Chlorophyll a COOH 20. Beschreiben Sie den Mechanismus der Indolsynthese nach Fischer: O NH NH2 OH + NH - H2O NH O HOOC 1-Phenylhydrazin OH COOH 2-Oxopropionsäure H+ NH NH NH NH Tautomerie H+ NH2 NH H H - H+ NH N COOH COOH NH2 NH NH COOH H - NH3 COOH 250°C NH NH2 COOH NH COOH - CO2 21. Verbindung 1 oxidiert in der Luft zu einem blauen Farbstoff. Welcher? Zeichnen Sie die Strukturformel. O OH NaOH, Luft N H 1 N H H N O Indigo (λmax 590 nm) 22. Schreiben Sie die chemischen Namen folgender Verbindungen und schlagen Sie eine Synthese für 4 vor: N N O N O N S N O 1 2 3 4 1-Methyl-1Himidazol 2-Phenyloxazol 4-Methylisothiazol 2,5-Dimethyloxazol O H2SO4 N CH2 H N-(2-oxopropyl)acetamid OH O N CH2 H OH O N CH2 H H2O O H N C H - H3O+ O N 4 2,5-Dimethyloxazol 23. Beschreiben Sie den Mechanismus von der Peptidbindung-Hydrolyse bei der katalytischen Triade Asp102, His57, Ser195 in dem Enzym Chymotrypsin. H+ O O OH NH N δ/π O O H ε/τ HO Ser195 Ser195 Asp102 HN N Asp102 His57 His57 O O O NH HN H OH O Ser195 Asp102 O Asp102 - H+ HN R1 O HN N H R2 - R1COOH O HO O O OH Asp102 His OH His O His - R2NH2 O H O R1 O 57 Ser195 57 N NH Asp102 R1 O Asp102 57 R2 H N O NH N Ser195 O Ser195 His57 His57 O NH N HN N O H O O R1 Asp102 Ser 195 His57 Ser195 24. Benennen Sie ein Lactam-haltige Antibiotikum und zeichnen Sie seine Strukturformel. Penicilline Cephalosporine R= β-Lactam COOH O O N R N H PhCH2 G PhOCH2 V PhOCH(Et) Propicillin PhCH(NH2) Ampicillin S Thiazolidinring H N R O S N O O COOH 25. Zeichnen Sie die Strukturformeln von Picolinsäure, Nikotinsäure und Isonikotinsäure. COOH COOH N COOH Picolinsäure N Nikotinsäure N Isonikotinsäure O Zucker • Zeichnen Sie D-Ribose in der offenen und α-furanosyl-Form. HC H H H C H2C O OH OH OH OH D-Ribose HO O OH OH OH α-D-Ribofuranose 2. Zeichnen Sie α- und β-D-Glucopyranose in der Sessel-Konformation. H OH HO HO H OH HO H H OH H OH α-D-Glucopyranose HO HO HO H H OH OH H β-D-Glucopyranose 3. Woraus bestehen Glykoside? Nennen Sie ein Beispiel. Aglykon H OH HO HO H H Aglykon H OH HO O OH H H HO O HO HO Amygdalin H H HO HO HO H H OH H O OH H OH Arbutin N 4. Beschreiben Sie den Unterschied zwischen Maltose und Cellobiose und nennen Sie ihre Herkunft. glycosidische Bindung C1-α-O-C4 CH2OH CH2OH D OH OH D O 1-α O OH OH OH 4-O-α-D-Glucopyranosyl-D-Glucopyranosid Maltose aus Stärke D OH O O OH CH2OH D OH O CH2OH O 1-β OH OH glycosidische Bindung C1-β-O-C4 OH OH 4-O-β-D-Glucopyranosyl-D-Glucopyranosid Cellobiose aus Cellulose 5. Glucose kann sowohl oxidiert wie auch reduziert werden. Beschreiben Sie die Ihnen bekannten Produkte. H HO H H CHO OH H OH OH CH2OH H HO H H HNO 3 COOH OH H OH OH COOH Glucarsäure Br 2, H 2O H HO H H D-Glucose COOH OH H OH OH CH2OH H HO H H CHO OH H OH OH CH2OH NaIO4* -H2O H O O + 3 O H Oxalaldehyd H D-Glucose * Das Periodat oxidiert nur die 1,2-Diole Gluconsäure O C HO O HO H HO H CH2OH [O] [H] O C O O O H HO H CH2OH CHO OH H OH OH CH2OH D-Glucose CHO OH H OH OH COOH COOH O OH HO NaBH4 H HO H H CH2OH OH H OH OH CH2OH Sorbitol HO HO H H CHO H H OH OH CH2OH D-Mannose OH OH D-Glucuronsäure Ascorbinsäure H HO H H H HO H H NaBH4 α-Anomer HO HO H H CH2OH H H OH OH CH2OH Mannitol O + OH H H 6. Zeichnen Sie D- und L-Galaktose in der Fischer-Projektion. HC H HO HO H C H2C HC HO H H HO C H2C O OH H H OH OH D-Galactose O H OH OH H OH L-Galactose 7. Was versteht man unter den Begriff Mutarotation? H OH H OH HO HO HO H H H OH OH α-D-Glucopyranose 36 % HO HO H H H H OH OH O OH H Aldohexose 0.02 % HO HO HO H H OH OH H β-D-Glucopyranose 64 % 8. Wodurch unterscheiden sich Amylose und Cellulose, und welche Sekundärstruktur bilden Sie? glycosidische Bindung C1-α-O-C4 glycosidische Bindung C1-β-O-C4 CH2OH CH2OH CH2OH D OH HO D OH O 1-α O OH Amylose D O 1-α CH2OH H D O OH OH n O O 1-β O OH H O OH n HO OH Cellulose 9. Was ist Chitin? Aus welchen Monomeren ist es aufgebaut, wo kommt es vor? Aufgabe 9 CH2OH D OO OH 1-β H HO glycosidische Bindung C1-β-O-C4 NHCOCH3 n Chitin besteht aus N-Acetyl-D-Glucosamin und kommt im Exoxkelett von Muscheln und Insekten vor 10. Aus welchen Monomeren besteht Hyaluronsäure? Wo kommt sie vor? glycosidische Bindung C1-β-O-C3 COOH D OO 1-β OH CH2OH D OO 1-β H OH HO OH NHCOCH3 n D-Glucuronsäure-β-1-3-N-Acetyl-D-Glucosamin Hyaluronsäure Bestandteil vom Bindegewebe, Synovialflüssigkeit, Knorpel und Glaskörper des Auges Aminosäuren • Zeichnen Sie die Strukturformel von Glycin, L-Asparagin, D-Prolin, L-Isoleucin O NH2 H2N COOH Glycin H2N N H COOH L-Asparagin COOH H2N D-Prolin COOH L-Isoleucin 2. Formulieren Sie das Dissoziationsgleichgewicht von Glutaminsäure: pK1(α-COOH), 2,2; pK2(γ-COOH), 4,3; pK3(NH2), 9,7 COOH COOH COO pKa 2,2 H3N pKa 4,3 H3N COOH COO COO pKa 9,7 H3N COO H2 N L-Glutaminsäure Netto-Ladung 1 0 -1 -2 2 4 6 8 10 pH COO 3. Skizzieren Sie einen Weg zur Darstellung von L-Asparaginsäure COOCH3 COOCH3 + NH3 H2N COOCH3 COOH O N H COOCH3 COOCH3 O Base N H NaOH COOCH3 COOH Acylase H2N COOH COOH COOH O pH>9 (CH3CO)2O N H COOH 4. Zeichnen Sie die D- und L-Struktur von Alanin nach Fischer und CIP COOH H2N H CH3 L-Alanin COOH H NH2 CH3 D-Alanin CH3 CH3 H COOH H2N S-Alanin H HOOC NH2 R-Alanin 5. Dansylchlorid ist ein fluoreszierendes Reagenz zur Markierung von primären und sekundären Amine. Skizzieren Sie seinen Einsatz in der Aminosäuresequenz-Bestimmung von Peptiden. N N N O + O S O Cl H2N R1 R2 N H Base H N O R3 HCl 6 N O S O O S O O HN R1 R2 N H O H N O HN R3 OH R1 + AminosäureGemisch - Cromathographie (Retentionszeti); Detektion bei 310 nm - Massenspektrometrie (nicht für Ile/Leu) (Beide Methoden erlauben die Bestimmung von Gln und Asn nicht, weil die Säureamid auch hydrolisiert wird) 6. Wie können Tyrosin- und Tryptophanreste in einem Peptid/Protein nachgewiesen werden? Wie kann man die beiden Reste unterscheiden? HCl NaOH HCl NaOH Peptide 1. Zeichnen Sie die Struktur des folgenden Peptides: Ac – Ala – Leu - Asp(OtBu) – Phe – Lys(Boc) – NH2 O HN O O H N N H O O O N H O H N O O N H NH2 O 2. Schlagen Sie eine Synthesemethode vor, um H – Ala – Lys – OH zu erhalten. Boc-HN H Boc-HN COOH + DIC/HOBt H2N COOtBu Boc-HN C O N COOtBu H TFA H2N C O N COOH NH2 NH-Boc 3. Beschreiben Sie die Struktur folgendes Peptidtoxins und nennen Sie die vorhandenen Aminosäurereste Aufgabe 3 Ser Trp Ala cyklische Peptidkette bicyklisches Peptid Thioether Bindung Cys-Trp Ala 4-Hyp (Phallotoxin-Familie) Cys Thr 4. Was ist ein Depsipeptid? Nennen Sie ein Beispiel. Valinomycin: Depsipeptid (alternierende Peptid-LactonBindungen) 5. Fmoc ist eine wichtige Schutzgruppe in der Peptidsynthese. Zum Schutz welcher Gruppen kann sie eingesetzt werden und wie wird sie abgespalten? NHR NHR O O N H O O + N H H H NHR + H H + N O CO2 + NH2R + O N H H 6. Beschreiben Sie die Schritten der Festphasenpeptidsynthese und zeichnen Sie ein Synthese-Schema für das Peptid Ac-Ala-Lys-Asp-Glu-Gly-OH Ac-Ala-Lys-Asp-Glu-Gly-OH Hydroxybenzyl oder Trityl Harz Typ + Fmoc-Gly-OH 1. 2. 3. 4. 5. 6. Beladung des Harzes mit der Cterminalen Aminosäure (ASn); Abspaltung der FmocSchutzgruppe: 30 % Piperidin in DMF; Kupplung der Aminosäure (ASn-1): 3- bis-10-facher Ueberschuss Aminosäure mit TBTU(HBTU)/ HOBt/Diisopropylethylamin oder mit HOBt/DIC; Wiederholung der Schritten 2. und 3.; Schritt 2.; Abspaltung vom Peptid vom Harz mit TFA. DIPEA (mit einem Trityl Harz) HOBt/HBTU/DIPEA (mit einem Hydroxybenzyl Harz) Fmoc-Gly-Harz Piperidin H-Gly-Harz Fmoc-Glu(OtBu)/ HOBt/HBTU/DIPEA Fmoc-Glu(OtBu)-Gly-Harz H-Ala-Lys(Boc)-Asp(OtBu)-Glu(OtBu)-Gly-Harz Ac2O/DIPEA Ac-Ala-Lys(Boc)-Asp(OtBu)-Glu(OtBu)-Gly-Harz TFA Ac-Ala-Lys-Asp-Glu-Gly-Harz