Pankreatitis bei Patienten mit Hyperparathyreoidismus
Werbung
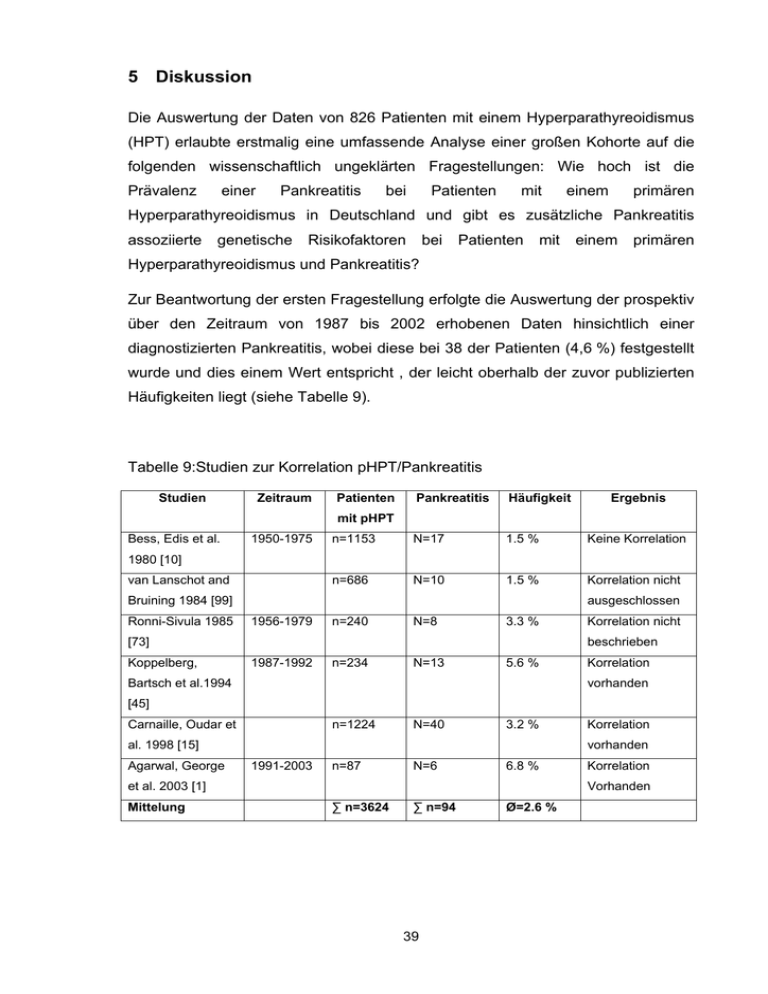
5 Diskussion Die Auswertung der Daten von 826 Patienten mit einem Hyperparathyreoidismus (HPT) erlaubte erstmalig eine umfassende Analyse einer großen Kohorte auf die folgenden wissenschaftlich ungeklärten Fragestellungen: Wie hoch ist die Prävalenz einer Pankreatitis bei Patienten mit einem primären Hyperparathyreoidismus in Deutschland und gibt es zusätzliche Pankreatitis assoziierte genetische Risikofaktoren bei Patienten mit einem primären Hyperparathyreoidismus und Pankreatitis? Zur Beantwortung der ersten Fragestellung erfolgte die Auswertung der prospektiv über den Zeitraum von 1987 bis 2002 erhobenen Daten hinsichtlich einer diagnostizierten Pankreatitis, wobei diese bei 38 der Patienten (4,6 %) festgestellt wurde und dies einem Wert entspricht , der leicht oberhalb der zuvor publizierten Häufigkeiten liegt (siehe Tabelle 9). Tabelle 9:Studien zur Korrelation pHPT/Pankreatitis Studien Zeitraum Patienten Pankreatitis Häufigkeit Ergebnis n=1153 N=17 1.5 % Keine Korrelation n=686 N=10 1.5 % Korrelation nicht mit pHPT Bess, Edis et al. 1950-1975 1980 [10] van Lanschot and Bruining 1984 [99] Ronni-Sivula 1985 ausgeschlossen 1956-1979 n=240 N=8 3.3 % [73] Koppelberg, Korrelation nicht beschrieben 1987-1992 n=234 N=13 5.6 % Bartsch et al.1994 Korrelation vorhanden [45] Carnaille, Oudar et n=1224 N=40 3.2 % al. 1998 [15] Agarwal, George vorhanden 1991-2003 n=87 N=6 6.8 % et al. 2003 [1] Mittelung Korrelation Korrelation Vorhanden ∑ n=3624 ∑ n=94 39 Ø=2.6 % Dabei wird der Zusammenhang zwischen dem HPT und einer Pankreatitis nun schon seit Jahrzehnten kontrovers diskutiert. Bereits 1962 wurde durch Mixter et al. [58] ein Zusammenhang zwischen einem HPT und der Pankreatitis postuliert. Durch zwei in den 90er Jahren publizierten Studien mit großen Patientenkohorten (n = 1153 und n = 686 Patienten) [10, 99] wurde dies allerdings erstmalig angezweifelt, denn die Auftretenshäufigkeit einer Pankreatitis bei Patienten mit HPT betrug lediglich 1,5 %. In ihrer Studie werteten Bess et al. [10] dabei retrospektiv Daten von 1153 Patienten aus, welche im Zeitraum zwischen 1950 bis 1975 behandelt worden waren. Es wurde nur bei 17 Patienten eine Pankreatitis diagnostiziert (1,5 %), weshalb die zuvor angenommene Assoziation von HPT und Pankreatitis angezweifelt wurde. Die Diagnose der Pankreatitis wurde dabei anhand von abdominellen Beschwerden und erhöhten Laborparametern (Amylase und Lipase), sowie radiologisch nachgewiesenen Pankreasverkalkungen und klinischen Zeichen einer exokrinen Pankreasinsuffizienz gestellt. Eine Angabe über die Diagnosekriterien des HPT, sowie über den Kalziumspiegel wurde nicht gemacht. Zu bedenken ist, dass es sich zwar um eine sehr große Kohorte handelte, die verwendeten Daten jedoch retrospektiv erhoben wurden und die Diagnosekriterien ggf. eine geringere Sensitivität besaßen. Ronni-Sivula wertete 1985 Daten von 240 Patienten aus und gab die Auftretenswahrscheinlichkeit für eine Pankreatitis mit 3,3 % an [73], die in den letzten größeren Studien durch Carnaille et al. [15] (1998; n = 1224 Patienten) und durch Agarwal et al. [1] (2003; n = 87 Patienten) in ihrer Tendenz bestätigt wurden (3,2 % bzw. 6,8 %). Agarwal et al. [1], die die höchste Prävalenz beschrieben, wiesen bei 6 von 87 Patienten (6,8 %) eine Pankreatitis nach, wobei die Kohorte mit 87 Patienten sehr klein war und die Pankreatitis einmal erst nach der operativen Sanierung des HPT auftrat und somit nicht gesichert durch den HPT bedingt gewesen ist. Dieses Beispiel erläutert somit sehr anschaulich die Gefahr einer kleinen Studienkohorte und möglicher systemischer Fehler in den Einschlusskriterien, die bei der Rekrutierung, der im Rahmen dieser Dissertation untersuchten Patienten, hinsichtlich dieser beiden Punkte vermieden wurde. Die Diskrepanz der Auftretenshäufigkeiten einer Pankreatitis bei Patienten mit einem HPT lässt sich möglicherweise zudem durch sensitivere Screeningmethoden aber auch durch mögliche, nun zu diskutierende, genetische Unterschiede durch unterschiedliche Herkunftsländer erklären (siehe Tabelle 9). 40 Anhand der aktuell bestehenden Datenlagen liegen die von uns erhobenen prospektiven Werte zur Auftretenswahrscheinlichkeit einer Pankreatitis bei Patienten mit einem HPT mit 4,6 % in einem, mit den bereits publizierten Studien, vergleichbaren Bereich. Obwohl die Pankreatitishäufigkeit in den Industrienationen in den letzten 50 Jahren deutlich zugenommen hat, existieren nur wenige Daten zur Pankreatitishäufigkeit in der deutschen Bevölkerung. Prof. Lankisch aus Lüneburg hat im Zeitraum von 1988 – 1995 Zahlen zur Epidemiologie der Pankreatitis in Deutschland erhoben. Die Inzidenz einer akuten Pankreatitis lag in diesem Zeitraum in der Region Lüneburg bei 19,7/100000 Einwohner/Jahr, die der chronischen Pankreatitis bei 6,4/100000 Einwohnern/Jahr. Die altersspezifische Häufigkeit zeigte einen Gipfel für die akute Pankreatitis in der Altersgruppe zwischen 35 - 44 Jahren und für die chronische Pankreatitis bei 45 – 54 Jahren [48]. In der hier untersuchten Kohorte trat eine akute Pankreatitis bei umgerechnet 193/100000 Patienten/Jahr auf und eine chronische Pankreatitis bei 113/100000 Patienten/Jahr. Die aktuellen Daten dokumentieren damit, dass das Pankreatitisrisiko bei Patienten mit einem pHPT um ca. das 10 fache erhöht ist. Trotzdem tritt sie mit 4,6% insgesamt nur selten auf, insbesondere hinsichtlich der für Nierensteine (45 %), Knochenschmerzen (35 %) und peptischen Ulcera (9 %) dokumentierten deutlich erhöhten Auftretenswahrscheinlichkeiten. Somit muss auch die pathophysiologische Bedeutung der im Rahmen des pHPT auftretenden Hyperkalzämie und der Zusammenhang mit der Pankreatitis als monokausaler Auslöser in Frage gestellt werden, der sich in der Aufführung der Hyperkalzämie bzw. der HPT in den gängigen Risikofaktorentabellen für eine AP und CP widerspiegelt [32, 41] (siehe Tabelle 1 und Tabelle 2). Die Ergebnisse deuten darauf hin, dass möglicherweise zusätzliche krankheits-modifizierende Faktoren (z.B. genetische Faktoren und Umweltfaktoren) die Entwicklung einer Pankreatitis bei Patienten mit einem pHPT beeinflussen könnten. Hintergrund der Diskussion einer Korrelation von HPT und Pankreatitis ist der postulierte pathophysiologische Mechanismus einer Hyperkalzämie vermittelten intrapankreatischen Trypsinaktivierung [29]. Unter physiologischen Bedingungen werden die Zymogene, unter ihnen Trypsinogen, im kalziumreichen Milieu des 41 Duodenums durch die Enterokinase aktiviert. Trypsin ist zudem in der Lage, andere Zymogene wie Proelastase und Chymotrypsinogen zu aktivieren und besitzt darüber hinaus die Fähigkeit zur Autoaktivierung. Bei der Pankreatitis beginnt die Trypsinaktivierung bereits innerhalb des Pankreas und leitet so die Selbstverdauung des Organs und damit die Pankreatitis ein. Kalzium spielt dabei eine essentielle Rolle. Haverback et al. konnten bereits 1960 nachweisen, dass Kalzium die Trypsinaktivierung steigert [38] und vermuteten, dass die HPT assoziierte Hyperkalzämie eine vermehrte intrapankreatische Konversion von Trypsinogen in Trypsin bedingt. Ward et al. zeigten, dass ein Anstieg des freien zytosolischen Kalziums als Auslöser einer Pankreatitis in Frage kommt [100, 101]. Diese Hypothese wurde durch Studien an Mäusen durch Mooren et al. bestärkt [59], denen es durch die Gabe des Kalzium Chelators BAPTA-AM gelang, nicht nur die Trypsinogenaktivität, sondern auch die Entstehung einer Pankreatitis signifikant zu reduzieren [59]. Krüger et al. untersuchten die Trypsinogenaktivierung an isolierten Pankreas-Azinus-Zellen invivo und bestätigten, dass Kalzium zur intrazellulären Trypsinogenaktivierung notwendig ist [47]. Dabei ergaben sich Hinweise dafür, dass eine zusätzliche Umverteilung des Kalziums in andere Zellregionen, die Dauer des KalziumionenEinstroms und die Lokalisation der intrazellulären Kalziumionen-Freisetzung direkt an der Zymogenaktivierung beteiligt zu sein scheinen [47]. Zugleich bestätigten sie, dass eine Absenkung sowohl der extrazellulären als auch der intrazellulären Kalziumionen-Konzentration die intrazelluläre Proteasenaktivierung erniedrigt bzw. vollständig aufhebt [47]. Die Kalziumhomöostase der Azinuszelle ist daher der vermutete kausale Pathomechanismus bei der Entstehung der Pankreatitis bei Patienten mit einem HPT. Die hier erhobenen Daten weisen allerdings darauf hin, dass die Hyperkalzämie nicht der allein auslösende Faktor zu sein scheint. Darüber hinaus scheint zumindest eine Hyperkalzämie von einer überwiegenden Mehrheit der Patienten ohne Entwicklung einer Pankreatitis (95,4 %) toleriert zu werden. In den letzten Jahren wurde die Hypothese der krankheits-modifizierenden Faktoren bei der Entstehung einer Pankreatitis, im Rahmen einer Hyperkalzämie, durch weitere Studien unterstützt [30, 31]. Bei der Untersuchung einer Familie mit einer chronischen Pankreatitis sowie 42 einer familiären hypokalziurischen Hyperkalzämie, die eine asymptomatische Hyperkalzämie bedingt, konnte eine Kombination einer SPINK1 N34S Mutation mit einer Mutation des Calcium-sensing Receptors (CaSR) (L518P) als Auslöser der Pankreatitis nachgewiesen werden [30]. Mutationen im CaSR-Gen waren bis zu dieser Studie einzig als Auslöser für Erkrankungen des Kalziumstoffwechsels, wie der familiären hypokalziurischen Hyperkalzämie, der autosomal dominanten Hypokalzämie sowie des schweren neonatalen Hyperparathyreoidismus bekannt. Aus den erhobenen Daten lässt sich ebenfalls vermuten, dass zusätzliche „disease modifier“, hier Mutationen im CaSR, bei der Genese der Pankreatitis eine Rolle spielen [30], denn erst die Kombination aus CaSR-Mutation und SPINK1(N34S)-Mutation löste den Phänotyp einer chronischen Pankreatitis aus, Träger einer einzelnen Mutation (CaSR oder SPINK1) blieben beschwerdefrei [30]. Eine Studie an einer großen Kohorte mit ICP bestätigte dies, indem eine weitere Familie mit dieser Konstellation gefunden wurde [31]. Diese Überlegung wird zudem durch die im Jahr 2002 durch Racz et al. publizierte Charakterisierung des CaSR auf duktalen und azinären Pankreaszellen unterstützt [69], wobei postuliert wurde, dass der CaSR im Pankreas eine multifunktionale physiologische Rolle bei der Regulation der Kalziumkonzentration im Pankreassaft spielen könnte [69]. Interessanterweise wurde im Jahre 2007 eine weitere Studie von Murugaian et al. publiziert [60], die Mutationen im CaSR Gen bei Patienten mit einer tropischen Pankreatitis (TP) entdeckten, wobei insbesondere für diese Kohorten eine Assoziation mit N34S SPINK1 Mutationen bekannt ist. Auch hier ergeben sich somit Hinweise auf eine multifaktorielle Genese und eine Abhängigkeit von der Kalziumhomöostase. Aufgrund der bis zum heutigen Zeitpunkt bestehenden Daten, bezüglich der Hypothese von krankheits-modifizierenden Faktoren bei der Entstehung einer Pankreatitis, lag damit die Schlussfolgerung einer Untersuchung auf genetische, mit Pankreatitis-assoziierter Risikofaktoren nahe. Zu den im Rahmen dieser Dissertation untersuchen Mutationen gehörten die im PRSS1-Gen (N29I und R122H), die eine erhöhte Trypsinogenaktivität verursachen [74, 75] und als Auslöser einer hereditären Pankreatitis bekannt sind. N29I und R122H sind dabei für mehr als 95% der HP Fälle verantwortlich, wobei auch seltenere mit HP assoziierte Mutationen wie A121T, V123M oder R122C mittels 43 unserer Methode detektiert worden wären. Keiner dieser Mutationen konnte in unserer Kohorte nachgewiesen werden. Dies verwundert im Nachhinein nicht, da im Regelfall bei der durch Mutationen verursachten HP eine Pankreatitis bereits im Jugendalter (13,9 ± 12,2) auftritt [52] und die Penetranz der Erkrankung mit 80% sehr hoch ist. Neben einer leeren Familienanamnese betrug das durchschnittliche Erkrankungsalter in der untersuchten Kohorte bei der Diagnosestellung, 57 ± 2,5 Jahre, was eine HP oder HP-assozierte Mutation unwahrscheinlich macht. Bei 16 % unserer Patienten (4 von 25 Patienten) konnte dagegen eine SPINK1 Mutation (N34S) nachgewiesen werden. SPINK1 ist der wichtigste intrapankreatische Trypsin-Inhibitor, der Trypsin durch kovalente Bindung zwischen dem katalytischen Serin der Protease und einem Lysin im reaktiven Zentrum von SPINK1 inhibiert. Im Gegensatz zu den PRSS1-Mutationen wird somit vermutet, dass die N34S Mutation im SPINK1-Gen physiologische Abwehrmechanismen gegen eine inadäquate oder verfrühte Enzymaktivität beeinflusst [7, 62, 95]. Es gilt als bestätigt, dass die N34S Mutation als häufigste SPINK1-Gen-Mutation mit unterschiedlichen Formen der CP assoziiert ist [72, 105], allerdings scheinen N34S-SPINK1-Mutationen eine Pankreatitis dabei nicht selbständig auszulösen, sondern nur zusammen mit weiteren genetischen oder Umweltfaktoren [68, 72]. Weder in-vitro Experimente noch Experimente an knock out Mäusen konnten dabei bis heute die Rolle der N34S Mutation abschließend erklären. Obwohl es sich zeigte, dass sich bei einem Ungleichgewicht zwischen Trypsin-Aktivität und ihrer Hemmung durch SPINK1 eine Pankreatitis entwickelt, führt die N34S Mutation allein weder zu einem Funktionsverlust des Proteins [39, 55] noch zu einer eingeschränkten Sekretion [43]. Es ist daher abschließend nicht geklärt, wie SPINK1 Mutationen zu einem Funktionsverlust oder zu einer Funktionseinschränkung des Proteaseninhibitors führen und dadurch eine erhöhte intrapankreatische Trypsinaktivität bedingen. Nach der Erstbeschreibung von SPINK1-Mutationen bei Patienten mit einer idiopathischen chronischen Pankreatitis (ICP) durch Chen et al. [16] konnten Witt et al. als erste eine Assoziation aufzeigen [104]. In Ihrer Studie hatten 23 % der Patienten mit einer ICP eine SPINK1 Mutationen. Dabei handelt es sich im Wesentlichen (bei 18 von 22 Patienten (81 %)) um eine N34S Mutation. Im 44 Weiteren zeigten sich seltenere Mutationen am N-terminalen Ende des Moleküls (P55S). Es fanden sich sowohl heterozygote als auch homozygote N34SPatienten (6 von 22 Patienten waren homozygot), wobei ein phänotypischer Unterschied zwischen beiden Gruppen nicht festzustellen war. In weiteren Studien wurde dieser Zusammenhang belegt und diskutiert. Dabei scheint eine Kombination mit anderen Gendefekten oder Umweltfaktoren zur Induzierung der Erkrankung („disease modifier“) notwendig zu sein [6, 63, 68]. Seit ihrer Entdeckung wurden N34S Mutationen in weiteren Pankreatitiskohorten mit tropischer Pankreatitis (44 %) [11] und äthyltoxischen Pankreatitis (6,3 % [78] und 9,2 % [97]) identifiziert. Bei der TP werden als pathogenetisch additive Risikofaktoren eine Malnutrition, Antioxidantien-Defizienz oder eine toxische Schädigung des Pankreas durch Cassavawurzel-Konsum (enthält toxische zyanogene Glykoside) diskutiert, wobei 2007 mit den CaSR Mutationen ein weiterer genetischer Risikofaktor, der auf eine multifaktorielle genetische Ursache deutet, identifiziert wurde [60]. Bhatia et al. konnten bei 44 Prozent der von ihnen untersuchten Patienten mit einer TP eine N34S-Mutation nachweisen [11]. Diese Daten lassen vermuten, dass genetische Dispositionsfaktoren wie z.B. die SPINK1 Mutationen bei der Pathogenese der TP eine wichtige Rolle spielen. Weitere Studien konnten eine signifikante Korrelation zwischen N34S Mutationen und einer [27; 94; 105], alkoholinduzierten so dass sich chronischen vermuten Pankreatitis lässt, dass (ACP) nachweisen ein modifiziertes Proteaseninhibitorsystem auch bei einer ACP pathogenetisch bedeutsam ist. Allerdings scheint der Einfluss der N34S-Mutation nicht so ausgeprägt wie bei der ICP und TP zu sein, denn es werden lediglich Auftretenshäufigkeiten von 6,3 % [78] bzw. 9,2 % [97] der SPINK1 Mutationen bei Patienten mit einer AP angegeben. Die mögliche Funktion der N34S SPINK1 Mutation als „disease modifier“ wird auch dadurch deutlich, dass Mutationsträger häufig in der Normalbevölkerung vorkommen. Dabei wird eine Häufigkeit von 1,6 % in den USA [68, 78], 1,58 % in Frankreich [16], 1 % in der Schweiz [96], 2,6 % in Finnland [97] und 0,36 % [104] bzw. 1,6 % [90] in Deutschland beschrieben, Pakreatitishäufigkeit liegt. 45 die deutlich über der Die N34S SPINK1 Mutationshäufigkeit von 16 % in unserer pHPT/PankreatitisSubgruppe überschreitet die Auftretenswahrscheinlichkeit von ungefähr 1 % in der Normalbevölkerung signifikant, womit ein zusätzlicher genetischer Mechanismus der Pankreatitisinduktion bei Patienten mit pHPT bewiesen scheint. Es ist in diesem Zusammenhang interessant, dass der einzige Patient mit einem pHPT und einer Pankreatitis, der bis zum jetzigen Zeitpunkt auf die SPINK1 Mutation getestet wurde, positiv für die N34S Mutation war [27]. Er war ein Bestandteil einer Gruppe von Patienten, welche als "verschiedenartige" ("miscellaneous") chronische Pankreatitis bezeichnet wurden, und, obwohl es sich nur um einen Fall handelt, unterstützt dieses Ergebnis die Hypothese einer genetischen Komponente. Im Rahmen dieser Dissertation konnte somit erstmalig gezeigt werden, dass N34S SPINK1 Mutationen eine wichtige Rolle bei der Entstehung einer Pankreatitis bei Patienten mit einem pHPT spielen. Hinsichtlich der CFTR Mutationen ergaben sich ähnliche Hinweise auf einen genetischen Background. Die Identifizierung einer schweren CFTR Mutation bei 4 (2-mal ∆F508 und 2-mal R553X) von 24 Patienten (17 %) unserer Patientengruppe unterlegt die mögliche Relevanz additiver genetischer Faktoren bei Patienten mit pHPT und Pankreatitis. Aktuelle Studien zeigen, dass bei ca. 30 % der Patienten mit einer chronischen oder rezidivierenden Pankreatitis mindestens ein abnormales CFTR Allel nachweisbar ist, im Gegensatz zu der zu erwartenden Häufigkeit von 3-4 % der Normalbevölkerung [64, 65, 92]. Das Risiko der Entstehung einer so genannten idiopathischen chronischen Pankreatitis (ICP) nimmt bei einem Träger der zystischen Fibrose ungefähr um das 5-fache zu, wobei insbesondere der Terminus „idiopathisch“ bei einer dann detektierten Mutation umstritten ist. Da nicht alle Träger einer CFTR Mutation an einer Pankreatitis erkranken, scheinen auch hier weitere Faktoren an der Entstehung einer Pankreatitis beteiligt zu sein. Obwohl in verschiedenen Kohorten seit 1998 bis zu 25 % CFTR Mutationen bei Patienten mit einer ICP aufgezeigt werden konnten [18, 63, 64, 80, 102], ist es bis zum heutigen Zeitpunkt nicht vollständig verstanden, warum heterozygote CFTR Mutationsträger anfällig für eine Pankreatitis sind. Noone et al., die den CFTR gesteuerten Ionen-Transport im Nasenepithel von Patienten mit einer ICP 46 gemessen haben, berichten über einen CFTR vermittelten, beeinträchtigten Cl¯Transport bei Patienten mit unterschiedlichen CFTR Mutationen, der darauf hinweisen könnte, dass es pathophysiologische Auswirkungen im Pankreas geben könnte [63]. Die CFTR-Protein-Funktion als Anionen-Kanal reguliert direkt den Cl¯Ausstrom und indirekt die HCO3¯-Sekretion. Im Weiteren reguliert es den H2Ound Na+-Einstrom. Patienten mit einer zystischen Fibrose weisen ein abnormales CFTR-Protein in den Epithelzellen, z.B. im Pankreasgang auf, so dass möglicherweise eine veränderte Viskosität des Pankreassaftes und/oder eine pHÄnderung infolge eines gestörten Ionentransportes die Autoaktivierung von Trypsinogen und damit die Pankreatitisentstehung begünstigt. Zudem vermutet man, dass es durch die Sekretion eines viskösen Sekrets zu einer obstruktiven Pankreatitis und damit zum Organuntergang kommen kann [18]. Hinsichtlich der HPT-assozierten Pankreatitis ergeben sich daraus weitere mögliche pathophysiologische Mechanismen. Während der physiologische Pankreassaft alkalisch ist und einen hohen Anteil an Kalzium aufweist, könnte die Kombination aus Hyperkalzämie im Rahmen eines pHPT und verminderter Flusseigenschaft des Pankreassaft bei einer CFTR Mutation eine Gangobstruktion durch auskristalisierte „Pankreas-Steine“ auslösen [19]. Die beiden ersten Studien, die zur Assoziation von CFTR Mutationen und Pankreatitis veröffentlicht wurden, sind 1998 publiziert. Damals beschrieben zwei Arbeitsgruppen aus England und den USA unabhängig voneinander in zwei Kohorten mit chronischer bzw. idiopathischer Pankreatitis Mutationen des CFTR Gens [18, 80]. Cohn et al. fanden bei 26 % ihrer Patienten mit einer ICP eine CFTR Mutation und bei 19 % ein 5T Allel [18], wohingegen Sharer et al. bei 13 % der Patienten mit einer CP eine heterozygote CFTR Mutation nachwiesen [80]. Dabei ist bemerkenswert, dass die letztgenannte Studie, die Patienten mit einer CP auf CFTR-Mutationen untersuchte, zwei Patienten mit einem pHPT enthielt [80]. Einer dieser Patienten wies eine heterozygote ∆F508-Mutation auf. Obwohl diese Studie den Grundstein für alle weiteren Studien zu CFTR Mutationen und Pankreatitis legte, wurde dieser Zusammenhag zwischen CFTR Mutationen in Patienten mit pHPT und Pankreatitis bis zu dieser Dissertation nicht weiter untersucht. 47 Man kann CFTR Mutationen in mindestens 5 Kategorien unterteilen, welche sich durch die molekularen Konsequenzen bzw. die sich daraus ergebenden Funktionseinschränkungen definieren [91]. Vereinfacht unterscheidet man zwischen „schweren“ und „milden“ Mutationen. Patienten mit einer zystischen Fibrose und einer Pankreasinsuffizienz haben jeweils eine „schwere“ Mutation auf beiden Allelen, wohingegen Patienten mit einer zystischen Fibrose und ausreichender Pankreasfunktion zumindest eine Mutation haben, welche mit einer „milden“ Funktionseinschränkung des CFTR Proteins assoziiert ist. Bei der großen Anzahl an bekannten CFTR-Mutationen (aktuell > 1500) ist eine Testung aller Exons bei Patienten mit einer Pankreatitis sehr aufwendig und nur mit genügend vorhandener DNA möglich. Auch aus diesem Grund konnte in dieser Kohorte keine vollständige CFTR Mutationsanalyse durchgeführt werden. Die Problematik der „Gengrösse“ (27 Exons) erklärt auch die nur begrenzt vorhandenen Daten hinsichtlich einer CFTR-Mutationsverteilung in der Normalbevölkerung. Während die ∆508F-Mutation mit 66 % als häufigste Mutation beschrieben wird [93], ist die R553X-Mutation in Familien mit einer zystischen Fibrose (~1,8 %) selten [98]. Wir konnten bei 2 von 24 Patienten (8,3 %) eine R553X-Mutation nachweisen, wobei offen bleiben muss, ob dies spezifisch für Patienten mit pHPT und Pankreatitis ist. Da CFTR, PRSS1 und SPINK1 Mutationen verschiedene Proteine betreffen, ergibt sich eine mögliche synergistische Risikoerhöhung für das Auftreten einer Pankreatitis bei gleichzeitigem Vorliegen [21, 63]. Der bereits, im Gegensatz zu den restlichen Patienten, im jungen Alter erkrankte trans-heterozygote Patient mit pHPT und Pankreatitis (SPINK1: N34S/ CFTR: R553X) unterstützt diese Hypothese einer Kumulation von genetischen Risikofaktoren eindrücklich. Dabei ist die These des synergistischen genetischen Effektes weitgehend akzeptiert und verschiedene Studien konnten bereits Kombinationen von SPINK1 Mutationen und CFTR Mutationen bei Patienten mit einer ICP nachweisen [6, 20, 63, 66, 102]. Nach den Daten von Noone et al. [63] ist das Risiko eine Pankreatitis zu entwickeln 40-fach erhöht, wenn zwei CFTR Mutationen vorliegen und um das 900-fache erhöht, sollte eine Heterozygotie für CFTR und N34S vorliegen. Cohn et al. beschrieben 2005 ein 10-fach erhöhtes Risiko eine chronische Pankreatitis zu entwickeln, wenn eine SPINK1 Mutation vorliegt, ein 48 40-fach erhöhtes Risiko für compound heterozygote CFTR Mutations-Träger und ein 500-fach erhöhtes Risiko sollten beide Genotypen vorliegen [21]. CFTR Gen Mutationen scheinen also ebenso wie die N34S Mutation bei der Entstehung einer Pankreatitis bei Patienten mit einem pHPT eine wichtige Rolle zu spielen. Ob weitere CFTR Mutationen bei vollständiger Sequenzierung gefunden worden wären, kann nicht beantwortet werden, scheint jedoch wahrscheinlich. Somit wäre auch eine größere genetische Suszeptibilität hinsichtlich der CFTR Mutationen denkbar. Abschließend ist zu sagen, dass das Pankreatitisrisiko bei Patienten mit pHPT ca. 10 fach erhöht ist. Dabei scheint die starke Assoziation der N34S SPINK1 und CFTR Mutationen (inklusive des 5T Allel) bei 9 von 25 Patienten mit pHPTassozierter Hyperkalzämie und Pankreatitis, die These zu unterstützen, dass die Hyperkalzämie lediglich das Risiko für die Entstehung einer Pankreatitis erhöht, aber möglicherweise nicht als alleiniger kausaler Auslöser gelten kann. Inwieweit weitere genetische und Umweltfaktoren eine Rolle bei der Entstehung einer Pankreatitis spielen ist bis zu jetzigen Zeitpunkt ungeklärt. Es ist daher von Nöten, weitere Kollektive mit pHPT prospektiv auf die von uns gestellte Hypothese einer multifaktoriellen untersuchen, um diese Ergebnisse zu validieren. 49 Genese der Pankreatitis zu











