Die Schrödinger Gleichung und ihre Anwendung:
Werbung

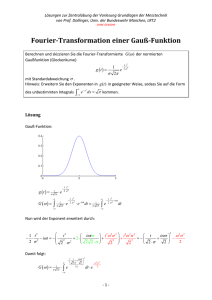
http://www.echemie.de.vu (oder http://bastian16.tripod.de) Die Schrödinger Gleichung und ihre Anwendung: Zwar lehnt die SG an Gleichungen zur klassischen Beschreibung von stehenden Wellen an. Sie lässt sich aber im Gegensatz zu jenen auf keiner weise herleiten! Es handelt sich um eine fundamentale Gleichung ähnlich der Newtonschen Axiome (wenn auch nicht sofort einleuchtend). Was die Gleichung kann: - durch Lösen der SG (es handelt sich dabei um eine Differentialgleichung) kann auf die Wellenfunktion eines Teilchens geschlossen werden. Dies ist immer dann nötig wenn man atomare Dimensionen betrachtet. Hier versagt die Newtonsche Mechanik völlig, da Quantisierungen auftreten. Durch Beschreibung dieser diskreten Energien eines Systems durch sehende Wellen ergibt sich eine Quantisierung von selbst. Anschaulich entspricht die errechnete Wellenfunktion (ψ) die Amplitude einer Welle in Abhängigkeit der Zeit und des Ortes. - Manchmal liefert die SG komplexe Wellenfunktionen (beinhalten − 1 = i ). Folglich kann die Wellenfunktion selber nicht interpretiert werden. Durch Bildung des Betragsquadrates der Wellenfunktion Ψ 2 erhält man aber eine anschauliche Größe, welche man als Wahrscheinlichkeitsdichte bezeichnet. Durch Quadrieren fällt der komplexe Teil der Funktion weg ( − 1 ⋅ − 1 = −1 ) hierdurch erhält man eine Physikalisch interpretierbare und messbare Größe. Die Idee welche hinter der Interpretation von 2 Ψ steckt, ist folgende: Wie bereits bekannt war ist die Intensität (Leistung pro Fläche) von Elektromagnetische Strahlung proportional zum Quadrat der Amplitude der Wellenfunktion der Strahlung (E-Feld) I ∝ E . Da ψ der Amplitude (Auslenkung) der Wellenfunktion eines beliebigen Teilchens an einem bestimmten Punkt entspricht, sollte dessen Quadrat proportional (nicht gleich!!) zur Wahrscheinlichkeit ein Teilchen dort anzutreffen, sein. 2 Vorsicht: Eine hohe Wahrscheinlichkeitsdichte an der Stelle A bedeutet nicht, dass die Wahrscheinlichkeit ein Teilchen dort anzutreffen groß ist. Es kommt auch auf die Größe von A an! Z.B. hat ein Elektron eines H-Atoms im Kern (wird später durch lösen der SG gezeigt) das größte Ψ 2 also die größte Wahrscheinlichkeitsdichte. Allerdings ist der Kern so klein, dass es wiederum unwahrscheinlich ist, ein e- dort anzutreffen. Zur Gleichung: Die Schrödinger Gleichung kann je nach Problem modifiziert werden. Durch anpassen an das jeweilige Problem kann sie stark vereinfacht werden und das lösen der Differentialgleichung fällt viel leichter. Man unterscheidet zwischen der zeitabhängigen SG und der zeitunabhängigen SG. Die meisten Probleme lassen sich bereits mit der zeitunabhängigen SG lösen. Da sie nur reelle Wellenfunktionen liefert ist der Rechenweg wesentlich einfacher. Die allgemeine Form der SG lautet: 2 2 2 ∂Ψ( x , y , z ,t ) h 2 ∂ Ψ( x ,t ) ∂ Ψ( y ,t ) ∂ Ψ( z ,t ) − + + + Ψ = V i h ( x , y , z ,t ) ( x , y , z ,t ) ∂y 2 ∂z 2 2m ∂x 2 ∂t Die Anwendungsweise wird weiter unten an vielen Beispielen erläutert. (SG Auswendiglernen) http://www.echemie.de.vu (oder http://bastian16.tripod.de) Betrachtet man nur eine Dimension z.B. Ein Teilchen in einen eindimensionalen „Kasten“ so vereinfacht sich die Gleichung: 2 ∂Ψ( x ,t ) h 2 ∂ Ψ( x ,t ) − + Ψ = V i h ( x ,t ) ( x ,t ) 2m ∂x 2 ∂t Nun sieht die Gleichung immer noch sehr abstakt aus. Dies wird sich legen wenn man einfach mal anfängt mit der Gleichung zu rechnen und sie umzuformen. h = Planckkonstante= 6.62608 x 10-34Js (Naturkonstante) h h≡ 2π m = Masse des Teilchens V = Potentielle Energie (Lageenergie) des Teilchens als Funktion des Ortes und der Zeit ψ = Wellenfunktion des Teilchens – Amplitude in abh. Des Ortes und der Zeit ∂ 2 Ψ( x ,t ) = Zweite Ableitung der Wellenfunktion nach x = Steigung der Steigung der Wellenfunktion = ∂x 2 Krümmung der Welle Nun ist die Potentielle Energie eines Teilchens (V) nur selten von der Zeit abhängig sondern meist nur von Aufenthaltsort (stationärer Fall). Diese Überlegung führt zur Zeitunabhängigen SG: Durch geschicktes Umformen lässt sich zeigen, dass die Wellenfunktion dann auch zeitunabhängig ist. Geschickt ist folgende Umformung: Ψ( x ,t ) = ψ ( x ) ⋅ e − iωt Man trennt also die Wellenfunktion in eine neue nur ortsabhängige Funktionψ ( x ) und eine zeitabhängige Funktion der Form e − iωt . Einsetzen ergibt: 2 − iωt ∂ (ψ ( x ) ⋅ e −iωt ) h 2 ∂ (ψ ( x ) ⋅ e ) −iωt + V ⋅ψ ⋅ e = ih − ( x) ( x) 2m ∂t ∂x 2 Man beachte, dass V also die Potentielle Energie nur noch von x, also dem Ort des Teilchens abhängt. Die linke Seite der Gleichung lässt sich durch Umformen vereinfachen. Auf der rechten Seite kann nun einfach nach der Zeit abgeleitet werden (Kettenregel). − 2 h 2 ∂ ψ ( x ) −iωt ∂ (e − iωt ) −iωt e V e i ⋅ + ⋅ ψ ⋅ = h ⋅ψ ( x ) ( x) ( x) 2m ∂x 2 ∂t 2 h 2 ∂ ψ ( x ) −iωt − ⋅ e + V( x ) ⋅ψ ( x ) ⋅ e −iωt = ih ⋅ e −iωt ⋅ (−iω ) ⋅ψ ( x ) 2 2m ∂x i ⋅ (−i ) = +1 http://www.echemie.de.vu (oder http://bastian16.tripod.de) − 2 h 2 ∂ ψ ( x ) −iωt ⋅ e + V( x ) ⋅ψ ( x ) ⋅ e −iωt = h ⋅ e −iωt ⋅ ω ⋅ψ ( x ) 2 2m ∂x − 2 h 2 ∂ ψ ( x ) + V( x ) ⋅ψ ( x ) = h ⋅ ω ⋅ψ ( x ) 2m ∂x 2 /: e-iωt E = h ⋅ν ω≡ dϕ 2π = = 2πυ zur Erinnerung der Definition der Winkelgeschwindigkeit. dt T Î ω = 2π E h 2 h 2 ∂ ψ ( x ) E h E Î− + V( x ) ⋅ψ ( x ) = h ⋅ 2π ⋅ψ ( x ) = ⋅ 2π ⋅ψ ( x ) 2 2m ∂x 2π h h 2 h 2 ∂ ψ ( x ) + V( x ) ⋅ψ ( x ) = E ⋅ψ ( x ) Dies ist die Zeitunabhängige (eindimensionale) SG Î− 2m ∂x 2 Durch sie (in der 3D Form) lassen sich z.B. die Wellenfunktionen des Wasserstoffatoms exakt berechnen. Hierbei handelt es sich um eine gewöhnliche homogene Dgl. 2. Ordnung wie wir sie in der Vorlesung von Prof. Pavel ein dutzend Mal gelöst haben. E ist die Gesamtenergie des Teilchens, welche sich aus potentieller und kinetischer Energie zusammensetzt. Hierdurch kann man sich die zweite Ableitung nach dem Ort verdeutlichen. Da es sich hierbei um die 2 Krümmung der Wellenfunktion handelt ∂ ψ ( x ) . ∂x 2 Î Nimmt bei konstanter Gesamtenergie E die Potentielle Energie V(x) ab, so muss die Krümmung der Welle zunehmen. Hierdurch steigt die Frequenz wegen kürzerer Wellenlänge. Bevor man nun loslegt und versucht die Dgl. Für verschiedene Systeme im atomaren Bereich anzuwenden sollte man sich folgendes vor Augen halten: - Eine homogene Dgl. Hat nie eine Lösung sondern unendlich viele. (Wenn ψ eine Lösung der SG ist, so ist Nψ auch eine. Wie man N „Normierungsfaktor“ bestimmt kommt später) - Die Wellenfunktion muss in jedem Punkt stetig sein. - Die Wellenfunktion muss differenzierbar sein 1.Anwendung: Das Teilchen im eindimensionalen „Kasten“: (Teilchen kann sich nur entlang x- Achse bewegen) 0 röhre l Nach klassischer Mechanik würde sich der rote Ball in der Röre hin und herbewegen. Die Energie kann jeden beliebigen Wert annehmen. Jeder Ort des 1D-Kastens weist die gleiche Wahrscheinlichkeit auf. http://www.echemie.de.vu (oder http://bastian16.tripod.de) Diese klassische Überlegung gilt aber nur für makroskopische Objekte. Im atomaren Bereich gilt dagegen die Quantenmechanik. Das Teilchen muss dann als Wellenfunktion beschrieben werden, welche die Zeitunabhängigen SG erfüllt. für 0 < x < l für 0 > x > l Î V=0 Î V= unendlich Wenn das Potential an einem Ort unendlich groß ist bedeutet das quantenmechanisch, dass sich ein Teilchen dort niemals aufhalten wird. Die Wellenfunktion ist dann 0. Î Randbedingungen: ! ψ ( x =0 ) = 0 ! ψ ( x =l ) = 0 Anpassen der SG: 2 h 2 ∂ ψ ( x ) − + V( x ) ⋅ψ ( x ) = E ⋅ψ ( x ) 2m ∂x 2 Da V(x) = 0 für 0 < x < l Î 2 2 h 2 ∂ ψ ( x ) h 2 ∂ ψ ( x ) − = E ⋅ψ ( x ) Î − − E ⋅ψ ( x ) = 0 2m ∂x 2 2m ∂x 2 Diese Dgl. Löst man nach dem allgemeinen Verfahren für homogene Dgl. 2.Ordnung. Vgl. Skript Mathe für Naturwissenschaftler (Pavel) –stures anwenden der Formel- a la Pavels Rezept. dψ E ⋅ 2m h2 2 ≡λ Î − λ − E = 0 Î λ2 + =0 dx 2m h2 Î λ hat zwei (Komplexe)Lösungen: − E ⋅ 2m E ⋅ 2m =i⋅ 2 h h2 λ1 = λ2 = − − E ⋅ 2m E ⋅ 2m = −i 2 h h2 Î Allgemeine Lösung der Dgl.: (noch Komplex; muss noch ins Reelle konvertiert werden) ψ ( x) = A ⋅ e E ⋅2 m i ⋅ ⋅ x h 2 + B⋅e Î zwei partikuläre Lösungen: E ⋅ 2m ⋅ x 2 h E ⋅ 2m = e 0⋅x ⋅ sin ⋅ x 2 h ψ 1( x ) = e 0 x ⋅ cos ψ 2( x) E ⋅2 m −i⋅ ⋅ x h 2 http://www.echemie.de.vu (oder http://bastian16.tripod.de) Î Allgemeine Lösung der Dgl.: -reell- E ⋅ 2m E ⋅ 2m ⋅ x + B ⋅ e 0⋅x ⋅ sin ⋅ x 2 h h2 ψ ( x ) = A ⋅ e 0 x ⋅ cos E ⋅ 2m E ⋅ 2m ⋅ x + B ⋅ sin ⋅ x 2 h h2 ψ ( x ) = A ⋅ cos Nun müssen nur noch die Konstanten A u. B bestimmt werden. Diese können in diesem Fall sehr leicht aus den Randbedingungen ermittelt werden. Bestimmung von A: ψ ( 0) = A ⋅ cos(0) + B ⋅ sin(0) = 0 Î A=0 E ⋅ 2m ⋅ x 2 h Îψ ( x ) = B ⋅ sin Bestimmung von B: E ⋅ 2m ⋅ l = 0 2 h ψ ( x=l ) = B ⋅ sin E ⋅ 2m ⋅ l = 0, π, 2π, 3π, 4π, 5π…= n ° π 2 h Diese Bedingung ist erfüllt, wenn entweder B=0 oder B=0 ist eine triviale Lösung und wird nicht weiter berücksichtigt. n=0 ist wegen der Unschärferelation nicht erlaubt. Wie man erkennt ergibt sich beim verwenden von Wellenfunktionen zur Beschreibung der Mechanik in atomarer Größenordnungen zwangsläufig ein Quantisierung der Energie: 2 2 E ⋅ 2m n ⋅ π n ⋅π h E = Î erlaubte Energieniveaus = n l h2 l 2m Außerdem ergibt sich für jedes n eine Wellenfunktion: n ⋅π ⋅ x l ψ ( x ) = B ⋅ sin Um nun noch B zu bestimmen bedient man sich der Normierungsbedingung. B entspricht hier also dem vorher schon angesprochenen Normierungsfaktor N. Wie schon erwähnt ist ψ 2 ein maß für die Wahrscheinlichkeitsteilchendichte. Multipliziert mit dem gesamten möglichen Aufenthaltsort muss die Wahrscheinlichkeit 1 sein. Der Aufenthaltsort ist im eindimensionalen logischerweise eine Linie. 2 n ⋅π ⋅ x l ψ ( x ) = B 2 ⋅ sin 2 l Î Es muss gelten: ∫ 0 ! n ⋅π B 2 ⋅ sin 2 ⋅ x ⋅ dx = 1 l http://www.echemie.de.vu (oder http://bastian16.tripod.de) Die Formelsammlung ergibt für die Stammfunktion: l x 1 n ⋅π 1 n ⋅ π = B 2 l − ⋅ sin 2 l − 1 = B2 − x ⋅ sin 2 n ⋅ π 2 l l n ⋅π 2 4 4 l l 0 l 1 1 = B2 − 2 4 n ⋅ π l Î B= l 1 n ⋅ π ⋅ sin 2 l = B2 − l 2 4 n ⋅ π l 0 1 n ⋅π 0 − ⋅ sin 2 2 l n ⋅π 4 l B 2l ⋅ sin (2nπ ) = =1 2 2 l Î Normierte Wellenfunktionen für den Kasten: 2 n ⋅π ⋅ sin ⋅ x ψ ( x) = l l MERKE: Wie hier sehr ausführlich gezeigt wurde kann man mit Hilfe der Schrödingergleichung Wellenfunktionen für bestimmte Systeme errechnen. Anschaulich gibt jene die Auslenkung (Amplitude) der Materiewelle in Abhängigkeit des Ortes wieder (Zeitunabhängige Schrödingergleichung). Bei Systemen bei denen sich die Potentielle Energie mit Ort und Zeit ändert muss die Zeitabhängige SG verwendet werden um die Wellenfunktion zu bestimmen. Da jene Funktionen meist komplex sind kann die Wellenfunktion nicht interpretiert werden, wohl aber die Wahrscheinlichkeitsdichte. Die Wahrscheinlichkeitsdichte wird auch verwendet um eine allgemeine Lösung einer SG zu normieren. Hierbei muss die Wahrscheinlichkeit eins ergeben, wird das gesamt möglich Aufenthaltsvolumen (im Dreidimensionalen Î 2D Aufenthaltsfläche, 1D Aufenthaltslinie) mit der Wahrscheinlichkeitsdichte multipliziert.