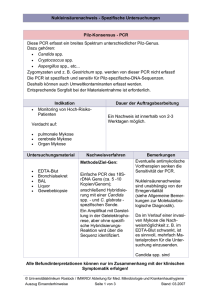
Handbuch für die Probenentnahme und Hinweise zu
Werbung

Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 1 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Institut für Medizinische Mikrobiologie und Hygiene, Uniklinikum Giessen und Marburg GmbH, Standort Marburg Hinweise zur Probenentnahme und zu besonderen Erregern für die mikrobiologische Diagnostik und Leistungsverzeichnis PD Dr.med. Frank Sommer und das Kollegium des Institutes für Medizinische Mikrobiologie und Hygiene in Marburg Version 10/2014 (aktualisiert 3/2014; 10/2014) Name Datum Dr. F. Sommer 04.05.2012 Überarbeitung: Dr. F. Sommer 10.10.2014 Prüfung: Dr. M. Kerwat 10.10.2014 Freigabe: Dr. M. Lohoff 10.10.2014 Erstellung: Unterschrift Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 2 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Wichtige Telefonnummern DECT TELEFON DIENSTARZT MIKROBIOLOGIE 64133 Bei Fragen an die ärztlichen Kolleginnen und Kollegen der Mikrobiologie (Diagnostik, nicht Hygiene) bitte bevorzugt das DECT-Telefon 64133 anrufen. Danke! Prof. Lohoff Sekretariat 06421-58-66455 DECT 64120 OA PD Dr. Sommer 06421-58-64330 DECT 64123 OÄ Frau Dr. Kerwat 06421-58-64312 DECT 64124 Dr. Cherkasov 06421-58-66123 DECT 64122 Frau Dr. Streubel 06421-58-66068 DECT 64126 Mitarbeiter Hygiene Prof. Mutters 06421-5864302, DECT 94302 Dr. Nonnenmacher 06421 09-64358, DECT 64121 Dr. Streubel 06421-58-66068, DECT 64126 Befundauskunft 06421-58-66061 (Varia und TB) 06421-58-66055 (Stuhl und Urin) Ärztlicher Notdienst Erreichbar über Information Uniklinikum Marburg (06421 58) 63691 Das Handy des „Ärztlichen Notdienstes“ ist nur außerhalb der „normalen“ Dienstzeiten der Mikrobiologie aktiv geschaltet! Bitte rufen Sie auf dem Dienstarzt-DECT-Handy (s. oben) an. Sonstige Telefonnummern der Labore Hygiene -65673 Zentrallabor -66263 Virologie -65147 (PCR Labor) Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie siehe Seite 14 2 Blutkulturen Seite 3 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 ZIVD (Serologie) -62098, -64313 Dienstzeiten Labor Marburg Montag bis Donnerstag 7.00 bis 18.00 Freitag 7.00 bis 17.45 Samstag 7.30 bis 15.00 Sonntag 8.00 bis 13.30 Außerhalb dieser Zeiten ist der ärztliche Notdienst erreichbar (s. unten). Die diensthabenden Ärzte sind während der regulären Dienstzeiten nicht über das NotdienstHandy erreichbar, sondern über ihre Funker (s. oben) oder über die 66061. Vorgehen bei Notfällen außerhalb der regulären Dienstzeiten 1) Rufen Sie den diensthabenden Mikrobiologen über Info Klinikum an. Tel (06421-58)-63691 2) Vereinbaren Sie, auf welche die Weise die Probe in das Labor kommt (weiteres s. Notfallschein). 3) Füllen Sie den Notfallschein aus (nur Kliniken Marburg). Dieser ist im Intranet/Hygieneportal/Formulare hinterlegt 4) Füllen Sie einen normalen Einsendeschein aus Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Leistungsverzeichnis Aktinomykose (s.Kapitel 6 (letzter Abschnitt) und 15) Amöben (s. Kapitel 5) Angina Plaut-Vincentii (s. Kapitel 9) Ascaris (s. Kapitel 5 Bandwürmer/Ascaris) Aspergillus (s. Kapitel 15) Atypische Mykobakterien (s. Kapitel 12) Atypische Pneumonie (s. Kapitel 12) Bakterien allgemein via 16S PCR (s. Kapitel 15) Bandwürmer (s. Kapitel 5) Blutkulturen (s. Kapitel 2) Borrelien (s. Kapitel 15) Botulismus (s. Kapitel 15) Candida sp. (s. Kapitel 15) Chlamydia trachomatis (s. Kapitel 6) Chlamydophila pneumoniae (s. Kapitel 12) Chlamydophila psittaci (s. Kapitel 12) Clostridium difficile (s. Kapitel 5) Clostridium perfringens (S. Kapitel 15) Corynebacterium diphtheriae (s. Kapitel 9) C-MRSA (s. Kapitel 15) Diarrhoe (Untersuchung bei Diarrhoe) (s. Kapitel 5) Dimorphe Pilze (s. Kapitel 15) Diphtherie (s. Kapitel 9) Echinokokken (s. Kapitel 15) EHEC (Shiga-like-Toxin) (s. Kapitel 5) ESBL-bildende Bakterien (s. Kapitel 15) Gardnerella vaginalis (Kapitel 6) Gasbrand (s. Clostridium perfringens) Gonokokken (s. Kapitel 6) Helicobacter pylori (s. Kapitel 5) Herzklappe (s. Kapitel 13) HUS (Hämolytisch-Urämosches Syndrom) (s. EHEC) IGRA (Interferon-gamma release assay –TB) (s. Kapitel 12 unter “Tuberkulose”) Kryptosporidien (s. Kapitel 5) Lamblien (s. Kapitel 5) Leptospira sp. ( s. Kapitel 15) Legionellen (s. Kapitel 12) Leishmaniasis (s. Kapitel 15) Malaria (s. Kapitel 15) Meningokokken (s. Kapitel 7) Meningitis (s. Kapitel 7) Mikrosporidien (s. Kapitel 5) Mycoplasma pneumoniae (s. Kapitel 12) Morbus Whipple (s. Kapitel 15) MRSA (s. Kapitel 15) Nokardien (s. Kapitel 12) Oxyuren (s. Kapitel 5) Pneumonie (s. Kapitel 11 und 12) Pneumocystis jirovecii (carinii) (s. Kapitel 12) Schistosomen (s. Kapitel 15) Shiga-like-Toxin (s. EHEC) Seite 4 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 5 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Staphylococcus aureus MRSA (s. Kapitel 15) Toxoplasmose (s. Kapitel 15) Typhus (s. Kapitel 5) Trichomonas vaginalis (s. Kapitel 6) Tuberkulose (s. Kapitel 12) Vancomycin-resistente-Enterokokken(VRE; s. Kapitel 15) Viren (Abteilung Virologie !) Wurmeier (s. Kapitel 5) Zystizerkose (s. Kapitel 15) Übersicht (Erreger/Verfahren/Material) Erreger Nachweisverfahren Material Hinweise Actinomyces spp. (Aktinomykose) Kultur (14 Tage) Abstrich, Gewebe Aeromonas hydrophila Amöben Kultur Stuhl Längere Bebrütung notwendig (s. Kapitel 6 (letzter Abschnitt) und 15) Erreger bei Gastroenteritis Mikroskopie, AntigenSchnelltest, PCR Stuhl Angina Plaut-Vincentii Mikroskopie, Kultur Mikroskopie Kultur, Mikroskopie, Abstrich Stuhl BAL, Bronchialsekret, Gewebe, Punktate Serum, BAL BAL, Bronchialsekret, Gewebe, Punktate Ascaris lumbricoides Aspergillus spp. Aspergillus spp. Atypische Mykobakterien Antigen-Nachweis Kultur, Mikroskopie Atypische Pneumonie (s. Kapitel 12) Bakterien allgemein via 16S PCR (s. Kapitel 15) PCR Für den Nachweis von Magnaformen (bei akuter blutiger Amöbiasis) ist frischer, sofort ins Labortransportierter Stuhl notwendig. Sollen nur Zysten nachgewiesen werden (Trägerstatus?) kann der Stuhl über Nacht im Kühlschrank gelagert werden. Für PCR bitte eine ExtraStuhl-Röhrchen einsenden. (s. auch Kapitel 5) (s. auch Kapitel 9) (s. Kapitel 5) (s. auch Kapitel 15) Fremduntersuchung (s. auch Kapitel 12). Bei besonderen Fragestellungen bitte Rücksprache mit Labor! (s. Kapitel 12) Zum Beispiel Punktate, Liquor, Herzklappe und andere primär-sterile Für den 16S PCR Nachweis auf bakterielle DNA bitte ein zusätzliches Probenröhrchen mit Material einsenden. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 6 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Mikroskopie Materialien Stuhl (s. auch Kapitel 15) Bandwürmer Bartonella spp. Serologie Serum Bordetella pertussis PCR, Serologie Rachenabstrich (PCR), Serum (Serologie) Katzenkratzkrankheit, z.B. bei Abklärung unklarer Halslymphknotenschwellung. Bestes Verfahren für den Nachweis einer frischen Infektion ist die PCR aus dem Rachenabstrich (Fremduntersuchung Giessen). Abstrich-Röhrchen ohne Gel verwenden. Die Serologie kann meist nicht zwischen Impfung und Infektion unterscheiden. Borrelien Serologie Serum Botulismus (s. Kapitel 15) Bei Verdacht auf Botulismus bitte immer Rücksprache mit dem Labor (s. Kapitel 15). Diagnostik ist nur wenig als Therapiekontrolle geeignet. In Marburg und Umgebung rel. hohe Durchseuchung! (Durchseuchungstiter!) (s. Kapitel 15) Bei Verdacht auf Botulismus bitte immer Rücksprache mit dem Labor Brucella Kultur, Serologie Gewebe, Punktate, Herzklappe (Kultur). Serum für Serologie Campylobacter spp. Candida spp. Kultur Kultur, Serologie, AgNachweis Chlamydia trachomatis PCR Chlamydia pneumophila Serologie, PCR Chlamydophila Serologie Stuhl Kultur: alle in der MIBI üblichen Materialien (z.B. Abstrich, Gewebe, Punktat etc…). Für Serologie oder Ag- Nachweis Serum oder Vollblut einsenden. Urethralabstrich mit entsprechendem Abstrich-Besteck. Serologie: Serum PCR: BAL; Trachealsekret Serum ACHTUNG. Brucella ist eine Erreger der Risikogruppe 3 nach Biostoffverordnung. Bei klinischem Verdacht Material bitte eindeutig kennzeichnen und telefonisch anmelden! Erreger einer Gastroenteritis Clostridium difficile (s. Kapitel 5) Toxin-Nachweis, Kultur Stuhl Clostridium perfringens Kultur, Mikroskopie Eiter, Abstrich. (s. Kapitel 5) s. auch Kapitel 6 Für PCR bitte eine Probe in einem Extra-Röhrchen einsenden. s. auch Kapitel 11 s. auch Kapitel 5. Das Toxin ist rel. instabil. Gewebe, s. auch Kapitel 15, Bei V.a. Gasbrand bitte telefonische Rücksprache mit dem Labor Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie c-MRSA Kultur Corynebacterium diphtheriae (s. Kapitel 9) Kultur, Mikroskopie Coxiella burnetii Serologie, PCR Serologie: Serum PCR: BAL; Trachealsekret Cryptococcus neoformans Cryptosporidien Antigen-Nachweis Serum, Liquor Antigen-Nachweis, Mikroskopie s. Kommentar! Stuhl Serologie, mikroskopischer Nachweis Häkchen. Serologie: Serum. Für den Nachweis von EchinococcusHäkchen: Zystenflüssigkeit. Stuhl, (Serum) Dimorphe Pilze (Histoplasmose, Kokzidioidomykose) Nasenoder Rachenabstrich, Eiter in einem sterilen Röhrchen, sonst. Proben z.B. Gewebe oder Abszessmaterial 2 x Rachenabstrich Version: H Diese Version ersetzt die Fassung vom Juni 2014 s. auch Kapitel 15 s. auch Kapitel 15 Bei V.a. Diphtherie bitte telefonische Rücksprache mit dem Labor. ACHTUNG! Der Verdacht auf Diphtherie ist meldepflichtig! Mit einem „schnellen“ Grampräparat kann eine Diphtherie weder bestätigt noch ausgeschlossen werden. Für PCR bitte eine Probe in einem Extra-Röhrchen einsenden Fremduntersuchung Bioscentia. Fa. s. Kapitel 15. ACHTUNG. Dimorphe Pilze sind Erreger der Risikogruppe 3 nach Biostoffverordnung. Bei klinischem Verdacht Material bitte eindeutig kennzeichnen und telefonisch anmelden! s. Corynebakterium diphtheriae Diphtherie (s. Kapitel 9) Echinococcose Seite 7 von 40 von EHEC (Shiga-likeToxin-bildende E.coli) PCR (Toxinnachweis im Stuhl), Kultur, Antikörper im Serum Entamöba histolytica Enterobius vermicularis ESBL-bildende Bakterien Gasbrand Siehe unter „Amöben“ Mikroskopie Kultur s. unter Clostridium perfringens Tesafilm auf Objektträger Abstrich, Gewebe, Abszess, etc. s. auch Kapitel 15 s. auch Kapitel 5, Fremduntersuchung (Uni Giessen). Serum bitte nur nach telef. Rücksprache mit dem Labor einsenden. s. unter „Amöben“ s. Kapitel 5 unter „Oxyuren“ s. auch Kapitel 15 Bei Verdacht auf Gasbrand sollte die Probe direkt per Bote ins Labor transportiert werden. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Gardnerella vaginalis (bakterielle Vaginose) Mikroskopie, Kultur Giardia lablia Gonokokken s. unter Lamblien PCR Helicobacter pylori (s. Kapitel 5) Ag-Nachweis (Stuhl), Resistenzbestimmung (Magenbiopsie), Serologie (Serum) HUS (HämolytischUrämosches Syndrom) (s. EHEC) IGRA (Interferongamma release assay –TB) siehe bei EHEC Vaginalabstrich, Sofortpräparat Urethralabstrich mit entsprechendem Abstrich-Besteck. s. links Seite 8 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 s. auch Kapitel 6. Die beste Nachweismethode ist der direkte Nachweis von sog. „Clue-cells“ im Direktpräparat. Daneben kann Gardnerella vaginalis auch kulturell nachgewiesen werden. s. unter Lamblien s. unter Kapitel 6 Für Resistenzbestimmung (Fremduntersuchung Uni Freiburg) bitte eine Biopsie in Portacul einsenden. s. auch Kapitel 5 Vollblut in bestimmten, nur dafür vorgesehen Röhrchen. Bei Unklarheiten bitte telef. Rücksprache. s. auch Kapitel 12 unter Tuberkulose Ag Schnelltest, Mikroskopie, PCR Stuhl Legionellen Schnelltest im Urin (Notfall, ZentralLabor). Serologie, PCR, Kultur. Urin: Ag Teste („Notfall“ und „Standard“) Atemwegsmaterialien (z.B. BAL, Bronchialsekret) für PCR und Kultur. Serum für Serologie Leishmanien (Leishmaniasis) div div Der Antigen-Schnelltest und die Mikroskopie haben keine optimale Sensitivität, sind aber als ScreeningVerfahren geeignet. Bei fortbestehendem Verdacht und negativer Mikroskopie empfiehlt sich die Durchführung einer PCR aus dem Stuhl (Fremduntersuchung, BNI, Hamburg) Siehe auch Kapitel 11 WICHTIG: Rund um die Uhr steht für die Notfalldiagnostik ein Schnelltest im Urin auf Legionellen im Zentral-Labor des Uniklinikum Marburg zur Verfügung. Dieser erfasst aber nur den Serotyp 1 (ca. 90% aller Infektionen). s. Kapitel 15 bei V.a. Leishmaniasis bitte telefonische Rücksprache mit dem Labor Leptospira sp. Serologie, PCR Serologie: Serum Kryptosporidien Kapitel 5) Lamblien lamblia) Interferon- Assay Release (s. (Giardia ( s. Kapitel 15) Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie PCR: Urin Liquor, Blutkultur, Gelenkpunktat, Gewebe, Abszessmaterial, etc. Listeria monocytogenes Kultur Madenwurm Siehe Enterobius vermicularis Malaria Meningokokken Kapitel 7) (s. Mikroskopie, Kultur Meningitis s. Kapitel 7 Mikrosporidien Mikroskopie, PCR Mycobakterium tuberculosis s. unten, „Tuberkulose“ Mycoplasma pneumoniae Serologie, PCR Liquor, Blutkultur s. auch Kapitel 15. Malaria Diagnostik findet „rund um die Uhr“ im Zentral-Labor des Uni-Klinikums Marburg statt. Bei V.a. auf Meningokokken-Meningitis bitte telefonische Anmeldung des Materials! Stuhl s. Kapitel 5 Atemwegsmaterialien, wie BAL, Sputum, Bronchialsekret s. Kapitel 11 unter s. Kapitel 15 MRSA s. Kapitel 15 Nokardien s. Kapitel 12 Oxyuren s. unter „Enterobius vermicularis Pneumocystis jirovecii (carinii) Quantiferon-Test Schistosomen PCR Shiga-like-Toxin EHEC) Staphylococcus aureus MRSA Tetanus s. unter EHEC Toxoplasmose (s. Kapitel 15) Treponema pallidum (Lues) Version: H Diese Version ersetzt die Fassung vom Juni 2014 Bei Verdacht auf generalisierte ListerienInfektion immer auch Blutkulturen abnehmen! Die Listerien-Serologie (Bestimmung von Antikörpern) ist eine sinnlose Untersuchung und wird daher nicht angeboten. Morbus Whipple (s. Seite 9 von 40 s. unter vermicularis“ Am besten BAL oder Bronchialsekret „Enterobius s. Kapitel 12 s. unter „IGRA“ s. Kapitel 15 s. Kapitel 15 Kultur, PCR Falls bei Verdacht auf Tetanus Laboruntersuchungen stattfinden sollen, bitte zunächst telel. Rücksprache. Serologie Serum Unterschiedlicher Umfang der serologischen Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 10 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Untersuchungen je nach Fragestellung. Bei Verdacht auf Typhus in “akuter” Phase Blutkulturen und NICHT Stuhl einsenden. Die Einsendung von Stuhl macht erst nach einem Krankheitsverlauf von 2 Wochen Sinn. Fremduntersuchung, BNI, Hamburg Typhus (s. Kapitel 5) Kultur, Blutkultur Blutkultur, (Spätphase) Trichinella spiralis Serologie Serum Mikroskopie, PCR, Kultur, QuantiferonTest Kultur s. Kapitel „Tuberkulose“ Abstriche, Urin, Stuhl, Abszess, etc. s. Kapitel 15 Kultur Stuhl Mikroskopie Stuhl ACHTUNG. Spezielles Transportmedium notwendig. Bitte immer telef. Rücksprache mit Labor Bitte für alle Untersuchungen auf Viren ein gesondertes Röhrchen in die Abteilung für Virologie senden! s. auch Kapitel 5 Bei Verdacht auf Parasiten im Gastrointestinaltrakt (z.B. Bandwurm) an drei verschiedenen Tagen Stuhl einsenden. Serologie Serum Trichomonas vaginalis (s. Kapitel 6) Tuberkulose VancomycinresistenteEnterokokken(VRE) Vibrio cholera Viren (Abteilung Virologie !) Wurmeier Zystizerkose solium) (Taenia Stuhl 12 s. Kapitel 12 „Tuberkulose“ Inhaltsverzeichnis 1 Allgemeine Hinweise zur Probengewinnung /Probeneinsendung 2 Blutkulturen 3 Katheter und Katheterspitzen 4 Urin 5 Stuhl 6 Genitalabstriche/Sekrete 7 Liquor 8 Augenabstriche 9 Nasen-, Rachen-, und Tonsillenabstriche 10 Ohrabstriche 11 Materialien aus dem tiefen Respirationstrakt Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 11 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 12 Tuberkulose und atypische Mykobakterien 13 Materialien von Wundinfektionen, Abszesse, Gewebe 14 Punktate aus primär sterilen Bereichen 15 Spezielle einzelne Erreger und Verfahren 16 Hinweise zur Antibiotikatherapie allgemein 17 Anhang 18 Literatur 1 Allgemeine Hinweise /Probeneinsendung zur Probengewinnung Alle Proben sollten, wenn möglich, vor Beginn einer antimikrobiellen Therapie gewonnen werden. Im Klinikum Marburg bitte ab sofort nur das Order-Entry-System (Lauris) verwenden. Dazu bitte im Lauris-System auf „Auftragserfassung“ klicken. Dort finden Sie die entsprechenden Anforderungsformulare: 1-Mikrobiologie (für „alles“ außer 2-4) 2-MRSA 3-MRE (inkl. MRSA) 4-Tuberkulose Im „Intranet“ unter Button „Institut für Laboratoriumsmedizin“ finden Sie unter „Lauris“ entsprechende Hilfen. Für alle externen Einsender (nicht Uniklinikum Marburg) oder im Falle dass „Lauris“ außer Betrieb ist bitte Einsendescheine verwenden. Bitte benutzen Sie für alle Abstriche, Punktate, Atemwegsmaterialien etc. den Schein MB1. Für Stuhl, Urin, Mykobakterien (TB) und Blutkulturen bitte den Schein MB2. Mit einem Schein MB 1 können drei Materialien von einem (!) Patienten eingesendet werden. Vorgehensweise: 1. Kodieren Sie das Material (z.B. C2 für Nasenabstrich) indem Sie das Feld „C“ und das Feld „2“ mit einem Bleistift markieren. 2. Bringen Sie einen Patientenaufkleber im Feld Patientenetikett an. 3. Ziehen Sie den Aufkleber mit dem Barcode ab und bringen Sie diesen auf dem Probenröhrchen/Material an. Beschriften Sie zusätzlich auf diesem Barcodeaufkleber das Probenröhrchen mit dem Namen des Patienten. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 12 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 4. Tragen Sie das Abnahmedatum in das entsprechende Feld ein. 5. Markieren Sie die gewünschte Untersuchung. Finden Sie die gewünschte Untersuchung nicht, geben Sie diese handschriftlich auf dem Einsendeschein an (im Feld Fragestellung). Bei „seltenen“ Untersuchungen rufen Sie bitte vorher das Labor an. Geben Sie links oben am Schein folgendes an: - Diagnose, Grunderkrankungen und/oder Symptomatik in Stichworten - Angaben zur antimikrobiellen Therapie - Reiseanamnese, falls vorhanden Die Abnahme einer Probe bei einem Patienten muss in den Patientenunterlagen dokumentiert werden (Wer? Wann? Was?). Transport, Verpackung und Lagerung Transport und Verpackung Für die Verpackung sind die Richtlinien nach UN 3373 und die 3 Verpackungsanweisung P 650 zu beachten . Die Verpackung setzt sich zusammen aus einer Innenverpackung (mit dichtschliessendem Probengefäß und Aufsaugmaterial) und einer Außenverpackung (von guter Qualität, die genügend widerstandsfähig ist, um den Stößen und Belastungen, die unter normalen Beförderungsbedingungen auftreten, standzuhalten). ACHTUNG. Bitte beachten. In Abstrichtupfer-Röhrchen (siehe Abbildung unten) darf weder Blut noch andere Flüssigkeiten gefüllt werden. Aus Sicherheitsgründen sind Abstrichröhrchen dafür nicht zugelassen. Flüssigkeiten bitte in verschraubbare Einmalröhrchen füllen (plus Umverpackung, wie oben beschrieben). Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 13 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Abstrichtupfer Flüssige Proben 3 Das erste Gefäß muss dicht sein und darf höchstens 500ml enthalten .Das erste Gefäß dann in ein zweites bruchsicheres und dichtes Gefäß einbringen (Umverpackung). Zwischen dem ersten Gefäß und dem zweiten Gefäß muss absorbierendes Material eingesetzt werden. Das absorbierende Material muss ausreichend sein, um die gesamte, im ersten Gefäß enthaltene Flüssigkeitsmenge, aufzunehmen. Die Außenverpackung darf höchstens 4 Liter enthalten. Lagerung von Proben (bis zur Abholung durch den Transportdienst) -Abstriche von Wunden: bei Raumtemperatur, maximale Lagerzeit über Nacht 0 -Sputum, Bronchialsekret, BAL: bei 4 Grad. Proben aus den Atemwegen sollten 2 innerhalb von zwei Stunden im Labor sein -Blutkulturen: bei Raumtemperatur, maximale Lagerungszeit über Nacht (16h). -Liquor: bei Raumtemperatur. Bei V.a. Meningitis sollte der Liquor per Notfallschein direkt ins Labor transportiert werden Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 14 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 0 -Urin: bei 4 Grad, maximale Lagerzeit über Nacht -Direkt per Bote ins Labor transportiert werden sollten zum Beispiel auch: Proben bei Verdacht auf Gasbrand, Stuhlproben bei Verdacht auf akute Amöbiasis, Liquor bei Verdacht auf eitrige Meningitis Die Proben sollten möglichst innerhalb von 2 Stunden im Labor bearbeitet werden. Die 2 Stunden Frist gilt insbesondere für Proben aus den tiefen Atemwegen und alle Proben aus primär sterilen Gebieten. Details über Lagerung und Transport siehe auch in der Übersichtstabelle oben. In Ausnahmefällen können Proben länger gelagert werden (s. unten im Text). Eine Zeit von 12 h soll dabei nicht überschritten werden. 2 Blutkulturen Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 15 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Aerobe und anaerobe Blutkulturflasche der Firma BD Indikationen -V.a. Bakteriämie -Systemische Infektionen, Sepsis -Meningitis, Pneumonie -Endokarditis -Kontrolle einer positiven Blutkultur (z.B. mit S.aureus oder Candida) -V.a. Katheterinfektion Materialien -venöses Blut in Blutkulturflasche (Bactec, BD) Hinweise zur Entnahme Bitte nur Bactec-Flaschen verwenden. Bitte eine aerobe und eine anaerobe Flasche abnehmen. Speziell für kleine Volumina an Blut (insbesondere Kinder) gibt es die „Pedibact“ Flasche. Bei Verdacht auf Pilzinfektionen empfiehlt sich die „Myko“ Flasche. Zwar können Pilze auch mit den „Standard“ Blutkulturen-Flaschen nachgewiesen werden, die „Myko“-Flasche weist aber eine höhere Sensitivität bei Pilzinfektionen auf. Flaschen nicht belüften. Für Blutkulturen keine anderen Gefäße verwenden. Lagerung der unbeimpften Flaschen: kühl und dunkel. Bitte achten Sie auf das Verfallsdatum der Flaschen. Blutkulturflaschen werden bis zu 5 Tagen bebrütet, d.h. ein negatives Ergebnis erhalten Sie nach 5 Tagen. Beimpfung und Blutabnahme: Hinweis: Bitte verwenden Sie wann immer möglich das Sarstedt-Abnahme System (s. Abbildung), weil dadurch das Umfüllen in die Blutkulturflaschen entfällt (und die Gefahr von Nadelstichverletzungen geringer ist). Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 16 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 17 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Wichtig ist die sorgfältige Hautdesinfektion bei der Abnahme von venösem Blut (Händedesinfektion; Einmalhandschuhe verwenden; Desinfektion der Entnahmestelle; Desinfektionsmittel mindestens 1 Min. einwirken lassen; nach der Desinfektion nicht mehr palpieren!). Bei Verwendung des SarstedtAbnahme-Systems (mit den entsprechenden Adaptern) füllt sich die Blutkulturflasche automatisch mit einem optimalen Volumen an Blut. Kann das Sarstedt-System nicht verwendet werden bitte folgendermaßen vorgehen: Gummimembran der Flasche mit 70%-Ethanol desinfizieren. Maximal 3-10 ml Patientenblut durch die Gummimembran in die Blutkulturflasche injizieren (optimal sind 8 ml pro Flasche). Für Pedibakt-Flaschen ist ein Volumen von 1-3 ml optimal (falls nicht mehr zu gewinnen ist - auch nur 0,5 ml). Nährmedium und Blut durch Schwenken der Flasche mischen. Sicherheitshinweis: Nadel nicht zurück in Schutzkappe bringen, sondern Spritze mit Nadel in dafür vorgesehenes Abfallgefäß entsorgen. Cave Nadelstichverletzungen! Bitte keine Flaschen in den Probentransport geben, die Blutanheftungen außen aufweisen! Anforderung via Order/Entry-System oder Blutkulturflasche mit dem Barcode von Schein MB2 bekleben. Dort auch den Namen des Patienten eintragen (auf den Barcode-Kleber). Blutkulturflaschen bis zur Abholung bei Raumtemperatur lagern. WICHTIG Möglichst im Fieberanstieg mehrere (3-4) Blutkulturen abnehmen! Die Sensitivität einer Blutkulturuntersuchung ist gut wenn 3 Blutkulturen (3 x 1 Pärchen) abgenommen werden und optimal wenn 4 Blutkulturen abgenommen wurden. Ein zeitlicher Mindestabstand zwischen den Entnahmen ist nicht erforderlich. Im Notfall (z.B. V.a. auf beginnende Sepsis) natürlich sofort abnehmen, so dass keine Verzögerung entsteht. Soweit machbar sollten die Blutkulturen durch getrennte Punktion gewonnen werden. Wenn das nicht möglich ist (zum Beispiel Notfall, schlechte Venenverhältnisse) macht es durchaus auch Sinn, 3-4 Blutkulturen sofort hintereinander an einer Punktionsstelle abzunehmen. Dringende Fälle (akute Endokarditis, septischer Schock): sofort 3-4 Blutkulturen in rascher Folge abnehmen. Weniger dringende Fälle (unklares Fieber, subakute Endokarditis): 3-4 Blutkulturen innerhalb von 24 Stunden abnehmen. Nur in diesen „weniger dringenden“ Fällen (z.B. Endocarditis lenta) macht es Sinn auf einen Fieberanstieg zu warten. Insbesondere bei Endokarditis ist die Abnahme mehrerer Blutkulturen vor Beginn der Antibiose sehr wichtig! Eine laufende Antibiotikatherapie ist keine Kontraindikation zur Untersuchung, insbesondere wenn unter Antibiose weiterhin Fieber besteht, bzw. die Antibiose klinisch nicht anspricht. Zur Bewertung der Relevanz eventuell nachgewiesener Keime sind bei Blutkulturen klinische Angaben besonders wichtig. Bitte Grund für die Abnahme von Blutkulturen und eventuelle VorAntibiose angeben. Lagerung beimpfter Blutkulturflaschen. Beimpfte Blutkulturflaschen bei Raumtemperatur lagern. Lagerung ist bei Raumtemperatur bis zu 24 Stunden möglich. Durch die längere Lagerung (bis zu 24 Stunden) wird die Sensitivität der Untersuchung nicht eingeschränkt, aber die Diagnostik verzögert sich natürlich um diese Zeit. Daher in dringenden Fällen dafür Sorge tragen, dass die Blutkulturflaschen schnell ins Labor transportiert werden. In dringenden Notfällen (z.B. frisch aufgenommener Patient mit unklarer Sepsis) zu Zeiten außerhalb der normalen Dienstzeiten (abends, Wo-Ende) bitte den Dienstarzt Mikrobiologie verständigen. Dieser kann organisieren, dass die Blutkulturen direkt in den „Notfall“-Blutkulturschrank im Zentral-Labor gestellt werden. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie siehe Seite 14 2 Blutkulturen Fehlermöglichkeiten Seite 18 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 4 -zu wenig Blutkulturen abgenommen (zum Beispiel hat die Abnahme von nur einem Pärchen eine geringe Sensitivität) -antibiotische Behandlung, bzw. Vorbehandlung -zu geringes Blutvolumen in Blutkulturflasche -Verunreinigung der Probe mit Keimen der normalen Hautflora 3 Katheter und Katheterspitzen Indikation: -Katheterinfektion, Kathetersepsis Material: -Katheter und Katheterspitzen: in sterilem Röhrchen einsenden. Hinweise zur Entnahme: Katheter steril entfernen (Katheterspitze nicht berühren und auch nicht über nicht-sterile Oberflächen streifen lassen; „no-touch Methode“), die vorderen 5 cm des Katheters mit einer sterilen Schere abtrennen und in einem sterilen Röhrchen nativ, ohne Zusatz von Flüssigkeit oder Nährmedien ins Labor einsenden. 4 Urin Indikation: -Harnwegsinfektionen (z.B. Zystitis, Pyelonephritis) Materialien: Mittelstrahlurin, (steriles Versandröhrchen). Die genaue Instruktion des Patienten ist sehr wichtig (s. unten „Hinweise zur Entnahme“) 10 ml sind ausreichend. Katheterurin, Blasenpunktionsurin: (steriles Versandröhrchen). Einmalplastikbeutel bei Säuglingen. Nur als orientierende Untersuchung nach sorgfältiger Reinigung des Perineums praktikabel. Externe Einsender (Einsender außerhalb von Marburg): bitte Urikult benutzen Hinweise zur Lagerung und Transport: a) Nativurin 7 Nativurin ist das am besten geeignete Material . Nach DIN-ISO 15189 müssen durch den Arzt oder 8 das Pflegepersonal der genaue Zeitpunkt der Entnahme auf dem Einsendeschein mitgeteilt werden . Urin möglichst schnell ins Labor bringen. Als Qualitätsstandard ist anerkannt, dass die Probe 7 innerhalb von 2 Stunden nach Entnahme im Labor sein sollte . Steht die Probe längere Zeit bei Raumtemperatur vermehren sich die Bakterien und es kann z.B. zu falsch hohen Keimzahlen kommen. Muss die Urinprobe gelagert werden, ist die bei 4 Grad Celsius durchzuführen 7 (Kühlschrank!) . Im Kühlschrank ist eine Lagerung über Nacht (bis zu 16 Stunden) möglich. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 19 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 b) Urikult Bei längerer Lagerung/längerer Transportzeit Eintauchobjektträger (Urikult) verwenden. 7 Objektträgerkulturen sollten nur ausnahmsweise verwendet werden, da diese viele Nachteile haben . Externe Einsender, die nicht in Marburg sind, sollten aber (bis auf besondere Fälle) dennoch Urikults verwenden. (Vorgehen beim Urikult: Urin in Tauchagargefäß auffangen, Agar vollständig eintauchen und abtropfen lassen, überschüssigen Urin verwerfen (!). Im Röhrchen darf kein flüssiger Urin „übrig“ bleiben! Tauchagar im Gefäß einsenden.) Urikults sollten soweit diese Möglichkeit besteht auf der Station über Nacht bebrütet werden. Wo diese Möglichkeit nicht besteht, den Urikult möglichst schnell ins Labor schicken und nicht mehrere Stunden rumstehen lassen. Hinweise zur Entnahme: Mittelstrahlurin beim Mann: Hände und Vorhaut mit Seife waschen. Vorhaut zurückziehen, Eichel waschen, mit frischem Wasser spülen und sauberem Tuch abtrocknen. Die erste Portion Urin verwerfen. Dann 10-20 ml Urin in einem sterilen Gefäß auffangen. Mittelstrahlurin bei der Frau: Äußeres Genitale gründlich mit Seife waschen, mit Wasser abspülen. Urethralmündung und Umgebung mit feuchten sterilen Tupfern reinigen, mit einem sterilen Tupfer trocknen. Weiteres Vorgehen wie beim Mann. Katheterurin: bei Dauerkatheter nach Desinfektion Punktion des Katheters an der dafür vorgesehenen Einstichstelle oder aus dem Katheter ablaufen lassen. Nicht aus dem Beutel entnehmen. Bei Verdacht auf Urogenital-TBC 50 ml Morgenurin an drei aufeinanderfolgenden Tagen einsenden. Bewertung der Keimmenge 5 >10 Keime /ml Harnwegsinfektion wahrscheinlich 4 5 10 bis 10 Keime/ml Grenzbereich. Harnwegsinfektion möglich. Bei Kindern sind bereits 4 Keimzahlen ab 10 Keimen/ml verdächtig für eine Harnwegsinfektion. 3 <= 10 Keime/ml Harnwegsinfektion unwahrscheinlich (Ausnahme z.B. unter antibiotischer Therapie) Fehlermöglichkeiten: -Eine Lagerung eines Nativurins ungekühlt über 2 Stunden kann zu falsch hohen Keimzahlen und damit zu falsch positiven Ergebnissen führen. -Wird ein Nativurin gekühlt ca. 24 Stunden gelagert kommt es bereits zu einer Keimreduktion 7 zwischen 10 und 20% . Im Einzelfall kann das zu falsch-negativen Ergebnissen führen -Fehler bei der Probenabnahme, z.B. Kontamination des Urins mit Keimen der normalen Hautflora -Abnahme unter Antibiotika-Therapie kann zu falsch negativen Ergebnissen führen -Bei starker Diurese können die Keimzahlen falsch zu niedrig ausfallen. -Größere Menge an Urin im Urikultröhrchen führt während des Transports zur wiederholten Benetzung des Urikults und damit zu falschen Ergebnissen Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 20 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 5 Stuhl Indikation -Diarrhoe durch bakterielle Erreger (Salmonellen, Shigellen, Yersinien, Campylobacter sp., Aeromonas) -Antibiotika-induzierter Durchfall: Clostridium difficile (Toxinnachweis). -Verdacht auf Infektion mit entero-hämorrhagischen Escherichia coli (EHEC) -Personaluntersuchung auf Salmonellen/Shigellen -Verdacht auf Infektion mit Kryptosporidien oder Mikrosporidien -Untersuchung auf Wurmeier und Parasiten Untersuchungsmaterial -Stuhl Eine erbsengroße Menge fester Stuhl, bzw. ca. 1ml flüssiger Stuhl oder Schleim ist ausreichend! Stuhlröhrchen zu einem Drittel füllen, falls parasitologische und/oder Antigen-Tests angefordert werden. Bei der Entnahme von Stuhl mit dem Löffel sollten blutige, schleimige oder eitrige Anteile bevorzugt entnommen werden. Führt der Patient dies selbständig durch, sollte er darauf hingewiesen werden. -Biopsiematerial Biopsiematerial aus dem Colon ist keine typische Probe zur mikrobiologischen Untersuchung. Daher bitte Zweck der Einsendung angeben (z.B. Untersuchung auf CMV), evtl. auch telefonische Rücksprache. -Duodenalsaft (für Untersuchung auf Lamblien) Duodenalsaft möglichst schnell ins Labor transportieren. -Magenbiopsie (f. Untersuchung auf H.pylori, s. unten unter „H.plyori“). Hinweise zur Lagerung und Tranpsort Erreger von Infektionen im Bereich des Darmes sind unterschiedlich empfindlich. Empfindliche Erreger, welche schnell absterben, sind zum Beispiel Campylobacter und Shigellen. Proben sollten dafür für eine optimale Diagnostik nach 4 Stunden im Labor sein. Eine Zeit von 24 Stunden bis zur Verarbeitung der Proben darf nicht überschritten werden. Probenlagerung bis zur Verarbeitung o erfolgt bei 4 C. In bestimmten Fällen wie Cholera oder Verdacht auf akute Amöbiasis müssen die Proben sofort direkt nach der Entnahme ins Labor. In diesen Fällen bitte Rücksprache mit dem Labor! Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 21 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Untersuchungen -pathogene Keime (Salmonellen, Shigellen, Yersinien, Campylobacter) -Dyspepsie Coli (nur bis zu einem Alter von 2 Jahren sinnvoll) Folgende Untersuchungen bitte gesondert anfordern (sind nicht in der Anforderung „pathogene Keime“ enthalten !) -Parasiten (z.B. Lamblien, Amöben, Wurmeier, tropische parasitäre Erkrankungen) -Enterohämorrhagische E.coli (EHEC) -Nachweis von Clostridium difficile Toxin -Nachweis von Spross- und Schimmelpilzen -Viren (z.B. Adenoviren, Rotaviren, Noro-Viren ) Diese bitte mit dem Virologie Schein anfordern (Schein 24). Stufendiagnostik Bei der Stuhldiagnostik ist wegen der Vielzahl an möglichen Untersuchungen eine Abwägung welche Untersuchungen sinnvoll sind sehr wichtig. Insbesondere muss auf dem Einsendeschein auch die Fragestellung der Untersuchung stehen (z.B. Durchfall nach Auslandsaufenthalt). Stationärer Patient Bei Krankenhauspatienten ist, wenn die Symptomatik erst mehr als 3 Tage nach Aufnahme beginnt, eher an nosokomiale Ursachen zu denken (z.B. Clostridium-difficile Colitis) als an Salmonellen. Untersuchung auf Salmonellen aber sinnvoll bei Verdacht auf Salmonellen-Ausbruch innerhalb des Krankenhauses. Bei Verdacht auf eine nosokomiale Enteritis-Epidemie sollte untersucht werden auf: Salmonellen, Shigellen, Campylobacter, Yersinien, Rota- und Adenoviren, EHEC und evtl. Noro-Virus. Bei stationären Patienten mit Immunsuppression (z.B. AIDS) und Diarrhoe ist neben der StandardStuhl Untersuchung (Salmonellen, Shigellen, etc...) auch die Untersuchung auf Kryptrosporidien, Mikrosporidien, Parasiten, Wurmeier, Rotaviren und Adenoviren. Bei ungeklärten Verläufen kann auch eine Untersuchung auf Mykobakterien, Clostridium perfringens (mit Toxinnachweis) und Aeromonas 9 spp. sinnvoll sein. Werden Darmbiopsien entnommen sollten diese auch auf CMV untersucht werden . Ambulanter Patient, bzw. Stationärer Patient mit ambulant-erworbener Diarrhoe Die Standard Anforderung ist eine Untersuchung auf Salmonellen, Shigellen, Campylobacter und Yersinien. Je nach Alter des Patienten und klinischer Situation ist dieses Basis-Schema noch zu ergänzen durch Untersuchung auf: (DIESE Erreger bitte alle zusätzlich anfordern!): -Parasiten und Wurmeier -Amöben (=PCR im BNI, Hamburg) -Aeromonas -Vibrio cholera -C.difficile -EHEC -EPEC -Cryptosporidien -Mikrosporidien -Mykobakterien -CMV Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 22 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 -Pilze -Viren (z.B. Adenoviren, Rotaviren, Noro-Viren) Hinweise zu einzelnen Erregern (Stuhldiagnostik) Clostridium difficile Bei Verdacht auf C.difficile Infektion Stuhl – wie oben beschrieben- einsenden. Es wird ein Elisa auf Toxin im Stuhl durchgeführt und eine Kultur, um den Erreger anzuzüchten. Das Ergebnis des Elisa auf Toxin liegt noch am selben Tag vor, wenn die Probe bis 12.00 im Labor ankommt. Das Ergebnis der Kultur liegt nach 48h vor. Für einige Einsender wird (da so gewünscht) die Kultur nur in besonderen Fällen durchgeführt. Interpretation besonderer Fälle: Toxin-Elisa-negativ, Kultur auf C.difficile positiv, das Isolat produziert kein Toxin. Es liegt wahrscheinlich eine Besiedlung mit einem nicht-Toxin produzierendem C.difficile-Stamm vor. Dies hat keinen Krankheitswert und erfordert keine Hygienemaßnahmen. Toxin-Elisa-negativ, Kultur auf C.difficile positiv, das Isolat produziert Toxin. Der Toxin-Elisa ist wahrscheinlich falsch negativ (das Toxin ist relativ instabil). C.difficile-assoziierte Erkrankung möglich, bei Diarrhoe sind entsprechende Hygienemaßnahmen erforderlich Oxyuren Bei Verdacht auf Oxyuren (Enterobius vermicularis) , bitte nicht Stuhl, sondern Analabklatschpräparat (Tesafilm) einsenden! Durchführung: Die in der Nacht im Perianalbereich abgelegten Eier werden mit Tesafilm am Morgen vor dem Waschen abgenommen. Der Tesafilmstreifen wird faltenfrei auf einen Objektträger aufgebracht. Typhus Bei Patienten mit Verdacht auf Typhus sind Stuhlkulturen nur ab der 2. Woche sinnvoll. In der akuten Phase erfolgt bei Typhus die Diagnose über Blutkulturen. Ruhr- oder Choleraverdacht Bei Ruhr- oder Choleraverdacht bitte telefonische Rücksprache mit dem Labor. Amöben Bei Verdacht auf eine Infektion mit Entamöba histolytica empfehlen wir die Durchführung einer PCR im Bernhard-Nocht-Institut in Hamburg. Die Probe wird durch uns dorthin verschickt. Zusätzlich wird im Institut f. Med. Mikrobiologie, Marburg, eine mikroskopische Untersuchung durchgeführt. Die mikroskopische Untersuchung hat aber – selbst bei geübten und erfahrenen Untersuchern – keine Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 23 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 optimale Sensitivität. Außerdem ermöglicht die Mikroskopie nicht die Differenzierung zwischen der pathogenen Form (E.histolytica) und apathogenen Formen (z.B. E.dispar). Allerdings kann mit der Mikroskopie (oft, aber nicht immer) sehr schnell (in wenigen Stunden) eine Verdachtsdiagnose gestellt werden. Daher sollte auf die Mikroskopie in akuten Fällen nicht verzichtet werden. Einsendung von Stuhl zur Mikroskopie: Für den Nachweis von Zysten reicht normal-eingeschickter Stuhl aus. Zysten sind relativ stabil und gehen auch über Nacht nicht kaputt. Soll der Nachweis von beweglichen Trophozoiten versucht werden (macht nur Sinn bei Verdacht auf akute Amöbiasis bei blutigem Stuhl) muss Stuhl in der Warmhaltebox innerhalb von 30 Minuten ins Labor gebracht werden. Bei Verdacht auf Amöbeninfektion daher bitte immer Rücksprache mit dem Labor. Lamblien Lamblien können Erreger akuter Diarrhöen sein, es gibt aber auch chronische (bzw. längere) Infektionen, die durch abdominelle Beschwerden und/oder leichte Diaarhoe gekennzeichnet sind. Die Untersuchung auf Lamblien erfolgt mikroskopisch im Stuhl (erbsengroße Menge an Stuhl im Stuhlröhrchen einschicken) oder auch im Duodenalsaft. Auf Schein MB2 Parasiten/Wurmeier ankreuzen und bei „Speziell“ vermerken „Lamblien“. Für den Nachweis steht sowohl ein AntigenSchnelltest als auch die Mikroskopie zur Verfügung. Diese Teste eigen sich als Screening-Verfahren, erfassen aber nicht jede Infektion. Besteht ein Verdacht auf Lambliasis trotz negativer Mikroskopie (z.B. Fälle in der Familie, chronische abdominelle Beschwerden unklarer Genese) empfehlen wir die Durchführung einer PCR (aus dem Stuhl; Fremduntersuchung, BNI, Hamburg). EHEC EHEC (entero-hämorrhagischer E.coli) ist ein Erreger von Diarrhoe, blutiger Diarrhoe (Colitis) und dem HUS). Die Untersuchung auf EHEC im Stuhl erfolgt: -mittels eines chromatographischen Schnelltestes (Dieser erkennt das Shiga-Toxin und den Stamm O157). Das Ergebnis liegt ca. 4-6 Stunden nach dem Eingang im Labor vor. -eine Kultur und eine PCR auf Verotoxin (Shiga-like Toxin) im Stuhl. Dies ist eine Fremduntersuchung (Uni Giessen). Wir leiten das Material nach Giessen weiter. Anforderung Schein MB2: EHEC. Zusätzlich ist eine serologische Untersuchung in bestimmten Fällen sinnvoll (Serum einsenden), evtl. telefonische Rücksprache. Bandwürmer/Ascaris Bei V.a. auf Bandwürmer/Ascaris 3x Stuhl, wie oben beschrieben einschicken. Markieren: Parasiten/Wurmeier. Soll ein Wurm differenziert werden, diesen in physiologischer Kochsalzlösung (z.B. in einem Urinbecher) einschicken. Typhus Bei Verdacht auf Typhus im Stadium der Kontinua nicht Stuhl, sondern Blutkulturen einsenden. Im Stuhl können die Erreger erst nach ca. 2-3 Wochen nachgewiesen werden. Kryptosporidien oder Mikrosporidien Stuhl einsenden, wie oben beschrieben. Bitte handschriftlich vermerken: Kryptosporidien und Mikrosporidien. Der Nachweis erfolgt mikroskopisch nach modifizierter Ziehl-Neelsen Färbung. Zystizerkose Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 24 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Bei Verdacht auf Zystizerkose Serum mit Schein 23 an das ZIVD schicken. Helicobacter pylori Für die Resistenzbestimmung von H.pylori wird eine Biopsie benötigt. Magenbiopsie unmittelbar nach Entnahme in „Portagerm Pylori“ einbringen! Kein anderes Medium verwenden! Die Biopsie(n) muss/müssen sich deutlich (mindestens 5 mm) unter der Oberfläche des Mediums befinden (Biopsien nicht auf das Medium legen!), da H.pylori sonst rasch abstirbt. Bitte beimpftes Medium noch am Tag der Abnahme ins Labor schicken! Falls möglich (z.B. bei einer elektiven Biopsieentnahme zur Resistenzbestimmung) bitte die Probe bis 11.00 in das MIBI-Labor bringen lassen (Hol- und Bringedienst) damit die Probe noch am selben Tag verschickt werden kann. Möglichst solche Proben nicht am Freitag einsenden, da am Wochenende keine Weiterverarbeitung erfolgt (Fremduntersuchung). 6 Genitalabstriche/Sekrete Indikation -Urethritis -Vaginitis, auch bakterielle Vaginose (Gardnerella vaginalis) -Zervicitis, Adnexitis -Prostatitis, Epididymitis -Untersuchungen in der Schwangerschaft (z.B. Chlamydien, B-Streptokokken) Geeignete Materialien -Cavumabstrich -Cervix- oder Vaginalabstriche -Sekret, Fluor (Abstrich in Transportmedium) -Ejakulat, Prostataexprimat (steriles Gefäß) Hinweise zur Entnahme Mann: Harnröhrenöffnung mit Wasser reinigen, Harnröhre ausstreichen, so dass ein Tropfen Sekret mit sterilem Tupfer entnommen werden kann. Frau: Zervixsekret oder Vaginalsekret unter Verwendung eines sterilen Vaginalspekulums entnehmen. Urtehralabstrich nach Reinigen der Harnröhrenöffnung mit Wasser entnehmen. Ejakulat oder Prostataexprimat wird in einem sterilen Röhrchen aufgefangen. Wichtiger Hinweis: Die Untersuchungsanforderung „pathogene Keime“ enthält bei Cervix-/Urethralabstrichen auch Mycoplasmen, Ureaplasmen und Gardnerella vaginalis. Im Gegensatz dazu sind Chlamydien und Gonokokken nicht in der Anforderung „pathogene Keime“ enthalten. Bei Verdacht auf Urethritis durch diese Keime (bzw. STD) bitte diese Keime gesondert anfordern und gesondertes Abnahme-Material verwenden. Für Chlamydien-PCR bitte spezielle Abstriche verwenden (s. unten) Gardnerella vaginalis Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 25 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Die bakterielle Vaginose ist durch das Auftreten bestimmter Bakterien gekennzeichnet. Einer dieses „Leitkeime“ ist Gardnerella vaginalis. Die bakterielle Vaginose kann am besten durch ein direktes Präparat von Vaginalsekret nachgewiesen werden („Clue-cells“). Gardnerella vaginalis kann auch kulturell nachgewiesen werden. Der kulturelle Nachweis und Differenzierung kann bis zu 96h dauern. Daher erhalten viele Befunde von Vaginalabstrichen den Kommentar „Untersuchungsergebnis auf Gardnerella vaginalis folgt“. Wichtig: Gardnerellen lassen sich auch bei gesunden Frauen in der Vaginalflora nachweisen. Entscheidend für die Diagnose ist der klinische Befund und das Direktpräparat „Clue cells“. Der kulturelle Befund kann die Diagnose nur unterstützen (Typischer Befund: Fehlen von Laktobazillen, reichlicher Nachweis von Gardnerella vaginalis und evtl. auch Anaerobiern). Trichomonadendiagnostik: Zur Trichomonadendiagnostik einen Objektträgerausstrich direkt vor Ort anfertigen und lufttrocknen. Bitte diesen Ausstrich unfixiert und ungefärbt ins Labor schicken. PCR auf Chlamydien (Chlamydia trachomatis) und Gonokokken Bei Verdacht auf STD für die Untersuchung auf Chlamydien und Gonokokken bitte einen Abstrich mit den entsprechenden „Chlamydien“ Abstrich-Besteck vornehmen. Alternativ eignet sich auch Urin, hier am besten Morgenurin (10 ml). Bei Verdacht auf Chlamydien-Infektion des Auges mit einem Wattestäbchen (evtl. angefeuchtet mit steriler isotonischer NaCl) etwas Sekret entnehmen, bzw. abstreichen. Lagerung in einem sterilen Röhrchen mit etwas steriler, isotonischer Kochsalzlösung. Wattestäbchen nicht in ein Röhrchen mit Gel einbringen! Aktinomykose im Urogenitalbereich Bei Verdacht auf Aktinomykose, diese Untersuchung bitte auch gezielt anfordern. Materialien von Patienten mit Verdacht auf Aktinomykose werden länger bebrütet (bis zu 2 Wochen). Dementsprechend erhalten Sie ein negatives Ergebnis erst nach dieser Zeit. (Schein MB1, sonstige Untersuchung, Aktinomykose handschriftlich hinzufügen!). Gonokokken Zum Nachweis von Gonokokken steht eine PCR-Methode und die Kultur zur Verfügung. Die sicherste Methode ist die PCR (s. oben „PCR auf Chlamydien (Chlamydia trachomatis) und Gonokokken“) 7 Liquor Indikation -ambulant erworbene Meningitis -nosokomiale Meningitis (z.B. postoperativ) -Meningitis bei liegenden Liquordrainagen -Neuroborreliose (z.B. für Borrelien-Serologie) -Tertiäre Lues mit ZNS-Beteiligung für Lues-Serologie Geeignete Materialien Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 26 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 -Liquor Hinweise zur Entnahme Liquorpunktion unter streng aseptischen Bedingungen durchführen. Für die Bakteriologie wird ein Extra-Röhrchen benötigt (zusätzlich zur Zytologie, bzw. Zellanalyse). Wird eine PCR-Untersuchung gewünscht (z.B. Tuberkulose-, Herpes-, oder Borrelien-PCR ) ist ein zusätzliches, steriles Röhrchen mit Liquor erforderlich. (Volumen: 500 µl ) Transport und Lagerung bei Raumtemperatur. Zusätzlich zum nativen Liquor kann ein Teil des Liquors in eine Blutkulturflasche gegeben werden. Diese dann bitte als Liquorflasche kennzeichnen auf dem Schein MB2. Eventuell außerdem Blutkulturen abnehmen (s.oben) Liquor sofort ins Labor transportieren. Bei V.a. auf eitrige Meningitis außerhalb der normalen Dienstzeiten den Notdienst der Mikrobiologie informieren (erreichbar über Info Klinikum Marburg – 06421-5863691) . Meningokokken Bei Verdacht auf Meningokokken Liquor einsenden (wie oben beschrieben) und Blutkulturen abnehmen. Tuberkulose Für die Untersuchung auf Tuberkulose ist nur nativer Liquor geeignet. Für die Untersuchung auf TBC im Liquor wird ein relativ großes Volumen benötigt (5 ml und mehr)! Bei Verdacht auf tuberkulöse Meningitis empfiehlt sich auch die Durchführung einer PCR. Daher bitte ein Extra Liquor Röhrchen für die (gesamte) TB-Diagnostik mit dem Schein MB2 einsenden. 16S/18S PCR In besonderen Fällen kann auch eine 16S/18S PCR durchgeführt werden, siehe Kapitel 15. 8 Augenabstriche Indikation -V.a. bakterielle Konjunktivitis -Endophtalmitis -Acanthamoeben-Keratitis Geeignete Materialien -Bindehaut-Sekret/Abstrich (Abstrich in Transportmedium) -Kammerspülwasser, Glaskörperpunktat Hinweise Bindehaut: Abstrich mit Abstrichtupfer entnehmen. Punktate: Punktat direkt im sterilen Röhrchen einsenden (kein Abstrich!). Bei Chlamydiendiagnostik bitte Rücksprache mit Labor. Bei V.a. auf seltene Erreger z.B. Toxocariose oder Akanthamöben bitte immer Rücksprache mit dem Labor. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 27 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 9 Nasen-, Rachen-, und Tonsillenabstriche Indikation -Nasenabstrich: Nachweis einer Kolonisation mit MRSA; eitrige Rhinitis -Rachenabstrich: Angina, Pharyngitis (z.B. durch A-Streptokokken) -Diphtherie -Mykose im Nasen-/Rachenbereich Geeignete Materialien -Abstrich mittels Abstrichtupfer vom entsprechenden Bereich Hinweise zu einzelnen Erregern Diphtherie Bei Verdacht auf Rachendiphtherie: Abstrich unterhalb der pseudomembranösen Belege, bitte Vorabinformation des Labors; bereits der Verdacht auf Diphtherie ist meldepflichtig. Bitte 2 Abstriche einschicken! (Einer wird für ein mikroskopisches Präparat, der andere für die Kultur benötigt). Da Corynebakterien physiologischerweise im Rachen vorkommen, kann die Aussage des Präparates gering sein. Es ist wahrscheinlich, dass auf Basis des Präparates ein Diphtherie-Verdacht weder bestätigt noch ausgeschlossen werden kann. In einigen Fällen kann aber eine Verdachtsdiagnose untermauert werden (beim reichlichen Vorkommen „typisch“ aussehender Bakterien). Einen sicheren „Schnelltest auf Diphtherie“ gibt es somit nicht. MRSA Untersuchung Siehe Anhang „Hinweise zur Untersuchung auf MRSA“. Angina Plaut Vincentii Bei Verdacht auf Plaut-Vincentii Angina bitte diesen Verdacht handschriftlich auf dem Befund vermerken! Hier bitte auch stets ein mikroskopisches Präparat anfordern (2 Tupfer) 10 Ohrabstriche Indikation - Otitis externa - Otitis media Geeignete Materialien -Mittelohrsekret -Gehörgangsabstrich Hinweise Geeignetes Material von der Läsion mittels Abstrichtupfer entnehmen. Abstrichtupfer mit Transportmedium einschicken. Otitis externa: eventuell vor dem Abstrich Krusten entfernen. Mit dem Tupfer Läsionen abstreichen. Bei trockenen Läsionen Tupfer ggf. mit etwas phys. Kochsalzlösung anfeuchten. Lagerung bei Raumtemperatur. Wird als Diagnose Otitis externa angegeben werden routinemäßig die Pilzplatten länger (bis zu einer Woche) bebrütet. Nach 48h wird allerdings bereits ein Endbefund erstellt, da nur sehr selten Schimmelpilze noch nach dieser Zeit kulturell nachgewiesen werden können. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 28 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 11 Materialien aus dem tiefen Respirationstrakt Indikation -Pneumonie -Verdacht auf Tuberkulose -atypische Pneumonie Geeignete Materialien Sputum Sputum (Auswurf) kann einfach (nicht-invasiv) gewonnen werden und ist für die Infektionsdiagnostik geeignet. Sputum wird von Patienten häufig mit Speichel gleichgesetzt. Daher muss den Patienten und dem beteiligten medizinischen Personal die richtige Gewinnung von Sputum erklärt werden, wobei besonders auf den Unterschied zwischen Sputum und Speichel hinzuweisen ist. Eine Anleitung für Patienten befindet sich im Anhang. Besonders gut geeignet ist das erste Morgensputum. Kann spontan kein Sputum aus der Tiefe produziert werden, lässt sich durch Inhalation von ca. 25 ml steriler, hyperosmolarer Kochsalzlösung (3-6 %) mittels Vernebler die Sekretion in den Atemwegen anregen und auf diese Weise ein induziertes Sputum gewinnen (Cave: Infektionsgefahr für das Personal und andere Patienten). Der Patient inhaliert über einen Düsen- oder Ultraschallvernebler solange (meist 15 bis 20 min) die hypertone NaCl Lösung, bis eine ausreichende Menge an Sputum in den Atemwegen induziert wurde. Dieses Sputum wird alle paar Minuten in ein steriles Gefäß expektoriert. Es sollte nur makroskopisch eitriges Sputum eingesandt werden Immunsuppression, Verdacht auf Legionellose, Verdacht auf dimorphe Pilze). (Ausnahme: z. B. Trachealsekret Die Untersuchung von Trachealsekret ist eine wichtige und komplikationsarme Technik. Möglichst unmittelbar nach Wechsel des Trachealtubus wird mit Hilfe eines sterilen Katheters Sekret so weit wie möglich aus den tiefen Abschnitten des Bronchialbaums aspiriert und in ein dicht schließendes, steriles Transportgefäß mit Schraubverschluss gegeben. Invasive Methoden (BAL, PSB, Bronchialsekret) Allgemein gilt: je näher zum Infektionsherd die Probe gewonnen wird, um so spezifischer (wenig Kontamination durch Mundflorakeime) und sensitiver (Keim in höherer Konzentration vorhanden als in der Peripherie) ist die mikrobiologische Diagnostik. Zu beachten ist, dass topisches Lidocain die Wiederfindungsrate beeinflussen kann. Bronchoalveoläre Lavage (BAL) Gewinnung von BAL-Material Im Mund-Nasen-Rachenraum und der Trachea befindliche Sekretansammlungen sollten vor Einführen des Bronchoskops abgesaugt werden. Nach Möglichkeit sollte vor Gewinnung der Proben für die Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 29 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 mikrobiologische Untersuchung kein Sog angewandt werden, da sonst die Kontaminationsgefahr erheblich zunimmt. Es ist zu berücksichtigen, dass anästhesierende Gele antimikrobiell wirken können. Zur bronchoalveolären Lavage führt man die Spitze des Bronchoskops in das Bronchuslumen ein und dichtet dieses mit der Spitze ab. Nach Instillation von bis zu 160 ml isotoner Kochsalzlösung in das Lumen wird die Flüssigkeit portioniert soweit möglich wieder aspiriert, wobei mindestens 50 ml Flüssigkeit wiedergewonnen werden sollten. Das erste Aspirat wird verworfen (Ausnahme: Suche nach obligat pathogenen Erregern bei abwehrgeschwächten Patienten), das zweite und ggf. folgende Aspirate entstammen eher der Lungenperipherie. In der Pädiatrie werden zur Gewinnung der BAL 3-4 x 1 ml/kg KG (bis max. 50 ml/Portion) vorgewärmte 0.9 %ige NaCl – Lösung verwendet. Die zurückgewonnene Flüssigkeit wird zusammengeführt. Davon werden Aliquots zur Erregerdiagnostik und zur zytologischen Diagnostik verwendet. Geht es nur um die Gewinnung von vorwiegend bronchialem Probenmaterial, reicht die Instillation einer kleineren Flüssigkeitsmenge aus (siehe auch „Minilavage“). Hier haben sich 1 bis 2 ml/kg KG bewährt. Dieses Verfahren ist auch die Methode der Wahl bei suppurativen Lungenerkrankungen (z. B. Mukoviszidose oder eitrige Bronchiektasen), da so eine Verschleppung von Erregern ins alveoläre Kompartiment vermieden wird. Dem Labor sollen die bei BAL instillierten und zurückgewonnenen Flüssigkeitsmengen mitgeteilt werden. Geschützte Bürste (PSB) Relevanz der geschützten Bürste Um das Problem der Kontamination von Materialien mit Besiedlungskeimen in den oberen Atemwegen zu umgehen, wurde die geschützte Bronchialbürste (Protected Specimen brush = PSB) entwickelt. Diese Technik erlaubt die kontaminationsarme Gewinnung von Proben aus dem Bereich der unteren Atemwege. Nachteil dieser Methode ist, dass sehr wenig Material asserviert wird. Dies führt zu einem sehr geringen „Sampling“ Volumen, mit der entsprechenden Gefahr eines „Sampling Errors“. Außerdem reicht das sehr geringe Volumen möglicherweise nicht für alle Untersuchungen aus. Durchführung der PSB Bei der geschützten Bronchialbürste wird eine Bürste verwendet, die von zwei Kathetern umhüllt ist. Nach Einführen des doppelten (Teleskop-) Katheters durch den Arbeitskanal des Bronchoskops wird der innere Katheter vorgeschoben. Die Bürste selbst wird dann mittels Führungsdraht soweit vorgeschoben, bis sie aus dem inneren Katheter herauskommt. Nach Bürsten einer geeigneten Stelle wird die Bürste in den inneren Katheter zurückgezogen, dieser sodann in den äußeren zurückverlagert. Bronchoskopisch gewonnenes Sekret Die Untersuchung eines gezielten, unter Sicht gewonnenen eitrigen Materials besitzt eine hohe Sensitivität und Spezifität, insbesondere auch zum Nachweis obligat pathogener Mikroorganismen (z. B. Mycobacterium tuberculosis). Hierbei besteht der große Vorteil, hochqualitatives Probenmaterial direkt aus dem Infektionsherd zu gewinnen. Das Sekret wird über einen Arbeitskanal des Bronchoskops aus einem größeren Bronchus aspiriert; ggf. muss vor der Aspiration eine geringe Menge isotoner Lösung (z. B. Kochsalzlösung), die keine antibakteriellen Zusätze enthält, instilliert werden. Blinde invasive Techniken (Mini-BAL, BPSB) Vorteile der sogenannten blinden invasiven Verfahren (Mini-BAL, BPSB) sind die einfachere technische Durchführbarkeit und die geringere Belastung für den Patienten. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 30 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Durchführung Bei der Mini-BAL werden über einen geschützten oder ungeschützten Katheter 20 bis 150 ml Flüssigkeit instilliert. Dem Labor müssen die bei der Mini-BAL instillierten und wieder gewonnenen Flüssigkeitsmengen mitgeteilt werden. Bei der blind-durchgeführten Bronchialbürste (blinded protected specimen brush, PBSP) wird die Probe wie oben beschrieben, aber ohne Bronchoskopie (blind) entnommen. Weitere Untersuchungsmaterialien Nasen-Rachenspülwasser Zur Gewinnung von Sekreten der oberen Atemwege kann bei Säuglingen z.B. bei V.a. Bronchiolitis über eine durch ein Nasenloch eingebrachte und mit einem Mundabsauger versehene Sekretfalle 0.5 bis 1 ml 0.9 % NaCl instilliert und rasch wieder abgesaugt werden. Auf diese Weise kann hochwertiges Material vor allem zur viralen Erregerdiagnotik aus dem Nasen- und Rachenraum gewonnen werden. Lungenbiopsiematerial, transthorakale Feinnadelpunktion Die offene Lungenbiopsie erbringt das beste Untersuchungsmaterial, ist allerdings mit dem Narkoseund Operationsrisiko belastet. Sie ist gegebenfalls indiziert, wenn alle anderen diagnostischen Verfahren ausgeschöpft sind und nicht zu einem verwertbaren Ergebnis geführt haben. Sie sollte frühzeitig durchgeführt werden, um die Therapie ggf. anpassen zu können. Eine Mikroskopie ist in jedem Fall durchzuführen. Geeignetes Untersuchungsmaterial ergibt auch die transthorakale Feinnadelpunktion, die bei erfahrenen Untersuchern eine niedrige Komplikationsrate zeigt. Biopsate für die mikrobiologische Diagnostik müssen direkt in einem sterilen Röhrchen mit physiologischer Kochsalzlösung eingesandt werden. Bioptat-Material muss umgehend ins Labor transportiert und sofort verarbeitet werden. Pleuraflüssigkeit Besteht ein Pleuraerguß oder -empyem, so haben die darin nachgewiesenen Erreger einen hohen diagnostischen Wert. Pleuraflüssigkeit muss stets auch auf obligate Anaerobier untersucht werden. Ein steriles Serumröhrchen kann zum Transport verwendet werden, das umgehend in das Labor zur Anlage-Verarbeitung gesandt werden muss, Ein längerdauernder Luftzutritt ist unbedingt zu vermeiden. Der Versand und/oder Transport von Pleuraflüssigkeit in einer Spritze ist obsolet. Falls mittels Spritze aspiriert muss die Probe in ein steriles, verschraubbares Röhrchen umgefüllt werden. Hinweise: Die Anforderung „pathogene Keime“ beinhaltet keine atypischen Erreger wie Legionellen, Mycoplasmen, Chlamydien oder gar Viren. Diese müssen gesondert angefordert werden (s. unten). Hinweise zu einzelnen Erregern (Atemwegsmaterialien) Legionellen Folgende Nachweismethoden stehen zur Verfügung a) direkte Anzüchtung aus Materialien der tiefen Atemwege (z.B. Bronchialsekret, BAL) Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 31 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 (Schein 23) b) PCR aus Bronchialsekret oder BAL (Schein 24) c) Bestimmung des Legionellen-Antigens im Urin (am besten Morgenurin). Hierzu bitte Nativurin (kein Urikult) einsenden! (Schein 23). Diese Untersuchung ist im Notfall auch nachts im Zentrallabor verfügbar (bitte Zentrallabor anrufen). d) Bestimmung von Antikörpern gegen Legionellen (Serum, Schein 23) Mycoplasma pneumoniae Antikörpernachweis aus Serum. In besonderen Fällen auch die PCR (nur nach Rücksprache). Chlamydophila pneumoniae Antikörpernachweis aus Serum. Bei speziellen Fragestellungen auch PCR. Dann bitte telefonische Rücksprache. Chlamydophila psittaci Antikörpernachweis aus Serum Nocardiose Bei Verdacht auf Nocardiose bitte Rücksprache mit dem Labor. Nocardiose muss gesondert angefordert werden. Materialien von Patienten mit Verdacht auf Nocardiose werden länger bebrütet (bis zu 7 Tagen). Dimorphe Pilze (s. Kapitel 15) Pneumocystis (carinii) jirovecii Zum Nachweis von P.carinii ist die BAL das bestgeeigneteste Material. Ankreuzen auf Schein MB1 „Pneumocystis jirovecii“. Verfahren ist der PCR-Nachweis. Bei negativer PCR werden keine weiteren Verfahren durchgeführt. Bei positiver PCR werden zusätzlich die Immunfluoreszenz und/oder die Grocott Färbung (Versilberung) durchgeführt. In Notfällen kann, wenn die PCR nicht zur Verfügung steht (z.B. abends), eine Immunfluoreszenz durchgeführt werden. Pertussis Bestes Verfahren beim Verdacht auf akute Infektion ist die PCR (Fremduntersuchung). Für die Pertussis-PCR bitte Abstriche ohne Gel benutzen. Alternativ kann eine Untersuchung auf Pertussis Antikörper angefordert werden (Serum !). Die Aussagekraft der Serologie ist aber gering. Oft kann 2 nicht zwischen Antikörpern bei/nach Infektion und Impf-Antikörpern unterschieden werden . 12 Tuberkulose und atypische Mykobakterien Vorgehen bei Verdacht Lungen-Tuberkulose Patienten 3 mal Sputum abhusten lassen zur Gewinnung einer größeren Menge an Sputum (ca. 2 – 5,6 10 ml) . 24-h Sammelsputum ist obsolet. Weitere Mengen siehe Tabelle 2. Evtl. auch Magensaft einsenden (v.a. bei Kindern). Für den Magensaft bitte die speziellen „Magensaftröhrchen“ benutzen. (Falls diese benötigt werden, bitte Rücksprache mit dem Labor). Tabelle 2 benötigte Mindestmengen bei Tuberkulose Diagnostik Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Art der Probe Sputum Benötigte Menge 2-10ml Bronchialsekret 2-5ml BAL Pleurapunktat Magensaft Urin Liquor 10-30ml 10-30ml 6 mindestens 2 ml 30-50ml optimal sind 5ml Seite 32 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Kommentar Mindestens 3 verschiedene Proben einsenden z.B. wenn kein Sputum abgehustet werden kann Spezielle Röhrchen verwenden Falls PCR gewünscht bitte ein zusätzliches Röhrchen mit ca. 2-5ml einsenden Bei allen anderen Formen der Tuberkulose z.B. Peritonealtuberkulose eignet sich Gewebe für die Untersuchung. Bei Verdacht auf Lymphknotentuberkulose bitte einen Teil des evtl. entnommenen Lymphknotens einsenden. Gewebe in physiologische Kochsalzlösung einbringen und sofort ins Labor transportieren lassen. Abstriche sind ungeeignet! Falls eine PCR durchgeführt werden soll, bitte Material in einem extra-Röhrchen für die PCR einsenden. Für eine optimale Diagnostik drei zu verschiedenen Zeitpunkten gewonnene Proben einsenden, insbesondere bei Verdacht auf LungenTbc. Transport und Lagerung Sputen einsenden in sterilen Röhrchen. Lagerung bei 4 Grad. Die Proben sollten sofort ins Labor 5,6 gebracht werden. Ist das nicht möglich, ist eine Lagerung bei 4 Grad bis zu 24 Stunden möglich Bei Verdacht auf Tuberkulose die Materialien bitte in bruchsicheren, fest verschraubten Röhrchen einsenden. Die Röhrchen dürfen keine Materialanhaftungen außen besitzen. Die Röhrchen müssen durch ein Außengefäß geschützt sein (siehe Kapitel 1). Diagnostisches Vorgehen Bei allen Einsendungen auf Tuberkulose wird noch am selben Tag eine Ziehl-Neelsen Färbung auf säurefeste Stäbchen durchgeführt. Der Nachweis von säurefesten Stäbchen im Sputum ist kein Beweis, bei entsprechender Klinik aber ein starker Hinweis auf eine Tuberkulose (auch atypische Mykobakterien sind säurefeste Stäbchen). Das kulturelle Ergebnis liegt nach 2-6 Wochen vor. PCR: Auf Wunsch wird auch eine PCR auf M.tuberculosis durchgeführt. Die PCR ist offiziell nur für Atemwegsmaterialien zugelassen. Wir führen die PCR auch aus anderen Materialien durch (z.B. Lymphknoten), weisen auf dem Befund aber darauf hin, dass es sich nicht um ein validiertes Testverfahren handelt. Die PCR erkennt nur typische Mykobakterien (M.tuberculosis, M.bovis, M.africanum), nicht aber atypische Mykobakterien. Zusätzlich bieten wir einen IGRA (Interferon-gamma-Release-Assay) an. Dies ist ein Test mit dem TB-spezifische T-Lymphozyten in einem Elispot Assay nachgewiesen werden. Der Test macht eine Aussage darüber, ob eine Immunantwort gegen M.tuberculosis stattgefunden hat. Mit BCG geimpfte Personen sind negativ. Benötigt werden Vollblut und spezielle Röhrchen. Falls Röhrchen benötigt werden, bitte bestellen über Apotheke (Klinikum Marburg), externe Einsender bitte das Labor anrufen (06421-58-66061). Fehlermöglichkeiten bei der Tuberkulose Diagnostik Zu falsch negativen Ergebnissen können führen: 1 Es wurde zu wenig Material eingesandt (siehe Tabelle 2 oben) 2 Es wurden zu wenig Proben eingesandt (z.B. nur ein statt drei Sputen) Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 33 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 3 Es wurden die falschen Proben eingesandt (z.B. Spucke statt Sputum bei Verdacht auf Lungentuberkulose; Abstrichtupfer statt Gewebe) 4 Gewebe mit Formaldehyd behandelt. (Hier ist kein Nachweis von Bakterien mehr möglich, Ausnahme PCR-Methoden). 5 Die Proben wurden länger als 48h gelagert. Atypische Mykobakterien Bei Verdacht auf pulmonale atypische Mykobakteriose Vorgehen wie oben für Tuberkulose beschrieben. Sollen Materialien, die nicht (!) Atemwegsmaterialien sind (z.B. Blut, Haut) auf atypische Mykobakterien untersucht werden, bitte Rücksprache mit dem Labor. Bewertung von Befunden: Die einmalige Isolierung von „atypischen“ Mykobakterien, z.B. aus Sputum oder Magensaft, ist nicht ausreichend, die Diagnose einer „atypischen Mykobakteriose“ zu stellen. Erst der Einschluss weiterer Kriterien, wie a) der mehrfache Nachweis oder die Isolierung aus primär sterilen Bereichen, b) das „passende“ klinische Bild und c) der Röntgenbefund mit Progression gestatten die Diagnose einer atypischen Mykobakteriose. 13 Materialien von Wundinfektionen, Abszesse, Gewebe Indikation -v.a. primäre Weichteilinfektion, Knochen- oder Gelenkinfektion -Abszesse -Wundinfektionen (nosokomial, Bissverletzung) -Eiter -Wundabstrich 3 -intraoperatives Material, Gewebe (falls möglich bis zu 1 cm ) Eiter in einem sterilen Röhrchen einsenden. Wenn genügend Flüssigkeit/Eiter vorliegt (ca. 1 ml oder mehr) ist es stets besser dieses Material in einem sterilen Röhrchen einzusenden und keinen Abstrich zu verwenden! Wenn wenig Eiter vorliegt, Eiter mit dem Abstrichtupfer aufnehmen und im Transportmedium versenden. Gewebe und Biopsien in physiologischer Kochsalzlösung möglichst schnell ins Labor bringen. Herzklappe Steriles Gefäß, z.B. sterilen Becher oder 50 ml Zentrifugenröhrchen mit ca. 20 ml steriler Kochsalzlösung füllen. Herzklappe oder Teile der Herzklappe in dieses Gefäß einbringen. Umgehender Transport ins Labor bei Raumtemperatur. Schrittmacher: in einem sterilen Becher direkt ins Labor bringen. Wundabstriche Falls notwendig, die Wunde mechanisch reinigen, oberflächliches Sekret (z.B. mittels sterilem Tupfer) entfernen, Nekrosen abtragen. Material aus der Tiefe oder vom Rand zum Gesunden hin entnehmen. Bei Abstrichen aus Fisteln zunächst austretendes Sekret verwerfen, danach Material gewinnen (falls möglich aus der Tiefe aspiriert). Wenn von einem Wundabstrich ein mikroskopisches Sofortpräparat durchgeführt werden soll (zusätzlich zur Kultur) bitte 2 Abstriche einschicken (entweder 2 Abstrichtupfer in einem Gel oder 2 komplette Abstriche). Bitte davon einen Kennzeichnen „nur für Präparat“. Alternativ kann auch ein direkt am Bett bestrichener Objektträger für das Präparat eingesandt werden. Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 34 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 14 Punktate aus primär sterilen Bereichen (Aszites, Gelenke, Pleuraflüssigkeit, Perikardpunktat) Indikation -Peritonitis -Arthritis -Pleuritis -Perikarditis Hinweise zur Entnahme Punktate bitte nicht in Abstrichröhrchen füllen (Grund: Gefahr des „Auslaufens“ mit Gefährdung des Personals, Gefahr der Kontamination der Probe). Punktate nur in fest verschraubbare, sterile Röhrchen füllen und möglichst viel Material einsenden. Lagerung und Transport bei Raumtemperatur. Ist bei flüssigen Materialien kein sofortiger Transport ins Labor möglich, sollte zusätzlich eine Blutkulturflasche mit dem Punktat beimpft werden. Gelenkpunktate Gelenkpunktate in sterile Gefäße einbringen. Festes Material ebenfalls in sterile Gefäße/Becher einbringen. Ist bei festen Materialien kein sofortiger Transport ins Labor möglich, physiologische Kochsalzlösung dazugeben (um Austrocknung zu verhindern). Ist bei flüssigen Materialien kein sofortiger Transport ins Labor möglich, sollte zusätzlich eine Blutkulturflasche mit dem Punktat beimpft werden. Blutkulturflasche und andere Proben bei Raumtemperatur lagern. Gelenkpunktate werden 14 Tage bebrütet. Nach 48h und 7 Tagen wird ein Zwischenbefund erstellt. 15 Spezielle einzelne Erreger und Verfahren 16S/18S PCR für Bakterien und Pilze Bei primär sterilen Materialien, wie z.B. Gelenkpunktaten, Liquor, Pleurapunktat kann auch eine 16S/18S PCR sinnvoll sein. Dies ist ein Verfahren, um bakterielle/fungale DNA nachzuweisen. Mittels Sequenzierung ist (im positiven Fall) auch eine Speziesdifferenzierung möglich. Für eine 16S/18S PCR senden Sie bitte ein Extra-Röhrchen mit Material ein. Haben Sie z.B. ein Gelenk punktiert und wollen die 16S/18S PCR anfordern, senden Sie bitte zwei Röhrchen ein (eines f. die konventionelle Diagnostik und eines für die 16S/18S PCR). Das Verfahren macht z.B. Sinn: -wenn konventionell (via Kultur) keine Erreger nachgewiesen werden konnten, aber dringender Verdacht auf eine Infektion besteht -wenn bei Materialien, welche reichlich Granulozyten enthalten, kulturell kein Keimnachweis gelingt -wenn mikroskopisch, aber nicht kulturell ein Keimnachweis gelungen ist. Die 16S/18S PCR können Sie mit dem Schein 24 anfordern. Aktinomykose Die typische „Aktinomykose“ (zervikofazial, thorakal, abdominell) wird heute selten gesehen. Falls Verdacht auf eine solche Erkrankung besteht bitte Rücksprache mit dem Labor vor Einsendung von Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 35 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Material. Aktinomyzeten werden aber auch häufig bei Mischinfektionen isoliert, z.B. bei Entzündungen/Abszessen im Bereich der Zähne, infizierten Pilonidalsinus und bei Pararektalabszessen. Aktinomyzeten sind Besiedler der Haut und auch des Gastrointestinaltraktes und können daher auch in Proben vorkommen ohne dass damit eine pathogene Bedeutung verbunden ist (z.B. Hautabstrich). Aspergillus Bei Verdacht auf pulmonale Aspergillose entsprechende Atemwegsmaterialien (Bronchialsekret, BAL) einsenden. Bei V.a. Aspergillose (insbesondere auch V.a. systemische Aspergillose) kann auch ein Antigentest im Serum durchgeführt werden (Fremduntersuchung). Hierzu Serum mit Schein 23 ins ZIVD senden. Bewertung von Befunden: Der Nachweis von Aspergillus fumigatus ist stets ernst zu nehmen. Auch bei (scheinbar) nicht immunsupprimierten Patienten liegt beim kulturellen Nachweis von Aspergillus nicht selten eine invasive Aspergillose vor! Borrelien Standarduntersuchung bei Verdacht auf Borreliose ist die Serologie (Schein 23, ZIVD). Für ausgewählte Fragestellungen kann auch eine PCR auf Borrelien durchgeführt werden. In diesem Fall bitte telefonische Rücksprache. Botulismus Bei Verdacht auf Botulismus bitte Serum einschicken. Es wird ein Tierversuch durchgeführt. Bei Verdacht auf Säuglingsbotulismus Stuhl einsenden. Andere Materialien (z.B. Lebensmittelproben, Erbrochenes) können nicht verarbeitet werden. Diese bitte an entsprechende Landesuntersuchungsämter senden. Candida Bei Verdacht auf eine Pilzinfektion kreuzen Sie bitte auf dem Einsendeschein „Untersuchung auf Pilze“ an. In diesem Fall werden dann spezielle Pilzplatten mit angelegt, die die Wahrscheinlichkeit eines Nachweises von Pilzen erhöhen (bei Mischinfektionen). Pilze werden in der Regel aber auch ohne diese Anforderung (auf anderen Platten) nachgewiesen. Daher können Sie auch einen Befund „Candida albicans“ erhalten, ohne speziell Pilze angefordert zu haben. Sollen nur Pilze (keine Bakterien) untersucht werden, bitte auch nur Pilze anfordern. Clostridium perfringens (Gasbrand) Bei Verdacht auf Gasbrand umgehend Material („mit Notfallschein“) in die Mikrobiologie senden. Probe mit Hol- und Bringedienst sofort in die Mikrobiologie bringen lassen. Schicken Sie wenn möglich Gewebe statt Abstrichen ein. Wenn dies nicht möglich ist, bitte zwei Abstriche einsenden (einen für das Präparat und einen für die Kultur). Es wird in der Mikrobiologie umgehend ein Präparat angefertigt. Das mikroskopische Präparat erlaubt, falls dort reichlich die typischen grampositiven Stäbchen zu sehen sind, die Verdachtsdiagnose zu untermauern. Die kulturelle Bestätigung dauert 12 Tage. Dermatophyten Indikation -Infektionen von Haut, Haaren, Nägeln Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 36 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Hinweis: Dermatophyten werden im Labor der Universitäts-Hautklinik untersucht. Materialien auf Dermatophyten bitte dort hinschicken. Nur Materialien, die neben Dermatophyten auch auf andere Erreger (z.B. Tuberkulose) untersucht werden sollten in die Med. Mikrobiologie geschickt werden. Hinweise zur Entnahme Materialien immer im Randbereich der Entzündung entnehmen. Haut: etwas Material abschaben (z.B. mit Skalpell) und in einem sterilen Röhrchen einsenden (ohne Medium!). Nur im Ausnahmefall Abstrichtupfer einsenden. Nägel: mehrere kleine Nagelschnipsel gewinnen und einsenden Die Untersuchung kann bis zu 6 Wochen und länger dauern ! (3-4 Wochen zur Anzucht, 1-3 Wochen zur Speziesdiagnose !). Werden Dermatophyten im Material nachgewiesen, ist dies generell als pathologisch zu werten. Auf dem Befund erscheint dann der Hinweis „Dermatophyten nachgewiesen“. Allerdings können auch nicht-Dermatophyten Hautmykosen verursachen, z.B. Sprosspilze (Hefen) und auch Schimmelpilze (z.B. Aspergillus). Dimorphe Pilze (Histoplasmose, Coccidiomykose) Achtung: Aufgrund der hohen Gefährdung dieses Materials für das Laborpersonal (Risikogruppe 3) ist jeder Verdacht vorab dem Labor mitzuteilen. Außerdem ist auf dem Einsendeschein gross und gut lesbar zu vermerken: Verdacht auf dimorphe Pilze! Alle weiteren Fragen bitte vorab telefonisch mit unserem Labor klären. Echinokokken Folgende zwei Untersuchungen werden angeboten: 1) Serologie (bitte Serum mit Schein 23 einsenden). 2) Untersuchung eines Punktates (nur falls bereits punktiert wurde!) auf Echinokokken„Häkchen“. ESBL ESBL steht für „Extented Spektrum ß-Laktamase“. Die Besiedlung von Patienten mit solchen Stämmen erfordert spezielle Hygienemaßnahmen. Eine gezielte Untersuchung auf ESBL-bildende Bakterien (z.B. im Stuhl, Haut etc.) macht nur in sehr besonderen Fällen Sinn. Eventuell in diesem Zusammenhang bitte Rücksprache mit der Hygiene, welche Untersuchungen hier sinnvoll sind. Ansonsten werden alle Materialien, in denen von gramnegativen Bakterien ein Antibiogramm erstellt wird (z.B. Trachealsekret, Wundabstriche), „automatisch“ auf die Anwesenheit von ESBL-Bildnern untersucht. Leishmaniasis Bei Verdacht auf Leishmaniasis bitte Rücksprache mit dem Labor zur Klärung des diagnostischen Procedere. Leptospirose Bei Verdacht auf Leptospirose bitte Rücksprache mit dem Labor. Prinzipiell steht hier eine serologische Untersuchung und eine PCR (Material: Urin) zur Verfügung. Malaria Die Untersuchung auf Malaria wird im Zentrallabor durchgeführt (Tel (06421-58) 66263). Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 37 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Morbus Whipple Bitte Rücksprache mit dem Labor wie der Fremdversand (Fremduntersuchung) organisiert wird. MRSA MRSA ist die Abkürzung für „Methicillin-resistenter Staphylococcus aureus“. Methicillin entspricht dem in Deutschland verwendeten Oxacillin, daher wird teilweise auch die Bezeichnung „ORSA“ verwendet. Methicillinresistenz bei Staphylokokken beruht auf der Bildung eines alternativen Penicillin-bindenden Protein PBP2a, was bedingt, dass alle ß-Lactam Antibiotika (Penicilline, Cephalosporine) und auch Carbapeneme (Imipenem, Meropenem) dann resistent sind. MRSA-Stämme sind mittlerweile weltweit verbreitet. Sie spielen eine große Rolle als Verursacher nosokomialer Infektionen, wie z.B. Wundinfektionen, Pneumonie, Katheterinfektion, etc. MRSA-Stämme können aber auch als reine Besiedler auftreten. MRSA Screening (konventionell) Kliniken des Uniklinikums Marburg: Bitte die entsprechenden Hygiene-Einsendescheine benutzen. Diese können aus dem „Hygieneportal“ (Intranet) gedruckt werden. Befundabfrage: 65673 Für spezielle Fragestellungen (inkl. MRSA-PCR) bitte Kontakt mit der Abteilung Hygiene aufnehmen. Externe Einsender: Bitte den Schein MB1 verwenden und handschriftlich angeben „MRSA-Screening“. Befundabfrage Tel. 06421-58-66061. Wesentliche Prädilektionsstellen sind Nasenvorhof, Rachen, Perineum und Leistengegend. Beim MRSA Screening ist die Untersuchung mehrerer Orte (z.B. Nase und Rachen) sensitiver als ein Nasenabstrich allein. Nasenabstrich auf MRSA (konventionell). 1. MRSA sitzt vor allem im vorderen Bereich der Nasenhöhle 2. Es sollten immer beide Nasenhöhlen (mit einem Tupfer) abgestrichen werden cMRSA Bei Verdacht auf eine Infektion (z.B. multiple Abszesse) mit cMRSA (=community acquired oder ambulant erworbener MRSA) diesen Verdacht bitte auf dem Einsendeschein mitteilen. cMRSA Stämme sind unter anderem durch die Anwesenheit des Toxins PVL (Panton-Valentin-Leukozidin) gekennzeichnet. Wird aus der eingeschickten Probe ein MRSA isoliert, kann via PCR festgestellt werden, ob dieses Isolat positiv für PVL ist. Dies wird auf dem Befund entsprechend dokumentiert. Jeder Nachweis eines cMRSA wird dem Einsender telefonisch mitgeteilt. Schistosomen Bei Verdacht auf Schistomiasis bitte Rücksprache mit dem Labor, um die Diagnostik zu optimieren. Prinzipiell können die Eier mikroskopisch im Stuhl oder Urin nachgewiesen werden (je nach Erreger). Dazu kann es notwendig sein, mehrfach Stuhl oder Urin zu untersuchen, evtl. auch Sammelurin. Die Eiausscheidung ist abhängig vom Stadium der Erkrankung. Auch der Antikörpernachweis im Serum ist möglich (Fremduntersuchung). Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 38 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 Toxoplasmose Bei Verdacht auf akute/reaktivierte Toxoplasmose Serum einsenden. In bestimmten Fällen kann die Durchführung einer PCR (z.B. aus Liquor) sinnvoll sein (Fremduntersuchung) VRE Soll in einem Material speziell auf VRE (Vancomycin-resistente-Enterokokken) untersucht werden, auf dem Schein MB1 unter „seltene weitere Erreger“ bitte handschriftlich „VRE“ angeben. Kontrolluntersuchungen auf VRE sind aber nur in ganz bestimmten Fällen sinnvoll. Dies bitte im Einzelfall mit der Hygieneabteilung besprechen. Zystizerkose Bei Verdacht auf Zystizerkose Serum (ZIVD, Schein 23) und ggf. Liquor einsenden. 16 Hinweise zur Antibiotikatherapie allgemein Das Antibiogramm gibt darüber Auskunft, ob der isolierte Keim in vitro empfindlich oder resistent auf das getestete Antibiotikum reagiert. Das entsprechende Ergebnis muss nicht immer der Situation in vivo entsprechen, d.h. ein empfindlich getestetes Antibiotikum kann im Einzelfall in vivo versagen. Mögliche Gründe dafür können sein: -Pharmakokinetische Probleme: Das entsprechende Antibiotikum gelangt nicht oder nicht ausreichend an den Ort der Infektion (Wirkungsort) -Induktion einer Resistenz in vivo, z.B. bei längerer Antibiotika-Therapie. -Das Antibiotikum wurde nicht ausreichend hoch dosiert. -Der Patient verfügt über keine Abwehr (z.B. Agranulozytose). Essentiell bei jeder Antibiotikatherapie sind daher die Fragen der richtigen Dosierung, der Pharmakokinetik und der einer möglichen Resistenzentwicklung. Die Behandlungsdauer sollte in der Regel 5-10 Tage betragen. Bestimmte Indikationen bedingen natürlich eine längere Therapie (z.B. schwere Staphylokokken Infektionen wegen hoher Rezidivgefahr, Tuberkulose). Einige Infektionen sind heutzutage gut mit einer Einmalgabe behandelbar. Dazu gehören z.B. die unkomplizierte Gonorrhoe oder die Zystitis bei jungen Frauen. In bestimmten Fällen ist eine Kombinationstherapie sinnvoll. Sinnvolle Kombinationen sind z.B. Amoxicillin mit Clavulansäure; ein Betalaktam-Antibiotikum mit einem Chinolon bei schweren intensivpflichtigen Pneumonien, wenn mit multiresistenten Keimen gerechnet wird. Beispiel für eine sinnvolle Indikation ist auch eine Kombinationstherapie von Amoxicillin (bzw. Ampicillin) und Aminoglykosid bei der Endokarditis durch Enterokokken. Bei schweren Pseudomonas Infektionen kann ebenfalls eine Kombination von Antibiotika sinnvoll sein z.B. ein Betalaktam (Ceftazidim, Meropenem oder Piperacillin) mit einem Chinolon (z.B. Ciprofloxacin). Im Intranet finden sich unter „Leitlinien“ einige für Marburg geltende „Leitlinien“ für die antibiotische Therapie. Zur Zeit (Stand 10/2014) sind das Empfehlungen für die antibiotische Therapie der Pneumonie (nosokomial), Sepsis, HWI, perioperative Prophylaxe, Endokarditis und Clostridium difficile. Wenn klinisch indiziert und/oder auf Anfrage, liefern wir auch genaue Minimale Hemmkonzentrationen (MHK) eines bestimmten Keimes gegen das Antibiotikum. Die MHK gegen Penicillin ist z.B. wichtig bei der Therapie der Endokarditis durch vergrünende Streptokokken. Bei der Endokarditis durch Enterokokken relevant ist die MHK gegenüber Aminoglykosiden zur Bestimmung Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 39 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 ob eine Low-Level- oder High-Level-Resistenz vorliegt. Nur bei der Low-Level-Resistenz wirken Aminoglykoside synergistisch mit ß-Laktamen bei der Therapie der Enterokokken-Endokarditis. 17 Anhang Patientenanleitung zur Sputumgewinnung Sehr geehrte Patientin, sehr geehrter Patient, zu den Maßnahmen, die wir zur Erkennung und Behandlung Ihrer Erkrankung durchführen möchten, gehört die Untersuchung von Sputumproben (Auswurf). Sputum ist das Sekret der Atemwege, das beim Husten in den Rachen gelangt und sieht in der Regel eitrig aus. Speichel (Mundflüssigkeit) aus dem Mundbereich ist für diese Untersuchung ungeeignet. Oft wird morgens besonders viel Sputum abgehustet, die Gewinnung von Sputum ist morgens daher leichter. Bitte versuchen Sie nach folgender Anleitung vorzugehen: 1. Wenn möglich, sollten Sie 1-2 Stunden vor der Sputumgewinnung keine Nahrung aufnehmen. 2. Wenn Sie morgens spontan husten müssen, versuchen Sie den dabei entstehenden Auswurf in dem Sputumbehälter aufzufangen. 3. Dazu den Deckel des Sputumbehälters entfernen. Bitte das Auffanggefäß nur von außen anfassen. 4. Konnten Sie nicht spontan Auswurf abhusten, versuchen Sie tief ein- und auszuatmen. Nach jedem Einatmen den Atem für ca. 3–5 Sekunden anhalten. Diesen Vorgang möglichst wiederholen. Durch die Atemarbeit wird die Lunge gut entfaltet und die Produktion von Sputum angeregt. 5. Erneut tief Luft holen und versuchen, Sputum abzuhusten. 6. Tuberkulosediagnostik: Das Abhusten zur Gewinnung einer möglichst großen Probenmenge 2 – 3mal wiederholen. 7. Sputumbehälter sofort bei dem Personal abgeben, damit die Probe rasch ins Labor transportiert werden kann. Falsche Ergebnisse durch zu lange Lagerungszeiten werden dadurch vermieden. 8. Sollten Sie kein Sputum aus der Tiefe der Lunge abhusten können, benachrichtigen Sie bitte das Personal und Ihre behandelnden Ärzte. 18 Literatur 1 Neumeister et al. Mikrobiologische Diagnostik. 2. Auflage. Thieme Verlag. Stuttgart-New York. 2009. 2 MIQ 8. Infektionen der tiefen Atemwege. Frank Sommer (Obmann) et al. Urban und Fischer. 2010. 2. Auflage 3 MIQ 20. Sicherheit im diagnostischen Labor. A. Essig et al. Urban und Fischer. 2005. 4 MIQ 3. Blutkulturdiagnostik. H. Seifert et al. Urban und Fischer. 2007. 2. Auflage. 5 MIQ 5. Tuberkulose/Mykobakteriose. Küchler et al. Urban und Fischer. 2005. 6 DIN-Taschenbuch 222. Medizinische Mikrobiologie und Immunologie. Diagnostische Verfahren. DIN 58943-3 Kulturelle Methoden zum Nachweis von Mykobakterien. Beuth Verlag. April 2004. 7 MIQ 2.Harnwegsinfektionen. S. Gatermann et al., Urban und Fischer. 2005. 2. Auflage Institut für Medizinische Mikrobiologie und Krankenhaushygiene Änderungshinweis: siehe Seite 14 2 Blutkulturen Anlage 5 zum Qualitätsmanagement-Handbuch Probenhandbuch Mikrobiologie Seite 40 von 40 Version: H Diese Version ersetzt die Fassung vom Juni 2014 8. DIN EN ISO 15189 - Medizinische Laboratorien-Anforderungen an die Qualität und Kompetenz (ISO 15189:2012). Beuth Verlag. 9 MIQ 9. Infektionen des Darmes. Manfred Kist (Obmann) et al. Urban und Fischer. 2000.