Grundaussagen der Elektrostatik
Werbung

Grundaussagen der Elektrostatik
(1) Es gibt zwei Arten von elektrischen Ladungen (bezeichnet als
„positiv“ und „negativ“, da sie einander neutralisieren können)
(2) Gleichnamige Ladungen stoßen einander ab, ungleichnamige
ziehen einander an.
(3) Ladung bleibt im abgeschlossenen System erhalten.
(4) Ladung ist gequantelt. Dass heißt sie existiert (in der direkt
beobachtbaren Natur) nur als ganzzahliges Vielfaches der
Elementarladung
e = 1.602 176 462(63) · 10-19 C (Coulomb)
SI-System:
1 Coulomb = 1 Ampere · 1 Sekunde
[Ladung] =
[Strom] ·
[Zeit]
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Grundaussagen der Elektrostatik
(5) Die Kraft zwischen zwei Punktladungen q0 und q1 mit Abstand r
(5a) wirkt entlang ihrer Verbindungslinie.
(5b) ist proportional zum Produkt q0q1 der Ladungen.
(5c) ist proportional zu 1/r2
Æ
Coulomb - Gesetz
q1
q0
r
F1
r
r
r
F0
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
r
r
1 q0 q1
F0 = −F1 =
rˆ
2
4πε 0 r
r r r
r = r0 − r1 ,
r
r= r = r
r
r
ˆr =
r
Coulomb-Gesetz
r
F1
q1
r
r
q0
r r r
r = r0 − r1 ,
r
F0
Æ
Æ
r
r
F0 = −F1 =
r
r
rˆ = ,
r
1
q0 q1
4πε 0 r
2
rˆ
r
r= r = r
Die Proportionalitätskonstante im Coulomb-Gesetz hängt dabei
vom Einheitensystem (Definition der Einheitsladung ...) ab!
ε0= 8.8541·10-12 C2/J·m „Dielektrizitätskonstante des Vakuums“
2
2
N
9 N ⋅m
9 N ⋅m
f =
= 10 ⋅ c ⋅ 2 = (8.987551787...) ⋅ 10 2 2 ≈ 9 ⋅ 10
4πε 0
A
A ⋅s
C2
*
1
−7
2
Lichtgeschwindigkeit
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Coulomb-Waage
1785 von C. Coulomb mit Hilfe der vom ihm entworfenen
Coulomb-Waage (1777) angewendet
(siehe Gravitationswaage)
Charles Augustin
Coulomb
(1736-1806)
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Coulomb-Kraft vs. Gravitationskraft
FC = f * ⋅
q1 ⋅ q2
r2
FG = G ⋅
m1 ⋅ m2
r2
Verhältnis der beiden Kräfte zwischen zwei Protonen
2
N ⋅ m2
−19
8.98 ⋅ 10
1.6
10
⋅
⋅
C
*
2
2
elektrische Kraft f ⋅ e
C
=
=
2
2
Gravitation
G ⋅ mp
−11 N ⋅ m
−27
2
6.67 ⋅ 10
(1.67
1
0
)
⋅
⋅
kg
kg 2
9
(
)
1010 ⋅ 10 −38
1
37
≈
=
⋅
10
7 ⋅ 10 −11 ⋅ 10 −54 7
... aber die meisten Ladungen heben sich auf, da ein (makroskopischer)
Körper nur einen geringen Teil seiner Ladungen (z.B. Elektronen)
abgeben kann.
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Coulomb-Kraft vs. Gravitationskraft
Ladungen von jeweils 1 Coulomb in Berlin und Potsdam (r~30km)
erzeugen eine Kraft von 10 Newton (entspricht der Gewichtskraft
einer Masse von 1 kg)
Ein Atom wird durch elektrische Anziehungskräfte zusammengehalten. Es gilt dabei für den Grundzustand des Wasserstoffs
ratom
4πε 0 h 2
−10
=
≈
0
,
529
⋅
10
m
2
e me
Würde das Atom lediglich durch die Gravitationsanziehung
zwischen Proton und Elektron zusammengehalten, dann wäre
~
ratom
h2
=
≈ 1.2 ⋅10 29 m ≈ 1.27 ⋅1013 Lichtjahre
G (me m p ) me
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Grundaussagen der Elektrostatik
(6) Die elektrische Kraft zwischen Elementarteilchen ist um viele
Größenordnungen stärker als die Gravitationskraft. Der Faktor
beträgt dabei für die Paarungen
(6a) Proton – Proton:
1.2 · 1036
(6b) Proton – Elektron:
2.3 · 1039
(6b) Elektron – Elektron:
4.2 · 1042
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Grundaussagen der Elektrostatik
(7) Für Kräfte zwischen Ladungen gilt das Superpositionsprinzip.
Welche Kraft wirkt auf eine Probeladung q0, falls mehrere
Punktladungen qk {k=1...n} vorhanden sind?
Die Abstandsvektoren zwischen q0 und
den Ladungen qk sind gegeben durch
z
r r r
rk = r0 − rk ,
Die resultierende Kraft auf q0 ergibt als
Summe über alle Kräfte zwischen q0 und
den qk (Superpositionsprinzip):
n
r
qk
1
F0 = q0 ⋅
⋅ ∑ 2 rˆk
4πε 0 k =1 rk
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
r
rk
x
q
y
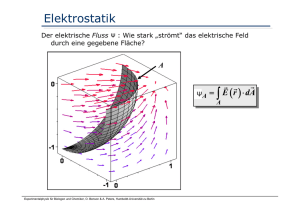
Elektrisches Feld
Elektrisches Feld (Vektorfeld !) einer
negativen Punktladung:
Die Länge der Pfeile gibt die lokale
Stärke, die Richtung der Pfeile die
lokale Richtung der Kraft an, die auf
Probekörper wirkt.
z [a.u.]
y [a.u.]
z=0
x [a.u.]
y [a.u.]
r
von positiven zu negativen
E zeigt
Ladungen.
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
x [a.u.]
Elektrisches Feld
Die Formel für die Kraft auf ein Probeteilchen
n
r
qk
1
F0 = q0 ⋅
⋅ ∑ 2 rˆk
4πε 0 k =1 rk
legt es nahe, diese Formel zu zerlegen und eine neue Größe
einzuführen:
Das elektrische Feld ist definiert durch die Kraftwirkung auf eine
(infinitesimal) kleine Punktladung
n
r r
qk
1
E(r0 ) =
⋅ ∑ 2 rˆk
4πε 0 k =1 rk
SI-Einheit:
[E-Feld]
[E-Feld]
r
r r
F0 = q0 ⋅ E(r0 )
r r r
rk = r0 − rk ,
= [Kraft] / [Ladung] = Newton / Coulomb
= [Spannung] / [Länge] = Volt / Meter
Später ...
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Elektrisches Feld einer Punktladung
Probeladung soll sehr klein sein, um Feld nicht zu verändern
Feld für einzelne Punktladung mit Ladung q
r r
E(r ) =
1
⋅
q
4πε 0 r
2
rˆ
Für einzelne Punktladungen verlaufen „Feldlinien“ radial
Feldlinien beginnen an positiven Ladungen und enden an negativen
Ladungen
positive Testladung bewegt sich in in Richtung der Feldlinien
Feldlinien kreuzen sich nicht
+
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
-
Regeln für Feldlinien
Feldlinien sollen ein intuitives Bild der Stärke
und Richtung eines Feldes im zwei bzw.
dreidimensionalen Raum geben.
Die Richtung der Tangente an die elektrische
Feldlinie in einem Punkt ist identisch zu der
Richtung der Kraft, die in diesem Punkt durch das
Feld auf eine positive Punktladung ausgeübt
wird.
Die Intensität der Feldlinien (= Anzahl der
Feldlinien pro Fläche dA senkrecht zum Feld) ist
proportional zur Stärke der Kraft, die durch das
elektrische Feld auf eine Punktladung ausgeübt
wird.
Im Falle von statischen Ladungen: Elektrische
Feldlinien beginnen immer an den positiven
Ladungen und enden an den negativen Ladungen.
Elektrische Feldlinien kreuzen sich nicht, d.h. das
elektrische Feld ist in jedem Punkt des Raums
eindeutig, denn gäbe es einen Kreuzungspunkt,
so erhielte man zwei unterschiedliche
Feldstärken.
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Überlagerung zweier Felder
Feldstärken addieren sich vektoriell
r
r r
r
r
r
r
Fges F1 + F2 F1 F2 r
Eges =
=
= +
= E1 + E2
q
q
q q
+
-
Richtung der
Feldstärke ist
Tangente an
Feldlinie
+
-
Feld(stärke)
nimmt mit
Abstand ab
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Überlagerung zweier Felder
Feldstärken addieren sich vektoriell
r
r r
r
r
r
r
Fges F1 + F2 F1 F2 r
Eges =
=
= +
= E1 + E2
q
q
q q
+
+
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
+
+
-
Illustration der Feldlinien
Grieskörner...
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Illustration der Feldlinien
Grieskörner...
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Größenordnung von E-Feldern
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Wirkung von E-Feldern
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Wirkung von E-Feldern / Influenz
Für „polarisierbare“ Nichtleiter:
Ladungsträgerverteilung kann sich lokal trotzdem ändern!
r
E extern
Elektronenhülle: -Q
+Q
-Q
+Q
-Q
r
d
Atomkern: +Q
Gesamtladung: 0
positiver und negativer
Ladungsschwerpunkt
liegen übereinander
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Ladungsschwerpunkte durch
elektrisches Feld räumlich getrennt:
es entsteht elektrischer Dipol,
Atom wird polarisiert
Wirkung von E-Feldern / Influenz
Atomare Polarisation in Nichtleitern:
r
E extern
Dielektrikum
Das externe elektrische Feld
erzeugt atomares Dipolmoment und Oberflächenladung
schwächt Feld im Inneren des „Dielektrikums“.
Geht die Polarisation aus Verschiebung der positiven relativ zu
negativen atomaren Ladungen hervor, so spricht man von
„Verschiebungspolarisation“
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Wirkung von E-Feldern / Influenz
Für Leiter (z.B. Metalle) gilt:
Ladungsträger (Leitungselektronen in Metallen) sind leicht verschiebbar
Æ Influenz-Effekte, Abschirmung elektrischer Felder, Ausgleich
von Spannungs- und Potentialdifferenzen (später ...)
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Wirkung von E-Feldern / Influenz
In der Elektrostatik stehen Feldlinien (=Richtung des Feldes) immer
senkrecht auf einem Leiter
Was würde geschehen, falls dies nicht so wäre?
Zerlege elektrisches Feld in Komponente transversal und parallel zur
Oberfläche
parallele Komponente wirkt auf Ladungen im Metall
Da Ladungen im Metall frei beweglich, fließt ein Strom bis Ladung auf
Metall so verteilt ist, dass Feldlinien auf Oberfläche senkrecht enden
⇒ Influenzladungen
Feldlinie
r
F⊥
r
F
Ladungen im Metall frei
beweglich
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Faradayscher Käfig
„Wie sieht das Feld innerhalb eines geschlossenen Metallfläche, in
der keine Ladung existiert, im statischen Fall aus?“
„Im Innern eines geschlossenen Leiters herrscht kein Feld.“
Falls Feld ungleich 0
⇒ Ströme bis Gleichgewicht herrscht
Ladungen werden so
verschoben, dass sich
äußeres Feld und das durch
die Influenzladung erzeugte
Feld im Innern aufheben
Faradayscher Käfig:
Beispiel: Auto, Flugzeug... Faraday‘scher Käfig
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Elektrostatik
Wichtige technische Anwendungen:
Faradayscher Käfig
Ein Faradayscher Käfig ist nur möglich,
weil sowohl positive als auch negative
Ladungen existieren, die sich gegenseitig
abschirmen können.
Es existiert kein Äquivalent für das
Gravitationsfeld!
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Faraday-Becher
Punktladung vor leitender Wand
In der Wand baut sich eine Oberflächenladung auf, die zusammen
mit der Ladung +Q ein Feld im Außenraum (rechst) ein Feld
erzeugt, das auch die Ladung +Q und die Spiegelladung –Q allein
(ohne Wand) erzeugen würden.
„Spiegelladung“
-Q
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Ladung
+Q
Spannungspitzen
Entladungen
V
Entladung an
Metallspitze
Elektrostatisches Lackieren
Auto wird Aufgeladen, damit
Farbtröpfchen entlang den
Feldlinien auch an
unzugängliche Stellen gelangen
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Homogenes elektrisches Feld
r
Wichtiger Fall: homogenes elektrisches Feld E = konstant
Realisation: Plattenkondensator mit positiv und negativ geladenen
Platten
+
+
Kraft auf Testladung q:
+
r
r
+
F = q ⋅ E = konstant
+
+
+
Newton:
+
r
r
+
F = m⋅a
+
+
Gleichsetzen beider Kräfte
r
r
r F q ⋅E q r
a=
=
= ⋅E
m
m
m
analoge Bewegungsgleichungen
wie im Schwerefeld
(z.B. waagrechter Wurf,...)
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Elektronenstrahlröhre - Prinzip
Komponenten
Elektronenquelle
Ablenkung im E-Feld
Parabelbahn
siehe waagrechter Wurf
Leuchtschirm
Kathode
Anode
Elektronenstrahl
l
Schirm
e-
ee-
r
v
e- r
e-
d
z
E
v
z
Ua
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Up
x
Elektronenstrahlröhre
J. J. Thomson (1897)
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Elektronenstrahlröhre
horizontal
Kathode
Ablenkplatten
Strahl wandert
langsam von links
nach rechts
Strahl
Zeit
„Sägezahn“
Heizung
Anode
vertikal
horizontale
Platten
Leuchtschirm
( z.B. ZnS )
Anwendungen
Oszilloskop (Praktikum)
Fernseher
Experimentalphysik für Biologen und Chemiker, O. Benson & A. Peters, Humboldt-Universität zu Berlin
Zeit