Podozyten-spezifische MDM2 Deletion führt zu Proteinurie und FSGS
Werbung

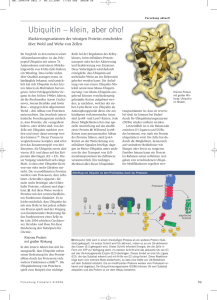
© MDM2-Mangel in Podozyten führt zu gestörter Autophagie und fokal-segmentaler Golerulosklerose Hauke Arne Bruns, Dana Thomasova, Helen Liapis, Hans-Joachim Anders Medizinische Klinik und Poliklinik IV, Ludwig-Maximilians-Universität, München Einleitung 80 60 3-4 N utlin 3a 1 MDM2 N FκB p53 2 4 p50 p65 3 9-11 12-13 p53 nuclear export N FκB p53 p50 p65 p53 Apoptosis, cell-cycle-arrest A A p53 stabilisation: Cell quiescence, senescence, apoptosis B Podo-MDM2 -/- Podo-MDM2 +/- Podozyten/Glomerulus 15 Verminderte MDM2-Expresssion in Podozyten A Podo-MDM2 -/- Podo-MDM2 +/- Lamp1 LC3B Podo-MDM2 +/- B 20 Vakuolen Lamp2 WT1/Neph Methoden 10 8 6 4 2 0 Podo-MDM2 -/- MDM2 hat durch verschiedenen Mechanismen negativ-regulatorische Effekte auf p53: (1) In seiner Funktion als E3-Ubiquitin-Ligase fördert MDM2 den Ubiquitin-bedingten Abbau von p53 durch Proteasomen, (2) MDM2 erhöht den Export von p53 aus dem Nukleus, (3) MDM2 hemmt die Transkriptionsaktivität von p53, (4) MDM2 hat positiven Einfluss auf die NF-κB-Signalkaskade indem es die Transkription von NF-κB/p65 fördert und außerdem als Kotranskriptionsfaktor für NF-κB-Zielgene fungiert. Mit dem Cre/loxP Recombinations-System generierten wir Podozyten-spezifische MDM2-Knockout Mäuse (Podocin-Cre/MDM2flox), bei denen das MDM2-Gen auf DNA-Ebene ausgeknockt wurde. Die anschließende Charakterisierung erfolgte mit Hilfe von Albumin-ELISA, Kreatinin-Essay, Immunhistologie, Elektronenmikroskopie und realTime PCR. Podo-MDM2 -/- 14W A Überleben, n=12. +/+ Tiere mit normalem Überleben (nicht dargestellt). B Nierenschnitte, PAS-Färbung. Deutlich progrediente segmentale Sklerosen bei -/- Tieren, +/- und +/+ (nicht dargestellt) unauffällig. recruitment MDM2 INHIBITION Podo-MDM2 -/- 8W MDM2-Mangel in Podozyten führt zu gestörter Autophagie N ucleus Podozytenverlust in MDM2 -/- Tieren Proliferation, tumor-attack, Podo-MDM2 +/- 14W % Vakuolen/Glomerulus p50 p65 7-8 Wochen Im Vergleich mit +/- Littermates zeigen Podo-MDM2 -/- Mäuse immunhistochemisch eine verminderte MDM2-Expression in Podozyten. In der Analyse von glomerulärer RNA mittels qPCR finden sich verminderte MDM2-mRNA Level. Der Quotient aus Podozyten/Glomeruli ist in 3 Wochen alten Mäusen für beide Gruppen nicht signifikant unterschiedlich. Der Quotient vergrößert sich bei älteren (16Wochen) +/- Mäusen, wohingegen er bei -/- Tieren abnimmt. Der relative Mangel an Podozyten manifestiert sich histologisch als fortschreitende fokal-segmentale Glomerulosklerose (FSGS). Die Tiere weisen eine progrediente Proteinurie und erhöhte Mortalität auf. qPCR mit glomerulärer RNA zeigt eine verringerte renale Expression von podozytenspezifischen Genen, wie z.B. Podocin und Synaptopodin. Elektronenmikroskopisch werden spezifische morphologische Veränderungen in Form von massiven Vakuolen und ER Veränderungen in den Podozyten auffällig, welche auf Autophagie und dadurch bedingten Zelltod hinweisen. Im Gegensatz dazu zeigen heterozygote Tiere innerhalb von 26 Wochen keine Anzeichen einer Proteinurie und normale Sterblichkeit. p53 N FκB 5-6 Ergebnisse Proteasome IκBα B 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Wochen Urinanalyse mittels Albumin-ELISA und Kreatinin-Assay. n=11. Über einen Zeitraum von 13 Wochen entwickeln nahezu alle -/- Tiere eine schwere Proteinurie. +/- und +/+ Tiere ohne Proteinurie (nicht dargestellt). Cytosol I κB α Alb/Crea <1 Podo-MDM2 +/Podo-MDM2 -/- 0 Genotoxic/ ribosomal/ oncogenic stress IKK Alb/Crea 1-100 100 80 60 40 20 0 20 p53 signaling pathway DAMPs PAMPs Alb/Crea >100 % 40 Effekte von MDM2 auf die NF-κB- und p53-Signalkaskaden N FκB signaling pathway A 100 % Überleben Podozyten tragen neben dem Kapillarendothel und der Basalmembran einen wesentlichen Teil zur Integrität der Glomerulären Filtrationsbarriere bei. Die Tatsache, dass es sich bei Podozyten um terminal differenzierte Zellen handelt, erklärt, warum Podozyten bei Verlust nicht ausreichend regenerieren und es daher oftmals zu Proteinurie, fokal-segmentaler Glomerulosklerose (FSGS) und progredienter Niereninsuffiziens kommt. Die Faktoren, die Podozyten ihre Jahrzehnte dauernde Widerstandsfähigkeit gegen hämodynamischen, toxischen oder immunologischen Stress verleihen, sind bisher größtenteils unbekannt. Die E3-Ubiquitin-Ligase Murine Double Minute (MDM-)2 ist Teil der NF-kB Signalkaskade und der wichtigste Negativregulator des Tumorsupressors p53 und der damit einhergehenden p53-vermittelten Zellzyklus Unterbrechung. MDM2 wirkt somit pro-mitotisch und anti-apoptotisch. In Vorarbeiten konnten wir zeigen, dass MDM2 Blockade Adriamycin-induzierten Podozytenverlust, Proteinurie und Glomerulosklerose verhindern kann. Die MDM2-Blockade führt zu p53 Anstieg und verhindert damit Podozytenverlust durch aberrante Podozytenmitose (katastrophale Mitose), bei der es zur Ablösung und Verlust der Podozyten kommt. Die physiologische Bedeutung von MDM2 in nicht-stimulierten Podozyten ist bisher nicht abschließend geklärt. Unsere Hypothese ist, dass MDM2 p53 Überaktivierung verhindert, da diese zum Verlust der Podozyten führen könnte. T LR MDM2 Mangel in Podoyzten führt zu FSGS Proteinurie Podo MDM2 -/- 10 Podo-MDM2 -/- 5 Podo-MDM2 +/- C 0 3 Wochen C 14 Wochen Podocin Podo-MDM2 +/+ Podo-MDM2 +/- mRNA/18srRNA 0,025 Podo-MDM2 -/- 0,020 B 0,020 0,015 0,010 0,005 0,000 D 0,015 0.3 mRNA/18s rRNA mRNA/18srRNA Podo-MDM2 +/- 0,010 0,005 Podo-MDM2 -/- Synaptopodin 0.2 0.1 0.0 0,000 Podo-MDM2 +/- Podo-MDM2 -/- A Nierenschnitte, 8 Wochen alte Mäuse, MDM2-Färbung B qPCR mit glomerulärer mRNA. +/+ idem -/+ (nicht dargestellt). Podo-MDM2+/Podo-MDM2-/A Nierenschnitte 14W, WT1/Nephrin Färbung. Podozyten erscheinen rot, GBM grün. B Anzahl Podozyten/Glomerulus. n=3/Gruppe, 3x20Gloms ausgezählt. C, D qPCR mit glomerulärer mRNA. +/+ idem -/+ (nicht dargestellt). Podo-MDM2 +/14 Wochen Podo-MDM2 -/8 Wochen Podo-MDM2 -/14 Wochen nahezu keine Vakuolen. B Färbungen zeigen erhöhte Expression von Lamp2 C Nierenparenchym. Deutliche Vakuolenbildung in -/- Mäusen, mit Progredienz (EM-Aufnahmen). Zusammenfassung & Schlussfolgerung Podozyten-spezifische MDM2 Deletion führt zu Podozytenverlust mit einhergehender Proteinurie und progredienter FSGS. Die histologischen Veränderungen lassen auf Autophagie-bedingten Zelluntergang schließen. Wir schließen daraus, dass MDM2 für die Homöostase und Widerstandsfähigkeit von Podozyten bedeutsam ist.