4. Isomerie von Komplexverbindungen
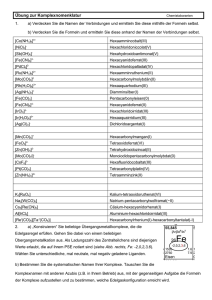
Werbung

4. Isomerie von
Komplexverbindungen
4. Isomerie bei
Koordinationsverbindungen
Grundsätzlich unterscheidet man Konstitutionsisomerie
Strukturisomerie) und Stereoisomerie (Konfigutationsisomerie).
Konstitutionsisomerie: gleiche
stöchiometrische Zusammensetzung,
unterschiedliche Verknüpfung der
Atome.
Butan
Ionisationsisomerie
Hydratationsisomerie
Koordinationsisomerie
Bindungsisomerie
2-Methylpropan
Stereoisomerie: gleiche
Konstitution, aber unterschiedliche
räumliche Anordnung von Atomen
und Atomgruppen
Geometrische Isomerie
Optische Isomerie
4.1 Ionisationsisomerie
Ionisationsisomerie bedeutet den Austausch eines Liganden
zwischen der inneren und äußeren Komplexsphäre. Dies ist
oft mit deutlichen Farbwechseln verbunden.
trans-[CoCl2(en)2]NO2
grün
trans-[CoCl(NO2)(en)2]Cl
orange
4.2 Hydratationsisomerie
Sonderfall der Ionisationsisomerie, bei der neutrale SolvatMoleküle beteiligt sind. Die Wassermoleküle sind entweder
als Liganden gebunden oder sie liegen im Kristallgitter als
Solvatmoleküle vor.
CrCl3·6H2O kann in Lösung in drei Isomeren auftreten:
[Cr(H2O)6]Cl3
[CrCl(H2O)5]Cl2·H2O
[CrCl2(H2O)4]Cl·2H2O
violett
blassgrün
dunkelgrün
4.3 Koordinationsisomerie
Salze, die komplexe Anionen und komplexe Kationen
enthalten, können Koordinationsisomere bilden, indem
Liganden zwischen Kation und Anion vertauscht werden.
[Co(NH3)6] [Cr(CN)6]
[Cr(NH3)6] [Co(CN)6]
[Cu(NH3)4] [PtCl4]
[Pt(NH3)4] [CuCl4]
4.4 Bindungsisomerie
Klassisches Beispiel ist der Komplex [Co(NH3)5(NO2)]Cl2,
der in den Farben gelb und rot vorkommt.
Die Farbe wird durch die Art der Bindung des Nitrit-Ions an
das Cobalt-Atom bestimmt:
hn
[Co(NO2) (NH3)5
]2+
Pentaammin(nitrito-k-N)-cobalt(III)
D
[Co(ONO)(NH3)5]2+
Pentaammin(nitrito-k-O)-cobalt(III)
[Co(NO2)(NH3)5]2+
[Co(ONO)(NH3)5]2+
Bindungsisomerie tritt auf für Liganden, die asymmetrisch
sind und über mehrere freie Elektronenpaare an
verschiedenen Atomen verfügen: z.B. NO2-, SCN-, CN-, SO2
CN- im Berliner Blau:
+II
+III
Fe2+ ist C-gebunden und
Fe3+ ist N-gebunden
Hohlräume sind mit K+Ionen und H2O-Molekülen
besetzt
Berliner Blau - Kristallgitter:
4.5. Stereoisomere
(Konfigurationsisomere)
- gleiche Atomverkettung, unterschiedliche räumliche Anordnung der
Atome
Enatiomere (optische Isomere):
-verhalten sich wie Bild und Spiegelbild zueinander (chirale Moleküle)
-gleiche physikalische und chemische Eigenschaften, aber
unterschiedliche Reaktionen mit optisch aktiven Verbindungen,
unterschiedliche Kristallformen und physiologische Eigenschaften
Diastereomere (geometrische Isomere):
-Stereoisomere, die nicht Enatiomere sind, nennt man Diastereomere
oder geometrische Isomere.
-unterschiedliche physikalische und chemische Eigenschaften
4.5.1 Diastereomere (geometrische Isomere)
Koordinationszahl 4
Für tetraedrische Komplexe gibt es keine geometrischen Isomeren.
Qadratisch-planare Komplexe: Für Komplexe des Typs [MA2B2]
unterscheidet man cis- und trans-Isomere; typisches Beispiel ist
[PtCl2(NH3)2]. Diese Komplexe unterscheiden sich bezüglich des
Dipolmomentes (C2v für cis, D2h für trans).
cis
trans
Das [PtCl4]2- Anion reagiert mit NH3 zu zwei unterschiedlichen
Isomeren, die chemisch unterscheidbar sind.
Die Bildung unterschiedlicher Isomere wird durch den trans-Effekt
verursacht.
Genaue Untersuchungen zeigen: Chlorid übt einen stärkeren transEffekt aus als Ammoniak.
Peyrone: Liebigs Annalen 1845, 51, 1
Joergensen J. prakt. Chem. 1886, 33, 489
Trans-Effekt-Reihe
CN- > CO > C2H4 ~ NO > PR3 > SR2 >
S=C(NH2) > NO2- > SCN- > I- > Cl- >
NH3 > Pyridin > RNH2 > OH- > H2O
Cancerostatisch
Störung der DNA-Struktur,
Absterben der Krebszellen
Pt
cis-[PtCl2(NH3)2], Peyrones Salz
orangegelb
0.252 g/100 ml H2O
Pt
trans-[PtCl2(NH3)2]
hellgelb
0.037 g/100 ml H2O
Mit zweizähnigen Liganden (en, acac) lässt sich die cis-Geometrie
erzwingen.
O
H3 N
OCCOOH
Pt
HOOCCO
O
NH 3
Koordinationszahl 4
Für Komplexe mit drei verschiedenen Liganden [MA2BC] gibt es zwei
geometrische Isomere. Quadratisch-planare Komplexe mit 4
verschiedenen Liganden können drei geometrische Isomere bilden.
cis
trans
Koordinationszahl 6
Es sind am Oktaeder zwei einfache Arten von cis-trans-Isomerie
möglich.
Bei Komplexen des Formeltyps MA4B2 kannte schon A. Werner zwei
Möglichkeiten, z. B bei CoCl3×4NH3 [Co(NH3)4Cl2]Cl, das als grüner
„Praseo-Komplex“ und als violetter „Violeo-Komplex“ vorkommt.
cis-[CoCl2(NH3)4]+
violett
trans-[CoCl2(NH3)4]+
grün
Dichloridodiethylendiamincobalt(III)
CH3OH
Wärme
[CoCl2(en)2]Cl
cis- Form
blauviolett
[CoCl2(en)2]Cl
trans- Form
fahlgrün
Koordinationszahl 6
Ebenso bei [MA3B3]/[ML3ABC]: die drei Liganden derselben Art
können jeweils die Ecken einer Oktaederfläche besetzen („faciale“
Anordnung von facies[lat.] = Gesicht) oder einen Meridian
(„meridionale“ Anordnung)
Für das mer-Isomere existieren, je nach Anordnung der Liganden A, B
und C (trans A-B oder trans A-C)
fac-[CoCl3(NH3)3]
mer -[CoCl3(NH3)3]
fac-Isomer
mer-Isomer
4.5.2 Enantiomere (Optische Isomerie)
Voraussetzung für Enantiomorphie ist Chiralität, die erfüllt ist, wenn im
Molekül weder eine Spiegelebene noch ein Symmetriezentrum
(Inversionszentrum) vorhanden ist.
Koordinationszahl 4
Optische Isomere sind typisch für tetraedrische Komplexe mit vier
unterschiedlichen Liganden.
Koordinationszahl 6
Einfachster Fall (bereits von Werner untersucht Ber. Dt. Chem. Ges.
1911, 44, 1887): Dichlorodiethylendiamincobalt(III) [CoCl2(en)2]+
trans-Isomer weist drei aufeinander
senkrecht stehende Spiegelebenen auf, ist
optisch inaktiv (kein Enantiomer)
cis-Isomer hat keine Spiegelebenen, es
existieren zwei Enantiomere
Die Chiralität in den Etylendiamin-Komplexen wird nicht durch
Kohlenstoffatome verursacht.
Erstes Beispiel für einen Kohlenstoff-freien, chiralen Metallkomplex
von Werner: {[(NH3)4Co(μ-OH)2]3Co}6+ Ber. Dt. Chem. Ges. 1914, 47,
3087).
Heute sind zahlreiche weitere Beispiele für Komplexe mit drei
zweizähnigen Liganden bekannt:
L/D-Nomenklatur gibt direkt Auskunft über die Koordinationsgeometrie
des betrachteten Zentrums. J. Am. Chem. Soc. 1961, 83, 3908; Inorg.
Chem. 1970, 9, 1.
Zur Bestimmung der D oder L-Konfiguration wird das Oktaeder entlang
der dreizähligen Achse betrachtet: rechtshändige Schrauben werden als
D-, linkshändige Schrauben als L-Isomer bezeichnet.
L[Co(en)3]3+
D[Co(en)3]3+