Folien zur Vorlesung
Werbung

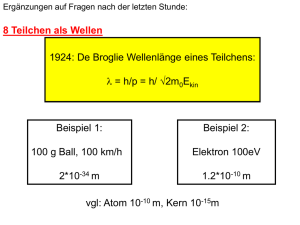
Wellenfunktion: Ebene Welle: Materie: E= h = ħ p= h/ = ħ k Impuls k=2/ Energie A(x,t) = A0 cos(kx - t) Wellenfunktion: Materie: E= h = ħ Ebene Welle: p= h/ = ħ k k=2/ x px ħ Ort x A(x,t) = A0 cos(kx - t) x px ħ Extremfall: scharfer Impuls p = ħ k Völlig delokalisiert (unendlich ausgedehnt) Impuls px Wellenfunktion: Ebene Welle: A(x,t) = A0 cos(kx - t) Wellenpaket: Überlagerung aus Ebenen Wellen verschiedenen k Fourieranalyse: Aufbau aus harmonischen Schwingungen Visual Quantum Mechanics Bernd Thaller Springer, New York 2000 Web Page: http://www.kfunigraz.ac.at/imawww/vqm/index.html Aufbau eines Wellenpaketes Y(x) = eikx d.h. die Phasengeschwindigkeit ist Energieabhängig -> Dispersion Realteil Real und Imaginaer Gauss Wellenpaket Ruhendes Teilchen Bewegung Beispiel: Schiefer Wurf = h/p = h/ 2m0Ekin Ort x Klassiche Bahn Quantemechanische Teilchen x px ħ „Wellenpaket“ Ortsunschärfe x px ħ Impuls px Impuls: Wellenlänge Unschärfe: verschiedene Wellenlängen http://www.kfunigraz.ac.at/imawww/vqm/german/wellen3.html Beispiel: Schiefer Wurf = h/p = h/ 2m0Ekin •Wellenlänge länger (langsamer am Scheitelpunkt) •Ausgedehnter: auseinandergelaufen http://www.kfunigraz.ac.at/imawww/vqm/german/wellen3.html Beispiel: Schiefer Wurf = h/p = h/ 2m0Ekin •Wellenlänge länger (langsamer am Scheitelpunkt) •Ausgedehnter: auseinandergelaufen http://www.kfunigraz.ac.at/imawww/vqm/german/wellen3.html Doppelspalt: Höhe: Wahrscheinlichkeit ein Teilchen dort zu finden ORT: dargestellt Gausssche Wellenpaket Gaussverteilung im Ort Impuls Ort x Impuls: nicht zu sehen x px ħ Impuls px Doppelspalt: ORT: dargestellt Ort x Impuls: in der Wellenlänge x px ħ Amplitude:Farbsättigung http://www.kfunigraz.ac.at/imawww/vqm/german/wellen3.html Impuls px Heisenbergsche Unschärfe Relation Ort / Impuls x px ħ Konsequenz: Potentielle Energie Klassisch: Oszillation zwischen Potentieller und kinetischer Energie x Heisenbergsche Unschärfe Relation Ort / Impuls x px ħ Potentielle Energie Konsequenz: Klassisch: ein Teilchen kann in Ruhe am Boden sitzen x Heisenbergsche Unschärfe Relation Ort / Impuls x px ħ Potentielle Energie Konsequenz: QM: In einem Potentialtopf gibts immer eine „Nullpunktsschwingung“ x px x Heisenbergsche Unschärfe Relation x px ħ ħ = 1 10-34 kg m2/sec Kugel 10g auf 1m Potentielle Energie 10-26 m/sec x px x Heisenbergsche Unschärfe Relation x px ħ ħ = 1 10-34 kg m2/sec Elektronen im Atom: Radius: 10-10m Elektronenimpuls>10-24 kg m/sec me=9 10-31kg -> 9 107 m/sec Heisenbergsche Unschärfe Relation Ort / Impuls x px ħ Energie/Zeit t E ħ Folgen: •Monochromatisches Licht kann nicht sehr kurz sein •Ein kurzlebiger Zustand hat keine scharfe Energie •Nur stabile Zustände (Bohrmodel) haben scharfe Energie Energieerhaltung? kann kurzzeitig verletzt sein! Gilt streng im Einzelprozess, aber nicht in beliebig kurzen Zeitintervallen. Beispiel 1: t E ħ Beispiel 1: t E ħ Klassische Mechanik Energieerhaltung gilt für jeden Zwischenschritt Quantenmechanik Energieerhaltung gilt für Zwischenschritte nur innerhalb t E ħ Beispiel 2: t E ħ Kurze Lichtpulse sind breitbandig: t E ħ = 6.58*10-16 eVs Ephoton= h langer sinus: scharfe Energie Kurzer Laserpuls Überlagerung von ebenen Wellen Bsp: 5*10-15 sec (femto) 0.1 eV (von z.B. 1,5 eV) •Teilchen durch Wellen beschrieben (de Broglie) •Die Wellen interferieren •Amplitudenquadrat ist Wahrscheinlichkeit •Unschärfe von Ort & Impuls, Energie & Zeit •Ebene Wellen: Impuls aber kein Ort •Teilchenanschauung: Wellenpaket 9. Heisenbergsche Unschärferelation 10. Das Bohrsche Atommodell 10.1. Diskrete Spektren Schwarzer Strahler 9. Heisenbergsche Unschärferelation 10. Das Bohrsche Atommodell 10.1. Diskrete Spektren a) Absorbtionsspektren Wasserstoff Gas Wasserstoff Absorbtionsspektrum 9. Heisenbergsche Unschärferelation 10. Das Bohrsche Atommodell 10.1. Diskrete Spektren a) Absorbtionsspektren b) Emissionsspektren Helium Wasserstoff Emissionsspektrum Wellenlänge nm H Spektralanalyse Kirchhoff und Bunsen: Jedes Element hat charakteristische Emissionsbanden H 1853 von Anders Jonas Angström entdeckt H 1 Å = 10-10 m Rydbergkonstante 109678 cm-1 infrarot sichtbar ganze Zahlen ultaviolett Lyman n1=1 Balmer n1=2 Paschen n1=3 9. Heisenbergsche Unschärferelation 10. Das Bohrsche Atommodell 10.1. Diskrete Spektren 10.2. Die Bohrschen Postulate Wie Rutherford Elektronen auf Kreisbahnen Coulomb Anziehung Z=1, e- Zentrifugalkraft: mer2 Gesamtenergie des Elektrons auf der Bahn: E = Ekin + Epot 0 Energy Epot r negativ Energie die frei wird wenn Elektron von unendlich zum Radius r gebracht wird. Widerspruch zur klassichen Mechanik & Maxwellgleichungen: •Bewegte Ladung strahlt Energie ab, Elektron stürzt in Kern! •Strahlung ist nicht quantisiert keine diskreten Linien! Bohrsche Postulate (Niels Bohr 1913) •Elektronen bewegen sich auf Kreisbahnen •Die Bewegung ist strahlungsfrei rn n •Der Drehimpuls der Bahnen ist quantisiert l=n ħ (Historisch nicht korrekt) Ry = Rydbergkonstante (Ionisierungsenergie n=1) 109678 cm-1 Einige Zahlenwerte: Radius des Wasserstoffatoms rn=1= 0.529 10-10m Ionisierungsenergie des Wasserstoffatoms En=1= 13.59 eV Z2 !! dh. Uran 115 keV Heisenbergsche Unschärfe x px ħ 10.3 Rydberg Atome 10.3 Rydberg Atome : n=10 000 Radius = 0.6 mm En=10 000= 1.3 10-7 eV 0.01 mm wurde wirkliche erreicht! Rydberg Atome •rn n2 •vn 1/n Heisenbergsche Unschärfe x px ħ n!1 Übergang zu klassischer Bahn (Bohrsches Korrespondezprinzip) Lebensdauer steigt E3 10.4 Korrektur durch endliche Kernmasse mproton / melektron = 1836 gemeinsame Bewegung um Korrektur: Massenschwerpunkt Wasserstoff Energie 0.0545 % 10-15m 10-10m Kerndurchmesser 10-5 des Atoms! Massenschwerpunkt liegt nicht im Kern Erinnerung: Wasserstoff 3 Isotope: H 1 Proton + 1 Elektron D (Deuterium) 1 Proton + 1 Neutron + 1 Elektron T (Tritium)(12.3 y) 1 Proton + 2 Neutronen + 1 Elektron 10.4 Korrektur durch endliche Kernmasse Folge: Isotope haben verschiedenen Spektrallinien Korrektur: Wasserstoff Energie 0.0545 % mdeuteron / mproton = 2 10.5. Myonische Atome Elektronenmasse! Meson m = 207 me 10.5. Myonische Atome Erzeugung von -Mesonen an Protonenbeschleunigern: p + n -> p + p + - Pion (Masse 273 me) 2.5 10-8s - + Myon + Myonneutrino 2.2 10-6 s e- + e + Spektrum 207 fach höhere Energie 10.5. Myonische Atome Wozu? Myonen Bahnen sind teilweise im Kern -> Energie gibt Information über Ladungsverteilung des Kerns

![228 Impuls [tra]](http://s1.studylibde.com/store/data/002209833_1-78fff0f04eecfca554443edbe3773399-300x300.png)








