T 2 -T 1
Werbung

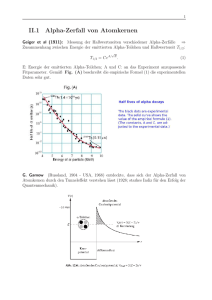
Besetzungswahrscheinlichkeiten der Energiezustände: W1 , W2 , W3 , g1 , g2 , g3 , Energiezustände: relative Häufigkeiten der Wi : Boltzmann-Verteilung: w i g i exp Wi kT Beweis: Finde Konfiguration mit größter statistischer Wahrscheinlichkeit Literatur Beispiel: Barometrische Höhenformel i h Wi Vh mgh gi const . n h n 0 exp mkgTh wi nh ρv d3N 1 N dvx dv y dvz exp dN dv x, y,z m v 2x 2 kT exp m v2 2 kT exp exp m v 2y 2 kT m v 2z 2 kT dN d|v| v 2x, y,z GaußVerteilung v2 Gaußfunktion 0 v x, y,z vx , vy , vz unkorreliert 0 ρ|v| v2 1 dN N d| v | |v| 2 m v2 v exp 2 kT Geschwindigkeitsverteilung f?r Heliumgas 77 K v<v2> 273 K 373 K 1000 K v [m/s] c) Definition: Adiabatenindex f 2 γκ CV f Cp Messung von Messung von f ( Molekülstruktur des Gases) einatomig f=3 κ = 5/3 ( Translation ) zweiatomig f=3 ( Translation ) + 2 ( Rotation ) dreiatomig f=3 ( Translation ) + 3 ( Rotation ) κ = 7/5 κ = 8/6 Schwingungsmoden erst bei sehr großen T ( Quantenmechanik ) Bemerkung: Spezifische Wärme von Festkörpern Schwingungen der Gitteratome: Phononen Mittlere Energie einer Schwingungsmode: D E T V const . T 12 m x 2 V 12 D x 2 m x Kristallgitter T mω A m A DA V 1 4 2 2 1 4 D m 2 1 4 2 3 Schwingungsrichtungen f 3 (kinetisch) 3 (potentiell) 6 Regel von Dulong Petit: CV f2 R 3R versagt für T 0K Quantenmechanik 6.2.3. Wärmekraftmaschinen Wärmekraftmaschine: W = Volumenarbeit Wirkungsgrad: T2 T1 T1 Q2 Q1 Reservoir 2 (z.B. Verbrennungsgemisch) Kältemaschine: Reservoir 1 (z.B. Auspuffgas) W η Q2 W (mechanisch, elektrisch) T1 T2 T2 Q1 Q2 η = Q2/W ≤ T2/(T2-T1) Reservoir 1 Reservoir 2 Kühlraum .............................. Wärmetauscher (Kühlschrank) Außenraum ............................... Heizsystem (Wärmepumpe) Ideale Maschine ( max) Carnotscher Kreisprozess p W p dV eingeschlossene Fläche Theorie-VL T2 T1 η 1 T2 W V Tafelrechnung Beispiel: Heißluftmotor ( Stirling-Maschine ) 90° Phasendifferenz p Q1 1 Q4 T2 ΔW 4 Q3 Kühlung Kolben B T1 Zwischenspeicherung in Kolben A T1 3 V2 V1 T1 2 Q2 V Kolben A T2 T1 Heizung Schritt A B 23 34 41 12 runter unten hoch oben oben runter unten hoch Typ isochor isotherm isochor isotherm pS p Dampfdruckkurve TC T2 Λ exp RT PC T1 V T1 T2 TC T Koexistenz Dampf / Flüssigkeit PC kritischer Punkt TC kritische Temperatur Λ Verdampfungswärme pro Mol Van-der-Waals-Gleichung: p ideales Gas Überhitzte Flüssigkeit kritischer Punkt Übersättigter Dampf identische Flächen ΔW p dV 0 Koexistenz Dampf / Flüssigkeit V Anwendung: Joule-Thomson-Effekt (adiabatische Expansion) p1 Drosselventil V1 V2 dT Beispiel: Linde-Verfahren ( Luftverflüssigung ) p2 εtot .36 .86 .92 1.19 1.27 1.52