Leitfähigkeit von Elektrolytlösungen
Werbung

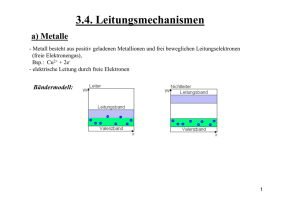
Leitfähigkeitfähigkeit wässriger Elektrolytlösungen Versuch Nr. 10 Gliederung: - Theorie • Allgemeines zur Leitfähigkeit wässriger Elektrolytlösungen • Leitfähigkeit starker Elektrolyte • Leitfähigkeit schwacher Elektrolyte - Versuchsaufbau / Messprinzip - Versuchsdurchführung und Auswertung - Anwendung: Konduktometrische Titration Allgemeines zur Leitfähigkeit von Elektrolytlösungen Ein Elektrolyt ist ein Stoff der beim Anlegen einer elektrischen Spannung den Strom leitet, wobei seine elektrische Leitfähigkeit auf frei beweglichen Ladungsträgern, den Ionen, beruht. Es gilt das Ohmsche Gesetz: U R I Der Widerstand R ist vom Leitermaterial abhängig, für einen homogenen Leiter gilt: l 1 l R A A Allgemeines zur Leitfähigkeit von Elektrolytlösungen Im elektrischen Feld wandern solvatisierte Ionen zwischen den Elektroden mit einer konstanten Transportgeschwindigkeit. Diese wird erreicht wenn die elektrische Kraft und die Stokesche Reibungskraft den gleichen Wert erreichen. v max z e0 E 6 r 1 Charakteristische Transportgeschwindigkeiten in Wasser, bei 298 K und einer Feldstärke von 1 V/cm: H+ OH- Na+ Cl- 36,23*10-4 cm/s 20,64*10-4 cm/s 5,19*10-4 cm/s 7,91*10-4 cm/s Allgemeines zur Leitfähigkeit von Elektrolytlösungen Für eine Elektrolytlösung vorgegebener Zusammensetzung gilt bei vorgegebener Temperatur: I L U Die Leitfähigkeit L ist abhängig von: - Art der Ionen - Konzentration der Ionen - Viskosität η - Temperatur - Dimension des Ionenleiters Für die Leitfähigkeit gilt: A L l Leitfähigkeit starker Elektrolyte Starke Elektrolyte sind vollständig dissoziiert. Leitfähigkeitsverhalten: Verdünnte Lösungen: lineare Abhängigkeit der Leitfähigkeit von der Konzentration Konzentriertere Lösungen: Abweichungen vom linearen Verhalten, bei hohen Konzentrationen Abfallen der Leitfähigkeit Leitfähigkeit starker Elektrolyte Die molare Leitfähigkeit Λm ist die Leitfähigkeit des Volumens einer Lösung, die genau 1 Mol Elektrolyt enthält. cm³ 1000 dm³ m Vm c Die Äquivalentleitfähigkeit Λe entspricht der molaren Leitfähigkeit dividiert durch die Äquivalentzahl ne: m e ne Leitfähigkeit starker Elektrolyte Die Konzentrationsabhängigkeit der molaren bzw. der Äquivalentleitfähigkeit wird durch das Kohlrauschsche Quadratwurzelgesetz beschrieben: e 0 k c Für starke Elektrolyte: Bestimmung der Äquivalentleitfähigkeit bei unendlicher Verdünnung Λ0 durch Extrapolation der Geraden. Leitfähigkeit schwacher Elektrolyte Schwache Elektrolyte sind unvollständig dissoziiert. Die Dissoziation wird beschrieben durch den konzentrationsabhängigen Dissoziationsgrad α, der erst bei unendlicher Verdünnung gegen 1 geht. Für schwache Elektrolyte: Eine genaue Bestimmung von Λ0 durch Extrapolation ist nicht möglich. Leitfähigkeit schwacher Elektrolyte Bestimmung der Grenzleitfähigkeit schwacher Elektrolyte mithilfe des 1. Kohlrauschschen Gesetzes (Gesetz der unabhängigen Ionenwanderung) : 0 HAc 0 ( H ) 0 ( Ac ) Schwache Elektrolyte dissoziieren gemäß: MA M A Für die Gleichgewichtskonstante K gilt: c ( M ) c ( A ) K c( MA) Leitfähigkeit schwacher Elektrolyte Mit c(M+) = c(A-) = c*α erhält man: K ² c² ²c (1 ) c (1 ) Da der Dissoziationsgrad α dem Quotienten Λe/Λ0 entspricht, gilt das Ostwaldsche Verdünnungsgesetz: e ² K c ( 0 e) 0 Durch Umformen ergibt sich: cm³ 1000 1 1 dm³ e 0 K 0² Versuchsaufbau / Messprinzip Die Messung der Leitfähigkeit erfolgt indirekt über die Messung von Strom und Spannung zwischen zwei Elektroden an die eine Wechselspannung angelegt wird. Die Berechnung der Leitfähigkeit erfolgt nach: I d I K U A U K ist die Zellkonstante der Messzelle und beträgt im Praktikum 1 cm-1. Versuchsdurchführung und Auswertung 1. Versuchsteil: - Messung der Leitfähigkeit verschieden konzentrierter HCl, NaCl und NaAc-Lösungen - graphische Auswertung durch Auftragen von Λe gegen c - Bestimmung der Grenzleitfähigkeit durch Extrapolation Äquivalentleitfähigkeit [cm²/mol*Ohm] NaCl - Auftragung der Äquivalenleitfähigkeit gegen die Konzentration 1,60E+02 1,40E+02 1,20E+02 1,00E+02 8,00E+01 6,00E+01 4,00E+01 2,00E+01 0,00E+00 y = -343,99x + 138,41 R2 = 0,6352 0 0,02 0,04 0,06 Wurzel(c) [Wurzel(mol/L)] 0,08 0,1 0,12 Versuchsdurchführung und Auswertung 2.Versuchsteil: - Messung der Leitfähigkeit verschiedener Konzentrationen einer HacLösung - graphische Auswertung durch Auftragen von 1/Λe gegen κ Kehrwert derÄquivalentleitfähigkei t [Ohm*mol/cm²] HAc - Auftragung des Kehrwerts der Äquivalentleitfähigkeit gegen Kappa 1,60E-01 1,40E-01 1,20E-01 1,00E-01 8,00E-02 6,00E-02 4,00E-02 2,00E-02 0,00E+00 0,00E+00 y = 1010,6x + 0,0012 R2 = 0,9602 2,00E-05 4,00E-05 6,00E-05 8,00E-05 1,00E-04 1,20E-04 1,40E-04 1,60E-04 Kappa [1/cm*Ohm] - Aus der Steigung der Geraden lässt sich die Gleichgewichtskonstante cm³ K bestimmen: 1000 1 dm³ m 0 K 0² Versuchsdurchführung und Auswertung 3. Versuchsteil: - Berechnung der Geschwindigkeit und Ionenradien von Natrium- und Chlorid-Ionen: Ionenbeweglichkeit u: 0 (u ( Na ) u (Cl )) zF Anhand von Literaturwerten lassen sich die Ionenbeweglichkeiten von Natrium- bzw. Chlorid-Ionen berechnen. Transportgeschwindigkeit vmax: v max u E Ionenradien: z e0 r 6 u Anwendung: Konduktometrische Titration Versuchsaufbau: Anwendung: Konduktometrische Titration Grenzleitfähigkeiten in Wasser: H3O+ 349,6 S*cm²/mol OH- 199,2 S*cm²/mol Na+ 50,1 S*cm²/mol Cl- 76,3 S*cm²/mol Quellenangabe - P.W. Atkins – Physikalische Chemie - wikipedia.de - Versuchsanleitung Versuch 10 Vortrag von Anneliese Bamberg und Sonja Krieger