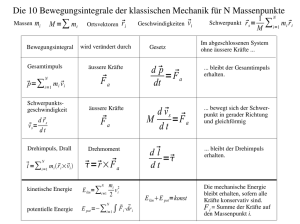
1/n 2 - CCP14
Werbung

Das Bohrsche Atommodell Jenseits der klassischen Physik: Die Quantenbedingung für den Drehimpuls Inhalt • Kräfte zwischen Kern und Elektronen • Quantenbedingung für den Drehimpuls • Abhängig von der Quantenzahl: – Bahnradius – Energie • Die Bohrschen Postulate Das Bohrsche Atommodell • Elektronen kreisen als geladene, mechanische Objekte um den Kern – Gleichgewicht zwischen Coulomb- und Zentrifugalkraft • Der Radius der Elektronenbahn ist konstant: – Die Erklärung dafür erfordert die Erweiterung der klassischen Physik zur Quantenmechanik Das Coulombgesetz q1 q2 F 2 40 r 1 q1 F F N q2 r Ungleichnamige Ladungen ziehen sich an Das Coulombgesetz für Kern und Elektron Z e F 2 40 r e F F 2 1 N Z e r Ungleichnamige Ladungen ziehen sich an Vektoren für Ort, Geschwindigkeit und Beschleunigung auf der Kreisbahn •Konstante Winkelgeschwindigkeit •Nullpunkt im Mittelpunkt des Kreises Kartesische Komponenten des Ortsvektors x r t y Einheit x(t ) r cos(t ) 1m y (t ) r sin( t ) 1m (t ) 2 T 1/s Komponenten des Vektors Kreisfrequenz, T Periode Komponente x des Ortsvektors bei Drehung mit konstanter Winkelgeschwindigkeit y t x(t ) r cost Komponente y des Ortsvektors bei Drehung mit konstanter Winkelgeschwindigkeit y t y (t ) r sin t T s Vektoren für Ort, Geschwindigkeit, Beschleunigung auf Bahn n cost x r sin t sin t x r cost x r 2 cost sin t Einheit Anmerkung 1m Ortsvektor zur Zeit t (Koordinatenursprung im Mittelpunkt) 1m/s Geschwindigkeitsvektor zur Zeit t 1 m/s2 Beschleunigungsvektor zur Zeit t Beträge für Ort, Geschwindigkeit, Beschleunigung auf Bahn n x r 1m Betrag des Ortsvektors x r 1m/s Betrag des Geschwindigkeitsvektors x r 2 1 m/s2 Betrag des Beschleunigungsvektor Beträge für Ort, Geschwindigkeit, Beschleunigung auf Bahn n cos t sin t 1 2 2 Gilt für beliebige Zeit t x r 1m Betrag des Ortsvektors x r 1m/s Betrag des Geschwindigkeitsvektors x r 2 1 m/s2 Betrag des Beschleunigungsvektor Kräfte auf Bahn n Formel Z e2 F 2 40 rn 1 F m rn n Einheit Anmerkung 1N Coulombkraft 1N Zentrifugalkraft 2 Die Bohrschen Postulate • Elektronen bewegen sich auf stationären Bahnen um den Kern • Auf diesen Bahnen strahlen die Elektronen – trotz Beschleunigung – keine Energie ab • Der Bahndrehimpuls ist „gequantelt“ • Die Ausstrahlung elektromagnetischer Strahlung erfolgt bei sprunghaftem Übergang eines Elektrons von einer Schale höherer zu einer Schale niederer Energie Bohrsches Atommodell: Kern, Ladung Ze Elektronenhülle , Z Elektronen mit Ladung -e auf Schalen um den Kern verteilt Der Drehimpuls und seine Quantisierung Ln m rn n 1 m2kg/s Drehimpuls Ln n 1 m2kg/s Quantisierung des Drehimpulses 2 Winkelgeschwindigkeit für Bahn n n m rn n 2 n n 2 m rn 1 m2kg/s Drehimpuls und Quantisierungsbedingung 1 1/s Winkelgeschwindigkeit, Funktion von Quantenzahl und Bahnradius Radius der Bahn n Einheit Z e2 F 2 40 rn 1N Coulombkraft F m rn n 1N Zentrifugalkraft 1N Zentrifugalkraft, Winkelgeschwindigkeit substituiert 1N Kräfte gleichgesetzt 1m Der Radius der Bahn n ist durch die Quantenzahl n gegeben 1 2 n F m rn 2 m rn 2 2 n 1 Z e2 m rn 2 2 40 rn m rn 40 2 n 2 rn 2 e m Z „Bohrscher Radius“ und Radien der Bahnen zur Quantenzahl n n2 rn r1 Z 40 2 r1 2 0,0529 109 e m 1m Radius der Bahn zur Quantenzahl n „Bohrscher Radius“, kleinster Bahnradius, zu 1m n=1 im Wasserstoffatom, Z=1 Radien der Bahnen zur Quantenzahl n für Atome mit Z=1 (Wasserstoff und Wasserstoff ähnliche Atome mit nur einem Elektron) Bahnradius Einheit Quantenzahl r1 1 r2 4 r1 2 r3 9 r1 r4 16 r1 … 1m 3 4 .. rn n 2 r1 n Bohrsches Atommodell r4=16r1 r3=9r1 r2=4r1 r1 Energie auf Bahn n Die gesamte Energie ist die Summe aus kinetischer und potentieller Energie E E pot n 1 m v2 2 1J Kinetische Energie 1 Z e2 40 rn 1J Potentielle Energie 1J Energie des Elektrons auf Bahn n kin n En Enkin Enpot Kinetische Energie auf Bahn n E E E kin n kin n kin n 1 m (rn n ) 2 2 1 n m rn 2 2 m rn Enkin E kin n 1 m v2 2 1J Kinetische Energie auf der Bahn n 1J Winkelgeschwindigkeit eingesetzt 2 n2 2 2 2 m rn n2 2 e4 m2 Z 2 2 2 4 2 m 16 0 n 4 1J 1J Quantisierte Winkelgeschwindigkeit eingesetzt 1 J mit 40 2 n 2 rn 2 e m Z Gesamte Energie auf Bahn n Die gesamte Energie ist die Summe aus kinetischer und potentieller Energie e mZ 2 8 0 h2 n2 4 E kin n Kinetische Energie, mit 2 1J h 2 Potentielle Energie, mit 2 4 2 1 Z e e m Z Enpot 2 40 rn 4 0 h2 n2 1J e4 m Z 2 2 8 0 h2 n2 1J En Enkin Enpot 40 2 n 2 rn 2 e m Z Energie des Elektrons auf Bahn n Energie der elektronischen Zustände • Die Energie der elektronischen Zustände ist proportional zu 1/n2 • Im Wasserstoffatom (Z=1) ist der niederste Energiezustand (n=1) e m 18 E1 2,17 10 J -13,6 eV 2 2 80 h 4 Energiewerte auf Skala der atomaren Anregung werden in Elektronenvolt angegeben: 1 eV 1,6021 10-19 J Bohrsches Atommodell r4=16r1 r3=9r1 r2=4r1 E1=-0,85 eV E3=-1,5 eV r1 E2=-3,4 eV E1=-13,6 eV Zusammenfassung Bohrs Atommodell: Elektronen kreisen als geladene, mechanische Objekte um den Kern – Gleichgewicht zwischen Coulomb- und Zentrifugalkraft • Die Quantenbedingung für den Drehimpuls führt auf diskrete, mit n = 1, 2, 3, … nummerierbare Bahnen, – kleinster Radius r1= 0,0529 nm • Zu jeder Bahn n gehört eine eigene Energie: En=e4mZ2/(8ε02h2) ·1/n2 [J], – größte Bindungsenergie E1=-13,6 [eV] Strahlung wird nur beim Übergang zwischen unterschiedlichen stationären Bahnen ausgesandt Konstanten Formelzeichen Wert SI Einheit e 1,60 10-19 1C 1,05 10-34 1 Js me 9,11 10-31 1 kg 0 10-12 , 8,85 1 F/m Anmerkung Elementarladung Plancksches Wirkungsquantum Masse des Elektrons Elektrische Feldkonstante