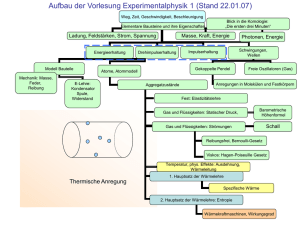
Entropieänderung bei Wärmeübertragung
Werbung

Energie und chemische Reaktionen Fachdidaktik Chemie ETHZ 27. Mai 2016 Hansruedi Dütsch [email protected] Plädoyer für die Hauptsätze Fachdidaktik Chemie ETHZ 27. Mai 2016 Hansruedi Dütsch [email protected] Thermodynamik in der Schule? + fundamental (2 Hauptsätze) + Grundlage für andere Themen + historisch interessant + interdisziplinär - schwierige Begriffe (Wärme, Temperatur, Energie, Entropie, spontan,...) - formal - abstrakt Die Ziele: • Warum wird bei vielen chemischen Reaktionen Energie (in Form von Wärme) freigesetzt? • Welche Gesetzmässigkeiten bestimmen, ob eine chemische Reaktion spontan abläuft? Energieumwandlung Kinetische Energie Wärme CH4 chemische Energie CH4 + 2O2 CO2 + 2H2O Elektrische Energie Lichtenergie 1. Hauptsatz (Energieerhaltungssatz) • Energie kann nicht erschaffen oder vernichtet, sondern nur umgewandelt werden. • Die Energie in einem abgeschlossenen System ist konstant. • Die Summe der Energieänderungen ist in einem abgeschlossenen System gleich Null. Warum wird es warm, wenn Stoffe verbrennen? 2H2 (g) + O2 (g) 2 H2O (g) O H-H + H-H + O=O EAufwand H 4H. 2O: EAufwand = 2 E(H-H) + E(O=O) = 1370 kJ EErtrag = 4 E(O-H) O H + H H EErtrag E 2H2 + O2 -482 kJ = 1852 kJ ΔE = EAufwand - EErtrag = -482 kJ = -241 kJ/mol H2O 2 H2O Wie kann man Reaktionswärmen messen? 2H2 + O2 H2O flüssig Kalorimeter 2 H2O Messung im Kalorimeter: -285 kJ/mol H2O Berechnung aus Bindungsenergien: -241 kJ/mol H2O Differenz: ? - 44 kJ/mol H2O Enthalpie Bei chemischen Reaktionen ändern nicht nur Bindungen, sondern auch zwischenmolekulare Beziehungen, etc. Enthalpie H ‚chemische Energie‘ Reaktionsenthalpie ΔH, ΔH = H (Produkte) – H(Edukte) Laborversuche: Messung der Reaktionsenthalpie • Fe + S FeS • Cu2+ + Zn Cu + Zn2+ Welche Reaktionen verlaufen exotherm? H H C H + O=O O=O H unpolare Bindungen schwache Bindungen O=C=O + H O + HH polare Bindungen starke Bindungen O H Welche Reaktionen verlaufen exotherm? H H C H + O=O O=O H unpolare Bindungen schwache Bindungen O=C=O + H O + HH polare Bindungen starke Bindungen Reaktionen verlaufen exotherm, wenn aus Molekülen mit unpolaren (schwachen) Bindungen, Moleküle mit polaren (starken) Bindungen entstehen. O H Warum sind polare Bindungen stark? A B δ+X Yδ- polare Bindung unpolare Bindung EN (Y) > EN (X) EN (A) ≅ EN (B) Zusammenhalt Zusammenhalt durch gemeinsame durch gemeinsame Elektronenwolke Elektronenwolke + Anziehung der Pole Wie gross ist die Enthalpie von Stoffen? 2H2 + O2 2 H2O (g) ΔQKalorimeter = ΔH = 2H(H2O) - 2H(H2) - H(O2) -DQ H(H2O) = = -242 kJ/mol 2 C + O2 CO2 ΔH = H(CO2) - H(O2) - H(C) =0 (def.) H(CO2) = ΔQ = - 393 kJ/mol =0 (def.) Wie gross ist die Enthalpie von Stoffen? CH4 + 2O2 2 H2O + CO2 ΔH = 2H(H2O) + H(CO2) - 2H(O2) - H(CH4) = ΔQ H(CH4) = - 75 kJ/mol einige Aufgaben • • Vergleichen Sie die Brennstoffe Kohle, Erdgas (CH4) und Erdöl (C9H20) in Bezug auf die Förderung der Klimaerwärmung durch CO2. Vergleichen Sie qualitativ (d.h. ohne Berechnungen) den ‚Kaloriengehalt‘ (Reaktion mit Sauerstoff zu Wasser und Kohlendioxid) von Zucker (Glukose) und Fett aufgrund ihrer molekularen Struktur. Fett • Glukose In einer modernen Heizung werden die Abgase im Heizkessel soweit abgekühlt, dass das bei der Verbrennung entstehende Wasser kondensiert (Kondensationskessel). Warum? Berechnen Sie für eine Erdgasheizung (Methan, CH4) welche prozentuale Einsparung dieser Prozess bringt. einige Aufgaben • Wieviele Liter Wasser kann man mit einer Kartusche eines Gaskochers (190 g Butan) theoretisch zum Kochen bringen. Treffen Sie notwendige Annahmen und suchen Sie allenfalls fehlende Angaben im Internet. • Überprüfen Sie, ob die in der nebenstehenden Werbung gemachten Angaben bezüglich Treibstoffverbrauch und CO2-Ausstoss plausibel sind. Annahme: Benzin = Octan, C8H18 Welche Vorgänge laufen spontan ab? 1. Hauptsatz: ΔEpot + ΔQ = 0 ΔEpot = -ΔQ ΔEpot < 0 Epot ΔQ > 0 exotherm spontan ΔQ Welche Vorgänge laufen spontan ab? Epot NIE ΔQ 1. Hauptsatz: ΔEpot + ΔQ = 0 ΔEpot = -ΔQ ΔEpot > 0 ΔQ < 0 endotherm Prinzip von Berthelot 1878 Essai de Mecanique chimique: “Jede chemische Reaktion, die ohne Einfluss von äusserer Energie abläuft, ist bestrebt, den Körper oder das System von Körpern zu bilden, die am meisten Wärme freisetzen.” „Reaktionen, die spontan ablaufen, sind exotherm (ΔH < 0).“ Überprüfung: • Ether verdampft spontan auf der Haut, Abkühlung • Ammoniumchlorid löst sich spontan in H2O Abkühlung • Ba(OH)2 reagiert spontan mit NH4SCN Abkühlung • etc. Prinzip von Berthelot 1878 Essai de Mecanique chimique: “Jede chemische Reaktion, die ohne Einfluss von äusserer Energie abläuft, ist bestrebt, den Körper oder das System von Körpern zu bilden, die am meisten Wärme freisetzen.” „Reaktionen, die spontan abläufen, müssen exotherm (ΔH < 0) sein.“ 2. Hauptsatz oder Q S = T ΔS DQ = >O T spontan Vorgänge laufen spontan ab, wenn die Entropie S in einem abgeschlossenen System zunimmt. fallende oder steigende Kittkugel? 1. Hauptsatz: ΔEpot + ΔQ = 0 ΔEpot = -ΔQ ΔEpot < 0 Epot ΔQ > 0 exotherm spontan 2. Hauptsatz: DQ ΔS = >0 T T ΔQ fallende oder steigende Kittkugel? Epot NIE 1. Hauptsatz: ΔEpot + ΔQ = 0 ΔEpot = -ΔQ ΔEpot > 0 ΔQ < 0 endotherm 2. Hauptsatz: ΔS = DQ < 0 T ΔQ Wärmeaustausch Isolation T -ΔQ ΔQ t T > Temp > t +ΔQ 1. Hauptsatz: ΔQT + ΔQt = 0 -ΔQT = ΔQt 2. Hauptsatz: ΔS = -DQ T spontan T + DQ t t > 0 Wärmeaustausch Isolation T ΔQT ΔQ T t -ΔQt t 1. Hauptsatz: ΔQT + ΔQt = 0 ΔQT = -ΔQt 2. Hauptsatz: ΔS = DQ T T + nicht spontan -DQ t t < 0 chemische Reaktionen Umgebung isolier A B ΔQ T=konst. p=konst. 1. Hauptsatz ΔQReakt + ΔQUmg = 0 ΔQReakt = ΔH ΔQUmg = -ΔH 2. Hauptsatz: ΔStot = ΔSUmg + ΔSReakt = - DH + (SProd – SEd) T Isolation ΔStot= - DH + ΔS T Wie gross ist die Entropie von Stoffen? Wie gross ist die Entropie von Stoffen? Ein Beispiel NH3(g) + HCl(g) ΔH [kJ] - ΔH [kJ/K] T ΔS [kJ/K] ΔStotal [kJ/K] NH4Cl(s) Voraussage Berechnung Berechnung < 0, exotherm Moleküle Ionengitter -176 exotherm, günstig + 176 endotherm ungünstig positiv, günstig +0.590 günstig -0.590 ungünstig <0, ungünstig Ordnung im Ionengitter -0.284 ungünstig +0.284 günstig keine Voraussage möglich +0.307 spontan -0.307 nicht spontan Temperaturabhängigkeit Bei welcher Temperatur T* ist die Reaktion weder spontan noch nicht-spontan? ΔStot = - DH + ΔS = 0 T* T* = DH = -176 DS -0.28 = 619 K ≈ 350 °C Das Experiment NH4Cl(s) T<350°C: NH3 (g) + HCl (g) NH4Cl(s) NH4Cl T>350°C: NH4Cl(s) NH3 (g) + HCl (g) Gibbs-Helmholtz-Gleichung ΔStot= - DH + ΔS = 0 T -T ΔStot = ΔH - TΔS × −T ΔG = ΔH - TΔS ΔG > 0 nicht spontan ΔG < 0 spontan Achtung: G enthält implizit die Temperatur als Variable! Gibbs Helmholtz Gleichung „Entropie und Enthalpie, Ordnung und Energie, sind die zwei Faktoren, die Reaktionsabläufe ermöglichen oder verhindern. Gibbs verknüpfte daher 1893 Enthalpie und Entropie zu einer neuen Funktion G, der freien Enthalpie.“ ΔG = ΔH - TΔS ΔG > 0 nicht spontan ΔG < 0 spontan „ Günstig für den Ablauf einer Reaktion ist es also, wenn nach dem Prinzip des Energieminimums ΔH<0 und nach dem Prinzip des Entropiemaximums ΔS>0.“ Schroedel, Chemie heute Du sollst nicht alles glauben! Textauszüge aus einigen Lehrbüchern Soll eine Reaktion freiwillig ablaufen, muss dabei Energie frei werden. In den meisten Fällen ist diese Energie in Form von Wärme (Reaktionswärme) vorzufinden. Der Gibbs-Helmholtzsche Satz beschreibt die alltägliche Erfahrung, dass die tatsächlich verfügbare Energie ΔG immer etwas kleiner ist als die theoretisch mögliche Menge an freigesetzter Reaktionsenergie ΔH, da immer einiges (ausgedrückt durch T · ΔS) durch Reibungsverluste (metastabile Systeme!), durch entstehende Unordnung oder durch elektrochemische Überspannungseffekte verloren geht. Reaktionen sind spontan, • wenn ΔHR sehr klein ist, wenn viel Energie abgegeben wird (Prinzip des Energieminimums) • wenn ΔSR sehr groß ist, wenn Systeme großer Unordnung entstehen, zum Beispiel bei Gasen (Prinzip des Entropiemaximums). Alles natürliche Geschehen wird regiert einerseits vom Bestreben nach Abnahme der Energie, anderseits nach Zunahme der Entropie. Temperatur und Spontaneität ΔH < 0 exotherm ΔS > 0 entropisch günstig ΔS < 0 entropisch ungünstig ΔH > 0 endotherm • immer spontan Reaktion spontan • mit steigender T wenn weniger spontan T* grösser als DH DS Reaktion spontan wenn T* kleiner als DH DS • nie spontan • mit sinkender T weniger spontan Entropie anschaulich: Würfelexperiment Aufgabe: Würfeln Sie während drei Minuten möglichst oft mit drei Würfeln. Notieren Sie in einer Tabelle, wie oft Sie jede mögliche Würfelsumme (3 bis 18) erreichen. Würfelexperiment 3 0 1 0 0 1 1 0 1 0 4 2 2 3 1 2 2 3 0 2 5 3 5 3 4 4 3 5 2 5 6 7 8 9 10 11 5 7 11 14 18 19 11 14 15 15 16 14 6 7 9 11 15 13 6 9 11 13 13 14 6 9 11 12 9 12 5 8 9 14 11 9 7 9 12 9 11 9 2 4 6 7 6 8 11 14 15 15 16 14 12 15 12 11 13 11 8 10 9 12 13 14 15 16 17 18 12 9 7 5 2 0 9 8 5 3 2 2 12 9 5 3 1 1 10 8 7 3 3 1 8 7 5 2 2 0 8 4 3 3 2 0 7 5 2 3 2 1 9 8 5 3 3 1 9 8 5 3 2 2 4 17 34 59 81 99 110 115 112 101 84 66 44 28 19 1 4 9 15 20 25 28 29 28 25 21 17 11 7 5 theoretisch: 1 3 6 10 15 21 25 27 27 25 21 15 10 6 3 8 2 1 Resultat Einzelne Würfelsummen werden viel häufiger gewürfelt als andere! Würfelsumme 3: sehr selten 111 1 Realisierungsmöglichkeit Würfelsumme 10: sehr häufig 145 415 451 541 154 514 244 424 442 136 163 316 361 613 631 343 334 433 226 262 622 253 235 325 352 532 523 27 Realisierungsmöglichkeiten Würfelexperiment 3 0 1 0 0 1 1 0 1 0 4 2 2 3 1 2 2 3 0 2 5 3 5 3 4 4 3 5 2 5 6 7 8 9 10 11 5 7 11 14 18 19 11 14 15 15 16 14 6 7 9 11 15 13 6 9 11 13 13 14 6 9 11 12 9 12 5 8 9 14 11 9 7 9 12 9 11 9 2 4 6 7 6 8 11 14 15 15 16 14 12 15 12 11 13 11 8 10 9 12 13 14 15 16 17 18 12 9 7 5 2 0 9 8 5 3 2 2 12 9 5 3 1 1 10 8 7 3 3 1 8 7 5 2 2 0 8 4 3 3 2 0 7 5 2 3 2 1 9 8 5 3 3 1 9 8 5 3 2 2 4 17 34 59 81 99 110 115 112 101 84 66 44 28 19 1 4 9 15 20 25 28 29 28 25 21 17 11 7 5 theoretisch: 1 3 6 10 15 21 25 27 27 25 21 15 10 6 3 8 2 1 Zustände, die sich auf viele verschiedene Arten realisieren lassen, sind wahrscheinlicher und treten häufiger auf als Zustände, die sich nur auf wenige Arten realisieren lassen Lösen eines Salzes NaCl (S) Na+(aq) + Cl-(aq) ΔH = +4 kJ/mol ΔS = +139 J/K mol starke Zunahme der Entropie Lösen eines Salzes • • • • • - + + - + - + - fest ‚eine‘ Realisierungsmöglichkeit unwahrscheinlich geordnet tiefe Entropie + + + + - + lösen + + - ++ ++- + + - - + + -+ + -+ -+ - - - + - ++ • • • • • gelöst viele Realisierungsmöglichkeiten wahrscheinlich ungeordnet hohe Entropie Die Entropie nimmt zu, wenn aus unwahrscheinlichen / geordneten Zuständen wahrscheinlichere / ungeordnetere Zustände entstehen. Kristalle 4 von 126 Anordnungen sind ‚Kristalle‘ Die Ordnung nimmt ab Die Entropie nimmt zu flüssig gasförmig fest flüssig fest gasförmig gelöst wenige Teilchen viele Teilchen wenige ‚Teilchen‘ ++ +- + ++ ++ +- + +-- viele Teilchen + Die Ordnung nimmt zu Die Entropie nimmt ab Was bedeutet „spontan“? G G G C+D A+B C+D ΔG<0 spontan AE < AE K>1 Gl.gew. rechts A+B C+D ΔG=0 ? AE = AE K=1 Gl.gew. ausgeglichen A+B ΔG>0 Nicht spontan AE < AE K<1 Gl.gew. rechts Gleichgewicht: kinetische Herleitung AE AE RG = RG k [A][B] = k [C][D] K= k [C][D] = [A][B] k Warum gibt es ein Gleichgewicht? A B Warum gibt es ein Gleichgewicht? ‚Energie‘ A B H △H <0; exotherm Reaktionsumsatz 0 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 Warum gibt es ein Gleichgewicht? ‚Energie‘ A B H -T x S Reaktionsumsatz 0 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 Warum gibt es ein Gleichgewicht? ‚Energie‘ △G <0; spontan G H -T x S Reaktionsumsatz 0 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 Mischungsentropie P = konstant T = konstant Mischungsentropie P = konstant T = konstant Mischung)von)1)Mol)A)und)1)Mol)B V1 =)V2 =)24)L DSMisch = 11.5 J/K DGMisch = -3.4 kJ Mischungsentropie kJ14 J/K 12 10 DSMisch 8 6 4 2 0 0 0.1 0.2 0.3 0.4 0.5 0.6 -2 -4 -6 DGMisch 0.7 0.8 0.9 1 Warum gibt es ein Gleichgewicht? ‚Energie‘ G H -T x S 0 0 0.1 0.2 0.3 0.4 0.5 0.6 Reaktionsumsatz 0.7 ∆GMisch = -T x SMisch 0.8 0.9 1 Warum gibt es ein Gleichgewicht? ‚Energie‘ H G -T x S Reaktionsumsatz 0 0 0.1 0.2 0.3 0.4 0.5 0.6 -T x SMisch 0.7 0.8 0.9 1 Warum gibt es ein Gleichgewicht? G < 0 spontan G < 0 spontan Erzeugung elektrischer Energie Verbrennung Chem. Energie (Öl, Gas, Kohle) Wärme Turbine Generator Kin.Energie el.Energie Erzeugung elektrischer Energie 40% Chem. Energie Kin.Energie Wärme (Öl, Gas, Kohle) 60% Abwärme el.Energie Wärmekraftmaschinen Wärmequelle T -ΔQT 1. Hauptsatz: -ΔQT + A = 0 Maschine Arbeit A A = ΔQT 2. Hauptsatz: ΔS = -DQ T T < 0 Diese Maschine verstösst gegen den 2. Hauptsatz Wärmekraftmaschinen Wärmequelle T -ΔQT 1. Hauptsatz: Maschine -ΔQT +ΔQt+ A = 0 A = ΔQT – ΔQt 2. Hauptsatz: -DQ T DQ t DS = + ³0 T t ΔQt Wärmeabfluss t Arbeit A Erzeugung elektrischer Energie 1. Hauptsatz: -ΔQT +ΔQt+ A = 0 A = ΔQT – ΔQt = ΔQT - ΔQT t T 2. Hauptsatz: -DQ T DQ t DS = + ³0 T t ΔQt = ΔQT Wirkungsgrad η η= A 1 t t = (ΔQT - ΔQT ) = 1 DQ T DQ T T T t T Beispiel T = 350 °C = 620 K t = 100 °C = 373 K η = 1- 373 = 0.38 = 38% 620 Abwärme ΔQt = 62 % Arbeit A = 38 % Erzeugung elektrischer Energie Elektrochemische Stromerzeugung: Brennstoffzelle 40% Chem. Energie Kin.Energie Wärme (Öl, Gas, Kohle) 60% Abwärme el.Energie