Komplexe - cci.ethz.ch
Werbung

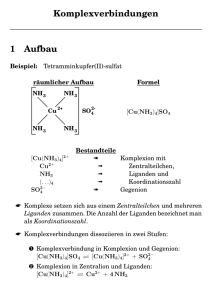
Übergangsmetalle und Komplexe Zwei Arten der Gruppenzählung im Periodensystem: Das ältere System zählt die Nebengruppen nach der Anzahl der Valenzelektronen, zu denen s- und d-Elektronen gehören: • Die Elemente der 3. NG (Sc, Y, La, Ac) haben zwei s- und ein dElektron (= 3 Valenzelektronen). • Die Elemente der 7. NG (Mn, Tc, Re) haben zwei s- und fünf dElektronen (= 7 Valenzelektronen). • In der 8. NG stehen in jeder Periode gleich drei Elemente nebeneinander. Es sind die ursprünglichen „Übergangselemente“ von Mendeleev. Hierbei unterscheidet sich die erste Reihe Fe, Co, Ni („Eisenmetalle“) recht erheblich von den übrigen sechs „Platinmetallen“. • Die Elemente Cu, Ag, Au bilden die 1. NG. Das hier das d-Niveau komplett gefüllt ist, zählt nur ein s-Elektron als Valenzelektron. • Die Elemente Zn, Cd, Hg bilden die 2. NG. Auch hier zählen nur die beiden s-Elektronen als Valenzelektronen. • Das neuere System zählt alle Gruppen des Periodensystems von links nach rechts. • Es beginnt mit den Alkalimetallen (1.Gruppe) und endet mit den Edelgasen (18.Gruppe). • Die Nebengruppenelemente bilden die 3.-12.Gruppe. • Trotzdem macht das alte System wenigstens teilweise Sinn, den von der 2.-7.NG lässt sich aus der Gruppennummer die höchstmögliche Oxidationszahl der Elemente unter normalen Bedingungen ablesen. • Alle Übergangselemente sind Metalle. • Sie bilden häufig stabile Komplexe und können meist in verschiedenen Oxidationsstufen auftreten. • Einige von ihnen bilden farbige Ionen und zeigen Paramagnetismus. • Die meisten Elemente zeigen gute elektrische Leitfähigkeit. • Sie sind ziemlich hart, oft spröde und haben hohe Schmelz- und Siedepunkte. • Ausnahmen sind Zn, Cd und Hg. Diese sind weich und haben niedrige Schmelzpunkte. • Die mittleren Glieder einer Übergangsreihe kommen in einer grösseren Zahl verschiedener Oxidationsstufen vor als die Anfangsund Endglieder. Die höchsten Oxidationsstufen erreichen die Elemente nur gegenüber den stark elektronegativen Elementen Cl, O und F. Die Oxidationszahl +8 wird nur von Os und Ru (OsO4 und RuO4) erreicht. • Ab der 9. Gruppe (mittlere Reihe der 8. NG) zeichnet sich die Tendenz ab, nicht mehr alle d-Elektronen zur Bindungsbildung heranzuziehen. • Die Elemente am Ende der d-Reihe (Zn, Cd, Hg) mit der Konfiguration (n-1)d10 ns2 lassen sich nur noch bis zur Stufe +2 oxidieren. • Das ist ebenso wie die Bevorzugung der Oxidationsstufe +1 bei Silber Ag und Gold Au ein Zeichen für die besondere Stabilität der vollbesetzten d-Schale. • Der Wechsel der Oxidationstufen kann häufig recht leicht erfolgen. Das ist die Ursache für das Auftreten von Fehlstellen in Festkörpern, die nicht dem Gesetz der konstanten Proportionen gehorchen deshalb nichtstöchiometrische (nichtdaltonide) bzw. berthollide Verbindungen genannt werden. In solchen Verbindungen liegen oft Ionen des gleichen Elements in unterschiedlichen Oxidationsstufen nebeneinander vor und ihre Zusammensetzung hängt von den Herstellungsbedingungen ab (z.B Fe0.95O, Na0.3MoO3). Oxidationszahlen der Übergangsmetalle Periode 4. 5. 6. Sc Ti V Cr 3 (2) 3 4 (2) 3 4 5 (2) 3 (4) (5) 6 Elemente Mn Fe 2 (3) 4 (5) 6 7 Tc Y Zr Nb Mo 3 (2) (3) 4 (2) (3) (4) 5 (2) (3) (4) (5) 6 (4) Re La Hf Ta W 3 (3) 4 (3) (4) 5 (2) (3) (4) (5) 6 6 7 (3) (4) (5) 6 7 Co Ni 2 3 (4) 2 (3) Ru Rh Pd 2 3 4 (5) 6 (7) (8) Os (2) 3 4 2 2 3 (4) Cu 1 2 Zn Ag 1 2 (3) Cd Au 1 Hg 1 2 2 (6) (2) (3) (4) (5) 6 7 8 2 4 (6) Ir Pt 2 3 4 (6) 3 4 Potenzialdiagramm des Mangans und seiner Verbindungen in saurer Lösung +0,74V +1,51V +1,63V MnO4 +0,56V MnO42 +2,26V MnO2 +1,24V Mn2 +0,02V +1,69V -1,18V Mn Bei den sogenannten inneren Übergangselementen werden die 4f- und 5f-Zustände der drittäussersten Schale besetzt. Es sind die Lanthaniden oder „Seltenen Erdmetalle“ (Ce-Lu, Ordnungszahl 58-71) und die Actiniden (Th-Lr, Ordnungszahl 90-103). Lanthaniden-Kontraktion: Zwischen den Elementen Lanthan (OZ 57) und Hafnium (OZ 72) werden im PSE die 14 Lanthanidenelemente eingeschoben, bei denen die sieben 4f-Orbitale – also innenliegende Orbitale – besetzt werden. Weil sich gleichzeitig pro Elektron die Kernladungszahl um eins erhöht, ergibt sich eine stetige Abnahme der Atom bzw. Ionengrösse. Die Auswirkungen der Lanthaniden-Kontraktion zeigen die folgenden Beispiele: • Lu3+ hat mit 85 pm einen kleineren Atomradius als Y3+ (92 pm). • Hf, Ta, W und Re besitzen fast die gleichen Radien wie ihre Homologen Zr, Nb, Mo und Tc. Hieraus ergibt sich eine grosse Ähnlichkeit in den Eigenschaften der Elemente. Hochofenprozess zur Eisengewinnung Kalkstein (CaCO3), Koks (C), Erz (Fe2O3/ SiO2) 3 Fe2O3 + CO 2 Fe3O4 + CO2 CaCO3 CaO + CO2 Fe3O4 + CO 3 FeO + CO2 C + CO2 2 CO 500°C 700°C Gase FeO + CO Fe + CO2 CaO + SiO2 CaSiO3 2 C + O2 2 CO "Gichtgas" 1000°C Feststoffe 1300°C 1800°C Luft Schlacke CaSiO3 Fe Eisen 2 Fe2O3 + SiO2 + 3 C + CaCO3 4 Fe + CaSiO3 + 4 CO2 • Komplexe heissen Verbindungen, die ein Zentralteilchen (Atom, Ion) enthalten, das von Liganden (Ionen, neutrale Moleküle oder Molekülionen) umgeben ist. Durch die Komplexbildung verlieren die Komplexbausteine ihre spezifischen Eigenschaften. Komplexe besitzen häufig charakteristische Farben. • Die Zahl der Liganden, die das Zentralteilchen umgeben, ist die Koordinationszahl (KZ). Die Position, die ein Ligand in einem Komplex einnehmen kann, heisst Koordinationsstelle. Konfiguration nennt man die räumliche Anordnung in einem Komplex. Kationischer Komplex: [Ag(NH3)2]Cl Di ammin Anzahl der Liganden Ligand (I) _ Oxidationszahl _ silber Zentralteilchen _ Kationischer Komplex chlorid Anion Anion Anionischer Komplex: K4[Fe(CN)6] Kalium _ hexa cyano ferr at (II) Kation _ Anzahl der Liganden Ligand Zentralteilchen at Oxidationszahl Kation _ Anionischer Komplex Die Zahl der freien Kationen bzw. Anionen der Komplexe wird nicht bezeichnet. Sie ergibt sich aus der Ladung der Komplexe. • Besetzt ein Ligand eine Koordinationsstelle, so heisst er einzähnig. Besetzt er mehrere Koordinationstellen am gleichen Zentralatom, so spricht man von einem mehrzähnigen Liganden oder Chelatliganden. Die zugehörigen Komplexe nennt man Chelatkomplexe. • Komplexe mit Chelatliganden sind im Allgemeinen stabiler als solche mit einzähnigen Liganden. Besonders stabil sind Komplexe, in denen fünfgliedrige Ringsysteme mit Chelatliganden gebildet werden. Diese Erscheinung ist als Chelateffekt bekannt. Der Effekt wird mit einer Entropiezunahme des Systems (Komplex und Umgebung) bei der Substitution von einzähnigen durch mehrzähnige Liganden erklärt. Einzähnige Liganden O C O C N N N NR3 NH3 O S C N SR2 O O ROH OH2 R OH C F Cl Br I O Zweizähnige Liganden OH O O C H2N C O H2C O NH2 CH2 N C CH3 N C CH3 N N OH Oxalat H3C Ethylendiamin (en) O O C C C H CH3 Acetylacetonat (acac-) Diacetyldioxim 2,2´-Dipyridyl (dipy) Iodokomplexe des Quecksilbers https://www.cci.ethz.ch/mainpic.html?picnum=-1&control=0&language=0&ismovie=1&expnum=170 Dreizähniger Ligand Vierzähniger Ligand CH2COO NH2 H2N CH2 CH2COO N CH2 CH2 CH2 CH2COO N H Diethylentriamin (dien) Anion der Nitrilotriessigsäure Fünfzähniger Ligand Sechszähniger Ligand COO OOC CH2 CH2 CH2 CH2 NCH2CH2N NCH2CH2N H COO OOC CH2 COO Anion der Ethylendiamintriessigsäure CH2 CH2 OOC Anion der Ethylendiamintetraessigsäure (EDTA) COO Wasserhärte und Enthärtung https://www.cci.ethz.ch/mainpic.html?picnum=-1&control=0&language=0&ismovie=1&expnum=10 Calcium-EDTA-Komplex O O O O O O O O N O N O O O O O O O O C222 18-Krone-6 O Kronenetherkomplex des KF (Dieses Salz ist in CHCl3 löslich.) N N O C221 O K O O O F Kronenetherkomplex des Kaliums https://www.cci.ethz.ch/mainpic.html?picnum=-1&control=0&language=0&ismovie=1&expnum=168 H2 N H2 N H2C N N CH2 Cu Cu H2C CH2 N H2 N H2 N [Cu(en)2]+ N [Cu(dipy)2]+ = C5H5Fe Cr = C6H6 Ferrocen Dibenzolchrom KZ Räumliche Anordnung der Liganden Beispiele [Ag(NH3)2]+, [Ag(CN)2]-, [AuCl2]-, [CuCl2]- 2 linear [BeF4]2-, [ZnCl4]2-, [Cd(CN)4]2-, [CoCl4]24 [FeCl4]-, [Cu(CN)4]3-, [NiCl4]2- tetraedrisch [PtCl4]2-, [PdCl4]2-, [Ni(CN)4]2-, 4 [Cu(NH3)4]2+, [AuF4]quadratisch-planar [Ti(H2O)6]3+, [V(H2O)6]3+, [Cr(H2O)6]3+, [Cr(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3-, 6 [Co(NH3)6]3+, [Co(H2O)6]2+, [Ni(NH3)6]2+, [PtCl6]2oktaedrisch Stereoisomerie an Komplexen Cis-trans-Isomerie Enantiomere oktaedrische Komplexe 18-Elektronen-Regel Mit den von den Liganden zur Verfügung gestellten Elektronenpaaren wird in der Valenzschale des Zentralatoms eine Zahl von 18 Elektronen erreicht. Die geometrische Anordnung in solchen Komplexen entspricht den Voraussagen des VSEPR-Modells Beispiele: Die Regel gilt vor allem für Metalle in niedrigen Oxidationszuständen. 18-Elektronen-Regel am Beispiel von Ni(CO)4 a) Grundzustand des Nickelatoms: Ni(0) 3d 4s 4p b) Bei der Komplexbildung kann man einen angeregten Zustand dadurch konstruieren, dass die beiden Elektronen des 4s-AO mit jeweils antiparallelem Spin in die beiden einfach besetzten d-AO eingebaut werden. Angeregter Zustand Ni(0)*: 3d 4s 4p c) Es können nun das 4s-AO und die drei 4p-AO zu vier gleichwertigen sp3-Hybridorbitalen gemischt werden, um den Tetraederwinkel von 109°28´ zu erreichen. 3d 3d 4s 3 vier sp -Hybridorbitale 4p d) In die leeren sp3-Hybridorbitale können die vier Elektronenpaare der vier CO-Liganden eingebaut werden. [Ni(CO)4]: 3d 4 sp3 Als Ergebnis erhält man ein diamagnetisches Komplexmolekül, dessen Zentralteilchen tetraederförmig von vier CO-Liganden umgeben ist. Nickel-Komplexe https://www.cci.ethz.ch/mainpic.html?picnum=-1&control=0&language=0&ismovie=1&expnum=173 NH3 H3N Ni H3N NH2 2+ NH3 H2N NH3 H2O NH3 2+ OH2 Ni OH2 OH2 dunkelblau hellblau en K = 106 β = 109 6 NH3 K = 109 en NH2 H2N Ni HN OH2 H2O H2O OH2 NH 2+ OH2 Ni 2+ OH2 dunkelblau OH2 en K = 105 OH2 3 en β = 1018 grün NH2 H2N Ni HN β = 10 17 NH 2 dmg 2+ H2 N N H2 violett - H3C C O C N N O N O Ni H O N C H3C 4 CN β = 1018 CH3 H CN Ni CN NC C rot NC CH3 gelb 2- d-Orbitale y z x dxy z y x dxz y z x x d(x2-y2) dyz dz2 Anordnung der Liganden relativ zu einem Satz von kartesischen Koordinatenachsen oktaedrischer Komplex planar-quadratischer Komplex Verteilung von vier tetraedrisch angeordneten Liganden relativ zu einem kartesischen Koordinatensystem Energie 2 2 d(x -y ), dz 2 eg d(xy), d(xz), d(yz) t2g 3d 3d 6 Dq ∆o = 10 Dq 4 Dq ∆t = 10 Dq 6 Dq 4 Dq eg t2g d(xy), d(xz), d(yz) oktaedrisches Feld 2 2 2 d(x -y ), dz tetraedrisches Feld CO, CN > NO2- > en > NH3 > EDTA > SCN > H2O > F > OH > Cl > Br > I Verteilung von 8 d-Elektronen (Ni2+) im oktaedrischen , tetraedrischen und planar-quadratischen Ligandenfeld Tetraedrisch "Freies Ion" Oktaedrisch Tetragonale Quadratisch Verzerrung planar d(x2-y2) d(xy) d(z2) d(xz), d(yz) vier d-Elektronen sieben d-Elektronen E eg t2g low-spinKonfiguration high-spinKonfiguration low-spinKonfiguration high-spinKonfiguration Konfiguration Ion Farbe Konfiguration Ion Farbe d0 Ti4+ farblos d5 Mn2+ blassrosa d1 Ti3+ violett Fe3+ blassgelb d VO2+ V3+ blau grün d6 d7 Fe2+ Co2+ blassgrün rosa d3 V2+ violett d8 Ni2+ grün Cr3+ Cr2+ violett blau d9 d10 Cu2+ Cu+ blau farblos Mn3+ violett Zn2+ farblos 2 d 4 Trennung von Cobalt und Nickel https://www.cci.ethz.ch/mainpic.html?picnum=-1&control=0&language=0&ismovie=1&expnum=174