Kapitel 8-9 Teil 2
Werbung

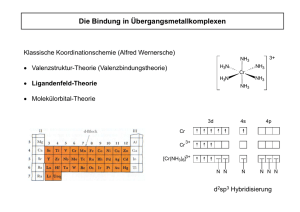
Elektronenspektrum von [Ti(H2O)6]3+ 3 2 1 15 eg 20 25 30 1000 cm-1 hv t2g 9.2. Ligandenfeldtheorie Deutung der Elektronenspektren Absorption bestimmter Frequenzen des eingestrahlten Lichts durch: Elektronenübergang zwischen den im Ligandenfeld energetisch abgesenkten und angehobenen dOrbitalen (sogenannte d-d-Übergänge) Ligandenfeldaufspaltung liegt in einem solchen Bereich, dass die meisten Komplexe im Sichtbaren absorbieren 9.2. Ligandenfeldtheorie 1 10 Dq-Werte in cm-1 · 103 Ti2+ V2+ Cr2+ Mn2+ Fe2+ Co2+ Ni2+ Cl¯ 17 0 Br¯ 18 0 I¯ 26 0 Cu2+ H2O 22 11 16 0 15 14 10 15 dn d2 d3 d4 d5 d6 d7 d8 d9 abhängig von Liganden und vom Metall 9.2. Ligandenfeldtheorie Einflüsse auf die d-Orbitalaufspaltung bei gleichen Liganden steigen die Dq-Werte mit der Oxidationsstufe des Metalls Dq-Werte steigen von einer Übergangsreihe zur nächsten um 30 bis 40 %: [Ti(H2O)6]3+ 10 Dq = 20000 cm-1 [Zr(H2O)6]3+ 10 Dq = 26000 – 28000 cm-1 Art der Liganden 9.2. Ligandenfeldtheorie 2 Konfiguration und LFSE der Ionen d1 bis d5 im oktaedrischen Feld Elektronenzahl Konfiguration LSFE (in Dq) 1 (t2g)1(eg)0 -4 2 (t2g)2(eg)0 -8 3 (t2g)3(eg)0 -12 4 (t2g)3(eg)1 high (t2g)4(eg)0 low (t2g)3(eg)2 high (t2g)5(eg)0 low -6 -16 0 -20 5 9.2. Ligandenfeldtheorie Spektrochemische Reihe high-spin-Komplexe schwaches Feld I < Br < S2- < SCN < Cl < NO3 < F < OH < C2O42- O2- < H2O < NCS < NH3 < en < NO2 < CN < PR3 < CO low-spin-Komplexe starkes Feld 9.2. Ligandenfeldtheorie 3 Grenzen der Valenzbindungstheorie [Co(NH3)6]3+ Spin-Paarung d2sp3 3d-Orbitale 4s 4p 4s 4p [CoF6]3- 3d-Orbitale 4d-Orbitale sp3d2 9.2. Ligandenfeldtheorie Verlauf der Ligandenfeldstabilisierungsenergie (LFSE) dn LFSE in Dq 0 0 2 4 6 8 10 -5 -10 high-spin -15 -20 low-spin -25 -30 9.2. Ligandenfeldtheorie 4 Sauerstoff-Transport und -Speicherung Sättigung Myoglobin (Mb) Bindungen zu den vier O2 Molekülen in Hb sind nicht unabhängig 100 % Hämoglobin (Hb) 50 % kooperativer Effekt 0% Sauerstoff-Partialdruck 9.2. Ligandenfeldtheorie Erklärung mit Ligandenfeldtheorie N N Fe2+ N N HOOC Fe2+ = Eisen-Porphyrin = Hämgruppe COOH Histidin Protein + O2 Fe2+ Protein Fe2+ Spinpaarung r(Fe): 92 75 pm Fe2+: d6, high-spin Histidin O2 Fe2+: d6, low-spin 9.2. Ligandenfeldtheorie 5 Rotation der Untereinheiten niedrige Affinität zu O2 hohe Affinität zu O2 9.2. Ligandenfeldtheorie Kinetische Stabilität Warum wird [Co(NH3)5Cl]Cl2 ausgehend von [Co(H2O)6]Cl2 und anschließender Oxidation und nicht direkt ausgehend von [Co(H2O)6]Cl3 hergestellt? + NH4Cl/NH3 [Co(H2O)6]Cl3 • diamagn. • low-spin d6 • sehr stabil • kinetisch inert • keine Substitution [Co(H2O)6]Cl2 [Co(NH3)5Cl]Cl + NH4Cl/NH3 + H2O2 + H2O2 + Cl- [Co(NH3)5Cl]Cl2 9.2. Ligandenfeldtheorie 6 Elektronenspektrum von [Ti(H2O)6]3+ 3 2 1 15 eg 20 25 30 1000 cm-1 hv t2g 9.2. Ligandenfeldtheorie Der Jahn-Teller-Effekt Beispiel: [Ti(H2O)6]3+ z Energie z y y x x dz2 dx2-y2 dxy dxz dyz 9.2. Ligandenfeldtheorie 7 Stauchung und Streckung im Oktaeder x2-y2 z2 δ‘‘ 2 2 2 x2-y2 x -y z 2 x -y z2 2 xy δ‘ xy xz yz z2 xy xz yz xz yz xz yz xy Stauchung reguläres Oktaeder Streckung quadrat.planar 9.2. Ligandenfeldtheorie d-Orbitale im tetraederischen Feld dz2 dxy 9.2. Ligandenfeldtheorie 8 Oktaeder oder Tetraeder? Beispiel Cobalt(II) Feststellung: häufigere Bildung von tetraedrischen Co(II)- Komplexen als mit andern Metallionen Im Einklang mit den Werten der LFSE: [Co(II)L6]-Komplexe: z. B. [Co(II)L4]-Komplexe: [Co(H2O)6]2+ z. B. [CoCl4]2 d7 LFSE (∆ ∆0): -8 Dq d7 LFSE (∆ ∆T): -12Dq • keine quantitativen Vergleiche möglich • LFSE nur ein Faktor von vielen, der über die Stabilität eines Komplexes entscheidet 9.2. Ligandenfeldtheorie Elektronenkonfiguration d8: Gruppe 9 Cobalt(I): Rhodium(I) Iridium(I) seltene Oxidationstufe, meist 5-fach koordiniert häufigste Oxidationsstufe, meist 4-fach koordiniert quadratisch-planar Cl Beispiele: RhCl3 3H2O + exc. PPh3 EtOH Rh Ph3P PPh3 PPh3 Wilkinson-Katalysator (1965) Cl IrCl3 + exc. PPh3 2-MeOCH2CH2OH Ir Ph3P PPh3 CO Vaska-Komplex (1961) 9.2. Ligandenfeldtheorie 9 Elektronenkonfiguration d8: Nickel(II) Nickel(II) wichtigste Oxidationsstufe, kaum redoxaktiv 6-fach koordiniert, oktaedrisch z. B. Ni(H2O)6]2+ oder 4-fach koordiniert, meist quadratisch-planar selten tetraedrisch [NiCl4]2CN 2- NC Ni CN NC O H O N N Ni N N O H O 9.2. Ligandenfeldtheorie [NiL4] Komplexe: Gleichgewicht zwischen tetraedrisch und quadratisch-planar PPh2Et EtPh2P EtPh2P Br Ni Ni Br braun quadratisch-planar EtPh2P Br Br grün tetraedrisch µ = 3.2 BM 2 ungepaarte Elektronen µ-Werte in Lösung zwischen 0 und 3.2 BM 9.2. Ligandenfeldtheorie 10 d8 im quadratisch-planaren Feld x2-y2 x2-y2 z2 x2-y2 • keine Stabilisierung durch tetragonale Verzerrung (JahnTeller) Stabilisierung möglich durch Liganden, die ein starkes Feld aufbauen Stabilisierung groß genug um Spinpaarungsenergie auszugleichen z. B. mit CN¯ quadr.-planare Komplexe stabiler als tetraedrische und oktaedrische. • z2 xy xy xy xz yz xz yz z2 xz yz reguläres tetragonal quadrat.Oktaeder verzerrt planar 9.2. Ligandenfeldtheorie Elektronenkonfiguration d8: Pd(II), Pt(II) größerer Effekt der Komplexbildung auf die Aufspaltung der d-Orbitale bei Elementen der 2. und 3. Übergangsreihe Pd(II)- und Pt(II)-Komplexe sind fast ausschließlich: • 4-fach koordiniert • quadratisch-planar und • diamagnetisch Beispiele [PtCl4]2- [PtCl3(H2O)]- trans-[PtCl2(DMSO)2] DMSO = (CH3)2SO 9.2. Ligandenfeldtheorie 11 Molekülorbital-Theorie Grundgedanke es wird für jedes Metallvalenzorbital eine Überprüfung durchgeführt, ob und wenn ja mit welcher Kombination der Ligandenorbitale eine Wechselwirkung stattfinden kann 9.3. MO-Theorie Wechselwirkung - Kombinationen von Ligandenorbitalen mit Metallvalenzorbitalen Metallorbital Symbol aus Gruppentheorie dx2-y2, dz2 eg p-Orbitale t1u s-Orbital a1g 9.3. MO-Theorie 12 Molekülorbitaldiagramm eines oktaedrischen Komplexes mit reinen σ-Liganden t1u* p-Orbitale a1g* t1u s-Orbital a1g eg* ∆o eg d-Orbitale t2g t2g eg 18-Elektronen a1g t1u eg M a1g t1u 6 L oktaedrisch 9.3. MO-Theorie 13