Periodensystem der Elemente
Werbung
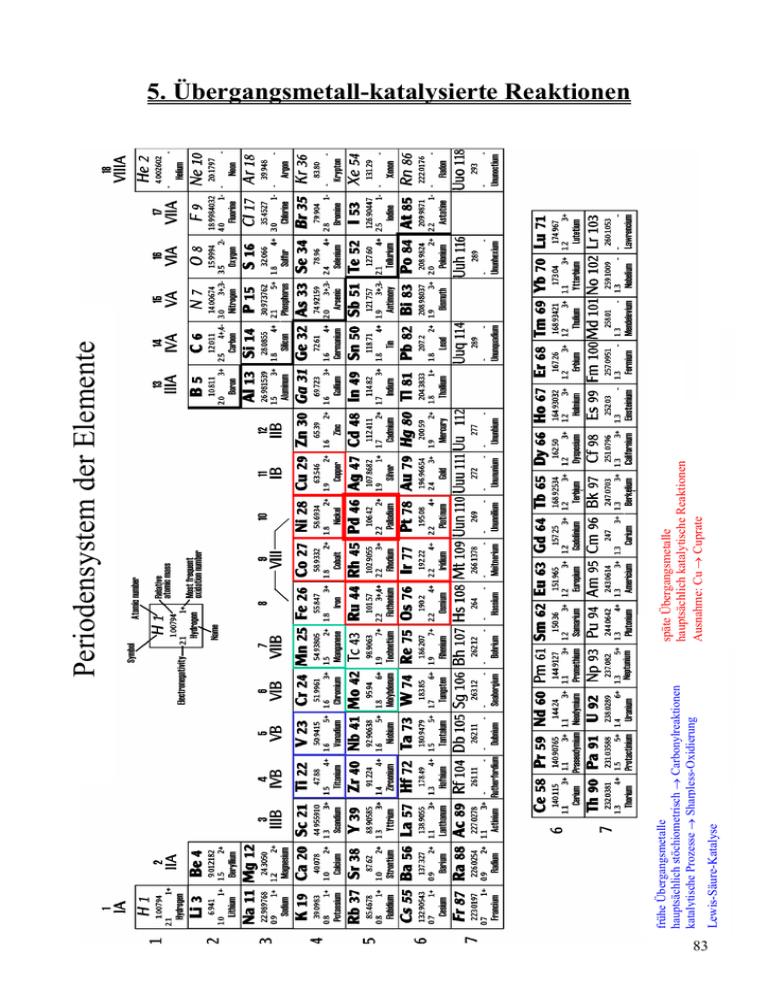
83 Lewis-Säure-Katalyse frühe Übergangsmetalle hauptsächlich stöchiometrisch → Carbonylreaktionen katalytische Prozesse → Sharpless-Oxidierung späte Übergangsmetalle hauptsächlich katalytische Reaktionen Ausnahme: Cu → Cuprate Periodensystem der Elemente 5. Übergangsmetall-katalysierte Reaktionen 83 5.1 Allgemeines Reaktionen spielen sich in der Koordinationssphäre der Metalle ab → Metallzentren und elektronische Umgebung bestimmen Verlauf. Für Verständnis wichtig: • Oxidationsstufe des Metalls • Anzahl der d-Elektronen • Koordinationszahl des Metalls • freie Koordinationsstellen am Metall 5.1.1 Oxidationsstufen Ladung die am Metall verbleibt, wenn alle Liganden mit abgeschlossener Elektronenschale, d.h. mit e−-Paar entfernt würden. Beispiele: Halogenide M−Cl ⇒ M+ + Cl− Hydride M−H ⇒ M+ + H− Carbonylkomplexe M−C≡O ⇒ M + CO Phosphinkomplexe Olefinkomplexe M− M−PPh3 ⇒ M + PPh3 − + ⇒ M + M ⇒ Μ + Allylkomplexe 5.1.2 Koordinative Sättigung, 18 e−-Regel Bestimmung der e−-Zahl anhand Periodensystem und Oxidationszahl 18 e−-Regel: Bei einkernigen diamagnetischen Komplexen ist die Summe der d- e− und der e− die die Liganden beisteuern maximal 18. Verbindungen mit 18 e− (maximale Ligandenzahl) sind koordinativ gesättigt! Verbindungen mit < 18 e− sind koordinativ ungesättigt → wichtig für katalytische Prozesse! Metall benötigt freie Koordinationsstellen um Substrat zu binden!!!! 84 5.1.3 Einteilung der Liganden formal 3 Familien: Anionen, Neutralliganden, (Kationen) → Oxidationsstufen-Formalismus Anionische Liganden: R− > Ar− > H− > R-CO− > X− (X− = Hal−, CN−) Donorfähigkeit: Liganden mit mehreren funktionellen Gruppen → Mehrelektronenliganden Beispiel: Allylgruppe C3H5− M 1 3 M M 3 η η η (2e−) (4e−) (4e−) 1 2 2 Koordinationsstellen (KS) Beispiel: Cyclopentadienyl-Ligand C5H5− M M 1 3 M 5 η η η (2e−) (4e−) (6e−) 1 2 3 Koordinationsstellen (KS) Neutral-Liganden: Beispiel: Phosphane (PR3) Amine (NR3) gute σ-Donatoren → erhöhen Elektronendichte am Metall Beispiel: CO, Olefine, Isonitrile: gute π-Akzeptoren → erniedrigen Elekt.-dichte am Metall Kationische Liganden: sehr selten, Bsp: NO+ → Nitrosylkomplexe 85 Abzählen der Elektronen: Beispiele: + Ph3P Cl Rh Fe OC OC FeII: Cp−: CO: : PPh3 PdII : 8 e− (d8) C3H3−: 4 e− Cl− : 2 e− Cl : 2 e− RhI: 8 e− (d8) Cl− : 2 e− Ph3P: 2 e− x 3 − − 18 e (gesättigt) Pd Cl Cl Ph3P 6 e− (d6) 6 e− 2 e− x 2 2 e− Pd 16 e− (ungesättigt) 16 e (ungesättigt) 18 e− -Komplexe: koordinativ gesättigt → unreaktiv 16 e− -Komplexe: koordinativ ungesättigt → reaktiv 5.1.4 Bindungsmodelle Übergangsmetalle: (teilweise) besetzte d-Orbitale, leere s,p-Orbitale Liganden: besetzte s, p, sp-Hybridorbitale, (teilweise) unbesetzte π*-Orbitale Orbitale gleicher Symmetrie können überlappen → Bindung σ-Donor-Bindung 2 Arten von Bindung π-Akzeptor-Bindung σ-Donorbindungen: - bei Liganden mit freien e−-Paaren (R3P, R3N, H−, R−) spn-HybridLigand + „dsp“-HybridMetall → erhöht e−-Dichte am Metall - π-Systeme (Alkene, Alkine, Arene, CO, Isonitrile) sowohl σ-Donor als auch π-Akzeptor σ-Bindung M leeres "dsp" besetztes π-Orbital 86 π-Akzeptorbindungen: 2 Arten a) seitengebundene (side-on) Akzeptoren Beispiel: Alkene, Alkin π-Rückbindung σ-Donor-π-Akzeptor-Komplex π M σ M besetztes δ-Orbital π leeres π*-Prbital b) endgebunden (edge-on) Akzeptoren Beispiel: CO, RNC π-Rückbindung σ-Donor-π-Akzeptor-Komplex π M M besetztes δ-Orbital σ π leeres π*-Prbital 5.2 Mechanismen metallorganischer Reaktionen 5.2.1 Ligandenaustauschprozesse extrem wichtig: M-L + L’ M-L’ + L Beispiel: inaktiver 18e− -Komplex Abspaltung Ligand aktiver 16e− -Komplex Substratbindung Eliminierung Produktkomplex Umsetzung inaktiver 18e− -Komplex 87 5.2.2 Oxidative Addition / Reduktive Eliminierung Grundlage: Leichter Wechsel der Oxidationsstufe am Metall Prinzip: B Oxidative Addition Mn + A−B n+2 M Reduktive Eliminierung A Vorteil: Es müssen nicht unbedingt dieselben Reste reduktiv entfernt werden die zuvor oxidativ addiert wurden! → wichtig für metallorganische Kupplungsreaktionen → Kreuzkupplungen wichtige Systeme: Ni0 → NiII Pd0 → PdII (d10 → d8 ) RhI → RhIII IrI → IrIII (d8 → d6 ) Oxidative Addition: Beispiel: Vaska-Komplex Ph3P Ph3P CO Ir + A Cl d8 16 e− -Komplex koordinativ ungesättigt CO Ir B PPh3 Cl A B PPh3 d6 18 e− -Komplex koordinativ gesättigt Palette an Substraten sehr breit → viele Anwendungen Polare Elektrophile: H−X, R−X, RCO−X Unpolare Elektrophile: H−H, R−H, R3Si−H Mehrfachbindungssysteme: Alkene, Alkine (A und B bleiben verbunden) „Oxidative Addition“ beschreibt Phänomen, keine Aussage über Mechanismus Reduktive Eliminierung: meist letzter Schritt eines Katalyse-Zyklus → extrem wichtig → Grundlage der meisten C−C-Knüpfungen Reduktive Eliminierung erfolgt immer aus der syn-Position → stereospezifisch! 88 5.2.3 Insertion / β-Hydrideliminierung formal wird ungesättigter Ligand Y (CO, RNC, Alken, Alkin) in benachbarte cis-Metallσ-Bindung insertiert. Prinzip: Z Y M Insertion koordin. gesättigt M Y Z L L koordin. ungesättigt M Y Z koordin. gesättigt Für Z = H, Alkyl wird neue C−H bzw. C−C-Bindung gebildet → reversibel Besitzt Z chirales Zentrum → Konfigurationserhalt a) CO-Insertion: wichtiger Prozess → Synthese von Aldehyden, Ketonen, Carbonsäureder. Carbonylierung, mit Z = H: Hydroformylierung Rückreaktion: Decarbonylierung R M CO Insertion R M C L L R M C O O Wanderungstendenz: η1-Allyl ≥ Et > Me > PhCH2 > Vinyl ≥ Aryl ~ ROCH2 > HOCH2 b) Alken-Insertion: geht gut bei M−C und M−H Bindungen (katalytische Hydrierung) Rückreaktion: β-Hydrideliminierung (für R = H) → Zersetzung von Alkylmetall-Komplexen R R M Insertion β-Hydridel. (R = H) stereospezifisch syn M Wanderungstendenz: Η >> R, Vinyl, Aryl > RCO >> RO, R2N c) Alkin-Insertion: analog: R R M Insertion M stereospezifisch syn 89 5.2.4 Nucleophiler Angriff an koordinierten Liganden Angriff an ungesättigten Verbindungen sehr wichtiger Prozess a) Carbonylkomplexe (Angriff am CO von Carbonylkomplexen) - + LnM C O - R R LnM C O - LnM C O + R−Li LnM C O E+ R O E R R reduktive Eliminierung LnM C O LnM C O E + E Carbenkomplexe Aldehyde Ketone Carbonsäureder. (stöchiometrische Umsetzungen) b) Acylkompexe Schlüsselschritt vieler Metall-katalysierter Acylierungsreaktionen Beispiel: X L O O Pd C Ar Ar + ROH C OR + L2Pd + HX L c) π-Komplexe extrem wichtig Reaktivität koordinierter Liganden: > > > > >> • Alken-Komplexe (η2-Komplexe) - anti-Addition: R R M > + Nu > Nu − M Bildung einer C−M und C−Nu-Bindung -syn-Addition: bei Cl−, AcO−, R− möglich R R M + Nu − M R M Nu Nu 90 • π-Allyl-Komplexe (η3-Komplexe) sehr wichtig → Pd-Chemie Prinzip: 0 Pd + R −X Pd R X − Pd + R X π-Allyl-Pd-Komplex π-Komplex 1 Nu - Pd 0 + R Pd R Nu Nu π-Komplex 2 optisch aktive Substrate: Retention (2x Inversion) Beispiel: L Ph L4Pd − AcO − 2L OAc Pd + - L Ph Nu - Ph + L 4Pd Nu • Dien-Komplexe (η4-Komplexe) Pd: Angriff des Nukleophils an der sterisch weniger gehinderten Position → Allylkomplex Prinzip: Nu - Nu Pd Cl Pd Cl Cl Cl − 2 Cl +2L Nu Pd + L L 5.2.5 Transmetallierung Übertragung eines Restes R von Hauptgruppenmetall M auf Übergangsmetall (ÜM) M‘ R M + M'X R M' + MX Hauptgruppenmetall sollte elektropositiver sein als Übergangsmetall wichtig: Kombination Transmetallierung mit anderen Reaktionen (oxid. Add. etc.) Übertragung zweier Reste R und R‘ auf ein ÜM → Kreuzkupplung durch red. Eliminierung Transmetallierung in Regel geschwindigkeitsbestimmender Schritt 91 5.3 Synthetische Anwendungen 5.3.1 Synthetische Anwendungen von Übergangsmetallhydriden ÜM-Hydride spielen zentrale Rolle bei Hydrierung, Hydrometallierung und Hydroformylierung Herstellungsverfahren: LnM + H 2 oxid. Add M M H β-H-Elim (H) LnM-X + M'H H O M Transmet. H a) Homogene katalytische Hydrierung Oxidative Addition von H2 homogene Hydrierung empfindlicher und selektiver als heterogene Hydrierung Monohydrid-Komplexe Katalysatoren (2 Klassen) Dihydrid-Komplexe → unterschiedliche Reaktivität und Selektivität • Monohydridkomplexe Beispiel: Rh(H)(PPh3)3CO selektiver Hydrierkatalysator für endständige Alkene Katalysecyclus: Monohydridkomplexe H L Rh L L CO −L H H R L redukt. Elim. H CO L L R H H L Rh L CO R Rh H H H Rh β-HElimin. L R CO R β-H-Elimin. oxidative Addition H2 Insertion R L Rh CO H L 92 • genereller anwendbar, besser untersucht Dihydridkomplexe Beispiel: RhCl(PPh3)3 Wilkinson-Katalysator Katalysecyclus: Dihydridkomplexe (vereinfacht) L L Rh Cl L −L H redukt. Elim. schnell H R L (S) H2 Rh Cl L oxidative Addition R H L L Rh Cl (S) H H Rh Cl H H (S) L Insertion langsam R H L H Rh Cl L R Reaktivität der Alkene: R R > > R > R > R R R asymmetrische Hydrierungen: Verwendung chiraler Liganden O PPh2 O PPh2 Ph2P P P PPh2 OMe OMe Diop N O O PPh2 PPh2 Dipamp BPPM Chiraphos 93 Beispiel: Synthese von Aminosäuren P *P E NH P *P Rh S Rh + E E = COOR + S Ph NHAc + + P diastereomere Komplexe Ph O O *P NH Rh E Ph geschwindigkeitsbestimmender Schritt * E P H NH Rh P * NH Rh P H E Ph NHAc Ph 98% H H + * O Rh E P H E NH Ph + O NH Rh E H P O H P P E P H * Ph O H + + Ph NHAc Ph H 2% Vorraussetzung für hohe ee’s: 1) Diastereomere Komplexe müssen sehr unterschiedlich reagieren 2) Zwischen beiden Komplexen muss schnelles Gleichgewicht sein 94 b) Hydrometallierung • Schwartz Reagenz Hydrozirkonierung H Cp2Zr Cl Beispiele: H ZrClCp2 Cp2ZrHCl Cp2ZrHCl R R ZrClCp2 H Cp2ZrHCl ZrClCp2 Angew. Chem. 1976, 88, 402. • Hydrostannylierung Alkine: stereospezifische syn-Addition, aber Gemisch von Regioisomeren Beispiele: SnBu3 Bu3SnH BnO Pd(PPh3)4 BnO BnO + SnBu3 J. Org. Chem. 1990, 55, 1867. Vinylstannane: wichtige Substrate für Kreuzkupplungsreaktionen (Stille-Kupplungen) geht auch mit Alkene und α,β-ungesättigten Carbonylverbindungen OH OH O O O O O O Bu3SnH Pd(PPh3)4 OH O OH O Tetrahedron Lett. 1982, 477. 95 Mechanismus: SnBu3 H R L H Pd R R Bu3Sn O L oxidative Addition L L H Bu3SnH Pd O H3O+ L L redukt. Elim. H L Pd O H Bu3Sn L Insertion R H L Pd O R Bu3Sn O 5.3.2 Synthetische Anwendungen von σ-Komplexen enthalten Metall-C-σ-Bindung Herstellung: R' M' + MX R M + Transmetallierung Insertion R' nucl. Angriff + Nu M Hydrometallierung M H + M oxidat. Addition R' X + M0 teilweise auch Kombinationen a) C-M-σ-Komplexe durch Transmetallierung von Carbanionen (Li, Mg) wichtig: Chemie der Kupferverbindungen (Cuprate) Gilman-Cuprate: 2 RLi + CuI R2CuLi wichtige Umsetzungen: 1,4-Additionen, Epoxidöffnungen, mit Säurechloriden → Ketonen aber alle stöchiometrisch! 96 Kreuzkupplungen: Beispiel: Stephens-Castro-Kupplung (ebenfalls stöchiometrisch) Ar I + Cu R Ar R + CuI Sonagashira-Kupplung: Katalytisch in Cu und Pd CuI, NEt3 + AcHN PdCl2(PPh3)2 I 95% DMF, ∆ COOMe AcHN COOMe Tetrahedron 1992, 48, 3239. Mechanismus: Pd(PPh3)4 2 PPh3 Pd(PPh3)2 R R' R oxidative Addition reduktive Eliminierung I R = Ar, Vinyl R R (PPh3)2Pd (PPh3)2Pd I R' CuI, NEt3 Transmet. CuI Cu R' R' NEt3H+ I− 97 b) C-M-σ-Komplexe durch Hydrometallierung H H M H + M M M M H H Beispiel: Pd-katalysierte Cycloisomerisierung von Eninen O Pd2d( ba)3 CHCl3 HOAc + R R dba = Ph Ph R J. Am. Chem. Soc. 1991, 113, 636. Mechanismus: H H Pd "HPdX" Insertion R H H R Produkte Pd Pd H R Addition und Eliminierung von Pd−H erfolgt stereospezifisch syn (cis) Beispiele: Mehrfachcyclisierung E E X E E X Pd2(dba)3 CHCl3 57% PPh3, HOAc - "HPdX" "HPdX" E E X E E E X E X PdX PdX XPd H J. Am. Chem. Soc. 1991, 113, 701; 1993, 115, 9421. OR OR Pd2(dba)3 CHCl3 AsPh3, HOAc R 86% R R R J. Am. Chem. Soc. 1991, 113, 701; 1993, 115, 9421. 98 c) σ-Komplexe durch oxidative Addition / Transmetallierung Transmetallierung: meist Transfer eines Restes R von Hauptgruppen- auf Übergangsmetall → oft geschwindigkeitsbestimmender Schritt wichtiger Prozess: + R X Pd(0) R Pd Ni(0) R Ni X X Nur Aryl- und Vinylhalogenide → Retention Alkylhalogenide → σ-Alkylkomplex → β-Hydrideleminierung Reaktivität: I > OTf > Br >> Cl Mechanismus und Reaktionsmöglichkeiten: Kreuzkupplung mit CO-Insertion R CO R R' c Pd(0) R Pd R' R X c a R' R CO Pd II CO d II R Pd R' b R Pd II II X R' R CO II X M R CO Pd II R' b R' DiorganoMetall-Komplex Pd M X M: Mg, Zr, Zn, Sn, B, Al, Si, Cu Teilschritte: a) Oxidative Addition b) Transmetallierung c) Reduktive Eliminierung d) Insertion extrem gut entwickelt: Pd(0)-katalysierte Kupplungen Katalysator: Pd(PPh3)4 oder in situ z.B. aus Pd2(dba)3 und PPh3 bzw. Reduktion: PdCl2(PPh3)2 Dibal-H 2 PPh3 Pd(PPh3)4 PPh3 Pd(OAc)2 99 • Zink: Zinkorganyle transmetallieren sehr gut → auch funktionalisierte Substrate Beispiel: Ph IZn I BocHN O Zn/Cu PhCOCl 60° (Ph3P)4Pd COOBn BocHN COOBn BocHN 70% COOBn J. Org. Chem. 1992, 57, 3398. • Zirkonium: Negishi-Kupplung Vinylzirkonium-Verbindungen leicht durch Hydrozirkonierung (Schwartz-Reagenz) erhältlich Beispiel: Br Cp2Zr(H)Cl RO RO RO E [Zr] Pd(0) E 70% Tetrahedron Lett. 1978, 1027. endständige Zr-Verbindungen kuppeln gut, interne kuppeln nicht. Abhilfe: Zusatz von ZnCl2 (Zr → Zn → Pd) Review: Acc. Chem. Res. 1982, 15, 340. Beispiel: Cp2Zr(H)Cl 1) ZnCl 2 [Zr] E 85% 2) Pd(0) Br E J. Am. Chem. Soc. 1978, 100, 2254. • Bor: Suzuki-Kupplung Bororganyle durch Hydroborierung Transmetallierung B → Pd zuerst problematisch Abhilfe: Umsetzung im Basischen Beispiel: I PdCl2, dppf I 9-BBN NaOH B OR H OR PPh2 B 9-BBN : . OR dppf : Fe PPh2 Tetrahedron Lett. 1992, 33, 2571. 100 ebenfalls gut. aromatische Boronsäuren → Herstellung funktionalisierter Aromaten B(OH)2 CONEt2 + CONEt2 • Zinn: CONEt2 Pd(PPh3)4 aq. Na2CO3 DME, ∆ Br CONEt2 Stille Kupplung eine der besten Methoden → viele Anwendungen Transmetallierung: > R C C > Ar > R CH CH Vinylzinn: Konfigurationserhalt CH2 CH CH2 , Bn >> Alkyl Allylzinn: Allylumlagerung Prinzipiell lassen sich alle Substrate kuppeln, die oxidativ an Pd addieren. Beispiel: Säurechloride O R R Cl O n O Bu3Sn Pd(0), CO O O n 32-70% 110° O Tetrahedron 1992, 48, 2957. Beispiel: Vinyl-, Aryliodide und –triflate O F O O F COOR + TfO N LiCl, THF, ∆ O N SnBu3 F COOR 2% PdCl2(PPh3)2 F 88% Tetrahedron Lett. 1990, 31, 1837. Geschwindigkeitsbestimmender Schritt: Transmetallierung → Koppeln mit Carbonylierung Beispiel: O O + I Pd(PPh3)4 Bu3Sn 63% 4 bar CO O J. Am. Chem. Soc. 1984, 106, 6417. 101 d) σ-Komplexe durch oxidative Addition / Insertion • CO-Insertion: geht sehr gut (auch bei Normaldruck) auch intramolekular → eine der besten Methoden um Carbonylgruppe einzuführen. Beispiel: OR OR RO PdCl2(PPh3)2 4 bar CO OH RO O K2CO3, DMF I 78% O J. Org. Chem. 1982, 47, 3630. • Alken-Insertion: Heck-Reaktion im Prinzip analog, Alkene etwas weniger reaktionsfähig Mechanismus: HX H Pd II a X R' R R X Pd(0) e R Pd II X d H II R Pd H H R' b X c R Pd II R' a: Oxidative Addition b: Koordination c: Insertion d: β-Hydrideliminierung e: reduktive Eliminierung X R' Insertion: schwierigster Schritt verläuft cis selektiv ebenso wie β-H-Eliminierung → Regioselektivität bei cyclischen Sys. Katalyator: entweder Pd(0) oder Pd(II) mit Reduktionsmittel (PPh3) Reaktion toleriert viele funktionellen Gruppen → breite Anwendung Beispiel: O O OTf N + O N R PdCl2, PPh3 NEt3, DMF, 60° R N O 96% N Heterocycles 1987, 26, 355. 102 Beispiel: intramolekulare Variante OSiR3 OTf OSiR3 Pd(PPh3)4 91% LiCl, Li2CO3 Acta. Chem. Scand. 1992, 46, 597. Beispiel: asymmetrische Variante + Pd(OAc)2 ArOTf O (R)-Binap Ar O Insertion H β-H-Elim. PdH Pd Pd Ar H Ins. β-H-Elim. O 40 - 60% > 96% ee O Ar H O Ar Tetrahedron Lett. 1992, 33, 1485 Beispiel: Dominoreaktionen Pd I Pd oxidative I I O CO-Insertion Addition n n n 5% PdCl2(PPh3)2 40 bar CO, NEt3 MeOH, MeCN, 100° AlkenInsertion O COOMe O Pd PdI O MeOH n R O geringer CO-Druck − HPdI n n R O hoher CO-Druck − HPdI I n J. Org. Chem. 1988, 53, 913. 3% Pd(PPh3)4 I MeCN, NEt 3 , ∆ 76% J. Am. Chem. Soc. 1990, 112, 8590. 103 5.3.3 Synthetische Anwendungen von Carbenkomplexen 2 Typen: Fischer-Carbene Schrock-Carbene OMe Beispiele: Cp2Ti (CO)5M R elektrophile Carbene Heteroatom subst. • nucleophile Carbene Olefinierung (→) ÜM-katalysierte Zersetzung von Diazoverbindungen Katalysatoren: Cu(I)- und Pd(II)-Salze, Rh(OAc)4 Beispiel: Cyclopropanierung O O COOMe Rh2(OAc)4 N2 RO COOMe RO 83%, 69% ds J. Org. Chem. 1992, 57, 441. Beispiel: asym. Cyclopropanierung O O R R' R Rh2L*4 O O R' N2 30 - 88% 72 - 94% ee L* = E N − O J. Am. Chem. Soc. 1991, 113, 1423 Keine geeignete Doppelbindung vorhanden → Insertion in C−H, O−H, N−H Beispiel: O E OH N2 Rh2(OAc)4 O O 71% E J. Chem. Soc. Perkin 1 1988, 1417. 104 • Metathese meist Metall-katalysierte Umsetzungen von Alkenen (Austausch von Alkenen) Prinzip: R' + R R' Katalysator + R ≠ R’: Kreuzmetathese R Ringöffnungsmetathese Ringschlußmetathese n (ROMP) (RCM) gängige Katalysatoren: Cl iPr PCy3 iPr F3C N F3C Mo O Cl Ph F3C F3C Ru PCy3 Ru Cl O O Ph Cl PCy3 Schrock Grubbs Hoveyda Mechanismus: Ringschlussmetathese LnM MLn MLn MLn viele präparative Anwendungen, starke Entwicklung Beispiel: OBn N O OBn OBn Grubbs-Kat. ∆ N OBn 80% O Tetrahedron Lett. 1996, 52, 7251. 105 5.3.4 Synthetische Anwendungen von Alken- und Dienkomplexen Durch Koordination: Umkehrung der Reaktivität des Alkens Nucl. Angriff an koord. Alken fundamenteller Prozess wichtige Metalle: Fe → stöchiometrisch, Pd → katalytisch • Alken-Komplexe Katalysatoren: PdCl2-Komplexe (MeCN, PhCN) Prinzip: Nu R Cl R L Cl Nu − Pd L2PdCl2 + Cl R Pd − Cl− L Nu β-H-Elim. R L H Pd Folgereaktionen Cl Pd(0) + HCl Beachte: Pd(II) nötig für Koordination. Nach nucl. Angriff entsteht Pd(0) → Reoxidation Beispiel: Wacker-Oxidation (Nucl. Addition von H2O) OHC O OHC PdCl2 / CuCl 59% O2, H2O O O Mechanismus: HX H Pd II 2 CuCl Pd(0) e a Cl II HO L2PdCl2 d R' b L II Cl Pd O L Cl II c HO R' O2 2 CuCl2 R' Cl Pd Cl R' R' a: Oxidative Addition b: Koordination c: Insertion / Nucl. Angriff d: β-Hydrideliminierung e: reduktive Eliminierung Nur monosubstituierte Alkene → Methylketone Auch andere O-Nucleophile möglich 106 Beispiel: Cyclisierung mit CO-Insertion R OMe R OMe OH 5% PdCl2 2 eq. CuCl2 O 87% 1 atm CO MeOH COOMe O O Pd(II) MeOH R OMe R OMe O CO O Pd Pd O O O J. Am. Chem. Soc. 1983, 105, 2034. • Dien-Komplexe hoch interessant da Bildung von π-Allylkomplexen (→) Prinzip: Nu1 − Nu2 Nu1 − X− Pd X − X− Pd X Nu1 Nu1 − Nu2 Nu2 Pd X Pd(0) Beispiel: Bäckvall-Oxidation cis- oder trans-Diacetat je nach Reaktionsbedingungen Pd(OAc)2 OAc L OAc − Pd(0) AcO Pd AcO Pd OAc AcO L − Cl OAc Reoxidation: − AcO + Benzochinon, MnO2 − Pd(0) AcO OAc Pd Cl L J. Org. Chem. 1984, 49, 4619; J. Am. Chem. Soc 1990, 112, 5160. 107 5.3.5 Synthetische Anwendungen von π-Allyl-Komplexen Im Prinzip von fast allen Metallen Komplexe bekannt wichtig: Pd(II)-Komplexe Herstellung: Pd X Pd PdH H 0 II PdX PdX2 Pd MgX X PdX2 Pd L Nu Nu − Pd Umsetzung von Allylsubstraten extrem viele Anwendungen allgemeiner Mechanismus: R Nu Pd(0) X a Nu PdX Pd d R Pd b Nu− L RM c + Pd f Pd L e L X Pd R − MX L Verschiedene Katalysatoren und Vorstufen, Bsp: Pd(PPh3)4 oder a: Oxidative Addition b: π−σ−π-Isomerisierung c: Ligandenaustausch d: Nucleophiler Angriff e: Τransmetallierung f: reduktive Eliminierung Cl Pd Pd Cl • Allylische Alkylierung vor allem mit „weichen Nucleophilen“ Stereochemischer Verlauf: Retention (2 x Inversion) Beispiel: Ph LnPd Ph OAc Nu− Nu Pd L Ph L Abgangsgruppen, Reaktivität: Cl > OCOOR > OAc >> OH → selektive Umsetzung von Bisallylsubstraten 108 Beispiel: OH OH Pd(OAc)2, PPh3 O2N OAc SO2Ph Base O2N SO2Ph ClCOOMe OCOOMe O2N SO2Ph Pd(OAc)2, PPh3 O2N OAc SO2Ph Base OAc J. Org. Chem. 1992, 57, 1588. effizient: Cyclisierungen Beispiel: OAc AcO Pd(PPh3)4 O 79% NaH OAc O E E H Tetrahedron Lett. 1992, 33, 3527, 3531. O O Pd(OAc)2 SO2Ph SO2Ph P(OiPr)3 O OH 92% SO2Ph SO2Ph OR OR Tetrahedron Lett. 1986, 27, 5695. modern: Asymmetrische Katalyse → Verwendung chiraler Liganden Beispiel: − Ph Ph LnPd E E Ph Ph O OAc E N E 74 - 98% 98.5% ee Ph2P Angew. Chem. 1993, 105, 614; Tetrahedron Lett. 1993, 34, 1769. geht auch mit Heteronucleophilen 109 Beispiel: Allylschutzgruppen: OH OH Pd(PPh3)4 SR N PPh3 O O N + N 92% O N H O SR O OH Tetrahedron Lett. 1987, 28, 4371. • Allylierung via Transmetallierung Beispiel: O OAc + Bu3Sn OBn Pd(PPh3)4 OBn DMF, LiCl 60°, 48h 81% O J. Org. Chem. 1990, 55, 3019. • π-Allylkomplexe als Intermediate Leichte Insertion von Alkenen, Alkinen und CO in π-Allylkomplexe Beispiel: Cyclisierungen Ts N AcO Ts N Pd2(dba)3 PPh3, CO MeOH, AcOH 77% COOMe Pd(0) Ts N MeOH Ts Ts N N Pd Pd Pd O J. Am. Chem. Soc. 1986, 108, 284. 110