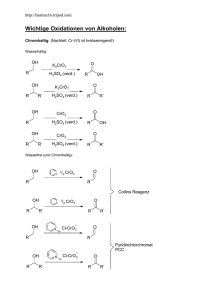
1. Übung zur Vorlesung OC IV 19.05.03
Werbung

1. Übung zur Vorlesung OC IV 19.05.03 Aufgabe 1 a) Zeichnen Sie in das unten abgebildete Schema für die Reaktionsgleichung I das Produkt (wählen Sie ein beliebiges Enantiomer) bzw. für die Reaktionsgleichung II das Edukt einer asymmetrischen Hydrierung! b) Welchen chiralen Katalysator und welche Hydrierbedingungen würden Sie jeweils wählen? c) Formulieren Sie jeweils einen allgemeinen Reaktionsmechanismus! MeO (I) N MeO A MeO (II) N MeO O B Aufgabe 2 Die asymmetrische Hydrierung des Allylalkohol A mit dem Noyori-Katalysator [Ru(OAc)2(S)BINAP] erfolgt mit einem ee von 90%. Welches Ergebniss erwarten Sie für die zweifache Hydrierung des Bisallylalkohol B mit dem Noyori-Katalysator, wobei die Stereozentren unabhängig voneinander gebildet werden! a) Zeichen Sie die Strukturformeln aller stereoisomeren Produkte! b) Geben die Diastereoselektivität und Enantioselektivität an (in %)! c) Vergleichen Sie das Ergebnis der Monohydrierung mit der zweifachen Hydrierung! 1 H2 OH Kat* OH A HO OH H2 Kat* B Aufgabe 3 a) Füllen Sie die Lücken der Reaktionsgleichungen I und II aus. b) Welches Diastereoisomer C entsteht bei der Hydrierung mit dem Wilkinson Katalysator? c) Welchen Katalysator wählen Sie für die diastereoselektive Hydrierung von Verbindung B, nachdem die Carbonyl Gruppe geschützt wurde? 2 O O TPSCl, Imidazol PPTS (I) (CH2Cl2), RT, 2 h (Aceton, H2 O) H 65°C, 2 h HO A H2 , RhCl(PPh3 )3 C O (II) HO B O O H HO D Aufgabe 4 Was bedeutet der Ausdruck dynamisch kinetische Resolution? Geben Sie ein Beispiel an und erklären Sie! 3 Aufgabe 5 a) Markieren Sie die Liganden mit C2-Symmetrie? b) Was ist der Vorteil von C2-symmetrischen Liganden in der asymmetrischen Synthese? NMe 2 PPh 2 Fe A Ph 2P PPh 2 N COR B O O PPh2 PPh2 PPh2 PPh 2 C D 4 2. Übung zur Vorlesung OC IV 21.05.03 Aufgabe 1: Reaktionsmechanismus a) Me Ph Me NaCH(CO2Me)2, [Pd(0) 1mol%], dppe, (THF), 25°C, 20h OAc Ph Me Ph + MeO 2C CO2Me 92 A MeO2C B CO 2Me 8 Durch eine allylische Substitution entsteht B aus A. Erklären Sie die Regio- und Stereoselektivität der Reaktion anhand des Mechanismus. b) Me Ph OAc Ph od. D OAc NaCH(CO2Me) 2, [Pd(0) 1mol%], dppe, (THF), 25°C, 20h Me Ph Me + CO 2Me MeO2C MeO2C E 90 B Ph CO 2Me 10 Aus den beiden Z-Olefinen D und E entstehen erneut die Produkte B (vgl. a). Begründen Sie diesen Befund. c) Me Ph PhZnBr, [Pd(PPh3)4, 5mol%] OAc F Welches Produkt erwarten Sie für den Fall, das PhZnBr als Nucleophil eingesetzt wird? 5 Aufgabe 2: Liganden Einer der am häufigsten eingesetzten Liganden in enantioselektiven allylischen Substitutionen ist das von Pfaltz et. al. entwickelte Oxazolin A. Es kann zum Beispiel eingesetzt werden, um racemisches B in enantiomerenreines C zu überführen. O PPh2 N OAc Ph 1mol% [Pd(LM3)Cl]2 12mol% A Ph MeO 2C CO 2Me Ph Ph R t i R = Bu, Pr, Ph A rac-B d) Wie erklärt man sich Differenzierung der enantiotopen Positionen durch A? e) Wie läßt sich A aus 2-Bromobenzonitril herstellen? C 6 Aufgabe 3 a) Füllen Sie die Lücken in dem unten abgebildeten Reaktionsschema ausgehend von den Edukten A bzw. B aus! b) Welches Diastereoisomer entsteht bei der Hydrierung mit dem Wilkinson Katalysator? c) Welchen Katalysator wählen sie für die diastereoselektive Hydrierung von Verbindung B? O O TPSCl, Imidazol PPTS (CH2Cl2), RT, 2 h (Aceton, H2 O) H 65°C, 2 h HO A H2 , RhCl(PPh3 )3 O HO B O O H HO C Aufgabe 4 Was bedeutet der Ausdruck dynamische kinetische Resolution? Geben Sie ein Beispiel an und erklären Sie! 7 Aufgabe 5 b) Markieren Sie die Liganden mit C2-Symmetrie? b) Was ist der Vorteil von C2-symmetrischen Liganden in der asymmetrischen Synthese? NMe 2 PPh 2 Fe A Ph 2P PPh 2 N COR B O O PPh2 PPh2 PPh2 PPh 2 C D 8 3. Übung zur Vorlesung OC IV 23.05.03 Aufgabe 1 In der Synthese von Scopodulinsäure tritt eine Domino-Heck-Reaktion auf. I O Pd(OAc) 2, PPh3, Ag2CO3 R H THF, 65° C, 18h O TBSO OTBS d) Definieren Sie den Begriff Domino-Reaktion! e) Zeichnen Sie den Reaktionsmechanismus! f) Wieso kommt es in der vorliegenden Domino-Reaktion zur zweiten Heck-Reaktion? (Betrachten Sie dazu die Struktur des Pd-σ-gebundenen Intermediates, das nach dem ersten Ringschluss entsteht.) Aufgabe 2 PhOTf O H Pd(OAc)2 (R)-BINAP O Ph Ph O H Geben Sie eine Erklärung für das entstehen zweier Produkte. Zeichnen Sie den Mechanismus für beide Produkte. Aufgabe 3 Erklären Sie die Regioselektivität bei der mehrfachen Heck-Reaktionen! Me CO 2Me Br Br I Ph Pd(OAc) 2 Pd(OAc)2 MeCN 100° C PPh 3 100° C 9 Aufgabe 4 In der folgenden Reaktion entstehen diastereoselektiv zwei neue stereozentren. Pd(OAc) 2 Bu4 NCl iPr2 NEt O I O HO DMF, 50° C Erklären Sie die Reaktionsverlauf und die Stereoselektivität. Aufgabe 5 Ergänzen Sie das Edukt oder Produkt folgender asymmetrischen Heck-Reaktionen. Welchen chiralen Katalysator kann man verwenden? OTIPS MeO (I) O N Br (II) N H O R (III) H 10 Aufgabe 6 COOMe MeOOC (2 Eq.) OTIPS MeO 2C CO 2Me H OTIPS Na Pdallyl2Cl2 (S)-BINAP DMSO OTf A Me B Erklären Sie den Mechanismus der Reaktion! Begründen Sie die Diastereoselektivität. 11 4. Übung zur Vorlesung OC IV 26.05.03 Aufgabe 1: Me COOEt N2CHCO 2Et, [Kat. 1mol%], (ClCH2CH2Cl), 25°C Ph COOEt + Ph Me Ph Me A 4 97 % ee NC N R 1 10 % ee R R N Cu N Kat. = : R = CMe2OH N R CN Wie erklären Sie die Stereoselektivität dieser Reaktion ? Aufgabe 2: Erklären Sie die Bildung von C aus der Diazoverbindung B. Wie sieht der Reaktionspartner A aus ? Welche Liganden könnte man für eine enantioselektive Reaktionsführung verwenden ? O O N2 O O [Rh2L 4] + O TBDMSO L=Ligand O OTBDMS O OTBDMS A B C 12 Aufgabe 3: a) Füllen Sie die Lücken in dem unten abgebildeten Totalsyntheseschema für Tremulonide A und Tremulenediol A ausgehend vom Edukt A aus. b) Erklären Sie den Rh-katalysierten Schlüsselschritt zu Intermediats C. c) Wie bildet sich D aus C ? OAc COOMe p-ABSA DBU + D Rh2 (OOct)4, (hexan), 69 °C B A C Cope Umlagerung H 2, ClRh(PPh3 ), 40 atm, (EtOH) AcO D E K 2CO3 (MeOH) MeO2 C DIBAL, (CH2Cl2), − 78°C Tremulenolide A Tremulenediol A p-ABSA = p-acetamidobenzenesulfonylazid (p-MeCONHC6H4SO2N3) 13 Aufgabe 4: Erklären Sie die Bildung von B aus dem Ester A. Welche Intermediate kann man sich vorstellen ? Geben Sie den Name der Reaktion ? nBuMgCl (5 eq.) Ti(OiPr)4 (0.5 eq.) O OH O A B 14