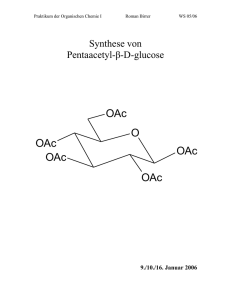
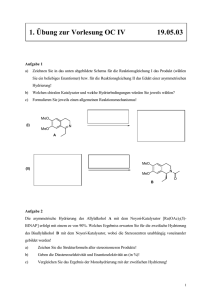
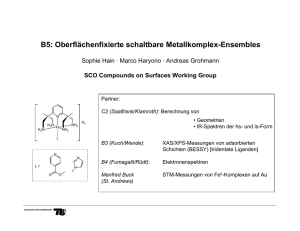
Klausur OCIII
Werbung

Seite A-1 Organische Chemie III Sommersemester 2001 – Technische Universität München Klausur am 26.7.2001 ___________________________________________________________________________ Name; Vorname .......................................................................... Matrikel-Nr. .......................... (Druckbuchstaben) geboren am ............................. in ................................................................. ............................................................ (Eigenhändige Unterschrift) ___________________________________________________________________________ Hinweise zur Klausur: 1. Die Klausur besteht aus insgesamt 12 Blättern (Deckblatt plus 11 Aufgabenblätter). Bitte kontrollieren Sie sofort, ob die Klausurunterlagen vollständig sind. 2. Es dürfen nur die vorgedruckten Bögen (einschließlich Rückseite) genutzt werden. Antworten sind zu kennzeichnen, sonst werden sie nicht bewertet. Bitte kurze Antworten! 3. Es sind keine Hilfsmittel erlaubt. Täuschungen und Täuschungsversuche führen zur Bewertung der Klausur mit 0 Punkten. 4. Bitte schreiben Sie mit einem Kugelschreiber oder Füller. Verwenden Sie keinen Bleistift und keine rote Tinte! 5. Jede richtig und vollständig beantwortete Aufgabe wird mit der jeweils angegebenen Anzahl von Punkten bewertet. Es können Teilpunkte gegeben werden. 1 2 3 4 5 6 7 8 9 10 Σ Seite A-2 1. Aufgabe a) Ausgehend von einem aromatischen Aldehyd soll der Heterocyclus 4 synthetisiert werden. Geben Sie außer dem Zielmolekül 4 die Zwischenprodukte 1-3 an. (8 Punkte) Ph N I O S HO Ar NEt3, H O O − S SO2H 1 Ph N I S HO O NEt3, Ar H 2 3 H , H2O 4 b) In einer ähnlichen Sequenz wurde das aus drei Heterocyclen bestehende Molekül 5 aufgebaut. Gesucht ist hier das Reagenz oder die Reagenzienkombination, die 5 in den Makrocyclus 6 überführt. (2 Punkte) S NH S NH OHC N HN CHO N HN S Seite A-3 2. Aufgabe Eine deutsche Arbeitsgruppe stellte den formylgeschützten Alkohol 2 durch Ozonolyse des Dihydropyrans 1 dar. Es sind aber auch andere kurze Zugangswege für 2 denkbar. Zeigen Sie eine Retrosynthese für den entsprechenden ungeschützten Alkohol, die mindestens einen C-CVerknüpfungsschritt enthält. (6 Punkte) O O Ph O O 3 (CH2Cl2, MeOH) H OMe Ph O 1 OH OMe Ph O 2 Seite A-4 3. Aufgabe Welches Produkt erwarten Sie jeweils bei folgenden Umsetzungen? Achten Sie auf die Regiound Stereoselektivität! (Je 3 Punkte) a) 1. t-BuLi (THF), −78 °C, 30 min 2. 8-Bromoctanal (THF), −78 °C BF4 TBSO S b) Ph Cl PhCOOH, t-BuNC H Cl NH 2 (CH 2Cl2 ), 20 °C, 5 h O c) O 2 MeMgBr H (Et2O) OH d), e) n-BuCeCl2 O (Et2O) n-Bu 2CuLi (Et2O) Seite A-5 4. Aufgabe a) Folgende Moleküle (A-C) sind durch eine Baylis-Hillman Reaktion aufgebaut worden. Bitte geben Sie die entsprechenden Ausgangsverbindungen an (je 2 Punkte). OH O C5H11 P(OEt)2 A OH O B O O O C b) Verbindung D wurde in einer Radikalkaskade (Bu3SnH, [AIBN]) gebildet. Bitte wählen Sie unter den 4 möglichen Ausgangsverbindungen (1-4) diejenige aus, aus der ihrer Meinung nach D entstanden ist (3 Punkte). OTf Br O O 1 2 O D Br Br O O 3 4 Seite A-6 Seite A-7 5. Aufgabe Die Totalsynthese von Saragossa-Säure gibt die Möglichkeit, Carbonylolefinierungen zu studieren. O O HOOC HOOC OH O OH OAc Saragossa-Säure O COOH Die unten abgebildeten Strukturen sind Zwischenprodukte des östlichen Teils der Saragossa-Säure. O OAc HO O 1 Es gibt zwei Wege, um den Alkohol 1 durch eine Carbonylolefinierung zu synthetisieren. Bitte geben Sie die Reaktionsbedingungen für die beiden Möglichkeiten an. Wie lautet der Name jeder dieser Schlüsselreaktionen? Tragen Sie auch die Reaktionsbedingungen ein, die den FGI-Schritt zu 1 ermöglichen. (8 Punkte) a) MeOOC O H Name: HO 1 TBDMSO TBDMSO b) H O Name: Seite A-8 6. Aufgabe Erklären Sie die (Z)/(E)-Selektivität der unten gezeigten Wittig-Horner-Reaktion anhand des unten dargestellten Energiediagramms und zeichnen Sie die zu den Energieniveaus A-F gehörenden Verbindungen ein. Geben Sie an, welches der beiden möglichen Produkte bevorzugt entsteht und erläutern Sie kurz, warum das so ist. (10 Punkte) E H C D O + (EtO)2OP COOEt B E A F . Reaktionswege Seite A-9 7. Aufgabe Der chirale Aldehyd A reagiert mit MeTi(Oi-Pr)3 mit hoher Diastereoselektivität zu dem Alkohol B, während bei der Umsetzung mit MeTiCl3 vorwiegend C gebildet wird! H Bn2N Ti-Reagenz O A MeTiCl3 b) c) OH Bn2N B MeTi(Oi-Pr) 3 a) OH Bn2N C 97 : 3 6 : 94 Welches Modell muß jeweils angewendet werden, um die Stereochemie des Hauptdiastereoisomeren zu erklären (2 Punkte)? Zeichnen Sie die Newman-Projektionen der Übergangszustande und machen Sie ersichtlich welches Produkt daraus resultiert (8 Punkte)! Versuchen Sie zu erklären, warum sich die Diastereoselektivität in Abhängigkeit vom Titanreagenz ändert (2 Punkte)! Seite A-10 8. Aufgabe a) Bei einer Heck-Reaktion von Iodbenzol mit einem Alken erhält man das Styrol A. Welches Alken wurde eingesetzt? Erklären Sie diesen Befund anhand der die Stereochemie bestimmenden Teilschritte des Mechanismus. (8 Punkte) Pd(0) NEt3 I + H A Alken b) Ähnliche Reaktionsbedingungen wählten Overman et al. für die Umsetzung von B. Welches Produkt ist zu erwarten? (4 Punkte) OTf O B Seite A-11 9. Aufgabe Die Vorteile der Carbometallierung liegen zum einen in ihrer Stereo- und Regioselektivität und zum anderen in der vielfältigen Folgechemie der entstehenden Organometall-verbindungen. Welche Verbindungen entstehen bei den folgenden Umsetzungen? (8 Punkte) a) Cu / MgBr2 1. C2H2 (Überschuß) 2. I2 b) Cu / MgBr2 1. OTMS + 2. H3O c) Cu / MgBr 2 1. C2H2 (Überschuß) 2. O d) Cp2ZrCl2, Mg; CO Seite A-12 10. Aufgabe Der Organiker hat mehrere Möglichkeiten die faciale Diastereoselektivität der Diels-Alder-Reaktion zu steuern. Denkbare Konzepte sind zum Beispiel: A Cyclische Stereokontrolle (Chiralitätszentrum im Ring) B Enantioselektive Katalyse mittels einer Lewissäure und chiraler Liganden C Lenkung durch 1,3-Allylspannung D Felkin-Anh-Kontrolle E Stereochemische Induktion durch ein Auxiliar Nachstehend sind fünf noch unvollständige Diels-Alder-Reaktionen aufgeführt. Setzen Sie fehlende Edukte bzw. Reagentien wenn nötig entsprechend ein und ordnen Sie die fünf Reaktionen jeweils einem der oben genannten Konzepte zu. (10 Punkte) Hinweis: Es muss nicht unbedingt jedes Konzept angewandt worden sein. Konzepte können auch doppelt vorkommen. Konzept O ∆T a) H t-Bu O Me H O O Me H B(OAc)3 b) OH O OH O H Ph H O OMe O Seite A-13 zu Aufgabe 10 Konzept OMe O 1. [BINOL-AlMe3] c) Ph 2. CF3 COOH O OTMS OH OH O O d) e) BINOL N O O O N EtAlCl2 Me O Me H N TBDMSO Me Bn Bn TiCl4 N Me OTBDMS OTBDMS