Nobelpreis Chemie 2010
Werbung

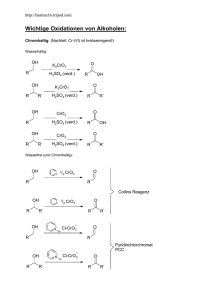
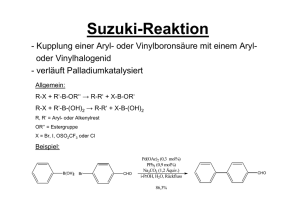
Nobelpreis Chemie 2010 Wer? Warum? Wer nicht? Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer Reaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur Nobelpreisvergabe und Diskussion Nobelpreise für C-C Knüpfungen Grignard Reaktion (1912) Victor Grignard Diels-Alder Reaktion (1950) Otto Diels und Kurt Alder Organische Bor und Phosphor Chemie (1979) Herbert Brown und Georg Wittig Olefinmetathese (2005) Yves Chauvin, Robert Grubbs und Richard Schrock Palladium katalysierte Kreuzkupplungen (2010) Richard F. Heck, Ei-ichi Negishi und Akira Suzuki Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer Reaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur Nobelpreisvergabe und Diskussion 1. Kupplungsreaktionen R X + R´ M Pd0 R R´ R = sp2 Komponente X = I, Br, Cl oder OTf M und R´ sind von der Reaktion abhängig [1] http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf 1. Pd-Katalysatoren Herkömmlich benutzte Katalysatoren Pd0 •Pd(PPh3)4 PdII •[Pd(PPh3)2Cl2] P •[Pd(dppe)Cl2] dppe R N P 1,2-bis(diphenylphosphino)ethane •[Pd(dppp)Cl2] • Auch N-heterocyclische Carbene möglich (NHC-Vortrag) [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874 P P dppp 1,3-bis(diphenylphosphino)propane N R N HC 1. Pd 0 Umweg über Pd(II)-Komplexe als Präkatalysator Gründe: • Pd(0)-Komplexe sind luft- und temperaturempfindlich → Schutzgas Die Katalysator Aktivierung erfolgt oft durch Homokupplung +II L2PdCl2 + 2 R-M Transmetallierung +II R L2 Pd R + 2 MCl Red. Eliminierung 0 R-R + L2 Pd [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874-922 1. Genereller Reaktionszyklus 1.Oxidative Addition 0 LnPd R R` R X 1 3 +II R Ln Pd R´ +II R Ln Pd X ● RX wird an den Pd(0) Komlpex gebunden ● Pd(0) -> Pd(II) 2 M X R´ M [1] http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf 1. Genereller Reaktionszyklus 1.Oxidative Addition 0 LnPd R R` R X 1 3 +II R Ln Pd R´ 2.Transmetallierung +II R Ln Pd X ● Ligandenaustausch; Wanderung des organisches Rests vom Metall (M) zum Pd 2 M X R´ M ● Dissoziation Abgangsgruppe (-X) [1] http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf 1. Genereller Reaktionszyklus 1.Oxidative Addition 0 LnPd R R` R X 1 3 +II R Ln Pd R´ 2.Transmetallierung +II R Ln Pd X 3.Reduktive Eliminierung 2 M X R´ M ● Bindungsbildung zwischen zwei Liganden im Komplex (Kupplung) ● Dekomplexierung ● Pd(II) -> Pd(0) [1] http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf 1. Die R-X Komponente Reaktivitäten der sp²-Komponente → I > OTf > Br >> Cl → Vinyl > Aryl Elektronenarme Aromaten aktiver als Elektronenreiche (Pd(0) Komplex ist selbst elektronenreich, also ein Nukleophil) 1. Das Metall M ● Pd als Katalysator 5 6 B C 14 13 Al ● u.a. B, Cu, Zn, Sn 28 als Metallkomponente 29 Ni 46 Pd 30 Cu 47 Ag Zn 48 Cd Si 31 32 49 50 Ga In Ge Sn 1. Überblick SUZUKI R OR´ R B OR´ R STILLE RSnR´ 3 R RZnX NEGISHI X R KUMADA RMgX + Pd0 R X=I, Br, Cl, OTf HECK R R SONOGASHIRA RC CH R BUCHWALD-HARTWIG HN R R N R Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer Reaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur Nobelpreisvergabe und Diskussion Nobelpreis Chemie 2010 2. Akira Suzuki - geboren am 1930 in Mukawa (Japan) - 1959 Promotion an der Hokkaido-Universität in Sapporo - 1963 Postdoktorand in Herbert Browns Arbeitskreis an der Purdue University und Forschung an Organoborverbindungen - 1973 Professor in der Abteilung Angewandte Chemie der Hokkaido-Universität - 1979 Publikation zur Suzuki-Kupplung - 1995 Professor an der Kurashiki-Universität 2. Suzuki Kupplung (1979) O O H O B O R H [4] Cl PdCl2 (PPh3 )2 NEt3 / NaOAc MeOH Suzuki R [3] Brown, H. C.; Gupta, S. K. J. Am. Chem. Soc. 1971, 93, 1816. [4] Norio Miyaura, Akira Suzuki Chem. Rev. 1995, 95, 2457 2. Suzuki Kupplung (1979) O O H O Cl B O R H PdCl2 (PPh3 )2 NEt3 / NaOAc MeOH Suzuki [4] OH OH BH3 O THF, 0°C O B H R R H Hydroborierung [3] Brown, H. C.; Gupta, S. K. J. Am. Chem. Soc. 1971, 93, 1816. [4] Norio Miyaura, Akira Suzuki Chem. Rev. 1995, 95, 2457 [4] 2. Suzuki Kupplung (1979) O O H O Cl B O R H PdCl2 (PPh3 )2 NEt3 / NaOAc MeOH Suzuki [4] OH OH BH3 O THF, 0°C O B H R R H [4] Hydroborierung ●Stabile und leicht zugängliche Borverbindungen ●Einfache Handhabung (Borverbindungen werden in situ durch Base aktiviert) ●Milde Reaktionsbedingungen ●Notwendigkeit der Base kann Funktionallität einschränken ●Verwendung von freier Boronsäuren oder 9-BBN möglich [3] Brown, H. C.; Gupta, S. K. J. Am. Chem. Soc. 1971, 93, 1816. [4] Norio Miyaura, Akira Suzuki Chem. Rev. 1995, 95, 2457 2. Suzuki Kupplung (1979) RO2 C NHCO2t-Bu B(OH)2 OMe 1.1 equiv TfO OMe ROOC t-BuO 2CHN (1 equiv) Pd(PPh3) 4 (4 mol%) K2 CO3 (1.4 equiv) Dioxan reflux (101°C) 45 min OMe OMe 90% H OH O HN CO2H O OMe H OH O OH (+)- Dynemicin A Krebsmedikament [5] A. G. Myers, N. J. Tom, M. E. Fraley, S. B. Cohen, and D. J. Madar, J. Am. Chem. Soc. 1997,119, 6072. 2. Ei-ichi Negishi -geboren 1935 in Shinkyo (Japan), (heute: Volksrepublik China) -1958 Bachelor an der Universität Tokio -1963 Promotion an der University of Pennsylvania -1968 Postdoc bei Herbert Brown (Perdue University) -1977 Publikation der Negishi-Kupplung -1979 Professor an der Purdue University 2. Negishi Kupplung (1977) I NO2 0.66 equiv. Ph ZnCl Pd(PPh3) 2Cl2 (3 mol%) [6] AlH(i-Bu)2(6 mol%) 1h, rt NO2 90% (GC) [6] Eiichi Negishi, Anthony O. King, Nobuhisa Okukado, J. Org. Chem., 1977, 42 (10),1821 2. Negishi Kupplung (1977) I NO2 0.66 equiv. Ph ZnCl Pd(PPh3) 2Cl2 (3 mol%) [6] AlH(i-Bu)2(6 mol%) 1h, rt NO2 90% (GC) ● Milde Reaktionsbedingungen [6] Eiichi Negishi, Anthony O. King, Nobuhisa Okukado, J. Org. Chem., 1977, 42 (10),1821 2. Negishi Kupplung (1977) I NO2 0.66 equiv. Ph ZnCl Pd(PPh3) 2Cl2 (3 mol%) [6] AlH(i-Bu)2(6 mol%) 1h, rt Ph Br Li Et2O Ph Li NO2 90% (GC) ZnCl2 (sol. THF) 1h [6] ● Milde Reaktionsbedingungen Problem: ● Herstellung der Aryl/Vinyl-Zinkhalogenide oft durch BuLi / Li Überschuss ● Isolation der Organozinkhalogenide umständlich (Luft/ Wasserempfindlich). ● Darstellung von Alkylzinkhalogeniden einfacher R X + 0.5 Zn [6] Eiichi Negishi, Anthony O. King, Nobuhisa Okukado, J. Org. Chem., 1977, 42 (10),1821 R ZnX 2. Negishi Eintopf Kupplung (2008) CN CO2 Et I Zn (3 equiv.) LiCl (3 equiv.) THF 50°C, 3h CO2 Et Br CN (0.8 equiv.) ZnI LiCl Pd(PPh3 )4 (0.5 mol%) THF 25°C, 15h EtO2 C (79%) [7] S. Sase, M. Jaric, A. Metzger, V. Malakhov, P. Knochel, J. Org. Chem., 2008, 73, 7380 2. Negishi Eintopf Kupplung (2008) CN CO2 Et I Zn (3 equiv.) LiCl (3 equiv.) THF 50°C, 3h CO2 Et Br CN (0.8 equiv.) ZnI LiCl Pd(PPh3 )4 (0.5 mol%) THF 25°C, 15h EtO2 C (79%) ● Organozinkhalogenid muss nicht isoliert werden ● Funktionalität bleibt erhalten ● Zinkpulver und Lithiumchlorid beinflussen Kupplungsreaktion nicht [7] S. Sase, M. Jaric, A. Metzger, V. Malakhov, P. Knochel, J. Org. Chem., 2008, 73, 7380 2. Negishi Kupplung (1977) Me N H Me I OTBDMS Me ZnCl2 N THF -78 - 0°C H Me Me ZnCl OBn OTBDMS Me Me I Pd(PPh3) 4 (13 mol%) Benzol OBn N H OTBDMS Me Me Me OH N Bn = Benzyl TBDMS = t-Butyldimethylsilyl [8] S. Hirashima, S. Aoyagi, and C. Kibayashi, J. Am. Chem. Soc. 1999, 121, 9873 H OH Me Pumiliotoxin A 2. Richard F. Heck - geboren 1931 in Springfield, Massachusetts - 1952 Bachelor an der University of California, Los Angeles (UCLA) - 1954 Promotion an der University of California, Los Angeles (UCLA) - 1956 Industrie bei Hercules Powder Co, Delaware - Professor an der University of Delaware - 1972 Publikation der Heckreaktion - 2005 Ruhestand Ei-ichi Negishi, J. om. Chem., 1999, 576, 16 2. Heck Reaktion (1972) S Br Pd(OAc)2 (1 mol%) P(o-Tol) 3 (2 mol%) NEt3 + N S + 100°C 96h N HNEt3Br 57% Br + COOMe Pd(OAc)2 (1 mol%) PPh3 (2 mol%) NEt3 100°C 70h [9] Richard F. Heck, Acc. Chem. Res., 1979, 12 (4), 146 COOMe + HNEt3Br 75% 2. Heck Reaktion (1972) S Br Pd(OAc)2 (1 mol%) P(o-Tol) 3 (2 mol%) NEt3 + N S + 100°C 96h N HNEt3Br 57% Br + COOMe Pd(OAc)2 (1 mol%) PPh3 (2 mol%) NEt3 100°C 70h COOMe + HNEt3Br 75% ●Außer Pd kein weiteres Metall ●PR3 als Additiv →Anderer Reaktionszyklus (abhängig vom Kat.) [9] Richard F. Heck, Acc. Chem. Res., 1979, 12 (4), 146 2. Heck Reaktion (1972) Katalysator Aktivierung hier anders, aber Aktive Form Pd(0) HOAc + Ph3 P O + H2 O PdII (OAc)2 + 2 PPh3 in situ PPh3 Ph3 P II OAc Pd AcO PPh3 Pd 0 + Ph3 P OAc Ph3 P OAc OAc + PPh 3 Ph3 P Ph3 P 0 Pd OAc [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc II X AcO Pd Ar L R 6 Ar II Pd OAc H H R • Oxidative Addition L Ar H 1. 1 L II H Pd OAc L ArX 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc 6 Ar II Pd OAc H H R • Oxidative Addition 2. • Dissoziation von X- II X AcO Pd Ar L R H 1. L Ar L ArX 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc L II X AcO Pd Ar L Ar R 6 L Ar H II Pd OAc H H R ArX 1. • Oxidative Addition 2. • Dissoziation von X- 3. • Dissoziation von PPh3 • п-Komplexierung 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc L II X AcO Pd Ar L Ar R 6 L Ar H II Pd OAc H H R ArX 1. • Oxidative Addition 2. • Dissoziation von X- 3. • Dissoziation von PPh3 • п-Komplexierung 4. • Syn - Insertion 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc L II X AcO Pd Ar L Ar R 6 L Ar H II Pd OAc H H R ArX 1. • Oxidative Addition 2. • Dissoziation von X- 3. • Dissoziation von PPh3 • п-Komplexierung 4. • Syn - Insertion 5. • Rotation um C-C Bindung 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc L II X AcO Pd Ar L Ar R 6 L Ar H II Pd OAc H H R ArX 1. • Oxidative Addition 2. • Dissoziation von X- 3. • Dissoziation von PPh3 • п-Komplexierung 4. • Syn - Insertion 5. • Rotation um C-C Bindung 6. • β-H Eliminierung • п-Komplexierung 2 L = PPh3 X L II AcO Pd Ar L 5 Ar H H L II Pd OAc H R 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Zyklus Ar + NEt3H R L NEt3 Pd L 7 0 OAc 1 L II H Pd OAc L II X AcO Pd Ar L Ar R 6 L Ar H II Pd OAc H H R ArX Ar H H H R • Oxidative Addition 2. • Dissoziation von X- 3. • Dissoziation von PPh3 • п-Komplexierung 4. • Syn - Insertion 5. • Rotation um C-C Bindung 6. • β-H Eliminierung • п-Komplexierung 7. • Red. Eliminierung • Dekomplexierung • Deprotonierung • Kat. Reaktivierung 2 L = PPh3 X L II AcO Pd Ar L 5 L II Pd OAc 1. 3 L 4 Ar II Pd OAc R R [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 2. Heck Reaktion (1972) DBS OMe N MeO H Pd(CO2CF3)2(PPh3)2 (10 mol%) I PMP(4 equiv.) Toluol 120° C OBn DBS N OBn OMe Bn = Benzyl PMP =1,2,2,6,6pentamethylpiperidine OOH Me DBS = N Morphin [11] C. Y. Hong, N. Kado, and L. E. Overman, J. Am. Chem. Soc. 1993, 115, 11028 Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer Reaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur Nobelpreisvergabe und Diskussion 3. Sonogashira Kupplung O I HN O Pd(PPh3 )2 Cl2 (0.5 mol%) CuI (0.5 mol%) TMS + NEt3 , EtOAc rt N H Ph I Ph O O Pd(PPh3) 4 (10mol%) CuI (20 mol%) Et2NH, reflux O aq. NaOH HN 99% N H 93% Ph Ph I TMS HN O N H Eniluracil [12] Ph Ph 90% [2] [12] J. W. B. Cooke, R. Bright, M. J. Coleman, K. P. Jenkins, Org. Process Res. Dev. 2001, 5, 383 [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874-922 H 3. Sonogashira Kupplung O I HN O Pd(PPh3 )2 Cl2 (0.5 mol%) CuI (0.5 mol%) TMS + NEt3 , EtOAc rt N H Ph I Ph O O Pd(PPh3) 4 (10mol%) CuI (20 mol%) Et2NH, reflux O aq. NaOH HN 99% N H 93% Ph Ph I TMS HN O N H Eniluracil [12] Ph Ph 90% [2] ● Cu(I) als Co – Kat. ● Einsatz von Aminbase → Anderer Reaktionszyklus [12] J. W. B. Cooke, R. Bright, M. J. Coleman, K. P. Jenkins, Org. Process Res. Dev. 2001, 5, 383 – 386 [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874-922 H 3. Sonogashira Kupplung R´ 0 PdL2 R R 3 1 R II L Pd L X ●Palladiumzyklus L II X Pd L R R´ 2 Cu R´ R3 NHX CuX 5 NR3 4 H H R´ CuX R´ [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874-922 1 Ox. Addition 2 Transmetallierung 3 Red. Eliminierung 3. Sonogashira Kupplung R´ 0 PdL2 R R 3 1 R II L Pd L X ●Palladiumzyklus L II X Pd L R R´ 2 Cu ●Kupferzyklus R´ R3 NHX CuX 5 NR3 4 H H 1 Ox. Addition 2 Transmetallierung 3 Red. Eliminierung R´ CuX R´ [2] R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874-922 4 π- Komplex 5 Deprot. und Komplexierung 3. Sonogashira Kupplung Ar Ar Et2O3P I I PO3Et2 Ar CHO NaH THF Wittig-Horner I I Ar Ar´ H Pd(0) CuI Piperidin Ar´ Ar´ Ar [13] Anthony J. Zucchero, James N. Wilson, and Uwe H. F. Bunz , J. Am. Chem. Soc., 2006, 128 (36), 11872 3. Sonogashira Kupplung H OH O HN CO2H O OMe Bsp aus Suzukikupplung H OH O OH (+)- Dynemicin A [5] A. G. Myers, N. J. Tom, M. E. Fraley, S. B. Cohen, and D. J. Madar, J. Am. Chem. Soc. 1997,119, 6072 3. Buchwald Hartwig Reaktion X R + H N R1 R2 PdCl2(P(o-Tol) 3) 2 (cat.) NaOt-Bu (Buchwald) oder LiHMDS (Hartwig) R1 N R R2 LiHDMS = LiN(SiMe3) 2 [14] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [15] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc. 2007 3. Buchwald Hartwig Reaktion X R + H N R1 R2 PdCl2(P(o-Tol) 3) 2 (cat.) NaOt-Bu (Buchwald) oder LiHMDS (Hartwig) R1 N R R2 LiHDMS = LiN(SiMe3) 2 ● Außer Pd kein weiteres Metall ● Direkte C-N Kupplung ● Starke Base stöchiometrisch notwendig [14] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [15] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc. 2007 3. Buchwald Hartwig Reaktion Ar R1 N R2 0 LnPd 1.Oxidative Addition 1 3 β-H Eliminierung Ar X +II Ar Ln Pd NR1 R2 +II Ar Ln Pd X 2 NaX + HOt-Bu R1 H N + NaOt-Bu R2 [14] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [15] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc. 2007 3. Buchwald Hartwig Reaktion Ar R1 N R2 0 LnPd 1.Oxidative Addition 1 3 β-H Eliminierung Ar X +II Ar Ln Pd NR1 R2 +II Ar Ln Pd X 2.“Transmetallierung“ 2 NaX + HOt-Bu R1 H N + NaOt-Bu R2 [14] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [15] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc. 2007 3. Buchwald Hartwig Reaktion Ar R1 N R2 0 LnPd 1.Oxidative Addition 1 3 β-H Eliminierung Ar X +II Ar Ln Pd NR1 R2 +II Ar Ln Pd X 2.“Transmetallierung“ 3.Reduktive Eliminierung 2 NaX + HOt-Bu R1 H N + NaOt-Bu R2 (β-H Eliminierung langsam und kann durch geeignete Liganden am Pd unterdrückt werden) [15] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [16] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc. 2007 3. Buchwald Hartwig Reaktion Br + Br H2NBu Pd(dba)2 (1 mol%) (1.2 equiv.) NaOt-Bu (1.4 equiv) Toluol 110°C 12- 24h H2 N Pd(dba)2 (2 mol%) NHBu (98%) NHPh + MeO (1.2 equiv.) NaOt-Bu (1.4 equiv) Toluol 110°C 12- 24h MeO (84%) [16] Xiaomin Xie, Tony Y. Zhang, Zhaoguo Zhang, J. Org. Chem., 2006, 71 (17), 6522 Gliederung 1. Einführung 2. Vorstellung der Preisträger und ihrer Reaktionen 3. Weitere Kupplungsreaktionen 4. Generelles zur Nobelpreisvergabe und Diskussion 4. Nobelpreis für Kupplungsreaktionen Warum? N O Ph Ph S NO2 Ph R H N MeO "Retro" Kupplung "Retro" "Klassisch" • Neue Synthesemöglichkeiten • Milde und katalytische Begingungen • Sehr vielfältig einsetzbar (Naturstofftotalsynthese) 4. Nobelpreis Wer? Wer nicht? Nominierung: • Ehemalige Preisträger • Chemieprofessoren best. schwed.Universitäten • Nur lebende Personen können nominiert werden Preisvergabe: • Maximal 3 Personen • Vergabe durch schwed. König (10.Dezember) 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) X R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R († 1989) STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) X R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R († 1989) STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) (RMgX) X R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R († 1989) STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) (RMgX) X R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC (C-N) CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R († 1989) STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) (RMgX) X R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC (C-N) CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? SUZUKI (1979) R OR´ R B OR´ R († 1989) STILLE (1978) RSnR´ 3 R RZnX NEGISHI (1977) X ? (RMgX) R KUMADA (1972) RMgX + Pd0 R X=I, Br, Cl, OTf HECK (1972) R R SONOGASHIRA (1975) RC (C-N) CH R BUCHWALD-HARTWIG (1995) HN R R N R 4. Nobelpreis Wer? Wer nicht? http://blog.everydayscientist.com/?p=2383 (26.Sept 2010) Anhang Literatur [1] [2] [3] [4] [5] http://static.nobelprize.org/nobel_prizes/chemistry/laureates/2010/Sciback_2010.pdf R. Chinchilla, C. Nájera, Chem. Rev. 2007,107 (3), 874 Brown, H. C.; Gupta, S. K. J. Am. Chem. Soc. 1971, 93, 1816. Norio Miyaura, Akira Suzuki Chem. Rev. 1995, 95, 2457A. G. Myers, N. J. Tom, M. E. Fraley, S. B. Cohen, and D. J. Madar, J. Am. Chem. Soc. 1997,119, 6072. [6] Eiichi Negishi, Anthony O. King, Nobuhisa Okukado, J. Org. Chem., 1977, 42 (10),1821 [7] S. Sase, M. Jaric, A. Metzger, V. Malakhov, P. Knochel, J. Org. Chem., 2008, 73, 7380 [8] S. Hirashima, S. Aoyagi, and C. Kibayashi, J. Am. Chem. Soc. 1999, 121, 9873 [9] Richard F. Heck, Acc. Chem. Res., 1979, 12 (4), 146 [10] Reaktionsmechanismen • Organische Reaktionen, Stereochemie, moderne Synthesemethoden (Hrsg.H R. Brückner) , 3.Aufl., Elsevier - Spektrum Akademischer Verlag, Heidelberg, Berlin, Oxford, 2004 [11] C. Y. Hong, N. Kado, and L. E. Overman, J. Am. Chem. Soc. 1993, 115, 11028 [12] J. W. B. Cooke, R. Bright, M. J. Coleman, K. P. Jenkins, Org. Process Res. Dev. 2001, 5, 383 [13] Anthony J. Zucchero, James N. Wilson, and Uwe H. F. Bunz , J. Am. Chem. Soc., 2006, 128 (36), 11872 [14] John F. Hartwig, Steven Richards, David Barañano, and Frédéric Paul J. Am. Chem. Soc., 1996, 118 [15] Name reactions for functional group transformations,(Hrsg.: Jie Jack Li), John Wiley & Sons, Inc.2007 [16] Xiaomin Xie, Tony Y. Zhang, Zhaoguo Zhang, J. Org. Chem., 2006, 71 (17), 6522 Von Jan Wenz und Thomas Kothe