Q11 Chemie: Übungs- und Wiederholungsaufgaben zur
Werbung

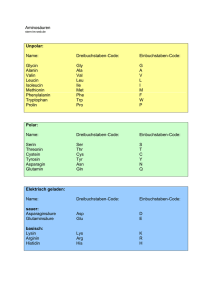
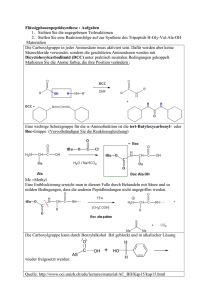
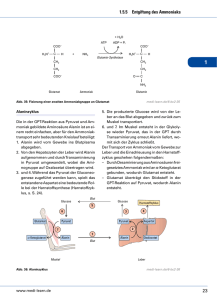
1a) Eine optische aktive Lösung dreht den Winkel der Schwingungsebene des eingestrahlten polarisierten Lichtes um einen bestimmten Wert (=Drehwinkel ) 1b) 2-Butanol = Butanol-2 = Butan-2-ol alles drei gültig 1c) Das die OH-Gruppe tragende C-Atom 2 besitzt 4 verschiedene Substituenten (H-, Methyl-, Ethyl-, -OH); es ist somit ein asymmetrisches C-Atom (Chiralitätszentrum). Dadurch wird das 2-Butanol zu einem chiralen Molekül, von dem 2 Enantiomere (Spiegelbilder) existieren. Die optisch aktive Lösung enthält nur eines der beiden Enantiomere (oder zumindest einen Überschuss davon). 2a) Unpolarisiertes Licht wird durch eine Polarisationsfolie geschickt. Durch die Wirkung dieses Polarisators entsteht polarisiertes Licht, d.h. Licht dessen Schwingung auf eine Ebene (die Polarisationsebene) beschränkt ist. Das polarisatierte Licht lässt man eine bestimmte Strecke durch eine auf optische Aktivität zu prüfende Lösung fallen, unter deren Wirkung im Fall einer aktiven Lösung die Polarisationsebene um einen bestimmten Drehwinkel verdreht wird. Die Verdrehung registriert man mit einer zweiten Polarisationsfolie, dem Analysator, der um nachgedreht werden muss, um die ursprüngliche (=ohne den optisch aktiven Stoff vorhandene) Lichtintensität wieder anzuzeigen. 2b) Reine -Glucose weist eine spezifischen Drehwinkel von +112° auf. In wässriger Lösung stellt sich ein chemisches Gleichgewicht ein, wobei am C1-Atom der Ring geöffnet werden kann. Durch erneuten Ringschluss bildet sich mit einer bestimmten Wahrscheinlichkeit die Glucose, die einen weniger positiven Drehwinkel aufweist. Es kommt zur Gleichgewichtseinstellung mit dem Drehwinkel von +52°, der durch die Gleichgewichtskonzentrationen von - und -Glucose bestimmt wird. Die Veränderung des Drehwinkels im Verlauf der Reaktion nennt man Mutarotation. 3a) 3b) 2c) CH2OH(COH)4CHO wird durch Ag+ zu CH2OH(COH)4COOH oxidert; Ag+ wird dabei zu Ag reduziert, was den Silberspiegel bildet. Reduktion: Ag+ + e– Ag Oxidation: CH2OH(COH)4CHO + 2 OH– CH2OH(COH)4COOH + 2 e– + H2O Redox: 2 Ag+ + CH2OH(COH)4CHO + 2 OH– 2 Ag + D-Galactose CH2OH(COH)4COOH + H2O Das Disaccharid Lactose wird fehlingpositiv reagieren, da am Glucoserest rechts an C1 ein Halbacetal vorliegt, das sich zur kettenförmigen Aldehydform öffnen kann und somit reduzierend wirkt. Lactose 3c) Durch die Säurezugabe kommt es zur Spaltung des Disaccharids Lactose in die Monosaccharide D-Galactose und D-Glucose. Da D-Glucose in Lösung einen Drehwinkel von +52° aufweist und die Lösung der Monosaccharide einen Drehwinkel von 40,3°, muss DGalactose einen etwas geringeren positiven -Wert aufweisen. 4a) Fehling I (Cu2+-Ionen-Reagenz) und Fehling II (alkalisch) werden zu einer FruktoseLösung gegeben. Aus der zunächst himmelblauen Lösung scheidet sich beim Erhitzen allmählich ein ziegelroter Niederschlag von Kupfer(I)oxid, Cu2O ab. Die Fruktoselösung reagiert fehlingpositiv (=reduzierend), da sich die Fruktose, bei der es sich um eine Ketose handelt, in alkalischer Lösung in die Glucose umlagert (isomerisiert). In dem Isomerisierungsgleichgewicht liegt ein bestimmter Prozentsatz offenkettige Glucose vor, die als Aldose das Fehlingreagenz reduziert. 4b) Unter Mutarotation versteht man die Änderung der optischen Aktivität einer Lösung infolge einer chemischen Reaktion. Insbesondere bei Sacchariden, die in verschiedenen Ringformen vorliegen können, kommt es durch Umwandlungsreaktionen zu einer Änderung des Drehwinkels . 4c) Fruktoselösungen zeigen ebenso wie Glucoselösungen das Phänomen der Mutarotation, da sich aus der offenkettigen Ketose zwei verschiedene ringförmige Halbketale, - und Fruktose (Diastereomere, die unterschiedlich stark optisch linksdrehend wirken), bilden können: -Fruktose Frukto-Ketose -Fruktose 1.1) [Vorbemerkung: Ether=Diethylether, H5C2–O–C2H5 ist trotz des durch den Sauerstoff bedingten Dipolcharakters ein eher unpolares Lösungsmittel, welches sich – im Unterschied zum Ethanol – mit Wasser nicht mischt. Die beiden großen Ethylgruppen mit ihrem lipophilen Einfluss fördern stark den lipophilen Charakter des Ethers] Alanin liegt vorwiegend in der Zwitterionenform vor und ist dadurch ein stark polarer Stoff. Die starken Wasserdipole bzw. die von ihnen ausgehenden Wasserstoffbrücken begünstigen die Wasserlöslichkeit des Alanins. Der vorwiegend unpolare Ether ist hierzu nicht in der Lage. 1.2) Reaktion mit H2SO4 Die Schwefelsäure wurde hier durch H3O+ dargestellt. Die Reaktionsgleichung kann auch unter Verwendung der Formel H2SO4 anstelle von H3O+ geschrieben werden. Dann muss auf der rechten Seite HSO4– anstelle von H2O erscheinen. Außerdem kann Alanin formelmäßig auch als Zwitterion eingesetzt werden. An der Formel des Produkts ändert das aber nichts. Reaktion mit NaOH Auch hier gibt es Darstellungsvarianten. Die Natronlauge kann auch als NaOH oder Na+ + OH– eingesetzt werden. Dann muss auf der Produktseite ein Na+ hinzugefügt werden oder die Carboxylatgruppe wird geschrieben als –COONa bzw. –COO–Na+. 1.3) Alanin Threonin Alanylthreonin Anmerkung: die AS sind hier nicht als Zwitterionen eingesetzt. Die Carboxylatgruppe –COO– ist überhaupt nicht in der Lage mit Nucleophilen zu reagieren und obendrein hat die –NH3+-Gruppe ihre nucleophilen Eigenschaften durch die Protonierung am Stickstoff verloren. Wie im Unterricht besprochen muss, damit die Reaktion tatsächlich abläuft die Carboxylgruppe aktiviert werden. 1.4) Die einzige optisch inaktive -Aminosäure ist die Aminoethansäure, das Glycin: H2N–CH2–COOH. Hier befindet sich am C kein Chiralitätszentrum, da anstelle der unterschiedlichen Substituenten H und der Seitenkette R bei allen anderen Aminosäuren zwei identische Wasserstoffsubstituenten an diesem Atom gebunden sind. 2.1) L-Alanin, in Proteinen vorkommend D-Alanin, nicht in Proteinen vorkommend 2.2) Der isolelektrische Punkt ist derjenige pH-Wert, bei dem eine Aminosäure (oder ein anderer Peptidstoff) in einem elektrischen Gleichspannungsfeld keine Wanderung durchführt, weil er dort als Zwitterion vorliegt. Die Absenkung des pH von 6 auf 5 bedeutet eine 2.3) Erhöhung der H3O+-Ionenkonzentration um den Faktor 10. Dadurch wird das linksstehende Gleichgewicht nach rechts verschoben. Valin liegt überwiegend als Kation vor → wandert zum Minuspol. 3.1) [wie bereits in Aufgabe 1.1 bei der Diskussion der Wasserlöslichkeit von Alanin erwähnt, war dort die Zwitterionenbildung eigenschaftsbestimmend. Das ist auch hier so. ] Die ionischen Gruppen in den Zwitterionen orientieren sich im Kristall so, dass sie starke Anziehungskräft ausbilden können. Da diese beim Schmelzen überwunden werden müssen resultiert ein für organische Stoffe ungewöhnlich hoher Schmelzpunkt. Bei den erwähnten 297 °C ist die Wärmebewegung bereits so hoch, dass es zu Bindungsbrüchen in den Aminosäuremolekülen kommt Zersetzung. 3.2) Aminosäuren verknüpfen sich [formal] unter Wasserabspaltung und Ausbildung von Peptidbindungen –CO–NH–; durch diese als Polykondensation zu bezeichnende Reaktionsart entstehen die Polypeptidketten, aus denen Proteine aufgebaut sind. Ausschnitt aus einer Polypeptidkette, bestehend aus 3 Aminosäureresten: die Sequenz Ala-Gly-Ala (Alanyl-Glycyl-Alanyl) 3.3) Beispiele für Sekundärstrukturen von Proteinen sind die -Helix, die -Faltblattstruktur und der -Turn. Die Stabilisierung erfolgt in allen drei Fällen durch Wasserstoffbrücken, die sich vor allem zwischen den –CO– und –NH–Dipolen der Peptideinheit ausbilden. Bei der -Helix und beim -Turn entstehend diese Bindungen zwischen Peptideinheiten, die aufgrund der Faltung der Polypeptidkette in Nachbarschaft geraten. Bei der Faltblattstruktur zwischen weiter entfernten, antiparallel verlaufenden Kettenabschnitten. Tertiärstrukturen werden zusätzlich durch anziehende Kräfte oder durch chemische Bindungen stabilisiert, die von den Seitenketten ausgehen und die verschiedenartig sein können: Unpolare Kräfte (Van-der-Waals-Kräfte) H-Brücken, Dipolkräfte, Ionische Anziehungskräfte, Disulfidbrücken. [Anmerkung: bei der Tertiärstruktur globulärer Proteine spielen die Van-der-Waals-Kräfte der unpolaren Seitenketten eine besonders große Rolle, da sie sich ins Innere der Kugelform, d.h. weg vom Wasser orientieren] 4.1) Aminoethansäure kann unionisiert, d.h. mit einer Amino- und einer Carboxylgruppe oder in Zwitterionenform vorliegen. 2-Aminopropansäure existiert ebenfalls in diesen beiden Formen. Zusätzlich besteht hier die Möglichkeit in der L- und in der D-Form, also als optische Isomere (Enantiomere) vorzuliegen, nämlich als L-Alanin oder als D-Alanin. [Anmerkung: Allerdings ist die Bezeichnung "Alanin" für L-Alanin reserviert] 4.2) Wurde maßgeblich schon bei 3.1 beantwortet. Die zugrundeliegenden Carbonsäuren sind flüssig, da sie keine Zwitterionen bilden können. [Der gasförmige Zustand kommt hier ebenfalls nicht infrage, da die Carbonsäuremoleküle Wasserstoffbrücken ausbilden]. 4.3) H H Bei der Bindungsart handelt es sich um die Peptidbindung [eine Spezialfall der Amidbindung] 4.4) Durch die Reaktion mit der Natronlauge wird das Dipeptid durch Deprotonierung der Carboxylgruppe in die anionische (also neg. geladene) Form übergeführt und wandert im elektrischen Feld zum Pluspol. 5.1) Asparaginsäure + Lysin + Valin → + 2 H2O hier ist R1= –CH2–COOH, R2= –CH2–CH2–CH2–CH2–NH2 und R3= –CH(CH3)2 5.2) 2,9 ist der IEP von Asparaginsäure; 6,0 derjenige von Valin und 9,7 der von Lysin. Begründung: Saure Aminosäuren wie Asparaginsäure liegen bei neutralem pH vorwiegend als negative Anionen vor (–COOH + H2O → –COO– + H3O+). Um sie in die Zwitterionenform zu bringen, die am IEP vorliegt, muss ein saurer pH gewählt werden, damit die zusätzliche Carboxylgruppe nicht mehr als Carboxylat vorliegt (–COO– + H3O+→ –COOH + H2O) Sinngemäß Umgekehrtes gilt für basische AS, wie Lysin. Annähernd neutrale AS wie Valin haben ihren IEP nahe beim Neutralpunkt; hier bei pH 6. 5.3) Valin Asparaginsäure Lysin (jeweils bei pH 9,7) Die Carboxylgruppen geben bei dem deutlich basischen pH von 9,7 durch Reaktion mit OH– ihr Proton ab (=werden deprotoniert) Valin und Asparaginsäure liegen als Anionen vor. Lysin ist an seinem IEP liegt in Zwitterionenform vor. 5.4) Das geeignetste Verfahren ist die Elektrophore. Man bringt dazu ein AS-Gemisch in das elektrische Feld einer Gleichspannung, wobei die Stoffe auf eine feste Trägerplatte aufgetragen werden. Aufgrund ihrer unterschiedlichen Ladungszustände wandern verschiedene Aminosäuren in verschiedene Richtungen und/oder unterschiedlich schnell. Die farblosen AS müssen mit einem Nachweisreagenz, z.B. Ninhydrin als Farbflecke sichtbar gemacht werden. 6.1) Siehe bei anderen Aufgaben 6.2) Antwort wie bei 1.2 (Ampholyt: Stoff des mit Säure und mit Base reagieren kann) 6.3) wie 2.2 6.4) Beantwortung ähnlich wie bei 3.3 7.4) [7.1–7.3 haben wiederholenden Charakter] Das ist die 3-Aminopropansäure, eine -Aminosäure. Alanin entspricht der 2-Aminopropansäure, die eine -Aminosäure ist. 8.1) Peptide [genauer gesagt gehört der Stoff zu den Oligopeptiden, es ist ein Tripeptid] 8.2) Bei der Hydrolyse von 1 mol des gezeigten Tripeptids entstehen 1 mol L-Alanin, 2Aminopropansäure, und 2 mol Glycin, Aminoethansäure. (Formeln s.o.) 8.3.1) siehe Aufgaben zu Kohlenhydraten: 1a) und 2a) 8.3.2) Das optisch aktive Produkt ist L-Alanin. Am C, also dem der Carboxylgruppe benachbarten Atom, befinden sich 4 verschiedenen Substituenten: H-, CH3-, NH2- und –COOH. Es handelt sich daher um ein asymmetrisches C-Atom, ein Chiralitätszentrum. Der Molekülbau ist daher asymmetrisch und von dem Stoff existieren optische Isomere (enantiomere Moleküle). Das Hydrolysat des Tripeptids enthält nur die L-Form der 2-Aminopropansäure; daraus folgt die optische Aktivität. Asymmetrische C-Atome Zuckerbestandteil (Ribose) Aromatisches Ringsystem Aminosäurerest Atome mit deutlich basischen Eigenschaften Starkes Reduktionsmittel (leicht oxidierbare –SH-Gruppe), kann Iod reduzieren Bei der Aminosäure handelt es sich um die 3-Aminopropansäure, welche auch als -Alanin bezeichnet wird. Strukturformel siehe Aufgabe 7.4. Die gezeigte Protein-Sekundärstruktur ist das -Faltblatt. Man sieht die gegenläufig parallelen Polypeptidketten. Die obere Kette läuft "von links nach rechts" (man sieht den Aminoterminus als den Kettenanfang an), die untere "von rechts nach links". In einer Falzebene liegen sich immer zwei Peptidbindungen so gegenüber, dass sich optimal Wasserstoffbrücken ausbilden können. Das rechte Bild gibt die Konfiguration des L-Aminosäurerestes richtig wieder R auf sich zukippen und von oben draufsehen das Ganze um 90° nach links drehen um C–CO.. Bindung im Uhrzeigersinn rotieren → Substituenten tauschen ihre Plätze. Jetzt entspricht es der Fischer-Projektion und es bestätigt sich die LKonfiguration