Arzneimittelentdeckung
Werbung
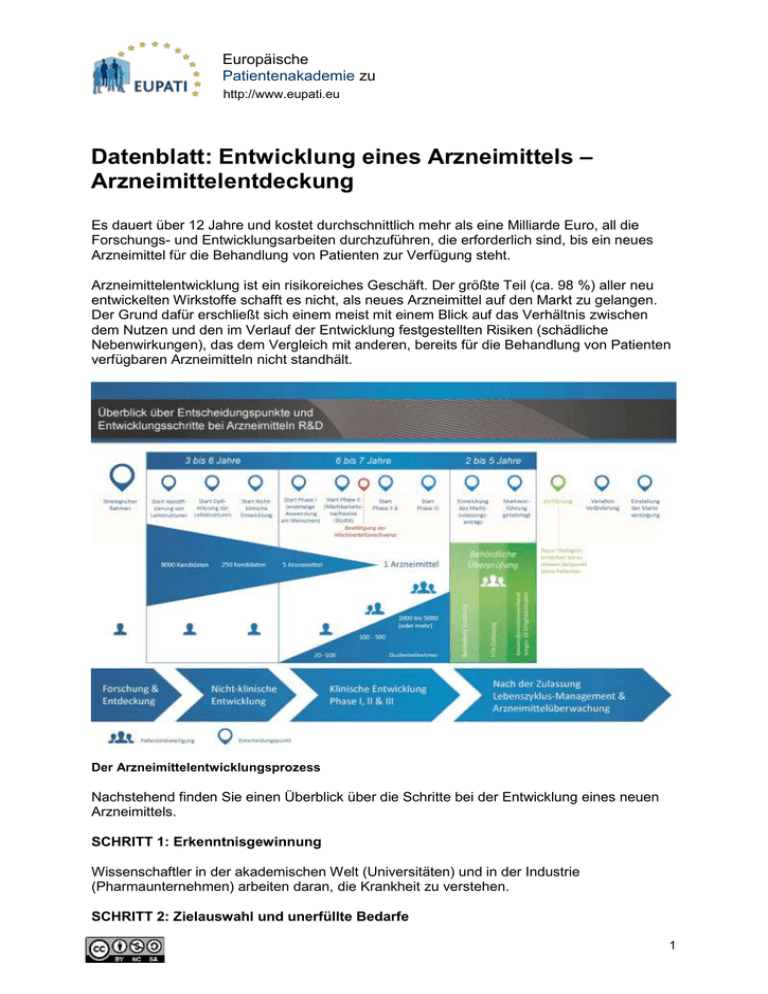
Europäische Patientenakademie zu Therapeutischen http://www.eupati.eu Innovationen Datenblatt: Entwicklung eines Arzneimittels – Arzneimittelentdeckung Es dauert über 12 Jahre und kostet durchschnittlich mehr als eine Milliarde Euro, all die Forschungs- und Entwicklungsarbeiten durchzuführen, die erforderlich sind, bis ein neues Arzneimittel für die Behandlung von Patienten zur Verfügung steht. Arzneimittelentwicklung ist ein risikoreiches Geschäft. Der größte Teil (ca. 98 %) aller neu entwickelten Wirkstoffe schafft es nicht, als neues Arzneimittel auf den Markt zu gelangen. Der Grund dafür erschließt sich einem meist mit einem Blick auf das Verhältnis zwischen dem Nutzen und den im Verlauf der Entwicklung festgestellten Risiken (schädliche Nebenwirkungen), das dem Vergleich mit anderen, bereits für die Behandlung von Patienten verfügbaren Arzneimitteln nicht standhält. Der Arzneimittelentwicklungsprozess Nachstehend finden Sie einen Überblick über die Schritte bei der Entwicklung eines neuen Arzneimittels. SCHRITT 1: Erkenntnisgewinnung Wissenschaftler in der akademischen Welt (Universitäten) und in der Industrie (Pharmaunternehmen) arbeiten daran, die Krankheit zu verstehen. SCHRITT 2: Zielauswahl und unerfüllte Bedarfe 1 Europäische Patientenakademie zu Therapeutischen http://www.eupati.eu Innovationen Krankheiten treten auf, wenn in die normalen Prozesse des Körpers eingegriffen wird oder diese nicht richtig ablaufen. Die Entwicklung eines Arzneimittels erfordert ein detailliertes (d. h. auf Zellebene) Verständnis der falschen Abläufe. Auf diese Weise kann der anormale Prozess „ins Ziel genommen“ und korrigiert werden. Das „Target“ kann ein Molekül sein, das im Übermaß produziert wurde und nun normale Körperfunktionen stört, das nicht im normalen Umfang produziert wird, oder das eine anormale Struktur aufweist. Beispielsweise kann bei Krebs eine Überproduktion eines chemischen Botenstoffs vorliegen, der die Zellen zu anormalem Wachstum anregt. Bei Diabetes liegt entweder ein Mangel bei der Insulinproduktion vor, oder aber die Zellen reagieren nicht auf normale Weise auf das Insulin. Bevor die Entwicklung einer neuen Behandlung in Angriff genommen wird, muss zudem festgestellt werden, ob ein unerfüllter Bedarf vorliegt oder nicht. Ein „unerfüllter Bedarf“ ist gegeben, wenn keine geeigneten Arzneimittel für die Behandlung der Krankheit verfügbar sind oder, wenn ein Arzneimittel für die Behandlung der Krankheit verfügbar ist, dieses von manchen Patienten aufgrund inakzeptabler Nebenwirkungen nicht eingenommen werden kann. Liegen identifizierbare Fälle mit unerfülltem Behandlungsbedarf vor, wird die Entwicklung einer neuen Behandlung fortgesetzt. SCHRITT 3: Generierung von Leitstrukturen Dieser Schritt umfasst die Suche nach einem Molekül, das mit dem „Target“ interagiert. Das Molekül kann natürlichen Ursprungs (beispielsweise ein Teil einer Pflanze) oder eine künstlich hergestellte chemische Verbindung sein. Hunderttausende von Molekülen werden getestet, um „Leitstrukturen“ – Moleküle, die mit dem „Target“ interagieren – zu finden. Das Testen auf Leitstrukturen bezeichnet man als Screeningverfahren. Moderne Robotertechnologie ermöglicht ein Hochdurchsatz-Screening. Dabei werden Millionen von Molekülen schnell getestet. Nachdem die Leitstrukturen generiert (oder gefunden) wurden, kann der Prozess zum nächsten Schritt übergehen. SCHRITT 4: Optimierung von Leitstrukturen Nachdem das Screeningverfahren Leitstrukturen identifiziert hat, müssen oftmals Modifikationen an diesen Molekülen vorgenommen werden, um ihre Wirkung zu verbessern – oftmals weisen die gefundenen Leitstrukturen nur eine geringe Wirkung auf das „Target“ auf und wären damit unmodifiziert für die Weiterentwicklung nicht geeignet. Zur Optimierung dieser Leitstrukturen verändern Chemiker das Leitstruktur-Molekül, indem sie Elemente hinzufügen oder manche der Elemente des Moleküls entfernen und auf diese Weise eine Anzahl leicht unterschiedlicher Moleküle schaffen. Das Molekül eines bereits existierenden Arzneimittels kann ebenfalls verändert oder verbessert und seine Wirkung auf diese Weise verändert werden. Computertechnologie kann auch dabei helfen, diese modifizierten Moleküle zu gestalten. Die modifizierten Moleküle werden dann getestet, um festzustellen, welche Struktur den höchsten Wirkungsgrad und die höchste Sicherheit besitzt (vom Körper am besten vertragen wird). Diese Untersuchungen helfen, Einblicke in die Pharmakologie des Moleküls (die Wirkung des Moleküls auf den Körper) zu gewinnen. Die Moleküle mit dem besten Wirkungsgrad und der höchsten Sicherheit können dann als Wirkstoffkandidat zu weiteren Testreihen vorrücken. 2 Europäische Patientenakademie zu Therapeutischen http://www.eupati.eu Innovationen Etwa zu diesem Zeitpunkt werden normalerweise die den Wirkstoffkandidaten betreffenden wissenschaftlichen und technischen Informationen (z. B. seine Molekularstruktur und Wirkung) registriert oder patentiert, um den Wirkstoffkandidaten als geistiges Eigentum zu schützen. SCHRITT 5: Nicht-klinische Sicherheitsprüfung Die Arzneimittelentwicklung unterliegt strengen Kontrollen und Reglementierungen. Das Gesetz legt mittels Regeln und Bestimmungen fest, was zu tun ist und wie es getan wird. Kein Wirkstoffkandidat kann am Menschen (in „klinischen Studien“) getestet werden, ohne dass zuvor in Tierstudien zur Unbedenklichkeit sein Sicherheitsprofil aufgestellt wurde. Diese nächste Phase des Entwicklungsprozesses, die nicht-klinische Sicherheitsprüfung, zielt darauf ab festzustellen, ob es sicher ist, mit dem Wirkstoffkandidaten in die klinischen Studien einzusteigen. Bevor die nicht-klinischen Untersuchungen durchgeführt werden können, müssen größere Mengen des Wirkstoffkandidaten hergestellt werden, damit sämtliche erforderlichen Tests durchgeführt werden können. Dieser Herstellungsprozess unterliegt strengen Richtlinien und Bestimmungen, die man „Gute Herstellungspraxis“ (Good Manufacturing Practice, GMP) nennt. Nicht-klinische Sicherheitsprüfungen umfassen Untersuchungen im Tiermodell. Diese Untersuchungen unterliegen den spezifischen Regel und Bestimmungen der Guten Laborpraxis (Good Laboratory Practice, GLP). Diese Untersuchungen bestimmen nicht nur das Sicherheitsprofil bei Tieren, sondern liefern zusätzlich wichtige Informationen zu den folgenden Aspekten: Aufnahme des Wirkstoffs im Körper (engl. Absorption) Verteilung des Wirkstoffs im Körper (engl. Distribution) Abbau des Wirkstoffs durch den Körper (engl. Metabolism) Ausscheidung des Wirkstoffs durch den Körper (engl. Excretion) Nach den Anfangsbuchstaben der englischen Bezeichnungen werden diese vier Faktoren kollektiv als „ADME“ bezeichnet. Auf Grundlage all dieser Informationen wird entschieden, ob und ggf. in welcher Dosierung der Wirkstoffkandidat erstmalig am Menschen (klinische Studie) getestet werden kann. 3