Signaltransduktion - Institut für Biochemie
Werbung

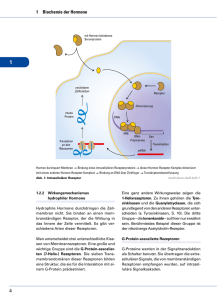
Prof. Dr. KH. Friedrich, Institut für Biochemie II Fakten und Fragen zur Vorbereitung auf das Seminar „Signaltransduktion“ Voraussetzung für einen produktiven und allseits erfreulichen Ablauf des Seminars ist, dass Sie sich vorbereitend mit den hier gegebenen Informationen (und dem Inhalt der Vorlesung...) beschäftigen. Sie sollten in der Lage sein (wird erwartet...), sich aktiv an am Seminar zu beteiligen. Beispielhaft sind einige Fragen zur Thematik weiter unten angeführt. Grundlagen und Prinzipien der Signaltransduktion „Signaltransduktion“ beschreibt die Erzeugung, Weiterleitung und Wirkung von Information in lebenden Systemen. Wir können Signaltransduktion auf verschiedenen Organisationsebenen (Moleküle, Zellen, Gewebe, der Gesamtorganismus) beobachten und unterscheiden „chemische“ und „elektrische“ Übertragung von Information. Für die Medizin ist das Gebiet von grundlegender Bedeutung, weil viele (wenn nicht letztlich alle) Krankheiten mit fehlerhaften Signaltransduktions-Prozessen assoziiert sind, deren gezielte pharmazeutische Beeinflussung zu den Zielen der angewandten Forschung gehört. Vielversprechende Entwicklungen gibt es etwa bei neurologischen und Tumorerkrankungen oder chronischen Entzündungsprozessen. Signalvermittelnde Botenstoffe gehören unterschiedlichen chemischen Substanzklassen an. Bei vielen handelt es sich um Proteine oder Peptide. Manche Signalstoffe sind niedermolekulare Substanzen wie Aminosäure-Abkömmlinge oder Fettsäure-Derivate. Steroide stammen vom Cholesterol ab. Sie sind aufgrund ihres lipophilen Charakters fähig, Membranen zu durchdringen und finden ihre Rezeptoren im Cytoplasma, die meisten anderen Signalmoleküle bedienen sich jedoch membranständiger Rezeptoren zur Signalvermittlung ins Zellinnere. Rezeptoren und Liganden: Signalauslösung Rezeptoren lassen sich in Familien mit gemeinsamen strukturellen und funktionellen Eigenschaften gruppieren. Eine grundsätzliche Unterscheidung ist zunächst die in membranständige und intrazelluläre Rezeptoren. Intrazelluläre Rezeptoren sind solche für lipophile und damit membrangängige Liganden wie Steroide. Sie werden durch Bindung des Liganden in ihrer Konformation verändert und können dadurch in den Zellkern wandern. Dort wirken sie als Genregulatoren. Bei den Membranrezeptoren kennt man ligandenabhängige Ionen-Kanäle und Membranproteine, die direkt Signale ins Zellinnere weiterleiten. Sie tun dies entweder, indem durch ligandeninduzierte Aktivierung eine intrinsische enzymatische Aktivität angeschaltet oder durch Vermittlung von intrazellulären G-Proteinen die Bildung von „Second Messengern“ im Zellinneren ausgelöst wird. Signalvermittelnde Liganden gehen spezifische, hochaffine Wechselwirkungen mit den Rezeptoren ein. Durch die Ligandenbindung werden die Rezeptoren “aktiviert”, was mit Di- oder Oligomerisierungsvorgängen und/oder Konformationsänderungen einhergeht. Typisch für enzymatisch aktive Rezeptoren ist die Aktivierung durch ligandeninduzierte Dimerisierung. G-Protein-gekoppelte Rezeptoren haben sieben Transmembrandomänen und werden durch die Bindung des Liganden in ihrer Konformation so verändert, dass sie ihrerseits intrazelluläre G-Proteine aktivieren können. Wege intrazellulärer Signaltransduktion: Protein-Phosphorylierung, Proteinkomplexe, Second Messenger Aktivierte Rezeptoren tragen Signale ins Zellinnere, indem sie nachgeschaltete Reaktionswege starten und modulieren. Am Ende derartiger „Pathways“ erreicht das Signal den Zellkern und die DNA. Es kommt zur spezifischen Beeinflussung der Transkription von Zielgenen und zur Realisierung zellulärer Programme wie Proliferation, Differenzierung und Zelltod. So kompliziert die zelluläre Signalverarbeitung auch erscheinen mag, beruht sie doch auf wenigen generellen Mechanismen: Reversible kovalente Protein-Modifikation Ihre wichtigste Art ist die Phosphorylierung. Reversible Proteinphosphorylierung von Serin/Threonin- und Tyrosin-Resten durch Kinasen und Phosphatasen ist in eukaryontischen Zellen die vorherrschende Strategie, die Aktivität von Proteinen zu kontrollieren. Reversible Bildung von Multiprotein-Komplexen Vorübergehendes Zusammenlagern von Signalproteinen (etwa im Komplex mit aktivierten Rezeptoren) ist ein Weg, Signale gezielt auf spezifischen Wegen weiterzuleiten. Viele an der Signaltransduktion beteiligte Proteine sind “modular” aufgebaut: Charakteristische Proteindomänen und Sequenzmotive tauchen in verschiedenen Kombinationen immer wieder auf und haben spezielle Bindungseigenschaften. Besonders wichtig ist die sehr verbreitete SH2- („Src homology 2“-) Domäne. SH2-Domänen sind für die spezifische Wechselwirkung von Proteinen mit phosphorylierten Tyrosinen und ihrer jeweiligen Umgebung in den jeweiligen Bindungspartnern verantwortlich und haben daher eine zentrale Bedeutung für Signalprozesse, die mit Tyrosinphosphorylierungen einhergehen. Reversible Aktivierung von Schalterproteinen G-Proteine sind Beispiele für molekulare Schalter. Wenn sie GTP gebunden haben, befinden sie sich in einer aktiven Konformation und können Signale weiterleiten, haben sie jedoch statt dessen GDP gebunden (das durch Hydrolyse des GTP entsteht), sind sie inaktiv. Erzeugung intrazellulärer „Second Messenger“ Manche Rezeptoren bedienen sich sogenannter “Second Messenger”, kleiner Moleküle, die in der Zelle die Aktivität nachgeschalteter Enzyme steuern. Der bekannteste Second Messenger ist cyclisches AMP (cAMP). Funktionsweise von Rezeptoren mit Tyrosinkinase-Aktivität und von G Proteingekoppelten Rezeptoren Viele Rezeptoren, insbesondere solche für Wachstumsfaktoren, leiten Signale weiter, indem bei ihrer Aktivierung eine intrazelluläre, enzymatische Aktivität angeschaltet wird. Es handelt sich dabei um eine Tyrosinkinase-Aktivität, die zur Phophorylierung von Substratproteinene an Tyrosinresten führt. Sie zeigen als membranständige Proteine zwei Domänen: die extrazelluläre, ligandenbindende Domäne ist über einen zellmembran-durchspannenden Teil mit der intrazellulären, katalytischen Domäne verbunden ist. Die Rezeptoren werden durch die Bindung des extrazellulären Liganden dimerisiert. Die Dimerisierung pflanzt sich zur cytoplasmatischen Domäne fort und führt dort durch die Annäherung der Tyrosinkinase-Domänen zu deren gegenseitiger Aktivierung. Das Ergebnis ist eine Trans-Phosphorylierung der Rezeptormoleküle an Tyrosin-Resten, eine Voraussetzung für anschließende Signalprozesse. Die phosphorylierten Rezeptoren dienen nun als Bindungspartner für SH2 Domänen-Proteine, die dann das Signal ins Zellinere weitertragen. Ganz anders arbeiten G-Protein-gekoppelte Rezeptoren (GCRs). Typisch für die Aktivität von GCRs ist die Entstehung von „Second Messengers“. Die Signalvermittler von GCRs sind heterotrimere G-Proteine, bestehend aus α-, β- und γ-Untereinheit. Die Bezeichnung der G-Proteine rührt daher, dass gebundene Guanosin-Nucleotide ihre Aktivität regulieren. Die α-Untereinheit kann GTP oder GDP binden, wobei die GTP-bindende Form die aktive ist. Die Aktivierung von GCRs durch ihre Liganden bewirkt, dass die α-Untereinheiten von G-Proteinen bevorzugt GTP binden, dadurch von den β- und γ-Untereinheiten abdissoziieren und in diesem Zustand Effektorenzyme regulieren können, die wiederum Second Messenger wie cAMP und Inositoltrisphosphat/Diacylglycerol produzieren. Die aktivierte, GTP-beladene α-Untereinheit vieler G-Proteine kann die membranassoziierte Adenylatcyclase stimulieren, die aus ATP cAMP bildet. Wichtigste Zielstruktur des Second Messengers ist nun die Proteinkinase A (PKA), deren Aktivität durch cAMP angeschaltet wird. Die PKA spielt u.a. eine zentrale Rolle bei der Kontrolle des Glycogen-Stoffwechsels, indem sie u.a. eine positive Regulation glycogen-abbauender Enzyme bewirkt. Es gibt ein weiteres wichtiges Second Messenger-System, das aus zwei Komponenten besteht: Das Membranlipid Phosphatidylinositid-bisphosphat (PIP2) ist Ausgangssubstanz für die beiden Signalmoleküle Diacylglycerol (DAG) und Inositidtris-phosphat (IP3), die durch die Phospholipase C (PLC) aus PIP2 gebildet werden. Die PLC wird, analog zur Adenylatcyclase (s.o.) durch GTP-beladene G-Proteine aktiviert. Ähnlich dem cAMP beeinflussen DAG und IP3 nachgeschaltete Enzyme. Das membraneingelagerte DAG aktiviert die membranständige Proteinkinase C, deren Substrate an der Kontrolle der Zellproliferation beteiligt sind. Das lösliche IP3 ist hingegend von großer Bedeutung für die Regulation der intrazellulären Konzentration von Ca2+, indem es z.B. Ca2+-Kanäle in den Membranen von cytoplasmatischen Calcium-Speichern beeinflusst. Es gibt verschiedene Mechanismen, die schließlich wieder zum Abbau von Second Messengers und damit zu einer Signalbegrenzung führen. So wird cAMP durch das Enzym cAMP-Phosphodiesterase wieder entfernt, d.h. zu AMP abgebaut. G-Proteine besitzen zudem eine intrinsische GTPase-Aktivität, die sie ständig mit einer gewissen Rate in den inaktiven, GDP-gebundenen Zustand zurückführt. Fragen zum Verständnis und zur Selbstkontrolle: 1.) Wie wird eine Rezeptor-Tyrosinkinase aktiviert und wie gibt sie Signale ins Zellinnere weiter? 2.) Welche Aminosäuren in Proteinen können phosphoryliert werden? Kennen Sie Beispiele für die funktionelle Bedeutung solcher Aminosäurespezifischen Phosphorylierung in Signaltransduktion und Zellphysiologie? 3.) Wie ist die Funktionsweise von heterotrimeren G-Proteinen? 4.) Was sind und tun Adenylatcyclase und Proteinkinase A? 5.) Welche Funktion hat die Phospholipase C? 6.) Welche Wirkungen haben die second messenger cAMP, DAG und IP3 ? 7.) Wie wird die WIrkung von second messengern begrenzt und beendet? 8.) Wichtig: Welche Beispiele von krankheitsauslösenden Fehlfunktionen der Signaltransduktion kennen Sie? Gibt es therapeutische Möglichkeiten?