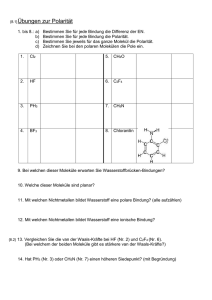
Studienbrief Moleküle
Werbung

PHYSIK Studienbrief Moleküle AUTOR: Dr. Johannes Bernardi PHYSIK / Studienbrief Moleküle - Inhalt: 1 Einführung .................................................................................................................................3 2 Ionenbindung (heteropolare Bindung): A+B- ............................................................................4 3 Kovalente Bindung (chemische Bindung): A-B .......................................................................6 4 Van der Waals Bindung .............................................................................................................7 5 Wasserstoffbindung ...................................................................................................................8 6 Mehratomige Moleküle..............................................................................................................9 7 Energie und Spektren von Molekülen......................................................................................10 7.1 Rotationsenergieniveaus..................................................................................................10 7.2 Schwingungsenergieniveaus............................................................................................12 7.3 Molekülspektren ..............................................................................................................12 8 Übungsteil ................................................................................................................................15 AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 2/16 - PHYSIK / Studienbrief Moleküle - 1 Einführung In einem vorangegangenen Studienbrief wurde der Aufbau der Atome beschreiben und das Periodensystem der Elemente erklärt. In der Natur tritt nur ein Bruchteil der chemischen Elemente als einzelne Atome auf (Edelgase). Die Mehrzahl der Elemente findet man in Form von Verbindungen, den sogenannten Molekülen, oder als regelmäßige Anordnung in Form von kristallinen Festkörpern. Die einfachsten Moleküle bestehen aus zwei gleichen Atomen, z.B. Sauerstoff (O2) oder Stickstoff (N2) in unserer Atemluft. Atome verbinden sich zu Molekülen, da ihre Gesamtenergien als stabil gebundene Moleküle geringer sind, als die Gesamtenergien der einzelnen freien Atome. Versucht man die Atome eines Moleküls aus der stabilen Gleichgewichtslage zu entfernen, so muß eine Kraft aufgewendet werden. Die Bindung zwischen Atomen geschieht hauptsächlich aufgrund der elektrostatischen anziehenden oder abstoßenden Kräfte. Sind die Atome genügend weit voneinander entfernt, so wirken keine Kräfte zwischen ihnen. Werden sie näher zusammengebracht, so wirken sowohl anziehende als auch abstoßende Kräfte zwischen ihnen. Erst wenn zwischen einzelnen Atomen nur mehr sehr kleine Entfernungen sind, überwiegen die abstoßenden Kräfte zwischen gleichen Ladungen. E pot r0 0 r Die Grafik beschreibt die potentielle Energie zweier Atome in Abhängigkeit von ihrem Abstand. Wenn sich die beiden Atome nähern, so verringert sich ihre potentielle Energie und erreicht ein Minimum bei Erreichen des Gleichgewichtsabstandes r0. Ein weiteres Annähern der Atome würde zu einem Ansteigen der potentiellen Energie führen aufgrund der Abstoßung gleicher Ladungen. In diesem Studienbrief werden nun die grundlegenden Bindungsarten zwischen einzelnen Atomen beschrieben: ionische Bindung, kovalente Bindung, van der Waals Bindung und Wasserstoff-Bindung. Eine genaue Beschreibung der Struktur von Molekülen ist nur mit Hilfe der Quantenmechanik möglich. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 3/16 - PHYSIK / Studienbrief Moleküle - 2 Ionenbindung (heteropolare Bindung): A+BFür die Bindungseigenschaften der Ionenbindung ist die Coulombanziehung zwischen positiven und negativen Ionen verantwortlich. Die Zuordnung der Elektronen zu den einzelnen Ionen ist aufgrund der Elektronenverteilung möglich. Jedes Atom hat seine eigenen Elektronen. Um den ionischen Bindungscharakter hervorzuheben, kann man bei der Schreibweise der chemischen Formel die positiven und die negativen Ionen besonders hervorheben (z.B.: Na + Cl − ). Die Ionenbindung ist am einfachsten zu beschreiben und tritt in vielen Salzen auf, z.B. Kochsalz, NaCl. Na besitzt die Elektronenkonfiguration 1s22s22p63s1. Die inneren beiden Elektronenschalen sind vollständig aufgefüllt. Die äußerste 3s Elektronenschale besitzt ein einzelnes Elektron, das leicht entfernt werden kann. Die Energie, die benötigt wird um dieses Elektron zu entfernen, beträgt etwa 5.1 eV und wird Ionisationsenergie genannt (im Vergleich dazu hat das Elektron eines Wasserstoffatoms eine Ionisationsenergie von 13.6 eV). Durch das Entfernen des einzelnen 3s Elektrons erhält man ein positiv geladenes Natrium-Ion mit einer kompletten äußeren Elektronenschale. Chlor hat die Elektronenkonfiguration 1s22s22p5. Ein einziges 2p-Elektron fehlt auf die aufgefüllte 2p-Elektronenschale von Argon. Durch Auffüllen der äußeren Elektronenschale erhält man das einfach negativ geladene Cl − Ion, das energetisch stabiler ist als das neutrale Cl Atom. Die Energie, die freigesetzt wird wenn ein Atom ein zusätzliches Elektron aufnimmt, wird als Elektronenaffinität bezeichnet. Für Chlor, die Elektronenaffinität ist 3.6 eV. Um also aus einem neutralen Na und Cl Atom ein Na + Ion und ein Cl − Ion zu bilden, müßte die Energie 5.1 eV - 3.6 eV = 1.5 eV aufgewendet werden. Dabei werden die beiden Ionen sehr weit voneinander entfernt (im Idealfall unendlich weit) angenommen. V(r) [eV] 5 ( 1,5 eV Na + + Cl− 0 -5 0,5 4,3 eV 1,0 1,5 ) r [nm] 0,24 nm AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 4/16 - PHYSIK / Studienbrief Moleküle - In dem Diagramm ist die potentielle Energie V(r) der beiden Ionen Na + und Cl − in Abhängigkeit vom Abstand r zwischen den beiden Atomkernen aufgetragen. Die potentielle Energie beträgt für r Æ ∞ 1.5 eV, das ist die Energie, die nötig wäre, zwei getrennte Na + und Cl − Ionen aus den neutralen Atomen zu erzeugen. Werden ein neutrales Na und Cl Atom einander genähert, so ist es erst ab einem Abstand < 0,95 nm energetisch günstiger, ein positives Na + Ion und ein negatives Cl − Ion anstelle der neutralen Atome zu bilden. Natrium gibt ein Elektron an das Cl Atom ab und es bildet sich das Molekül Na + Cl − . Die elektrostatische Anziehungskraft zwischen den beiden Ionen bewirkt eine weitere Annäherung. Das Energieminimum von -4,3 eV ist bei einem Abstand der beiden Kerne von rund 0,24 nm erreicht. Eine weitere Annäherung der Atome ist dann nur noch möglich, wenn Energie aufgewendet wird. Die Ursache dafür liegt in der Überlappung der Elektronenschalen der inneren Elektronen und im Pauli-Prinzip. Ein bestimmter Quantenzustand kann demnach nur durch maximal ein Elektron besetzt sein. Ein Zusammenführen der beiden Atome über den Gleichgewichtszustand hinaus führt zu einer Überlappung der Wellenfunktionen. Aufgrund des Pauli-Verbotes müssen daher Elektronen Zustände mit höheren Quantenzahlen einnehmen, was nur unter Energiezufuhr möglich ist. Der typische Verlauf der potentiellen Energie bei der ionischen Bindung beruht auf der • elektrostatischen Anziehung der unterschiedlich geladenen Ionen und der • Abstoßung der Ionen bei kleinen Abständen aufgrund des Pauli-Verbotes. Die Energie, die benötigt wird, um ein ionisch gebundenes Molekül aus dem Gleichgewichtszustand (= Energieminimum) in die neutralen Atome (V=0) umzuwandeln, nennt man Dissoziationsenergie. Für ein NaCl Molekül beträgt die Dissoziationsenergie rund 4.3 eV. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 5/16 - PHYSIK / Studienbrief Moleküle - 3 Kovalente Bindung (chemische Bindung): A-B Die ionische Bindung tritt vor allem zwischen Atomen auf, bei denen durch Austausch von Elektronen energetisch günstige abgeschlossene Elektronenschalen gebildet werden. Beispiele dafür sind Molekülverbindungen der Alkaligruppe (z.B. Li, Na, K) mit den Halogenen (z.B.: F, Cl, Br). Sehr oft treten jedoch Moleküle aus gleichen Atomen auf oder Verbindungen zwischen Atomen, bei denen aufgrund der Energiebilanz keine ionische Bindung nicht möglich ist (z.B. H2, O2, N2, CO, CO2, H2O, CH4). Wenn man die Energie berücksichtigt, die notwendig wäre um die positiv und negativ geladenen Ionen zu bilden, sowie die elektrostatische Anziehungsenergie, so findet man z.B. für ein H2-Molekül keinen möglichen Abstand zwischen den Atomen, bei dem die Gesamtenergie negativ wird und daher einen energetisch bevorzugten Zustand darstellt. In diesem Fall kann also durch die ionische Bindung kein H2 Molekül gebildet werden. In diesen Molekülen wird die Stabilität durch die sogenannte kovalente Bindung gewährleistet. Die kovalente Bindung zeichnet sich dadurch aus, das mehrere Atome einen Teil der äußeren Elektronen gemeinsam besitzen. Beim H2 Molekül gehören die beiden vorhandenen Elektronen zu den Hüllen beider Protonen. Eine wichtige Rolle bei der kovalenten Bindung spielen die Symmetrieeigenschaften der quantenmechanischen Wellenfunktionen der Elektronen. Man kann die kovalente Bindung bei der Schreibweise der chemischen Formel hervorheben, indem man für jedes gemeinsame Elektron zwischen den Atomen einen Bindestrich schreibt (z.B.: H-H, O=O, N≡N). Ionenbindung und chemische Bindung sind zwei Extremfälle, zwischen denen die Bindung realer Moleküle liegt. So ist die Bindung zwischen gleichen Atomen stets rein kovalent, während bei verschiedenen Atomen oft eine Mischung zwischen kovalenter und ionischer Bindung auftritt. Durch Messung des Dipolmomentes p = q ⋅ l läßt sich der Anteil der ionischen Bindung abschätzen. Der Gleichgewichtsabstand r0 der beiden Ionen des Na + Cl − Moleküls beträgt etwa 0,24 nm. Da beide Ionen je eine positive bzw. negative Elementarladung besitzen, errechnet man für das Dipolmoment: p = q ⋅ l = e ⋅ r0 = 1,6 ⋅ 10 −19 C ⋅ 0,24 ⋅ 10 −9 m = 0,38 ⋅ 10 −29 Cm Der experimentell gemessene Wert pexp = 0,30 ⋅ 10 −29 Cm beträgt nur 79 % des errechneten Wertes des Dipolmomentes. Die Differenz erklärt sich, daß neben der ionischen Bindung auch ein kleinerer Anteil kovalenter Bindung vorhanden ist. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 6/16 - PHYSIK / Studienbrief Moleküle - 4 Van der Waals Bindung Zwischen Atomen mit abgeschlossenen Elektronenschalen (Edelgase) oder zwischen Molekülen sind keine ionische oder kovalente Bindungen möglich. Dennoch gibt es zwischen ihnen Verbindungen aufgrund der Van der Waals Kräfte, die auf der elektrostatischen Anziehung zwischen elektrischen Dipolen beruhen. Die Van der Waals Kräfte sind viel schwächer als die Anziehungskräfte bei der ionischen oder der kovalenten Bindung. Sie sind dafür verantwortlich, daß Gase bei genügend tiefen Temperaturen zu Flüssigkeiten und bei noch tieferen Temperaturen zu Festkörpern kondensieren. Die Verbindung aufgrund der Van der Waals Kräfte kann daher oft schon durch geringe Energiezufuhr, z.B. einer kleinen Temperaturerhöhung, aufgehoben werden. Man unterscheidet zwischen verschiedenen Arten der schwachen Bindungskräfte zwischen Molekülen: • Dipol-Dipol-Kräfte zwischen Molekülen mit permanenten elektrischen Dipolmomenten, sogenannte polare Moleküle (z.B. H2O) H O + - p + H H O + - p H + • Dipol-induzierte Dipol-Kraft, bei der ein Molekül mit einem permanenten elektrischen Dipolmoment ein Dipolmoment in einem Molekül ohne Dipolmoment, einem nicht polaren Molekül, induziert • Van der Waals Kräfte zwischen zwei nicht polaren Molekülen oder Atomen, bei denen das durchschnittliche Dipolmoment Null ist, aber aufgrund von Ladungsdichtenfluktuationen kurzfristig Dipolmomente entstehen, die zu einer Anziehung von Atomen oder Molekülen führen können. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 7/16 - PHYSIK / Studienbrief Moleküle - 5 Wasserstoffbindung Wasserstoff hat nur ein einziges Elektron und bildet gewöhnlicher Weise kovalente Bindungen mit anderen Atomen. Es gibt jedoch auch Fälle, in denen ein Wasserstoffatom eine Bindung mit mehr als einem Atom eingeht. Diese Bindung wird als Wasserstoffbindung oder als Wasserstoffbrückenbindung bezeichnet. Sie ist eine relativ schwache Bindung mit einer Bindungsenergie von etwa 0,1 eV. Der Wasserstoffbrückenbindung kommt, trotz ihrer schwachen Bindung, eine entscheidende Bedeutung bei der Bildung von großen biologischen Molekülen zu. Beim Aufbau der DNA (siehe Abbildung) bilden die Wasserstoffatome die Bindeglieder zwischen den beiden Ästen der Helixstruktur. Bei der Wasserstoffbindung wird durch die gleichzeitige Verwendung eines Protons zwischen zwei Atomen eine Bindung hergestellt. Dieser Mechanismus ist ähnlich zur kovalenten Bindung, bei der ein Elektron von zwei Atomen gleichzeitig verwendet wird und dadurch die kovalente Bindung erzeugt. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 8/16 - PHYSIK / Studienbrief Moleküle - 6 Mehratomige Moleküle Die wichtigste Bindungsform bei mehratomigen Molekülen ist die kovalente Bindung, bei der die bindenden Elektronen zugleich zu zwei Atomen gehören, d.h. die Wellenfunktionen der äußeren Elektronen müssen sich überlappen. Die Struktur, d.h. der räumliche Aufbau, der Moleküle läßt sich mit Hilfe der Quantenmechanik erklären. Abhängig von ihrer Wellenfunktion besitzen die Elektronen eine räumliche Verteilung, die graphisch als sogenannte Orbitale dargestellt werden. Ein Orbital kann dabei je 2 Elektronen mit unterschiedlichem Spin aufnehmen. Als Beispiel ist hier die Struktur des Wassermoleküls (H2O) erklärt. Wasserstoff besitzt nur ein s-Elektron (1s1). Sauerstoff besitzt die Elektronenkonfiguration 1s22s22p4. Zwei Elektronen fehlen auf die voll aufgefüllte äußerste Elektronenschale. s - Elektronen besitzen eine kugelsymmetrische Elektronendichteverteilung (in der Abbildung ist das 1s-Orbital dargestellt). Im Fall des H-Atoms ist das 1s-Orbital mit einem einzelnen Elektronen besetzt.. Es gibt sechs 2p-Elektronen, die in 3 Orbitalen angeordnet sind (Orbitale von d oder fElektronen sind entsprechend komplizierter aufgebaut). Im Wassermolekül sind zwei der drei 2p Orbitale des Sauerstoffatoms nur mit einem Elektron aufgefüllt und teilen sich daher je ein 1s Elektron jedes Wasserstoffatoms. Dadurch erhält das O-Atom eine 2p6- und die beiden H-Atome eine energetisch günstige 1s2-Konfiguration Die durch die kovalente Bindung entstehende Ladungsdichteverteilung der nun aufgefüllten 2p Orbitale ist dann jedoch nicht mehr symmetrisch um den Koordinatenursprung, ebenso ist der Winkel zwischen den beiden bindenden Orbitalen nicht mehr 90° sondern rund 105°, was sich auch quantenmechanisch berechnen läßt. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 9/16 - PHYSIK / Studienbrief Moleküle - 7 Energie und Spektren von Molekülen Die Struktur und die Eigenschaften von Molekülen können, ähnlich wie bei Atomen, durch die Untersuchung der absorbierten oder emittierten Strahlung erforscht werden. Dabei emittieren Moleküle elektromagnetische Strahlung beim Übergang von einem angeregten Energiezustand in einen tiefergelegenen. Ebenso muß beim Übergang in einen höheren Energiezustand Strahlung absorbiert werden. Aus den dabei gewonnenen Spektren der Moleküle erhält man Aussagen über die Energieniveaus und damit über Struktureigenschaften der untersuchten Moleküle. Die Energie eines Moleküls setzt sich aus mehreren Anteilen zusammen: • elektrische Energie, aufgrund von Wechselwirkungen zwischen Elektronen und Nukleonen des Moleküls • Translationsenergie aufgrund der Bewegung des Massenschwerpunktes des Moleküls (die Translationsenergie hängt jedoch nicht von der inneren Struktur des Moleküls ab) • Rotationsenergie, aufgrund der Rotation des Moleküls um Massenschwerpunkt • Schwingungsenergie, verursacht durch Schwingungen der Atome des Moleküls Diese Energien sind so unterschiedlich, daß man sie für Routineuntersuchungen getrennt voneinander betrachten kann. Die elektrische Energie zur Anregung von Elektronen ist in der Größenordnung von einigen eV. Die Schwingungs- und Rotationsenergien sind weitaus geringer. 7.1 Rotationsenergieniveaus Im einfachen Fall eines zweiatomigen Moleküls existieren nur zwei Freiheitsgrade für die Rotation, beide senkrecht zur Verbindungsachse der beiden Atome. z x AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 y Seite 10/16 - PHYSIK / Studienbrief Moleküle - Die Rotation um die Verbindungsachse kann vernachlässigt werden. Die Rotationsenergie E rot = 1 2 Iω , 2 wobei I das Trägheitsmoment des Moleküls ist und ω die Winkelgeschwindigkeit. Man kann die Rotationsenergie auch durch den Drehimpuls L ausdrücken. E rot L2 = 2I mit L = Iω . Das Trägheitsmoment des Moleküls ist gegeben durch m ⋅m I = 1 2 ⋅ r 2 = µ ⋅ r 2 , m1 + m2 dabei ist µ die reduzierten Masse des Moleküls und r der Abstand zwischen den beiden Atomen. Klassisch gesehen ist jeder Drehimpuls L für das Molekül erlaubt, die Quantenmechanik jedoch erlaubt nur quantisierte Drehimpulse L: L = J ( J + 1) h J = 0,1,2,3,.. ( Rotationsquantenzahl ). .. Die Energieniveaus der Rotation sind somit gegeben durch: E rot = J ( J + 1) 2 h , 2I sie hängen vom Trägheitsmoment I ab. Der Abstand benachbarter Energieniveaus liegt für die meisten Moleküle im Frequenzbereich von Mikrowellen ( f ≈ 1011 Hz). AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 11/16 - PHYSIK / Studienbrief Moleküle - 7.2 Schwingungsenergieniveaus Man kann sich ein Molekül vereinfacht als ein System von zwei oder mehr Atomen vorstellen, die durch „Feder“ miteinander verbunden sind. Wird im Fall eines zweiatomigen Moleküls der Abstand zwischen den Atomen verändert, so beginnt das Molekül zu schwingen. Die Schwingungsfrequenz ν eines harmonischen Oszillators beträgt nach der klassischen Mechanik ν= 1 2π k µ , mit der Federkonstanten k und der reduzierten Masse µ der beiden Atome. Quantenmechanisch betrachtet erhält man für die erlaubten Energieniveaus eines harmonischen Oszillators 1 ESchwing = v + hν 2 v = 0,1, 2, 3,.... Schwingungsquantenzahl . Die einzelnen Energieniveaus haben jeweils einen Abstand von hν. Typische Frequenzen der Molekülschwingungen liegen in der Größenordnung von 5 .1013 Hz was einer Energie von rund 0,2 eV entspricht. Die Übergänge zwischen verschiedenen Energieniveaus liegen im Infrarotbereich, d.h. ein Photon mit der Frequenz im Infrarotbereich muß durch das Molekül absorbiert werden, damit das Molekül ein höheres Schwingungsenergieniveau einnimmt. 7.3 Molekülspektren In der Molekülspektroskopie unterscheidet man zwischen Emissions- und Absorptionsspektren. Beim Übergang von einem angeregten Energieniveau in ein tiefer liegendes werden Photonen im oder nahe beim sichtbaren Bereich des Spektrums emittiert. Daher werden Emissionsspektren von Molekülen auch als optische Spektren bezeichnet. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 12/16 - PHYSIK / Studienbrief Moleküle - Anmerkung: der sichtbare Bereich des Spektrums hat eine Wellenlänge von 400 nm (blau) bis 700 nm (rot). Der anschließende Wellenbereich zu größeren Wellenlängen wird als Infrarotbereich bezeichnet. Im allgemeinen rotiert und schwingt ein angeregtes Molekül gleichzeitig. Man kann als Näherung diese beide Bewegungen als unabhängig voneinander betrachten. Die gemeinsame Energie ergibt sich als die Summe der Rotationsenergie und der Schwingungsenergie E Schwing = J ( J + 1) 1 h2 + v + hν . 2I 2 Jeder Energiezustand ist durch zwei Quantenzahlen, J und v, definiert. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 13/16 - PHYSIK / Studienbrief Moleküle - Die Abbildung zeigt mögliche Energiezustände, wie sie bei einem zweiatomigen Molekül bei der Absorption eines Photon auftreten können wenn das Molekül aus dem Schwingungsgrundzustand (v=0) in den ersten angeregten Schwingungszustand (v=1) übergeht. Für ein solches Molekül gilt die quantenmechanische Auswahlregel ∆J = ±1 , d.h. es sind nur Übergänge erlaubt, bei denen sich die Rotationsquantenzahl J um 1 ändert. Zu jedem erlaubten Schwingungszustand v gibt eine Satz erlaubter Rotationszustände J. Für jeden erlaubten Übergang erhält man eine Linie in Spektrum. Der Energieunterschied zwischen benachbarten Rotationszuständen ist dabei viel geringer als zwischen benachbarten Schwingungszuständen. Die Abbildung zeigt einen Auschnitt aus einem Absorptionsspektrum von gasförmigen HCl. Die "Lücke" im Spektrum bei 8,65 x1013 Hz entspricht der Energie hν beim Übergang zwischen zwei benachbarten Schwingungsniveaus. Aufgrund der Auswahlregel ∆J = ±1 ist dieser Übergang jedoch verboten und wird auch nicht beobachtet. Die beiden "Banden" rechts und links der Frequenz ν resultieren von den Rotationsübergängen mit ∆J = −1 (links) und ∆J = +1 (rechts). Die Frequenzen des Absoptionsspektrum entsprechen Wellenlängen von etwa 3200 - 3800 nm und liegen im Infrarotbereich des Spektrums. AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 14/16 - PHYSIK / Studienbrief Moleküle - 8 Übungsteil • Warum verbinden sich Atome zu Molekülen? • Zählen Sie die wichtigsten Bindungsmechanismen für Moleküle auf. • Nennen Sie die Voraussetzungen für eine Ionenbindung? • Welche Elemente besitzen eine vollkommen aufgefüllte äußere Elektronenschale? • Welche Aussage ist richtig: die potentielle Energie eines Moleküls • ist gleich Null im Grundzustand • ist maximal im Grundzustand • ist minimal im Grundzustand • Was bewirkt die Anziehung der Ionen bei der ionischen Bindung? • Warum können sich die Ionen nicht beliebig weit nähern? • Welche Atome gehen bevorzugt eine kovalente Bindung ein? • Stickstoff besitzt folgende Elektronenkonfiguration der äußeren Elektronenschale: 2s 2 2 p 3 . Wie viele Elektronen muß Stickstoff mit einem anderen Atom bei einer kovalenten Bindung teilen, damit eine Edelgaskonfiguration erreicht wird? • Wie läßt sich der Anteil der ionischen Bindung abschätzen? • Beispiel: Der Abstand zwischen dem H Atom und dem Cl Atom im HCl Molekül beträgt 0,13 nm. Das experimentell gemessene Dipolmoment beträgt 3,6x10-30 Cm. Wie hoch ist der ionische Anteil bei dieser Bindung? • Welche Bindung können Edelgase eingehen? • Aus welchen Energiebeiträgen setzt sich die Energie eines Moleküls zusammen? • Überlegen Sie sich: warum kann man bei der Berechnung der Rotationsenergieniveaus eines zweiatomigen Moleküls die Rotation um die Verbindungsachse vernachlässigen? • Wovon hängen die Energieniveaus der Rotation eines Moleküls ab? • Mit welchem Modell kann man sich die Schwingungsenergieniveaus erklären? AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 15/16 - PHYSIK / Studienbrief Moleküle - • Wie groß ist der Energieunterschied zwischen zwei benachbarten Schwingungsenergieniveaus eines Moleküls? • In welchem Energiebereich (Frequenzbereich) schwingen üblicherweise Moleküle? AUTOR: Dr. Johannes Bernardi / Stand: 27. April 2000 Seite 16/16 -