Die Pertussis-Impfung in der hausärztlichen Praxis
Werbung

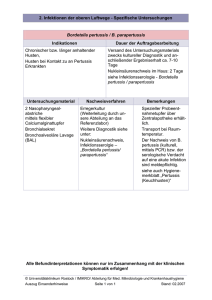
Die Pertussis-Impfung in der hausärztlichen Praxis Autor: Dr. med. Dietmar Beier Facharzt, Vorsitzender der Sächsischen Impfkommission, Chemnitz Redaktion: Dr. Anne Domonell KW medipoint, Köln www.pfizermed.de Pfizer Pharma GmbH · Linkstraße 10 · 10785 Berlin Seite 2 | Die Pertussis-Impfung in der hausärztlichen Praxis Korrespondenz Dr. med. Dietmar Beier Facharzt Vorsitzender der Sächsischen Impfkommission Chemnitz Zschopauer Str. 87, 09111 Chemnitz Tel.: +49 351- 8144 3100 Fax: + 49 351- 8144 3110 E-Mail: [email protected] Einleitung Pertussis ist eine hoch kontagiöse und langanhaltende bakterielle Infektionskrankheit der Atemwege. Generell kann sie ganzjährig auftreten – mit einer erhöhten Inzidenz im Herbst und Winter. Trotz einer guten Durchimpfungsrate bei jüngeren Kindern – 2012 waren 95 % der Schulanfänger geimpft [RKI 2014c] – kommt es etwa alle vier bis sechs Jahre zu einem zyklischen Anstieg der Krankheitsfälle [Broutin et al. 2010]. Die letzte Krankheitswelle, bei der 42 Fälle je 100.000 Einwohner auftraten, wurde in Deutschland 2011/2012 verzeichnet und brachte die Pertussis wieder in den Fokus der Öffentlichkeit. Bereits seit 2002 (in Sachsen seit November 1995) besteht in den neuen Bundesländern eine kontinuier­liche Pertussis-Meldepflicht, die aufgrund der Änderung des Infektionsschutzgesetzes (IfSG) 2013 auf eine bundesweite Meldepflicht erweitert wurde. Belastbare Daten zur Entwicklung und Häufigkeit der Pertussis in Deutschland beziehen sich nur auf Meldedaten der neuen Bundesländer. In der Vergangenheit galt die Pertussis als eine typische Kinderkrankheit, die sich jedoch zunehmend zu einer Erwachsenen­ krankheit entwickelt hat. Welche Faktoren zu dieser Entwicklung beigetragen haben, wie die Pertussis diagnostiziert werden kann und welche Anpassungen in der Prävention vorgenommen werden sollten, ist Gegenstand dieser Fortbildung. Erkrankungsverlauf Der Erreger der Pertussis ist hauptsächlich das stäbchenförmige, gramnegative Bakterium Bordetella pertussis. I­ nfektionen mit B. parapertussi spielen hingegen nur eine sehr untergeordnete Rolle und sind nur für 2 bis 3 % der Infektionen ursächlich [RKI 2014d]. Die Pertussis-Erreger besiedeln das zilientragenden Epithel der Atemwegsschleimhäute, vermehren sich und bilden dort eine Vielzahl von Toxinen und Virulenzfaktoren, wie Pertussis-Toxin, filamentöses Hämagglutinin (FHA), Pertactin, Fimbrien-Agglutinogene, ­Trachea-­Zytotoxin, hitzelabiles Toxin und Adenylatzyklase-­Toxin. Filamentöses Hämagglutinin, Pertactin und Fimbrien ermöglichen dem Erreger die Anheftung an die Epithelzellen, wo dieser mit Hilfe von Pertussis-Toxin, Trachea-Zytotoxin und Adenylatzyklase-Toxin lokal die Mukosa und umliegendes Gewebe zerstört und zusätzlich die lokalen Abwehrkräfte schwächt [WHO 2005]. Die Übertragung der Pertussis erfolgt durch Tröpfcheninfek­ tion, direkt durch Husten, Niesen oder Sprechen in einem Um­kreis von 1 Meter [Duclos und Halperin 2008]. Als weitere Infektionsquellen kommen zudem infektiöse Personen, auch bei subklinischem bzw. abortivem Verlauf, in Betracht [LUASachsen 2013]. Nach einer Inkubationszeit von meist 9 bis 10 Tagen (Spanne 6 bis 20 Tage) beginnt die Ansteckungsfähigkeit, die ihren Höhepunkt vor allem während der ersten beiden Wochen der Erkrankung erreicht [Duclos und Halperin 2008]. Seite 3 | Die Pertussis-Impfung in der hausärztlichen Praxis Der Verlauf der etwa 6 bis 12 Wochen andauernden Pertussis-­ Erkrankung lässt sich nach Ablauf der Inkubationszeit in drei klinische Stadien unterteilen (Tabelle 1). Die Symptomatik der Pertussis ist bei Jugendlichen und Erwachsenen häufig nicht so stark ausgeprägt wie bei jüngeren Kindern und wird daher nicht als diese erkannt. So zeigt sich die Pertussis bei Jugendlichen und Erwachsenen oftmals nur als lang dauernder Husten ohne typische Hustenanfälle. Säuglinge haben das höchste Risiko schwerwiegende Komplikationen zu erleiden. Am häufigsten sind Pneu­monien, die durch Suprainfektionen mit anderen bakteriellen Erregern ausgelöst werden [Liese et al. 2013]. Neben 10 % der Säuglinge sind vor allem ältere Menschen, seltener Jugendliche und jüngere Erwachsene von Pneumonien betroffen [Halperin und DeSerres 2009]. Weitere schwerwiegende Komplikationen bei Säuglingen sind Atelektasen, Otitis media und seltener Krämpfe oder Enzephalopathien [Heymann 2008]. Tabelle 1: Verlauf und klinische Stadien der Pertussis [modifiziert nach RKI 2014a] 1. Stadium catarrhale 2. Stadium convulsivum 3. Stadium decrementi •Dauer: 1 bis 2 Wochen •Prodromalstadium mit grippeähnlichen Symptomen (Schnupfen, Husten, Schwäche) •Kein oder nur mäßiges Fieber •Dauer: 4 bis 6 Wochen •Anfallsweise auftretender Stakkatohusten mit inspiratorischem Stridor und Schleimerbrechen •Kein oder nur sehr geringfügiges Fieber •Krampfanfälle, Keuchhusten, Muskelkater, Bauch- und Kopfschmerzen •Bei Säuglingen: Apnoen möglich •Dauer: 6 bis 10 Wochen •Allmähliche Abnahme der Hustenanfall-Frequenz und -Intensität Diagnose Der typische Stakkatohusten mit inspiratorischem Stridor gibt deutliche Hinweise auf das Vorliegen einer Pertussis­erkrankung. Eine Indikation zur Differentialdiagnose besteht bei ungeimpften Patienten mit hartnäckigem und länger anhaltendem Husten (trocken und unproduktiv) und Erkältungssymptomen. Auch bei Patienten mit unklarem Impfstatus oder länger zurückliegender Impfung sollte bei vorliegender Symptomatik eine mögliche Pertussis abgeklärt werden. Die Diagnose Pertussis sollte jedoch nach Möglichkeit durch eine Laboruntersuchung gesichert werden. Ein Nachweis von B. pertussis und B. parapertussis aus Nasopharyngeal­abstrichen ist in frühen Stadien der Infektion mittels Kultur oder Polymerase-Ketten-Reaktion (PCR) möglich. Der Kultur­nachweis der Erreger ist 100 % spezifisch, jedoch liegt die Sensitivität bei ungeimpften Säuglingen bei maximal 70 % und bei Erwachsenen und Jugendlichen sogar unter 5 % [Liese et al. 2013]. Maßgeblichen Einfluss auf die Sensitivität hat die Sensibilität der Erreger, die empfindlich gegen Trockenheit und Kälte sind, so dass ein falscher Umgang vor allem während der Probenahme und des Transports die Sensitivität herabsenken kann. Der PCR-Nachweis bietet in den frühen Stadien der Pertussis eine schnellere und sensitivere Alternative zur Kultur, jedoch ist die Spezifität etwas geringer [RKI 2014a]. Da in den frühen Stadien der Pertussis noch keine spezifischen Antikörper nachweisbar sind, ist eine serologische Diagnostik frühestens beim Übergang ins Stadium convulsivum möglich. Nach Empfehlung des Robert-Koch-In­ stituts (RKI) [2014b] sollte der serologische Nachweis von B. pertussis-Antikörpern mittels eines Enzyme Linked Immunosorbent Assay (ELISA) erfolgen, der als Antigen ausschließlich Pertussis-Toxin enthält. ELISAs mit anderen Antigenen, wie etwa FHA oder Pertactin, haben sich wegen der Kreuzreaktivität mit anderen Erregern als nicht aussagekräftig herausgestellt [ECDC 2012]. Der serologische Nachweis sollte möglichst über IgG-Antikörper gegen Pertussis erfolgen, da diese eine bessere Aussagekraft und Sensitivität als IgM-Antikörper oder IgA-Antikörper besitzen [RKI 2014a]. In Deutschland werden folgende Grenzwerte zur serologischen Diagnostik empfohlen [Riffelmann et al. 2008]: •Hinweis für einen Erregerkontakt: Pertussis-­Toxin-IgG-Antikörper ≥ 100 IU/ml oder IgA-Antikörper > 12 IU/ml (bezogen auf ein WHO-Referenzpräparat) •Kein Erregerkontakt: IgG-Pertussis-Toxin < 40 IU/ml •Unsicherer Erregerkontakt: IgG-Pertussis-Toxin ≥ 40 IU/ml aber < 100 IU/ml; Untersuchung einer zweiten Probe oder Bestimmung von Antikörpern gegen andere Antigene Ein bestehender Krankheitsverdacht, eine Erkrankung und der Tod durch Pertussis sind seit dem 29.03.2013 gemäß IfSG bundesweit meldepflichtig. Zudem unterliegt der direkte oder indirekte Nachweis von B. pertussis oder B. parapertussis der Meldepflicht, sofern der Nachweis auf eine akute Infektion hinweist. Seite 4 | Die Pertussis-Impfung in der hausärztlichen Praxis Pertussis im Erwachsenenalter Generell können alle Altersgruppen von der Pertussis betroffen sein. Jährlich kommt es zu etwa 16 Millionen Pertussis-­ Erkrankungen weltweit, von denen etwa 195.000 tödlich verlaufen [CDC 2014]. Das größte Morbiditäts- und Mortalitätsrisiko haben Säuglinge [Greenberg et al. 2005]. In den Jahren 2002 bis 2011 war in Deutschland – bei einer generellen Hospitalisierungsrate von 3,5 % über alle Altersgruppen hinweg – der Anteil an Säuglingen unter den hospitalisierten Erkrankten mit 71 % am höchsten [RKI 2014d]. Zwar ist die Pertussis-Inzidenz beim Vergleich aller Altersgruppen unter Kindern und Jugendlichen weiterhin am höchsten, jedoch waren in den Jahren 2011 bis 2012 in zwei Drittel der Fälle Erwachsene über 19 Jahre betroffen [RKI 2014d]. Eine Analyse der Pertussis-Erkrankungen zwischen 1995 bis 2007 in den neuen Bundesländern unterstreicht die zunehmende Krankheitslast bei Erwachsenen über 19 Jahren. In Sachsen lag der Anteil an Pertussis erkrankten Erwachsenen 1995 noch bei 16,7 % und stieg bis 2007 auf 67,8 % an, wobei 2005 ein Peak von 80,3 % erreicht wurde (Abbildung 1a). Eine ähnliche Tendenz zeigte sich auch in den übrigen neuen Bundesländern, die ebenfalls bis 2007 einen Anstieg des Alters von Pertussis betroffenen Personen verzeichnen konnten (Abbildung 1b). Zwar stützen sich verlässliche Daten zur Pertussis Epidemiologie in Deutschland bisher nur auf Meldungen der neuen Bundesländer, jedoch gehen Hochrechnungen des RKIs [2009] Abbildung 1: Altersverteilung von Pertussis Erkrankten in (a) Sachsen, und (b) Brandenburg, Mecklenburg-Vorpommern, Sachsen-Anhalt und Thüringen im Verlauf von 1995 – 2007 [modifiziert nach Hellenbrand et al. 2009]. 84 40 143104167175498497412452 5121222 Gemeldete Pertussis-Fälle ( %) 90 % 70 % 43,7 45 43,6 40,4 38,1 30 50 % 21,5 40 % 30 % 23,5 25,0 22,4 25 20 15,7 13,8 15 20 % 10 10 % 5 100 % 199519961997199819992000200220032004200520062007 283 557 1075 761 810 2005 818 986 1266332640864004 90 % Gemeldete Pertussis-Fälle ( %) 40 35 31,7 60 % 0 % b 42,7 80 % 50 0 50 45 80 % 39,0 38,0 70 % 33,3 60 % 28,0 50 % 19,3 40 % 30 % 28,2 30,3 28,2 31,8 32,6 40 35 30 25 21,6 20 15,4 15 20 % 10 10 % 5 0 % Durchschnittsalter (Jahre) 100 % 199519961997199819992000200220032004200520062007 Altersklassen: <1 1–4 5–9 10–14 Durchschnittsalter (Jahre) 15–19 20–39 40–59 60+ 0 Durchschnittsalter (Jahre) a Seite 5 | Die Pertussis-Impfung in der hausärztlichen Praxis von einer absoluten Zahl von 110.000 an Pertussis erkrankten Erwachsenen in der gesamten Bundesrepublik aus. Dabei kommt es, ebenso wie in anderen europäischen Ländern, den USA und Kanada, trotz Grundimmunisierung im Kindesalter zu einer deutlichen Zunahme der Inzidenz bei älteren Kindern, Jugendlichen und Erwachsenen [Hellen­ brand et al. 2009]. Während der Krankheitswelle 2006 bis 2008 lag die Gesamtinzidenz bei 40 Fällen/100.000 Einwohner. Die meisten Erkrankungsfälle betrafen die Gruppe der 5- bis 14-Jährigen, in welcher die Inzidenz bei 147 Fällen/100.000 Einwohner lag. Daraufhin wurde von der Ständigen Impfkommission (STIKO) im Jahr 2006 eine Empfehlung für eine Auffrischungsimpfung im Vorschul­ alter gegeben. Aufgrund der guten Durchimp fungsquote in dieser Altersgruppe kam es während der Krankheitswell 2011/2012 zu einer Verschiebung der hauptsächlich betroffenen Altersgruppe. So waren bei dieser Krankheitswelle mit einer Gesamtinzidenz von 42 Erkrankungen/100.000 Einwohner nicht mehr hauptsächlich jüngere Kinder betroffen, sondern mit 135 Fällen/100.000 Einwohner vor allem die Gruppe der 10- bis 19-Jährigen [RKI 2014d]. Einen großen Einfluss auf die Inzidenz der Pertussis hat die präventive Impfung. 2011 waren 95 % der eingeschulten Kinder gegen Pertussis geimpft [RKI 2013a]. Die vom RKI in den Jahren 2008 bis 2011 erhobenen Daten zeigen, dass im Gegensatz zur guten Durchimpfung bei Kindern, nur rund ein Drittel der Erwachsenen überhaupt eine Pertussis-­Impfung erhalten haben. Nur etwa 12 % der Frauen und 9 % der Männer in Westdeutschland hatten davon innerhalb der letzten 10 Jahre eine Auffrischung erhalten. In Ostdeutschland war die Rate etwa doppelt so hoch [Poethko-Müller und Schmitz 2013]. Bereits im Kindesalter zeigen sich bei den Impfquoten deutliche Unterschiede beim Vergleich der verschiedenen Alters- gruppen. Wird die Durchimpfungsrate von Säuglingen, Kindern und Jugendlichen betrachtet, so zeigt sich eine deutliche Abnahme der Durchimpfung mit ansteigendem Alter der Kinder, wobei der Anteil der ungeimpften Kinder ab einem Alter von etwa 11 Jahren deutlich zunimmt (­ Tabelle 2). Seit 2006 empfiehlt die STIKO eine 1. Auffrischungsimpfung im Vorschulalter, gefolgt von einer seit 2000 empfohlenen Auffrischungsimpfung im Alter von 9 bis17 Jahren. Diese werden jedoch nur unzureichend durchgeführt, so dass 40 % der Jugendlichen bereits im Alter von 14 bis 17 Jahren über keinen Impfschutz gegenüber Pertussis verfügen. Trotz der seit 2009 empfohlenen Auffrischungsimpfung für Erwachsene, wurde diese im Jahr 2010 bei nur 6 % der Erwachsenen innerhalb der letzten 10 Jahre durchgeführt und lag auch in Risikogruppen mit 11 % nur unwesentlich höher [Bohmer et al. 2013]. Dabei spielen vor allem Jugendliche und Erwachsene als Krankheitsüberträger auf Säuglinge eine entscheidende Rolle. So wird angenommen, dass etwa 55 % der Infektionen bei Säuglingen ursächlich auf eine Pertussis-Erkrankung der Eltern zurückzuführen sind [Wendelboe et al. 2007]. Nach der aktuellen Empfehlung der STIKO in 2014 sollten Erwachsene zusammen mit der nächsten fälligen Tetanus- und Diphtherie-Impfung (Td-Impfung) einmalig eine TdaP-Kombinationsimpfung zusammen mit Pertussis (aP) bekommen [RKI 2014a]. Zudem sollten Frauen im gebärfähigen Alter und enge Haushaltskontaktpersonen zu Säuglingen (Eltern, Geschwister, Tagesmütter, Babysitter und ggf. Großelternw oder andere Personen mit direktem Kontakt) möglichst 4 Wochen vor der Geburt eine Auffrischungsimpfung erhalten, sofern diese nicht innerhalb der vorangegangenen 10 Jahre erfolgt ist. Bereits seit 2007 wird von der Sächsischen Impfkommission (SIKO) nicht nur eine einmalige, sondern eine regelmäßige Auffrischungs­impfung alle 10 Jahre für Erwachsene empfohlen [SIKO 2014]. Tabelle 2: Impfquoten bei Kindern und Jugendlichen in den neuen Bundesländern 2011 [modifiziert nach RKI 2014a] Grundimmunisierung + 1. (+ 2.) Auffrischimpfung Grundimmunisierung KiTa Schulanfänger Schul anfänger 2. Klasse BB 94,6 %1 97,4 % 32,9 % MV – 97,6 % ST – TH SN Grundimmunisierung + 1. (+ 2.) Auffrischimpfung Schul­ 8. Klasse abgang 4 3. Klasse 4. Klasse 6. Klasse – – – – – 76,2 % 44,0 % – – 78,0 % (3,4 %) – 64,0 % (4,6 %) – 96,4 % – – 80,4 % – 48,1 % – – 96,1 % 2 97,0 % 30,4 % – – 73,7 % – 53,6 % – 96,3 % 3 97,0 % 42,2 % 82,4 % – – 84,1 % (36,1 %) – – 1) 30 – 42 Monate; 2) Kindergarten/Vorschule; 3) 4. Lebensjahr; 4) 15 – 16 Jahre Seite 6 | Die Pertussis-Impfung in der hausärztlichen Praxis Dauer der Immunität nach Impfung Eine vollständige Immunität gegen Pertussis kann sowohl nach Infektion, als auch durch eine Impfung nicht erreicht werden. Es gibt Studiendaten, die darauf hinweisen, dass nach einer Impfung die Immunität etwa zweimal länger besteht als nach einer durchgemachten Infektion [Dalby et al. 2010]. Aufgrund der stetig abnehmenden Immunität gegenüber dem Pertussis-Erreger kommt es zu einer erhöhten Inzidenz der Erkrankung. Ursächlich hierfür sind neben niedrigen Durchimpfungsraten in höheren Altersgruppen zudem eine abnehmende natürliche Boosterung, Veränderungen des Erregers und eine insgesamt verminderte Immunitätsdauer. Vor allem Personen ohne vollständigen Impfschutz bzw. mit länger zurückliegender Impfung sind daher von einer ­Pertussis betroffen. Jedoch treten Pertussis-Erkrankungen mit einer hohen Rate auch bei geimpften Personen auf (Abbildung 2). Neben der Durchimpfungsrate scheint daher auch die Dauer der Impfwirkung einen entscheidenden Einfluss auf die Pertussis-Immunität zu haben. Angaben über die Dauer der Immunität durch Impfung variieren zwischen 4 bis 12 Jahre [Mooi et al. 2014, Wendelboe et al. 2005]. Die Persistenz von Pertussis-Antikörpern nach Impfung wird vom RKI auf etwa 5 Jahre geschätzt [RKI 2009]. Aktuelle Studien zeigen eine starke Impfwirkung nur innerhalb der ersten zwei Jahre nach Impfung [Plotkin 2014], bzw. ein Nachlassen der Immunität bereits nach 4 bis 6 Jahren [Robbins et al. 2007]. Die verkürzte bzw. verschlechterte Impfwirkung beruht maßgeblich auf der Adaption des Pertussis-Erregers an die Impfstoffe. Diese äußert sich durch eine zunehmende Antigen-Varianz und eine vermehrte Freisetzung des krankheitsauslösenden T ­oxins. Eine Untersuchung von Pertussis-Erregern in den USA zeigte eine deutliche Zunahme an Pertactin-freien Erregern zwischen 1935 bis 2012. Während im Zeitraum von 1935 bis 2009 von 666 isolierten Erregern nur ein Erreger kein Pertactin-Antigen auf der Zelloberfläche trug, konnte 2010 bereits bei 14 %, 2011 bei 40 % und 2012 bei mehr als 50 % der Erreger ein vollständiger Verlust des Pertactin-Antigens auf der Zelloberfläche nachgewiesen werden [Pawloski et al. 2014]. Erreger ohne Pertactin-Antigen konnten auch bei 14 % der Erreger in Frankreich und 27 % der Erreger in Japan nachgewiesen werden [Mooi et al. 2014]. Neben dem Pertactin-Verlust kommt es bei den Erregern zu einer deutlich erhöhten Freisetzung von Pertussis-Toxin [Mooi et al. 2014, Plotkin 2014]. Diese erhöhte Pertussis-Toxin-Ausschüttung führt u.a. zu einer Unterdrückung des Immunsystems und somit einer inadäquaten Immunabwehr. Zur Neutralisation sind hohe anti-Pertussis-Toxin-Antikörper-Titer von Vorteil. Für die Pertussis existiert kein sicheres serologisches Korrelat, das als Surrogatmarker für einen bestehenden Schutz geeignet wäre [RKI 2013b]. Dennoch konnten Studien aus den USA zeigen, dass IgG anti-Pertussis-Toxin Unter­suchungen die beste serologische Methode sind, um eine Pertussis-Infektion nachzuweisen [Robbins et al. 2007]. IgG anti-Pertussis-Toxin-Antikörper sind nicht nur während einer akuten Infektion nachweisbar, sondern Pertussis-Erkrankungen nach Impfstatus ( %) Abbildung 2: Prozent der an das RKI übermittelten Pertussis-­Erkrankungen nach Impfstatus in Brandenburg, Mecklenburg-Vorpommern, Sachsen-Anhalt und Thüringen im Zeitraum von 2010 und 2012 (nur Fälle mit bewertbarem Impfstatus; n = 6.364; 70,8 % aller Fälle). Zahl in den Balken = Anzahl Fälle [modifiziert nach RKI 2014d]. 100 % 90 % 110 80 % 70 % 60 % 32 285 22 67 40 % 30 % 10 % 0 % 115 562 69 50 % 20 % 207 88 21 92 144 110 217 108 1.273 259 154 98 98 9 0 1.511 154 182 44 208 11 94 16 1–4 5–9 10–1415–1920–3940–59 ≥60 Alter (Jahre) vollständig geimpft (< 5 Jahre) vollständig geimpft (5 bis < 10 Jahre) unvollständig geimpft ungeimpft Seite 7 | Die Pertussis-Impfung in der hausärztlichen Praxis spiegeln auch die Immunisierung durch Impfung wieder. So konnte gezeigt werden, dass eine signifikante Korrelation zwischen dem IgG anti-Pertussis-Toxin Level und dem Grad an Pertussis-­Immunisierung besteht [Taranger et al. 2000], wobei ein höherer anti-Pertussis-Toxin-Antikörper Level mit einer höheren Rate an Immunisierung korreliert [Robbins et al. 2007]. Eine Untersuchung von Dalby et al. [2010] konnte zeigen, dass der Abbau von IgG anti-Pertussis-Toxin-Antikörpern nach Infektion mehr als doppelt so schnell verläuft wie nach Impfung. So betrug die Halbwertszeit der IgG Pertussis-­ Toxin-Antikörper bei durch Infektion immunisierten Perso- nen nur durchschnittlich 221 Tage, wohingegen die Dauer bei geimpften Personen bei durchschnittlich 508 Tagen lag. Aufgrund der verminderten Impfwirkung und des veränderten Erregers ist eine entsprechende Anpassung sowohl der Impfstoffzusammensetzung, als auch der Impfschemata notwendig. Bereits seit 2009 wird von der STIKO daher eine einmalige Auffrischungsimpfung für Erwachse empfohlen. Die SIKO empfiehlt jedoch bereits seit 2007 als einzige Impfkommission in Deutschland nicht nur die einmalige Auffrischung, sondern eine regelmäßige Auffrischung für Erwachsene alle 10 Jahre. Pertussis-Impfstoffe Zur Pertussis Prophylaxe in Deutschland stehen azelluläre Pertussis-Impfstoffe (aP) in TdaP- und TDaP-Kombinationspräparaten mit zusätzlichen Tetanus (T)- und Diptherie (d oder D)-Antigenen zur Verfügung. Weitere Kombinationsimpfstoffe sind die Fünffach- und Sechsfach-Impfstoffe für das Säuglings- und Kleinkindesalter und TdaP-IPV-Impfstoffe, welche eine zusätzliche Poliomyelitis-Komponente (IPV) enthalten. Der Zeitpunkt der Immunisierung richtet sich nach dem Impftermin des Kombinationsimpfstoffes, da ein monovalenter Pertussis-Impfstoff nicht mehr zur Verfügung steht [RKI 2014a]. Bei vorhandener Impfindikation für ­Pertussis sollte der Mindestabstand zur letzten Td-Grund­ immunisierung, bzw. zur letzten Td-Auffrischung mindestens 1 Monat betragen [RKI 2013b]. Generell unterscheiden sich die Pertussis-Impfstoffe in Hinblick auf die Anzahl und Konzentration an Pertussis-Antigenen (Tabelle 3). Td1aP Td3aP Td5aP Anzahl an PertussisKomponenten 1 3 5 Menge an PertussisToxin-Antigen [µg] 20 8 2,5 Menge an FHAAntigen [µg] – 8 5 Menge an PertactinAntigen [µg] – 2,5 3 Menge an FimbrienAntigenen 2/3 [µg] – – 5 Tabelle 3: Zusammensetzung der Pertussis-Antigene in TdaP-Impfstoffen in Deutschland [Quelle Fachinformationen]. Aktuelle Untersuchungen zur Wirksamkeit der verschiedenen TdaP-Impfstoffe liegen nur begrenzt vor. Eine randomisierte Studie an 2.284 gesunden 19- bis 64-jährigen Personen, die eine Td3aP- oder Td5aP-Impfung erhalten hatten, zeigte für beide Impfstoffe eine ähnliche Wirksamkeit gegen Diphtherie, Tetanus und Pertussis. Jedoch zeigten sich deutliche Unterschiede in den Konzentrationen der gebildeten Pertussis-Antikörper. So war die Konzentration der anti-Pertussis-Toxinund anti-FHA-Antikörper 1 Monat und auch 1 Jahr nach der Impfung mit Td3aP-Impfstoff etwa doppelt so hoch wie nach einer Td5aP-Impfung. Die Konzentration der anti-Pertactin-Antikörper wird durch beide Impfstoffe gleichermaßen erhöht [Blatter et al. 2009]. Durch den Einsatz von Td1aP können ebenfalls deutlich höhere anti-Pertussis-Toxin-Antikörperkonzentrationen im Vergleich zu einer Immunisierung mit Td5aP erreicht werden. So war in einer Studie mit 230 14- bis 15-Jährigen die Konzentraton der anti-Pertussis-Toxin-Antikörper bei den mit Td1aP geimpften Jugendlichen 3- bis 4-mal höher, als bei den mit Td5aP Geimpften [Netterlid et al. 2012]. Auch bei Erwachsenen wurden durch die Td1aP-Booster-Impfung die höchsten Ansprechraten erreicht. So konnten nach der Td1aP-Impfung Booster-Raten von 92 % im Vergleich zu 77 % nach Td3aP-Impfung und 47 % nach Td5aP-Impfung erzielt werden [Thierry-Carstensen et al. 2013]. Vor allem die Konzentration der Pertussis-Toxin-Antigen-Komponente scheint einen entscheidenden Einfluss auf die anti-Pertussis-Toxin-Antikörper-Konzentration zu haben. N ­ eben den seit längerem in Deutschland zugelassenen ­ Td3aPund Td5aP-Impfstoffen ist seit 2013 auch in Deutschland ein Td1aP-Impfstoff zugelassen. In Dänemark werden seit 15 Jahren ausschließlich Td1aP-Impfstoffe eingesetzt. Dort kam Seite 8 | Die Pertussis-Impfung in der hausärztlichen Praxis es 2002 zum letzten Mal zu einer Pertussis-Epidemie mit 36 Fällen/100.000 Einwohner [Thierry-Carstensen et al. 2013]. Seitdem ist die Pertussis-Inzidenz vergleichsweise niedrig. So traten in Dänemark zwischen 2004 und 2011 nur 6 bis 11 Fälle/100.000 Einwohner auf. In Deutschland lag die Inzidenz im gleichen Zeitraum mit 13 bis 40 Fällen/100.000 Einwohner deutlich höher [RKI 2014d]. ­ Zwar liegen die Durchimpfungsraten bei Kindern in Dänemark ähnlich wie in Deutschland bei 87 bis 91 % [Petersen et al. 2012], dennoch kommt es in Dänemark trotz weniger Impfungen bis zum Erwachsenenalter – 4 Impfungen im Vergleich zu 6 Impfungen in Deutschland – seltener zu ­Pertussis-Erkrankungen. Robbins et al. konnten in seiner Analyse zu Pertussis-Impfstoffen keine Erhöhung der Immunität aufgrund weiterer Pertussis-Antigene außer anti-­ Pertussis-Toxin feststellen [Robbins et al. 2009]. Die maßgeblich zur Immunität beitragende Komponente ist demnach das im Td1aP-Kombinationsimpfstoff in hoher Konzentration enthaltene Pertussis-Toxin-Antigen. Dies scheint sich mit der guten Immunität in Dänemark zu decken. Fazit Noch immer ist die Inzidenz der Pertussis bei Kindern und Jugendlichen am höchsten, jedoch nahmen in den letzten Jahren Infektionen vor allem bei Erwachsenen über 19 Jahren zu. Pertussis rückt damit zunehmend auch in den Fokus der hausärztlichen Praxis. Ausgelöst durch eine unzureichende Durchimpfung im Erwachsenenalter – etwa 89 % der Erwachsenen haben in den letzten 10 Jahren keine Auf­frischungsimpfung erhalten – und den relativ kurzen Impfschutz kommt es zu einem vermehrten Auftreten von Pertussis bei Erwachsenen. Impfstoffe wie der Td1aPKombinationsimpfstoff mit einer hochdosierten Pertussis-Toxin-Antigenkomponente führen zu deutlich höheren anti-Pertussis-Toxin-­Antikörpermengen, da mehr anti-Pertussis-Toxin-Antikörper zur Pertussis-Toxin Neutralisierung gebildet werden. Zwar verläuft die Pertussis bei den meisten Erwachsenen ohne schwere Komplikationen, dennoch sollte aufgrund der langen Krankheitsdauer und der großen Ansteckungsgefahr für ungeimpfte Säuglinge eine konsequente Immunisierung auch im Erwachsenenalter durchgeführt werden. Diese sollte spätestens mit der nächsten Td-Impfung, die alle 10 Jahre zu wiederholen ist, als TdaP- bzw. bei entsprechender Indikation als TdaP-IPV-Kombinationsimpfung erfolgen. Jede Td-Auffrischungsimpfung sollte daher Anlass sein, die Notwendigkeit einer Pertussisimpfung zu prüfen und einen aP-haltigen Kombinationsimpfstoff einzusetzen. Seite 9 | Die Pertussis-Impfung in der hausärztlichen Praxis Literatur Blatter M, Friedland LR, Weston WM et al. Immunogenicity and safety of a tetanus toxoid, reduced diphtheria toxoid and three-component acellular pertussis vaccine in adults 19-64 years of age. Vaccine 2009;27:765 – 72. Bohmer MM, Hellenbrand W, Matysiak-Klose D et al. Pertussis vaccination coverage among adults in Germany. Dtsch Med Wochenschr 2013;138:1451 – 7. Broutin H, Viboud C, Grenfell BT et al. Impact of vaccination and birth rate on the epidemiology of pertussis: a comparative study in 64 countries. Proc Biol Sci 2010;277:3239 – 45. CDC. Pertussis fast facts. http://www.cdc.gov/pertussis/fastfacts.html. Abgerufen am 25.09.2014. Dalby T, Petersen JW, Harboe ZB et al. Antibody responses to pertussis toxin display different kinetics after clinical Bordetella pertussis infection than after vaccination with an acellular pertussis vaccine. J Med Microbiol 2010;59:1029 – 36. Duclos P, Halperin S. Pertussis. Heymann D, editor. Washington D.C.: American Public Health Association 2008. ECDC. European Centre for Disease Prevention and Control. Guidance and protocol for the use of realtime PCR in laboratory diagnosis of human infection with Bordetella pertussis or Bordetella parapertussis. Stockholm: 2012. Greenberg DP, von Konig CH, Heininger U. Health burden of pertussis in infants and children. Pediatr Infect Dis J 2005;24: S39 – 43. Halperin S, DeSerres G. Pertussis. New York: Springer 2009. Hellenbrand W, Beier D, Jensen E et al. The epidemiology of pertussis in Germany: past and present. BMC Infect Dis 2009;9:22. Heymann D. Control of communicable diseases manual. 19 ed. Washington D.C.: American Public Health Association 2008. Liese J, Heininger U, Hellenbrand W et al. Pertussis. Stuttgart, New York: Georg Thieme Verlag 2013. LUA-Sachsen. Landesuntersuchungsanstalt für das Gesundheits- und Veterinärwesen (LUA) Sachsen. Empfehlungen zur Verhütung und Bekämpfung von Pertussis im Freistaat Sachsen. 2013 Mooi FR, Van Der Maas NA, De Melker HE. Pertussis resurgence: waning immunity and pathogen adaptation – two sides of the same coin. Epidemiol Infect 2014;142:685 – 94. Netterlid E, Hallander H, Nilsson L et al. An immunogenicity and safety study of combined adsorbed tetanus, low dose diphtheria and acellular pertussis vaccine given as a school-leaving booster to 14 – 15 year olds primed with a five component acellular pertussis vaccine at 3, 5 and 12 months of age and a booster dose at 5½ years of age. In: Poster Session at Nordic Vaccine Meeting 5. – 7. September 2012. Pawloski LC, Queenan AM, Cassiday PK et al. Prevalence and molecular characterization of pertactin-deficient Bordetella pertussis in the United States. Clin Vaccine Immunol 2014; 21:119 – 25. Petersen RF, Dalby T, Dragsted DM et al. Temporal trends in Bordetella pertussis populations, Denmark, 1949 – 2010. Emerg Infect Dis 2012;18:767 – 74. Plotkin SA. The pertussis problem. Clin Infect Dis 2014;58:830 – 3. Poethko-Müller C, Schmitz R. Impfstatus von Erwachsenen in Deutschland. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 2013;56:845 – 57. Riffelmann M, Littmann M, Hulsse C et al. Pertussis: not only a disease of childhood. Dtsch Ärztebl Int 2008;105:623 – 8. RKI. Robert-Koch-Institut. Pertussis: Zum Vergleich von Grundimmunisierung und Auffrischimpfungen in den alten und neuen Bundesländern. Epid Bull 2008;27:1 – 6. RKI. Robert-Koch-Institut. Zusätzliche Pertussis-Impfung im Erwachsenenalter als Tdap-Kombinationsimpfung bei der nächsten fälligen Td-Impfung – Empfehlung und Begründung. Epid Bull 2009;31:1 – 20. RKI. Robert-Koch-Institut. Impfquoten bei der Schuleingangsuntersuchung in Deutschland 2011. Epid Bull 2013a;16:1 – 10. RKI. Robert-Koch-Institut. Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut/Stand: August 2013. Epid Bull 2013b;34 RKI. Robert-Koch-Institut. Pertussis (Keuchhusten). Epid Bull 2014a;29:1 – 8. Seite 10 | Die Pertussis-Impfung in der hausärztlichen Praxis RKI. Robert-Koch-Institut. Erste Erfahrungen mit der Umsetzung der neuen IfSG-Meldepflichten für impfpräventable Krankheiten aus Sicht des Robert-Koch-Instituts. Epid Bull 2014b; 4:1 – 8. RKI. Robert-Koch-Institut. Impfquoten bei der Schuleingangsuntersuchung in Deutschland 2012. Epid Bull 2014c:137 – 41. RKI. Robert-Koch-Institut. Keuchhusten-Erkrankungen in den neuen Bundesländern, 2002 bis 2012. Epid Bull 2014d;1:1 – 14. Robbins JB, Schneerson R, Keith JM et al. The rise in pertussis cases urges replacement of chemically-inactivated with genetically-inactivated toxoid for DTP. Vaccine 2007;25:2811 – 6. Robbins JB, Schneerson R, Keith JM et al. Pertussis vaccine: a critique. Pediatr Infect Dis J 2009;28:237 – 41. SIKO. Sächsische Impfkommission. Empfehlungen der Sächsischen Impfkommission zur Durchführung von Schutzimpfungen im Freistaat Sachsen. Impfempfehlung E 1. 2014 Taranger J, Trollfors B, Lagergard T et al. Correlation between pertussis toxin IgG antibodies in postvaccination sera and subsequent protection against pertussis. J Infect Dis 2000;181: 1010 – 3. Thierry-Carstensen B, Dalby T, Stevner MA et al. Experience with monocomponent acellular pertussis combination vaccines for infants, children, adolescents and adults – a review of safety, immunogenicity, efficacy and effectiveness studies and 15 years of field experience. Vaccine 2013;31:5178 – 91. Wendelboe AM, Van Rie A, Salmaso S et al. Duration of immunity against pertussis after natural infection or vaccination. Pediatr Infect Dis J 2005;24:S58 – 61. Wendelboe AM, Njamkepo E, Bourillon A et al. Transmission of Bordetella pertussis to young infants. Pediatr Infect Dis J 2007;26:293 – 9. WHO. Pertussis vaccines. WHO position paper. Wkly Epidemiol Rec 2005; 4:31 – 4.