6.1.1.4 - IOC
Werbung

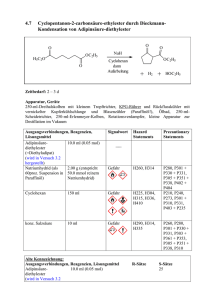
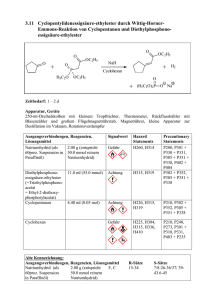
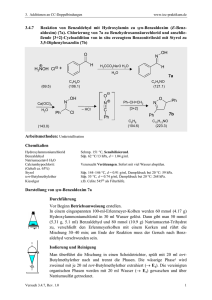
6. Oxidations-, Reduktions-Reaktionen 6.1.1.4 www.ioc-praktikum.de Oxidation von Mandelsäureethylester mit Calciumhypochlorit zu Phenylglyoxylsäureethylester (4) HO O OC2H5 PhasentransferKatalyse O OC2H5 Ca(OCl)2 C10H12O3 (180.2) CaCl2O2 (143.0) O 4 C10H10O3 (178.2) Arbeitsmethoden: Destillation Chemikalien rac-Mandelsäureethylester Calciumhypochlorit (Gehalt ca. 65%) Adogen 464 (Aliquat 336) Cyclohexan Schmp. 24–27 °C, Sdp. 253–255 °C. Verursacht Verätzungen. Sofort mit viel Wasser abspülen. Technisches Methyltrioctylammonium-chlorid (C25H54ClN, 404.2), Phasentransfer-Katalysator. Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 500-ml-Dreihalskolben mit Rückflusskühler, Innenthermometer und Magnetrührstab werden 80 mmol (14.4 g) Mandelsäureethylester in 100 ml Cyclohexan und 80 ml Wasser suspendiert und mit 0.8 g Adogen 464 versetzt.1 Unter Eiskühlung und kräftigem Rühren werden langsam 42 mmol (8.58 g) Calciumhypochlorit (Gehalt 65%) portionsweise zugegeben. Die Temperatur der Mischung soll dabei zwischen 20 und 25 °C liegen, gegebenenfalls muss mit einem Eis/Wasser-Bad gekühlt werden. Nach Ende der Zugabe (Dauer etwa 1 h) wird noch 1 h bei Raumtemperatur weitergerührt, anschließend 30 min bei 60 °C, bis die Mischung beim Tüpfeln auf Iod-Stärke-Papier keine Blaufärbung mehr zeigt.2 Isolierung und Reinigung Die Reaktionsmischung wird in einen 500 ml-Scheidetrichter mit 200 ml gesättigter Kochsalzlösung und etwa 100 g Eis gegossen und dreimal mit je 50 ml Cyclohexan ausgeschüttelt. Die vereinten organischen Phasen werden mit 30 ml Wasser gewaschen (→ E1) und über Natriumsulfat getrocknet. Nach dem Absaugen vom Trockenmittel (→ E2) wird das Lösungsmittel am Rotationsverdampfer abdestilliert (→ R1). Der ölige Rückstand wird in einer kleinen Destillationsapparatur mit Spinne und tarierten 25-mlVorlagekölbchen bei vermindertem Druck fraktionierend destilliert. Führen Sie ein Destillationsprotokoll, Fraktionen mit gleichem Brechungsindex werden vereinigt, Destillationsrückstand (→ E3). Ausbeute an 4: 70–80%, Sdp. 128–130 °C/13 hPa. 1 2 Versuch 6.1.1.4, Rev. 1.0 Erläutern Sie die Wirkung des Phasentransferkatalysators. Formulieren Sie! 1 6. Oxidations-, Reduktions-Reaktionen www.ioc-praktikum.de Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: E2: E3: R 1: Wässrige Phasen mit organischen Verunreinigungen → Entsorgung (H2O mit RHal/Halogenid). Trockenmittel → Entsorgung (Anorg. Feststoffe). Destillationsrückstand in wenig Aceton lösen → Entsorgung (RH). Abdestilliertes Lösungsmittel → Recycling (Cyclohexan). Auswertung des Versuchs 1H-NMR-Spektrum von 4 (300 MHz, CDCl3): δ = 1.39 (3 H), 1.42 (2 H), 7.44–7.53 (2 H), 7.59–7.67 (1 H), 424.5 Hz 417.4 Hz 410.3 Hz 1339.0 Hz 1331.9 Hz 1324.7 Hz 1317.6 Hz 7.91–8.02 (2 H). a) b) b) a) 9.0 8.0 7.0 6.0 5.0 4.0 3.0 1.0 [ppm] 2.0 0.0 von 4 (75.5 MHz, CDCl3): δ = 14.12 (CH3), 62.38 (CH2), 128.93 (CH), 130.03 (CH), 132.41 (C), 134.97 (CH), 163.87 (C), 186.50 (C). 13C-NMR-Spektrum LM 200 180 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 4 (Film): 100 T [%] 3070 2985 50 1595 1735 0 4000 Versuch 6.1.1.4, Rev. 1.0 3000 2000 1690 1500 1000 ~ [cm-1] ν 2 6. Oxidations-, Reduktions-Reaktionen www.ioc-praktikum.de * Formulieren Sie den zu 4 führenden Reaktionsmechanismus. * Formulieren Sie die partiellen Redoxgleichungen für die Oxidation zu 4. Weitere denkbare Reaktionsprodukte: O Ph Cl O PhCHCO2Et PhCCO2H A B O PhC H CO2Et O O O Ph Ph O C H H O D * Mit welchen spektroskopischen Daten lassen sich A–D ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Die Reaktion kann auch analog mit Mandelsäuremethylester durchgeführt werden (Produkt: Phenylglyoxylsäuremethylester, Sdp. 138–140 °C/20 hPa). Calciumhypochlorit [1] wirkt wie Natriumhypochlorit.[2] Sein Vorzug ist, dass es sich um ein stabiles und billiges Festprodukt handelt. Es ist insbesondere für die Oxidation sekundärer Alkohole zu Ketonen geeignet. Aldehyde können zu Carbonsäuren oxidiert werden. Zur Oxidation von Menthol mit Na2Cr2O7/H2SO4 siehe Lit. [3]. [1] S.O. Nwauka, P.M. Keehn, Tetrahedron Lett. 1982, 23, 35, 3131–3134, 3135–3138; M. Schneider, J.-V. Weber, P. Faller, J. Org. Chem. 1982, 47, 364–365; siehe auch H.G.O. Becker, J. prakt. Chem. 1995, 337, 690–691. [2] G.A. Lee, H.H. Freedman, Tetrahedron Lett. 1976, 17, 1641–1644; R.V. Stevens, K.T. Chapman, H.N. Weller, J. Org. Chem. 1980, 45, 2030–2032. [3] L.T. Sandborn in Organic Syntheses Coll. Vol. 1 (Hrsg. H. Gilman, A.H. Blatt), J. Wiley & Sons, New York, 1941, S. 340–341; H.C. Brown, C.P. Garg, K.-T. Liu, J. Org. Chem. 1971, 36, 387–390. Versuch 6.1.1.4, Rev. 1.0 3