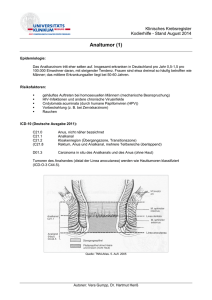
Untitled
Werbung

Inhaltsverzeichnis Einleitung . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 Leitlinien Autopsien . . . . . . . . . . . . . . . . . . . . . . . . . . . Chirurgische Pathologie . . . . . . . . . . . . . . . . Zytologie . . . . . . . . . . . . . . . . . . . . . . . . . . . . Externe Qualitätskontrollen . . . . . . . . . . . . . . 2 3 4 5 Organlisten Gehirn/Rückenmark . . . . . . . . . . . . . . . . . . . 6 Harnblase . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 Hoden . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 Kolon/Rektum . . . . . . . . . . . . . . . . . . . . . . . . 9 Larynx . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .10 Lunge . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 Lymphknoten . . . . . . . . . . . . . . . . . . . . . . . . .12 Magen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13 Mamma . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14 Milz . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 Muskel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16 Nebenniere . . . . . . . . . . . . . . . . . . . . . . . . . 17 Nerv . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 18 Niere, Nierenbecken, Ureter . . . . . . . . . . . . 19 Oesophagus . . . . . . . . . . . . . . . . . . . . . . . . 20 Ovar, Tube . . . . . . . . . . . . . . . . . . . . . . . . . . 21 Pankreas . . . . . . . . . . . . . . . . . . . . . . . . . . . 22 Prostata . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23 Schilddrüse . . . . . . . . . . . . . . . . . . . . . . . . . 24 Skelett . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 Uterus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26 Weichteile . . . . . . . . . . . . . . . . . . . . . . . . . . 27 Einleitung II Die Leitlinien zur Sicherung und Förderung der Qualitätskontrolle stehen Ihnen nach Vernehmlassung durch alle Institute mit zwei neuen Kapiteln „Larynx“ und „Oesophagus“ als pdf-File auf der Homepage der SGPath zur Verfügung. Endlich konnte auch ein Konsens bei der Verarbeitung von Sentinel-Lymphknoten in der Mammapathologie erzielt werden. Weitere kleinere Revisionen werden laufend vorgenommen, die Ihnen per e-mail spontan übermittelt werden. Die Zusammensetzung der Kommission hat sich seit dem Jahr 2000 bis anfangs 2002 etwas geändert und setzt sich wie folgt zusammen: Rosmarie Caduff, Zürich (Vorsitz), Jean-Claude Pache, Genf, Ennio Pedrinis, Locarno, Ivo Tosoni, Winterthur, Hans-Ruedi Zenklusen, Luzern. Weiterhin greifen wir bei Gelegenheit dankbar auf die Hilfe der Kolleginnen und Kollegen zurück, die bereits in der ersten Einleitung vermerkt wurden. Neu zu erwähnen für Hilfestellungen in der HNO-Pathologie ist Madeleine Pfaltz, Zürich. Zürich, im Herbst 2002 Reg. 1 Einleitung 1 EINLEITUNG Die FMH hat ein Qualitätssicherungs- und Qualitätsförderungs-Konzept (QS-QF) entwickelt. Dieses wurde durch die Aerztekammer vom 18./19. Juni 1997 bewilligt. Gemäss dieses Konzeptes ist die Ausarbeitung und Aktualisierung von Guidelines eine ständige Aufgabe der Fachgesellschaften. Die FMH fördert und koordiniert diese Tätigkeit. Sie will auch ein Evaluationssystem für die Anerkennung von Guidelines schaffen. In der Mitgliederversammlung vom 08. November 1997 hat die SGP eine Kommission für die Qualitätssicherung in der Pathologie eingesetzt, die sich wie folgt zusammensetzt : W. Wegmann, Liestal (Vorsitz), P. Chaubert, Lausanne, P. Dalquen, Basel, C. Moll, Münsterlingen, E. Pedrinis, Locarno, H.-R. Zenklusen, Basel. Die Kommission verdankt die konstruktive Mitarbeit folgender Kollegen : A. Aguzzi, Zürich, F. Bannwart, Zürich, M. Boss, Basel, S. Brandner, Zürich, S.B. Cogliatti, St. Gallen, P.A. Diener, St. Gallen, J. O. Gebbers, Luzern, N. Hurwitz, Basel, G. Jundt, Basel, P. Komminoth, Zürich, J. Obwegeser, (Gynaekozytologie), Zürich, C. Oehlschlegel, St. Gallen, A. Probst, Basel, B. Rinderknecht (Gynaekozytologie), St. Gallen, G. Sauter, Basel, H. P. Spichtin, Basel, P. Spieler, St. Gallen, B. Stamm, Aarau, L. Terracciano, Basel, J. Torhorst, Basel, M. Tötsch, Genf. P. Chaubert, C. Genton, W. Wegmann und S. Widgren haben die Uebersetzungsarbeiten besorgt. Entsprechend ihrem Auftrag hat die Kommission Leitlinien für die Qualitätssicherung der Hauptaktivitäten der Institute für Pathologie (chirurgische Pathologie, Zytologie und Autopsie) ausgearbeitet. Die Schweizerische Gesellschaft für Klinische Zytologie (SGKZ) verzichtet auf die Erarbeitung separater Leitlinien. Angestrebt wird auch eine Anerkennung der ZytologieLeitlinien durch die Schweizerische Gesellschaft für Gynäkologie und Geburtshilfe (SGGG). Es werden auch Empfehlungen für eine externe Qualitätskontrolle abgegeben. Zusätzlich wurden sogenannte Organlisten erstellt, die Anleitungen für eine optimale Aufarbeitung verschiedener chirurgischer Operationspräparate bei den häufigsten malignen Tumoren geben. Für die histologische Klassifikation gilt in der Regel die jeweils letzte Ausgabe der Serie „International Histological Classification of Tumours WHO“ und für die TNMKlassifikation immer die jeweils letzte Ausgabe der UICC. Alle Kommissionsmitglieder beteiligten sich aktiv an der Ausarbeitung der Leitlinien und Organlisten. Für eine erste Vernehmlassung gingen die Manuskripte an die zuständigen Organspezialisten. Revidierte Fassungen zirkulierten darnach bei den Kommissionsmitgliedern bis schriftlich oder mittels Telefonkonferenz ein Konsens erreicht war. Ausländische Leitlinien (Quality Improvement Manual in Anatomic Pathology, College of American Pathologists 1993 und Arbeitsgruppe der British Society for Clinical Cytology (Cytopathology 1996; 7: 4-9) wurden konsultiert und zum Teil adaptiert oder modifiziert übernommen. Die aktuelle internationale Literatur wurde berücksichtigt (Suchsystem Medline). Der Grad der wissenschaftlichen Absicherung entspricht gemäss dem level of evidence der Canadian Medical Association (1998) vorwiegend dem Grad V. (Grad V: Die Evidenz basiert auf der Meinung derjenigen Personen, welche diese Guidelines geschrieben oder aktualisiert haben, beruhend auf ihrer Erfahrung, ihrer Kenntnis der einschlägigen Literatur und der Diskussion mit ihren Fachkollegen.) Die Leitlinien haben empfehlenden Charakter. Es wird immer wieder Situationen geben, z.B. bei ungewöhnlichen oder seltenen Befunden oder Forschungsprojekten, wo davon abgewichen werden muss. Lokale Traditionen oder persönliche Präferenzen sollten jedoch zurückgestellt werden. Ziel ist eine Befunderhebung und Berichterstattung, die in allen universitären, kantonalen und privaten Instituten auf den gleichen Kriterien beruht, wie sie in den Leitlinien und Organlisten formuliert wird. Eine Befolgung der Leitlinien ergibt nicht zwangsläufig eine Verbesserung der Diagnostik. Sie schafft jedoch eine der Voraussetzungen hierfür. Reg. 1 Einleitung Kontrollierte Studien (z. B. im Rahmen der SAKK) und epidemiologische Datenerfassung (Krebsregister) sind ohne definierte Beurteilungskriterien nicht durchführbar. Das Gesundheitswesen ist grösstenteils kantonal geregelt. Die Leitlinien haben (mindestens zum jetzigen Zeitpunkt) keinen rechtlichen Charakter. Leitlinien haben auch temporären Charakter. Sie müssen laufend neuen Erkenntnissen oder Erfordernissen angepasst und auch vervollständigt werden. Die Leitlinien und Richtlinien gehen anfangs 2000 zur Vernehmlassung an die Institute, die Leitlinie Zytologie zusätzlich an die SGKZ. Korrektur-/Aenderungsvorschläge müssen bis zum 30. Juni 2000 beim Präsidenten der QSKommission eingereicht werden, wenn möglich mit Angabe des „level of evidence“ bzw. der einschlägigen Literatur. Die Kommission entscheidet über die Annahme der eingegangenen Anträge und verschickt eine revidierte Fassung an die Institute. Diese wird auch der Mitgliederversammlung im November 2000 zur Genehmigung vorgelegt. Wenn diese zustande kommt, beschliesst die Mitgliederversammlung das zeitliche Intervall der Revisionen und legt die Leitlinien/Richtlinien der FMH zur Genehmigung vor. Jeder Fachpathologe soll ein eigenes Exemplar (Sammelordner) erhalten. Eine Aufnahme ins Internet via link FMH sollte angestrebt werden. Liestal, Ende 1999 2 Reg. 2 Autopsien 1 AUTOPSIE Gründe für die Durchführung einer Autopsie - Qualitätskontrolle der klinischen Diagnostik und Behandlung sowie der zytologischen und histopathologischen Diagnostik. (Diese Qualitätskontrolle durch die Autopsie ist bis heute durch nichts anderes ersetzbar. Es ist deshalb eine hohe Autopsiefrequenz anzustreben.) -Abklärung der Todesursache. --Nachweis einer Komplikation einer chirurgischen oder medikamentösen Behandlung. - Nachweis eines Behandlungserfolges oder -misserfolges. - Nachweis einer kriminellen Handlung (Auftrag an Rechtsmedizin). - Nachweis einer ansteckenden Krankheit. - Nachweis einer Erbkrankheit. - Nachweis einer Berufskrankheit oder umweltbedingten Krankheit. - Abklärung neu aufgetretener Krankheiten. - Korrelation hochtechnisierter bildgebender Verfahren mit dem pathologisch-anatomischen Befund. - Wunsch der Angehörigen. - Epidemiologische Untersuchungen. - Aus-, Fort- und Weiterbildung der Aerzte. Auftrag zur Autopsie Die rechtlichen Grundlagen für die Durchführung einer Autopsie sind in den verschiedenen Kantonen unterschiedlich. In einigen Kantonen ist es Aufgabe des behandelnden Arztes, das Einverständnis zur Autopsie bei den Angehörigen einzuholen. In seltenen Fällen gibt der Patient selbst die Einwilligung zur Autopsie vor seinem Tod. In verschiedenen Kantonen gilt die sogenannte Einspruchsregelung (Widerspruchslösung). Eine Autopsie muss unterbleiben, wenn die nächsten Angehörigen oder der Verstorbene vor seinem Tod von sich aus Einspruch erheben. Es besteht keine Verpflichtung des Arztes, die Angehörigen zu befragen. Dies setzt voraus, dass die Allgemeinheit, und speziell die Spitalpatienten (via Spitalbroschüre) orientiert sind, dass in öffentlichen Spitälern in der Regel eine Autopsie durchgeführt wird. Bei Verdacht auf eine kriminelle Handlung oder eine ansteckende Krankheit kann von der zuständigen Behörde eine Autopsie auch gegen den Willen der Angehörigen angeordnet werden. Sofern der Patient oder die Angehörigen der Autopsie zugestimmt, oder keinen Einspruch erhoben haben, erteilt der behandelnde Arzt den Auftrag zur Autopsie. Reg. 2 Autopsien 2 Treten während einer Autopsie Läsionen zu Tage, die auf Einwirkung dritter schliessen könnten, muss die Autopsie unterbrochen und eine rechtsmedizinische Konsultation in Anspruch genommen werden. Nach einer telefonischen Voranmeldung übermittelt der Kliniker dem Pathologen ein Auftragsformular. Dieses muss enthalten: - Name und Adresse des Auftraggebers. - die Personalien des Patienten mit Geburtsdatum. - die Daten des Spitaleintrittes und des Todes. - die Empfänger des Autopsieberichtes. - Wünsche betreffend Autopsie (vollständig oder partiell). - Vorliegen einer infektiösen Krankheit oder bekannter therapiebedingter Resistenzen. An klinischen Informationen sind erforderlich: - kurze Zusammenfassung von Anamnese und Verlauf. - die wichtigsten Daten bildgebender Verfahren. - bei Totgeburten Angabe der Schwangerschaftsdauer. - bei Tod in der Perinatalperiode Geburtszeit. - wichtige Laborbefunde. - Liste der klinischen Diagnosen und/oder Verdachtsdiagnosen. - Hinweise auf besondere oder unklare Befunde. - Formulierung von Fragen an den Pathologen. Durchführung der Autopsie Üblicherweise wird die Autopsie durch einen Assistenzarzt unter Mithilfe eines hierfür speziell ausgebildeten Präparators durchgeführt, unter der Kontrolle und der Verantwortung eines Fachpathologen. Die Autopsietechnik richtet sich nach dem in den entsprechenden Fachbüchern beschriebenen Prozedere, ergänzt oder modifiziert durch die lokale Tradition und angepasst an die Erfordernisse der zu erwartenden Befunde. Spezielle Techniken (besondere Organkonservierungen, besondere Präparationstechniken, Materialentnahme für Bakteriologie, Toxikologie, Immunhistochemie, Elektronenmikroskopie und Molekularbiologie) sind in institutsinternen schriftlichen Anleitungen zu regeln. Bei unklarem makroskopischem Befund sollen Organe oder Organteile formalinfixiert bis zum Abschluss des Falles aufbewahrt werden. Vorsichtsmassnahmen bei Autopsien Siehe dazu auch SUVA-Broschüre, Arbeitsmedizin Nr. 30, Bestell-Nr. 2869/30d. Bei jeder Autopsie besteht eine potentielle Infektionsgefahr. In der Regel genügt aber sauberes, ruhiges Arbeiten mit Handschuhen, Maske, wasserdichter Schürze und wasserdichten Schuhen. Allfällige Verletzungen müssen sofort mit Wasser und Seife ausgewaschen und anschliessend desinfiziert werden. Personen mit offenen Wunden sollen sich nicht an Autopsien beteiligen. Das Autopsiepersonal sollte gegen Hepatitis B geimpft sein. Bei gewissen blutübertragbaren Infektionskrankheiten, insbesondere HIV-Infekte/Aids und Creutzfeldt-Jakob Krankheit sind bei der Autopsie und histologischen Aufarbeitung besondere Vorsichtsmassnahmen notwendig. Falls es zu keinen penetrierenden Verletzungen mit kontaminierten Gegenständen kommt, besteht praktisch keine Ansteckungsgefahr. Liegt eine blutübertragbare Infektionskrankheit vor, darf die Autopsie nicht durch eine schwangere Ärztin vorgenommen werden. Reg. 2 Autopsien 3 Autopsie bei vermutetem oder diagnostiziertem HIV-Infekt - separater Sezierraum (falls vorhanden). - erfahrener Obduzent. - Kleidung aller an der Autopsie unmittelbar Beteiligten: Kopfhaube, Schutzbrille, Mundschutz, doppelte Handschuhe oder Sicherheitshandschuhe, wasserdichte Schürze, Bluse und Hosen (Einwegmaterial), wasserundurchlässige Schuhe. - Hilfskraft für Protokoll, Transportdienste, Fotografieren, etc. Diese darf nicht mit der Leiche, deren Blut, Sekreten, Exkreten oder Samenflüssigkeit in Kontakt kommen, dies zur Vermeidung der äusseren Kontamination von Transportgefässen. - Obduzent und Präparator bleiben während der ganzen Dauer der Autopsie am Autopsietisch. - Oeffnung der Schädelkalotte mit Handsäge oder einer elektrischen Oszillationssäge mit entsprechender Absaugvorrichtung. - keine Nadeln oder Skalpelle verwenden. - Sezieren der Organe in der Regel in der Leiche und diese in der Leiche belassen. „Blinde“ Präparation der Hals- und/oder Beckenorgane sollte wenn möglich unterbleiben. Organe in der Leiche oder allenfalls auf dem Obduktionstisch fotografieren. - Verzicht auf eine klinische Demonstration. - am Schluss der Autopsie Kleidungsstücke als infektiöses Material entsorgen. - Leiche mit 80 %igem Aethylalkohol abwaschen. - benützte Instrumente und Seziertisch mechanisch reinigen, dann mit 80 %igem Alkohol abwaschen. Instrumente 12 Std. in Gigasept (Alkoholgemisch) einlegen. Autopsien bei vermuteter oder diagnostizierter Creutzfeldt-Jakob-Krankheit Das vom BAG bestimmte Referenzzentrum für übertragbare spongioforme Enzephalopathien befindet sich beim Institut für Neuropathologie des Departements Pathologie des Universitätsspitals Zürich. Es wird empfohlen, das Referenzzentrum bei der autoptischen Abklärung spongioformer Enzephalopathien konsiliarisch zuzuziehen, dies auch im Hinblick auf Zusatzuntersuchungen (PrP-Genanalyse und biochemischer Nachweis des PrPsc-Proteins). Eine neuropathologische Untersuchung ist für eine sichere Diagnose der Creutzfeldt-JakobKrankheit und anderer spongioformer Enzephalopathien erforderlich. Die Autopsie darf deshalb nicht verweigert werden. Sie muss nötigenfalls durch eine entsprechende Amtsstelle verfügt werden. - Um eine Kontamination des Autopsietisches zu vermeiden, soll die Leiche auf einer nicht permeablen Plastikfolie oder ähnlichem Material seziert werden. - Eröffnung des Schädeldachs mit Handsäge oder einer elektrischen Oszillationssäge mit entsprechender Absaugvorrichtung. Vorher Unterlage dick mit Zellstoff ab decken. - Herausnahme und makroskopische Beurteilung des Gehirns in üblicher Weise. - Asservierung von unfixiertem, schockgefrorenem Material nach Absprache mit dem Referenzzentrum. - Fixation in gepuffertem 4 %igem Formalin. Gehirn- und Fixationslösung sind infektiös (Behälter kennzeichnen). - Uebrige Autopsie unter den gleichen Vorschriftsmassnahmen wie bei HIV-Infekten durchführen. Dekontamination: - Verbrennung von Zellstoff und Einwegmaterial. Autoklavierbares Material im Vakuumverfahren dekontaminieren. - Instrumente und Oberflächen durch 2 N NaOH (80 g/l) oder Javelwasser über 1 Stunde dekontaminieren. Reg. 2 Autopsien 4 Verarbeitung des Gehirns bei Creutzfeldt-Jakob-Krankheit für die histologische und immunhistochemische Untersuchung - Das Personal soll Sicherheitshandschuhe tragen; besondere Sorgfalt zur Vermeidung akzidenteller penetrierender Verletzungen ist angezeigt. - Das Formalin-fixierte Gehirn wird auf einem mit einer Plastikfolie geschützten Autopsietisch und darauf liegenden Zellstofflagen zerlegt. Folie und Zellstoff sind als infektiöser Spitalabfall zu verbrennen. - Untersuchung von mindestens vier Grosshirnarealen und Kleinhirn. Gewebe für 1 Std. in 100 %ige Ameisensäure und anschliessend 48 Std. in frisches Formalin einlegen. Das Gewebe wird dadurch etwas spröde und schwieriger für die histologische Bearbeitung. Ohne diesen Schritt können aber die Paraffinblöcke noch infektiös bleiben. - Alle Instrumente, Handschuhe, etc. mit potentiell infektiösem Material müssen dekontaminiert werden. Instrumente, die mit Formalin-fixiertem Material ohne Ameisensäurevorbehandlung in Berührung kamen, werden nicht durch Autoklavieren, sondern durch Einlegen in 2 N NaOH für 1 Std. dekontaminiert. - Gewebsreste, Schnittabfälle und kontaminierte Formalin-Lösungen sollen in einem Plastikbehälter als infektiöser Krankenhausmüll durch Verbrennung entsorgt werden. Akzidentelle Verletzungen bei Risikoautopsien - Wunde während einigen Minuten bluten lassen, dann mit Seife gründlich reinigen und anschliessend mit 80 %igem Aethylalkohol oder Sterillium desinfizieren. - Nicht penetrierende Hautverletzungen bei übertragbaren spongioformen Enzephalopathien mit frischer, 2,5 %iger Natrium-Hypochloridlösung (muss im Seziersaal bereitstehen) desinfizieren. - Bei Kontamination von Augen oder Schleimhäuten kontaminierte Stelle gründlich abwaschen. Augen längere Zeit am fliessenden Wasser oder mit Augendusche reinigen. - Meldung an den Vorgesetzten und den personalärztlichen Dienst aus medizinischen und versicherungstechnischen Gründen. Das Autopsieprotokoll Alle Befunde sind zu beschreiben, entweder als freier Text oder mit Hilfe eines vorgedruckten Schemas. Wichtige Befunde sind zu fotografieren und/oder in Skizzen (ad hoc oder Schematas) festzuhalten. Masse und Gewichte werden in das Protokoll integriert oder auf einem separaten Blatt festgehalten. Obligat: Körpergrösse (und –gewicht). Hirngewicht, Gewicht und Masse von Herz (Wanddicke der Ventrikel), Leber, Milz und beider Nieren. Histologische Untersuchung Das Ausmass der histologischen Untersuchung richtet sich nach der Komplexität der Autopsie, dient aber auch der Dokumentation. - Fälle ohne besondere Fragestellung oder bereits aufgrund der makroskopischen Befunde eindeutig: Histologische Untersuchung einer Gewebsprobe der wichtigsten Organe. - Bei Fällen mit malignen Tumoren zusätzlich Primärtumor und - wenn vorhanden - mindestens eine Metastase histologisch untersuchen. - Aetio-pathogenetisch unklare Fälle: erweiterte gezielte histologische Dokumentation. Reg. 2 Autopsien 5 Eine Beschreibung der histologischen Befunde ist fakultativ. Alle histopathologischen Befunde müssen aber bei der Formulierung der definitiven Diagnose berücksichtigt werden. Besondere histologische Befunde inkl. Im munhistochemie, Elektronenmikroskopie, Mikrobiologie, etc. müssen schriftlich festgehalten werden, falls sie nicht in der Schlussdiagnose genügend ausformuliert erscheinen. Die formalinfixierten Gewebsproben (Feuchtmaterial) müssen bis zur Formulierung der endgültigen Diagnose aufbewahrt werden. Schnitte und Blöcke aller Autopsien sollen mindestens so lange aufbewahrt werden, wie es kantonal vorgeschrieben ist. Bezüglich Eigentum sind kantonale Bestimmungen massgebend. Die Autopsiediagnose Er ist an den Auftraggeber und an die im Auftragsformular vermerkten Aerzte (Kopien) zu richten. Am Anfang des Dokumentes müssen folgende Angaben gemacht werden: - Name, Adresse, Telefon- und Fax-Nummer des Institutes. - Autopsienummer (für jedes Jahr fortlaufend). - Name (bei Frauen auch Mädchenname), Vorname und vollständiges Geburtsdatum - Tag und Zeitpunkt der Autopsie. - Obduzent und Supervisor. - Auflistung der Empfänger der Autopsiediagnose. - Abschlussdatum für vorläufige und definitive Diagnose. Die vorläufige Autopsiediagnose, die auf makroskopischen Befunden und den Vorbefunden beruht, sollte innerhalb einer Woche, die definitive Autopsiediagnose, in der auch die histologischen Befunde integriert sind, innerhalb von 2 Monaten abgegeben werden. Die definitive Diagnose soll eine Synthese aller makroskopischen, mikroskopischen und klinisch relevanten Befunde sein. Auflistung aller Befunde in einer bestimmten Organreihenfolge - ätio-pathogenetische Gliederung. Ein Kommentar zur Diagnose ist angezeigt, wenn - sich die Beantwortung der Fragen des Klinikers nicht aus der Autopsiediagnose ergibt. - die Todesursache unklar ist. - die Autopsie eine relevante Diskrepanz zu bioptischen oder zytologischen Vorbefunden ergibt. - ungewöhnliche morphologische Befunde eine Erklärung notwendig machen. Interne Qualitätskontrolle (siehe Seite 7) Es wird empfohlen institutsintern jährlich bei mind. 10% der Autopsien, proportional auf die Supervisoren verteilt, diese Qualitätskontrolle durchzuführen und das Ergebnis im Staff zu diskutieren. Klinisch-pathologisch-anatomische Demonstrationen Wünschbar ist eine Demonstration und Diskussion der pathologisch-anatomischen Befunde für die in Behandlung und Diagnostik involvierten klinischen Aerzte unmittelbar im Anschluss an die Autopsie. Wenn dies nicht möglich ist, muss eine telefonische Orientierung erfolgen. Reg. 2 Autopsien 6 Von grossem Nutzen für die Qualitätskontrolle (für Kliniker und Pathologen) sowie für die Weiter- und Fortbildung sind wöchentliche Demonstrationen bei Anwesenheit der Klinik- und Pathologie-Staffs. Hiefür können Organe oder Organteile aufbewahrt oder allenfalls konserviert werden. Geeignet sind auch Diapositive oder Videobilder, die von makroskopischen und mikroskopischen Befunden erstellt wurden. Falls Organe demonstriert werden, muss die Möglichkeit zu einer nachträglichen Einäscherung in einer hiefür geeigneten Anlage (nach Möglichkeit Krematorium) bestehen. Literatur Laissue JA, Altermatt HJ, Zurcher B, Truniger B, Gebbers JO. Significance of autopsy. Continuous evaluation of autopsy findings by internists. Schweiz Med Wochenschr 1986; 116: 130-134. Bauer TM, Potratz D, Goller T, Wagner A, Schafer R. Quality control by autopsy. How often do the postmortem examination findings correct the clinical diagnosis? Dtsch Med Wochenschr 1991; 116: 801-807. Budka H, Aguzzi A et al. Konsensusbericht: Die Gewebsbehandlung bei Verdacht auf Creutzfeldt-Jakob-Krankheit und andere spongiforme Enzephalopathien (Prionen-Krankheiten) des Menschen. Pathologe 1996; 17: 171-176. McPhee SJ. Maximizing the benefits of autopsy for clinicians and families. What needs to be done. Arch Pathol Lab Med 1996; 120: 743-748 Zarbo RJ, Baker PB, Howanitz PJ. Quality assurance of autopsy permit form information, timeliness of performance, and issuance of preliminary report. A College of American Pathologists Q-Probes study of 5434 autopsies from 452 institutions. Arch Pathol Lab Med 1996; 120: 346-352 Reg. 3 Chirurgische Pathologie 1 CHIRURGISCHE PATHOLOGIE A Entnahme, Asservierung, Identifikation und Transport des Materials Eine gute pathologisch-anatomische Untersuchung ist abhängig von einer korrekten chirurgischen oder endoskopischen Biopsieentnahme. In Merkblättern, die den Klinikern abgegeben werden, soll über die Art der Biopsieentnahme, Fixation, Markierung des Materials, Beschriftung, Vorschriften für den Transport und notwendige klinische Angaben informiert werden. 1. Entnahme und Markierung des Materials Eine Gewebsentnahme für eine histopathologische Untersuchung soll nach Möglichkeit repräsentativ für die klinisch beobachtete Läsion sein. Das Material soll nicht fragmentiert oder eingeschnitten werden und vollständig an den Pathologen geschickt werden. Falls ein Teil des Materials für Forschungszwecke oder spezielle Untersuchungen an ein anderes Laboratorium gehen soll, muss die Aufteilung des Materials im Institut für Pathologie durch einen Pathologen erfolgen. Für Forschungszwecke abgegebenes Material muss von der Untersuchsstelle zurückgefordert werden können, falls der Fall wegen Unvollständigkeit des Untersuchungsmaterials nicht abgeschlossen werden kann. Für gezielte Gewebsentnahmen oder solche, die eine räumliche Orientierung verlangen, muss der Chirurge das Exzisat markieren, z.B. mit verschieden langen Fäden, um so dem Pathologen eine dreidimensionale Orientierung am Präparat zu ermöglichen. Die Markierungen müssen vom Chirurgen auf dem Einsendeformular beschrieben oder auf einer Skizze eingezeichnet werden. 2. Asservierung / Fixation Für Spezialuntersuchungen (Elektronenmikroskopie, Molekularbiologie, Immunhistochemie, Immunfluoreszenz, Zytogenetik, Zytometrie etc.) muss das Material frisch und unfixiert an das Institut für Pathologie geschickt werden. In einem Merkblatt sollen die besonderen Situationen, bei denen solche Zusatzuntersuchungen angezeigt sind, für den Kliniker aufgelistet werden. Dieses soll auch den Namen einer kompetenten Kontaktperson enthalten, die den Einsender über die Indikationen einer Spezialuntersuchung und die hierfür notwendigen Voraussetzungen orientieren kann. Wenn das Material gleich nach Entnahme fixiert wird, ist auf ein optimales Verhältnis zwischen Fixationslösung (10 Volumenteile) und Gewebe (1 Volumenteil) zu achten. Für gewisse Biopsien (z.B. Niere, Hoden, Knochenmark) sind spezielle Fixationslösungen notwendig. Diese sind auf dem Merkblatt für den Einsender aufzuführen. Falls Gewebeproben falsch fixiert, unfixiert (NaCl), fixiert statt frisch oder umgekehrt eingeschickt werden, muss dies bei der Annahme vermerkt werden. Im histopathologischen Bericht muss darauf eingegangen und der Einsender auf das korrekte Prozedere aufmerksam gemacht werden. 3. Transport Die Modalitäten für einen Transport von unfixiertem Frischgewebe (spitalinterner Transportdienst, Rohrpost, Taxi etc.) müssen zwischen dem Einsender und dem Pathologen abgesprochen sein. Die Verantwortung für einen möglichst raschen Transport liegt beim Einsender. Beim Material, das zu spät eintrifft, müssen Datum und die genaue Ankunftszeit im Institut registriert werden. Reg. 3 Chirurgische Pathologie 2 4. Identifizierung des Materials Die Verantwortung für eine korrekte Bezeichnung des Materials liegt beim Einsender, der die Gewebsentnahme vorgenommen hat. Jeder Behälter mit Gewebsproben muss mit folgenden Angaben etikettiert werden: - Name, Vorname(n) - vollständiges Geburtsdatum - bei mehreren Proben vom gleichen Patienten alphabetischer oder numerischer Index - Entnahmestelle (ausgeschrieben). Im Einsendeformular muss jede Probe mit dem gleichen Buchstaben oder der gleichen Zahl, wie sie auf dem Behälter angeschrieben wurde, unter Angabe der Art der Gewebeprobe aufgeführt sein. 5. Angaben des Auftraggebers (Auftragsformular) Zu jeder pathologisch-anatomischen Untersuchung gehört ein vollständig ausgefülltes Einsendeformular (Auftragsformular für eine pathologisch-anatomische Untersuchung). Falls für eine Untersuchung mehrere Gewebeproben entnommen werden, genügt ein Formular. Jede einzelne Probe muss aber eindeutig identifiziert, numeriert und auf dem Einsendeformular erwähnt werden. Alle Informationen auf dem Einsendeformular müssen mit den Angaben auf den Behältern übereinstimmen. Das Einsendeformular muss folgende Angaben enthalten: - Name (auch Mädchenname) und Vorname des Patienten - Geschlecht - vollständiges Geburtsdatum - Patientennummer (bei Spitalpatienten) - Privat- und Spitaladresse des Patienten - Datum und Uhrzeit der Gewebsentnahme - Angaben zu Anamnese, Klinik und Labor - Klinische Diagnose oder Differentialdiagnose - Entnahmestelle und Art des Materials - Resultate früherer histopathologischer oder zytologischer Untersuchungen - Fragestellung an den Pathologen - Erwähnung allfälliger infektiöser Risiken (spezielle Kennzeichnung des Formulars) - Name, Adresse und Telefonnummer des Einsenders - Name des oder der behandelnden Aerzte Die Einsendeformulare müssen solange archiviert werden wie es die kantonalen Vorschriften verlangen. 6. Empfang und Uebernahme des Materials durch den Pathologen Die Annahmezeiten müssen geregelt sein und den Auftraggebern auf entsprechenden Merkblättern bekannt gegeben werden. Annahmen von Untersuchungsmaterial ausserhalb der regulären Oeffnungszeiten müssen zwischen dem Einsender und einem Pathologen für den Einzelfall abgesprochen werden. Nach Empfang des Untersuchungsmaterials an einem hierfür klar bezeichneten Ort, ist der Pathologe für dieses verantwortlich. Er kann jedoch die Annahme verweigern, wenn die oben erwähnten Bedingungen nicht erfüllt sind (z.B. kein oder unvollständig ausgefülltes Einsendeformular, Material ungenügend gekennzeichnet oder Behälter nicht oder ungenügend beschriftet). Die Entscheidung eine Annahme zu verweigern, muss von einem Pathologen getroffen werden. Vorgängig soll der Auftraggeber informiert werden. Falls die gewünschten Informationen nicht geliefert werden, wird das Material an den Einsender zurückgeschickt. Fälle, deren Annahme verweigert wurde, müssen unter Angabe der Gründe registriert werden. Reg. 3 Chirurgische Pathologie 3 Sobald der Fall akzeptiert ist, wird er mit einer Nummer (Probennummer) versehen. In der Regel erhält jede Entnahmestelle eine eigene Probennummer. Pro Patient können deshalb mehrere Nummern vergeben werden. Datum und Zeit des Eingangs im Institut müssen registriert werden. 7. Qualitätskontrolle der Einsendungen Alle Fälle, die in bezug auf Art der Entnahme, Fixation, Transport oder Identifikation beanstandet werden müssen, sollten gesondert registriert werden. Die Einsendeformulare müssen systematisch in bezug auf ihre Vollständigkeit überprüft werden. Falls vom gleichen Einsender wiederholt ungenügende Angaben gemacht werden, soll dieser durch den Institutsvorsteher schriftlich darüber orientiert werden. Der Einsender muss infektiöse Krankheiten (HIV, Hepatitis, Tuberkolose, etc.) speziell vermerken. Reg. 3 Chirurgische Pathologie 4 B Schnellschnittuntersuchungen 1. Indikation Die Indikationen sind: - Histopathologische Diagnose während der Operation um das operative Vorgehen festzulegen - Untersuchung von Resektionsflächen in bezug auf Tumorfreiheit - Entscheid ob das eingesandte Material in bezug auf Quantität und Qualität für eine spätere definitive Diagnose am Einbettschnitt genügt - Gewinnung von Frischmaterial für Spezialuntersuchungen Das Resultat einer Schnellschnittuntersuchung ist abhängig von einer korrekten Indikationsstellung, der Qualität der klinischen Information, einer klaren Fragestellung des Auftraggebers, der Qualität des entnommenen Gewebes und der fachlichen Kompetenz des Pathologen. Das Vorgehen bei einer Schnellschnittuntersuchung soll im Institut schriftlich festgehalten sein. Dazu gehören Anweisungen für die Identifikation und Wahl der zu untersuchenden Gewebsprobe(n) sowie Gefrieren, Schneiden und Färben des Materials. Es soll auch angegeben werden, wie das Resultat der Untersuchung schriftlich festzuhalten und dem Einsender mitzuteilen ist. 2. Entnahme, Asservierung, Identifikation und Transport des Materials In bezug auf die Entnahme gilt das unter A1 Gesagte. Die Angaben des Chirurgen sind in bezug auf Orientierung am Exzisat und Wahl der zu untersuchenden Gewebspartie(n) durch den Pathologen besonders wichtig. Das Material für eine Schnellschnittuntersuchung sollte nach Möglichkeit kein Knochengewebe enthalten. Die für eine Schnellschnittuntersuchung bestimmten Gewebe müssen im Frischzustand möglichst rasch in das Institut für Pathologie geschickt werden. Wenn der Transport länger als ein paar Minuten dauert, soll das Gewebe trocken in einem Behälter (ohne direkten Kontakt mit physiologischen Lösungen) auf schmelzendem Eis transportiert werden. Unsachgemäss eingeschicktes Material muss protokolliert werden. In bezug auf den Transport gilt das unter A3 Gesagte: Der Auftraggeber notiert die Abgangszeit der Probe aus dem Operationssaal, die Pathologie die Ankunftszeit im Institut. Abnorm lange Transportzeiten werden registriert. In bezug auf die Identifikation des Materials gilt A4: Ein vollständig ausgefülltes Einsendeformular gemäss den Empfehlungen unter A5 muss in jedem Fall das Untersuchungsmaterial begleiten. Auf dem Formular muss ausdrücklich vermerkt werden, dass es sich um eine Schnellschnittuntersuchung handelt. Es kann hierfür auch ein speziell konzipiertes Einsendeformular geschaffen werden (siehe Anhang 1). Für jede Schnellschnittuntersuchung sind folgende Angaben unerlässlich: - Anamnese und klinische Diagnose - präzise Fragestellung des Chirurgen - Angabe über ein mögliches Infektionsrisiko - frühere pathologisch-anatomische (inkl. zytologische) Untersuchungen/Diagnosen - Telefonnummer und Name des Auftragebers Der Pathologe kann die Durchführung einer Schnellschnittuntersuchung verweigern, falls die oben erwähnten Bedingungen nicht erfüllt sind (z.B. kein oder unvollständig ausgefülltes Einsendeformular, Untersuchungsmaterial ungenügend bezeichnet oder Behälter ungenügend etikettiert, falsche Indikationsstellung). In diesem Fall nimmt er sofort mit dem Einsender Kontakt auf, um sich die fehlenden Informationen zu beschaffen oder die Indikationsstellung zu diskutieren. Der Entscheid auf eine Schnellschnittuntersuchung zu verzichten muss gemeinsam vom Pathologen und dem Auftraggeber gefasst werden. Fälle, bei denen Reg. 3 Chirurgische Pathologie 5 eine Schnellschnittuntersuchung verweigert wurde, müssen unter Angabe der Gründe registriert werden. Die Voraussetzungen, die für die Annahme einer Schnellschnittuntersuchung während und ausserhalb der Oeffnungszeiten des Instituts erfüllt sein müssen, sollen definiert und dem Einsender bekanntgegeben werden (z.B. durch Versand eines entsprechenden Merkblattes). 3. Arbeitsplatz Für die Schnellschnittuntersuchungen muss ein hierfür geeigneter, sauberer und genügend grosser Arbeitsplatz mit guter Beleuchtung zur Verfügung stehen. Die Arbeitsfläche darf nicht porös sein und muss leicht desinfiziert werden können. Das Instrumentarium umfasst ein Dissektionsbesteck, Massstab, Waage, eine Gefriereinrichtung, einen Kryostaten und Färbelösungen. Kulturmedien und Fixationslösungen für Spezialuntersuchungen (z.B. Glutaraldehyd) sollen in Reichweite sein. Der Arbeitsplatz wird von einer hierfür verantwortlichen Person regelmässig gewartet und desinfiziert. Diese kontrolliert auch das Instrumentarium auf Vollständigkeit. In einem Arbeitsheft wird laufend notiert, wann die Reinigung des Arbeitsplatzes und des Kryostaten und die Erneuerung der Färbelösungen (in der Regel einmal täglich) erfolgte. 4. Makroskopische Beurteilung von Schnellschnittmaterial Die Beschreibung des makroskopischen Befundes erfolgt durch einen erfahrenen Pathologen. Diese ist Bestandteil des definitiven Berichtes. Der verantwortliche Pathologe entscheidet, ob aufgrund des makroskopischen Befundes eine sichere Diagnose abgegeben werden kann. In diesem Fall erfolgt anstelle der Schnellschnittuntersuchung eine übliche histologische Aufarbeitung. Der verantwortliche Pathologe entscheidet, ob ein Teil des Materials für Spezialuntersuchungen (z.B. Mikrobiologie, Hormonrezeptorbestimmung, Elektronenmilkroskopie etc.) asserviert werden soll. Bei Bedarf erstellt der Verantwortliche Pathologe Tupfpräparate für zytologische Untersuchungen und/oder für spezielle Zusatzanalysen (z.B. Zytometrie). 5. Kryostatschnitte Die Kryostatschnitte müssen durch eine erfahrene Person hergestellt werden. Der Pathologe beurteilt die Qualität der Schnitte und entscheidet, ob weitere Schnitte auf gleichem Niveau oder tiefer (Stufenschnitte) erforderlich sind. Auf Objektträgern mit Gefrierschnitten einer Schnellschnittuntersuchung müssen mittels einer nicht abwischbaren Schrift der Name des Patienten und die Probennummer angebracht werden. Es ist besonders darauf zu achten, dass es zu keiner Verwechslung von Proben kommt. 6. Mikroskopische Beurteilung der Schnellschnitte Die Beurteilung erfolgt durch einen erfahrenen Pathologen, der über die klinischen und – falls vorhanden – auch über frühere histopathologische oder zytologische Befunde orientiert ist. Letztere müssen ihm unbedingt vom Einsender mitgeteilt werden. Wenn die Beurteilung unsicher ist, soll ein zweiter erfahrener Pathologe zugezogen werden, falls ein solcher im gleichen Haus vorhanden ist. Eine Diagnose soll nur abgegeben werden, wenn in bezug auf die Interpretation keine Zweifel bestehen. Ist diese unsicher, muss die definitive Diagnose zurückgestellt werden. In diesem Fall wird dem Einsender mitgeteilt, weshalb keine sichere Diagnose gestellt werden kann. An ihrer Stelle wird eine deskriptive Diagnose oder Differentialdiagnose abgegeben. Reg. 3 Chirurgische Pathologie 6 7. Uebermittlung des Resultates Das Resultat der Schnellschnittuntersuchung muss raschmöglichst direkt dem Chirurgen und nicht via Personal des Operationssaales mitgeteilt werden. Falls der Chirurge nicht direkt erreichbar ist, kann das Resultat einem anderen an der Operation beteiligten Arzt (z.B. Anästhesie-Arzt) mitgeteilt werden. Die Mitteilung kann direkt mündlich, per Telefon oder Interfon, erfolgen. Der Pathologe, der das Resultat durchgibt, gibt seinen Namen bekannt. Er nennt den Namen des Patienten, die Art des untersuchten Gewebes und die Diagnose. Der Chirurg gibt seinen Namen ebenfalls bekannt und bestätigt den Empfang der Mitteilung, indem er die durchgegebene Diagnose wiederholt. Die Diagnose der Schnellschnittuntersuchung und die Zeit zu welcher diese abgegeben wurde, werden sofort auf dem Auftragsformular notiert. Die Schnellschnittdiagnose muss auch im definitiven Bericht erwähnt werden. 8. Archivierung Die histologischen Schnittpräparate einer Schnellschnittuntersuchung werden nach den gleichen Prinzipien archiviert, wie dies für die definitiven gilt. Der Rest des gefrorenen Materials wird fixiert und für die definitive Beurteilung in Paraffin eingebettet. 9. Qualitätskontrolle Die Qualität der Schnellschnittuntersuchung muss in bezug auf korrekte Indikationsstellung, Dauer der Untersuchung und Qualität der Diagnose beurteilt werden. Die Indikationen für eine Schnellschnittuntersuchung sind unter B1 aufgeführt. Der Chirurge ist verantwortlich für eine korrekte Indikationsstellung. Der Pathologe hat darüber zu wachen, dass sich der Chirurge an die genannten Kriterien hält. Eine Schnellschnittuntersuchung kann vom Pathologen verweigert werden, wenn dadurch eine definitive Diagnose gefährdet oder verunmöglicht wird oder wenn keinerlei Aussicht besteht, dass eine für den Chirurgen unmittelbar nützliche Diagnose gestellt werden kann. Eine systematisch und periodisch durchzuführende Kontrolle muss auch folgende Punkte erfassen: - korrekte Indikationsstellung durch den Chirurgen, besonders im Hinblick darauf, ob das zu erwartende Resultat einen Einfluss auf die Operationstaktik hätte haben können - ob der Pathologe durch die Annahme und Durchführung einer Schnellschnittuntersuchung allenfalls eine definitive Diagnosestellung verunmöglichte. Es ist schwierig festzulegen, wie lange eine Schnellschnittuntersuchung dauern darf. Die Zeit zwischen Ankunft des Materials und Durchgabe der Diagnose soll jedoch periodisch kontrolliert werden. Starke Abweichungen vom mittleren Zeitbedarf müssen abgeklärt und gegebenenfalls müssen präventive Massnahmen ergriffen werden. Folgende Punkte müssen periodisch und systematisch überprüft werden: - stimmen Schnellschnittdiagnose und definitive Diagnose überein oder besteht eine Diskrepanz - war eine Diskrepanz von klinischer Bedeutung (relevant oder irrelevant) - was war die Ursache einer relevanten Diskrepanz - war ein Hinausschieben der Diagnose gerechtfertigt Die häufigsten Ursachen für eine Diskrepanz zwischen Schnellschnittdiagnose und definitiver Diagnose sind: - inadäquate Probeentnahme durch den Chirurgen - ungenügende klinische Informationen - Probleme bei der Identifikation des Materials (Verwechslung der Proben im Operationssaal oder im Institut für Pathologie) - Inadäquate Auswahl der zu untersuchenden Gewebspartie(n) durch den Pathologen (Läsion makroskopisch nicht erkannt, schlechte Auswahl der Probe, Läsion ungenügend erfasst) Reg. 3 Chirurgische Pathologie 7 - Qualität des Gefrierschnittes ungenügend oder zu wenig tief angeschnitten - Probleme der Färbung - ungenügende oder falsche Interpretation des Befundes durch den Pathologen Die Diskrepanzen in Bezug auf ihre Auswirkungen auf den Patienten und seine Behandlung können folgendermassen klassiert werden: - gering und ohne Konsequenzen für die Behandlung des Patienten - gross oder relevant für den Patienten und seine Behandlung Ein Beispiel für die Qualitätskontrolle der Schnellschnittuntersuchungen findet sich im Anhang 2. Reg. 3 Chirurgische Pathologie 8 C Makroskopische und mikroskopische Untersuchung Grundsätzlich soll alles von einem Patienten stammende Material pathologisch-anatomisch untersucht werden. Die wichtigsten Ausnahmen sind: - Prothesen und anorganische harte Fremdkörper, die nicht histologisch untersucht werden können - Zähne (in indizierten Ausnahmefällen nach langer Entkalkung möglich) - normales Gewebe, das bei plastischen Operationen entfernt wurde 1. Makroskopische Untersuchung Die makroskopische Beurteilung ist ein sehr wichtiger Teil der pathologisch-anatomischen Untersuchung. Sie beinhaltet die Beschreibung des eingesandten Materials, die Wahl der histologisch zu untersuchenden Gewebspartien und der anzuwendenden Techniken. Hierfür brauchen der Pathologe und das technische Hilfspersonal geeignete Räumlichkeiten und technische Mittel, welche den Ergonomie- und Sicherheitsnormen genügen. Schriftliche Instruktionen für den persönlichen Schutz und die Sicherheit am Arbeitsplatz müssen vorhanden sein. Es empfiehlt sich, hierfür die SUVA-Broschüre Arbeitsmedizin Nr.25 „Verhütung von Berufskrankheiten in pathologisch-anatomischen Instituten und histologischen Laboratorien“, Dezember 1993 zu benützen (Bestell-Nr. 2869/25d). Am Arbeitsplatz muss ein Ventilationssystem für die Eliminierung der Formalindämpfe installiert sein. Es muss eine Liste der für die Untersuchung notwendigen Instrumente und Apparate vorhanden sein. Installationen, Apparate und Instrumente müssen unter der Verantwortung eines Laborchefs periodisch kontrolliert, gereinigt und unterhalten werden. Durchgeführte Kontrollen, Reinigungen und Unterhaltsarbeiten sollen registriert werden. Die makroskopische Untersuchung muss durch einen erfahrenen Pathologen oder unter seiner Verantwortung durch einen Assistenten durchgeführt werden. Einsendungen bei denen die makroskopische Beurteilung kein spezialisiertes Fachwissen voraussetzt, können von erfahrenen Laboranten/innen verarbeitet werden (z.B. Nadelbiopsien, Prostataresektionsschnitzel). Schriftliche Anleitungen für die Beschreibung und Aufarbeitung (dissection) der Operationspräparate sowie für die Entnahme der zu untersuchenden Gewebsproben müssen vorhanden sein. In Check-Listen werden die zu erfüllenden Minimalanforderungen festgehalten. Diese Anleitungen müssen datiert sein und regelmässig aktualisiert werden. Sie sollen auch Angaben über spezielle Fixationstechniken und die Indikationen für Spezialuntersuchungen (z.B. Immunhistochemie, Elektronenmikroskopie, Zytogenetik etc.) enthalten. Vor der Aufarbeitung des Materials muss dieses identifiziert und mit den Angaben auf dem Auftragsformular verglichen werden. Wenn eine Diskordanz besteht oder Unklarheiten vorhanden sind, muss der Einsender kontaktiert werden. Nachträglich erhaltene Zusatzinformationen müssen auf dem Einsendeformular schriftlich festgehalten werden. Die makroskopische Beschreibung einer Einsendung muss enthalten: - genaue Masse der Exzisate und ev. vorhandener zusätzlicher Fragmente - Gewicht (endokrine Organe, Tumoren, Hysterektomiepräparate etc.) - anatomische Lokalisation einer Läsion - Grösse der Läsion - Beziehung der Läsion zu bestimmten anatomischen Strukturen - Beschaffenheit der Ober- und Schnittfläche, der Form, Farbe und Konsistenz der Läsion - die Art wie eine Läsion anatomische Strukturen verändert - Beziehung der Läsion zu den Resektionsrändern Reg. 3 Chirurgische Pathologie 9 Der/die Laborant/in notiert auf einem Laborbegleitformular oder gibt direkt in das EDVSystem ein: - Probennummer - Entnahmestelle - Anzahl Gewebepartikel pro Probe - vom Pathologen angeordnete Spezialfärbungen - Untersuchungsmaterial teilweise (es bleibt Restmaterial) oder vollständig eingebettet - Asservierung von Gewebe für Spezialuntersuchungen - fotografische Dokumentation Es empfiehlt sich interessante, ungewöhnliche oder seltene Präparate für Aus- und Fortbildung sowie im Hinblick auf Publikationen zu fotografieren. Von komplizierten Operationspräparaten sollen Skizzen, Fotokopien oder Fotografien hergestellt werden, auf denen die Entnahmestellen der Gewebsproben eingezeichnet werden können. Die Gewebsproben sollen in hierfür geeigneten Dimensionen korrekt fixiert werden. Die Qualität der Fixationslösungen muss durch den Laborchef dauernd überwacht werden. 2. Histologietechnik Es muss ein Labor zur Verfügung stehen, das über die notwendigen technischen Mittel verfügt um Gewebsproben einzubetten, zu schneiden, zu färben und auf Objektträger aufzuziehen. Diese Einrichtungen müssen den gültigen Ergonomie- und Sicherheitsnormen genügen. Von den Apparaten und Instrumenten des histologischen Labors muss ein Inventar erstellt werden. Die Installationen, Apparate und Instrumente müssen unter der Verantwortung eines Laborchefs periodisch kontrolliert, gereinigt und unterhalten werden. Durchgeführte Kontrollen, Reinigungen und Unterhaltsarbeiten werden registriert. Alle technischen Anleitungen sollen in einem Laborbuch zusammengefasst werden, welche auch die Empfehlungen für Schutz und Sicherheit am Arbeitsplatz enthalten soll. Potentiell toxische und/oder brennbare Reagenzien/Lösungen müssen als solche bezeichnet und entsprechend den feuerwehrpolizeilichen Vorschriften gelagert werden. Das Personal muss über die Gefährlichkeit der Reagenzien/Lösungen und über einzuhaltende Vorsichtsmassnahmen bei deren Umgang orientiert sein. Die Qualität der Reagenzien/Lösungen muss unter der Verantwortung des Laborchefs dauernd überwacht werden. Alle Lösungen und Produkte müssen das Herstell- und Verfalldatum tragen. Die Qualität des Einbettungsprozesses inkl. Orientierung der Gewebsstücke, der Schnitte (Dicke, Artefakte) und der Färbungen muss einer dauernden internen Kontrolle unterzogen sein. Laborchef und Pathologe tragen hierfür gemeinsam die Verantwortung. Die Teilnahme an einer externen Qualitätskontrolle, wie sie z.B. durch die Schweiz. Gesellschaft für Histotechnik und NEQUAS in England (siehe Kapitel „externe Qualitätskontrollen“) angeboten wird, wird empfohlen. 3. Mikroskopische Untersuchung Die histologische Untersuchung muss durch einen erfahrenen Pathologen oder unter seiner Supervision erfolgen. Die Block- und Schnittnummern müssen mit den Nummern des Laborbegleitformulars übereinstimmen. Die Beschreibung des mikroskopischen Befundes ist fakultativ. Sie kann aber unter folgenden Gesichtspunkten nützlich oder sogar notwendig sein: - objektive Befunderhebung, die einen Vergleich zu früheren histologischen Untersuchungen und eine Interpretation durch einen Zweitbeurteiler gestattet - erklärt die Kriterien, die zur Diagnose führen - zählt die morphologischen Elemente auf, die für eine Gradierung, ein Staging oder eine andere Methode mit prognostischer Aussagekraft gebraucht werden. Reg. 3 Chirurgische Pathologie 10 4. Spezialtechniken Die Anwendungen von Spezialtechniken (Immunhistochemie, Elektronenmikroskopie, in situHybridisierung, Zytogenetik, Molekularbiologie, Durchflusstytometrie, Histochemie) ist bei verschiedenen Fragestellungen zur Diagnosesuche, Sicherung der Diagnose oder für prognostische Aussagen angezeigt. Diese können im eigenen Labor durchgeführt oder einem externen Labor in Auftrag gegeben werden. Es gelten auch hier die unter Histologietechnik (C 2) aufgeführten Empfehlungen. Die Interpretation der Resultate von Spezialtechniken muss durch hierfür qualifizierte Personen, vorzugsweise durch spezialisierte Pathologen, vorgenommen werden. Die Resultate müssen in den histopathologischen Schlussberichten integriert werden. Die Indikationen für die Anwendung von Spezialtechniken müssen definiert sein. Es muss periodisch überprüft werden, ob die Indikationsstellungen korrekt waren. 5. Konsilien Interne oder externe Konsilien sind angezeigt: - bei ungewöhnlichen Fällen oder solchen von besonderem Interesse - bei unsicherer oder umstrittener (nicht allgemein anerkannter) Diagnose - bei institutsinternen Meinungsverschiedenheiten in bezug auf die Diagnose - auf Wunsch des Patienten oder des Klinikers Das Resultat eines Konsiliums muss im definitiven Bericht schriftlich festgehalten und in die Diagnose integriert werden. Bei einem internen Konsilium muss der konsultierte Pathologe den Bericht mitunterzeichnen oder im Bericht erwähnt werden. Bei einem externen Konsilium kann eine Kopie des konsiliarischen Berichtes dem definitiven Bericht beigelegt werden. Eine fortlaufende Registrierung aller Konsiliarfälle wird empfohlen (siehe Anhang). Interne oder externe Konsilien können auch auf Wunsch anderer Pathologen oder Kliniker erfolgen. In diesem Fall organisiert der primär verantwortliche Ortspathologe das Konsilium. Das Resultat wird in einem ergänzenden oder revidierten Bericht übermittelt. 6. Definitive Diagnose und Kommentar Für jede untersuchte Gewebsprobe muss eine eigene Diagnose gestellt werden (Ausnahme: mehrere Proben aus der gleichen Lokalisation). Die Nomenklatur soll für das ganze Institut und wenn möglich auch unter verschiedenen Instituten einheitlich sein. Sie muss mit anerkannten Klassifikationen (z.B. WHO und FIGO) konformgehen. In gewissen Situationen kann es angezeigt sein, für ein bestimmtes Institut oder Spital eine eigene Nomenklatur zu gebrauchen, unter der Voraussetzung, dass diese vom Kliniker verstanden und korrekt interpretiert werden kann. Ausser dem histologischen Befund müssen in die Diagnose je nach Fall auch der klinische Kontext, frühere histopathologische Diagnosen, der makroskopische Befund, die Lokalisation und das Resultat von Spezialuntersuchungen integriert sein. In periodisch zu überarbeitenden sogenannten Check-Listen werden Empfehlungen für die Formulierung der Diagnose sowie der vorzugsweise anzuwendenden Nomenklatur und Klassifikation gegeben. Ein Kommentar zu einer Diagnose ist angezeigt für: - Interpretation der Resultate von Spezialuntersuchungen - Vergleich des aktuellen mit einem früheren histologischen Befund - Diskussion einer Differentialdiagnose - Erklärung einer Mehrdeutigkeit eines Befundes oder des Sicherheitsgrades einer Diagnose - Erklärung der Gründe, die zu einer Diskrepanz zwischen Schnellschnitt- und definitiver Diagnose führten - Erklärung einer Diskrepanz zwischen früherer und aktueller histologischer Diagnose oder zwischen pathologisch-anatomischer und klinischer Diagnose Reg. 3 Chirurgische Pathologie 11 7. Codierung Ein Codierungssystem auf EDV soll vorhanden sein. Es dient folgenden Zwecken: - Suche von Vergleichsfällen für die Beurteilung aktueller Fälle - Suche interessanter Einzelfälle für die kontinuierliche Weiterbildung und den Unterricht - retrospektive Studien - statistische Erhebungen - Leistungsausweis für Pathologen in Ausbildung (log book) 8. Qualitätskontrolle Die Qualitätskontrolle muss technische und ärztlich-diagnostische Aspekte berücksichtigen. Die histologische und histochemische Technik muss durch die Pathologen, welche die Schnitte beurteilen, einer dauernden internen Kontrolle unterzogen werden. Die Beteiligung an einem externen Kontrollsystem, wie es z.B. von der Schweiz. Gesellschaft für Histologietechnik angeboten wird, wird empfohlen. Auch die Immunhistochemie bedarf einer dauernden internen Kontrolle. Der für das immunhistochemische Labor Verantwortliche (nach Möglichkeit ein Pathologe) soll - die Spezifität der angewandten Primärantikörper prüfen - kontinuierlich die Qualität der in Gebrauch stehenden Antikörperchargen überwachen - die Qualität der Fixation der für eine immunhistochemische Untersuchung vorgesehenen Gewebe kontrollieren - adäquate Positiv- und Negativkontrollen herstellen lassen - kontrollieren ob die Indikationen für die immunhistochemischen Untersuchungen korrekt gestellt wurden - kontrollieren, ob die Auswahl der Antikörper der histopathologischen Problemstellung adäquat war Die Beteiligung an einem externen Kontrollsystem (z.B. UK-NEQUAS) wird empfohlen. Immunhistochemische Präparate müssen auf die gleiche Art wie andere Schnitte archiviert werden. Von Immunfluoreszenzpräparaten sollen anstatt der Schnitte repräsentative Fotos archiviert werden. Die permanente interne Qualitätskontrolle der Elektronenmikroskopie soll durch diejenigen Pathologen erfolgen, welche sie betreiben und die Bilder interpretieren. Die Auswahl der Blöcke, die Beurteilung der Semidünnschnitte und die Untersuchung der Dünnschnitte im Elektonenmikroskop muss durch einen hierfür ausgebildeten Pathologen erfolgen. Ein Teil dieser Tätigkeiten kann auch einem erfahrenen Techniker übertragen werden. In diesem Fall müssen von den Präparaten Uebersichten und gezielte Aufnahmen der spezifischen diagnostischen Elemente hergestellt werden. Es muss eine genügende Zahl von Dünnschnitten und Netzfeldern untersucht werden. Auf den elektronenmikroskopischen Fotos müssen die Fallnummer, der Name des Labors, die Negativnummer, das Datum und die Vergrösserung angegeben sein. Für die Qualitätskontrolle der übrigen Spezialtechniken (Durchfluss- und statische Zytometrie, Bildanalyse, Zytogenetik, in situ-Hybridisierung, Molekularpathologie) sind die zuständigen Spezialisten oder spezialisierten Pathologen zuständig. Kontinuierliche Fortbildung sowie interne und externe Konsilien bilden die Basis für die Qualitätssicherung in der pathologisch-anatomischen Diagnostik. Unabhängig davon sollen interne retrospektive Kontrollen von zufällig ausgewählten Fällen durchgeführt werden. Diese können in Rotation durch verschiedene Pathologen oder auch durch einen Senior-Pathologen durchgeführt werden. Bei diesen Kontrollen sollen folgende Punkte berücksichtigt werden: - Qualität der Schnitte und der Färbungen - Genauigkeit der makroskopischen Beschreibung - adäquate Probenentnahme und genügende Zahl der Proben - Genauigkeit und Richtigkeit der mikroskopischen Beschreibung Reg. 3 Chirurgische Pathologie 12 - Richtigkeit der Diagnose - Zeitintervall zwischen Eintreffen des Materials und Abgabe des definitiven Berichtes (unter Berücksichtigung der Komplexität oder des Schwierigkeitsgrades eines Falles, sowie eines technisch aufwendigen Prozedere, z.B. Entkalkung) - adäquate Wahl der Spezialuntersuchungen - korrekte Codierungen für Diagnose und Rechnungsstellung Ein Schema für eine solche retrospektive Kontrolle findet sich im Anhang 4. Ueber die von Kollegen durchgeführten Kontrollen (peer review) muss Buch geführt werden. Bei wiederholt auftretenden Fehlern oder Unzulänglichkeiten müssen Massnahmen für deren Korrektur ergriffen werden. Durch Kontrollen in relativ kurzen Abständen, z.V. alle 3 Monate, können systematische Fehler in verschiedenen Bereichen rasch und effizient aufgedeckt werden (z.B. systematisch falsche Diagnose-Codierung durch einen Pathologen). Eine Kontrolle von 2-4% zufällig ausgewählter Fälle ist angezeigt. Die Resultate dieser Kontrollen sollen jährlich statistisch erfasst werden. Dies gestattet Jahresvergleiche und eine Evaluation der getroffenen präventiven oder korrektiven Massnahmen. Ein PC-Programm für die Erfassung und Auswertung der für eine Qualitätskontrolle relevanten Daten wurde von Prof. C.-Y. Genton (Institut für Pathologie, Lausanne) entwickelt. Es steht Interessenten gratis zur Verfügung. Reg. 3 Chirurgische Pathologie 13 D Berichterstattung Ein histopathologischer Bericht muss definiert sein als: - definitiv - provisorisch (vorläufig), wenn eine Verspätung für die Abgabe eines definitiven Berichtes voraussehbar ist, Spezialuntersuchungen durchgeführt werden müssen, frühere Schnittte eingesehen werden müssen oder ein externes Konsilium eingeholt werden muss - revidiert, wenn die Schlussdiagnose aufgrund neuer Aspekte, einer Spezialuntersuchung oder eines externen Konsiliums geändert werden muss - ergänzend, wenn durch zusätzliche Untersuchungen oder zusätzliche klinische Informationen eine Diagnose ohne substanzielle Aenderung präzisiert oder vervollständigt werden kann - korrigiert, wenn der Bericht wegen Fehlern in Orthographie, Grammatik oder in bezug auf numerische Angaben modifiziert werden muss, ohne dass die definitive Diagnose eine Aenderung erfährt Ein pathologisch-anatomischer Bericht muss enthalten: - Untersuchungsnummer - demografische Angaben über den Patienten (Name inkl. Mädchenname, Vorname, vollständiges Geburtsdatum) - Patientennummer (bei Spitalpatienten) - Name und Adresse des einsendenden Arztes - Liste der Kopieempfänger (behandelnde Aerzte) - klinische Angaben (inkl. spätere z.B. telefonisch eingegangene Angaben - Art und Entnahmestelle des eingesandten Untersuchungsmaterials - Empfangsdatum und Datum der Berichtabgabe - makroskopische Beschreibung - mikroskopische Beschreibung (falls notwendig) - histopathologische Diagnose (vorläufige oder definitive) - Unterschrift (manuell oder elektronisch) Je nach Fall zusätzlich: - Schnellschnittdiagnose - Resultat eines internen oder externen Konsiliums - Resultate und Interpretation zusätzlicher Spezialuntersuchungen - Vergleich mit den Resultaten früherer Untersuchungen - Kommentar - Literaturangaben zum Fall Reg. 3 Chirurgische Pathologie 14 E Archivierung Es müssen archiviert werden: - Auftragsformulare der histopathologischen Untersuchungen - vom Auftraggeber gelieferte zusätzliche Dokumente, die den Patienten betreffen (Endoskopie- und Operationsberichte, klinische oder früherer auswärtige pathologischanatomische Berichte, erklärende Skizzen zur Gewebsentnahme etc.) - Paraffinblöcke - histologische Schnittpräparate (Schnellschnittpräparate und definitive) - Dokumente und Material durchgeführter Spezialuntersuchungen - histopathologische Berichte Die oben erwähnten Dokumente müssen mindestens so lange aufbewahrt werden wie es die kantonalen Vorschriften verlangen. Das von histopathologischen Untersuchungen übrig bleibende Restmaterial muss mehrere Tage über die Abgabe der definitiven Diagnose hinaus aufbewahrt werden. Bei Einwänden gegen die Diagnose von Seiten des Einsenders oder dem Wunsch nach zusätzlichen Informationen können daraus weitere Proben entnommen werden. Dokumente und Material müssen so archiviert sein, dass sie auf einfache und schnelle Art gefunden werden können. Sie müssen leihweise oder in Kopien an andere Institute abgegeben werden, falls diese bei der Beurteilung einer Einsendung auf die Daten früherer Untersuchungen angewiesen sind. Das Material bleibt jedoch im Besitz des Erstuntersuchers und muss diesem zurückerstattet werden. Reg. 3 Chirurgische Pathologie Anhang 1 AUFTRAG FÜR EINE SCHNELLSCHNITTUNTERSUCHUNG Patient Name: Vorname: Geschlecht: m / w Geburtsdatum: Patientennummer: Art der gewünschten Untersuchung: o Schnellschnittuntersuchung o Makroskopische Beurteilung Klinische Angaben: Klinische Diagnose: Genaue Entnahmestelle der Probe(n): Aspekt und Ausdehnung der Läsion: Vorgeschichte (insbesondere Tumoranamnese): Frühere histopathologische oder zytologische Diagnosen: Infektionsrisiko: o nein o ja, welches: Genaue Fragestellung(en): Datum: Zeit der Gewebsentnahme: Einsender (Arzt): Telefonnummer für die Durchgabe der Diagnose: Pathologisch-anatomische Untersuchung Ankunftszeit im Institut: Probennummer: Makroskopische Beschreibung: Entnahmen für mikroskopische Untersuchung: Entnahmen für Spezialuntersuchungen (Hormonrezeptoren, Tiefkühlung, Mikrobiologie, Elektronenmikroskopie etc.): Histopathologische Schnellschnitt-Diagnose: Zeitpunkt der Durchgabe der Diagnose: Arzt, dem die Diagnose mitgeteilt wurde: Pathologe: Reg. 3 Chirurgische Pathologie Anhang 2 PROTOKOLL FÜR DIE QUALITÄTSKONTROLLE VON SCHNELLSCHNITTEN Fallnummer: Verantwortlich: Reviewer: Schnellschnitt-Diagnose: Definitive Diagnose: Diskordanz zwischen Schnellschnitt und definitiver Diagnose: o ja relevant o nicht relevant o o nein Gründe für die Diskrepanz (falls relevant): Schlechte Probenauswahl durch den Chirurgen o Angaben des Chirurgen ungenügend o Probleme der Materialidentifikation o Schlechte Probenentnahme durch den Pathologen o Schnittproblem o Problem der Färbung o Beurteilungsproblem o Anderes o Dauer der Untersuchung in Minuten: Qualität der klinischen Angaben: Bemerkungen: ogut ogenügend oungenügend Reg. 3 Chirurgische Pathologie Anhang 3 EXTERNE KONSILIEN Pathologe Fall-Nr. Dr. A.X. 99.677 Name des Eigene Konsiliarische Folge Konsultierten Diagnose Diagnose AFIP Pleomorphes Malignes revidierter Liposarkom fibröses Bericht Histiozytom Dr. A.Z. 99.10455 Prof. H.Y. Fibröse Fibröse Ergänzender Dysplasie Dysplasie Bericht Reg. 3 Chirurgische Pathologie Anhang 4 EVALUATIONSPROTOKOLL HISTOPATHOLOGIE Fallnummer: Verantwortlicher: Name des Reviewers: Art des Materials: o Kleine endoskopische Biopsie o Biopsie o Operationspräparat Zeitdauer (Tage) bis zum definitiven Bericht: Technik: Qualität der Schnitte genügend o ja o nein Qualität der Färbungen genügend o ja o nein Technische Leistungen genügend Aerztliche Leistungen: ja nein Bearbeitungszeit dem Schwierigkeitsgrad der Probe adäquat o o Adäquate makroskopische Beschreibung o o Probenentnahmen adäquat und in genügender Menge o o Auswahl der Zahl der Spezialfärbungen richtig o o Auswahl und Zahl der Spezialtechniken richtig o o Mikroskpische Beschreibung (falls indiziert) adäquat o o Schlussdiagnose richtig o o Diagnosekodierung richtig o o Tarifkodierung richtig o o Aerztliche Leistung genügend o ja o nein o ja o nein Bemerkungen: Qualität der klinischen Angaben: o gut o genügend o schlecht Reg. 4 Zytologie ZYTOLOGIE Einleitung Grundlage der nachfolgenden Empfehlungen der SGP zum internen Qualitätsmanagement (IQM) sind die Antworten der LaborleiterInnen auf die im Januar 1996 durchgeführte Befragung zum Ist-Zustand des IQM der Laboratorien. Sie fassen die in der Mehrzahl der Laboratorien üblichen Massnahmen zur Qualitätssicherung zusammen. Die Empfehlungen stützen sich ausserdem auf die Empfehlungen zum IQM von Laboratorien für zervikale Zytopathologie der Arbeitsgruppe der British Society for Clinical Cytology (Cytopathology 1996 ; 7 : 4-9) und auf A. Böcking, Standardisierte Befunderstellung in der extragenitalen Zytologie/Standardisierung der zytopathologischen Diagnostik (Pathologe 1998 ; 19 : 235-241). Definitionen - Vorsorgezytologie: Im wesentlichen heute angewendet in der Prävention des Portiokarzinoms. Der klinische Teil der Untersuchung liegt in den Händen der Gynäkologen. Der zytomorphologische Teil ist den Fachärzten für Pathologie, speziell Zytopathologie bzw. für Gynäkologie, speziell gynäkologische Zytologie vorbehalten. - Klinische Zytopathologie: Breite Anwendung in der Tumordiagnostik (diagnostische Zytopathologie). Sie ist aus Gründen der Qualitätssicherung den Fachärzten für Pathologie, speziell Zytopathologie Liegt in der Regel in den Händen von Zytopathologen. Abkürzungen MA: MitarbeiterIn ZTA: Zytotechnische(r) AssistentIn SGKZ: Schweizerische Gesellschaft für klinische Zytologie IQM: Internes Qualitätsmanagement IAC: International Academy of Cytology SRK: Schweizerisches Rotes Kreuz 1 Reg. 4 Zytologie 1. Räumliche Struktur Zytologische Laboratorien sollen nach Möglichkeit an einem kliniknahen, für Patienten und Kliniker gut zugänglichen Ort eingerichtet sein, damit die Vorteile der zytologischen Untersuchung als "bedside"-Methode ausgeschöpft werden können. Intraoperative zytologische Schnelluntersuchungen sollen möglich sein. Gynäkologische Vorsorgezytologie und klinische Zytopathologie sollen personell und räumlich möglichst nicht getrennt sein. Abteilungen für Zytopathologie und für Histopathologie eines Instituts sollen möglichst im selben Gebäude untergebracht sein. Ungeachtet der wünschbaren Integration der Zytologie in ein Institut für Pathologie wird eine räumliche und personelle Trennung zwischen zytologischer und histologischer Abteilung innerhalb des Instituts empfohlen, um die für das Qualitätsmanagement notwendige Unabhängigkeit der Diagnosestellung zu wahren. Die räumliche Ausstattung einer zytologischen Abteilung umfasst: - Materialannahme, Registratur - Laborplatz für Präparation und Färbung - Screeningraum, möglichst getrennt von Präparation und Färbung - Schreibsekretariat - Archivraum für Berichte und Präparate - Aufenthaltsraum - Waschraum/Toiletten 2. Personelle Struktur Jedes zytologische Labor soll von einem Facharzt für "Pathologie" geleitet werden, der über Untertitel/Schwerpunkt-Weiterbildung für "klinische Zytopathologie" verfügt. Gynäkozytologische Laboratorien, die nicht von einem Facharzt für Pathologie mit Schwerpunkt Zytopathologie geleitet werden, fallen nicht in den Verantwortungsbereich der SGP. Für Laboratorien, die nicht unter der Leitung eines hauptamtlich tätigen Facharztes, sondern unter der nebenamtlichen fachärztlichen Beratung durch einen Zytopathologen stehen, soll die Verantwortlichkeit des beratenden Zytopathologen für die Aufrechterhaltung eines anerkannten Qualitätsstandards vertraglich festgelegt sein. Fachärztliche Stellvertretung des Zytopathologen muss gewährleistet sein. Nur fachärztlich geleitete zytologische Laboratorien werden von der SGP als Ausund Weiterbildungsstätte anerkannt. Die Zahl der ärztlichen Team-Mitglider einer zytologischen Abteilung richtet sich nach dem Umfang des Einsendeguts und den Aufgaben im Bereich der Aus- und Weiterbildung. Laboratorien mit mehr als drei ZTA sollen eine TeamleiterIn haben, die über eine mindestens dreijährige Berufserfahrung verfügt und das IAC-Examen für ZTA oder das Weiterbildungsdiplom für ZTA der SGKZ besitzt. 2 Reg. 4 Zytologie Labortechnische Arbeiten sollen in der Hand von im Screening beschäftigten ZTA liegen. Eine Beteiligung aller ZTA an technisch-präparatorischen Arbeiten wird empfohlen. 3. Aufgaben des Zytopathologen Medizinisch-fachliche Leitung des Labors/der Abteilung Kontrolle aller verdächtigen und tumorpositiven Befunde (Zumutbare Arbeitsbelastung: ca 6000 Fälle/Jahr) Teilnahme am Primärsceening Kommunikation mit den einsendenden Ärzten; verantwortlich für sämtliche Diagnosen Kontinuierliche eigene Fortbildung entsprechend Vorgaben der FMH Ausbildung von Pathologen zu Zytopathologen gemäss Vorgaben der FMH Ausbildung von nichtärztlichen MitarbeiterInnen zu ZTA. Kann teilweise an erfahrene ZTA (ZTA mit IAC-Examen oder Weiterbildungsdiplom der SGKZ) delegiert werden. Fort- und Weiterbildung der Mitarbeiter Qualitätsmanagement 4. Aufgaben der/des TeamleiterIn Organisation aller zytotechnischen Arbeitsabläufe Unterstützung der ärztlichen Leitung in der Aus- und Weiterbildung von ZTA Teilnahme am Screening (5000 Ausstriche/Jahr) und an technischen Laborarbeiten Qualitätssicherung im zytotechnischen Bereich (Präparation, Färbung, Screening) Supervision aller Laborarbeiten 5. Anforderungen an ZTA Alle am Primärscreening beteiligten ZTA sollen im Besitz eines Befähigungsnachweises (Certificate of Competence) sein. Dazu zählen: Abschlussnote in Zytologie von lokalen Laborschulen des RK, Zytologieschulen des In- und Auslandes. Ein(e) ZTA soll durchschnittlich 40 - 60 Ausstriche/Tag (= 7'500 bis 10'000 Ausstriche/Jahr) durchmustern (screenen). Kurzfristig werden bis zu 70 Ausstriche/Tag als zumutbar erachtet, sofern eine Gesamtzahl von 10'000 Ausstrichen pro ZTA und Jahr nicht überschritten wird. Für das Durchmustern von 10 Ausstrichen soll durchschnittlich 1 Stunde zur Verfügung stehen. Ein Viertel der Arbeitszeit soll für anderweitige Laborarbeiten verwendet werden. Diese Mengen- und Zeit-Vorgaben für das Durchmustern der Präparate gelten gleichermassen in der gynäkologischen Vorsorgezytologie wie in der klinischen Zytologie. 3 Reg. 4 Zytologie Alle ZTA sollen Gelegenheit zur Fort- und Weiterbildung erhalten und im Minimum alle drei Jahre an einem Auffrischungskurs teilnehmen. Alle als Supervisoren (Sekundärscreening) tätigen ZTA sollen das Weiterbildungsdiplom der SGKZ oder das IAC-Examen haben. Im Minimum sollen jeder/jedem ZTA (auch Teilzeitangestellten!) 1 Tag/Vierteljahr (4 Tage/Jahr) zur laborinternen Fortbildung zur Verfügung stehen. Ein Auffrischungstraining und häufigere Screening-Kontrolle soll erfolgen, wenn ein/eine ZTA länger als drei Monate nicht mehr im Primärscreening tätig war. Die Kosten der Fortbildung sind bezüglich Labor-Budget und Rechnungstellung integraler Bestandteil der Labor- und Screening-Kosten. Es wird empfohlen, dass jede(r) ZTA einmal pro Jahr an einem internen Leistungstest teilnimmt. 6. Screening und Rescreening Grundsätzlich werden alle zytologischen Präparate, auch die Präparate aus dem extragenitalen Bereich einschliesslich Feinnadelaspiraten durch ZTA vorgemustert. Die Verantwortlichkeit für Screening und abschliessenden Bericht (Arzt, ZTA) wird registriert. ZTA können im Auftrage des verantwortlichen Arztes unauffällige und nichtneoplastische Befunde in der gynäkologischen Vorsorgezytologie und in der klinischen Exfoliativ-Zytologie dem Einsender direkt mitteilen. Die Verantwortlichkeit für die Diagnose bleibt trotzdem beim Zytologen (Arzt). Alle tumor-positiven und pathologischen Befunde sollen vom Arzt abschliessend beurteilt werden. Alle, auch die tumor-negativen Feinnadelaspirate werden grundsätzlich durch den Arzt abschliessend beurteilt. Empfohlen wird eine Supervision des Screening von ZTA mit weniger als dreijähriger Berufserfahrung durch die/den TeamleiterIn oder durch andere ZTA mit entsprechender Qualifikation. Die Organisation der Supervision bleibt den einzelnen Laboratorien überlassen. Ein routinemässiges Nachmustern (Rescreening) von 10% der gynäkozytologischen Ausstriche wird von der SGP nicht als ausreichende qualitätssichernde Massnahme erachtet. Die in der Literatur empfohlene rasche Durchmusterung ("Rapid Review") von allen gynäkozytologischen Ausstrichen gilt derzeit noch nicht als ausreichend getestet. Die SGP behält sich aber vor, zu gegebener Zeit, d.h. nach ausreichender wissenschaftlicher Testung, die Methode zur Nachmusterung zu empfehlen. Die maschinelle Nachmusterung der gynäkozytologischen Präparate wird von der SGP als gangbarer Weg der Qualitätssicherung angesehen, aber nicht als regelmässig anzuwendende Massnahme gefordert, weil die dazu notwendigen Automaten sich noch immer im Stadium der Entwicklung befinden. Bezüglich der für das maschinelle Screening der zytologischen Präparate verwendbaren Systeme folgt die SGP den Empfehlungen der US-amerikanischen Federal Drug Agency (FDA). Derzeit ist von der FDA in beschränktem Umfang das System NeoPath zugelassen. 4 Reg. 4 Zytologie Die bei der Nachmusterung erhobenen Befunde werden in ein EDV-System aufgenommen. Das Gesamtergebnis der Nachmusterung wird in den jährlich zu erstellenden IQMDokumentationsbogen eingetragen. 7. Laborausrüstung Die minimale apparative Laborausrüstung umfasst: - Gedeckter Arbeitsplatz mit Abzugsvorrichtung für die Bearbeitung von flüssigen Proben sowie Sekreten und für die Färbung - Mittlere Tischzentrifuge - Zytozentrifuge - Färbeautomat*1, Filtriereinrichtung - Eindeckautomat* - Monolayer-Präparations-Automat* - Mikroskope - Mehrfachbetrachter-Diskussionsmikroskop Die Arbeitsgänge und die im Labor routinemässig angewendeten präparatorischen Methoden sollen in einem jederzeit zugänglichen Laborordner niedergelegt sein. Die notwendigen Informationen hinsichtlich Sekretariatsarbeit und IQM sind ebenfalls in einem Ordner schriftlich niedergelegt. 8. Archivierung der Ausstriche Die zytologischen Ausstriche werden von Institut/zytologischer Abteilung/zytologischem Labor, in dem sie hersgestellt wurden, verwaltet und aufbewahrt. Bezüglich Eigentum gelten die entsprechenden kantonalen Vorschriften. Die Präparate müssen mindestens so lange aufbewahrt werden wie es die kantonalen Vorschriften verlangen. Die Ausstriche müssen so aufbewahrt werden, das sie für das Rescreening einfach wieder auffindbar sind. 9. Konsiliarische Befundung Auf Verlangen der Patientin/des Patienten oder des behandelnden Arztes/Ärztin werden die Präparate einem von ihr/ihm benannten Zytopathologen zur Einsichtnahme und Zweitbeurteilung leihweise überlassen. Über alle zur konsiliarischen Beurteilung zugesandten Präparate wird ein schriftlicher Bericht zuhanden des Erstbeurteilers abgegeben. Eine Kopie dieses Berichtes wird dem behandelnden Arzt nicht automatisch, sondern nur in Absprache mit dem Erstuntersucher zugestellt. 1mit * bezeichnete Geräte sind nicht zwingend erforderlich. 5 Reg. 4 Zytologie Der Konsiliarius ist zu einer sachgemässen Behandlung (Lichtschutz/Abdeckung der nach Papanicolaou gefärbten Präparate) und Rückgabe der ihm anvertrauten Präparate verpflichtet. Vom behandelnden Arzt oder vom Patienten verlangte Konsiliaruntersuchungen sind grundsätzlich honorarpflichtig. Die Kosten werden in der Regel dem Patienten berechnet. 10. Datenerfassung Alle zytologischen Laboratorien sollen über ein EDV-System verfügen. Empfohlen wird eine Computer-Software, die es erleichtert, retrospektiv histologische und zytologische Diagnosen im Sinne des IQM zu vergleichen. Alle mit zytologischen Untersuchungen in Zusammenhang stehenden klinischen Informationen (Rückantworten, auswärtige histologische Befunde) werden zusammen mit den übrigen Daten eines Patienten archiviert. Für die Datenspeicherung gelten dieselben Grundsätze wie für die Datenspeicherung auf anderen Teilgebieten der Pathologie (Histologie, Autopsie). Erfasst werden ausser Patientendaten i.e.S. Entnahmedatum, Topographie, Diagnose, Abgabedatum, Zweitberichte, korrigierte Berichte, Angaben zur Materialqualität). 6 Reg. 4 Zytologie 11. Zytologischer Bericht Für die Berichterstattung gelten dieselben Regeln wie für die histologische Befundung. Die Berichte sind klar gegliedert und enthalten je eine gesonderte Rubrik für: - Patientenidentifikation - Klinische Angaben - Datum des Proben-Eingangs - Datum der Berichterstattung bzw Unterschreibung des Berichts - Topographie (Entnahmeort des Materials) - Makroskopische Beschreibung (sofern möglich) - Mikroskopische Beschreibung - Diagnose - Kommentar - Kurze separate Beurteilung von Materialqualität, Sicherheit der Diagnose, Dignität (gutartig/bösartig). Bei der Abfassung des Berichtes sollen frühere Befunde/Präparate vorliegen und mitberücksichtigt werden. Alle Diagnosen werden als Klartextdiagnosen formuliert. Zusätzlich kann in der gynäkologischen Zytologie auch eine Klassierung der Befunde in Anlehnung an die Papanicolaou-, München- oder Bethesda-Einteilung erfolgen. Für die Qualitätsbeurteilung ist die Klartextdiagnose entscheidend. Bei der Abfassung der zytologischen Diagnosen wird grundsätzlich die auch in der Histologie übliche Terminologie verwendet. Ist eine klare Trennung zwischen Beschreibung und Diagnose nicht möglich, soll die Diagnose offen bleiben und der Grund dafür in einem Kommentar erläutert werden. Nachträglich erhobene Befunde werden in einem ergänzenden Zweitbericht dem Einsender mitgeteilt. Ergeben sich neue Aspekte, die eine Korrektur eines Berichtes erforderlich machen, ergeht an den Einsender ein neuer revidierter Bericht. Bei nachträglich entdeckten Fehlern im Text eines Berichtes, die keinen Einfluss auf die Diagnose haben, ergeht ein korrigierter Bericht. Für die kodierte Befundspeicherung im EDV-System wird SNOMED empfohlen, das individuelle Anpassungen zulässt. Mit Ausnahme der unauffälligen Befunde in der gynäkologischen Vorsorgezytologie sollen alle Berichte von Arzt/Ärztin unterschrieben werden. Bei unauffälligen Befunden in der gynäkologischen Vorsorgezytologie wird die Signatur des Berichtes durch eine(n) zur Supervision des Screening berechtigte(n) ZTA als ausreichend betrachtet. Die Verantwortung für den Inhalt der Berichte liegt in jedem Falle beim Arzt. 7 Reg. 4 Zytologie 12. Qualitätsmanagement Zytologische Diagnose Um den Vergleich zwischen zytologischem und histologischem Befund zu erleichtern, sollen zytologisches und histologisches Untersuchnugsmaterial an dasselbe Institut/Labor gesandt werden. Wo dies nicht möglich ist, soll das zytologische Labor vom Einsender eine Kopie der zur Kontrolle der zytologischen Befunde notwendigen histologischen Befunde verlangen. Dem zytologischen Laboratorium sollen die zur Kontrolle der zytologischen Befunde notwendigen histologischen Schnitte auf Anforderung zur Verfügung gestellt werden. Bei Nichtübereinstimmung von zytologischer und histologischer Diagnose sollen alle relevanten zytologischen Präparate nachuntersucht werden. Durch die Nachprüfung aufgedeckte Diskrepanzen werden dem Kliniker mitgeteilt. Jede relevante klinische Information soll vom Einsender an das Zytologielabor weitergeleitet werden. Klinisches Feed-Back und auswärts erhobene histologische Befunde werden regelmässig in das EDV-System eingegeben und stehen für das IQM zur Verfügung. Prüfung des labortechnischen Standards Fixation, Ausstrichtechnik und Färbequalität sollen durch TeamleiterIn/CheflaborantIn oder Arzt regelmässig und standardisiert überprüft werden. Das Ergebnis soll protokolliert und der jährlich zu erstellenden QM-Dokumentation angefügt werden (s.u.). Die Bearbeitungsdauer (Eingangs- bis Berichtsdatum) sind mittels EDV-System abruf- und überprüfbar. Neue Technologien und Methoden müssen Gegenstand einer rigorosen und umfassenden Prüfung unterzogen werden, bevor sie in die Routine eingeführt werden. Jährlicher Qualitätsreport Jedes Labor ist gehalten, alljährlich einen Qualitätsreport zu erstellen. Dieser soll enthalten: - Zahl der MitarbeiterInnen (Ärzte, ZTA, andere) - Zahl der zytologischen Einsendungen - Zahl der bearbeiteten Ausstriche - Anzahl Spezialuntersuchungen - Liste der gestellten Diagnosen - Liste der falsch-positiven Diagnosen - Liste der falsch-negativen Diagnosen (soweit eruierbar) 8 Reg. 4 Zytologie - Protokolle der regelmässigen Prüfungen der Laborstandards - Ergebnisse der internen Leistungsprüfungen der ZTA - Liste der festgestellten Mängel und Massnahmen zu ihrer Beseitigung Die IQM-Dokumentation wird mindestens 10 Jahre aufbewahrt. 13. Anforderungen an den Einsender Vom Einsender sind folgende Daten zu verlangen: - Adresse der Klinik/Praxis, Telefonnummer - Patientenidentifikation (Name, Mädchenname, Vorname, vollständiges Geburtsdatum, Privatanschrift, Krankenkasse) - Entnahmedatum, Topographie, Art des Materials). - Adressaten von Berichtskopien - Angaben zur Anamnese - Angaben über frühere zytologische oder histologische Untersuchungen - Chemo-, Radiotherapie - Relevante Daten bildgebender Verfahren - Klinische Diagnose, Differentialdiagnose - Art des Materials - Entnahmestelle - Fragestellung Für gynäkozytologische Untersuchungen sind zusätzlich folgende Angaben notwendig - Letzte Menstruation - Blutungsanamnese - Vorausgegangene Hormonbehandlung Intrauterin-Pessar - bei Gravidität Schwangerschaftswoche 9 Reg. 4 Zytologie 14. Literatur SGP S. G. f. P.: Empfehlungen der SGP bezüglich Besitzverhältnisse des Untersuchungsgutes, Archivierung und Datenschutz (Beschluss 18.1.1994). Erhältlich durch Sekretär der SGP (1994) Jones BA: Rescreening in gynecologic cytology. Rescreening of 8096 previous cases for current low-grade and indeterminate-grade squamous intraepithelial lesion diagnoses - a College of American Pathologists Q-Probes study of 323 laboratories. Arch Pathol Lab Med 120, 519-22 (1996) Brit Soc Clin Cyt : Recommended code of practice for laboratories providing a cytopathology cervice 1997. Cytopathology 8, Suppl. 1, 1-26 (1997) Diehl AR, Prolla JC: Rapid rescreening of cervical smears for internal quality control. Acta Cytol 42, 949-53 (1998) Böcking A: Standardisierte Befunderstellung in der extragenitalen Zytologie. Pathologe 19, 235-258 (1998) 10 Reg. 4 Zytologie Checkliste zur Herstellung zytologischer Ausstriche Die Sensitivität der zytologischen Untersuchung hängt ab von - Qualität der Ausstriche (Fixation!) - Qualität des Screening - Repräsentativität des Materials - Anzahl der Ausstriche Für die verschiedenen zytologischen Materialproben gelten Ausstrichpräparation folgende Minimalanforderungen: Gynäkologische Abstriche - Bei Jahreskontrollen Portio- und Zervixabstrich auf einem Ausstrich - Bei Wiederholungsabstrichen wegen eines pathologischen Befundes Abstrich der äusseren Portio und aus der Endozervix getrennt - Für den Abstrich Verwendung eines Spatels oder einer Bürste - Färbung: Papanicolaou - Deckglas 24x50 mm Sputum - 4 Ausstriche aus verschiedenen Stellen der Sputumprobe - Färbung: Papanicolaou. Zusatzfärbungen siehe Bronchialsekret - Deckglas 24x50 mm - Sedimenteinbettung nicht als Standardverfahren Bronchialsekret - Flüssigkeiten von Bronchiallavagen (nicht zu verwechseln mit bronchalveolären Lavagen/BAL) zuerst zentrifugieren - 3 Ausstriche. Getrennt eingesandte Proben eines Patienten müssen getrennt behandelt werden - Färbung: Zum Tumorzellnachweis Papanicolaou, zusätzlich zum Nachweis von Pilzen und Pneumozysten evtl. Grocott, zum Nachweis von Bakterien MGG oder Gram, von Eosinophilen MGG, zum Eisennachweis Berliner Blau (auch noch nachträglich über Papanicolaou möglich). - Deckglas 24x50 mm Bronchoalveoläre Lavage (BAL) 11 Reg. 4 Zytologie - Zentrifugation, Herstellung einer Zellsuspension aus dem Sediment - Bestimmung der Zellzahl in der Suspension Konventionelle Untersuchungen - Zwei konventionelle Ausstriche Papanicolaou, 1 Ausstrich MGG. - Bei Infektsuche zusätzlich 2 Papanicolaou-Ausstriche, 1 Ausstrich Grocott, 1 Ausstrich Ziehl-Neelsen (ZN geht auch an vorher Papanicolaou-gefärbten Präparaten), evtl weitere Ausstriche für CMV-Nachweis etc. - Deckglas 24x50 mm - Differentialzellbild Spezialuntersuchungen (Immunzytochemie, B- und T-Zell-Rearrangement) - Cytospinpräparate (Aufbewahrung bei -70o C) - Bei entsprechender Fragestellung Differenzierung von Lymphozytensubpopulationen mittels Immunzytochemie: CD1a, CD2, CD4, CD8, CD20, CD25, TIA-1 (zusätzlich evtl CD, CD 57). - Alternative: Durchflusszytometrie Ergusspunktate - Auf der Einsendung des gesamten Punktats bestehen - Grosse Punktate in 2 Schritten zentrifugieren - 2 Ausstriche Papanicolaou, 1 Ausstrich MGG. Eventuell auch mehr Ausstriche für immunzytochemische Untersuchung herstellen; diese nicht nach MGG färben! - Deckglas 24x50 mm - Geronnenes Sediment einbetten (Sedimenteinbettung nicht als Standardverfahren). Urin und Harnblasenspülflüssigkeit - Je nach Menge 1 oder 2 x zentrifugieren - 2 - 4 Ausstriche, wenn statische DNS-Zytometrie vorgesehen ist, auch mehr - Färbung: Papanicolaou. Für statische Zytometrie Feulgen - Deckglas 24x50 mm Liquor cerebrospinalis - 1 - 2 Cytospinpräparate - Färbung: In der Regel MGG. Papanicolaou für nachfolgende Immunzytochemie besser geeignet. Feinnadelpunktate 12 Reg. 4 Zytologie - Nadelinhalt direkt ausstreichen oder in Zellmedium ausspülen und dieses zentrifugieren und wie andere Sedimente ausstreichen. - Gesamten Nadelinhalt ausstreichen. Anzahl der Ausstriche richtet sich nach Umfang des Aspirates - Färbung: Papanicolaou, evtl MGG (Schilddrüse, Lymphknoten) - Deckglas 24x50 mm Generell ist vor Papanicolaou-Färbung sofortige Immersionsfixation in Delaunay'scher Lösung (Aceton + 100% Alkohol 1:1, Zusatz von 0.5 ml 1M Trichloressigsäure ad 1000.0) der Sprayfixation vorzuziehen. Sie ist leichter und rascher zu handhaben, vermeidet Trocknungsartefakte und ist in den meisten Fällen die beste Voraussetzung für nachträgliche immunzytochemische Reaktionen. - MGGFärbung geht auch an trocken fixierten Präparaten. 13 Reg. 5 Externe Qualitätskontrollen 1 EXTERNE QUALITÄTSKONTROLLEN A Diagnostik Zur Zeit besteht kein Expertengremium der SGP dem die Aufgabe übertragen werden könnte, die Qualität der Dienstleistungen der Institute periodisch zu überprüfen. Hierfür dienen bis auf weiteres die institutsinternen Qualitätskontrollen, regionale pathologischanatomische Kolloquien, wissenschaftliche Tagungen der SGP, durch die SGP und die Swiss Division der IAP organisierte Schnittseminare und der Besuch ausländischer Fachveranstaltungen. Weitere Möglichkeiten sind : 1. „Check Sample program“ der American Society of Clinical Pathologists Die ASCP hat im Rahmen ihres Fortbildungs- und Qualitätssicherungsprogrammes ein „Check Sample Program“ geschaffen. Je nach gewählter Spezialität (Surgical Pathology, Cytopathology, Forensic Pathology, Molecular diagnostic and Immunopathology etc. ). Erhält der Teilnehmer 4-12 Aussendungen pro Jahr mit entweder Diapositiven, histologischen Schnittpräparaten oder farbigen histologischen Abbildungen. Aufgrund der beigelegten Dokumentation muss eine Diagnose und Differentialdiagnose gestellt und nach Lektüre der beigelegten ausführlichen Diskussion des Falles müssen multiple choice-Fragen beantwortet werden. Für die Archivierung des Materials werden Ringbücher mitgeliefert. Für das Studium jeder Aussendung wird auf Wunsch eine Stunde Fortbildung bestätigt (Continuing Medical (Laboratory) Education (CME/CMLE) Credit). Kosten : Das Paket Surgical Pathology mit histologischen Schnittpräparaten und Diapositiven (8 Aussendungen pro Jahr) kostet z. B. $US 480.-, ein Sammelpaket mit Hämatopathologie, chirurgische Pathologie und Zytologie kostet $US 1644.-. Adresse : American Society of Clinical Pathologists Assessment and Continuing Education Programs 2100 West Harrison Street Chicago, IL 60612-3798 PD: 312-738-4890, Fax: 312-850-8819 Internet: http://www.ascp.org 2. „Check Path program“ der American Society of Clinical Pathologists Dieses Qualitätssicherungsprogramm ist für verschiedene Subspezialitäten (Anatomic Pathology, Cytopathology, Hematopathology) mit je 4 Aussendungen pro Jahr erhältlich. Jede Aussendung enthält Diapositive oder ein histologisches Schnittpräparat mit klinischem Befund und Labordaten. Der Teilnehmer hat aus der beigelegten Liste der Differentialdiagnosen die wahrscheinlichste auszuwählen und einzuschicken. Wenige Wochen später erhält er die Lösung mit einer ausführlichen Diskussion des Falles und der prozentualen Verteilung der Antworten auf die aufgelisteten Differentialdiagnosen. Kosten : Das „Anatomic Pathology Package“ mit den Subspezialitäten anatomische Pathologie, Zytopathologie und Hämatopathologie kostet $ 1'883.70 (Versandspesen inbegriffen). Adresse : Gleich wie für „Check Sample“. B Histotechnik Die Schweizerische Gesellschaft für Histologietechnik (SGHT) führt seit 1994 Ringversuche für die Qualitätskontrolle durch. Sechsmal jährlich werden von den teilnehmenden Laboratorien 2 verschiedene Testfärbungen aus den Bereichen Histologie, Histochemie und Immunhistochemie verlangt. Das Testmaterial wird je nach Aufgabe als formalinfixiertes Gewebe oder als aufgezogene ungefärbte Schnitte abgegeben. Je nach Färbung müssen positive Reg. 5 Externe Qualitätskontrollen 2 und negative hausinterne Kontrollen mitgeliefert werden. Die Beurteilung erfolgt nach einem Kriterienkatalog mit je nach Aufgabe unterschiedlicher Gewichtung durch eine/n erfahrene/n Laborantin/en und eine/n FMH-Pathologin/en. Das teilnehmende Labor enthält sein eigenes Resultat (Punktzahl), den Mittelwert aller Teilnehmer und die Maximum-/Minimumwerte sowie das Rezept, mit dem die besten Resultate erreicht wurden. Dem Labor wird mitgeteilt, ob nach der Beurteilung der Experten die technische Qualität der Testschnitte dem heutigen Standard entspricht und ob sie eine sichere Diagnose ermöglichen. Falls eine oder beide Anforderungen nicht erfüllt wurden, verpflichtet sich das Labor den Test zu wiederholen, bis ein positives Resultat erreicht wird. Jährlich werden Säulengrafiken erstellt, welche die Resultate (erreichte Punkte) aller Labors für die einzelnen und die Gesamtheit aller Tests aufzeigt. Das einzelne Labor kann so rasch seine qualitativen Leistungen mit denjenigen aller anderen Teilnehmer, die anonym bleiben, vergleichen. Kosten : Fr. 840.--/Jahr Adresse : Bert Jaspers Koordinator für Qualitätskontrollen in der Histologie-Technik 2063 Saules Tel.: 032/ 853 50 95, Fax: 032/ 853 50 95 E-mail: [email protected] C Immunhistochemie Diese wird teilweise durch die Ringversuche der SGHT abgedeckt (siehe oben). Eine detaillierte und kompetente Qualitätskontrolle wird durch das UK National External Quality Assessment Scheme for Immunocytochemistry (UK NEQUAS-ICC) angeboten. Diese national organisierte non-profit Institution gewährleistet die immunhistochemische Qualitätskontrolle fast aller Laboratorien in Grossbritanien. Zusätzlich benutzen Laboratorien aus 22 Ländern diese Dienstleistung. Folgende Programme können gewählt werden : Allgemeine Pathologie, Mamma, Neuropathologie, Lymphome und Zytologie. Es erfolgen 4 Aussendungen pro Jahr (Zytologie nur 2) für den Nachweis von je 2 Antigenen. Bei jeder Aussendung erhält der Teilnehmer formalinfixierte, aufgezogene Paraffinschnitte. Gleichzeitig werden hausinterne Kontrollschnitte angefordert. Die Färbungen werden von 4 Experten nach definierten Kriterien bewertet. Auf einer Punkteskala von 0-20 bedeuten mehr als 12 ein gutes, 10-12 ein suboptimales und weniger als 10 ein schlechtes Resultat. Bei ungenügender Qualität muss der Test wiederholt werden. Dem Teilnehmer wird sein eigenes Resultat und anonym das aller anderen in Form einer Säulengrafik mitgeteilt. Farbige Abbildungen des besten Resultates werden beigefügt. Auch die Methodik, die zu den besten Resultaten führte, wird detailliert vermittelt. Zusätzlich erhalten die Teilnehmer 3 Kopien jeder Ausgabe des Journal of Cellular Pathology. Kosten : Pro Programm (Laufzeit 1 Jahr) £ 210, zusätzliche Programme je £ 125. Adresse : UK NEQAS for Immunocytochemistry Histopathology University College London Medical School University Street UK - London WC1E6JJ Tel.: +44 171 209 6048, Fax: +44 171 387 3674 E-mail: [email protected]. Internet : http://www.ukneqas.org.uk D Zytologie Für die Zytologie gibt es zur Zeit keine organisierte externe Qualitätskontrolle. Reg. 5 Externe Qualitätskontrollen E DNA-Zytometrie Euroquant (Remote Quantitation Server of Europath) bietet via Internet eine Qualitätskontrolle für die DNA-Färbung, das sampling und die diagnostischen Interpretation von Histogrammen an. Die Uebermittlung der Daten ist technisch und zeitlich aufwendig. Kosten : Lediglich Uebermittlungsgebühren Kontaktperson : Dr. W. Meyer, e-mail: [email protected] Adresse : Technische Universität Dresden Medizinische Fakultät Institut für Pathologie Fetscherstr. 74 D-01307 Dresden Tel.: +49 351 458 3562, Fax: +49 351 458 4358 E-mail: [email protected] 3 Reg. 6 Gehirn und Rückenmark 1 GEHIRN UND RÜCKENMARK Makroskopie - Gewebezustand: Fixiert (wie?) / nativ - Entnahmeort: Offene Biopsie / stereotaktische Biopsie - Jede der Komponenten wird beschrieben, gemessen und (ausser Biopsien) gewogen Tumoren, Präparation und Zuschnitt - Gliome Heterogene Gruppe von Tumoren, die in der Regel infiltrativ in das umliegende Hirnparenchym einwachsen. Resektionsränder und Infiltration des Tumors spielen deshalb nur eine untergeordnete Rolle, ausser es bestehe eine spezielle Fragestellung des zuweisenden Neurochirurgen. In letzterem Fall werden in der Regel getrennte Biopsate mit der jeweiligen Fragestellung nach Tumorinfiltration zugestellt. Bei grösseren Einsendungen repräsentative Anteile aus verschiedenen Regionen des Tumors entnehmen. Makroskopische Beschaffenheit des jeweiligen Präparates (Farbe / Konsistenz) festhalten. Im seltenen Fall einer sehr ausgedehnten Biopsie mit Einsendung eines Hirnlappens Fotodokumentation und repräsentative Anteile aus mehreren Arealen, inklusive Resektionsrand, einbetten. - Meningeome werden häufig mit anhaftender Dura eingesandt. Kommen entweder als en bloc-Exzisat oder als zahlreiche Fragmente. Mindestens eine Probe soll die Tumorbasis mit anhaftender Dura enthalten. Zahlreiche Tumorfragmente einbetten zur Erfassung von am Tumorrand anhaftendem Hirngewebe. - Schwannome sind praktisch immer gut differenziert und benigne. Wenige Proben genügen. - Lymphome werden üblicherweise bereits am Schnellschnitt diagnostiziert. Einen Teil des Materials für eine eventuelle Gefrierschnittuntersuchung (Immunhistochemie) asservieren. - Metastasen werden meist nicht en bloc sondern in Stücken eingesandt. Aus diesem Grund ist es in der Regel nicht nötig oder möglich, histologisch die Resektionsränder zu bestimmen. Hippocampektomie Braucht eine topografisch korrekte Beurteilung des Neuronenbandes. Resektat ausreichend fixieren und am Folgetag in Scheiben zerteilen und einbetten. Vorteilhaft ist eine standardisierte Schnittrichtung (z.B. lateral-medial), sofern dies die Orientierung des Präparates zulässt. Blutungen Frische Hämatome zunächst formalinfixieren. Insbesondere spontan aufgetretene, atypisch lokalisierte, sog. lobäre Hämatome relativ grosszügig einbetten (kongophile Angiopathie oder Reste einer arterio-venösen Missbildung im miterfassten Gewebe). Berichterstattung 1. Art des Operationspräparates 2. Anatomische Tumorlokalisation 3. Histologischer Tumortyp nach WHO 4. Gradierung: Gemäss WHO-Klassifizierung für Hirntumore 1993 (revidierte Fassung im Januar 2000 erhältlich). 5. Tumorinfiltration in benachbartes Gewebe (nur ausnahmsweise von Belang; siehe oben). Reg. 7 Harnblase HARNBLASE Art des Materials: Biopsie, transurethrale Resektate, Zystektomie 1. Transurethrale Resektate A Makroskopie/Zuschnitt - Gewicht - Alle Gewebsproben einbetten ausser bei palliativer Resektion eines bekannten invasiven Karzinoms. 2. Zystektomie A. Makroskopie - Wenn frisch und geschlossen eingesandt mittels Ballonkatheter mit Formalin füllen. 24 Stunden fixieren lassen. Eröffnetes Präparat aufgespannt (z.B. Styropor) fixieren. - Masse - Mitresezierte Organe (Ureteren, Urethra, Prostata, Uterus) - Tumor: Ja/nein - Ulcus/exophytisch/diffus - Masse - Anatomische Lage - Infiltrationstiefe - Befunde der übrigen tumorfreien Harnblase und allfälliger mitresezierter Organe - Präparation des perivesikalen Fettgewebes (Lymphknoten?) B Zuschnitt - Resektionsränder (Ureteren, Urethra) - Tumor - Maximale Infiltrationstiefe - Uebergang zu unveränderter Mukosa - Je eine Probe aus Vorder-, Hinterwand, Trigonum und Harnblasendach - Prostata/Samenblasen Pro 1cm Durchmesser eine Probe Dokumentation der periurethralen Abschnitte 1 Reg. 7 Harnblase 2 C Berichterstattung Art des Materials: Biopsie, transurethrale Resektate, Zystektomie Tumortyp: Nach WHO 1999, sowie Consensusklassifikation 1998 Papilläre Neoplasien: Papillom; Invertiertes Papillom; Papilläre Neoplasie von niedrigem Malignitätspotenial; Papilläres Karzinom, low grade Papilläres Karzinom, high grade Differenzierungsgrad: Gut, mittel, wenig Infiltrationstiefe: Stroma, muskuläre Wandschichten, Fettgewebe (für Fettgewebe mikroskopische (= pT3a) und makroskopische Invasion (= pT3b) unterscheiden). Lymph-/Blutgefässinvasion: Ja/nein Resektionsränder: Befallen: Lymphknoten: Anzahl befallene/tumorfreie Lymphknoten Durchmesser der grössten Metastasen Relevante Diagnosen der übrigen Harnblase: - Anatomische Lokalisation - Invasiver Tumor - Urotheliale Dysplasie Z.B. Dysplasie pTNM-Klassifikation 3. Immunhistochemie (fakultativ) Anti-Endothel-Antikörper (Faktor VIII, CD31 oder CD34) zum Nachweis von Gefässeinbrüchen. PSA und PSAP zur Differentialdiagnose einer prostatischen intraepithelialen Neoplasie (PIN) gegenüber einer intraduktalen Urotheldysplasie in der Prostata. p53 Positivität korreliert mit einem erhöhten Progressionsrisiko vor allem beim pTa Stadium. Reg. 7 Harnblase 3 Literatur: Parkinson MC, Fisher C: Gross examination of bladder specimens. J Clin Pathol 1991; 44: 890-895. Murphy WM: ASCP survey on anatomic pathology examination of the urinary bladder. Am J Clin Pathol 1994; 102: 715-723. Recommendations for the reporting of urinary bladder specimens containing bladder neoplasms. Association of directors of anatomic and surgical pathology. Hum Pathol 1996; 8: 751-753. Recommendations for the reporting of urinary bladder specimens containing bladder neoplasms. Association of directors of anatomic and surgical pathology. Comment. Hum Pathol 1997; 3: 389. Epstein JI, Amin MB, Reuter VR, Mostofi FK, and the bladder Consensus Conference Committee. The World Health Organization/International Society of Urological Pathology Consensus Classification of urothelial (transitional cell) neoplams of the urinary bladder. Am J Surg Pathol, 1998, 22:1435-1448. Mostofi FK, Davis MB, Sesterhenn IA, Sobin LH.: Histological typing of urinary bladder tumours. WHO 1999, Springer Verlag, Berlin. Reg. 7 Harnblase Checkliste Harnblase Art des Materials: Biopsie, transurethrale Resektate Zystektomie Tumortyp: WHO 1999, Consensus 1998 Differenzierungsgrad: Gut, mittel, wenig Infiltrationstiefe: Stroma, muskuläre Wand, für Fettgewebe (makro- und mikroskopisch) Gefässinvasion: Resektionsränder: Lymphknoten: Anzahl tumorbefallene, im Verhältnis zu den histologisch untersuchten Lymphknoten Metastasendurchmesser Diagnosen der übrigen Harnblase: Z.B. Dysplasie pTNM-Klassifikation: 4 Reg. 8 Hoden 1 HODEN 1. Tumor A Allgemeines Rund 90 % der Hodentumoren sind Keimzelltumoren und davon mind. 1/4. kombinierte Tumoren. Routine: Einschneiden der Resektate (Tunica vaginalis und Tunica albuginea längs anteromedial) und Fixation in mindestens zehnfacher Menge Formalin. Besonders Seminome sind sehr empfindlich auf eine ungenügende Fixation. Die dadurch auftretenden Artefakte sind oft für Probleme in der Diagnostik verantwortlich. B Makroskopie − Art des Präparates Biopsie, Tumorenukleat, Semikastrationspräparat ohne/mit Hodenhüllen und Samenstrang − Masse Gewicht Masse von Probe/Organ/mitresezierten Strukturen in cm − Beschreibung Gewebszustand: − nativ/fixiert in Formalin/Spezialfixation − intakt/eingeschnitten − Samenstrang anhaftend/abgetrennt Oberfläche − Verwachsungen − Gefässzeichnung − Tumordurchbruch Schnittfläche − Tumorgrösse in cm (drei Ebenen) − Lokalisation des Tumors im Hoden − Uni/multizentrisch − Farbe, Konsistenz und Begrenzung − Beziehung zu umliegendem Gewebe (Infiltration von Tunica albuginea/vaginalis/Nebenhoden/Samenstrang/Resektatrand) − Restliches Parenchym/Tunica/Nebenhoden/Samenstrang C Zuschnitt Pro Semikastrationspräparat werden mindestens 10 Blöcke untersucht mit folgender Verteilung: − Resektatrand des Funiculus vor Manipulation am Hoden (1Block) − Schnitte aus zwei Etagen des Samenstranges vor Manipulation am Hoden (1 Block mit EvG) − Zerlegen des Hodenpräparates in Scheiben (quer zur Längsachse) von 3-4 mm Dicke. − Asservierung von Blöcken aus dem Hoden-Nebenhoden unter Berücksichtigung: Reg. 8 Hoden − des makroskopischen Bildes zur Erfassung aller Tumorkomponenten, inklusive Narben − der Topographie zur Erfassung der Tumorbeziehung zur Tunica albuginea/zum Rete Testis/Nebenhoden/ Samenstrang/ zu den Blut- und Lymphgefässen. (vor allem Hilusregion und Tunica albuginea) − des Restparenchyms (min. 1 Block mit PAS) − Minimale Blockzahl 8 Blöcke, bei sehr grossen Tumoren entsprechend mehr, bei bei kleinem Tumor mehr Resparenchym einbetten) − Immunhistochemische Untersuchungen nur sekundär und restriktiv (Alpha-Foetoprotein-, Beta-HCG, PLAP, ev. Endothelmarker zum Nachweis von Gefässeinbrüchen, MIB-1Fraktion als Risikofaktor bei Nicht-Seminom-Stadium I). − Das Restmaterial mindestens bis zur Klärung der serologischen Markersituation aufbewahren. D Berichterstattung − − − − − − − − − Art des Resektates Histologischer Tumortyp nach WHO (bei gemischtem Keimzelltumor geschätzter Anteil der Komponenten in %) Tumorgrösse Beziehung zu Organgrenzen Gefässeinbrüche Resektatränder Relevante Befunde der übrigen Resektatstrukturen Tumorstadium nach pTNM-Klassifikation 2. Biopsie bei Infertilität/Intratubuläre Keimzell-Neoplasie A Allgemeines Biopsien nach der Entnahme so rasch als möglich fixieren. Keine reine Formalinfixation verwenden. Als Fixationsmittel sind in absteigender Qualität folgende Gemische zu empfehlen. Karnovsky (gepuffertes Glutaraldehyd 0,2% und Formalin 2%) Formolsublimat Bouin Falls Flowzytometrische Analyse erwünscht ist, zusätzlich unfixiertes Gewebe asservieren. (Asservierungsart und Aufbewahrung mit Untersucher absprechen.) B Makroskopie − Probengrösse und Farbe − Anteil Tunica zu Parenchym 2 Reg. 8 Hoden 3 C Zuschnitt − Bei Karnovsky-Fixation und Methacrylateinbettung behalten von ¼ der Probe als Feuchtmaterial für allfällige elektronenmmikroskopische- oder immunhistochemische Untersuchung. − Cave: Mechanische Kräfte führen sehr rasch zur Desorganisation des Keimepithels und zu Quetschartefakten. − Einbettebene beachten (Tunica seitlich) D Berichterstattung − − − − − − − − Art der Biopsie (Stanzbiopsie, chirurgische Biopsie) prä/postpuberaler Zustand Ausmass der Spermatogonien/Spermiogenese qualitativ und quantitativ Intratubuläre maligne Keimzellneoplasie vorhanden ? Leydigzellen Entzündung tubulär/interstitiell/Vaskulitis Gefässpathologie Kommentar zur Bedeutung des Befundes im Hinblick auf spontane oder technisch assistierte (Spermatozoen/Spermatidenextraktion aus Hoden oder Nebenhoden) Fertilität. Literatur Jacobsen KG, Talerman A : Atlas of Germ Cell Tumours. Munksgaard 1989. Young RH & Scully RE : Testicular Tumors. ASCP Press 1990 Hedinger Ch: Pathologie des Hodens in Spezielle pathologische Anatomie Bd 21: Pathologie des Männlichen Genitale. W.Doerr et al. Springer Verlag 1991 Stocker JT, Dehner LP : Pediatric Pathology. J.B. Lippincott Company 1992. Nistal M & Paniagua R : Non-neoplastic Diseases of the Testis in Urologic surgical Pathology, D.G. Bostwick & J.N.Eble, Mosby 1997 Ro YJ, Grignon DJ, Amin MB, Ayala A : Atlas of Surgical Pathology of the Male Reproductive Tract. W.B. Saunders Company 1997 Mostofi FK & Sesterhenn IA : Histological Typing of Testis Tumours - WHO International Classification of Tumours. Second Edition. Springer Verlag 1998 Ulbright TM, Amin MB, Young RH : Tumors of the Testis, Adnexa, Spermatic Cord and Scrotum. Atlas of Tumor Pathology, Third Series. Fascicle 25. American Registry of Pathology AFIP 1999 Ulbright M & Roth LM : Testicular and Paratesticular Neoplasms in Diagnostic Surgical Pathology , St. Sternberg Third ed. 1999 Reg. 9 Kolon / Rektum 1 KOLON / REKTUM 1. Karzinom A Makroskopie - Probetyp: Resektat, Ektomie, Nachresektat, Schlingenresektat - Anatomische Lokalisation: (z.B. Ileum-Kolonresektat, Rektumamputat mit Anus) - Gewebezustand: - Nativ/fixiert - Eröffnet/nicht eröffnet - Fragmentation: Ja/nein (Schlingenresektate von Polypen) - Länge des Dickdarms und anderer allfällig mitresezierter Strukturen (z.B. Analmanschette, Appendix, Dünndarmsegment) - Tumor: - Anatomische Lage: (z.B. Beschreibung eines Rektumtumors in Beziehung zur peritonealen Umschlagfalte (oberhalb, auf Höhe, unterhalb) und Distanz zur Linea dentata. - Resektionsränder: Abstand zum oralen, aboralen und tiefen Resektionsrand. - Grösse: Angabe in drei Dimensionen falls möglich, oder im Durchmesser - Wuchsform: Polypös, Ulkus, zirkulär, diffus intramural, Stenose - Infiltrationstiefe: In Bezug auf Darmwandschichten, Angabe der Infiltrationstiefe in cm - Beziehung zur Serosa (z.B. Perforation) - Konsistenz, Farbe, Nekrose, Blutung - Beschreibung des übrigen, nicht vom Tumor befallenen Darmes (z.B. Divertikel, Polypen) - Lymphknoten - Anzahl Lymphknoten - Tumorbefallen: Ja/nein B Zuschnitt Grundsätzlich Dokumentation jedes makroskopisch erhobenen Befundes - Uebergang Tumor/normale Mukosa Tiefste Infiltrationsstelle und/oder Beziehung zur Serosa Oraler/aboraler (falls Abstand weniger als 5cm) und tiefer Resektionsrand Dokumentation allfälliger makroskopisch erhobener Befunde des übrigen Darmes (z.B. Divertikel, Polypen) und des Fettgewebes - Lymphknoten (üblicherweise 12 oder mehr Lymphknoten). Tumorherde im perirektalen oder perikolischen Fettgewebe mit einem Durchmesser grösser als 0.3 cm werden als Lymphknotenmetastase taxiert, auch wenn histologisch keine Lymphknotenreste erkennbar sind. Reg. 9 Kolon / Rektum 2 C Berichterstattung - Art des Resektats (z.B. Rektumamputat, Ileozaekalresektat) - Histologischer Typ nach WHO Differenzierungsgrad GI - GIII - Makroskopische Befunde (Grösse, Ulkus, Stenose, Perforation) - Infiltrationstiefe (Tela submucosa, Tunica muscularis propria, Fettgewebeinfiltration in cm, Serosa) - Blut- und Lymphgefässeinbrüche, in der Darmwand und/oder im perikolischen Fettgewebe - Perineuralspalteninfiltration - Resektionsränder: Oral, aboral und tiefer Resektionsrand frei (Abstand) oder tumorbefallen (direkt oder durch Lymphangiosis carcinomatosa) - Relevante Befunde des übrigen Dickdarms: Z.B. Adenome, Divertikel - Lymphknoten: - Anzahl der histologisch untersuchten Lymphknoten und Zahl der tumorbefallenen - pTNM-Klassifikation 2. Endoskopisch reseziertes Karzinom in einem Adenom A Makroskopie - Lokalisation Fragmentation: Ja/nein Masse Stiel: Länge B Zuschnitt - Tuschemarkierung der Resektionsflächen - Adenome mit Stiel: Vollständige Einbettung von Adenom und Stiel in Längsrichtung (sagittal) - Wenn Stiel länger als 6 mm kann die Stielabtragungsstelle quer geschnitten werden C Berichterstattung - Entnahmestelle und Entnahmeart Histologischer Typ des invasiven Karzinoms nach WHO und Differenzierungsgrad Invasionstiefe Gefässeinbrüche Abstand des Tumors zum Resektionsrand pTNM Gemäss WHO sollten die Begriffe intramuköses Karzinom oder Carcinoma in situ wegen der Gefahr der Uebertherapie (unnötige Darmresektion) nicht verwendet werden. - Anzahl der histologisch untersuchten Lymphknoten und Anzahl der tumorbefallenen Die Indikation für eine nachträgliche Dickdarmresektion ergibt sich aus der Kombination folgender prognostisch günstiger oder ungünstiger Faktoren des Karzinoms. Reg. 9 3 Kolon / Rektum Günstige Prognose Ungünstige Prognose Differenzierungsgrad: Gut, mittelgradig differenziert Wenig differenziert Lymph-/Hämangioinvasion: Fehlt Vorhanden Resektionsrand: Tumorfrei (Abstand > oder = 3mm) Befallen oder Abstand < 3mm Invasion tieferer Schichten als Tela submucosa Nein Ja 3. Kolonadenom A Makroskopie und B Zuschnitt analog zu Abschnitt 2. C Berichterstattung - Entnahmestelle Grösse Histologischer Typ Dysplasiegrad : Low-grade (leichte und mittelschwere Dysplasie), high grade (schwere Dysplasie). 4. Familiäre Polyadenomatose A Makroskopie - Auszählen der Polypen als Mass auf einer Fläche von z.B. 5 Quadratzentimeter Sessil/gestielt Grösse Verteilung im Dickdarm B Zuschnitt - Herstellung einer Skizze und Einzeichnen der Entnahmestellen (erlaubt die Lokalisation schwerer Dysplasien oder invasiver Karzinome) - Untersuchung aller grossen und sessilen Adenome (erhöhtes Karzinomrisiko wenn grösser als 1cm) - Lymphknoten wie unter Abschnitt 1C, aber segmentbezogen Reg. 9 Kolon / Rektum 4 C Berichterstattung - Anzahl Adenome (geschätzt), Adenomtyp (tubulär, tubulo-villös, villös), Grösse Dysplasiegrad (vgl. Abschnitt 3.) Anzahl tumorbefallene im Verhältnis zur Gesamtzahl der histologisch untersuchten Lymphknoten 5. Karzinom/Dysplasie bei Colitis ulcerosa A Makroskopie - Ausdehnung der entzündlichen Veränderung - Kontinuierlich/segmental - Tumor: Ja/nein, Wachstumstyp B Zuschnitt - Skizze mit Einzeichnen der Schnittpräparate - Gewebeproben aus Tumor oder indurierter Plaque - Eine Gewebeprobe pro 10 cm Darmlänge makroskopisch entzündlich veränderter Mukosa - Lymphknoten wie unter 1C C Berichterstattung - Karzinom: Analog zu Abschnitt 1 - Dysplasie: Low grade und high grade (analog zu 3. C) Indefinite for Dysplasia: Die Diagnose der Dysplasie kann nicht gestellt werden, sei es aus diagnostischen Gründen (nukleäre Atypien vorhanden aber nicht eindeutig als Dysplasie einzuordnen), aus qualitativen (Artefakte, schwere Entzündung) oder aus quantitativen Gründen (ungenügendes, zuwenig Biopsiematerial). 6. Immunhistochemie Bei unsicherem Befund eines Lymph- oder Blutgefässeinbruchs Einsatz eines EndothelAntikörpers vor allem bei endoskopisch reseziertem Karzinom im Adenom (siehe Abschnitt 2). Obwohl die konventionelle Lichtmikroskopie das entscheidende Kriterium für die Beurteilung darstellt, kann zusätzlich das p53 bestimmt werden. Eine p53-Mutation scheint ein frühes Ereignis bei der Colitis ulcerosa assoziierten Dysplasie zu sein. Sie korreliert mit dem Aneuploidie- und Dysplasiegrad und findet sich bereits in histologisch nicht dysplastischer Mucosa. Als positives Resultat gilt eine Expression von p53 in mehr als 10% der Tumorzellkerne. Reg. 9 Kolon / Rektum 5 Literatur Morson BC, Whiteway JE, Jones EA et al.: Histopathology and prognosis of malignant colorectal polyps treated by endoscopic polypectomy. Gut 1984; 25:437-444. Coverlizza S, Risio M, Ferrari A et al.: Colorectal adenomas containing invasive carcinoma: Pathologic assessment of lymph node metastatic potential. Cancer 1989; 64:1937-1947. Hermanek P. Onkologische Chirurgie/Pathologisch-anatomische Sicht. Langenbecks Arch Chir Suppl 1991; 277-281. Burmer GC, Rabinovitch PS, Haggitt RC et al.: Neoplastic progression in ulcerative colitis: Histology, DNA content, and loss of a p53 allele. Gastroenterology 1992; 103: 1602-1610. Brentnall TA, Crispin DA, Rabinovitch PS et al.: Mutations in the p53 gene: An early marker of neoplastic progression in ulcerative colitis. Gastroenterology 1994; 107: 369-378. Harpaz N, Peck AL, Yin J et al.: p53 protein expression in ulcerative colitis-associated colorectal dysplasia and carcinoma. Hum Pathol 1994; 25: 1069-1074. Zarchy TM and Ershoff D: Do characteristics of adenomas on flexible sigmoidoscopy predict advanced lesions on baseline colonoscopy? Gastroenterology 1994; 106:1501-1504. GastroMed Suisse in Zusammenarbeit mit der Fachgesellschaft der Schweizerischen Gastroenterologen FMH: Empfehlungen zur Nachsorge nach Abtragung von kolorektalen Polypen (Adenomen). Beilage zur Schweizerischen Aerztezeitung Nr. 23, 1996 Harpaz N and Talbot IC. Colorectal cancer in idiopathic inflammatory bowel disease. Semin Diagn Pathol 1996; 13(4): 339-357. Recommendations for the reporting of resected large intestinal carcinoms. Association of directors of anatomic and surgical pathology. Hum Pathol 1996; 27:5-8. Schweizerische Gesellschaft für Pathologie: Borderline lesions of the gastro-intestinal tract: Slide seminar handout. Saraga E. Case 6. Schnittseminar vom 08.05.99 in Bern. . Reg. 9 Kolon / Rektum 6 Checkliste Kolon-/Rektumkarzinom Anatomische Topographie: Zaekum, Colon ascendens, transversum, descendens, sigmoideum, Rektum Probetyp: Darmresektat, Ektomie, Schlingenresektat Tumor: Exophytisch, polypös, Ulkus, Stenose, diffus intramural Invasives Karzinom: Klassierung nach WHO Differenzierungsgrad: Hoch (G1), mittelgradig (G2), wenig differenziert (G3) Infiltrationstiefe: Tela submucosa, Tunica muscularis propria, perikolisches Fettgewebe Angioinvasion: Lymph- und Blutgefässe Serosa: Tumorfrei/Perforation Resektionsränder: Tumorbefallen: Makroskopisch, mikroskopisch direkt oder durch Lymphangiosis carcinomatosa Anatomische Lokalisation des tumorbefallenen Resektionsrandes Diagnosen des übrigen tumorfreien Dickdarms: Adenom (histologischer Typ, Dysplasie) Divertikel Lymphknoten: Anzahl tumorbefallene im Verhältnis zu den histologisch untersuchten Lymphknoten Karzinom in Adenom (Schlingenresektat): Differenzierungsgrad des Karzinoms Infiltrationstiefe in Millimeter oder Zentimeter Angioinvasion Abstand zum Resektionsrand Adenomtyp und Dysplasiegrad pTNM-Klassifikation: Reg. 10 Larynx 1 LARYNX Laryngektomie wegen Karzinom Makroskopie Operationspräparat: - Resektionstyp: Hemilaryngektomie, Larynxresektion, totale Laryngektomie mit/ohne Neckdissection Zustand des Präparates: unfixiert/fixiert, geschlossen, eröffnet, Fadenund/oder Metallmarkierungen Tumor: Anatomische Lokalisation: Supraglottis, Glottis, Subglottis Grösse (Längs- und Querdurchmesser, Tiefenausdehnung) Wuchsform (polypös, verrukös, plaqueförmig, ulzeriert, multifokal, Begrenzung) Infiltration von Knorpel und Knochen Uebergreifen auf Muskulatur Abstand vom proximalen und distalen Resektionsrand Präparation und Zuschnitt - Eröffnung je nach Tumorlokalisation Resektionsränder 5 mm Schnitte durch Tumor (maximale Infiltrationstiefe darstellen) und Uebergang zur tumorfreien Mukosa Dekalzifizierung falls Tumor auf Knochenstrukturen übergreift Benachbarte Organe (z. B. Schilddrüse) und eventuelle Tracheostomieseite Nicht neoplastische Mukosa Neckdissection Lymphknotengruppen (sollten vom Chirurg markiert werden): Level I: Level II: Level III: Level IV: Level V: Level VI: Knoten der Submandibular- und Submentalgegend Knoten der kranialen Jugularkette Knoten der mittleren Jugularkette Knoten der kaudalen Jugularkette (die Grenze zwischen Level III und IV liegt dort, wo der Omohyoidmuskel in der Tiefe den Sternocleidomastoideus kreuzt). Knoten des hinteren Dreiecks, hinter dem hinteren Rand des musculus sternocleidomastoideus Knoten des vorderen Kompartements um die viszeralen Organe der Mittellinie (vom Hyoid zur Suprasternalgegend) Identifizierung der Neckdissection-Strukturen: Lymphknoten, nach Level trennen und mit Kapsel und Fettgewebe zuschneiden Glandula submandibularis Reg. 10 Larynx - Musculus Sternocleidomastoideus Musculus Omohyoideus Vena jugularis externa und interna Nervus accessorius Glandula parotis Haut Stylohyoid Musculus digastricus Berichterstattung - Art des Operationspräparates histologischer Tumortyp nach WHO Differenzierungsgrad Anatomische Lokalisation des Tumors Makroskopischer Aspekt (polypös, verrukös, ulzeriert, multifokal) Grösse des Tumors Tiefe der Infiltration Typ der Infiltration (breite cohäsive Front, Front aus schmalen Zellsträngen oder dissozierten Zellgruppen) Gefässinvasion (Lymph- und/oder Blutgefässe) Nerveninfiltration Resektionsränder; wenn tumorfrei: Abstand Anzahl regionärer Lymphknoten, davon tumorbefallen nach Level (I - VI) Transkapsuläres Wachstum Befall regionärer Strukturen (Knorpel, Knochen, Muskulatur, Speicheldrüsen) Tumorklassifikation nach pTNM Dysplastische Läsionen/carcinoma in situ der Schleimhäute Andere Befunde (Zeichen einer vorausgegangenen Therapie) 2 Reg. 10 Larynx 3 Checkliste Larynxkarzinom - Seite: links, rechts, median Anatomische Lokalisation (Glottis, Supraglottis, Subglottis) Tumor: Grösse in drei Dimensionen Klassifizierung: nach WHO Differenzierungsgrad: gut, mässig, wenig differenziert Angioinvasion (Lymph- und Blutgefässe) Nerveninvasion Knorpel-/Knocheninfiltration Resektionsränder: tumorbefallen tumorfrei: Ausmessen des minimalen Abstandes der invasiven Front - Lymphknoten: Anzahl tumorbefallene Knoten nach Level im Verhältniss zur Gesamtzahl histologisch untersuchter Lymphknoten Metastasen (Makro- Mikrometastasen, konfluierend) transkapsuläres Wachstum Weichteilinfiltration pTNM-Klassifikation - Literatur Derek C. Allen Histopatology Reporting: Guidelines for Sugical-Cancer, Springer Verlag London Limited 2000. Helliwell TR,Woolgar JA. Minimum Dataset for Head and Neck Carcinoma (http://www.rcpath.org), 2000. Slootweg PJ, de Groot JAM. Surgical Pathological Anatomy of Head and Neck Specimens: A Manual for the Dissection of Surgical Specimens From the Upper Aerodigestive Tract. Springer 1999. Sobin LH et al. TNM Supplement (2nd edition) and TNM Classification of Malignant Tumours. (fifth edition) New York: John Wiley & Sons, Inc 2001 and 1997. Lumermann H, Freedmann P, Kerpel S. Oral epithelial dysplasia and development of invasive squamous cell carcinoma. Oral Surg. Oral Med. Oral Pathol. 1995: 79: 321329 Roland NJ, Caslin AW, Nash J, Stell PM. Value of grading squamous cell carcinoma of the head and neck. Head Neck 1992: 14: 224-229 Van den Bekel NWM, Stel HV, van der Valk P, van der Waal I, Meyer MCJL, Snow GB. Micrometastases from squamous cell carcinoma in neck dissection specimens. Eur. Arch. Othorinolaryngol. 1992: 249: 349-353. Snow GB, Annayas A, Vanslooten EA, Bartelink H, Hart AM. Prognostic factors of neck node metastatis. Clin. Otolaryngol. 1982: 7: 185-190. Hellquist H, Lundgren J, Olofsson J. Hyperplasia, keratosis, dysplasia and carcinoma in situ of the vocal cords - a follow-up study. Clin. Otolaryngol. 1982: 7: 11-27. Reg. 11 Lunge 1 LUNGE Allgemeiner Teil Aufarbeitung von ganzen Lungen, Lungenlappen, Segmenten oder Keilresektaten Lungenentfaltung - Lungenresektate sollen generell in entfaltetem Zustand untersucht werden. Dies gewährleistet eine exakte Bestimmung von Lokalisation, Grösse und morphologischem Typ jedweder Gewebsveränderung (Tumoren, entzündliche Veränderungen, Emphysem). - Bei Autopsien ist die Untersuchung einer - in der Regel der linken - Lunge nach Fixation in entfaltetem Zustand von Vorteil. Fixation - Instillierung des Fixationsmittels über die Bronchien bei einem Druck von 20 cm H2O. - Alternative (Segmentresektate/offene Biopsie): Infiltration des Fixationsmittels mit einer Spritze von aussen in das Lungengewebe. Präparation - von aussen sichtbare (lobäre/hiläre) Lymphknoten werden getrennt untersucht - Zuerst Bronchien, dann Arterien in Längsrichtung aufschneiden. Bei Tumoren vor Aufschneiden Bronchien zur Feststellung von Bronchusverschlüssen sondieren. - Bronchusabtragungsstelle zur Prüfung auf Tumorfreiheit quer schneiden. - Nach Präparation des Hilus wird die Lunge von lateral her von der Pleura auf den Hilus zu (sagittal) in 0,5 - 2,0 cm dicke Scheiben zerlegt. (Falls eine Korrelation mit Computertomogrammen gewünscht, auch in horizontale Scheiben). - Zur Darstellung der segmentalen und subsegmentalen Lymphknoten wird ein Schnitt durch eine hilusnahe Ebene gelegt. - Auch bei makroskopisch unauffälligen Lungen wird aus Ober- und Unterlappen der zentralen Lungenscheibe Gewebe entnommen. - Bei Keilexzisaten wegen Tumor oder Tumorverdacht Schnittführung senkrecht zur Abtragungsfläche Reg. 11 Lunge 2 Aufarbeitung von offenen Lungenbiopsien Definition - Als offene Lungenbiopsie (OLB) gilt die Entnahme von Lungengewebe aus diagnostischer Indikation mittels Thorakotomie oder Thorakoskopie/VATS (= video assisted thoracic surgery). Indikation der OLB - Abklärung disseminierter Lungenkrankheiten, wenn die Diagnose nicht mittels bronchologischer Methoden (transbronchiale Biopsie, bronchoalveoläre Lavage) gestellt werden konnte. Chirurgische Gewebsentnahme - Die Gewebsentnahme soll gezielt aus der Läsion erfolgen und auch angrenzendes, unverändertes Lungengewebe enthalten. - Adäquate Grösse: 3-4 x 2 x 1 cm - Für mikrobiologische Untersuchungen (Kultur) sollten Gewebsabstriche möglichst unter sterilen Kautelen im Operationssaal erfolgen. Am besten ist die Entnahme eines zweiten Gewebsstückes direkt für die Mikrobiologie. - Zur Kontrolle, ob die Läsion getroffen ist, kann ein kleiner Teil des Gewebes von der Abtragungsfläche im Schnellschnitt untersucht werden. Das gefrorene Gewebe kann anschliessend tiefgefroren asserviert werden. - Je nach Fragestellung Gewebsentnahme für Elektronenmikroskopie. Fixation - durch Infiltration mit 4% gepuffertem Formalin (s.o.). - Fixationsdauer: Einige Stunden Histologische Aufarbeitung - Nach beendeter Fixation Zerlegung des Gewebes mit einer Rasierklinge parallel zur Abtragungsfläche in 2 - 3 mm dicke Scheiben - Makroskopische Beschreibung von Pleuraoberfläche und Schnittfläche - Einbettung: In der Regel das formalinfixierte Gewebe vollständig in Paraffin einbetten. Wenn Gewebsstück ausreichend gross, formalinfixiertes Gewebe für allfällige Fettfärbung aufbewahren. - Färbungen: Standard: H&E, EvG; zusätzlich je nach Fragestellung Berliner Blau, AlcianblauPAS, Giemsa (Mastzellen, hämatologische Erkrankung), Grocott (Pilze, Pneumozysten) oder eine andere Färbung zur Erregerdarstellung. Reg. 11 Lunge 3 Aufarbeitung von Bronchusbiopsien und transbronchialen Lungenbiopsien - Bronchoskopisch werden meist mehrere Gewebsproben aus dem Bronchialsystem und/oder Lunge entnommen. Wegen der Kleinheit der Gewebsproben müssen von vornherein mehrere ungefärbte Serienschnitte hergestellt werden, um Gewebsverluste durch wiederholtes Anschneiden der Paraffinblöcke zu vermeiden. - Färbungen richteten sich nach Fragestellung. Bei Tumor ist stets Schleimfärbung indiziert. Aufarbeitung von Gefrierschnitten - Ein Verdacht auf Tuberkulose ist keine Kontraindikation - Schnellschnitt zur Tumordiagnose nur indiziert, wenn der Tumor unter Ausschöpfung aller weniger invasiven Methoden bioptisch und zytologisch nicht diagnostiziert werden konnte. - Indikation bei Tumoren: Schnittrandbeurteilung Reg. 11 Lunge 4 Spezieller Teil Vorgehen bei resezierten Bronchuskarzinomen Bei der Begutachtung von Lungenresektaten wegen Bronchuskarzinoms sind folgende Punkte zu berücksichtigen und im Bericht festzuthalten Makroskopie - Art des Resektates: Pneumonektomiepräparat / Lappen- / Segment- / Keilresektat - Seitenlokalisation re/li. - Zustand des Resektats bei Ankunft: fixiert / unfixiert, angeschnitten / unangeschnitten, nachträglich wie fixiert?, Grösse, Entfaltungszustand - Tumor: Lokalisation (Lappen, Segment, zentral/peripher) Beziehung des Tumors zu Resektionsrändern: Absetzungsbronchus, Entfernung vom bronchialen Resektionsrand grosse Gefässe, Pleura, Perikard, Zwerchfell, Rippen Tumorgrösse in cm (grösster Durchmesser) Tumorschnittfläche (bei Nekrose prozentualen Anteil schätzen) - Lymphknoten: siehe Präparation im allgemeinen Teil - Lungengewebe ausserhalb des Tumors: Atelektase, Bronchiektasen, endogene Lipidpneumonie ("xanthomatöse Pneumonie"), Emphysem Herausschneiden, Gewebsasservierung - Frischgewebe: Wenn möglich Gewebe von Tumor und "normaler" Lunge bei -70o C einfrieren (ca 1 cm3) - Anzahl Gewebsblöcke: Genügend Tumorgewebe aufbewahren (tiefgefroren und in Paraffin eingebettet). - Grundsätzlich: - Vermuteter Ausgangspunkt - Tumorperipherie mit Übergang zu Lungengewebe - Resektionsränder (Bronchus- und Gefässstümpfe, Pleura) - Getrennt aus allen Lymphknotenstationen. Alle Lymphknoten untersuchen. - Nicht von Tumor befallenes Lungengewebe (1 Stück/Lappen) - Besondere Befunde Reg. 11 Lunge 5 Berichterstattung - Histologischer Typ des Tumors nach WHO - Histologischer Differenzierungsgrad gemäss WHO (bei Plattenepithel-, Adeno- und neuroendokrinem Karzinom) - Grösster Tumordurchmesser - alle für die Bestimmung des pTNM-Stadium nach UICC wichtigen Daten (nach Möglichkeit soll das pTNM-Stadium angegeben werden) - Abstand des Tumors vom bronchialen Resektionsrand - Resektionsränder (Bronchus- und Gefässstümpfe, Pleura) - Carcinoma in situ im Bronchialsystem - Mikroskopischer Tumoreinbruch in die Blutgefässe - Lymphangiosis carcinomatosa - Perineurale Tumorinvasion Vorgehen bei resezierten Lungenme tastasen - Grundsätzlich wie bei Bronchuskarzinom. Wichtig: Resektionsränder Literatur WHO. Histological typing of lung and pleural tumours (3nd edition ed.), Springer-Verlag, 1999 Association of Directors of Anatomic and Surgical Pathology. Recommendations for the reporting of resected primary lung carcinomas. Association of Directors of Anatomic and Surgical Pathology. Am J Clin Pathol 1995;104:371-4. Hermanek P, Hutter RVP, Sobin LH, Wagner G, Wittekind CH, ed. TNM Atlas. Illustrated Guide to the TNM/pTNM Classification on Malignant Tumours. 4. Auflage ed. Berlin Heidelberg New York: Springer-Verlag, 1997:125-126. Mountain C. F., Dresler C.: Regional lymph node classification for lung cancer staging. Chest 1997: 111, 1718-1723 Reg. 11 Lunge 6 Checkliste zur Aufarbeitung und Begutachtung von Lungenkarzinomen Zustand des Resektates: fixiert/unfixiert Entfaltungszustand nachträgliche Fixation Grösse Topographie: Rechte Lunge ROL Linke Lunge LOL Segment (re. 1-10, li. 1-10) RML RUL LUL Operationstyp: Pneumonektomie Lobektomie Bilobektomie Segmentresektion Keilexzision Anderes (Sleeve resection, Enukleation etc) Lokalisation: Lappen Segment zentral peripher Tumorgrösse: grösster Durchmesser Resektionsränder: Bronchus Arterie (evtl. Vene) Pleura - Abstand Tumor - bronchialer Resektionsrand Histologischer Tumortyp: nach WHO Histologischer Differenzierungsgrad: Nur bei Plattenepithel- und Adenokarzinomen hoch mittel niedrig Zusatzbefunde: Gefässinvasion Carcinoma in situ Nicht von Tumor befallenes Lungengewebe: Atelektase Bronchiektasen Anderes Lymphknoten gemäss pTNM Lymphangiosis carcinomatosa Invasion in Nervenscheiden Poststenotische Pneumonie Tumorbedingter Lungeninfarkt Reg. 12 Lymphknoten LYMPHKNOTEN 1. Klinische Angaben Ausser den üblichen Angaben (siehe Leitlinien Chirurgische Pathologie) werden folgende zusätzliche Angaben benötigt: - Topografie des Lymphknotenbefalls - Hepato- oder Splenomegalie - B-Symptome - Peripheres Blutbild - Knochenmarkbefund - Serologische Befunde 2. Wahl des zu biopsierenden Lymphknotens - Immer den grössten erreichbaren Lymphknoten biopsieren. Zervikale Lymphknoten am besten geeignet (inguinale und axilläre Lymphknoten sind oft durch unspezifische Reaktionen vergrössert). 3. Bioptische Methoden - - Chirurgische Biopsie: Nach Möglichkeit immer anzustreben, insbesondere bei Erstdiagnose. Feinnadelaspiration: Als orientierende Untersuchung bei Lymphknotenschwellungen akzeptiert. Nadelbiopsie (true cut), Zangenbiopsie: Ungeeignet, da Gewebe häufig traumatisiert, Strukturveränderungen schlecht erkennbar und Material für Zusatzuntersuchungen meist ungenügend. Ausnahme: Schwer zugängliche Lymphknoten (z.B. retroperitoneal). Eine Feinnadelaspiration kann zusätzlich Informationen liefern. Schnellschnittuntersuchungen: Nicht geeignet für die Diagnose maligner Lymphome. Ausnahmen: Nachweis von Metastasen bei bekanntem Primärtumor oder Ueberprüfung, ob genügend Material für Zusatzuntersuchungen bzw. eine definitive Diagnose vorhanden ist. Keine Schnellschnittuntersuchung bei HIV-positiven Patienten oder Hepatitis B. 4. Fixation und Einsendung - - Einsendung von unfixiertem Material: gekühlt auf Gaze, angefeuchtet mit pysiologischer Kochsalzlösung oder in trockenem, gutverschlossenem Behälter auf Eis (Ausnahme: HIV positive Patienten oder Hepatitis B). Transportdauer nicht länger als eine Stunde. Für Standardfärbungen und Immunhistochemie mit paraffingängigen Antikörpern: 4% gepufferte Formaldehydlösung. Bei Verdacht auf infektbedingte Lymphadenopathie sterile Materialasservierung für mikrobiologische Untersuchung vor dem Versand. Zerstörung des Lymphknotens möglichst vermeiden. 1 Reg. 12 Lymphknoten 2 5. Makroskopie - Lokalisation (Entnahmestelle) Anzahl Knoten / einzelner / mehrere / verbacken Gewebezustand: nativ / fixiert (wie) Markierungen Grösse (grösster Durchmesser) und Form Kapsel: vorhanden / nicht abgrenzbar / beschädigt / anhaftendes Gewebe Konsistenz Beschaffenheit der Schnittfläche 6. Aufarbeitung von unfixiertem Material Fakultative Massnahmen (je nach Komplexität des Falles): - Hausinterner Schnellschnitt zur Orientierung und für die Wahl des weiteren Vorgehens. - Schockgefrieren eines Teiles und Aufbewahren bei –80°C - Tupfpräparate für Zytologie, Immunhistochemie, Bildanalyse und statische Zytometrie - DNA-Extration für molekularbiologische Untersuchungen (Southern Blot, PCR) - Zellsuspension für Durchflusszytometrie und Zytogenetik 7. Histologische Aufarbeitung und Zusatzuntersuchungen von fixiertem Material - Schnittdicke 3-4µm Standardfärbungen: HE, Giemsa, PAS, Gömöri, EVG Fakultativ: Immunhistochemie. Die Antikörperauswahl richtet sich nach der an den Standardpräparaten gestellten Diagnose und der Differentialdiagnose Gen-rearrangement (fakultativ) 8. Histopathologische Diagnose - Die primäre histopathologische Beurteilung erfolgt am Paraffinschnitt. Sie ist die Grundlage für die Durchführung weiterer Spezialuntersuchungen. Klassifikation nach Kiel (1992), R.E.A.L. (1994) und/oder WHO (2000) 9. Berichterstattung - Lokalisation Lymphomtyp Resultate von Zusatzuntersuchungen Reg. 13 Magen MAGEN 1. Magenresektion wegen fortgeschrittenem Karzinom Makroskopie Operationspräparat - Resektionstyp - Länge der kleinen und der grossen Kurvatur - ösophageale oder duodenale Manschette ja/nein - zusammen mit dem Magen resezierte Gewebsteile oder Organe - Zustand des Präparates: unfixiert/fixiert, geschlossen/eröffnet, fragmentiert oder ganz Tumor - anatomische Lokalisation (grosse oder kleine Kurvatur, Kardia, Fundus, Korpus, Antrum, Pylorus) - Abstand vom proximalen und distalen Resektionsrand - Grösse (Längs- und Querdurchmesser, Tiefenausdehnung) - Wuchsform (polypös/ulzeriert/diffus) - zirkulär oder nicht - Infiltation/Perforation der Serosa - Infiltrationstiefe und Abstand zur axialen Resektionsfläche kleinkurvaturseits - Uebergreifen auf Duodenum, Oesophagus oder andere mitresezierte Organe Nicht tumorbefallener Magenteil - Beschaffenheit der Schleimhaut, zusätzliche Läsionen Lymphknoten - Zahl, Grösse und Lokalisation Präparation und Zuschnitt - Kleines und grosses Netz abtrennen. Vorhandene Lymphknoten herauspräparieren - Eröffnung entlang der grossen Kurvatur (Tumor nicht durchschneiden) Histologische Dokumentation jedes makroskopisch erhobenen Befundes, insbesondere: - Tumorrandpartien mit Uebergang zu tumorfreier Schleimhaut - maximale Infiltrationstiefe mit Einbezug der Resektionsfläche kleinkurvaturseits und/oder der Serosa (Tusche-Markierung angezeigt) - bei diffus wachsenden und schlecht abgrenzbaren Tumoren mehrere orientierbare Gewebeproben, um die Grösse des Tumors abschätzen zu können - je nach Lokalisation des Tumors proximaler und/oder distaler Resektionsrand (z.B. als swiss roll), Resektionsrand (Fettgewebe) klein- und/oder grosskurvaturseits - tumorfreie Schleimhaut (Nachweis präkanzeröser Läsionen) - alle auffindbaren regionären Lymphknoten, üblicherweise 15 und mehr - Beziehung Tumor zu Oesophagus/Duodenum/andere ev. mitresezierte Organe - ev. zusätzliche Proben gemäss Fragestellung des Chirurgen Spezialfärbungen / Immunhistochemie - modifizierte Giemsa-Färbung zum Nachweis von Helicobacter pylori - endotheliale Marker zur Abklärung einer fraglichen Angioinvasion (fakultativ) 1 Reg. 13 Magen Berichterstattung - Art des Operationspräparates - histologischer Tumortyp nach WHO - anatomische Lokalisation des Tumors - Differenzierungsgrad - makroskopischer Aspekt (polypös/ulzeriert/flach/perforiert) - Grösse des Tumors - Tiefe der Infiltration - Gefässinvasion (Lymph- und/oder Blutgefässe) - Resektionsränder: wenn tumorfrei: Abstand; wenn tumorbefallen: direkt oder durch Lymphangiosis carcinomatosa - Anzahl regionäre Lymphknoten, davon tumorbefallen - Befall nicht regionärer Lymphknoten (z.B. retropankreatisch, mesenterial oder paraaortal) - Tumorklassifikation nach pTNM - andere relevante Befunde am Magen (Gastritis mit Angabe des Typs, HP-Befall, Metaplasie, Dysplasie) - andere relevante Befunde an Duodenum und Oesophagus 2. Magenresektion wegen schwerer Dysplasie oder Frühkarzinom Makroskopie Operationspräparat Wie unter 1. beschrieben Schleimhautbefund - Lokalisation und Grösse der Läsion - Oberflächenbeschaffenheit: erhaben/à Niveau/oberflächlich oder tief ulzeriert - Abstand vom proximalen und distalen Resektionsrand Normaler Magenanteil - Beschaffenheit der Schleimhaut, ev. zusätzliche Läsionen, Wanddicke Lymphknoten - Zahl, Grösse, Lokalisation Präparation und Zuschnitt Histologische Dokumentation aller Befunde, insbesondere: - Kartographische Entnahme orientierter Proben aus dem ganzen suspekten Schleimhautbezirk mit Uebergangszonen zu normaler Schleimhaut - proximale und distale Resektionsränder - mehrere Proben aus Schleimhaut mit normalem Aspekt zur Erfassung prädisponierender und prämaligner Läsionen - alle entlang der kleinen oder grossen Kurvatur auffindbaren Lymphknoten, üblicherweise 15 und mehr - besondere makroskopische Befunde - ev. zusätzliche Proben gemäss Fragestellung des Chirurgen 2 Reg. 13 Magen 3 Berichterstattung - Art des Operationspräparates - Lokalisation und Ausdehnung der neoplastischen Läsionen gemäss den makroskopischen und mikroskopischen Befunden - Resektionsränder: wenn tumorfrei: Abstand; wenn tumorbefallen: Ausdehnung - Anzahl Lymphknoten, davon tumorbefallen - Tumorklassifikation nach pTNM - andere relevante Läsionen am Magen (Gastritis mit Angabe des Typs, HP-Befall, Metaplasie, Dysplasie) - andere relevante Läsionen an Duodenum und Oesophagus 3. Magenresektion wegen Stromatumor Makroskopie Operationspräparat - Typ der Resektion (Resektion oder Gastrektomie, Tumorexzision) - Zustand des Präparates: frisch/fixiert, eröffnet/geschlossen, fragmentiert oder nicht - Masse des Präparates - Beschreibung eventueller durch den Chirurgen angebrachter Markierungen - ev. mitresezierte andere Organe oder Organteile Tumor - anatomische Lokalisation - Abstand von den Resektionsrändern - Grösse dreidimensional falls möglich, oder maximaler Durchmesser - Aspekt des Tumors, Nekrose, Schleimhautulzeration - Beziehung des Tumors zu Muscularis propria und Serosa - Infiltration anderer mitresezierter Organstrukturen Tumorfreier Magenanteil - Beschaffenheit, zusätzliche Läsionen der Schleimhaut Präparation und Zuschnitt Histologische Dokumentation aller makroskopischer Befunde, insbesondere: - eine Probe aus dem Tumor pro cm Tumordurchmesser - Uebergang Tumor/tumorfreie Wand - Resektionsflächen (Tuschemarkierung angezeigt) - nicht tumorbefallene Magenwand inkl. Schleimhaut - alle tumorsuspekten, vom Haupttumor abgesetzten Knoten - Tumorinfiltration mitresezierter, benachbarter Strukturen - alle auffindbaren Lymphknoten - ev. zusätzliche Proben gemäss Fragestellung des Chirurgen Reg. 13 Magen 4 Zusatzuntersuchungen bei stromalen Tumoren - Proliferationsindex (MIB 1, Ki-67) - immunhistochemische Typisierung (c-kit/CD 117, CD34, sm-actin, Desmin, S-100, GFAP) - Materialasservierung für elektronenmikroskopische Untersuchung (fakultativ) Berichterstattung - Art des Operationspräparates - histologischer Typ nach WHO - anatomische Lokalisation des Tumors - makroskopischer Aspekt des Tumors (Grösse, Ulzeration oder Infiltration der Schleimhaut, Nekrosen) - Beziehung zu den verschiedenen Wandstrukturen - Stellungnahme oder Kommmentar zur Dignität - Resektionsränder: wenn tumorfrei: Abstand; wenn tumorbefallen: Ausmass - Lymphknoten: Anzahl, davon tumorbefallen - zusätzliche gastrische, ösophageale oder duodenale Läsionen Literatur Lauren P. The two histological main types of gastric carcinoma. Diffuse and so-called intestinal type carcinoma. Acta Pathol Microbiol Scand 1965 ; 64 : 31-49. Kajitani T. The general rules for the gastric cancer study in surgery and pathology. Jap J Surgery 1981 ; 11 : 127-139. Borchard F. Classification of gastric carcinoma. Hepato-gastroenterology 1990 ; 37 : 223232. Amin MB, Ma CK, Linden MD, Kubus JJ, Zarbo RJ. Prognostic value of proliferating cell nuclear antigen index in gastric stromal tumors. Correlation with mitotic count and clinical outcome. Am J Clin Pathol 1993 ; 100 : 428-432. Miettinen M, Virolainen M, et al. Gastrointestinal stromal tumors. Value of CD34 antigen in their identification and separation of true leiomyomas and schwannomas. Am J Surg Pathol 1995 ; 19 : 207-216. Ma CK, Deperalta MN, Amin MB, Linden MD, Dekovich AA, Kubus JJ, Zarbo RJ. Small intestinal stromal tumors. A clinicopathologic study of 20 cases with immunohistochemical assessment of cell differentiation and the prognostic role of proliferation antigens. Am J Clin Pathol 1997 ; 108 : 641-651. Sarlomo-Rikala M, Kovatich AJ, Barusevicius A, Miettinen M. CD117 : a sensitive marker for gastrointestinal stromal tumors that is more sensitive than CD34. Mod Pathol 1998 ; 11 : 728-734. Reg. 14 Mamma MAMMA 1. Invasives Karzinom Makroskopie - Typ des Operationspräparates: Mastektomie, Lumpektomie, Probeexzisat, Nachresektat, Inzisionsbiopsie, Stanze - Lokalisation: Rechts, links, Angabe des Quadranten, zentraler Drüsenkörper, axillärer Ausläufer - Gewebezustand: - Nativ/fixiert - Faden- und/oder Metalldrahtmarkierungen - Resektat in einem Stück/in Fragmenten - Unregelmässige Resektionsränder ohne Möglichkeit der topographischen Orientierung - Grösse: - Resektatgrösse in allen drei Dimensionen gemessen Beschreibung einer allfälligen vorausgegangenen Exzisionsstelle - Tumor: - Anatomische Lage: Im Mastektomiepräparat (Angabe des Quadranten) Im Probeexzisat: Beziehung zu allfälligen Fadenmarkierungen - Grösse (Angabe in drei Dimensionen) - Begrenzung - Konsistenz, Farbe, Nekrose, Blutung - Minimaler Abstand zur Resektionsfläche (bei Mastektomie), Abstände zu den Resektaträndern (bei Probeexzisat, Lumpektomie) - Festhalten, ob Tumorgewebe asserviert wurde für Spezialuntersuchungen (Hormonrezeptorbestimmung, Tumorbank, EM etc.) - Beschreibung des übrigen, nicht vom Tumor befallenen Parenchyms, der Mamille und Haut - Lymphknoten: - Grösse des axillären Fettgewebekörpers - Anzahl der Lymphknoten (mindestens 6, wünschbar 12), Grösse, Konsistenz, einzeln isolierbar oder konfluiert - Weichteilinfiltrate Zuschnitt Grundsätzlich histologische Dokumentation jedes makroskopisch erhobenen Befundes - Entnahme von Tumorgewebe aus makroskopisch unterschiedlichen Abschnitten - Beziehung des Tumors zu Resektionsrändern - Mamille - Allfällige Skelettmuskulatur - Allfällige vorausgegangene Biopsie- oder Resektionsstellen inkl. Narben - Gewebsproben aus dem übrigen Brustdrüsenkörper, optimalerweise aus allen Quadranten und zentralem Drüsenkörper 1 Reg. 14 Mamma 2 Berichterstattung - Art des Operationspräparates, Seiten und Quadrantenlokalisation - Histologischer Typ des Tumors nach WHO-Nomenklatur - Differenzierungsgrad GI bis III nach Bloom, Richardson, Elston (= B.R.E. - Score und Einzelwerte im Bericht aufführen) - Tumordurchmesser und topographische Beziehungen - Angioinvasion - Zusätzliches in situ-Karzinom: - Histologischer Typ nach WHO-Nomenklatur - Duktales in situ-Karzinom: - Prädominant duktales in situ-Karzinom: in situ-Karzinom über 75 % der Tumormasse - Extensives duktales in situ-Karzinom: In situ-Karzinom zwischen 25 % und 75 % der Tumormasse - Wenig duktales in situ-Karzinom: In situ-Karzinom unter 25 % der Tumormasse - Duktales in situ-Karzinom nur innerhalb der makroskopisch vorhandenen Tumormasse oder auch tumorfern - Mikrokalk: - Quantität - Lokalisation: Im invasiven Karzinom, im duktalen in situ-Karzinom oder in einer benignen Läsion (z.B. sklerosierende Adenose) - Resektionsränder: Tumorbefallen: - durch invasives Karzinom, in situ-Karzinom oder Lymphangiosis carcinomatosa - Lokalisation bezüglich Fadenmarkierungen am Probeexzisat - Ausdehnung des Tumorbefalls: Fokal oder breitflächig Tumorfrei: - Angabe der minimalen Distanz eines invasiven Karzinoms oder eines in situ-Karzinoms zum Resektionsrand - Relevante Diagnosen des übrigen tumorfreien Brustdrüsengewebes: Z.B. Mastopathie, Papillome, Adenose, atypische lobuläre oder intraduktale Hyperplasie. - Lymphknoten: Anzahl tumorbefallene im Verhältnis zu Gesamtzahl der histologisch untersuchten Lymphknoten: - Konfluierte Lymphknotenmetastasen - Durchmesser der Metastasen (Makro- Mikrometastasen, sogenannte isolated tumor cells siehe Cancer 1999) - Extranodales Tumorwachstum - Weichtelinfiltrate - pTNM- Klassifikation Reg. 14 Mamma 3 2. In situ-Karzinome Makroskopie Analog zum invasiven Karzinom Berichterstattung - Seitenlokalisation und Art der Gewebsentnahme - Histologischer Typ: - Lobuläres in situ-Karzinom - Duktales in situ-Karzinom - Klassifikation des duktalen in situ-Karzinoms: - nach Architektur (kribriform, mikropapillär, papillär, clinging, solid, Komedo) und fett. - Kerngrading: Geringe Atypien (low grade), mittelgradige Atypien (intermediate grade) und schwere Atypien (high grade). Consensuskonferenz, Cancer 1997. Von der Arbeitsgruppe Mammapathologie SGP wird van Nuys Klassifikation empfohlen: High grade (G3)/non high grade (G1 + G2), Lancet 1995 - Grösse: Die makroskopische Tumorgrösse entspricht der Ausdehnung des duktalen in situKarzinoms (falls invasives Karzinom ausgeschlossen) - Kein makroskopischer Tumor: (siehe 3. nicht palpable Läsion) - Mikrokalk: - Ausdehnung und Angabe in welcher Läsion der Kalk vorliegt (im duktalen in situKarzinom oder z.B. in einer benignen Läsion wie sklerosierender Adenose) Korrelation der histologischen Mikroverkalkung mit dem präoperativen Mammogramm und/oder dem Präparatröntgen Bei histologisch fehlendem Mikrokalk und fehlendem Nachweis von Kalzium-OxalatKristallen mittels polarisiertem Licht müssen zur Herstellung gezielter Stufenschnitte die Paraffinblöcke radiographiert werden - Resektionsränder: - Fokaler oder diffuser Tumorbefall - Tumorfreier Resektionsrand: Angabe des minimalen Abstandes zur Resektionsfläche - Nicht beurteilbar wenn topographisch nicht bezeichnete Fragmente - Relevante Diagnosen des übrigen Brustdrüsengewebes: Z.B. Mastopathie, Papillome oder sklerosierende Adenose Reg. 14 Mamma 4 3. Nicht palpable, mammographisch suspekte Läsionen (Mikroverkalkungen und kleine Läsionen unklarer Dignität) - Schnellschnittuntersuchung ist kontraindiziert und muss abgelehnt werden Chirurgisches Exzisat Wird mit liegendem Metalldraht eingesandt Präparatröntgen obligatorisch Makroskopische Beurteilung inklusive Markierungen zusätzlich zum Markierdraht Vollständige Aufarbeitung bei Präparatdurchmesser bis 5 cm. Bei grösseren Läsionen z.B. extensives kartographisches Sampling oder z.B. Einbetten jedes 2. Gross-Schnittes durch das ganze Präparat mit Schema. - Gegebenenfalls zusätzliches Präparatröntgenbild mit Markiergitter (Methode nach Bollmann) - Falls histologisch kein Kalk oder nicht adäquat zu Präparatröntgen nachgewiesen, Paraffinblöcke von der Gegenseite anschneiden und/oder röntgen - Alternative Methode: pimär alle Paraffinblöcke röntgen - Chirurgische Exzision mit Hilfe des „ Advanced Breast Biopsy Instrumentation System“ - Einzeitige ambulant durchführbare Operation Entfernung der Läsion in einem Gewebezylinder Makroskopische Beurteilung (Maximaldurchmesser 2 cm, Länge 10 cm) Orientierung nach den Markierungen (in der Regel hautnah und hautfern) Durchlamellierung (Querscheiben mit Durchmesser von 3-4 mm) und vollständige histologische Aufarbeitung Exzision mit Hilfe des Mammotoms/ABBIS - Makroskopische Beurteilung der Gewebszylinder (Länge, Dicke) - Alle Gewebszylinder vollständig längs einbetten Berichterstattung - Der angewandten Methode angepasst - bei mammographisch vorhandenem Mikrokalk Stellung nehmen zum mikroskopisch nachgewiesenen Korrelat. Kalziumoxalat-Kristalle histologisch schlecht, im polarisierten Licht gut sichtbar (eventuell Kalziumkristallnachweis, z.B. Kossafärbung) 4. Hormonrezeptorbestimmung Immunhistochemische Bestimmung ist obligat bei allen invasiven Karzinomen, fakultativ bei duktalen in situ-Karzinomen. Konsens der Arbeitsgruppe Mammapathologie SGP (Protokoll 4.12.1999): In der Befundung der immunhistochemischen Hormonrezeptorenbestimmung dürfte die Angabe einer Abschätzung der Anzahl positiver Zellkerne der Biologie des Tumors am ehesten entsprechen. Die Angabe eines SCORE für die Färbeintensität ist in zu grossem Masse von technischen Problemen abhängig, wie Qualität der Fixation, der Fixationsdauer und der inhomogenen Hormonrezeptorexpression im Tumor selber. Die Arbeitsgruppe empfiehlt, in der Befundung lediglich die Anzahl positiver Zellkerne in % anzugeben. Als „cut off“ für ein positives Resultat werden 10% positive Zellen angenommen. Für eine weitere graduelle Gruppenbildung wird keine Empfehlung abgegeben, da an verschiedenen Instituten verschiedene Modelle benützt werden. Empfohlen wird die Teilnahme an Labor-ringversuchen zur Qualitätssicherung z.B. UK-NEQAS. (J Clin Pathol 2000) Reg. 14 Mamma 5 5. Fakultative Untersuchungen Nach Absprache mit dem Einsender oder innerhalb von Studien: ErbB-2/Her-2, MIB 1(ki-67), p53, Cathepsin, Flow- oder interaktive Zytometrie 6. Verarbeitung eines Sentinel-Lymphknotens Die Arbeitsgruppe Mammapathologie SGPath empfiehlt unten aufgeführtes Verarbeitungsprotokoll für Mamma Sentinel Lymphknoten. Der Konsens konnte im Rahmen der Diskussion zur Studie 23-1 der IBCSG erzielt werden. Diese Studie verlangte anfänglich eine Verarbeitung, die von schweizerischen Instituten schlicht nicht zu erbringen gewesen wäre und auf unsere Verhältnisse abgeändert werden musste in die jetzt vorliegende Form. Protokoll 1. Lymphknoten ≥ 5 mm werden längs halbiert. Lymphknoten grösser als 7-8-mm werden in 2-3mm grosse Scheiben zerlegt. 2. Beide Hälften, resp. alle Scheiben werden nach Protokoll untersucht. 3. Lymphknoten < 5 mm werden ganz eingebettet. Variante A Variante B 4A 4B 5A 6A 7A 8A 9A 10A 11A Ein HE-Schnellschnitt pro Lymphnoten/Hälfte oder Scheibe. Diagnose wird durchgegeben, keine Stufen im Schnellschnitt. Fixation des Restgewebes in Formalin 4 %. Wenn Makrometastasen im Schnellschnitt diagnostiziert wurden, nur ein HE-Schnitt vom Paraffinmaterial angefertigen, sonst weiter mit Schritt 7-11. Der Sentinel-Lymphknoten wird auf Stufenschnitten vollständig eingebettet. Von jeder Stufe wird ein Serienschnitt angefertigt. Der Stufenabstand beträgt 250 µm. Von allen Stufenschnitten wird ein HE angefertigt. Wenn Karzinomzellen entdeckt werden, keine weiteren Untersuchungen. Wenn kein Karzinom nachweisbar, dann Immunhistochemie mit ortsüblichen Zytokeratinmarkern, cf.11A. Die Leerschnitte der Stufen 1, 4, 7, 10 werden bei invasiv lobulären und 5B Kein Schnellschnitt. Fixation des Gewebes in Formalin 4 %. 6B Ein HE-Schnitt wird untersucht. Wenn eine Makrometastase vorhanden ist, keine weiteren Schnitte, sonst Weiter mit Schritt 7-11. 7B bis 11B gleich wie in Variante A. Reg. 14 Mamma 6 duktulo-lobulären Karzinomen inkubiert. Bei invasiv-duktalen Karzinomen werden die Leerschnitte gefärbt, die im HE verdächtige Zellen zeigen. Wenn keine verdächtigen Zellen im HE zu finden sind, dann Leerschnitte 1,4,7,10 inkubieren. Literatur Bollmann R: Lokalisation radiologisch erkennbarer, nicht tastbarer Mammaveränderungen. Pathologe 1990; 11: 195. Owings D, Hann L et al.: How thoroughly should needle localization breast biopsies be sampled for microscopic examination ? A prospective mammographic-pathologic correlative study. Am J Surg Pathol 1990; 14: 578-583. Elston CW, Ellis IO: Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991; 19: 403-410. Recommendations of the association of directors of anatomic and surgical pathology. Immediate management of mammographically detected breast leasons. Hum Pathol 1993; 24:689-690. Schweizerische Krebstagung 1994, ‘Früherfassung von Brustkrebs’, Erarbeitung eines Konsens. 28.-29.11.1994 in Bern Esteban JM, Ahn C et al.: Predictive value of estrogen receptors evaluated by quantitative immunohistochemical analysis in breast cancer. Am J Clin Pathol 1994; 102 (Suppl 1): S9-S12. Recommendation for the reporting of breast carcinoma. Association of directors of anatomic and surgical pathology. Am J Clin Pathol 1995; 104: 614-619. Frierson H et al.: Interobserver reproducibility of the Nottingham modification of the Bloom and Richardson histologic grading scheme for infiltrating ductal carcinoma. Am J Clin Pathol 1995; 103: 195-198. Silverstein MJ, Koller DN et al.: Prognostic classification of breast ductal carcinoma-in-situ. Lancet 1995; 345:1154-1157. Goulding H, Pinder S et al.: A new immunohistochemical antibody for the assessment of estrogen receptor status on routine formalin-fixed tissue samples. Hum Pathol 1995; 26: 291-294. Haerslev T, Jacobsen GK: An immunohistochemical study of p53 with correlations to histopathological parameters, C-ErbB-2, proliferating cell nuclear antigen, and prognosis. Hum Pathol 1995; 26: 295-301. Page D et al.: Histologic grading of breast cancer. Let’s do it. Am J Clin Pathol 1995; 103: 123-124. Recommandations européennes pour l’assurance de qualité dans le cadre du dépistage mammographique du cancer du sein, Ann Pathol 1996, 16, 315-333. Reg. 14 Mamma 7 Leitlinien für die Pathologie: Anhang zu den europäischen Leitlinien für die Qualitätssicherung beim Mammographiescreening. Bericht der Arbeitsgruppe Pathologie der europäischen Gemeinschaft. Sloane JP et al.: Pathologe 1997; 18: 71-88. Consensus conference on the classification of ductal carcinoma in situ. The consensus conference committee. Schwartz GF et al.: Cancer 1997; 80: 1798-1802. Consensus conference on the classification of ductal in situ carcinoma. Hum Pathol 1997; 28: 1221-1225. Hermanek P, Hutter R, Sobin L, Wittekind C, et al.: Classification of Isolated Tumor Cells and Micrometastasis. Cancer 1999; 86: 2668-2673. Rhodes A. et al: Reliability of immunhistochemical demonstration of oestrogen receptors in routine practice: interlaboratory variance in the sensitivity of detection and evaluation of scoring systems. J Clin Pathol 2000; 53:125-130. Literatur zum Sentinel-Lymphknoten : Veronesi U, Paganelli G, Galimberti et al.: Sentinel-node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet 1997; 349: 14-18. Andersen TJ. The challenge of sentinel node biopsy. Histopathology 1999; 35:82-84. Van Diest PJ, Torrenga H, Borgstein PJ, Pijpers R, Bleichrodt RP, Rahusen FD, Meijer S. Reliability of intraoperative frozen section and imprint cytological investigation of sentnel lymph nodes in breast cancer. Hystopathology 1999; 35: 14-18. Dixon JM, Mamman U, Thomas J. Accuracy of intraoperative frozen-section analysis of axillary nodes. Br J Surg 1999; 86: 392-395. Cibull ML for the College of American Pathologists Surgical Pathology Committee: Handling sentinel lymph node biopsy specimens: A work in progress. Arch Pathol Lab Med 1999; 123: 620621. Lee AHS, Ellis IO, Pinder SE. et al Pathological assessment of sentinel lymph-node biopsies with breast cancer. Virchows Arch 2000; 436:97-101. Turner RR, Ollila DW et al.: Optimal histopathologic examination of the sentinel lymph node for breast carcinoma staging. Am J Surg Pathol 1999; 23: 263-267. Reg. 14 Mamma 8 Checkliste Mammakarzinom Seite: links, rechts Anatomische Lokalisation: Quadrant Probetyp: Mastektomie Probeexzisat Lumpektomie Nachresektat Stanzbiopsie Tumor: Grösse in drei Dimensionen Invasives Karzinom: Klassierung nach WHO Differenzierungsgrad: Gut (G1), mittelgradig (G2), wenig differenziert (G3) (B. R. E. – Score) (Gesamtscore Einzelwerte) Angioinvasion: Lymph- und Blutgefässe In situ-Karzinom: Klassierung nach WHO Duktales in situ-Karzinom: (DCIS) Innerhalb oder ausserhalb des invasiven Karzinoms. Mikroarchitektur (kribriform, solid, mikropapillär, papillär,clinging, Komedo). Nukleäres Grading (G I bis III) Quantifizierung des DCIS im Verhältnis zum invasiven Karzinom in der Tumormasse. Prädominantes DCIS: Mehr als 75 % Extensives DCIS: 25-75 % Wenig DCIS: Weniger als 25 % Mikrokalk: Quantifizierung (wenig/reichlich) Lokalisation (im invasiven Karzinom, im DCIS, in benignen Veränderungen) Korrelation mit dem Präparatröntgen Haut, Muskulatur, Mamille: Tumorbefallen: Durch invasives Karzinom oder Lymphangiosis Resektionsränder: Tumorbefallen: Durch invasives Karzinom oder in situ-Karzinom Makroskopisch, mikroskopisch Fokal, ausgedehnt Anatomische Lokalisation des tumorbefallenen Resektionsrandes. Tumorfrei: Ausmessen des minimalen Abstandes des invasiven oder DCIS zum Resektionsrand. Reg. 14 Mamma 9 Diagnosen des übrigen tumorfreien Brustdrüsengewebes Lymphknoten: Anzahl tumorbefallene im Verhältnis zur Gesamtzahl der histologisch untersuchten Lymphknoten Metastasendurchmesser (Makro- Mikrometastasen, sogenannte isolated tumor cells) Extranodales Wachstum Konfluiert Weichteilinfiltrate pTNM-Klassifikation Fakultativ: Hormonrezeptorbestimmung bei duktalen Karzinomen in situ, weitere prognostische Marker. Reg. 15 Milz 1 MILZ Klinische Angaben Bei hämatologischen Erkrankungen : Lymphknotenschwellungen / Hepatomegalie / peripheres Blutbild / Knochenmarkbefund. Makroskopie - Splenektomie oder Resektat / Grösse (dreidimensional) / Gewicht. - Kapsel : zart / verdickt (fokal oder diffus) / Risse (Länge / Ablederung (Ausdehnung) / subkapsuläre Hämatome (Grösse, Farbe). - Schnittfläche : Trabekel- und Follikelzeichnung / Knoten (Anzahl, Grösse, Farbe, Begrenzung) / Infarkte (Grösse, Farbe). - Bei Frischpräparaten : Konsistenz, Brüchigkeit, Abstrichsaft der Schnittfläche - Milzhilus: Gefässverschlüsse, Aneurysmen, Lymphknoten (Zahl, Grösse und Beschaffenheit). Fixation - Für eine optimale Fixation 5 mm dicke Milzscheiben in gepuffertes Formaldehyd legen. Zuschnitt - Alle pathologischen Veränderungen. - Milzparenchym mit Kapselanteil. - Lymphknoten Milzhilus. Histologische Aufarbeitung Je nach Fragestellung : HE, Fe, Giemsa, Gömöri, EVG, evt. PAS. Störende Formalinpigmentniederschläge durch Vorbehandlung der Schnitte während 20 Minuten mit gesättigter Pikrinsäure in 100%-igem Alkohol entfernen. Verdacht auf malignes Lymphom - Verarbeitung wenn möglich in frischem Zustand. - Gewebeasservierungen/Fixationen für fakultative Zusatzuntersuchungen wie bei Lymphknoten. - Bei unterschiedlich grossen/beschaffenen Knoten Proben aus jedem Knotentyp. Bei regelmässigen kleinen Knoten oder diffusem Befall 2-4 Proben. - Lymphknoten des Milzhilus mituntersuchen. Verdacht auf Infekt - Sterile Gewebsentnahme für Mikrobiologie. Verdacht auf Speicherkrankheit - Glutaraldehydfixation für Elektronenmikroskopie. - Schockgefrieren für biochemische Analyse. Berichterstattung - Typ des Operationspräparates. - Gewicht. - Bei malignen Lymhomen analog Lymphknoten. Reg. 16 Muskel 1 MUSKEL Allgemeines Einsendungen von Muskelbiopsien wegen des sehr hohen Bearbeitungsaufwandes nur nach vorheriger Absprache. Muskelgewebsfragmente am besten nativ (unfixiert) auf einer feuchten, nicht nassen NaCl Kompresse in einem Gefäss. Dieses sollte in einer mit Eis gefüllten Styroporschachtel so rasch wie möglich eingeschickt werden (Taxi, Kurier). Das Gewebe darf keinen direkten Kontakt zum Eis haben. Makroskopie Zahl, Grösse und Aspekt der Biopsate. Resektionstyp: In der Regel offene Biopsie. Sehr selten (vor allem bei Kindern) mehrere Nadelbiopsate. Verarbeitung und Zuschnitt - Lichtmikroskopie Je nach Fragestellung ein Teil des Muskelgewebes in 4%iges Formalin geben. Formalinfixiertes Material teils quer, teils längs einbetten. - Gefrierschnitte sind für viele Fragestellungen notwendig. 20:5:5 mm grosses Muskelstück auf feuchten, mit physiologischer Kochsalzlösung getränkten und ausgedrückten Tupfer legen und ohne zusätzliche Flüssigkeit einschicken. - Einfrieren von Muskelbiopsaten Präparat hochkant auf hochvisköses Einbettmedium stellen. Um Gefrierartefakte zu vermeiden, Präparat in tiefgekühltem Isopentan (entweder auf Trockeneis oder in Flüssigstickstoff vorgekühlt), schockgefrieren. Bis zur weiteren Verarbeitung Material in vorgekühlte Plastikgefässe überführen und bei –80°C lagern. - Elektronenmikroskopie Ein 2-3 cm langes Stück von max. 2 mm Ø auf Zahnstocher aufbinden und sofort in 5%iges gepuffertes, auf 4°C vorgekühltes Glutaraldehyd geringen. Fixation in diesem Zustand während mind. 90 Minuten. Danach wird das Präparat abgenommen, zerteilt und nochmals über Nacht fixiert. Anschliessend Einbettung in Epon. - Muskelbiopsien bei Verdacht auf Myositis und/oder Vaskulitis Da es hier auf eine schnelle Diagnosestellung ankommt, ist eine rasche Verarbeitung angezeigt. In der Regel Formalinfixierung und Paraffineinbettung. Gefrierschnittuntersuchung wünschenswert, jedoch nicht Bedingung. Reg. 16 Muskel Berichterstattung Beurteilung der Faserdurchmesser Atrophie und Hypertrophie einzelner Fasern oder ganzer Gruppen Entzündliche Infiltrate Muskelnekrose Einschlüsse Strukturenverteilung der Mitochondrien, ragged red fibres Endomysiales Bindegewebe, Vakatfett Literatur A.G.Engel und C.P.Armstrong: Myology. New York, McGraw-Hill, INC. 1994, second edition 2 Reg. 17 Nebenniere 1 NEBENNIERE Klinische organspezifische Angaben - Veränderungen im Körper-Habitus Hypertonie Endokrines Syndrom (Virilisierung, Feminisierung) Familienanamnese (z.B. MEN -Syndrom Typ 2) Tumoren anderer endokriner Organe Makroskopie und Präparation - Typ des Operationspräparates: laparoskopische Resektion; Adrenalektomie / subtotale Exzision / Biopsie - Gewebezustand: frisch / fixiert / Zeitdauer zwischen Exzision und Eintreffen im Institut - Bei besonderen Fagestellungen im Operationssaal kein Gewebe für Spezialuntersu-chungen entfernen, sondern ganzes Präparat frisch einschicken und dem Pathologen den Auftrag für besondere Gewebsasservierungen geben - Gewicht und Masse: solitärer Tumor in 3 Dimensionen. Bei multiplen Knoten kleinster und grösster Durchmesser - Dicke und Beschaffenheit von Rinde und Mark im Bereich von Kopf, Körper und Schwanz - Bei Verdacht auf invasiven Tumor Tuschemarkierung der Oberfläche - Querschnitte zur Längsachse in Intervallen von ca. 5 mm durch Kopf (medialster Teil), Körper (dickster Teil) und Schwanz (lateral). Die konkave Seite der Drüse entspricht der infero-lateralen Fläche - Beschreibung von Ober- und Schnittfläche des/der Tumoren (Farbe, Nekrose, Blutungen) Zuschnitt - Tumor: Zahl der Gewebsproben der Tumorgrösse anpassen. Proben aus makroskopisch unterschiedlichen Arealen - Bei invasiven Tumoren Resektionsränder, Invasion periadrenales Fettgewebe, mitresezierte Organteile - Gewebsproben von Rinde und Mark ausserhalb des/der Tumoren - Je nach Fragestellung Asservierung von Gewebe für Spezialuntersuchungen (Gefrierschnitte für Lipidfärbungen, Fixation mit K-Chromatlösung , Schockgefrieren für bio-chemische Analyse, Immunhistochemie und Molekularbiologie, Flow- oder interaktive Zytometrie, Glutaraldehyd für Elektronenmikroskopie) Berichterstattung - Typ des Operationspräparates - Histologischer Tumortyp (WHO 2000) cf. (8) - Deskriptive Diagnose falls Tumordignität unsicher (z.B. Nebennierenrindentumor unbestimmter Dignität) cf. (9). - Gradierung: kein allgemein anerkanntes System cf. (5) - Deskriptive Angaben: Nekrose, extra-adrenale Ausbreitung, Invasion benachbarter Strukturen, Invasion von Lymph- oder Blutgefässen Reg. 17 Nebenniere 2 - Masse und Gewicht (in der Regel gesamtes Präparat) Resektionsränder Lymphknoten: Anzahl, davon tumorbefallene, Lokalisation Tumorklassifikation: in der TNM-Klassifikaktion nicht enthalten (siehe 5) Bei diffusen Prozessen: Mark oder Rinde betroffen, gleichmässige Veränderung oder nodulär - Resultate von Spezialuntersuchungen - Kommentar: Korrelation zu Schnellschnittbefund, zu klinisch-endokrinologischen Angaben Gradierung/Prognose Nierenrindenkarzinome: zur Zeit kein allgemein anerkanntes Gradierungssystem (allenfalls hohe und niedrige Malignität nach Mitosezahl ; Weiss et al. 1989) Phaeochromozytome: kein Gradierungssystem vorhanden Neuroblastäre Tumoren: Elemente für Gradierung und Prognose: - Differenzierung der Neuroblasten (undifferenziert, wenig differenziert, differenziert) - Mitose-Karyorrhexis-Index (niedrig: 2% oder weniger, mittel: 2-4%, hoch: 4% oder mehr) - Stroma (wenig, viel) - Verkalkungen (ja/nein) - DNS-Ploidie - Zytogenetische und molekulare Marker (loss of heterozygosity 1 p und 14 q, N-Myc Onkogen, Tyrosinkinasen TRK-A, B und C Literatur Shimada H, Chatten J, Newton WA, Jr: Histopathologic prognostic factors in neuroblastic tumors: Definition of subtypes of ganglioneuorblastoma and age-linked classification of neuroblastoma. J Natl Cancer Inst 1984;73: 405-416 Weiss LM, Medeiros LJ, Vickery AL, Jr: Pathologic features of significance in adrenocortical carcinoma. Am J Surg Pathol 1989; 13: 202-206 Joshi VV, Chatten J, Sather HN, et al: Evaluation of the Shimada classification on advanced neuroblastoma with a special reference to the mitosis-karyorrhexis index: A report form the Childrens Cancer Study Group. Mod Pathol 1991; 4: 139-147 Joshi VJ, Cantor AB, Brodeur GM, et al: Correlation between morphologic and other prognostic markers of neuroblastoma. Cancer 1993; 71: 3173-3181 Lack EE: Tumors of the Adrenal Gland and Extra-adrenal Paraganglia. Atlas of Tumor Pathology, Third Series, Fascicle 19, Washington, DC, 1997 Brodeur GM, Maris JM, Yamashiro DJ. et al: Biology and genetics of human neuroblastoma. J Pediatr Hematol Oncol 1997; 19:93-101 Association of Directors of Anatomic and Surgical Pathology: Recommendation for reporting of tumors of the adrenal cortex and medulla. Hum Pathol 1999: 30: 887-890 Reg. 17 Nebenniere 3 Solcia E., Klöppel G., Sobin L.H.: Histological Typing of Endocrine Tumours. Springer-Verlag, WHO 2000. Schröder S., Komminoth P., Padberg B., Heitz Ph.U.: Morphologische Typisierung, Dignitätsund Prognosebeurteilung sowie ätiologische Einordnung adrenomedullärer und adrenokortikaler Neoplasien. Pathologe 1995; 16:307-314. Reg. 18 Nerv NERV Besonderheiten Einsendungen von Nervenbiopsien müssen vorher mit dem Pathologielabor abgesprochen werden. Es wird formalin- und glutaraldehydfixiertes Material benötigt. Nativmaterial ist nicht notwendig. Makroskopie Zahl, Grösse und Aspekt der Biopsien Zuschnitt und Aufarbeitung Einbettung von Längs- und Querschnitten Formalinfixiertes Material für histologische Untersuchung Glutaraldehydfixierte Proben für Semidünnschnitte und Elektronenmikroskopie. Gefrierschnitte sind nicht notwendig. Berichterstattung Faszikelzahl, perineurales Bindegewebe. Anzahl und Dichte der myelinisierten und unmyelinisierten Axone. Myelinisierungsstörungen, Demyelinisierung. Vorhandensein von Entzündungszellen, endoneuralen Makrophagen. Einschlusskörper Amyloid Literatur G.Midroni and J.M.Bilbao: Biopsy, Diagnoses of peripheral neuropathy. Boston, ButterworthHeinemann, 1995. 1 Reg. 19 Niere, Nierenbecken, Ureter NIERE, NIERENBECKEN, URETER Makroskopie - Gewebszustand: fixiert (wie) / nativ / intakt oder eingeschnitten Resektat oder Nephrektomie Seitenlokalisation / Grösse / Gewicht Anhängende Gewebe: Ureter, peripelvines Fettgewebe, Nebenniere, hiläre Lymphknoten, Blutgefässe Dimension der anhängenden Gewebe Nierenoberfläche: glatt / fein-, mittel-, grobgehöckert / Renkuluszeichnung Farbe Zysten Narben: Grösse / Beschaffenheit / Grundfarbe Eiterherde: Grösse / Verteilung / Randsaum Schnittfläche - Masse: Rinde und Mark - Rindenmarkgrenze: scharf / unscharf - Papillenbeschaffenheit: Form / Nekrosen / abgestossene Nekrosen - Zysten: Rinde / Mark / Durchmesser / Inhalt - Eiterherde: Rinde / Mark / Form / Gruppierung Pyelon - Weite - Inhalt: Konkremente / Blut / Eiter - Schleimhautbeschaffenheit Ureter - Länge / Durchmesser / Schleimhautbeschaffenheit nach Längseröffnung Nierenarterien und Venen: Wand- und Lumenveränderungen / Polgefässe Bei Parenchymtumoren - Lage in der Niere / äussere Nierenkontur / Rinde / Mark - Masse / Form / Konsistenz / Farbe / Zysten / Nekrose/ Narben / Blutungen / Begrenzung zum Nierenparenchym - Beziehung, Distanz zu Kapsel / perirenales oder peripelvines Fettgewebe / Gerota-Faszie / Nierenbecken / Nierenvene / Nebenniere - Satellitentumoren - Makroskopisch erkennbare Invasion: Nierenvene / Vena cava / angrenzende Organe / Nierenbecken / Ureter Bei Nierenbeckentumoren - Zahl / Grösse - Topografie in bezug auf Nierenbecken / Kelche - Oberflächenbeschaffenheit - Invasion in angrenzende Strukturen 1 Reg. 19 Niere, Nierenbecken, Ureter Bei Uretertumoren - Lage in bezug auf proximalen und distalen Resektionsrand - Zahl / Grösse / Oberflächenbeschaffenheit - Beziehung zur Ureterwand - Beschaffenheit des nicht tumorbefallenen Ureters Lymphknoten - Zahl / Grösse / makroskopischer Tumorbefall Zuschnitt Ohne Tumor - Rinde, Mark, Pyelon, Ureter, Nierengefässe Bei Nierenparenchymtumoren - Tumorgewebe: bei inhomogener Beschaffenheit mehrere Proben - Invasionsstellen (sicher oder vermutet): angrenzendes Nierenparenchym / Pyelon / perirenales oder peripelvines Fettgewebe / Nierenvene / Nebenniere Bei Pyelontumoren - Proben mit vermuteter oder offensichtlicher Invasion Bei Uretertumoren - Querschnitte - Stellen mit vermuteter oder offensichtlicher Wandinfiltration Bei Verdacht auf Ureterkarzinom - Nach Längseröffnung alle Schleimhauterhebungen (weiss, rötlich oder papillär) - Falls makroskopisch keine Veränderungen erkennbar, Probe alle 2 cm Lymphknoten (alle Tumortypen) - Alle Lymphknoten einbetten Urotheltumoren allgemein - Ureterquerschnitt mit PAS-Färbung (Nachweis einer Kapillarosklerose) oder Gefrierschnitt mit Sudan-Färbung Wilms-Tumoren (Nationale Wilms-Tumoren Studiengruppe) - Eine Probe pro cm des grössten Tumordurchmessers - Probe der äusseren Kapsel an ihrer dünnsten Stelle - Zwei Proben Uebergang Tumor/Nierenparenchym - Eine Probe Tumor mit Nierenbecken - Bei multizentrischem Tumor eine Probe von jedem Tumorknoten - Querschnitt der Nierenvene extrarenaler Anteil - Eine Probe von jedem Lymphknoten - Bei multizentrischem Tumor eine Probe von jedem Tumorknoten - Eine Probe des tumorfreien Nierengewebes (tumorfern) mit Einbezug der Rindenoberfläche 2 Reg. 19 Niere, Nierenbecken, Ureter 3 Berichterstattung / Diagnostische Information - Seitenangabe - Art des Operationspräparates (Resektat oder Nephrektomie) Bei Tumoren - Histologischer Typ (erste Wahl WHO) - Differenzierungsgrad G I - III (bei Karzinomen des Nierenparenchyms nach Thoenes, wenn lokal gewünscht nach Fuhrman, bei Wilms-Tumoren spezielles Gradierungssystem) - Lokalisation des Tumors in der Niere und Durchmesser - Invasion benachbarter Gewebestrukturen: Nierenbecken / Ureter / perirenales, peripelvines oder periureterales Fettgewebe / Gerota-Faszie / Nebenniere - Einbruch in intrarenale Venen / hiläre Venen / Vena cava - Lymphknoten (Lokalisation, Gesamtzahl und Anzahl befallene) - Satellitentumoren - Relevante Diagnose des übrigen, nicht tumorbefallenen Nierenparenchyms, des Nierenbeckens und des Ureters - Vollständigkeit der Resektion (Resektatoberfläche benachbart zum Tumor, Nierengefässe, Ureter) - pTNM-Klassifikation Literatur Mostofi FK, Davis CJ, Sesterhenn IA, Sobin LH. (1999). Histological typing of urinary bladder tumours. WHO, second edition, Springer-Verlag, Berlin. Mostofi FK, Davis CJ, Sobin LH. (1998). Histological typing of kidney tumours. WHO, second edition, Springer-Verlag, Berlin. Epstein JI, Amin MB, Reuter VR, Mostofi FK, and the bladder Consensus Conference Committee. The World Health Organization/International Society of Urological Pathology Consensus Classification of urothelial (transitional cell) neoplasms of the urinary bladder. Am J Surg Pathol, 1998, 22:1435-1448. Fuhrman SA, Lasky LC, Limas C (1982) Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 6: 633-655 Kovacs G et al. The Heidelberg classification of renal cell tumours. J Pathol, 1997, 183:131-133. Murphy WM, Beckwith JB, Farrow GM (1994) Tumors of the kidney, bladder and related urinary structures. In: Rosai J, Sobin LH (eds) Atlas of tumor pathology 3rd series, fascicle. Armed Forces Institute of Pathology, Washington, DC Recommendations for the reporting of resected neoplasms of the kidney. Association of Directors of Anatomical and Surgical Pathology. Virchows Arch 1996; 428: 71-3 Reg. 20 Ösophagus 1 ÖSOPHAGUS Makroskopie Typ des Operationspräparates: Resektat, Ektomie Magenmanschette ja/nein Weitere mitresezierte Strukturen - Gewebezustand: Nativ/fixiert Markierungen Masse: Im aufgeschnittenen Zustand - Tumor: Anatomische Lokalisation: Ösophago-gastrischer Übergang Abstand zum oralen und aboralen Resektionsrand Aspekt: Ulkus, Stenose, polypös Zirkumferentielle Ausdehnung: Partiell/vollständig Grösse: Längs- und Querdurchmesser Invasionstiefe bezogen auf anatomische Schichten (Tunica mucosa, Tela submucosa, Tunica muscularis propria, Adventitia) Abstand zur äusseren tuschemarkierten Resektionsfläche Beziehung des Tumors zu mitresezierten Strukturen - Lymphknoten: Anzahl, Grösse, Konsistenz, einzeln isolierbar oder konfluiert - Beschreibung des nicht vom Tumor befallenen Ösophagus, Magens und allfälliger mitresezierter Strukturen Zuschnitt Grundsätzlich histologische Dokumentation jedes makroskopisch erhobenen Befundes - Entnahme von Tumorgewebe aus makroskopisch unterschiedlichen Abschnitten Beziehung des Tumors zu den Resektionsrändern und Strukturen, die das pTNM-Stadium beeinflussen (z.B. maximale Invasionstiefe) Bei fehlendem Makrotumor kartographische Entnahme von Proben mit Einzeichnen der Schnitte auf einer Skizze, Photographie oder Photokopie des Operationspräparates Nicht vom Tumor befallene Mukosa (Dokumentation von Metaplasie und/oder Dysplasie) Mitresezierte Strukturen Alle auffindbaren Lymphknoten Berichterstattung Art des Operationspräparates Histologischer Typ nach WHO Differenzierungsgrad Anatomische Lokalisation Reg. 20 - - Ösophagus Uni-/multifokal Makroskopischer Aspekt (Ulkus, Stenose, polypös) Grösse und Invasionstiefe Gefässinvasion (Lymph-/Blutgefässe) Resektionsränder Befallen: Direkt/Lymphangiose Frei: Abstand Lymphknoten: Anzahl tumorbefallener im Verhältnis zur Gesamtzahl Konfluierte Lymphknotenmetastasen Durchmesser der Metastasen Extranodales Tumorwachstum Bei vorausgegangener Radio-/Chemotherapie: Vitalität des Tumors, Art und Ausdehnung der Therapieeffekte pTNM-Klassifikation: Relevante Diagnosen des übrigen, tumorfreien Ösophagus, Magens und mitresezierter Strukturen: z.B. Barrett, Dysplasie (uni/-multifokal), Dysplasiegradierung (niedrig-/hochgradig), Gastritis, Helicobacterstatus Fakultative Untersuchungen - p53 kann Hinweis auf Dysplasie in einer Barrett-Mukosa ergeben (positiv bei mehr als 10% positiver Kerne) 2 Reg. 19 Ösophagus 3 Literatur Klimstra D: Pathologic prognostic factors in esophageal carcinoma. Semin Oncol 1994; 18:321-330. Lewin KJ and Appelman HD: Handling of esophageal and gastric biopsy and resection specimens. In: Lewin KJ, Appelman HD (eds) Atlas of tumor pathology: tumors of the esophagus and stomach 3rd series, Fas 18. Armed Forces Institute of Pathology, Washington, DC, 1996; pp 3-16. Lee RG, Compton CC: Protocol for the examination of specimens removed from patients with esophageal carcinoma: a basis for checklists. Arch Pathol Lab Med 1997; 121:925-929. Wu TT, Watanabe T, Heitmiller R et al.: Genetic alterations in Barrett esophagus and adenocarcinomas of the esophagus and esophagogastric junction region. Am J Pathol 1998; 153:287-294. Recommendations for the reporting of resected esophageal carcinomas. Association of directors of anatomic and surgical pathology. Virchows Arch 2000; 437:348-350. Reg. 19 Ösophagus 4 Checkliste Ösophagus Anatomische Topographie: Ösophago-gastrischer Übergang Probetyp: Resektat, Ektomie Tumor: Exophytisch, Ulkus, diffus intramural, Sklerose Invasives Karzinom: Klassierung nach WHO Differenzierungsgrad: Gut (G1), mittelgradig (G2), wenig differenziert (G3) Infiltrationstiefe: Tela submucosa, Tunica muscularis propria, Adventitia, anhängende Organe Angioinvasion: Blut-, Lymphgefässe Resektionsränder: Tumorbefallen: Makroskopisch, mikroskopisch, direkt oder durch Lymphangiosis carcinomatosa Anatomische Lokalisation des tumorbefallenen Resektionsrandes Diagnose des übrigen tumorfreien Ösophagus und anderer allfällig mitresezierter Strukturen: Barrett mit oder ohne Dysplasie Dysplasiegrad (niedriggradig (low grade) hochgradig (high grade)) Gastritis, Helicobacterstatus Lymphknoten: Anzahl tumorbefallene im Verhältnis zu allen untersuchten Lymphknoten pTNM-Klassifikation: Reg. 21 Ovar, Eileiter OVAR UND EILEITER (Adnexe) Art des untersuchten Materials : - Adnexektomie - Ovariektomie / Keilexzision / Biopsie - Salpingektomie / Tubenresektion (Sterilisation) OVAR Makroskopie - Grösse in drei Dimensionen ; wenn Ovarialtumor, Gewicht - Zustand des Gewebes : in einem Stück oder fragmentiert, eingeschnitten, eingerissen, frisch oder fixiert - Tubo-ovarielle Masse (Konglomerat) - Wenn Tumorverdacht : - chirurgische Resektionsränder identifizieren wenn möglich (mit Tusche markieren) - Beziehung des Tumors mit der Tube, der Kapsel des Ovars und den Resektionsrändern - Oberfläche : glatt, Verwachsungen, Papillen, Tumorinfiltration, Ruptur, Anriss - Schnittfläche : solid und/oder zystisch, Nekrose, Blutungen - Zysteninhalt (serös, schleimig, gelatinös, Talg mit oder ohne Haare, eitrig, blutig) - Innenfläche der Zysten : glatt, granuliert, knotig, papillär ; Farbe Zuschnitt - Wenn Ovar makroskopisch normal : eine Hälfte des Ovars (Längsschnitt mit Hilus) einbetten - Wenn Ovarialtumor : im Prinzip 1 Block pro cm Durchmesser - Bei muzinösen proliferativen und atypischen Tumoren (« Borderline »), grosszügig Gewebe einbetten, insbesondere von den soliden Arealen. Der gleiche Tumor kann gutartige, proliferative (borderline) und eindeutig maligne Anteile aufweisen ! - Aussenfläche (Kapsel) : papilläre und/oder knotige Wucherungen, verdickte und/oder infiltrationsverdächtige Bezirke - Innenfläche : papilläre und/oder knotige Wucherungen, hämorrhagische Bezirke - Solide Abschnitte : Dokumentation aller makroskopisch verschiedenen Areale, hämorrhagische und/oder nekrotische Bezirke - Ovarialgewebe, das als solches erkennbar ist - Wenn Adnexektomie mit einer Hysterektomie wegen Corpuskarzinom assoziiert, beide Ovarien in toto einbetten - Bei Torsion und Infarzierung der Adnexe, Retikulinfärbung (Ag) nützlich, um die nekrotischen Gewebsstrukturen besser darzustellen. 1 Reg. 21 Ovar, Eileiter EILEITER Makroskopie : - Länge, Durchmesser (min. & max wenn nötig), Verwachsungen, Status nach Sterilisation - Wenn makroskopischer pathologischer Befund : Lokalisation, Beschaffenheit (zystisch und/oder solid), Grösse, Inhalt der Zysten, Beziehung zum Ovar, Tubenlumen, zur Serosa ; Ruptur Zuschnitt : Eileiter ohne Tumor - Ohne makroskopischen Befund : je ein Querschnitt aus dem proximalen, mittleren und Fimbriennahen Drittel - Dokumentation aller makroskopisch festgestellten Läsionen Eileiter mit Tumor - Querschnitte aus der ganzen Länge der Tube - Dokumentation der Ausdehnung, der Tiefe der Wandinfiltration, des Befalls der Serosa und/oder der angrenzenden Gewebe - « Staging » wie bei den Ovarialtumoren « Staging » Operation bei malignen Adnextumoren Omentum : Makroskopie : - Dimensionen, Anwesenheit von verdächtigen Bezirken, Knoten, Verhärtungen, Verwachsungen Histologische Dokumentation : - Ein bis drei tumorverdächtige Bezirke einbetten - Zwei zufällig entnommene Proben wenn keine makroskopisch erkennbare Läsion Peritonealbiopsien : - In toto einbetten, wenn nötig Stufenschnitte Lymphadenekomie : Alle aufgefundenen Lymphknoten in toto einbetten. Lokalisation, Zahl und Beschaffenheit. Darm-Resektate : - Proben aus allen infiltrationsverdächtigen Bezirken - Alle identifizierte Lymphknoten einbetten Berichterstattung (Ovar und Eileiter) 2 Reg. 21 - Ovar, Eileiter Art des untersuchten Materials Masse und Gewicht Histologischer Typ des Tumors nach WHO-Klassifikation, Differenzierungsgrad Lymphangiosis carcinomatosa und/oder Gefässeinbrüche Stadium nach pTNM (und/oder FIGO) Klassifikation Alle nicht neoplastische signifikante Befunde Literatur Hruban RH, Isacson C et al : Surgical pathology dissection : An illustrated Guide. SpringerVerlag, 1996, p. 130-135 Scully RE, Henson DE et al : Practice protocol for the examination of specimens removed from patients with ovarian tumors. A basis for checklists. Cancer 1996 ; 78 : 927-940 Russel P, Bannatyne P : Surgical pathology of the ovaries, 2nd Edition 1997, Churchill Livingstone, Edinburgh, London, Melbourne & New York, p 22-33 3 Reg. 22 Pankreas PANKREAS Makroskopie - Gewebezustand: Fixiert (wie) / nativ / eröffnet oder eingeschnitten / uneröffnet. - Resektionstyp: Biopsie / Lokalexzision / Standard Pankreatiko-Duodenektomie nach Whipple / Pylorus erhaltende Pankreatiko-Duodenektomie / Pankreatektomie / Pankreasschwanzresektion. Jede Komponente beschreiben und messen, ebenso allenfalls zusätzlich resezierte Organe/Organteile. - Längseröffnung des Duodenums. - Darstellung und Tuschemarkierung des Ductus choledochus und der Papilla Vateri durch Längseröffnung. Bei Tumorverschluss Querschnitte. - Tuschemarkierung der Pankreasresektionsflächen. - Querlamellierung des Pankreas (ca. 5 mm Scheiben) ohne ganz durchzuschneiden. - Fixation über Nacht. - Zuschnitt am folgenden Tag. - Tumorbeschreibung: - Anatomische Lokalisation (Kopf, Körper, Schwanz, diffus). - Ausgangspunkt: Duodenum / Papilla Vateri / Ductus choledochus / Pankreas. - Grösse dreidimensional / Farbe / Konsistenz / Begrenzung. - Multizentrizität. - Neoplastische uni- oder multilokuläre Zysten / Zysteninhalt. - Beziehung zu Galle- und Pankreasgängen. - Tumorumgebung: - Beschaffenheit des Pankreasparenchyms und der Pankreasgänge (Strikturen / Dilatation). - Nicht neoplastische Zysten in Tumorumgebung. - Standard Whipple-Präparate oder Pankreatektomie: - Pankreasgänge, Ductus choledochus, Ductus cysticus, Papilla Vateri. - Tumorausdehnung in Bezug auf Duodenum, Magen, Milz, Kolon. - Tumorgefässinvasionen (Pfortader, V. mesenterica superior, Milzvene, A. hepatica). - Resektionsränder tumorbefallen oder frei (Distanzangabe in cm). Zuschnitt - Resektionsrand Duodenum und/oder Magen proximal, Duodenum distal, Papilla Vateri zusammen mit Einmündung des Ductus choledochus längs und angrenzendes Pankreasgewebe. - Choledochus-Resektionsstelle quer. - Pankreasresektionsfläche. - Eine Pankreasprobe pro 1 cm Pankreaslänge. - Repräsentative Tumorschnitte. - Alle Lymphknoten. 1 Reg. 22 Pankreas 2 Berichterstattung Art des Operationspräparates. Histologischer Tumortyp nach WHO. Differenzierungsgrad. Tumorlokalisation / Ausgangspunkt. Tumorgrösse. Tumorbefall von oder Distanz zu Resektionsrändern. Beziehung zu Nachbarschaft / Organen. Gefässeinbrüche. Lymphknotenbefall (Gesamtzahl und Anzahl tumorbefallene). Zusätzliche nicht-neoplastische Veränderungen in Pankreas und mitresezierten Organen / Organteilen. - pTNM - Gradierung Duktale Karzinome: 3 Grade (WHO 1996) Gradierung abhängig von der glandulären Differenzierung, der Muzinproduktion, der Mitoserate/pro 10 HPF und der nukleären Polymorphie Intraduktale Karzinome: Grading fakultativ Neuroendokrine Tumoren: 3 Grade (WHO 2000) - Gut differenzierte, endokrine Tumoren - Gutartig - Unklare Dignität Gut differenzierte, endokrine Karzinome Wenig differenzierte, endokrine Karzinome Literatur Klöppel G., Solcia E., Longnecker D.S., Capella C., Sobin L.H.: Histological Typing of Tumours of the Exocrine Pankreas. Springer-Verlang, WHO 1996. Solcia E., Klöppel G., Sobin L.H.: Histological Typing of Endocrine Tumours. SpringerVerlag, WHO 2000. Hruban RH., Westra WA., Phellps TH. Et al: Surgical Pathology Dissection. An illustrated Guide. New York, Springer, 1996. Association of Directors of Anatomic and Surgical Pathology: Recommendations for the reporting of pancreatic specimens containing malignant tumors. Hum Pathol 1998; 29: 893895. Reg. 23 Prostata PROSTATA 1. Invasives Karzinom A. Makroskopie - Biopsietyp: Stanze, transurethrale Resektate, Ektomie - Prostatektomie - Gewebezustand: nativ/fixiert Fragmentation, Einrisse - Masse der Prostata/Samenblasen - Kontur - Gewicht - Tuschemarkierung der gesamten Resektionsfläche, evt. mit zwei verschiedenen Farben für rechts und links. - Tumor Anatomische Lage: Aussendrüse, Transitionalzone, Apex, multifokal Beziehung zu Samenblasen/Resektionsränder - Grösse, Konsistenz, Farbe, Nekrose - Beschreibung der übrigen, nicht vom Tumor befallenen Prostata B. Zuschnitt - Transurethrale Resektate: Patient unter 80 Jahre: Bis 15g alles einbetten, wenn mehr als 15g vorhanden, zusätzlich die Hälfte des restlichen Gewebes einbetten. Patient über 80 Jahre: Bis 15g alles einbetten, wenn mehr nur die Hälfte des gesamten Materials einbetten (pro Block ca. 1,25g) oder pro 5 g ein Block des Restgewebes. Nicht mehr als 15 Blöcke. - Prostatektomie: - Grossschnitte in der Frontalebene vom Apex Richtung Samenblasen, erste und letzte Scheibe quer lamellieren. - Als Alternative Querschnitte in Frontalebene auf zahlreiche Blöcke verteilt (Legende). - Samenblasen getrennt nach Seite mit besonderer Berücksichtigung des Übergangs Prostata/Samenblase. Ein weiterer Schnitt prostatafern. C. Berichterstattung - Art der Biopsie/Resektate: Stanze, transurethrale Resektate, Ektomie Histologischer Typ nach WHO Differenzierungsgrad nach Gleason (Gleason score) Tumorausdehnung/Volumen 1 Reg. 23 Prostata - Transurethrale Resektate: Anteil Tumor befallener Gewebspartikel (numerisch und in Prozent) - Prostatektomie: Tumordurchmesser - Anatomische Lage: Apex, Seite, uni-/multifokal - Ausdehnung: Intra-/extraprostatisch Extraprostatisch: Ausmass und anatomische und Lokalisation - Perineurale Infiltration: - Gefässinvasion: - Samenblasen: Tumorbefall: Ja/nein, Seite - Resektionsränder: Tumorbefall: Ja/nein, makro-/mikroskopisch, anatomische Lokalisation - Relevante Diagnosen der übrigen Prostata: Myoglanduläre Hyperplasie etc. - Lymphknoten Anzahl tumorbefallene, im Verhältnis zu den histologisch untersuchten Lymphknoten Druchmesser der Metastase(n) - pTNM-Klassifikation 2. Immunzytochemie (fakultativ) Antiendothelialer Antikörper (Faktor VIII, CD31 oder CD34) zum Nachweis von Gefässeinbrüchen. Die Proliferationsrate (Ki-67) scheint ein unabhängiger, statistisch signifikanter prognostischer Faktor der Ueberlebensrate des Prostatakarzinoms zu sein. 2 Reg. 23 Prostata 3 Literatur Gleason DF, Mellinger GT and the veterans administration cooperative urological research group: Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111: 58-64. Mostofi FK: Grading of prostatic carcinoma. Cancer Ther Rep 1975; 59: 111-117. Mostofi FK, Sesterhenn J, Sobin LH: Histological typing of prostate tumours. International histological classification of tumours. No. 22. World Health Organisation, Geneva. Recommendations for the reporting of resected prostate carcinomas. Association of directors of anatomic and surgical pathology. Am J Clin Pathol 1996; 105: 667-670. Bonkhoff H, Remberger K: Diagnostische Kriterien und Differentialdiagnose der prostatischen intraepithelialen Neoplasie. Pathologe 1998, 19: 33-41. Breul J, Hartung R: Was erwartet und erhofft der Urologe vom Pathologen in der Diagnostik des Prostatakarzinoms? Pathologe 1998; 19: 59-62. Bubendorf L, Tapia C, Gasser TH et al.: Ki67 labeling index in core needle biopsies independently predicts tumor-specific survival in prostate cancer. Hum Pathol 1998; 29: 949-954 Helpap B: Prognosefaktoren des Prostatakarzinoms. Pathologe 1998; 19: 42-52. Reg. 23 Prostata Checkliste Prostata Probetyp: Stanze, transurethrale Resektate, Ektomie Invasives Karzinom: Klassierung nach WHO Differenzierungsgrad: Gleason-Score Tumorausdehnung/Volumen: Transurethrale Resektate: - tumorbefallene Resektate numerisch und prozentual Prostatektomie: - Tumordurchmesser, extraprostatische Ausdehnung (Fettgewebe) Anatomische Lage des Tumors: Ausdehnung und Lage rechter/linker Lappen Multifokalität Gefässinvasion: Perineuralspalten: Samenblasen: Tumorbefall: Resektionsränder: Tumorbefall: Makroskopisch/mikroskopisch anatomische Lokalisation Ausdehnung Diagnosen der übrigen tumorfreien Prostata: Lymphknoten: pTNM-Klassifikation: Anzahl tumorbefallene, im Verhältnis zu den histologisch untersuchten Lymphknoten 4 Reg. 24 Schilddrüse 1 SCHILDDRÜSE Makroskopie - Gewebezustand: frisch/fixiert - Typ des Operationspräparates: Thyroidektomie total/subtotal, Hemithyreoidektomie mit/ohne Isthmus, Knotenexzision; je mit Seitenangabe - Grösse, Gewicht - Orientierung des Präparates, ev. mit Hilfe von Markierungen des Operateurs - Bei Thyreoidektomie: Symmetrie/Asymmetrie - Beschaffenheit der Kapsel, äusserlich sichtbare Knoten - Knoten: Lokalisation, Zahl, grösster Durchmesser, Farbe, Zysten, Konsistenz, Kalkeinlagerungen, Nekrosen - Kapsel um Knoten: Dicke, Regelmässigkeit, Vollständigkeit, kleinster Abstand Kapsel zu Resektionsrand - Dorsale Seite: Kontrolle auf Anwesenheit von Epithelkörperchen/Lymphknoten - Ventrale Seite: Anteile von Muskulatur - Bei Tumorverdacht Tuschemarkierung der Resektionsränder Schnellschnitt Bei solitären abgekpaselten Knoten mit follikulärem Wachstumsmuster Beschränkung auf die Diagnose einer follikulären Neoplasie. Definitive Diagnose erst am Einbettschnitt stellen. Die definitive Diagnose muss innerhalb von drei Tagen dem Einsender zur Verfügung stehen. Zuschnitt - Bei Hemistrumektomiepräparaten Isthmusregion als Scheibe separat einbetten - Lamellierende Schnitte quer zur Längsachse der Lappen (gibt die besten topographischen Beziehungen zur Kapsel), Dicke 5 mm - Für die Suche von papillären Mikrokarzinomen Lamellierung in 3 mm dicke Scheiben. Jede scharf begrenzte fibrotische und v.a. eine sternförmige Läsion, gilt als suspekt - Herdförmige Läsionen: Beziehung der Läsion zur Schilddrüsenkapsel, Infiltration von extrathyreoidalem Gewebe Histologische Dokumentation - Alle Komponenten einer Läsion, z.B. solid und zystisch - Diffuse Läsionen: 2 Proben aus jedem Lappen und 1 Probe aus dem Isthmus - Grosse Knotenstrumen: 1 Probe aus bis zu 5 verschiedenen Knoten mit Einschluss der Knotenperipherie und angrenzendem Drüsengewebe - Knoten mit Kapsel: Gesamte Kapselregion histologisch untersuchen (Kapseldurchbrüche, Gefässinvasionen). Schnittführung immer möglichst senkrecht zur Kapsel. Randpartien des Knotens radiär schneiden. In der Regel 1 Probe pro cm Knotendurchmesser - Bei makroskopisch invasivem Karzinom mindestens 3 Proben aus dem Tumor, 3 aus nicht neoplastischem Gewebe und separat Resektionsränder - Bei MEN-Syndromen: zahlreiche Proben aus verschiedenen Abschnitten - Falls vorhanden Epithelkörperchen und Lymphknoten - Je nach Fragestellung Asservierung von Material für Spezialuntersuchungen (z.B. Elektronenmikroskopie, Molekularbiologie) Reg. 24 Schilddrüse 2 Berichterstattung - Art des Operationspräparates - Grösse und Lokalisation der Läsion - Histologischer Tumortyp nach WHO (evt.Gradierung) - Tumorklassifikation nach pTNM - Neoplasien mit Kapsel: Kapseldurchbruch/Gefässinvasion - Läsion beschränkt auf Schilddrüse oder Penetration der Organkapsel und Uebergreifen auf extrathyreoidales Gewebe - Befunde in nicht neoplastischem Schilddrüsengewebe - Anzahl Lymphknoten, davon tumorbefallene (mit Einbezug einer ev. neck dissection) Literatur Rosai JR, Carcangiu ML, Delellis RA: Tumors of the Thyroid Gland. Atlas of Tumorpathology, Third Series, Fascicle 5, Washington, DC, 1992, page 330-333. Hruban RH, Westra WH, Phelps TH, Isacson Ch: Surgical Pathology Dissection. An Illustrated Guide. Springer, 1996, page 172-175 Reg. 25 Skelett SKELETT 1. Allgemeines Vor der Bearbeitung einer Biopsie oder eines Resektates muss dem Pathologen der präbioptische/präoperative Röntgenbefund übermittelt werden. Bei Biopsien oder Curettagen kommt dem präoperativem Röntgenbefund besonderes Gewicht zu, da das Röntgenbild die Läsion in ihrer gesamten Ausdehnung und in ihrem Verhalten zum angrenzenden Knochen darstellt. Bei Diskrepanzen zwischen radiologischer und histologischer Beurteilung sollen Präparate und Röntgenbilder konsiliarisch beurteilt werden. 2. Klinische Angaben Spezifische Anamnese (Schmerzsymptomatik oder Zufallsbefund?) Benötigte Röntgendokumentation: - Konventionelle Röntgenbilder in 2 Ebenen - Genaue topographische Lokalisation der Läsion im Knochen: epi-, meta- oder diaphysär; zentral / exzentrisch; Kortikalis intakt, arrodiert oder durchbrochen. - Angabe über den Aggressivitätsgrad des vermuteten Tumors (Schema nach Ennneking oder Lodwick). - Gegebenenfalls Biospieentnahmestelle einzeichnen - Mitteilung der radiologischen Verdachtsdiagnose 3. Schnellschnittuntersuchung Angezeigt zur Abklärung ob repräsentatives Material vorhanden ist und für die Materialasservierung für Molekularbiologie (z.B. Ewing-Translokation) und ev. Mikrobiologie. Bei strahlendichten (kalzifizierten) Tumoren periphere Abschnitte wählen. Bei unsicherem Befund oder Diskrepanz radiologischer/histologischer Befund keine Schnellschnittdiagnose stellen. Schnellschnittuntersuchungen mit der Fragestellung Chondrosarkom vs. Enchondrom ablehnen. 4. Makroskopie Kürettage - Beschaffenheit der Fragmente: - Gesamtgrösse, maximale Grösse der Einzelfragmente - kompakter Knochen, Spongiosa, knorpelig-glasige oder fest-fleischige Fragmente - Farbe: gleichartig gefärbt, Farbunterschiede - Konsistenz: kalzifiziert, körnig, gleichmässig fest, weich - Von unfixiert eingesandtem Material Teile schockgefrieren für ev. notwendige molekularbiologische Untersuchungen. Biopsie - Material aus extraossärem oder intraossärem Tumoranteil? - Periost abgehoben, Kortikalis durchbrochen oder arrodiert - Spongiosa/Markraumgewebe erkennbar - Einblutungen/ Nekrose 1 Reg. 25 Skelett - Unterschiedliche Anteile: Knorpel, körnige, weiche, fleischige oder pseudozytstische Areale - Von unfixiert eingesandtem Material Teile schockgefrieren für ev. notwenige molekularbiologische Untersuchungen Resektat - Topographie: epi-, meta-, oder diaphysär; proximal/distal - Enbloc-Resektat/ mehrere Fragmente - Weichteilmantel/ mit oder ohne Biopsiekanal - Resektionsflächen: erkennbar/proximal/distal/seitliche spongiöse Resektionsfläche - Eigentlicher Tumor bereits sichtbar - Gelenkeinbruch - Fixation über Nacht (kleine Resektate 4% Formalin, grosse Resektate ev. mit Weichteilmantel 10% Formalin für 6-8 Std. ggf. über Nacht) 5. Präparat-Radiographie - Anzufertigen vor der weiteren Bearbeitung von Resektaten oder auch grösseren Biopsien - Bei Unklarheiten Rücksprache mit dem Operateur - Gegebenenfalls Markierung von klinisch suspekten Regionen vor Aufsägen (z.B. Resektatareale in Nachbarschaft von in situ gebliebenen Gefäss-Nervenbündeln) - Tumorausdehnung und Beziehung zu den Resektionsflächen, der Kompakta und dem Weichteilmantel 6. Zuschnitt - Markierung der zu untersuchunden Resektionsränder (Zeichnung, Foto oder Fotokopie) Rein intraossärer Tumor ohne Kortikalis-Durchbruch - Präparation der Weichteile; besondere Strukturen kennzeichnen (Biopsiekanal, GefässNervenbündel, Lymphknoten) - Longitudinaler Sägeschnitt in der Ebene der grössten Tumorausdehnung gemäss Präparat-Radiographie und präoperativem Röntgenbefund - Gewinnung einer 5 mm dicken Scheibe - Beschreibung der Schnittfläche, insbesondere minimale Abstände zu den Resektionsflächen - bei seitlichen spongiösen Resektionsflächen senkrechte Schnittführung zur Resektionsfläche, um den Abstand Tumor - Resektionsfläche in mm bestimmen zu können - Dokumentation der entnommenen Proben mittels Zeichnung oder Foto Tumor mit extraossärem Anteil und Kortikalisdurchbruch - Feststellung der grössten Tumorausdehnung mittels Präparat-Radiogramm zur Planung der Tumorschnittfläche - Einschneiden der Weichteile bis auf den Tumor - Bei weichen extraossären Tumoranteilen Einschnitt durch den Tumor bis zur sorgfältig exponierten Kortikalis - Aufsuchen spezieller Strukturen wie Biopsiekanal, Gefäss-Nervenbündel, Lymphknoten: darstellung ihrer Beziehung zu extraossären Tumorausläufern - Falls technisch möglich Schnittfläche durch exponierten extraossären Tumoranteil und Knochen anfertigen - Beschreibung der Schnittfläche 2 Reg. 25 Skelett 3 Resektate nach präoperativer Chemotherapie - Vollständige Scheibe mit der grössten Tumorausdehnung herstellen - Landkartenartig aufarbeiten (Foto/Fotokopie der zusammengesetzten Blöcke der Scheibe vor Paraffineinbettung) - prozentualen Anteil der vitalen (i.d.R. peripher) und der nekrotischen (i.d.R. zentral) Areale bestimmen Tumoren, die Gegenstand laufender Studien sind Vor der Bearbeitung mit dem Referenz-Pathologen Kontakt aufnehmen. 7. Entkalkung - Säureentkalkung geht rasch, oft aber auf Kosten der Qualität (gegebenenfalls rehämatoxilieren; siehe Fechner & Mills) - Unkontrollierte Säureentkalkung (z.B. über das Wochenende) vermeiden. - EDTA oder SUSA-Entkalkung einer Tumorprobe im Mikrowellenofen empfehlenswert (schnell, schonend, bessere Schnittqualität, Möglichkeit der Immunhistochemie). - Kortikalis wenn möglich separat entkalken (braucht gewöhnlich länger) 8. Berichterstattung - Histologischer Tumortyp nach WHO-Nomenklatur - Gradierung: - Es gibt keine allgemein akzeptierte Gradierung maligner primärer Knochentumoren - Unterteilung in niedrig- und hochmaligne ist jedoch anzustreben, ev. analog der FNCLCC-Gradierung verfahren (siehe Weichteilsarkome) - Bei konventionellen Chondrosarkomen Unterteilung in 3 Malignitätsgrade prognostisch relevant - Riesenzelltumoren nicht gradieren, da prognostisch irrelevant - Grösster Tumordurchmesser in mm - Kortikalisdurchbruch und Weichteilbefall - Gefässeinbruch (extraossär/intraossär) - Vollständigkeit der Resektion mit Abstand zu den Resektionsrändern in mm - Ergebnisse von Spezialuntersuchungen (Immunhistochemie, Molekularbiologie) Literatur Lodwick GS, Wilson AJ, Farrell C, Virtama P, Dittrich F: Determining growth rates of focal lesions of bone from radiographs. Radiol. 1980; 134: 577-583. Salzer-Kuntschik M, Brand G, Delling G: Bestimmung des morphologischen Regressionsgrades nach Chemotherapie bei malignen Knochentumoren. Pathologe. 1983; 4: 135-141. Reg. 25 Skelett 4 Von Hochstetter, AR: Verdacht auf Knochentumor, die Planung der Biopsie aus der Sicht des Pathologen. Schweiz med Wschr 1987; 117:1302-1306. AFIP. Laboratory Methods in Histotechnology. Washington, D.C.: American Registry of Pathology; 1992. 279 p. Remagen, W: Bedeutung von Referenz-Registern in der Knochentumor-Diagnostik. Z Orthop 1992; 130:267-268. Fechner RE, Mills SE: Tumors of the bones and joints. Washington D.C.: Armed Forces Institute of Pathology; 1993. 300 p. Mankin HJ, Mankin CJ, Simon MA: The hazards of the biopsy, revisited. J Bone & Joint Surg (Am). 1996; 78-A: 656-663. Dorfman HD und Czerniak B: Bone tumors. Mosby, St.Louis.1998. 1261p Freyschmidt J,. Ostertag H, Jundt G: Knochentumoren. Klinik. Radiologie. Pathologie. Springer Verlag, Berlin, Heidelberg, New York,. 1998. 973p. Reg. 26 Uterus 1 UTERUS 1. Cervix uteri Makroskopie - Typ des Operationspräparates : Konisat (Dysplasie oder CIS), LLETZ, Portioamputat - Gewebezustand : nativ oder fixiert, orientiert oder nicht - Masse : Höhe, Breite und Tiefe - Sichtbare Läsionen der Schleimhaut : Leukoplakie, Ulzerationen, exophytischer Tumor Zuschnitt - Portioamputat (negative Zytologie) - Querschnitt durch den Zervixkanal, eine Scheibe einbetten - Sagittaler medianer Längsschnitt durch die Zervix, je ein Block von jeder Muttermundslippe - Konisat, LLETZ (positive Zytologie) - Resektionsränder mit Tusche markieren, vorzugsweise mit zwei verschiedenen Farben für die vordere und hintere Muttermundslippen. Alternative : quere Einkerbung der vorderen Muttermundslippe mit scharfer Klinge - Variante A : - Vollständige Aufarbeitung in sagittalen parallelen Längsschnitten von 3-9 Uhr - So einbetten, dass alle Blöcke von der gleichen Seite angeschnitten werden ; nur die letzte Scheibe umkehren. Diese Technik erlaubt eine genaue Evaluation der Grösse einer Läsion, insbesondere diejenige eines Mikrokarzinoms - Variante B : - Das Präparat halbieren in vordere und hintere oder linke und rechte Hälfte. - Beide Hälfte spreizen und in « Orangeschnitzen » im Uhrzeigersinn aufarbeiten - Alle Scheiben so einbetten, dass sie alle von der gleichen Seite angeschnitten werden - Variante C : (natives Präparat) - In Längsrichtung bei 12 Uhr eröffnen und aufspannen (z.B. auf Korkplatte) ; fixieren lassen - Vollständige Aufarbeitung und Einbettung wie unter B Die Varianten B & C ergeben mehr Anschnitte der Transformationszone (Übergangszone) Wenn das Präparat bereits aufgeschnitten oder eingerissen wurde, in Radiärschnitten aufarbeiten Wenn das Präparat vom Kliniker nicht orientiert wurde, die grössere Muttermundslippe als die vordere betrachten (mit Vermerk im Bericht !) Reg. 26 Uterus 2 2. Hysterektomie Makroskopie - Zustand des Gewebes : nativ oder fixiert - Totale oder sub-totale Hysterektomie - Uterus in einem Stück oder in mehreren Fragmenten (topographische Orientierung möglich ?) - Uterus mit oder ohne Adnexen, mit oder ohne Parametrien, mit oder ohne Vaginalmanschette a) Hysterektomie ohne malignen Tumor : - Masse (Länge, Breite, a-p-Durchmesser), Gewicht total (ohne Adnexe) - Äussere Beschaffenheit : Serosa intakt ? Deformation durch Myome ? - Aspekt der Schleimhäute (Exo- und Endozervix, Endometrium) - Aspekt (Adenomyose) und Dicke des Myometriums - Wenn Myome, Anzahl, Lokalisation, Masse, Schnittfläche, Abgrenzung b) Radikale Hysterektomie (Wertheim-Meigs) wegen Portiokarzinom : - Vaginalmanschette vorhanden (Breite) oder nicht - Wenn sichtbarer Tumor : Lokalisation, Aspekt (exophytisch und/oder ulzeriert), Masse, Tiefe der Infiltration, Ausdehnung im Zervixkanal, Beziehungen mit der Vaginalmanschette und ihren Resektionsrändern - Parametrien : Aspekt, Masse, Verhärtung ? - Aspekt der vorderen und hinteren parazervikalen Resektionsränder - Anzahl, Lokalisation und Aspekt der resezierten Lymphknoten c) Hysterektomie wegen Karzinom, Sarkom oder Karzinosarkom des Endometriums : - Erkennbarer Tumor : Aspekt, Lokalisation, Ausdehnung, Masse, Abgrenzung, Tiefe der Infiltration ins Myometrium, makroskpischer Befall der Serosa, des Zervixkanals, makroskopisch erkennbare Veneneinbrüche - Aspekt der Adnexe - Anzahl, Lokalisation und Aspekt der resezierten Lymphknoten Zuschnitt a) Uterus ohne malignen Tumor : - Den Uterus ventral längs eröffnen, von der Portio bis zum Fundus, mit Zusatzschnitten in Richtung beider Tubenwinkel oder - Sonde in Zervixkanal und Cavum einführen und den Uterus frontal von der Portio aus in eine ventrale und eine dorsale Hälfte teilen. - Corpus uteri in 5-10 mm dicken Querschnitten zerlegen. Mindestens 2 Proben vom fundusnahen Endomyometrium einbetten, wenn möglich mit der ganzen Myometriumdicke und Serosa. Bei vorgängiger Diagnose einer komplexen Hyperplasie, mehrere endomyometrane Proben - Eine Querscheibe durch den Zervixkanal entnehmen. Portio in Längsschnitten lamellieren. Je eine Probe von jeder Muttermundslippe einbetten. - Dokumentation der makroskopisch festgestellten Laesionen (Polypen, Myome usw.) Eine Probe aus jedem Myom entnehmen, das entweder > 5 cm gross ist oder eine auffällige Schnittfläche (Nekrose, Blutung usw.) aufweist. Reg. 26 Uterus 3 b) Radikale Hysterektomie (Wertheim-Meigs) wegen Portiokarzinom - Resektionsränder (vaginal, parazervikal ventral, dorsal und lateral (Parametrien) mit Tusche markieren Wenn kein sichtbarer Tumor : Portio amputieren und wie ein Konisat verarbeiten. Querschnitte durch den Zervixkanal bis zum Isthmus. Bei makroskopisch erkennbarem Tumor : - Vaginaler Resektionsrand einbetten (quer oder längs, je nach seiner Beziehung zum Tumor) Portio amputieren. Je ein Längsschnitt von jedem Quandrant. Mehrere seitengetrennte Querschnitte durch den Zervixkanal mit der ganzen Dicke der Zervixwand bis zum Isthmus, Übergang zu den Parametrien sowie ventralen und dorsalen Resektionsrand erfassen. - Dokumentation der Tiefe der Invasion sowie der Ausdehnung des Tumors - Zwei Proben aus Endomyometrium (Fundus ant. und post.) - Alle mit dem Präparat resezierten Lymphknoten einbetten - Für das weitere Prozedere, siehe a) c) Hysterektomie wegen Karzinom, Sarkom oder Karzinosarkom des Endometriums : Wenn kein sichtbarer Tumor, Einbetten des gesamten Endometriums mit angrenzendem Myometrium. Für das weitere Prozedere, siehe a). Alle Lymphknoten einbetten. Bei makroskopisch erkennbarem Tumor : - Resektionsränder mit Tusche markieren (parazervikal und Parametrien) - Den Uterus eröffnen, nach einer der oben beschriebenen Methoden. Die frontale Dissektion gibt eine gute Übersicht des Cavums, inklusive Tubenwinkel. - Corpus uteri in ca. 5 mm dicke Querscheiben zerlegen. - Geeignete Proben für die notwendige Dokumentation, insbesondere der Tiefe der myometranen Tumorinfiltration (Proben mit der Gesamtdicke des Myometriums) und des eventuellen Befalls des Zervixkanals (Querschnitte) entnehmen. - Je ein Längsschnitt von jeder Muttermundslippe - Alle erhaltenen Lymphknoten in toto einbetten Bericht - Art des untersuchten Materials : Portio allein, Konisat, LLETZ ; totale oder subtotale Hysterektomie, mit oder ohne Vaginalmanschette und/oder Adnexen und/oder Parametrien. - Gutartige Läsionen (Polypen, Kondylome, Adenomyosis, Myome usw.), Lokalisation, Masse Bei Zervixdysplasie : - Histologischer Typ nach Bethesda, CIN- und WHO-Klassifikation Reg. 26 Uterus 4 Bei malignem Tumor : - Histologischer Typ nach WHO-Klassifikation, Differenzierungsgrad - Klassifikation nach pTNM (und FIGO) - Masse in drei Dimensionen, insbesondere Tiefe der Infiltration - Lokalisation, Beziehungen zu den angrenzenden Strukturen (Vaginalmanschette, Parametrien, Serosa, Endozervix) und den Resektionsrändern - Lymphangiosis carcinomatosa und/oder Blutgefässeinbrüche - Anzahl der untersuchten Lymphknoten, Lokalisation und Anzahl der positiven Lymphknoten Angeben, wenn Gewebe für Spezialtechniken (Hormonrezeptoren, Gewebebank, EM usw. ) asserviert wurde. Weitere fakultative Untersuchungen Bestimmung der Hormonrezeptoren beim Corpuskarzinom. Evaluationsschema : cf. Reg. 14 Mamma S. 4. Literatur : Hruban RH, Isacson C et al. Surgical Pathology Dissection : An illustrated Guide.Springer Verlag, Berlin, New York 1996 ; 116-127 Horn LC, Riethof L, Löning TH. Leitfaden für die Präparation uteriner Operationspräparate. Der Pathologe 1999 ; 20 : 9-14 Lax SF, Pizer ES, Ronnett BM, Kurman RJ. Comparison of estrogen and progesterone receptor, Ki-67, and p53 immunoreactivity in uterine endometrioid carcinoma and endometrioid carcinoma with squamous, mucinous, secretory and ciliated cell differentiation. Hum Pathol 1998 ; 29 : 924-931 Burton JL, Wells M. Recent advances in the histopathology and molecular pathology of carcinoma of the endometrium. Histopathology 1998 ; 33 : 297-303 Association of Directors of Anatomic and Surgical Pathology : Recommendations for the reporting of surgical specimens containing uterine cervical neoplasms. Modern Pathol 2000 ; 13 : 1029-1033 Reg. 26 Uterus 5 Checkliste Uteruskarzinome Art des Materials : Hysterektomie, Portioamputat, Konisat, LLETZ Tumor : Portio : Corpus : Carcinoma in situ / invasiv : Masse in 3 Dimensionen, Beziehungen zu Vagina, Corpus uteri, Parametrien Mikrokarzinom : Tiefe der Infiltration, oberflächliche Ausdehnung Tiefe der Infiltration im Myometrium, Beziehungen zur Serosa und zur Endozervix (Kolonisation der Drüsen und/oder infiltratives Wachstum) Histologischer Typ nach WHO-Klassifikation Differenzierungsgrad : Endometrioides Adenokarzinom des Endometriums : G1 : < 5% solide Anteile G2 : 6-50% solide Anteile G3 : >50% solide Anteile ; zusätzlich muss das Kerngrading berücksichtigt werden, da evt. ein Upgrading erfolgen muss (z.B. Kerngrading 3, architektonisches Grading 1 oder 2). Für die anderen histologischen Typen ist das Kerngrading allein bestimmend. Gefässeinbrüche : Lymph- oder Blutgefässe betroffen Resektionsränder : Befall der Resektionsränder : - makroskopisch und/oder mikroskopisch - durch invasives oder in situ Karzinom, Lymphangiosis carcinomatosa - fokal oder ausgedehnt ; Lokalisation Kein Befall der Resektionsränder - Minimaler Abstand zwischen Tumor und Resektionsrand Andere Befunde : Myome, Polypen, Adenomyosis Lymphknoten : Anzahl der untersuchten und der positiven Lymphknoten pTNM-Klassifikation : Fakultativ : Bestimmung der Hormonrezeptoren beim Korpuskarzinom (unter Angabe des Auswertungsschemas) Reg. 27 Weichteilsarkome 1 WEICHTEILSARKOME Die folgenden Angaben gelten primär für Weichteilsarkome des Erwachsenenalters. 1. Nadelbiopsien Bei nicht vordiagnostizierten Weichteiltumoren eignen sich Nadelbiopsien meist nur zur Abgrenzung eines mesenchymalen Tumors von einem Melanom, einem Lymphom oder der Metastase eines Karzinoms. Gelegentlich ist selbst die Malignitätsdiagnose an Nadelbiopsien sehr schwierig (z.B. zellreiches Neurofibrom vs maligner peripherer Nervenscheidentumor - MPNST). Eine Typisierung und Gradierung sollte nur an einer ausreichend grossen Biopsie vorgenommen werden. Im Zweifelsfall immer eine Inzisionsbiopsie verlangen. 2. Schnellschnittuntersuchung Bei der Primärdiagnostik ist eine Schnellschnittuntersuchung lediglich angezeigt zur Abklärung, ob vitales Tumorgewebe erfasst wurde. Die histologische Diagnose muss an Parafinschnitten gestellt werden. Es ist dringend abzuraten, am Schnellschnitt die primäre Diagnose eines Weichteiltumors stellen zu wollen. Für zytogenetische und molekulare Untersuchungen soll stets ein Fragment gefroren werden. Dies ist vor allem zur Untersuchung spezifischer Translokationen (pädiatrische Tumoren) essentiell. Wenn möglich soll ein Gewebsfragment auch in Glutaraldehyd für evt. elektronenmikroskopische Untersuchungen asserviert werden. 3. Makroskopie - Präparat unfixiert oder Formalin-fixiert. Markierungen vorhanden (Fäden, Tusche) und eindeutig bezeichnet? Einzelnes Resektat (bereits eingeschnitten?), mehrere Präparatfragmente (Anzahl?). Topographische Orientierung. Wenn aus der Anatomie und den Markierungen nicht eindeutig abzuleiten, sofortige Rücksprache mit dem Operateur. - Operationstyp: Inzisions-Biopsie, Exzisions-Biopsie, marginale Resektion (in der Pseudokapsel des Tumors oder innerhalb der unmittelbaren peritumoralen reaktiven Randzone; reaktive Randzone um ein Sarkom beträgt mind. 1cm), weite, lokale Exzision (Resektion sicher ausserhalb der reaktiven Randzone), Kompartment-Resektion, radikale Resektion (ausserhalb des betroffenen Kompartments), Amputation. - Beschreibung des Gesamtpräparates: Grösse und resezierte Gewebeanteile wie Haut (Biopsienarbe sichtbar?), subkutanes Fettgewebe, Faszie, Skelettmuskulatur, Periost und Knochen, Gefässnervenbündel, eventuell benachbarte Organe (bei zentral gelegenen Tumoren). Markierung und Identifizierung der tumornahen Resektionsränder mit Tusche (besser erst nach vorausgegangener Fixation vornehmen). - Beschreibung des Tumors: Grösse in dreidimensionaler Ausdehnung. - Infiltrationstiefe in Bezug auf anatomische Strukturen (z.B. subkutan, epifaszial, intramuskulär, viszeral, mehrere Kompartemente). - Nekrose makroskopisch sichtbar (in % nach Auflamellierung des Tumors. - Unterschiedliche Areale (Farb- und Tastbefund) auf Schnittflächen. Reg. 27 Weichteilsarkome 2 - Biopsiekanal Ausdehnung in mm und in Bezug auf betroffene Kompartemente wie Haut, Subkutis, Faszie, Muskulatur. Beziehung des Biopsiekanals zu Resektionsrändern, komplette Entfernung des Biopsiekanals mit Resektat: ja/nein. - Infiltration makroskopisch erkennbarer Strukturen (Gefässnervenbündel, Knochen). - Satellitenknoten (Anzahl, Grösse in cm, minimaler Abstand zum Resektionsrand). - Lymphknoten Anzahl, Grösse, Schnittfläche. - Resektionsrand- Spezifizierung und genaue Bezeichnung aller Ränder, die weniger als 2cm vom Tumor entfernt sind unter Angabe des Abstandes in mm. Topographische Orientierung der Resektionsränder beziehungsweise Flächen: oberflächlich/tief, proximal/distal, medial/lateral. Falls ein Resektionsrand beziehungsweise eine Resektionsfläche durch eine anatomische Struktur (z.B. Faszie) gebildet wird, sollte dies gesondert aufgeführt werden. 4. Zuschnitt - Minimum ein Block pro cm des maximalen Tumordurchmessers mit exakter Angabe der Entnahmestelle (Zeichnung, Fotokopie, Video-Print). - Entnahme aus allen makroskopisch unterschiedlichen Regionen. - Untersuchung der Resektionsränder in Blöcken, die senkrecht vom Schnittrand auf den Tumor hin orientiert sind. Bei Angiosarkomen und epitheloiden Sarkomen auch Resektionsränder mit mehr als 5cm Abstand vom Tumor mituntersuchen (häufig Satellitenknoten). - Angabe über Gewebeentnahmen für Spezialuntersuchungen (Frischmaterial für Molekularbiologie, Tumorbank, Zytogenetik, DNA-Flowzytometrie, Material für Elektronenmikroskopie). 5. Berichterstattung - Anatomische Lokalisation und Beziehung des Tumors zu anatomischen Strukturen (Infiltration von Haut, Subkutis, Muskulatur etc.). - Histologischer Typ nach WHO-Nomenklatur. Kann der Tumortyp auch nach Konsil nicht festgelegt werden, Bezeichnung als unklassifiziertes Sarkom, ergänzt durch pleomorphzellig, spindelzellig, myxoid oder rundzellig (FNCLCC-Grading dennoch möglich). - Tumorgrösse in mm. - Der histologische Malignitätsgrad ist nur am Primärtumor zu ermitteln. Die Gradierung basiert auf dem histologischen Tumortyp, dem Nachweis von Nekrose und der Mitoserate. Empfohlen wird das Gradierungssystem der Fédération Nationale des Centres de Lutte contre le Cancer (FNCLCC, siehe Guillou und Coindre, 1998) für Weichteilsarkome des Erwachsenenalters. Dieses Gradierungssystem kann nicht für viszerale (z.B. GIST), uterine und pädiatrische Sarkome angewendet werden. - Nekrose : Makroskopisch oder mikroskopisch; keine, unter 50%, über 50%. - Mitoserate: Anzahl Mitosen pro 10 kalibrierten Gesichtsfeldern aus den Stellen mit der höchsten proliferativen Aktivität. Dafür müssen die mitotisch aktivsten Gesichtsfelder berücksichtigt werden (nicht Durchschnitt der ausgezählten Gesichtsfelder verwenden). Mikroskoptyp beachten: Mitosenzahl hängt von der Gesichtsfeldgrösse ab (FNCLCC-System: High-power field = 0.174mm2). - Abstand des Tumors von allen Resektionsrändern (ein Abstand des Tumors von weniger als 2 cm zur Resektionsfläche scheint mit einem erhöhten Rezidivrisiko einherzugehen; Ausnahme: wenn Resektionsfläche durch Faszie oder Periost gebildet wird). - Lymphknotenbefall - Gefässinvasion, Infiltrationsart des Tumors (gut begrenzt, netzförmig infiltrierend, diffus infiltrierend), entzündliche Begleitreaktion. Reg. 27 Weichteilsarkome 3 - Änderung des Malignitätsgrades (von niedrig maligne in hoch maligne und umgekehrt z.B. nach Therapie) im Vergleich zum Vorbefund. - Zusatzuntersuchungen: Resultate von Immunhistochemie, Elektronenmikroskopie, Molekularbiologie, DNA-Flowzytometrie, statische Zytometrie etc. Literatur Enzinger FM and Weiss SW: Soft tissue tumors 1995; 3 ed. St. Louis, USA, C.V. Mosby Company Mankin HJ, Mankin CJ, Simon MA: The hazards of the biopsy, revisited. J Bone & Joint Surg (Am) 1996; 78-A: 656-663. Guillou L, Coindre JM, Bonichon F et al: Comparative study of the National Cancer Institute and French Federation of Cancer Centers Sarcoma Group grading systems in a population of 410 Adult Patients With Soft Tissue Sarcoma. J Clin Oncol 1997; 15(1): 350-362 Guillou L and Coindre JM: How should we grade soft tissue sarcomas and what are the limitations? Pathology Case Reviews 1998; 3: 105-110 Guillou L and Coindre JM: Grade histoprognostique des sarcomes des tissues mous de l’adulte. Méthode d’évaluation, interêt et limites. Ann Pathol 1998; 18(6): 473-80. Association of Directors of Anatomic and Surgical Pathology. Recommendations for the reporting of soft tissue sarcomas. Hum Pathol 1999; 30(1): 3-7. Kilpatrick SE: Histologic prognostication in soft tissue sarcomas: grading versus subtyping or both? A comprehensive review of the literature with proposed practical guidelines. Ann Diagn Pathol 1999; 3(1): 48-61.