Idegi Kommunikáció
Werbung

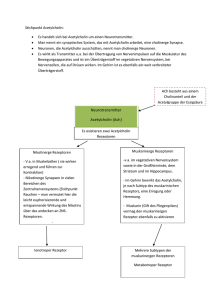
Neurale Kommunikation Die Molekular- und Zellenbiologie der neuronalen Kommunikation Inhalt 1. Einleitung 1a. Die Art des Signaltransports 1b. Die Netz-Theorie kontra Neuron-Theorie 1c. Die Komplexität des Nervensystems 1d. Die Arten der Neurone 2. Der Funktionsmechanismus eines Neurons 2a. Ruhepotential 2aa. Das Wandern der elektrisch geladenen Teilchen 2ab. Das Donnan Gleichgewicht 2ac. Steady state 2ad. Gleichgewichtspotential 2ae. Ruhepotential 2b.Transportproteine 2ba. Arten der Transportproteine 2bb. Regulierung der Ionenkanäle 2bc. Gap-junction 2bd. Na+- K+ Pumpe 2be. Na+, Ca+Kanäle 2bf. K+ Kanäle 2bg. Funktionsmechanismus der Ionenkanäle 2bh. Funktion der Spannungssensoren 2c.Aktionspotential 2ca. Erregung, EPSP 2cb. Hemmung, IPSP 2cd. „Alles oder Nichts” Gesetz 2ce. Verbreitung des Aktionspotentials 3. Kommunikation der Neurone 3a. Synaptischer Signaltransport 3aa. Arten der Synapsen 3ab. Funktionsmechanismus der chemischen Synapsen 3ac. Neurotransmitter 3b.Rezeptore 3ba. Arten der Rezeptoren 3bb. Ionotrope Rezeptoren 3bc. G-Protein gekoppelte Rezeptoren 3d. Neuromodulation 3da. Hemmung 3db. Autorezeptoren 3dc. Metabotrope Rezeptor Modulation 3de. Long-term Potential 3f. Funktionelle Neuronsysteme Wörterverzeichnis Grundanforderung Seite 1 Neurale Kommunikation 1. Einleitung Die Arten der Signalübertragungen (Folie 1) Lokale Kommunikation: Die Zelle sendet sich die Informationen, durch autokrine Signalübertragung, selbst. Im Fall einer parakrinen Signalübertragung findet die Kommunikation zwischen der Zelle, und deren Nachbarzellen statt, dies wird, wenn es sich um einen Neuron handelt, neurokrine Signalübertragung genannt. Ferne Kommunikation: Die endokrine Signalübertragung bedeutet den Transport von Hormonen bis zu den Rezeptoren der fernen Zellen, mit Hilfe der Blutströmung. Die Neurokommunikation ist selbstverständlich auch eine ferne Signalübertragung, denn die Neurone kommunizieren nicht ausschliesslich mit den Nachbarzellen. Hormone: Langsame und diffuse (diese geraten durch den Blutstrom zu den Zielgeweben). Neuronale Signalübertragung: Schnell und gezielt. Die beiden Systeme sind auf evolutionärer Ebene miteinander Verwandt: mehrere Hormone funktionieren auch als Neurotransmitter. (Folie 4) 1b. Die Netz-Theorie gegenüber der Neuron-Theorie (Folie 2) Die Netz-Theorie (Camillo Golgi): das Nervensystem besteht aus sogenannten Synzytien , deren Cytoplasma über zusammenhängend (mit freiem Durchgang) sind, und über eine extrem hohe Anzahl von Zellkernen verfügen. Die Neuron-Theorie sagt, dass grundsätzliche strukturelle und funktionelle Einheiten des Nervensystems die Nervenzellen sind. Diese Theorie wurde in den letzten Jahren des 19. Jahrhunderts von Santiago Ramón y Cajal bekannt gemacht. Laut dieser Meinung sind die Neurone keine netzartig zusammenschmelzende Zellen, sondern genetisch einzelne Einheiten, die auch in ihrem Stoffwechsel getrennt sind; diese verfügen über Zellkörper, Axon und Dendrit. Weiterhin sagt die Neuro-Theorie aus, dass der neuronale Signaltransport in eine Richtung stattfindet, von der Richtung der Dendrite (oder dem Zellkörper) in Richtung der Axone (anterograde Verbreitung). Interessanterweise haben beide Wissenschaftler 1906 einen Nobel-Preis (Physiologie und Medizin) bekommen. Golgi erhielt diesen Preis wegen der von ihm enwickelten, sogenannten Golgi-Färbung. Von den durch Anwendung dieser Technik erhaltenen Ergebnissen war es aber Cajal, der die richtigen Konsequenzen ziehen konnte. 1c. Komplexität des Nervensystems (Folie 3) Das menschliche Gehirn besteht aus 3-5 milliarden (3-5 x 1011) Neuronen. Die Zahl der synaptischen Kontakte eines durchschnittlichen Neurons beträgt 10 Tausend. Das heisst, dass im Gehirn eines Menschen durchschnittlich 3-5 x 1015 Synapsen anwesend sind. Zwei weitere Faktoren steigern diese gewaltige Komplexität: (1) die Synapsen können je nach Verwendung eine andere Struktur annehmen ( Plastizität); (2) Die Reaktion einer Nervenzelle auf einen Stimulus hängt je von dem Zustand der Zelle ab, welcher wiederum unter einer ständigen (nicht diskreten) und komplexen Regulation steht. 1d. Die Arten der Neurone (Folie 4) Die ca. zehntausend Neuronartigen Elemente die das Nervensystem bilden, können in drei grosse Gruppen eingeteilt werden, davon abhängend, woher diese die Informationen wohin transportieren. (1) Die afferenten Nervenzellen – oder auch Sensoneurone genannt – transportieren die Nervenimpulse von den Rezeptoren oder von den Senso-Organen in die Richtung des zentralen Nervensystems. (2) Die efferenten Nerven – anders auch motorische oder effektor Neurone genannt transportieren die Impulse aus der Richtung des zentralen Nervensystems in die Richtung des periferischen Gewebe ( Muskeln, Drüsen). (3) Die Interneurone sind solche Neurone, welche mit anderen Neuronen Grundanforderung Seite 2 Neurale Kommunikation kommunizieren. Es gibt unter diesen zwei grundsätzliche Typen: die ProjektionsInterneurone (mit anderen Worten auch Schalt-Neurone genannt) verfügen über einen langen Axon und ihre Aufgabe ist es die Informationen in niedrigere oder höhere Nervenzentren zu transportieren. Die lokalen (örtlichen) Interneurone ( auch Assoziationsneurone genannt) regulieren, modulieren die Funktion von Neuronen anderer Art. 2. Der Funktionsmechanismus einer Nervenzelle 2a. Ruhepotential Das Ruhepotential bedeutet das Potential einer nicht stimulierten, erregbaren Zelle ( Neuron-, Muskel-, oder Herzmuskelzelle). Das Membranpotential ist der Unterschied zwischen der Anspannung der zwei Seiten eines Plasmamembrans. Das Ruhepotential ist im Inneren der Zelle negativ, der Wert davon liegt in einem Neuron, abhängend von der Art der Nervenzelle, zwischen -65 mV und -90 mV. Die elektrochemische Kraft, welche ein Ion dazu bringt durch ein Membran durchzudringen wird von dem Unterschied zwischen dem Ruhepotential und dem Gleichgewichtspotential eines gegebenen Ions gewonnen ( siehe detailierter Sektion 2aa.). Das heisst, dass das Ruhepotential einerseits durch den Unterschied zwischen der intraund interzellularen Verteilung, andererseits dadurch, dass die Permeabilität des Zellenmembrans unterschiedlich auf die einzelnen Ione wirkt, geschaffen wird. Das Gleichgewichtspotential eines Ions ist der angespannte Zustand, in welchem keine netto Einströmung in das Membran vorhanden ist. Erklärung: Strömung ist vorhanden ( dynamischer Zustand), aber die Zahl der ein- und austretenden Ionen ist ausgeglichen. 2aa. (Folie 5) Das Wandern der geladenen Partikel innerhalb einer Zelle wird von 3 Faktoren bestimmt: (1) Konzentrations(chemische)Gradient; (2) elektrisches-Gradient; (3) Ionpumpe. In der Natur strebt alles nach Gleichgewicht. Ein Ion verfügt über eine zweiseitige Natur: einerseits ist es ein über eine bestimmte materielle Qualität verfügendes Partikel ( Atom, Molekül), andererseits, ein über Ladung verfügendes Partikel. Zur Natur des Ions gehört, das es sich auf den zwei Seiten des Zellenmembrans gleichmässig verteilt. Hierbei zählt nicht was für andere Atome oder Moleküle in der Umgebung sind. Als geladenes Partikel strebt das Ion stets danach, dass sich die Ladungen gleichmässig im Extra- und im Intrazellularraum verteilen. Hierbei spielt die materielle Natur keine Rolle, nur die Ladung. Wenn irgendein Ion nicht fähig ist durch den membran durchzudringen, dann wird sich in Folge dessen auch die Verteilung der anderen Ione ändern, dass heisst, diese werden nicht mehr gleichmäßig verteilt sein. Aber auch die Gesamt-Ion Verteilung gleicht nicht aus, denn die Konzentration der Partikel kann wegen den erwähnten Gründen nicht gleich werden. Den Prozess macht die aktive Teilnahme der Ionenpumpen an der Entwicklung des Membranpotentials noch komplizierter. 2ab. (Folie 6) Das Donnan-Gleichgewicht bezieht sich auf die Verteilung der Ione auf den zwei Seiten eines semipermeablen Membrans٭. Einige Ion-Artigkeiten können frei durch den Membran( ٭durch Diffusion) durchdringen, während andere dies nicht schaffen. Diese Situation führt an einer Grenzoberfläche zu einer unregelmäßigen Verteilung der Ionen. 2ac. Das steady state (Folie 7) ist solch eine dynamische Verteilung der Ionen auf den zwei Seiten eines Membrans, welche sich mit der Zeit nicht verändert. Grundanforderung Seite 3 Neurale Kommunikation 2ad. Das Gleichgewichtspotential eines Ions (z.B. K+ auf Folie 8) ist die Spannung bei welcher es keine netto Ionenwanderung durch den Membran gibt. 2af. Das Ruhepotential des Membrans (Folien 9-11) ist ein Spannungsunterschied zwischen den zwei Seiten des Plasmamembrans eines nicht stimulierten Neurons. Wenn ein Neuron kein Signal sendet, dann sagt man, dass es ruht. In einem Ruhezustand ist das Innere der Nervenzelle mit dem Extrazellularraum verglichen negativ. Obwohl die Konzentration der unterschiedlichen Ionen nach Gleichgewicht strebt, kann dies nicht verwirklicht werden, da der Zellenmembran nicht für alle Ionen durchdringbar ist. Im Ruhezustand können die Kaliumionen recht einfach durch die Membran dringen ( durch die sickernden KaliumIonkanäle; siehe später), bis dies für die Klorid und Natrium Ionen nicht so einfach ist. Die negativ geladenen Proteinmulekülen ( A1) sind überhaupt nicht in der Lage durch die Membran zu dringen ( ausgenommen die ausgewählten Proteine). Es gibt eine Pumpe ( Na +K+- Pumpe) im Zellmembran, welche mit verwendung von Energie, mit einer Drehung 3 Na+ aus der Zelle hinaus, bzw. 2 K+ in die Zelle hineinschleusen kann. Wenn dann letztendlich alle drei Kräfte ausgeglichen sind können wir das Ruhepotential messen, dieser beträgt in den Neuronen -70 mV (millivolt). Die elektrochemische Kraft die die Ionen durch die Membran bewegt ergibt sich aus dem Unterschied zwischen dem Ruhepotential und dem Gleichgewichtspotential einiger Ione. 2b. Transportproteine 2ba. Arten der Transportproteine (Folie 12) Transportproteine sind integrierte Membranproteine, welche Ionen oder Moleküle durch die Plasmamembran transportieren. Wir unterscheiden zwei Grundtypen der Transportproteine aufgrund ihres Energieverbrauches (verbrauchen sie Energie während sie funktionieren, oder nicht); Ionenkanäle und Ionenpumpen. Ein Ionenkanal kann ein integriertes (durch die Membran dringendes) Membranprotein, oder häufiger eine, aus mehreren Protein-Unterelementen bestehende Struktur sein. Diese, aus mehreren Unterelementen gebildete Strukturen sind ringelartig, und können aus den gleichen (homo-), oder aus unterschiedlichen (hetero-) tetrameren (4) Untereinheiten gebildet sein. Die Ionenkanäle transportieren die gebundenen Moleküle in die von dem elektrochemischen ٭Gradienten vorgeschriebene Richtung (passiver Transport). Man unterscheidet zwei Subtypen : sickernde Kanäle, welche die Wanderung der Ionen durch die Poren nicht regulieren ( deshalb selbstverständlich gleichzeitig nur wenige Ionen durchlassen können); und regulierte Kanäle. Es gibt mehrere Arten der regulierten Kanäle: Spannungsabhängige, ligand regulierte, Phosphorilations-regulierte, Anspannungs-regulierte Kanäle, GProtein gekoppelte und Gap-junction (Spalt Verbindung) Kanäle. Laut einer anderen Gruppierung kann man spezifische und Kation-selektive Kanäle unterscheiden. Die spezifischen Ionenkanäle sind für eine Art der Ionen durchdringbar, während die Kationselektiven Kanäle mehrere Ionenarten durch ihre Poren dringen lassen können. Die Ionenpumpe ist auch ein Transmembranprotein, welches in der Lage ist die Ionen in die entgegengesetzte Richtung ihrer elektrochemischen Gradiente zu bewegen (aktiver Transport). Diese Ionenpumpen, welche oft auch Ionentransporter genannt werden verwenden aus unterschiedlichen Energiequellen (ATP, Konzentrationsgradiente anderer Ionen) stammende Energie zu ihrer Funktion. Grundanforderung Seite 4 Neurale Kommunikation 2bb. Regulierte Ionenkanäle (Folie 13) Bei regulierten Ionenkanälen sichert -abhängig von der Art des Ionenkanals- ein „Tor” den Zugang zu der Pore, welche sich auf Wirkung von chemischen oder elektronischen Signalen öffnet oder schliesst. Die Spannungsabhängigen Ionenkanäle sind solche Arten der Ionenkanäle, welche auf Wirkung der Spannung der Umgebung aktiviert werden. Sie tragen eine grundlegende Rolle in den reizbaren Geweben ( Nerv, Muskel) da diese eine schnelle und koordinierte Depolarisation ٭möglich machen. Sie bestehen meistens aus mehreren Untereinheiten, welche so verteilt sind, dass sie eine zentrale Pore bilden, durch welche die Ionen auf einer von ihren elektrochemischen Gradient festgelegten Art, wandern. Die Kanäle sind Ion-spezifisch, obwohl sie für ähnlich grosse Ionen bis zu einem gewissen Maβe auch durchdringbar sind. Hierher gehören die Neuron- und Muskelzellen abhängigen Kanäle bei Natrium- und Kalzium, bzw. die Kalium Kanäle, welche bei dem Ausstoß von Neurotransmittern in den praesynaptischen Nerv-Enden eine Rolle spielen. Die Spannungs-Abhängigen Kanäle bestehen aus mehreren Teilen. (1) der Ion-Selektivität Filter bestimmt, was für Ionen durch das Filter dringen können. (2) das Aktivitäts Tor reagiert auf die Veränderungen der Spannung; die Natrium Kanal-Tore öffnen sich in depolarisations-, und die Tore der Kalium Kanäle öffnen sich in repolarisations Umgebung. Das aktivitäts-Tor des Ionkanals wird von dem (3) SpannungsSensor reguliert, indem sich dieser auf Wirkung der Änderung des Membranpotentials bewegt. (4) Das Inaktivitäts-Tor grenzt die „ÖffnungsZeit” des Kanals ein. Viele Ion-Kanäle haben kein Inaktivitäts-Tor. Die Ligand gesteuerten Ionenkanäle (anders auch Ionotrope Rezeptoren genannt) sind transmembrane Proteine, welche sich auf die Wirkung eines chemischen Senders (primärer Sender, Ligand) öffnen. Die Ionenkanäle, die von Neurotransmittern gebunden sind, sind meistens auf einen, oder mehrere Kanäle selektiv: Na+, K+, Ca+ oder Cl-. Die sich bei den Synapsen befindenden Rezeptoren wandeln das von dem praesynaptischen Neuron gesendete chemische Signal schnell in ein postsynaptisches elektrisches Signal um. Phosphorilations-gesteuerte Ionenkanäle Ein Phosphorilations-gesteuerter Ionenkanal öffnet oder schliesst-je nach Art des Kanals- auf Wirkung der Phosphorilation. Die Phosphorilation wird in der Regel, als Teil eines Transduktions-Prozesses eines gegebenen Signals, von einem Kinase-Enzym durchgeführt (ausführlicher siehe Sektion 3c). Spannungabhängige Ionenkanäle aktivieren sich auf die Wirkung der Deformation der Plasmamembran der Neurone. Die Proteine der Zellstruktur vermitteln den mechanischen Impuls, den die Zelle erhalten hat, in Folge dessen entsteht eine strukturelle Veränderung bei den Ionenkanälen, und dadurch ändert sich die Ion-Durchlassungsfähigkeit dieser. 2bc. Gap-junction (Spalt Kontakt) (Folie 14) ist eine Verbindung zwischen den Neuronen, welche die freie Strömung von Ionen und Molekülen möglich macht. Die Junktion verbindet Grundanforderung Seite 5 Neurale Kommunikation die Zytoplasmen der Zellen. Eine Gap-junction besteht aus Connexonen, und jeder Connexon wird von 6 Connexinen ٭gebildet. Die durch Gap-junction verbundenen Neurone verhalten sich manchmal, als würden sie einen einzigen grossen Neuron bilden, dessen massenhafte Outputs in Einklang miteinander feuern. 2bd. Die Na+/K+ Pumpe (Folie 15) (anders Na+/ K+- ATPase oder Na+/ K+ exchanger genannt) ist ein im Membran platziertes Enzym. Es kommt praktisch in der Plasmamembran von jeder Zelle vor. Es funktioniert auf die folgende Weise: (1) Auf Wirkung von ATP bindet die Pumpe 3 intrazellulare Na+. (2) ATP löst sich, was zu der Phosphorilation (bei einer stark konservierten Asparaginsäure) und der Bildung von ADP führt. (3) Die Phosphorilation ändert die Struktur der Pumpe, wodurch 3 Na+ in die Umgebung geraten. Die phosphorilisierte Form der Pumpe zeigt eine niedrige Aktivität gegenüber dem Na+, und lässt deshalb los. (4) Danach bindet die Pumpe 2 extrazellulare K+ , was zu der Dephosphorilation der Pumpe führt. (5) ATP bindet sich erneut an die Pumpe, was zu einer Drehung dieser führt, und wodurch Kalium Ionen in die Zelle gestoßen werden. 2be. Na+/Ca+-Kanäle (Folie 16) Drei Untereinheiten der Spannungsabhängigen Na+ Kanäle sind bekannt: die grosse α-Untereinheit, welche, unter anderem die Pore des Kanals bildet, und zwei weitere, kleinere Untereinheiten, welche β1 und β2 Untereinheiten genannt werden. Letztere regulieren die Funktion der α-Untereinheit. Die α-Untereinheit verfügt über vier sich wiederholende Abschnitte (Domain), welche von I bis IV nummeriert werden, und über sehr ähnliche Aminosäuresequenzen verfügen. Jede Wiederholung enthält sechs membrandurchdringende Regionen, welche von S1 bis S6 nummeriert werden (S: Segment). 2bf. Die K+-Kanäle (Folie 17) sind die häufigsten Ionenkanalartigkeiten. Sie bilden Kaliumselektive Poren, welche die Zellmembran überbrücken. Sie können in homo- und heterotetrameren Formen vorkommen. Die vier Untereinheiten verteilen sich um die zentrale Pore. Bisher wurden mehr als 80 Säugetier Kalium Kanal Gene beschrieben. Die Natrium und Kalium Kanäle sind wahrscheinlich aus zwei aufeinander folgenden Duplikationen von urzeitlichen Kalium-Kanälen entstanden. 2bg. Der Funktionsmechanismus der Spannungsabhängigen Kanäle (Folie 18) Bei geschlossenem Zustand hilft ein Natrium-Kanal den Ruhezustand der Neurone aufrecht zu erhalten; in geöffnetem Zustand macht sie das schnelle Einströmen von Natrium Ionen in die Zelle möglich, was zu einer Depolarisation führt. Die Spannungsabhängigen Natrium-Kanäle können in drei unterschiedlichen Zuständen vorkommen: ruhend (geschlossen), aktiv ( offen), und inaktiv ( geschlossen). Die ruhenden Kanäle befinden sich in einem durch den aktivierungs Kanal blokierten Zustand. Der inaktivierungs-Kanal (besteht aus den II und IV-er Domainen der α-Untereinheit) tritt kurz nach der Aktivierung in Funktion. Die Inaktivität nimmt dann ein Ende, wenn das Membran-Potential wieder negativ wird, aber erst nach einer kurzen Latenzzeit. Die Spannungsabhängigen Natrium-Kanäle spielen eine grundlegende Rolle bei der Erschaffung des Aktionspotentials. Wenn sich in Folge der Veränderung des MembranPotentials genügend Kanäle öffnen, dann gerät eine große Menge an Natrium Ionen in die Zelle, was eine weitere depolarisierende Wirkung mit sich zieht. Das heißt, je mehr NatriumKanäle in der Membran sind, desto schneller wird das Aktionspotential. Die Inaktivation der Natrium-Kanäle spielt eine wichtige Rolle um eine Strömung in die gleiche Richtung zu erreichen: der Impuls darf nur in eine anterograde Richtung, dass heißt, von dem Zellenkörper Grundanforderung Seite 6 Neurale Kommunikation zu den Axonterminalen strömen. Grund dafür ist, dass solange die depolarisierende Welle in der Nähe ist, der Inaktivisations-Kanal die zuvor noch geöffneten Kanäle eine kurze Zeit nicht wieder öffnen lässt (bis die Depolarisations-Welle weiterströmt). Die meisten Kalium-Kanäle sind Spannungsabhängige Ionenkanäle. In den Neuronen sind die Herstellung des Aktionspotentials und das aufrechterhalten des Ruhepotentials ihre Aufgaben. Zur Öffnung einiger ist neben der Depolarisation noch die Anwesenheit anderer Ionen oder SignalMolekülen notwendig (Folie 18). 2bh. Der Funktionsmechanismus der Spannungssensors (Folie 19) Die stark konservierte (evolutionsartig unveränderte) Region S4 ist ein Spannungs-Sensor, welcher in jeder 3. Position positiv geladene Aminosäuren, und in den dazwischenliegenden Räumen hydrophobe Aminosäuren enthält. In Folge von Stimulation (Potenzänderung der Membran) bewegt sich die Untereinheit S4 in die Richtung des extrazellulären Raumes, und öffnet dadurch die Pore ( aktivitäts-Tor), welche sonst durch die positiven Ladungen blockiert wäre. 2c.Aktionspotential Das postsynaptische Potential ist die Potential-Änderung der Membran auf dem das Signal enthaltenden (postsynaptischen) Neuron. Als erstes senden die Axon-Enden der präsynaptischen Neurone Neurotransmitter in den presynaptischen Spalt. Danach knüpfen sich die Transmitter an die Rezeptoren des postsynaptischen Neurons, was abhängend von dem Typ des Rezeptors, aktiviert oder gehemmt wird. 2ca. Das erregende postsynaptische Potential ( EPSP) (Folie 20) ist die vorübergehende Modifikation des postsynaptischen Potentials in den Dendriten oder dem Zellkörper, welche von der Einströmung der Natrium Ionen in das annehmende Neuron hervorgerufen wird. Für die Natrium Ionen wird der freie Durchgang von der Bindung der Neurotransmitter an die postsynaptischen Rezeptoren hervorgerufen. Die EPSP-s werden so summiert. Größere EPSPs führen zu einer Membran-Depolarisation, was mit größerer Wahrscheinlichkeit zu dem Erreichen der Stimulus-Schwelle, und so zur Initiative des Aktionspotentials führen kann. 2cb. Das Hemende Postsynaptische Potential (IPSP) (Folie 21) ist der Wachstum des Membran-Potentials in den postsynaptischen Neuronen, was zu einer Anknüpfung eines hemmenden Neurotransmitter-Rezeptors führt. Die am häufigsten vorkommenden hemmenden Neurotransmitter sind die γ-Amino-Buttersäure (GABA) und das Glycin. Bei einer typischen hemmenden Synapse wird die postsynaptische Membran für das Einströmen von K+ (strömt aus) und Cl- (strömt ein) permeabel, aber für die Na+ Ionen undurchdringlich, was das Membran-Potential näher zu dem Gleichgewicht-Potential dieser Ionen bringt. 2cc. Räumliche und zeitliche Summation (Folie 22-25) Wenn mehrere EPSP-s und IPSP-s verursachende Geschehen auf einer kleinen Oberfläche einer postsynaptischen Zelle vorkommen, oder diese neben geringem Zeitunterschied passieren dann kommt es zur Summation dieser Auswirkungen. 2cd. Das „alles oder nichts“ Gesetz (Folie 26) Das Aktionspotential ist eine depolarisierende welle (Impuls) entlang des Axon, im Laufe dessen das Ruhepotential in Richtung des 0 mV Wertes rückt. Wenn in Folge der Wirkung der Summierten EPSP-s die Depolarisation um den Axon-Hügel ٭das Schwellen-Potential (-55 mV) erreicht, dann erzeugt das Neuron Aktions- Grundanforderung Seite 7 Neurale Kommunikation Potential, welches in gegebenen Neurontypen über eine ständige Größe verfügt, aber in unterschiedlichen Neuronen unterschiedlich sein kann. Wenn der Neuron das SchwellenPotential nicht erreicht, wird es kein Aktionspotential geben. Mit anderen Worten, es gibt kein großes oder kleines Aktionspotential, jedes ist im gegebenen Neuron gleichgroß. Das heißt entweder erreicht ein Neuron das Schwellen-Potential nicht, oder es erreicht es, und dann wird ein ganzes Aktions-Potential erzeugt- das ist das „Alles oder nichts“ Grundgesetz. Das Neuron kodiert also die Stärke des Stimulus nicht in der Größe dessen, sondern in der Häufigkeit des Stimulus. Die Zahl der feuernden Neurone ist ein anderes Mittel zur Kodierung der Stärke des Stimulus: starker Stimulus- mehrere aktive Neurone. 2ce. Verbreitung des Aktionspotentials (Folie 27-31) Das Aktionspotential ist der Austausch von Ionen durch die Membran des Axons durchdringend. Ein Stimulus führt als erstes zur Öffnung der Natrium-Kanäle. Da Natrium positiv geladen ist wird das Neuron auch positiv (Depolarisation). Die Öffnung der Kalium-Kanäle nimmt mehr Zeit in Anspruch. Wenn sich diese öffnen geraten die Kalium-Ionen in den Intrazellularen Raum, und dies führt zur Umkehrung der Depolarisation. Zur gleichen Zeit beginnen sich die Natrium-Ion-Kanäle zu schließen. All dies führt dazu, dass das Membran-Potential wieder den -70 mV Wert erreicht (die Repolarisation). In Wirklichkeit steigt das Aktionspotential über -70 mV (Hyperpolarisation), weil die Kalium-Kanäle länger geöffnet bleiben. Wegen dem in Aktion treten der Ionenpumpen gerät die Ionen-Konzentration Schritt für Schritt wieder in den Ruhezustand, bzw., die Verteilung der Ionen entspricht wieder der des Ruhezustands. Noch mehr Na+ Kanäle öffnen sich In den Axonen mit Myelinscheiden verbreiten sich die Impulse sprungartig (Folie 32-33) zwischen den nicht umhüllten Segmenten des Axons (Ranvier Schnürrung). Die sprungartige Leitung steigert die Geschwindigkeit (eine weitere Möglichkeit dies zu erreichen ist die Steigerung des Durchmessers des Axons). 3. Kommunikation der Neurone 3a. Synaptische Signalübertragung die Übertragung der Signale geschieht an den Neuronen über die Synapsen. (Folie 34-37). 3aa. Arten der Synapsen (Folie 36-37) Es gibt zwei Grundarten der Synapsen: elektrische und chemische Synapsen. Bei den höheren Lebewesen spielt die chemische Synapse eine wesentlich wichtigere Rolle, obwohl immer mehr Forschungen zeigen, wie wichtig auch die elektrischen Synapsen (Gap-junction) sind. Man kann die Synapsen auch aufgrund dessen in Gruppen teilen, zwischen welchen Zellenpartikeln es zum Kontakt kommt. Wenn die Endung Grundanforderung Seite 8 Neurale Kommunikation des Axons des presynaptischen Neurons am Dendrit des postsynaptischen Neurons endet reden wir von Axo-dendritischen Synapsen. Kontakt zwischen Axonen und Zellenkörper nennen wir Axo-somatische Synapse. Der Kontakt zwischen zwei Axonen wird Axoaxonische Synapse genannt. 3ab. Funktionsmechanismus der chemischen Synapse (Folie 38) Den Ausstoß von Neurotransmittern induzieren die Nervenimpulse (Aktionspotential). Der Prozess läuft sehr schnell ab. Das Aktionspotential aktiviert die Vesikeln die in der Nähe der Membran vorzufinden sind. Erster Schritt ist die Öffnung der Spannungsabhängigen Kalzium Kanäle, und das Einströmen der Ca2+ in das Axoplasma. Die Kalzium Ionen induzieren eine biochemische Kaskade (nacheinander folgende Schritte), welche letztendlich zum Zusammenschmelzen der Neurotransmitter-Vesikeln mit der praesynaptischen Membran führen, und wodurch es dann zum Einströmen der Transmitter in den synaptischen Spalt kommt. Die auf der postsynaptischen Membran vorzufindenden Rezeptoren binden die entsprechenden Neurotransmitter-Moleküle, und so öffnen sie die Ionen-Kanäle. Die einströmenden Ionen ändern das Membranpotential. Wenn innerhalb eines gegebenen Zeitraumes die Zahl der anregenden Stimuli ausreichend ist, kann die EPSP den Schwellenwert erreichen, und der Neuron wird abfeuern. Dies ist bei den depolarisierenden Strömungen der Fall, deren Wirkung anregend ist. Im Fall einer hyperpolarisierenden Strömung tritt Hemmung (IPSP) auf. 3ac. Neurotransmitter (Folie 39) Die Neurotransmitter können in fünf Gruppen aufgeteilt werden: (1) Aminosäuren (hauptsächlich Glutaminsäure, GABA, Asparaginsäure und Glycin), (2) Neuropeptide (Vasopressin, Somatostatin, Neurotensin, usw.), (3) Monoamine ( Norepinefrin, Dopamin und Serotonin), bzw. (4) Acetylcholin und (5) andere Neurotransmitter. Die wichtigsten Aminosäuren im Gehirn sind Glutaminsäure (anregende) und GABA (hemmende).Es wurden schon mehr als 50 neuroaktive Peptide beschrieben, ein Teil dieser sind Hormone wie zB. luteinisierendes Hormon (LH) oder Insulin. Postsynaptische Wirkung Die Wirkung des Neurotransmitters entscheidet der Rezeptor. GABA kann zB. schnelle und langsame Hemmung herbeirufen, abhängig davon, an was für Rezeptoren sie sich anknüpfen (GABA-A Rezeptor beschleunigend, GABA-B Rezeptor langsam machend); oder: Acetylcholin kann sowohl beschleunigend, als auch verlangsamend wirken (Nikotin Rezeptor, Muskarin Rezeptor langsam wirkend). Bestimmte Neurotransmitter können sowohl erregend als auch Hemmend wirken, davon abhängend an was für Rezeptoren sie sich anknüpfen. In den meisten Fällen aber löst ein Neurotransmitter entweder ein erregendes oder ein hemmendes postsynaptisches Potential aus. Grundanforderung Seite 9 Neurale Kommunikation Eine (nicht vollständige) Liste der Neurotransmitter 1. Aminosäuren: Asparginsäure (Asp), glutaminsäure (Glu), γ-Aminobuttersäure(GABA), Glycin (Gly) 2. Acetylcholin (Ach) 3. Monoamine: Katecholamine(Dopamin, DA; Norepinefrin=Noradrenalin,NE; Epinefrin= Adrenalin, Epi), Serotonin (5-HT), Melatonin (Mel), Histamin(H) 4. Neuropeptide: Oxytocin, Vasopressin, Neuropeptid Y, Kortikotropin, Dinorfin, Endorfin, Enkefalin, Glukagon, Somatostatin, Neurokrin A+B, P „Stoff“, usw. 5. Weitere Neurotransmitter: Nitrogen Oxid (NO), Kohlenmonoxid (CO), Adenosin, ATP, GTP 3b. Rezeptoren Ein Rezeptor ist ein integriertes Membranprotein, an welches ein spezifisches Ligand anknüpfen kann, welches im Fall der Nervenzellen ein Neurotransmitter ist. Die Bindung des Liganden induziert physiologische Änderungen. 3ba. Die Arten der Rezeptoren (Folie 40-41) Anhand ihrer strukturellen und funktionalen Merkmale können diese in zwei Klassen eingeordnet werden: ionotrope und metabotrope Rezeptoren. 3.bb. Der Prototyp der Ionotropen Rezeptoren (Folie 42-43) (anders auch Nikotinischer Acetylcholin Rezeptor ligand-regulierte Ionenkanäle genannt) ist der Nikotinischer Acetylcholin Rezeptor. Dieser besteht aus fünf ProteinUntereinheiten (Pentamer).An dem Rezeptor sind zwei Acetylcholin Ankoppelstellen vorzufinden. In Folge der Acetylcholin-Ankoppelung ändert sich die räumliche Struktur des Rezeptors, was zur Öffnung der Pore führt. Die Pore ist für Na + durchdringbar. Wenn sich zu einer bestimmten Zeit genügend Kanäle öffnen, dann kann die Na+ Konzentration einen Wert erreichen, welcher für den Beginn der Herstellung eines Aktionpotentials ausreicht. Über die wichtigsten Ionotrope Rezeptoren siehezu den ionotropen Rezeptoren 3bc. Metabotrope Rezeptoren (Folie 44-46) Im Gegensatz bilden die metabotropen Rezeptoren keine Poren. Stattdessen stellen sie auf indirekter Weise, durch Signal-Transduktions Mechanismen Kontakt zu den Ion-Kanälen Zu dieser Rezeptoren-Familie gehört her. Grundanforderung unter anderem auch der Glutamat Rezeptor, der Muskarinischer Acetylcholin Rezeptor, der GABA Rezeptor, die meisten Serotonin Rezeptoren, sowie Epinephrin, Norepinephrin, Hystamin, Dopamin und die Rezeptoren der Neuropeptide. Alle metabotropen Rezeptoren sind aus sieben transmembranen Domainen Seite 10 bestehende Monomere. Neurale Kommunikation Der N-Terminus des Proteins befindet sich im extrazellularem, und der C-Terminus im intrazellularen Raum. Die Liganden der metabotropen Rezeptoren sind auch Neurotransmitter, deren Ankoppelung einen Signal-Transduktions Prozess startet. Endergebnis dieses Prozesses ist in der Regel das Öffnen oder Schliessen eines Ionenkanals. Die Ankoppelung eines Neurotransmitters (welcher auch primären Boten genannt werden kann) an den Rezeptoren verändert die räumliche Struktur dessen, und dies aktiviert einen primären Effektor (Vollzieher) Molekül (z.B. G Protein), was dann einen oder mehrere sekundäre Boten aktiviert. Da es sich hier um einen aus mehreren Schritten bestehenden Prozess handelt ist die Wirkung des Rezeptoren (z.B. auf die Öffnung der Ionenkanäle) langsamer, wie im Fall der ionotropen Rezeptoren. Die metabotropen Rezeptoren erreichen eine langzeitigere Wirkung. Weiterhin entfalten die ionotropen Rezeptoren ihre Wirkung meist nur in der Nähe des Kanals, die Metabotropen können ihre Wirkung demgegenüber auch in weiter verbreiteten Zellen spüren lassen. man unterscheidet zwei grössere gruppen der metabotropen Rezeptoren: Tyrosin Kinase und G-Protein gekoppelte Rezeptoren. 3c. Signaltransduktion in den Neuronen Die Signaltransduktion ist ein Prozess, währenddessen eine Zelle ein Signal in ein Signal anderer Natur umwandelt. Die Signaltransduktion ist meist eine Reihe von biochemischen Prozessen, welche unterschiedliche Enzyme enthalten. Diese Enzyme kommunizieren auf indirekter weise, mit sekundären Boten miteinander. Die Zeit dieser Prozesse kann von einigen Millisekunden bis zu einigen Sekunden beanspruchen. Die langsameren Prozesse wie diese, werden selten Signaltransduktion genannt. (1) Adenylcyclase sekunderes Transmitter-System (Folie 47) Das Enzym Adenylcyclase wird von einer spezifischen Familie der G-Proteine, den Gs Proteinen (s:stimulierend) aktiviert. Das Enzym katalysiert die ATP-cAMP Wandlung. Das cAMP ist ein sekundärer Botenstoff, welches frei im Zytoplasma diffundiert und sich an eine Protein Kinase A (PKA) Molekül ankoppelt, welche dadurch aktiviert wird. Das PKA phosphoriliert dem folgend zahlreiche Zielproteine, z.B. Ionenkanäle. Das Enzym erkennt an den Proteinen eine spezifische Aminosäuren-Reihenfolge. Der PhosphorilationsZustand eines Kanals bestimmt, ob der Kanal geöffnet oder geschlossen ist. Viele Kanäle öffnen sich auf die Wirkung der Phosphorilation, aber es gibt auch solche, die schliessen. Ein einziges PKA Molekül ist in der Lage mehrere Zielproteine zu phosphorilieren und dadurch die in die Zelle ankommenden Signale zu verstärken. (Folia 65-69) (2) Phosphoinositol sekundäres TransmitterSystem (Folie 48) Viele metabotrope Rezeptoren koppeln an ein Gq Protein , welches in aktivierter Form das Enzym Phospholipase C (PLC) aktiviert. Das PLC baut ein kleines, sich im Plasmamembran befindendes Phospholipid ( Phosphatidil Inositol4,5-Biphosphat;PIP2) ab, in Folge dessen dann ein sekundäres Signaltransport Molekül entsteht: Diacylglycerin (DAG) und Inositol-1,4,5-Triphosphat (IP3). DAG ist ein hydrophobes Molekül, welches sich im Membran frei bewegend das Protein Kinase C (PKC) Enzym aktiviert. Danach phosphoriliert das PKC mehrere Proteinartigkeiten, was, von den Typen abhängend, den Stoffwechsel, und die Rezeptor und Ionkanal-Funktionen beeinflusst. IP3 ist in Wasser lösbar, deshalb kann es im Zytoplasma frei diffundieren. IP3 knüpft sich an den IP3Rezeptor. Der IP3 Rezeptor ist ein Kalzium-Ionkanal, welcher sich im Membran des glatten endoplasmatischen Retikulum (SER) befindet. Der SER spielt in den Neuronen als intrazelluläres Ca2+ Lager eine wichtige Rolle. IP3 führt zur Öffnung der Rezeptoren, in Folge dessen strömt Ca2+ in das Zytoplasma. Das Ansteigen des intrazellulären Ca2+ führt zu einer Grundanforderung Seite 11 Neurale Kommunikation Reihe von unterschiedlichen Wirkungen, welche oft von den Zellentypen abhängen. In den Nervenzellen befindet sich ein Kalmodulin (CaM) genanntes Kalziumbindendes Protein. Infolge der Koppelung mit den Ca2+ aktiviert CaM mehrere Enzyme. Unter denen ist eins der wichtigsten das Kalzium-Kalmodulin-abhängige Protein Kinase II (CaMKII) Enzym. Das CaMKII, und viele weitere Kalzium-koppelnde Proteine regulieren in Folge des gestiegenen Kalziumspiegels mehrere Prozesse, unter anderem die Membranpermeabililtät und die Genexpression. (Folia 70) Extra Anforderungen 3d.Neuromodulation 3da.Hemmung Ein hemmendes Neuron kann eine Synapse sowohl auf der Axon-Terminale eines presynaptischen erregenden Neurons als auch am Zellkörper eines postsynaptischen Neurons bilden (Folie 49). 3db. Der Autorezeptor (Folie 50) ist ein Rezeptor, welcher sich am Axonende eines presynaptischen Neurons befindet, und auf die von demselben Neuron ausgestossenen Neurotransmitter empfindlich ist. Das Aufeinandertreffen des Neurotransmitters und dem Autorezeptor führt meistens zu einem Zurückkoppelungs-Prozess (negatives oder positives Feedback) in dem Ende des praesynaptischen Axons, was den Neurotransmitter-Ausstoß des Neurons moduliert. 3dc. Modulation durch Metabotrope Rezeptoren (Folie 51) in pre- und postsynaptischen Zellen. Bei einer presynaptischen Modulation kann das Neurotransmitter an ein Metabotropes Rezeptor ankoppeln, was die Art der Funktion der Autorezeptore oder anderen Mechanismen auf indirekte Weise beeinflussen kann. Die Metabotropen Rezeptore in den postsynaptischen Zellen können das EPSP oder IPSP durch Signal-Transduktions Prozesse verändern. Weiterhin können dadurch die Sensibilität der Rezeptoren verändert werden. 3dd. Neurotransmitter Inaktivation (Folie 52) Es gibt mehrere Wege, auf denen man die Neurotransmitter aus dem synaptischen Spalt entfernen kann. (1) Neuaufnahme Nachdem die Neurotransmitter in dem synaptischen Spalt angekommen sind geraten sie durch ein spezielles Membranprotein ( Neurotransmitter „reuptake“ Pumpe) in das Axonende des presynaptischen neurons zurück, wo sie wiederverwertet werden. Wenn diese Zurücknahme nicht stattinden würde, dann würden die Neurotransmitter die Abfeuerung des Neurons ständig erregen oder hemmen, was nach einer Zeit zu Desensitisierung, das heisst zum Schwinden der Sensibilität des postsynaptischen Neurons führen würde. Der Rücknahme Prozess wird auch reguliert. Die allermodernsten antidepressiva Mittel regulieren die Funktion der die Neurotransmitter zurücknehmenden Pumpe. Die selektiven Serotonin „reuptake“ Inhibitore (SSRI) hemmen in bestimmten Synapsen die Rücknahme des Serotonins. (2) Enzym degradierung Andere Neurotransmitter, wie z.B. Acetylcholin oder bestimmte Monoamine werden durch enzymatischen Abbau aus dem Synaptischen Spalt entfernt: das Acetylcholin-Estherase baut Acetylcholin ab, das Mono-Amino Oxidase (MAO) ist für den Abbau von Dopamin, Serotonin, und Norepinefrin zuständig. (3) Diffusion Die Peptid Neurotransmitter werden in der Regel durch Diffusion aus dem Synaptischen Spalt entfernt, später werden sie dann von bestimmten Proteasen abgebaut. 3de. Long-term Potential (Langzeit-Potential;0) (Folien 53-) langzeitige verstärkung von der Verbindung von zwei Zellen. In Folge von vielen Stimulationen verstärken sich die Synapsen, das kann Grundanforderung Seite 12 Neurale Kommunikation Minutenlang, aber auch stundenlang dauern. In lebenden Zellen kommt LTP auch normalerweise vor, und kann minutenlang, aber auch stundenlang anwesend sein. Der biologische Mechanismus von LTP wird hauptsächlich von der Veränderung der Proteinkinasen, Phosphatasen und der Genexpression gesichert. Das LTP macht die Plastizität des Nervensystems möglich. In der Neurobiologie bilden LTP, und dessen entgegengesetzter Prozess, „Long-term Depression“ (LTD) die zellulare Grundlage des Lernens und der Memorie. 3f. Die funktionalen Nervensysteme können auf mehrere Arten klassifiziert werden (Folie 60): zentrales- und periferisches Nervensystem, somatisches- und vegetatives (autonomes) Nervensystem. Das somatische Nervensystem kann in weitere Klassen aufgeteilt werden, dies sind senso-, moto-, und assioziative Systeme; das vegetative Nervensystem kann in das sympatische und parasympatische Nervensystem geteilt werden. Wörterverzeichnis Axonhügel, der Axonhügel ist ein spezialisierter Abschnitt des Axons, welches für die Herstellung des Aktionspotentials zuständig ist. Unter Aktionspotenial versteht man eine elektronische Ladungswelle, die am Membran des Axons entlangwandert. Depolarisation: Elektrischer Zustand der Zellen, in welchem das Innere der Zellen mit dem Ruhepotential verglichen weniger negativ wird. Eine Depolarisation einer Neuron-Membran ist möglich, wenn ein Stimulus die Spannung von -70mV in Richtung 0 senkt. Diffusion: Ist eine spontane Tendenz von einer niedrigen Konzentration in die Richtung einer höheren Konzentration (am Konzentrationsgradient entlang). Der elektrochemische Gradient verfügt über zwei Komponente. (1) Den elektrischen Komponenten bildet der Unterschied zwischen den Ladungen der zwei Seiten der Lipid-Membran. (2) Die chemischen Komponente stammen wiederum aus dem Unterschied der Konzentration der zwei Seiten der Membran. Die Kombination der zwei Faktoren schreibt die thermodynamisch optimale Richtung der Wanderung der Ionen vor. Stufenartiges Membranpotential: der Unterschied des Membranpotentials ist an einem Gradienten verteilt. Die Connexine (Gap junktion Proteine) sind Proteine die über vier transmembrane Domaine mit cytoplasmischen C und N Endungen, verfügen. Sechs Connexine bilden einen Connexon. Long-Term depression (LTD) ist eine dauerhafte (kann tagelang dauern) Abschwächung der Signalübertragung an den Synapsen von Nervenzellen. Sekundäre Transmitter sind Moleküle, die über ein niedriges Molekülegewicht verfügen, und die an Signaltransduktion teilnehmen, und die Umwandlung der eintreffenden Signale durchführen. Die semipermeable (halbdurchlässige) Membran ist eine Membran, die bestimmten Molekülen oder Ionen selektiven Durchgang durch Diffusion durchlässt. Grundanforderung Seite 13