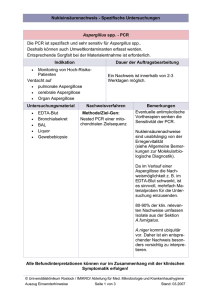
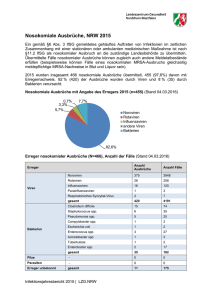
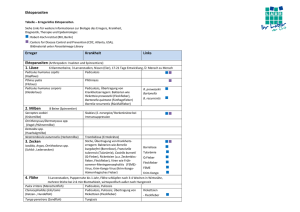
Leistungskatalog - Institut für Hygiene und Mikrobiologie
Werbung

Leistungskatalog Institut für Hygiene und Mikrobiologie der Bayerischen Julius-Maximilians-Universität zu Würzburg Stand Januar 2007 1/261 Öffnungszeiten – Ansprechpartner – Rufbereitschaft Dienstzeiten: Montag – Freitag Annahmeschluss Samstag Annahmeschluss Sonntag Annahmeschluss 8.00 – 17.00 Uhr 16.30 Uhr 8.00 – 12.00 Uhr 11.30 Uhr 8.00 – 12.00 Uhr 11.30 Uhr Rufbereitschaftsdienst: Montag – Freitag: 17.00 – 8.00 Uhr Samstag und Sonntag 12.00 – 8.00 Uhr Diensthandy: Bei eiligen Untersuchungen können die Materialien auch außerhalb der regulären Dienstzeiten verarbeitet werden. In diesen Fällen ist der Dienstarzt über die Telefonzentrale 201-13 oder über Dienst-Handy 0172 – 6633567 erreichbar. 2/261 Wichtige Adressen, Telefonanschlüsse und Funkruf __________________________________________________________________________ Telefon Funk __________________________________________________________________________ Institut für Hygiene und Mikrobiologie Institutsvorstand Prof. Dr. M. Frosch Sekretariat 46 161 Stellvertreter Prof. Dr. U. Vogel 46 803 3556 46 802 3556 46 941 3154 46 802 3556 Frau Heinrich 55 449 3361 Frau Junger 55 448 2274 Herr Kühnlein 55 448 2263 Nationales Referenzzentrum für Meningokokken Prof. Dr.U. Vogel Medizinische Mikrobiologie Frau PD Dr. Dr. Abele-Horn Krankenhaushygiene Prof. Dr.U. Vogel Hygienefachkräfte Diagnostik Institut für Hygiene und Mikrobiologie Pforte 46 918 Varialabor 46 939 Blutkultur-, Liquorlabor 46 933 TB-Labor 46 919 Pilzlabor 46 910 Stuhl-/Parasitologielabor 46 940 Serologisches Labor 46 938 DNA-Labor 46 912 __________________________________________________________________________ 3/261 Inhaltsverzeichnis: BAKTERIOLOGIE: I. II. III. Gewinnung und Versand mikrobiologischer Untersuchungsmaterialien (S. 7-23) Diagnostik von Infektionskrankheiten (S. 24-121) 1. Kardiovaskuläre Infektionen/ Sepsis / Bakteriämie (S. 24-36) 2. Neurologische Infektionen und Infektionen des ZNS (S. 37-44) 3. Infektionen der oberen Atemwege und der Ohren (S. 45-53) 4. Infektionen der tiefen Atemwege (S. 54-65) 5. Infektionen am Auge (S. 66-72) 6. Infektionen der Haut, der Weichteile, Abszesse innerer Organe und postoperative Wundinfektionen (S. 73-83) 7. Infektionen der Knochen und Gelenke (S. 84-85) 8. Infektionen der Urogenitaltraktes (S. 86-109) 9. Infektionen des Gastrointestinaltraktes (S. 109-115) 10. Infektionen durch Parasiten (S. 116-120) Diagnostik bei Infektionen mit seltenen Erregern (S. 121-165) SEROLOGIE (ab S. 166-186) I. Bakteriologie (S. 166-178) II. Mykologie (S. 179-181) III. Parasitologie (S. 182-186) HYGIENE (ab S. 187-230) I. Laboruntersuchungen für Krankenhäuser und Arztpraxen (S. 189-196) 1. Untersuchung von Dialysierflüssigkeit und Permeat (S. 189-190) 2. Kontaminationsprüfung von Arbeitsflächen, Gegenständen und Körperoberflächen (S. 191-192) 3. Hygienische Umgebungsuntersuchungen mittels Abstrichtupfer (S. 193) 4. Nachweis von Mikroorganismen zur Kontrolle der Aufbereitung von Endoskopen (S. 194-196) II. Wasser- und Abwasseruntersuchungen (S. 197-203) 1. Untersuchung von einer Rein- und Beckenwasserprobe nach DIN19643/1 (S. 197-198) 2. Untersuchung von Trinkwasser für den menschlichen Verbrauch nach der Trinkwasserverordnung (TrinkwV vom 21.05.2001) (S. 199-200) 4/261 3. Untersuchung von Abwasser nach den Richtlinien des Robert-KochInstituts (Thermische Desinfektion von Krankenhausabwasser) (S. 201-202) 4. Untersuchung von Aqua purificata nach dem Europäischen Arzneibuch (EuAB) (S. 203) III. Überprüfung der Sterilisations- und Desinfektionsleistung (S. 204-211) 1. Biologische Überprüfung von Desinfektionsgeräten (S. 204-205) 2. Biologische Überprüfung von Dampf-, Heißluft-, Gas-Sterilisatoren (Formaldehyd- und Ethylenoxid-Sterilisatoren) und Chemiklaven (S. 206-207) 3. Mikrobiologische Überprüfung von Blut und Blutkomponenten auf Sterilität (S. 208-209) 4. Prüfung auf Sterilität nach dem Europäischen Arzneibuch (EuAB) (S. 210-211) IV. Lebensmittelhygiene und dietätische Nahrungsergänzungsmittel (S. 212226) 1. Prüfung auf mikrobielle Verunreinigung bei nicht sterilen Naturprodukten oder Drogen nach dem Europäischen Arzneibuch (EuAB) (S. 212-214) 2. Reagenzien und allgemeines Vorgehen bei hygienischbakteriologischen Untersuchungen von Lebensmitteln (S. 214-216) 3. Hygienisch-bakteriologische Untersuchung von Lebensmitteln (ohne Produktspezifizierung) (S. 217-218) 4. Hygienisch-bakteriologische Untersuchung von Fleisch und Fleischerzeugnissen (außer Geflügelfleisch) (S. 219-220) 5. Nachweis von Mikroorganismen in Geflügelfleisch und Geflügelfleischerzeugnissen nach der Geflügelfleischhygiene-Verordnung (GFIHO) (S. 221-222) 6. Hygienisch-bakteriologische Untersuchung von Speiseeis (S. 223-224) 7. Hygienisch-bakteriologische Untersuchung von Kakao, Schokolade, Zuckerwaren und Rohmassen (S. 225-226) V. Lufthygienische Untersuchungen (S. 227-230) 1. Partikel- und Keimzahlbestimmung der Luft (S. 227-228) 2. Abnahme raumlufttechnischer Anlagen (S. 229-230) 5/261 MOLEKULARBIOLOGIE (ab S. 231-258) I. Präanalytik (S. 231) II. Laufzeiten bei molekularbiologischen Untersuchungen (S. 232-233) III. Angaben zu den einzelnen Untersuchungen (S. 234-258) 1. Direktnachweise von Erregern aus diagnostischen Proben (S. 234-250) 2. Molekularbiologische Methoden zur Speziesdiagnostik, Feintypisierung und Resistenztestung (S. 251 – 258) NRZM (ab S. 259-261) I. Meningokokken-Nachweis und Typisierung (S. 259-260) II. Meningokokken-Serologie (S. 260) III. Beratung u. Epidemiologie (S. 260) IV. Literatur (S. 261) 6/261 BAKTERIOLOGIE I Allgemeine Angaben zur Gewinnung und zum Transport mikrobiologischer Untersuchungsmaterialien Die Diagnose bakterieller Infektionen zählt zu den wichtigsten Aufgaben des medizinischmikrobiologischen Labors. Die Häufigkeit, die Zahl der in Frage kommenden Erreger dieser Erkrankungen und die diagnostischen Möglichkeiten haben in großem Maß zugenommen. Der vorliegende Leistungskatalog gibt in dem speziellen Teil einen Überblick über die Erregergruppen, die bei bakteriologisch verursachten Krankheitsbildern eine Bedeutung haben können. Im Hinblick auf einen gezielten Resourceneinsatz wird zwischen häufig vorkommenden und seltenen Infektionserregern unterschieden. Im Rahmen einer Stufendiagnostik sollten zuerst die häufigen Erreger untersucht und dann, bei negativem Untersuchungsergebnis, an die seltenen Erreger gedacht werden. Für Mikroorganismen, die im Institut für Hygiene und Mikrobiologie nachgewiesen werden, sind die labordiagnostischen Verfahren mit Angaben der Untersuchungsmethoden angegeben. Für Erreger, deren Untersuchungen nicht angeboten werden, die aber differentialdiagnostisch von Bedeutung sind, wird auf das Referenzlabor, in dem entsprechende Untersuchungen durchgeführt werden, verwiesen. 1. Gewinnung und Versand mikrobiologischer Untersuchungsmaterialien Die richtige Gewinnung adäquaten Untersuchungsmaterials und der sachgemäße Transport zum Labor sind die Voraussetzung für ein valides Ergebnis. Dafür müssen folgende Bedingungen erfüllt sein: 1. ausreichende Angaben auf der Untersuchungsanforderung 2. optimale Entnahme des Untersuchungsmaterials 3. adäquate Transportbedingungen 4. die Informationsübermittlung wesentlicher Patientendaten 7/261 1.1 Angaben auf dem Anforderungsschein Bitte senden Sie pro Untersuchungsmaterial einen Anforderungsschein ein ! Exakte Angaben auf dem Anforderungsschein erleichtern durch Einengen der Fragestellung die Befundbeurteilung. In einigen Fällen ergibt sich aus ihnen erst die entsprechend anzuwendende Verarbeitungstechnik (z. bei Brucellose, Legionellose). Wichtige Angaben auf dem Anforderungsschein einer bakteriologischen Probe ______________________________________________________________________ Allgemeine Daten - Name, Vorname, Geburtsdatum und Adresse des Patienten - Station und Telefonnummer des Einsenders - Telefonnummer über die eilige Befunde übermittelt werden sollen - Unterschrift des einsendenden Arztes Persönliche bzw. wesentliche Daten des Patienten - Klinische Angaben - Anamnestische Hinweise, z. B. Reiseanamnese - Diagnose oder Verdachtsdiagnose (für spezielle Fragestellungen) - Immunstatus des Patienten, z. B. Neutropenie - Vorbehandlung und aktuelle antibiotische Therapie - Erst- oder Wiederholungsuntersuchung (ggf. Datum und Ergebnis der Erstuntersuchung) - Vorbefunde Untersuchungsmaterial - Infektlokalisation - Art und Herkunft des Untersuchungsmaterials (z. B. intraoperativ entnommener Abstrich von der Gallenblase, bei Blutkulturen auch Angabe des Entnahmeorts (z. B. Vene, ZVK, Port) - Entnahmedatum, bei Blutkulturen auch Uhrzeit der Entnahme Untersuchungsanforderung - Gewünschte Untersuchung, ggf. Stufendiagnostik ______________________________________________________________________ 8/261 1.2 Gewinnung von Untersuchungsmaterialien Mangelnde Qualität des Untersuchungsmaterials führt zu einer Einschränkung der Befundqualität; unzureichende bakteriologische Befunde führen eventuell zu falschen therapeutischen und gelegentlich zu forensischen Konsequenzen. Allgemeine Grundsätze zu Entnahme und Transport von Untersuchungsmaterialien __________________________________________________________________________ - Klärung, welches Untersuchungsmaterial für die Diagnose der vorliegenden Erkrankung geeignet ist, z. B. Blutkulturen bei Sepsis. - Entnahme des Probenmaterials ohne Kontamination mit Keimen der Standortflora und Keimen aus der Umwelt, da die Anwesenheit von Standortflora zu Interpretationsschwierigkeiten bei der Befundung führen kann. - Entnahme des Probenmaterials ohne Kontakt des Untersuchungsmaterials mit Antiseptika und Desinfizientien, um eine Schädigung der Keime zu vermeiden - Entnahmezeitpunkt vor Beginn der antimikrobiellen Therapie, um falsch negative Befunde zu verhindern; eine lebensrettende Therapie hat allerdings Vorrang und sollte nicht vehindert werden! - Einsendung geeigneter Untersuchungsmengen zur Durchführung aller gewünschten Anforderungen, z. B. reicht 1 ml Liquor zur Untersuchung von Pilzen, Mykobakterien und pathogenen Keimen nicht aus. - Auswahl geeigneter Transportgefäßes, z. B. keine Abstrichröhrchen für flüssige Untersuchungsmaterialien. - Auswahl geeigneter Transportmedium, um das Austrocknen anspruchsvoll wachsender Keime oder das Absterben anaerober Keime zu verhindern. - Korrekte Beschriftung der Untersuchungsgefäße - Korrekter Umgang mit infektiösen Materialien: alle Materialien sind grundsätzlich als infektiös zu betrachten; sie müssen in sterile, dicht verschließbare und auslaufsichere Gefäße gegeben werden; der Verdacht auf Erreger mit einem hohem Infektionspotential (Brucellen, außereuropäische Pilze) müssen wegen der Gefahr der Laborinfektion dem Labor mitgeteilt werden (Personenschutz beachten! DIN 55515). - Für den Postversand müssen bezüglich der Verpackung die Richtlinien beachtet werden. __________________________________________________________________________ 9/261 1.3 Transportgefäße und Transportmedien Blutkulturflasche, aerob Verwendung: zur direkten Beimpfung von aeroben Blutkulturen BacT/ALERT FA Aerob bioMérieux Deutschland GmbH Art.-Nr. 259791 Bezug über Klinikapotheke möglich Blutkulturflasche, anaerob Verwendung: zur direkten Beimpfung von anaeroben Blutkulturen BacT/ALERT FN Anaerob bioMérieux Deutschland GmbH Art.-Nr. 259793 Bezug über Klinikapotheke möglich 10/261 Blutkulturflasche Kinder, Verwendung: zur direkten Beimpfung von Blutkulturen von Kindern BacT/ALERT PF Pediatric bioMérieux Deutschland GmbH Art.-Nr. 259794 Bezug über Klinikapotheke möglich Brain-Heart-Infusion-Medium in Glasröhrchen mit schwarzer Kappe Verwendung: zum Transport von Augenabstrichen Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 11/261 Brain-Heart Infusion-Medium in Universal-Probenröhrchen mit weißem Schraubdeckel, frei stehend Verwendung: Transport von ZVK-Spitzen von Frühgeborenen Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 Weithalsgefäße mit Herzklappenmedium Verwendung: zum Transport von intraoperativ entnommenen Herzklappen Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 12/261 Weithalsgefäße mit Thioglykolatbouillon Verwendung: zum Transport von intraoperativ entnommen Untersuchungsmaterialien der Orthopädischen Klinik Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 Uricult (Urin-Eintauch-Nährmedium) Verwendung: zur direkten Beimpfung von und Bebrütung von Urin zu bestellen über Apotheke Roche Diagnostics GmbH Art.-Nr. 1284894 Bezug über Klinikapotheke möglich 13/261 Universal-Probenröhrchen, konisch mit rotem Schraubverschluss Verwendung: zur Untersuchung von Urinproben Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Universal- Abstrichtupfer mit Transportmedium (blaue Kappe) Verwendung: Abstriche für bakteriologische und mykologische Untersuchungen mit Transportmedium für Aerobier, Anaerobier und anspruchsvoll wachsende Bakterien Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 14/261 Universal Abstrichtupfer mit Transportmedium (orange Kappe) Verwendung: besonders dünner Tupfer für die Entnahme von Untersuchungsmaterialien; mit Transport-medium für Aerobier, Anaerobier und anspruchsvoll wachsende Bakterien zur PCR von C. trachomatis Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Go-Slide Verwendung: kultureller Nachweis von Neisseria gonorrhoeae Bezug über: Becton Dickinson GmbH Art.-Nr. 273257 15/261 Objektträger zum Nachweis von Chlamydien Verwendung: zum Nachweis von Chlamydia trachomatis (Immunfluoreszenz) Weithalsgefäße mit Spezialmedium zum Nachweis von Cholera Verwendung: Alkalisches Peptonwasser zum Transport von Stuhlproben bei Verdacht auf Cholera Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 Spezialmedium zum Nachweis von Leptospiren Verwendung: zum Nachweis von Leptospiren aus Urin, Blut und Liquor Vorrätig im: Institut für Hygiene und Mikrobiologie Varia- Labor: Tel.: 201 46939 16/261 Spezialmedium zum Nachweis von Mykoplasmen Verwendung: - 10B-Medium zum kulturellen Nachweis von urogenitalen Mykoplasmen (Ureaplasma urealyticum, Mycoplasma hominis) - Hayflick-Medium zum Nachweis von Mycoplasma pneumoniae Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 Universal-Probenröhrchen mit Schraubdeckel (blauer Deckel) Verwendung: - Transport von flüssigen Untersuchungsmaterialien Punktate bei Biopsien Zusatz von wenig steriler physiologischer NaCl BAL Bronchialsekret zu beziehen: Apotheke Bezug über: Zentrallager des Uniklinikum (Petrinistraße) Tel. 201 55587 SAP-Nr. 10104808 17/261 Universal-Probenröhrchen mit weißem Schraubdeckel, frei stehend Verwendung: zum Nachweis von Bakterien aus Sekreten des Respirationstraktes Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Stuhlröhrchen mit Löffel Verwendung: Transport und Untersuchung von Stuhl Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 18/261 Magensaftröhrchen Verwendung: zur Untersuchung von Magensaft auf Mycobacterium tuberculosis enthält 2 ml an 70%igem Tri-Natriumphosphat zur Pufferung Bezug über: Institut für Hygiene und Mikrobiologie Pforte Tel.: 201 46918 Nährbodenküche Tel.: 201 46707 1.4 Transport und Lagerung von Untersuchungsmaterialien Zur Vermeidung von Qualitätseinbußen (quantitative Bewertung, Absterben sensibler Erreger) wird die Verarbeitung des Materials innerhalb weniger Stunden nach der Entnahme (optimal bis zu 2 Stunden) dringend empfohlen. Bei einem längeren Transport sollten geeignete Transportmittel verwendet werden. Die Anlage der Materialien sollte bis spätestens 24 Stunden nach der Abnahme angestrebt werden; innerhalb dieses Zeitraumes können die meisten Materialien bei Raumtemperatur gelagert werden. Anspruchsvoll wachsende Mikroorganismen wie Shigellen, Gonokokken oder Meningokokken und Anaerobier sind besonders anfällig gegen Umwelteinflüsse und sterben nach der Entnahme der Untersuchungsmaterialien sehr schnell ab. Um dies zu verhindern, müssen die Proben bei längerem Transport entweder sofort ins Labor gebracht werden, oder aber in einem geeigneten Transportmedium gelagert und transportiert werden. Die Lagerung bei Kühlschranktemperatur ist nur dann zu empfehlen, wenn zwischen Materialentnahme und Transport mehr als 12 Stunden liegen sowie bei Außentemperaturen von mehr als 20°C. Bei der Lagerung im Kühlschrank besteht die Gefahr, dass empfindliche Erreger (Anaerobier, Pneumokokken, Haemophilus usw.) absterben oder so geschäigt werden, dass die kulturelle Anzucht nur schwer oder nicht mehr möglich ist. Dies trifft zu für Wunden, Abszesse, Infektionen aus dem Respirationstrakt. 19/261 Zum Nachweis der hier aufgeführten anspruchsvoll wachsenden Mikroorganismen müssen mit Ausnahme der Anaerobier zusätzlich zu den Routine-Untersuchungsmaterialien gesonderte Proben abgenommen und in den aufgeführten speziellen Transportmedien verschickt werden. 20/261 Versand und Lagerungsbedíngungen für bakteriologische Untersuchungsproben __________________________________________________________________________________ Untersuchungsmaterial Transportmedium Untersuchungs- Transport Lagerung methode __________________________________________________________________________________ Blut/Liquor Blut für Blutkulturen direkte Beimpfung Kultur, (PCR) ≤ 2 h, RT ≤ 24 h, 25°C (RT) Katheterspitzen: Erwachsene in sterilem Gefäß Kultur ≤ 2 h, RT nicht möglich Frühgeborene Brain-Heart-Bouillon Kultur ≤ 2 h, RT ≤ 24 h, 37°C nativ Kultur ≤ 1 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, Knochenmark Liquor 25°C (RT) Unterer Respirationstrakt 1 Sputum auf Bakterien nativ Kultur (PCR) ≤ 2 h, RT ≤ 24 h, 4°C Sputum Mykobakterien nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Sputum auf Pilze nativ Kultur (AG, PCR) ≤ 2 h, RT ≤ 24 h, 4°C Bronchialsekret nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Trachealsekret, BAL nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Rachenspülwasser nativ Kultur, PCR ≤ 2 h, RT ≤ 24 h, 4°C Aspirate Trachea anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, 4°C Oberer Respirationstrakt1 Aspirate Nebenhöhlen anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Material Nasopharynx aerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Innenohrabstriche aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Abstriche Otitis externa aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, 4°C Rachenabstrich aerobes TM Kultur, Mikroskopie ≤ 2 h, RT ≤ 24 h, RT Nasenabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Mundabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Dentogene Abszesse anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Bindehautabstriche aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Augenkammerwasser sofortiger Transport Kultur ≤ 2 h, RT nicht möglich Hornhautgeschabsel sofortiger Transport Kultur, Mikroskopie ≤ 2 h, RT nicht möglich Augen __________________________________________________________________________________ 21/261 ________________________________________________________________________________ Untersuchungsmaterial Transportmedium Untersuchungs- Transport Lagerung methode __________________________________________________________________________________ Urogenitaltrakt Urin nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Uricult Eintauchkultur Kultur ≤ 2 h, RT ≤ 24 h, 37°C Dialysat nativ Kultur ≤ 2 h, RT nicht möglich in BK-Flaschen Kultur ≤ 2 h, RT ≤ 24 h, 37°C Material aus Genitaltrakt aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Vaginalabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Zervixabstrich anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT intraoperatives Material anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Urethralabstrich aerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Prostatasekret aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Verbrennungswunden aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, 4°C Ulcus anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Fisteln nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen, TM Kultur ≤ 2 h, RT ≤ 24 h, RT nativ Kultur ≤ 2 h, RT nicht möglich in Blutkulturen, TM Kultur ≤ 2 h, RT ≤ 24 h, RT Intraoperative Materialien anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Galle, Abszessmaterial anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Campylobacter, nativ Kultur ≤ 4 h, RT nicht möglich Cholera, Shigellen aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT andere Bakterien nativ Kultur ≤ 2 h, RT ≤ 24 h, 4°C Rektumabstrich aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Magensaft auf Tbc nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Tri-Natriumphosphat Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Helicobacter/Stuhl nativ Kultur ≤ 4 h, RT nicht möglich Helicobacter/Biospie nativ Kultur ≤ 1 h, RT nicht möglich Spezial-TM Kultur ≤ 1 h, RT ≤ 4 h, 4°C Wunden Sekrete Intraoperatives Material Gastrointestinaltrakt Stuhl zum Nachweis von: __________________________________________________________________________________ 22/261 __________________________________________________________________________________ Untersuchungsmaterial Transportmedium Untersuchungs- Transport Lagerung methode __________________________________________________________________________________ Sterile Kompartimente nativ Kultur, PCR ≤ 2 h, RT nicht möglich in Blutkulturen Kultur ≤ 2 h, RT ≤ 24 h, RT Punktate anaerobes TM Kultur, PCR ≤ 2 h, RT ≤ 24 h, RT Biopsate von aerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT anaerobes TM Kultur ≤ 2 h, RT ≤ 24 h, RT Synovialflüssigkeit2 2 Verbrennungen Gewebe _____________________________________________________________________________ BAL = broncho-alveoläre Lavage, D = direkte Beimpfung, RT = Raumtemperatur, TM = Transportme-dium 1 Bei längerem Transport (≥ 12 h oder über Nacht) sollte die Lagerung bei 4°C erfolgen, um ein Überwuchern derätiologisch bedeutsamen Flora durch Keime der Normalflora zu verhindern. Allerdings besteht dadurch die Gefahr, daß empfindliche Keime absterben. 2 Bei längerem Transport empfiehlt sich das Einimpfen in Blutkulturflaschen. 23/261 II Diagnostik von Infektionskrankheiten 1. Kardiovaskuläre Infektionen / Sepsis / Bakteriämie Die Diagnose der kardiovaskulären Infektionen erfolgt mittels Erregernachweis aus Blut. 1.1 Blutkulturen Indikation für die Abnahme von Blutkulturen V. a. Sepsis oder septischer Schock, V. a. Bakteriämie, Fungämie, Endokarditis (Verdachtsdiagnose immer auf dem Antragsformular vermerken, da Blutukulturen bei Endokarditis länger bebrütet werden müssen), bei Fieber unklarer Genese (FUO; fever of unknown origin). Darüber hinaus sollten Blutkulturen neben den Kulturen von Liquor, Sputum, Urin, Wundabstrichen und Punktaten bei folgenden Erkrankungen entnommen werden: Meningitis, Pneumonie, Pyelonephritis, Osteomyelitis, eitrige Arthritis, Epiglottitis, Omphalitis bei Neugeborenen, Abszess und Phlegmone. Bei Erregerwechsel oder Fungämie ist auch eine unter antibiotischer Therapie entnommene Blutkultur sinnvoll. Zeitpunkt der Abnahme von Blutkulturen - möglichst frühzeitig im Fieberanstieg (größte Keimdichte bei ständiger Anwesenheit der Erreger im Blut etwa eine Stunde vor dem Fieberanstieg; auf dem Höhepunkt des Fiebers sind die Erreger häufig nicht mehr nachweisbar) - vor Beginn einer antibiotischen Therapie - bei der Blutabnahme unter einer antibiotischen Therapie empfiehlt sich die Abnahme vor einer erneuten Antibiotika-Applikation (Zeitpunkt der niedrigsten Antibiotikaspiegel) - bei Fieber mit Continua mehrere Abnahmen im Abstand von mindestens 15 min; in Ausnahmefällen alle 3 Blutkulturen innerhalb von 30 min abnehmen! - bei neutropenischen Patienten und immunsupprimierten Kindern ist es sinnvoll, die Entnahme von einer bestimmten Fieberhöhe, z. B. 38,5°C, abhängig zu machen. 24/261 Probengefäß - Blutkulturflaschen ; vor Gebrauch auf Raumtemepratur oder auf 37°C vorwärmen. - Bei Verdacht auf eine Fungämie sollten keine Blutkulturflaschen mit Kunstharz verwendet werden. - Herzklappen-Medium für intraoperativ entnommene Herzklappen. Entnahmetechnik Die Blutentnahme erfolgt üblicherweise durch Punktion einer peripheren Vene. Da die Kontaminationsrate bei Blutkulturen, die über einen intravasalen Katheter abgenommen wurden, höher sind, sollte die Entnahme über einen liegenden Gefäßkatheter nur dann erfolgen, wenn der Verdacht auf eine Katheter-assoziierte Infektion vorliegt. In diesem Fall müssen zwei Blutkulturpärchen (aus ZVK und peripher) abgenommen werden. Bei Neugeborenen kann während der ersten Lebensstunden auch die Entnahme über einen Nabelarterienkatheter sinnvoll sein. Die Kultur von arteriellem Blut bringt bei Fungämie keine Vorteile. Abnahme Blutkulturen sollten mit sterilen Einmalhandschuhen entnommen werden. Vor der Entnahme muss eine Händedesinfektion und eine Hautdesinfektion der Punktionsstelle erfolgen. Die Hautdesinfektion der Punktionsstelle wird zunächst mit 70%-igem Ethanol durchgeführt. Die Einwirkungszeit beträgt mindestens 2 Minuten, alternativ bis zur Trocknung des Ethanols. Anschließend erfolgt erneut eine Hautdesinfektion – konzentrisch vom Zentrum der desinfizierenden Fläche nach außen – mit 70%-igem Ehanol mittels sterilem Tupfer. Eine nochmalige Palpation der Punktionsstelle sollte vermieden werden. Nach einer Fehlpunktion muss die Kanüle gewechselt werden. Beimpfen der Blutkulturflaschen Nach Entfernen der Schutzkappen muss der darunterliegende Gummi mit Ethanol desinfiziert werden (Einwirkzeiten beachten!). Die Beimpfung der Flaschen muss zur Reduktion der Kontaminationsrate mit einer neuen, ausgetauschten Kanüle erfolgen. Das Blut wird auf zwei Kultursysteme (aerobe und anaerobe Keime) verteilt. Reicht die entnommene Blutmenge nur für ein System aus, so sollte der aeroben Blutkulturflasche der Vorrang gegeben werden. Zuerst die anaeroben, dann die aeroben Flaschen beimpfen! Die Belüftung der aeroben Blutkulturflaschen ist bei den neuen Blutkultursystemen nicht mehr notwendig. 25/261 Blutvolumen Das Verhältnis von Blut und Kulturmedium sollte etwa 1 : 5 bis 1 : 10 sein (Neutralisation der bakteriziden Wirkung des Serums): Erwachsene: 10 – 12 ml (je 5 – 6 ml für eine aerobe und anaerobe Flasche) Kleinkinder: 3 – 4 ml (je 2 ml für eine aerobe und anaerobe Flasche für Kinder) Säuglinge: 1 - 2 ml (je 1 ml in eine aerobe und anaerobe Flasche für Kinder) Frühgeborene: 0.5 ml (nur aerob) Anzahl der Blutkulturflaschen Bei Sepsis 3 Blutkulturpärchen (je 3 aerobe und anaerobe Flaschen) innerhalb von 10 min abnehmen; die Abnahme einer größeren Zahl verbessert die Ausbeute nicht. Bei akuter Endokarditis in rascher Folge Abnahme von 3 Pärchen in 1 – 2 h, bei subakuter Endokarditis Abnahme von 3 Pärchen innerhalb von 24 h. Bei Fieber unklarer Genese 3 Blutkulturpärchen in 24 h, wenn negativ weitere 3 Pärchen in 24 h. Lagerung und Versand Der Transport der beimpften Blutkulturflaschen muss sofort und gegen Abkühlung geschützt erfolgen (< 2 h). Wenn dies nicht möglich ist, sollten die Blutkulturflaschen bis zum Versand bei Raumtemperatur (25°C) aufbewahrt werden. Versehentlich vorinkubierte Flaschen werden im Labor besonders bearbeitet, um ein positives Ergebnis zu gewährleisten. Es muss daher auf dem Antragsformular vermerkt werden, ob und wie lange Blutkulturflaschen vorinkubiert wurden. Fehlermöglichkeiten bei der Abnahme von Blutkulturen Falsch positive Ergebnisse: unzureichende Händedesinfektion, Kontamination durch verunreinigten Gummistopfen oder bei der Belüftung Falsch negative Ergebnisse: vorbestehende Antibiotikatherapie, zu großes Blutvolumen, zu lange Transportzeit, zu niedrige Temperatur während des Transportes Interpretation Nicht alle positiven Blutkulturen sind klinisch relevant; in etwa 2 – 3% der Fälle liegt eine abnahmebedingte Kontamination durch Hautflora vor. Hinweis für die klinische Relevanz des nachgewiesenen Erregers in der Blutkultur gibt der Erregernachweis in mehreren 26/261 Blutkulturflaschen oder der Nachweis desselben Erregers aus anderen Untersuchungsmaterialien, z. B. Urin. Zu den häufigen Kontaminanten von Blutkulturen zählen:; - koagulasenegative Staphylokokken (meist Staphylococcus epidermidis) - Korynebakterien (Achtung: Corynebacterium jeikeium bei Patienten mit Malignomen!) aerobe apathogene Sporenbildner - Propionibakterien (anaerobe Hautflora) - α- oder nicht-hämolysierende Streptokokken (Achtung: können Erreger einer subakuten Endokarditis oder Sepsis bei Neutropenie sein!). Wenn diese Erreger nur in einer Blutkulturflasche nachgewiesen werden, ist die Bedeutung des Befundes fraglich. Allerdings können sie bei immunsupprimierten Patienten eine Rolle spielen. Dauer der Untersuchung Erstablesung positiver Flaschen nach 12 - 24 h, Differenzierung und Erstellung des Antibiogramms der isolierten Keime erfolgt nach 48 –72 h, Endablesung negativer Flaschen in der Regel nach 7 Tagen, in Ausnahmefällen wie Endokarditis oder bei V. a. langsam wachsende Mikroorganismen nach 21 Tagen. Bei mikroskopischem oder kulturellem Nachweis von Mikroorganismen aus Blutkulturen wird der Einsender sofort benachrichtigt ! 1.2 Nativblut Indikation Malaria, Infektion durch Mykobakterien, Trypanosomiasis, Filariose, Leptospirose Probengefäß Universal-Probenröhrchen, konisch mit rotem Schraubverschluss 27/261 Abnahme Entnahme von Blut mit steriler Kanüle aus Vene oder aus einem liegenden venösen Katheter - Malaria: 5 ml EDTA-Blut - Tuberkulose: 10 ml Citrat-Blut - Trypanosomen: 5 ml EDTA-Blut - Filariose: 5 ml EDTA-Blut, ggf. nächtliche Blutentnahme, um die Periodizität der Erreger zu berücksichtigen (Rücksprache mit dem Labor) Transport bei Raumtemperatur bis zu 24 h 1.3 Herzklappen Probengefäß Weithalsgefäß mit Brain-Heart-Infusion-Bouillon (anzufordern unter Tel. 46939) Abnahme Herzklappen intraoperativ steril entnehmen und in das Gefäß überführen. Transport Der Transport muss innerhalb von 2 h bei Raumtemperatur erfolgen, eine längere Lagerung ist bei 37°C (bis zu 24 h) möglich. Dauer der Untersuchung Ein negativer Befund wird nach 3 –4 Wochen erstellt. 1.4 Knochenmark Probengefäß Serile Spritze mit Schraubdeckel oder Blutkulturflaschen 28/261 Abnahme - Beckenkammpunktion und Strenalpunktion unter strengster Beachtung der Hygienevorschriften - zur Punktion des hinteren Beckenkamms liegt der Patient in Seitenlage - Hände gründlich desinfizieren - Anziehen steriler Handschuhe und Abdecken der Punktionsstelle mit einem sterilen Tuch - Lokalanästhesie und Infiltration des Periosts unter Aspiration - 3-4 mm große Hautinzision mittels Skalpell und Vorschieben der Punktionsnadel unter druckvollen Drehbewegungen senkrecht bis auf das Periost. Punktionsrichtung ist hinten 15° nach kaudal und vorne 15° nach kranial - Nach Passieren der Kompakta Herausziehen des Obturators (enthält Knochenbiopsat für die hämatologische Diagnostik) und Aspiration von Knochenmark mit einer sterilen Spritze (Vorlage von EDTA zur Untersuchung von Parasiten) - Entfernen der Nadel und Kompression der Punktionsstelle mit sterilen Tupfern - Anlage eines sterilen Verbandes - Lagerung des Patienten auf einem Sandsack - Knochenmark in Blutkulturflaschen einimpfen oder nativ in der Spritze transportieren oder auf Objektträger ausstreichen. Transport Umgehender Transport der Proben bei Raumtemperatur. Eine Zwischenlagerung ist nur in Blutkulturflaschen oder auf Objektträgern möglich. Kleinere Mengen direkt in Flüssigmedien einbringen. 1.5 Perikardpunktat Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss. Untersuchungsmethode - Kultur - universelle PCR 29/261 Abnahme - strengste Beachtung der Hygienevorschriften - Ortung des Ergusses mittels Echokardiographie - Lokalanästhesie der Punktionsstelle und Punktion unter sterilen Kautelen mit einer dicklumigen Nadel mit aufgesetzter Spritze - Abnahme der Punktatsflüssigkeit und Verteilen in die Probengefäße - Entfernen der Kanüle und Anlegen eines sterilen Verbandes Transport Sofortiger Transport bei Raumtemperatur. Eine Zwischenlagerung ist nicht möglich. Dauer der Untersuchung Ein negativer Befund wird nach 21 Tagen erstellt. 1.6 Schrittmacher Probengefäß Weithalsgefäß mit Brain-Heart-Infusion-Bouillon Abnahme Schrittmacher unter sterilen Bedingungen entnehmen und in Transportgefäß überführen. Transport Bei Raumtemperatur innerhalb von 24 h. Weiterführende Diagnostik bei Infektionen mit ungewöhnlichen Erregern - Aspergillus spp. - Bartonalla spp. - Brucella spp. - Leptospira spp. - Mycoplasma hominis - Mycobacterium spp, - Ureaplasma urealyticum 30/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Bakteriämie und Sepsis häufige Erreger: E. coli Blut 0 + + 0 0 0 S. aureus Blut 0 + + 0 0 0 S. pneumoniae Blut 0 + + + 0 0 Enterococcus spp. Blut 0 + + 0 0 0 koagulasenegative Staphylokokken Blut 0 + + 0 0 0 Klebsiella spp. Blut 0 + + 0 0 0 Enterobacter spp. Blut 0 + + 0 0 0 Haemophilus influenzae Blut 0 + + + 0 0 Salmonella spp. Blut 0 + + 0 0 + Pseudomonas aeruginosa Blut 0 + + 0 0 0 Neisseria meningitidis Blut 0 ++ + + 0 0 Candida spp. Blut 0 ++ + + 0 + Malassezia furfur Blut 0 + + 0 0 0 Anaerobier Blut 0 + + 0 0 0 Blut 0 + + 0 0 0 Nutritionally variant streptococci (NVS) Blut 0 + + 0 0 0 Enterococcus faecalis Blut 0 + + 0 0 0 Enterococcus spp. Blut 0 + + 0 0 0 Staphylococcus aureus Blut 0 + + 0 0 0 Enterobacteriaceae Blut 0 + + 0 0 0 seltene Erreger: (Bacteroides, Fusobakterien, Prevotella) Endokarditis Subakute Endokarditis/häufige Erreger Streptokokken der Viridansgruppe (u. a. S. sanguis, S. salivarius, S. mutans Akute Endokarditis/häufige Erreger __________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = Mikroskopie nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Kultur: nach Anzüchtung Identifizierung und Erstellung eines Antibiogramms 31/261 __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Akute Endokarditis/ seltene Erreger Neisseria spp. Blut 0 ++ + 0 0 0 Coxiella burnetii Blut 0 0 0 0 0 + *Brucella spp. (!) Blut 0 + + 0 0 + Candida spp. Blut 0 ++ + + 0 + *Bartonella spp. Blut Speziallabor Haemophilus influenzae Blut 0 + + 0 0 0 Haemophilus spp. Blut 0 + + 0 0 0 Actinobacillus spp. Blut 0 + + 0 0 0 Eikenella corodens Blut 0 + + 0 0 0 Cardiobacterium homins Blut 0 + + 0 0 0 Kingella spp. Blut 0 + + 0 0 0 Pseudomonas aeruginosa Blut 0 + + 0 0 0 Staphylococcus aureus Blut 0 + + 0 0 0 Candida spp. Blut 0 ++ + + 0 + Enterococcus faecalis Blut 0 + + 0 0 0 Streptokokken der Viridansgruppe Blut 0 + + 0 0 0 koagulasenegative Staphylokokken Blut 0 + + 0 0 0 Staphylococcus epidermidis Blut 0 + + 0 0 0 Staphylococcus aureus Blut 0 + + 0 0 0 Enterobacteriaceae Blut 0 + + 0 0 0 Candida spp. Blut 0 ++ + + 0 + Streptokokken der Viridansgruppe Blut 0 + + 0 0 0 Enterococcus faecalis Blut 0 + + 0 0 0 Corynebacterium spp. Blut 0 + + 0 0 0 *Bakterien der HACEK-Gruppe: Endokarditis bei Drogenabhängigen Endokarditis bei Klappenersatz Early onset __________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = Mikroskopie nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 32/261 __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Late onset Staphylococcus epidermidis Blut 0 + + 0 0 0 Staphylococcus aureus Blut 0 + + 0 0 0 Enterobacteriaceae Blut 0 + + 0 0 0 Candida spp. Blut 0 ++ + + 0 + Legionella spp. Blut 0 0 + 0 0 + Staphylococcus aureus Blut 0 + + 0 0 0 Streptococcus pneumoniae Blut 0 + + 0 0 0 Streptokokken der Gruppe A Blut 0 + + 0 0 0 Escherichia coli Blut 0 + + 0 0 0 Pseudomonas aeruginosa Blut 0 + + 0 0 0 Salmonella spp. Blut 0 + + 0 0 + Shigella spp. Blut 0 + + 0 0 0 Neisseria meningitidis Blut 0 ++ + 0 0 0 *Histoplasma capsulatum (!) Blut 0 + + 0 0 + Mycoplasma pneumoniae Blut 0 0 0 0 0 + Chlamydia pneumoniae Blut 0 0 0 0 0 + Candida spp. Blut 0 ++ + + 0 + *Mycobacterium tuberculosis (!) Blut 0 ++ + 0 0 0 Echinococcus granulosus Blut 0 0 0 0 0 + Entamoeba histolytica Blut 0 0 0 0 0 + Toxoplasma gondii Blut 0 0 0 0 0 + Trichinella spiralis Blut 0 0 0 0 0 + Perikarditis häufige Erreger seltene Erreger __________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = Mikroskopie nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, (!) =Keime der Risikogruppe 3, * = langsames Wachstum 33/261 1. 7 Intravaskuläre Katheter Intravaskuläre Katheter werden in 2 Kategorien unterteilt: solche für kurzeitigen (ein- oder mehrlumige Silikon- oder Polyurethankatheter) und solche für längerfristigen Einsatz; letztere müssen in der Regel chirurgisch implantiert werden. Zu den Langzeitkathetern gehören Hickman-Katheter, Broviac-Katheter, Port-Systeme. Da die Katheter schwer ersetzbar sind, sollten zunächst alle diagnostischen Möglichkeiten am noch liegenden Katheter ausgeschöpft werden. Zur Diagnose einer Katheter-bedingten Infektion erscheint die Bestimmung der DTTP (detection time till positivity)-Zeit durch Gewinnung von Blutkulturen aus dem Katheter und zeitgleich aus einer Vene am sinnvollsten. Bei Langzeitkathetern können auch schnell wachsende Mykobakterien, Pilze und Anaerobier eine Rolle spielen. Malassezia furfur kann bei Neu- und Frühgeborenen, die eine lipidreiche parenterale Ernährung erhalten, Katheter-assoziierte Infektionen verursachen. Da diese Keime eine Subkultivierung auf Spezialnährmedien erfordern, muss ein klinischer Verdacht dem Labor mitgeteilt werden. Indikation zur mikrobiologischen Untersuchung Bei Verdacht auf Katheter-assoziierte Infektionen muss der Katheter gezogen und zur Untersuchung in die Mikrobiologie gesandt werden. Ist dies nicht möglich, sollte die DTTP bestimmt werden. Probengefäß Erwachsene: steriles Transportgefäß ohne Transportmedium Frühgeborene: Brain-Heart-Infusion-Medium Entnahmetechnik - Einmalhandschuhe anziehen - Katheter mit einer sterilen Pinzette vorsichtig ziehen. Dabei darauf achten, dass die Spitze nicht mit unsterilem Material in Kontakt kommt - Transportgefäß öffnen - Katheterspitze (4-6cm) mit einer sterilen Schere vorsichtig abschneiden und in das Gefäß fallen lassen - Transportgefäß verschließen. 34/261 Die heute übliche mikrobiologische Methode zur Untersuchung von Venenkathetern ist die Agar-Roll-Technik nach Maki. Sie erlaubt eine semiquantitative Bestimmung der Bakterien. Versand Der Transport muss rasch ohne Transportmedium erfolgen (< 15 min). Ist dies nicht möglich, muss der Katheter bei 4°C gelagert werden (optimal 2 h, maximal 24 h). Katheter von Frühgeborenen werden in eine Brain-Heart-Infusion-Bouillon überführt und sofort ins Labor gebracht. Ist dies nicht möglich sollten die Bouillonen bei 37°C bebrütet werden. Interpretation Der Nachweis von Mikroorganismen in einer Keimzahl von ≥ 15 Kolonien/Katheterspitze gilt als klinisch relevante Besiedlung und ist bei vorliegender klinischer Symptomatik oder lokalen Infektionszeichen wahrscheinlich mit einer Katheterinfektion assoziiert. Weniger als 15 Kolonien/Katheterspitze sprechen für eine Kontamination. Beim Nachweis von Korynebakterien, Propionibakterien, Bacillus spp. und von koagulasenegativen Staphylokokken ist die klinische Bedeutung des Befundes fraglich, inbesondere dann, wenn die Erreger nur aus einer Blutkulturflasche isoliert wurden. DTTP Es wird die zeitliche Differenz zwischen dem Positivwerden der aus dem Katheter entnommen Blutkultur und der aus der Peripherie entnommenen Blutkultur bestimmt. Voraussetzung für diese Untersuchung ist die zeitgleiche Abnahme der Blutkulturen. Patienten mit einer katheterbedingten Infektion zeigen in der Katheterkultur schneller ein positives Ergebnis als in der peripher abgenommen Blutkulturen. Die Differenz muss > 2 h sein. 1.8 CAP-Dialysat Bei CAP-Dialysaten handelt es sich um hypertone Lösungen. Um ein Absterben oder eine Schädigung der Mikroorganismen zu verhindern, sollten die CAP-Dialysate sofort nach der Abnahme in das Labor gebracht werden oder aber schon auf der Station in Blutkulturflaschen geimpft werden (5 – 10 ml, Verdünnungseffekt der hypertonen Lösung und optimales Wachstumsmedium für Mikroorganismen). 35/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Angewandte Nachweisverfahren ---------------------------------------------Material TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Kurzzeitkatheter häufige Erreger: koagulaseneg. Staphylokokken ZVK-Spitze 0 --- + 0 0 0 Staphylococcus aureus ZVK-Spitze 0 --- + 0 0 0 Enterococcus spp. ZVK-Spitze 0 --- + 0 0 0 Candida spp. ZVK-Spitze 0 --- + 0 0 0 Enterobacteriaceae ZVK-Spitze 0 --- + 0 0 0 Malassezia furfur ZVK-Spitze 0 --- + 0 0 0 koagulaseneg. Staphylokokken Blut (ZVK, peripher) 0 --- + 0 0 0 seltene Erreger: Langzeitkatheter häufige Erreger: Staphylococcus aureus Blut (ZVK, peripher) 0 --- + 0 0 0 Enterococcus spp. Blut (ZVK, peripher) 0 --- + 0 0 0 Candida spp. Blut (ZVK, peripher) 0 --- + + 0 + Enterobacteriaceae Blut (ZVK, peripher) 0 --- + 0 0 0 atypische Mykobakterien Blut (ZVK, peripher) 0 --- + 0 0 0 Anaerobier Blut (ZVK, peripher) 0 --- + 0 0 0 Acinetobacter spp. Blut (ZVK, peripher) 0 --- + 0 0 0 Alcaligenes spp. Blut (ZVK, peripher) 0 --- + 0 0 0 seltene Erreger: _________________________________________________________________________ TM = Transportmedium, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose rlauben, --- = Mikroskopie nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, (!) = Keime der Risikogruppe 3 36/261 2. Neurologische Infektionen und Infektionen des ZNS Indikation für die Untersuchung von Liquor und Hirnbiopsien Eine Lumbalpunktion sollte bei allen akuten und chronischen entzündlichen neurologischen Erkrankungen durchgeführt werden, u. a. bei Meningitis, Meningoenzephalitis, Enzephalitis, Ventrikulitis, Hirnabszessen, Hirnnervenlähmungen, Myelitis transversa, bei unklarem Fieber und bei unklaren Krämpfen. Kontraindikationen sind erhöhter intrakranieller Druck (Stauungspapille) und Gerinnungsstörungen. Eine relative Kontraindikation ist ein kontaminiertes bzw. infiziertes Punktionsgebiet. 2.1 Liquor Zeitpunkt der Lumbalpunktion Die Lumbalpunktion sollte bei akuten Entzündungen vor einer antibiotischen Therapie erfolgen. Ist eine Lumbalpunktion nicht möglich, sollte auf jeden Fall eine Blutkultur entnommen werden, da 90% der bakteriellen Meningitiden im Rahmen einer Bakteriämie oder Sepsis ablaufen. Eine Kontrollpunktion nach 12 – 48 Stunden ist indiziert nach Einsenden einer für die Diagnostik zu geringen Liquormenge (z. B. bei Verdacht auf Tuberkulose), bei zweifelhaftem oder ungewöhnlichen Initialbefund, beim Nachweis von resistenten Erregern oder von Keimen mit einer ungewöhnlichen Resistenz (Kontrolle), bei klinischer Verschlechterung des Krankheitszustandes trotz adäquater Therapie und in Ausnahmefällen zur Beurteilung der Effizienz der Therapie. Probengefäß - Universal-Röhrchen aus Kunststoff mit blauem Schraubdeckelverschluss. - Pilzantigene können an der Oberfläche des Kunststoffgefäßes adhärieren und dadurch den Nachweis von Pilzantigenen erschweren. Bei dringendem Verdacht auf eine Pilzinfektion verwende man daher besser Glasgefäße. Diese müssen dann unter entsprechenden Vorsichtsmaßnahmen ins mikrobiologische Labor transportiert werden. Liquorgewinnung Üblicherweise wird Liquor durch Lumbalpunktion, in selteneren Fällen durch Ventrikel- oder Subokzipitalpunktion gewonnen. In Sonderfällen kann Liquor auch aus Ableitungssystemen 37/261 (Shuntliquor) gewonnen werden. Es sollte nach Möglichkeit kein blutiger Liquor eingesetzt werden. Vorgehen bei Lumbalpunktion - Hygienische Händedesinfektion - Mundschutz (notwendig für Untersuchungen mittels PCR) - Reinigung und Hautdesinfektion der Punktionsstelle (L4/5 oder L3/4) (70%-iger Alkohol, konzentrisches Auftragen, Einwirkzeit 2 Minuten) - sterile Einmalhandschuhe - nach der Punktion Entfernung evtl. PVP-Jod-Reste mittels Aethanol getränktem Tupfer und Abdecken der Punktionsstelle mit sterilem Verbandsmaterial Liquorvolumen Wenn immer möglich, sollten die für entsprechende mikrobiologischen Untersuchungen vorgeschriebenen Mindestmengen eingesandt werden. Nur so ist mit einem positiven Untersuchungsergebnis zu rechnen! Falls nur wenig Liquor zur Verfügung steht, sollten Prioritäten für den Nachweis der mit größter Wahrscheinlichkeit in Frage kommenden Erreger gesetzt werden. Mindestvolumen: - Bakterien ≥ 1 ml - Pilze ≥ 2 ml - Parasiten ≥ 5 ml - Mykobakterien ≥ 5 ml, besser 10 – 15 ml (je 5 ml für Mikroskopie, Kultur und PCR); Bei negativer Mikroskopie und bestehendem Verdacht auf eine tuberkulöse Meningitis, sollte erneut Liquor gewonnen und mindestens 15 ml für die Kultur verarbeitet werden. Ist nur wenig Liquor vorhanden, so ist der Kultur der Vorrang zu geben. Die Kultur gilt nach wie vor als Goldstandard, sie hat die größte Sensitivität. Lagerung und Versand Der Transport der Liquorproben zum Nachweis von Bakterien muss unverzüglich bei Raumtemperatur und vor Licht geschützt erfolgen (innerhalb von maximal 2 h). Ist ein sofortiger Transport nicht möglich, so wird ein Aliquot des Liquors in Blutkulturflaschen eingeimpft (Lagerung bis zu 24 h bei Raumtemperatur möglich). Da unter diesen Umständen einige Untersuchungen nicht möglich sind (mikroskopisches Präparat, Antigennachweis, quantitative Bestimmung der Erreger, Nachweis von Viren, Nachweis von Parasiten), sollte 38/261 außerdem nativer Liquor parallel eingesandt werden. Zum Nachweis von Viren, Mykobakterien, Parasiten, Pilzen und Nukleinsäuren Lagerung und nach Möglichkeit auch Versand des Liquors bei 4°C (maximal 24 h). Bei Verdacht auf Parasiten und Pilze Liquor nicht tieffrieren. 2.2 Abszessmaterial von Hirnabszessen Hirnabszesse werden in erster Linie von Anaerobiern verursacht (vgl. Tabellen) Probengefäß Je nach Materialmenge steriles Universal-Röhrchen mit blauem Schraubdeckelverschluss. Probenentnahme - Desinfektion der Hautareale - Punktion und Sekretaspiration mit einer sterilen Spritze unter aseptischen Bedingungen - bei Abszessspaltung vorher Material für die mikrobiologische Untersuchung durch Punktion gewinnen, ggf. Inzision des Abszesses und Aufnahme des Abszessinhaltes in sterile Gefäße unter aseptischen Bedingungen. Transport und Lagerung - rasch und in einem Medium, das für den Transport von Anaerobiern geeignet ist Nativmaterial ≤ 2 h, RT im Transportmedium für Anaerobier ≤ 24 h, RT - bei Transportverzögerungen Einimpfen der Materialien in Blutkulturflaschen - Liquores und Abszessmaterial nicht einfrieren! 39/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Akute bakterielle Meningitis häufige Erreger Neisseria meningitidis Liquor, Blut 0 ++ + + 0 0 Streptococcus pneumoniae Liquor, Blut 0 ++ + + 0 0 Haemophilus influenzae Liquor, Blut 0 + + + 0 0 Peptostreptococcus spp. Liquor, Blut 0 + + 0 0 0 Fusobacterium spp. Liquor, Blut 0 + + 0 0 0 Clostridium perfringens Liquor, Blut 0 + + 0 0 0 *Brucella spp. (!) Liquor, Blut 0 + + 0 0 0 Treponema pallidum Liquor 0 0 0 0 0 + Borrelia burgdorferi Liquor 0 0 0 0 + + Streptokokken der Gruppe B Liquor, Blut 0 + + + 0 0 Escherichia coli Liquor, Blut 0 + + + 0 0 Listeria monocytogenes Liquor, Blut 0 + + 0 0 0 Streptokokken der Gruppe A Liquor, Blut 0 + + 0 0 0 Klebsiella pneumoniae Liquor, Blut 0 + + 0 0 0 Streptococcus pneumoniae Liquor, Blut 0 + + + 0 0 Neisseria meningitidis Liquor, Blut 0 ++ + + 0 0 Listeria monocytogenes Liquor, Blut 0 + + 0 0 0 Enterobacteriaceae Liquor, Blut 0 + + 0 0 0 Pseudomonas aeruginosa Liquor, Blut 0 + + 0 0 0 seltene Erreger bei Früh- und Neugeborenen bei Immunsupprimierten ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, B = 10 B Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 40/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ bei Schädelbasisfrakturen Streptococcus pneumoniae Liquor 0 + + + 0 0 Haemophilus influenzae Liquor 0 + + + 0 0 Streptokokken der Gruppe A Liquor 0 + + + 0 0 Staphylococcus aureus Liquor 0 + + 0 0 0 Staphylococcus epidermidis-Gruppe Liquor 0 + + 0 0 0 Enterobacteriaceae Liquor 0 + + 0 0 0 Staphylococcus epidermidis-Gruppe Liquor 0 + + 0 0 0 Staphylococcus aureus Liquor 0 + + 0 0 0 Enterobacteriaceae Liquor 0 + + 0 0 0 Propionibacterium acnes Liquor 0 + + 0 0 0 Acanthamoeba Liquor 0 +++ 0 0 0 0 *Brucella spp. (!) Liquor 0 + + 0 0 + Candida spp. Liquor 0 ++ + + 0 + *Coccidioides immitis (!) Liquor 0 + + 0 0 + Cryptococcus neoformans Liquor 0 + + 0 0 + *Histoplasma capsulatum (!) Liquor 0 + + 0 0 + Borrelia burgdorferi Liquor 0 0 0 + + Treponema pallidum Liquor 0 0 0 *Mycobacterium tuberculosis (!) Liquor 0 ++ + 0 + 0 Leptospira spp. Liquor (+) 0 + 0 0 + nach Schädeltrauma bei Shuntpatienten Chronische Meningitis + ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikro- organismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keim der Risikogruppe 3, * = langsames Wachstum 41/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Fokale ZNS-Läsionen *Actinomyces spp. Liquor, Punktat 0 + + 0 0 0 *Blastomyces spp. (!) Liquor, Punktat 0 + + 0 0 0 Cysticercus spp. Liquor, Punktat 0 +++ 0 0 0 Aspergillus spp. Liquor, Punktat 0 ++ + + 0 + *Nocardia spp. Liquor, Punktat 0 ++ + 0 0 0 Schistosoma mansoni Liquor, Punktat 0 +++ 0 0 + Toxoplasma gondii Liquor, Punktat 0 0 0 0 0 + Naegleria fowleri Liquor 0 +++ + 0 0 0 Acanthamoeba Liquor 0 +++ + 0 0 0 Salmonella typhi Liquor 0 + + + 0 + Ehrlichia canis Liquor Speziallabor Coxiella burnetii Liquor 0 0 0 0 0 + Mycoplasma pneumoniae Liquor H 0 + + + + *Brucella spp. (!) Liquor 0 + 0 0 0 + Listeria monocytogenes Liquor 0 + + 0 0 0 Treponema pallidum Liquor 0 0 0 0 0 + Borrelia burgdorferi Liquor 0 0 0 0 + + Leptospira spp. Liquor + 0 + 0 0 + Nocardia spp. Liquor 0 ++ + 0 0 0 *Actinomyces spp. Liquor 0 ++ + 0 0 0 *Mycobacterium tuberculosis (!) Liquor 0 ++ + 0 + 0 *Histoplasma capsulatum (!) Liquor 0 + + + 0 + Naegleria fowleri Liquor 0 +++ 0 + 0 0 Acanthamoeba Liquor 0 +++ + 0 0 0 Toxoplasma gondii Liquor 0 0 0 0 0 + Meningitis durch Protozoen Encephalitis ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 42/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Encephalitis Plasmodium falciparum Liquor 0 +++ 0 0 0 0 Tropheryma whippelii Liquor 0 0 0 0 + 0 Bartonella spp. Liquor Speziallabor Punktat N/P + + 0 0 0 Staphylococcus aureus Punktat N/P + + 0 0 0 Streptococcus pneumoniae Punktat N/P + + 0 0 0 Haemophilus influenzae Punktat N/P + + 0 0 0 Subdurales Empyem Streptococcus spp. (S. milleri, S. anginosus) Enterobacteriaceae Punktat N/P + + 0 0 0 Bacteroides spp. Punktat N/P + + 0 0 0 Punktat N/P + + 0 0 0 Peptostreptococcus spp. Punktat N/P + + 0 0 0 Bacteroides spp. Punktat N/P + + 0 0 0 Prevotella spp. Punktat N/P + + 0 0 0 Porphyromonas spp. Punktat N/P + + 0 0 0 Enterobacteriaceae Punktat N/P + + 0 0 0 Staphylococcus aureus Punktat N/P + + 0 0 0 Candida spp. Punktat N/P ++ + 0 0 + Actinomyces spp. Punktat N/P ++ + 0 0 0 Nocardia spp. Punktat N/P ++ + 0 0 0 Fusobacterium spp. Punktat N/P ++ + 0 0 0 Streptococcus pneumoniae Punktat N/P + + 0 0 0 Haemophilus influenzae Punktat N/P + + 0 0 0 Listeria monycytogenes Punktat N/P + + 0 0 0 Hirnabszess Streptococcus spp. (S. intermedius, S. anginosus) _______________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikro- organismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 43/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Epiduraler Abszess Staphylococcus aureus Punktat N/P + + 0 0 0 Escherichia coli Punktat N/P + + 0 0 0 Pseudomonas aeruginosa Punktat N/P + + 0 0 0 Streptococcus spp. Punktat N/P + + 0 0 0 Peptostreptococcus spp. Punktat N/P + + 0 0 0 Salmonella spp. Punktat N/P + + 0 0 + Staphylococcus epidermidis Punktat N/P + + 0 0 0 *Nocardia spp. Punktat N/P ++ + 0 0 0 *Actinomyces spp. Punktat N/P ++ + 0 0 0 Fusobacterium spp. Punktat N/P ++ + 0 0 0 *Mycobacterium spp. (!) Punktat N/P ++ + 0 0 + Aspergillus spp. Punktat N/P ++ + 0 0 0 *Brucella spp. (!) Punktat N/P + + 0 0 + Treponema pallidum Punktat N/P 0 0 0 0 + Peptostreptococcus spp. Punktat N/P + + 0 0 0 Streptokokken der Viridansgruppe Punktat N/P + + 0 0 0 Streptococcus milleri Gruppe Punktat N/P + + 0 0 0 Bacteroides spp. Punktat N/P + + 0 0 0 Staphylococcus aureus Punktat N/P + + 0 0 0 Enterobacteriaceae Punktat N/P + + 0 0 0 Pseudomonas aeruginosa Punktat N/P + + 0 0 0 Streptococcus pneumoniae Aspirat N ++ + 0 0 0 Haemophilus influenzae Aspirat N + + 0 0 0 Staphylococcus aureus Aspirat N + + 0 0 0 Cranialer epiduraler Abszess Dentogener Abszess Peptostreptococcus spp. Aspirat N + + 0 0 0 Fusobacterium spp. Aspirat N ++ + 0 0 0 Prevotella spp. Aspirat N + + 0 0 0 Porphyromonas spp. Aspirat N + + 0 0 0 ________________________________________________________________________________________ TM = Transportmedium, P = Port-A-Cul Medium®, S = Stuart-Medium®, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Zuordnung möglich, +++ = Nachweis von Mikroorganismen, gattungsspezifische Spezial-färbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = nicht Keime der Risikogruppe 3, * = langsames Wachstum 44/261 3. Infektionen der oberen Atemwege und der Ohren Dazu gehören: - Infektionen der Mundhöhle: persistierende, eitrige oder nekrotisierende Stomatitis, eitrige Sialadenitis, juvenile oder schwere generalisierte Parodontitis - Rhinitis: bei einer Dauer von > 2 Wochen oder eitrigem Sekret - Sinusitis: bei chronischem Verlauf (> 8 Wochen) oder bei Komplikationen unter Beteiligung der Orbita und Schädelgrube - Otitis externa: bei Therapieversagen - Akute Otitis media: bei Neugeborenen, Immunsupprimierten, Mastoiditis, Beteiligung der Schädelknochen oder Hirnnerven - Tonsillopharyngitis: bei Fieber, bei eitriger Pharyngitis (A-Streptokokken, Angina Plaut Vincentii) - Laryngitis: bei einer Dauer > 2 Wochen sowie bei Komplikationen wie z. B. Epiglottitis oder Laryngotracheitis - Diphtherie Indikation für die Abnahme von Untersuchungsmaterialien Die Indikation zur mikrobiologischen Diagnostik ergibt sich bei Versagen einer kalkulierten Therapie, bei Infektionen von Früh- und Neugeborenen und bei immunsuppremierten Patienten. Materialentnahme Die Materialgewinnung erfolgt gezielt nach klinischen Symptomen: - Stomatitis Tupferabstrich, Spülflüssigkeit, Blut (Serologie) - Sialadenitis Absaugflüssigkeit, Punktat, Blutkultur, Blut (Serologie) - Parodontitis Zahntaschenexprimat, Sulcus-Flüssigkeit - Rhinitis Tupferabstrich, Spülflüssigkeit, Absaugflüssigkeit - Sinusitis Punktate, endoskopisch gewonnenes Material - Laryngitis Tupferabstrich, Spülflüssigkeit (Bronchoskop) - Epiglottitis Tupferabstriche - Otitis externa Tupferabstriche, Spülflüssigkeit - Otitis media Tupferabstriche, Punktionen - Tonsillitis/Pharyngitis Tupferabstriche 45/261 Lagerung und Transport Wegen der Empfindlichkeit der Erreger gegen Umwelteinflüsse sollten die Untersuchungsmaterialien möglichst schnell (innerhalb von 2 h bei Raumtemperatur) und wegen der Gefahr der Austrocknung in einem Transportmedium versandt werden. Da empfindliche Bakterien bei Temperaturen um 4°C absterben, sollte eine Lagerung im Kühlschrank unterbleiben. Ist eine Verarbeitung innerhalb von 2 h nach der Abnahme nicht möglich, muss die Lagerung bei Raumtemperatur erfolgen. Dabei besteht die Gefahr, dass die Krankheitserreger von Keimen der Normalflora überwuchert werden. Untersuchungsmaterialien 3.1 Nasenabstrich Indikation - zum Nachweis einer Kolonisation mit MRSA (Methicillin-resistenter Staphylococcus aureus) - zum Nachweis einer Rhinitis - Nasopharyngealabstrich zum Nachweis einer Pharyngitis Probengefäß Universal-Abstrichtupfer mit blauer Kappe Abnahme - Tupfer aus der Sterilverpackung entnehmen - mit dem Watteteil des Tupfers die Nasenhöhle des Patienten abstreichen - bei Screening auf MRSA mit einem Tupfer nacheinander beide Nasenhöhlen abstreichen - Tupfer in das Transportmedium stecken und fest verschließen - Nasopharyngealabstrich: Tupfer vorsichtig entlang der Nasenscheidewand und des Nasenbodens in den Nasopharynx vorschieben, dann rotierend abstreichen. Lagerung und Transport innerhalb von 24 h bei Raumtemperatur 46/261 3.2 Rachenabstrich Indikation Bakterielle Pharyngitis, Tonsillitis, Angina Plaut-Vincenti Probengefäß Universal-Abstrichtupfer mit blauer Kappe Abnahme - Tupfer aus der Sterilverpackung entnehmen - mit dem Watteteil des Tupfers mehrfach den Rachen abstreichen; darauf achten, dass der Tupfer nicht mit der Wangen- oder Zungenschleimhaut in Berührung kommt (Kontamination mit physiologischer Mundflora) - Deckel des Transportmediums abziehen und verwerfen - Tupfer in das Transportmedium stecken und fest verschließen. Pharyngitis - Pharynxabstrich bei Pharyngitis: Mund mehrmals mit Leitungswasser ausspülen, Zunge mit Spatel nach unten drücken, Tupfer einführen ohne die Lippen, Mundschleimhaut oder Uvula zu berühren, Tupfer unter Druck von oben nach unten über Tonsillen oder horizontal über die Rachenwand - streichen. Nasopharyngealabstrich: Tupfer vorsichtig entlang der Nasenscheidewand und des Nasenbodens in den Nasopharynx vorschieben, dann rotierend abstreichen. Diese Abstriche dürfen nur ausgeführt werden, wenn die Epiglottis nicht entzündet ist! Epiglottitis - Tupferabstriche dürfen nur nur unter laryngoskopischer oder bronchoskopischer Kontrolle entnommen werden; bei eitrigen Infektionen besteht die Gefahr der Atemwegsobstruktion - statt dessen Entnahme von Blutkulturen 47/261 Angina Plaut-Vincenti Der Abstrichtupfer sollte in ein Transportmedium für Anaerobier gegeben werden. Außerdem sollte zur Sicherung der Diagnose ein Grampräparat angefordert werden und die Verdachtsdiagnose auf dem Antragsformular vermerkt werden. Lagerung und Transport innerhalb von 24 h bei Raumtemperatur 3.3 Rachenspülwasser Probengefäß Sputumröhrchen mit Schraubdeckel Abnahme - Mund mit physiologischer Kochsalzlösung ausspülen - Gurgeln mit 10 ml physiologischer Kochsalzlösung - Gurgelflüssigkeit in Sputumröhrchen überführen und schnell versenden. Lagerung und Transport innerhalb von 24 h bei Raumtemperatur 3.4 Mund- und Zungenabstrich Es werden in der Regel Keime der physiologischen Flora nachgewiesen. Zum Nachweis einer Mykose der Schleimhaut ist ein gezielter Untersuchungsauftrag notwendig. Probengefäß Universal-Abstrichtupfer mit blauer Kappe Abnahme - Tupfer aus der Sterilverpackung entnehmen 48/261 - mit dem Watteteil des Tupfers mehrfach in die zu untersuchende Region streichen. Deckel des Transportmediums abziehen und verwerfen - Tupfer in das Transportmedium stecken und fest verschließen. Transport und Lagerung Transport ≤ 2 h bei RT, eine Lagerung ist bis zu 24 h bei RT möglich. 3.5 Ohrabstriche und Punktate zum Nachweis einer Otitis media oder externa Probengefäß - Universal-Abstrichröhrchen mit blauer Kappe - Universal-Probengefäß mit blauer Verschlusskappe Untersuchungsmaterial bei Otitis externa - Spülflüssigkeit - Tupferabstrich Abnahme bei Otitis externa Ohrmuschel vorher desinfizieren. Mit einem Abstrichtupfer wird dann der Gehörgang rotierend abgestrichen. Bei einem tiefen Gehörgangabstrich sollte ein Ohrtrichter verwendet werden, um eine Kontamination mit Keimen des Außenohres zu vermeiden. bei Otitis media - Tupferabstrich - Punktat Abnahme bei Otitis media - Tupferabstrich des Gehörgangs bei Ruption des Trommelfells: Spekulum in Gehörgang einführen und durch diesen den Abstrich durchführen - Punktion und Aspiration bei intaktem Trommelfell: 49/261 Gehörgang mit Tupfer und physiologischer Kochsalzlösung säubern, dann Punktion und Inzision des Trommelfells (HNO-Arzt) und Aspiration der Mittelohrflüssigkeit (Transport ohne Medium 1 h), zusätzlich Blut (Serologie) Transport und Lagerung Der Transport erfolgt ≤ 2 h bei RT, die Lagerung ≤ 24 h bei 4°C. Interpretation Die Diagnostik ist dadurch erschwert, dass der obere Respirationstrakt von einer Vielzahl von Mikroorganismen, einschließlich pathogener Keime, besiedelt ist. Beim Nachweis pathogener Keime wie ß-hämolysierenden Streptokokken ist daher die Relevanz der Isolate zu prüfen. Eine Infektion liegt nur vor, wenn klinische Symptome vorhanden sind. Weiterführende Diagnostik bei Infektionen mit seltenen Erregern - Bordetella pertussis (Keuchhusten) - Diphtherie - Mycoplasma pneumoniae - Chlamydophilia pneumoniae 50/261 - Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Sinusitis Streptococcus pneumoniae Nasenabstrich + --- + 0 0 0 Haemophilus influenzae Nasenabstrich + --- + 0 0 0 Streptokokken der Gruppe A Nasenabstrich + --- + 0 0 0 Prevotella spp. Nasenabstr., Aspirat + --- + 0 0 0 Fusobacterium spp. Nasenabstr., Aspirat + --- + 0 0 0 Peptostreptococcus spp. Nasenabstr., Aspirat + --- + 0 0 0 Staphylococcus aureus Nasenabstrich + --- + 0 0 0 Moraxella catarrhalis Nasenabstrich + --- + 0 0 0 Rachenabstrich + --- + 0 0 + Rachenabstrich + --- + 0 0 0 Corynebacterium ulcerans Rachenabstrich + --- + 0 0 0 Arcanobacterium haemolyticum Rachenabstrich + --- + 0 0 0 Angina Plaut Vincent Rachenabstrich + +++ 0 0 0 0 Moraxella catarrhalis Rachenabstrich + --- + 0 0 0 Bordetella pertussis Rachenhinterwandabstr. D --- + 0 + + Bordetella parapertussis Rachenhinterwandabstr. D --- + 0 0 + Haemophilus influenzae Rachenabstrich + --- + 0 0 0 Haemophilus influenzae b / non b Rachenabstrich + --- + 0 0 0 Haemophilus parainfluenzae Rachenabstrich + --- + 0 0 0 Streptococcus pneumoniae Rachenabstrich + --- + 0 0 0 Staphylococcus aureus Rachenabstrich + --- + 0 0 0 Pasteurella multocida Rachenabstrich + --- + 0 0 0 Pharyngitis, Tonsillitis Hämolysierende Streptokokken der Gruppen A, C und G Corynebacterium diphtheriae (*Toxinnachweis) (Anaerobier) Laryngitis Epiglottitis __________________________________________________________________________ TM = Transportmedium, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben , --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier 51/261 _______________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Tracheitis Staphylococcus aureus Rachenabstrich + --- + 0 0 0 Streptokokken der Gruppe A Rachenabstrich + --- + 0 0 0 Haemophilus influenzae b Rachenabstrich + --- + 0 0 0 Peritonsillarabszess Streptokokken der Gr. A Punktat + + + 0 0 0 oropharyngeale Flora Punktat + + + 0 0 0 Otitis media Akute Form Streptococcus pneumoniae Oropharynx-Abstrich + --- + 0 0 0 Haemophilus influenzae Oropharynx-Abstrich + --- + 0 0 0 Moraxella catarrhalis Oropharynx-Abstrich + --- + 0 0 0 Streptokokken der Gruppe A Oropharynx-Abstrich + --- + 0 0 0 Staphylococcus aureus Oropharynx-Abstrich --- + 0 0 0 Chronische Form Pseudomonas aeruginosa Ohrabstrich + --- + 0 0 0 Enterobacteriaceae Ohrabstrich + --- + 0 0 0 Staphylococcus aureus Ohrabstrich + --- + 0 0 0 Staphylococcus aureus Ohrabstrich + --- + 0 0 0 Streptokokken der Gruppe A Ohrabstrich + --- + 0 0 0 Aspergillus spp. Ohrabstrich 0 --- + 0 0 0 Candida albicans Ohrabstrich 0 --- + 0 0 0 Ohrabstrich + --- + 0 0 0 Otitis externa Akute Otitis externa Akute diffuse Otitis externa (Swimmers ear) Pseudomonas aeruginosa ________________________________________________________________________ TM = Transportmedium, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier 52/261 _______________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Chronische Otitis externa Streptococcus pneumoniae Ohrabstrich + --- + 0 0 0 Haemophilus influenzae Ohrabstrich + --- + 0 0 0 ________________________________________________________________________ TM = Transportmedium, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier 53/261 4. Infektionen der tiefen Atemwege Indikation Ambulant erworbenen Pneumonien, bes. mit schwerem Verlauf, bei Pneumonien von Patienten mit Risikofaktoren wie Alter > 65 Jahre, Diabetes mellitus oder anderen schweren Grunderkrankungen sowie bei Immunsuppression, bei nosokomialen Pneumonien, bei Pneumonien mit persistierenden Infiltraten oder bei Therapieversagen, bei Patienten mit rezidivierenden Bronchitiden oder Atemwegsinfektionen sowie zur Erfassung resistenter Erreger. 4.1 Sputum Es sollte nur eitriges Sputum eingesandt werden. Zur Beurteilung der Qualität wird jedes Sputum mikroskopisch untersucht. Die Anzahl der Plattenepithelzellen und Granulozyten gibt Auskunft über die Eignung der Probe; gut geeignete Sputumproben enthalten mehr als 25 Granulozyten und weniger als 10 Epithelzellen pro Gesichtsfeld. Ein erhöhter Anteil an Plattenepithelien spricht für Speichel. Zellarmes Sputum (keine Granulozyten und Plattenepithelien) kann bei Pneumonien durch sog. atypische Erreger, Mykobakterien oder Aspergillen, bei Patienten mit Immunsuppression (Fehlen einer entzündlichen Reaktion) und bei CF-Patienten auftreten. Probengefäß Sputumröhrchen Abnahme - Mundspülung mit Wasser zur Reduktion der apathogenen Keime der Normalflora - tief aus- und einatmen; nach jedem Einatmen den Atem für 3 - 5 Sekunden anhalten - diesen Vorgang mehrmals wiederholen! Durch die Atemarbeit wird die Lunge gut entfaltet und die Produktion von Sputum angeregt. - zum Schluß tief Luft holen und Sputum abhusten - bei Verdacht auf eine Tuberkulose sollte das Abhusten zur Gewinnung einer möglichst großen Probenmenge 2 – 3 x wiederholt werden. - bei Anforderung zur Untersuchung auf atypische Mykobakterien sollte die Mundspülung mit physiologischer Kochsalzlösung durchgeführt werden, um eine Kontamination mit den im Leitungswasser vorkommenden Mykobakterien zu vermeiden - das gewonnene Sputum sollte in einem sterile Sputumröhrchen aufgefangen werden. 54/261 Am besten geeignet ist frisches Morgensputum, das vor der ersten Mahlzeit gewonnen wird! Sammelsputen über 24 h sind unbrauchbar ! Bei chronisch bakteriellen Prozessen und Verdacht auf eine Lungenmykose oder auf eine Legionellose sollten Sputumproben (besser BALs) an mehreren aufeinanderfolgenden Tagen, ggf. in 2 – 3-tägigen Intervallen entnommen werden. Wenn die Gewinnung von Sputum nicht gelingt, sollte ein induziertes Sputum gewonnen werden, bei Kindern sind auch Rachenabstriche möglich! Bei V. a. eine Pneumonie sollten auch immer Blutkulturen abnehmen! Transport Möglichst rasch (innerhalb von 2 h) bei Raumtemperatur. Ist dies nicht möglich.sollten die Proben für die kulturelle Anzüchtung der Erreger bis zum Transport bei 4°C aufbewahrt werden. Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. 4.2 Induziertes Sputum Probengefäß Sputumröhrchen Abnahme - Mundspülung mit Wasser - Inhalation von 25 ml 3 – 10% Kochsalzlösung im Ultraschall-vernebler (cave Infektionsgefahr!) über ca. 20 min - Abhusten von Sekret aus den tiefen Atemwegen innerhalb von 30 min nach der Inhalation - Überführen des Sekretes in ein steriles Weithalsgefäß. Untersuchungsmenge Das Untersuchungsvolumen sollte ≥ 1 ml sein. Transport Möglichst rasch (innerhalb von 2 h) bei Raumtemperatur. Ist dies nicht möglich.sollten die Proben für die kulturelle Anzüchtung der Erreger bis zum Transport bei 4°C aufbewahrt werden. Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. 55/261 4.3 Trachealsekret/ Bronchialsekret Tracheal- und Bronchialsekret ist ein wertvolleres Material als Sputum und sollte immer dann gewonnen werden, wenn die Gewinnung einer BAL nicht möglich ist. Probengefäß Sputumröhrchen Abnahme Trachealsekret wird bei intubierten Patienten oder bei tracheotomierten Patienten durch Absaugung mit zwischengeschaltetem Auffanggefäß entnommen. Falls genügend Material vorhanden ist, sollte die erste Portion verworfen werden. Bei Frühgeborenen und Säuglingen ist auch die Entnahme mit sterilen Spritzen möglich. Bronchialsekret wird während der Bronchoskopie aus den Bronchien gewonnen. Untersuchungsmenge Das Untersuchungsvolumen sollte ≥ 1 ml sein. Stellenwert der Methode in der Diagnostik Die Materialien sind geeignet zum Nachweis von: - schnell wachsenden Bakterien - Sproßpilzen, Schimmelpilzen - Mycobacterium spp. (suboptimal, BAL besser) - Legionella spp. (suboptimal) - Mycoplasma pneumoniae (suboptimal), Chlamydophila pneumonia, Chlamydia trachomatis bei Säuglingen (suboptimal) - Nocardia spp., Aktinomyzeten - Anaerobiern bei Aspirationspneumonie (suboptimal). Transport Möglichst rasch (innerhalb von 2 h) bei Raumtemperatur. Ist dies nicht möglich, sollten die Proben für die kulturelle Anzüchtung der Erreger bis zum Transport bei 4°C aufbewahrt werden. Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. 56/261 4.4 Broncho-alveoläre Lavage (BAL) Probengefäß Sputumröhrchen Abnahme Die BAL wird durch Spülung des distal der Bronchusspitze gelegenen Bronchialsystems und des Alveolarraumes mit dem Bronchoskop durchgeführt. Untersuchungsmenge Das Untersuchungsvolumen sollte ≥ 30 ml betragen. Stellenwert der Methode in der Diagnostik Die BAL ist das geeignetste Material für die Pneumonie-Diagnostik und gilt als beste Methode zum Nachweis alveolärer oder in den terminalen Bronchioli ablaufenden Infektionen. Es werden alle ätiologisch bedeutsamen Keime quantitativ erfasst; das Risiko einer Kontamination mit Keimen der Normalflora ist mit dieser Methode am geringsten; weiterhin kann die Kontaminationsrate durch Verwerfen der ersten Sekretportion gesenkt werden. Transport Möglichst rasch (innerhalb von 2 h) bei Raumtemperatur. Ist dies nicht möglich.sollten die Proben für die kulturelle Anzüchtung der Erreger bis zum Transport bei 4°C aufbewahrt werden. Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. Interpretation Bei der mikroskopischen Untersuchung der BAL-Flüssigkeit spricht ein Anteil an Plattenepithelzellen von mehr als 1% an der Gesamtheit der nachweisbaren Zellen für eine erhebliche Kontamination der Probe! Keimzahlen ≥ 104 KbE/ml sprechen für eine Pneumonie. Die pathogenen Keime sollten in höheren Konzentrationen vorliegen als die Kontaminationskeime der Normalflora. 57/261 4.5 Nasopharyngeale Absaugung Probengefäß Sputumröhrchen Abnahme - flexible Einwegpipette oder mit einem über eine Flüssigkeitsfalle und Pumpe verbundenen Schlauch transnasal in den Nasopharynx einführen - beim Herausziehen des Schlauches leichten Sog ausüben und dabei schleimig-eitriges Material aus dem Nasopharynx unter Sicht absaugen - Überführen des Sekretes in ein steriles Weithalsgefäß. Transport Möglichst rasch (innerhalb von 2 h) bei Raumtemperatur. Ist dies nicht möglich.sollten die Proben für die kulturelle Anzüchtung der Erreger bis zum Transport bei 4°C aufbewahrt werden. Materialien zur Untersuchung auf Tuberkulose oder für die PCR müssen bei 4° im Kühlschrank gelagert werden. 4.6 Biopsate/Abszessmaterial Probengefäß Universal-Probenröhrchen mit blauem Schraubdeckelverschluss Abnahme - Abszessmaterial sollte punktiert oder aspiriert werden, Abstriche sind ungeeignet. - um ein Austrocknen zu verhindern, sollte vor allem Biopsiematerial in wenig Ringerlösung (ca. 1 ml) überführt werden. Transport Bei längerem Transport (> 2 h ) muss Abszessmaterial in Transportmedien (Thioglykolatbouillon) bei Raumtemperatur versandt werden und kann dann bis zu 24 h bei RT gelagert werden. Biopsate können nicht gelagert werden, sondern müssen sofort transportiert werden. 4.7 Blutkulturen Da Pneumonien häufig Bakteriämien verursachen, sollten stets Blutkulturen abgenommen werden (siehe Kapitel Blut). 58/261 Transport und Lagerung Sekrete aus dem Oropharynx können bis auf wenige Ausnahmen (Mykoplasmen, Chlamydien) nicht durch Transportsysteme geschützt werden. Die empfohlenen Transportzeiten und Lagerungsbedingungen müssen strikt eingehalten werden, da nur dann ein Absterben empfindlicher Mikroorganismen sowie die Überwucherung oder Hemmung ätiologisch wichtiger Erreger durch Keime der Normalflora weitgehend verhindert werden kann. Interpretation Die Untersuchung von Tracheal- und Bronchialsekret hat eine hohe Sensitivität, aber eine geringe Spezifität für bakterielle Pneumonieerreger. Mikroorganismen der Normalflora zu denen in geringen Keimzahlen auch die pathogenen Pneumonieerreger wie Pneumokokken gehören, besiedeln unter Beatmungsbedingungen auch den oberen und unteren Respirationstrakt und sind schwer von den ätiologisch bedeutsamen Pneumonieerregern zu unterscheiden. Die nachgewiesenen pathogenen Keime verursachen nicht in jedem Fall eine Pneumonie. Eine antibiotische Therapie sollte deshalb nur bei vorliegenden klinischen oder radiologischen Zeichen durchgeführt werden. Weiterhin dürfen potentielle andere Infektionsloci nicht vernachlässigt werden. Da die Kontaminationsgefahr mit Keimen der Normalflora bei der BAL geringer ist, weist die Untersuchung eine hohe Spezifität auf: 104 Keime/ml sprechen bei entsprechender klinischer Symptomatik für den ätiologisch bedeutsamen Pneumonieerreger. Standortflora in den oberen Atemwegen Nasopharynx: Streptokokken der Viridans-Gruppe, A-Streptokokken, Streptococcus pneumoniae, Staphylococcus aureus, koagulasenegative Staphylokokken, Neisseria spp., Haemophilus spp., Corynebacterium spp., Moraxella catarrhalis, Anaerobier, Sproßpilze Mundhöhle: Streptokokken der Viridans-Gruppe, Neisseria spp., Moraxella catarrhalis, Anaerobier, Sproßpilze Oropharynx: Flora der Mundhöhle, Bacteroides spp., Fusobacterium spp., Spirochaeten, Peptostreptococcus spp., Actinomyces spp., möglich auch A-Streptokokken, Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus spp., Corynebacterium spp. 59/261 4.8 Pleurapunktat Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss Abnahme - Patient sitzt und stützt sich nach vorne auf - Pleurapunktat mit Ultraschall kontrollieren - großflächige Desinfektion der Punktionsstelle - Anlegen eines Mundschutzes und anziehen steriler Hanschuhe - Abdecken der Punktionsstelle mit sterilen Tüchern (Lochtuch) - Lokalanästhesie - Punktion der Pleuraflüssigkeit - Abnahme von Pleuraflüssigkeit mit steriler Spritze und Auffangen im Probengefäß Transport Umgehender Transport ins Labor bei Raumtemperatur. Ist dies nicht möglich Überführen in Blutkulturflaschen oder in Thioglykolatbouillon. Im Transportmedium ist eine Lagerung bis zu 24 h bei Raumtemperatur möglich. 4.9 Magensaft Die Einsendung von Magensaft dient zur Diagnose der Tuberkulose. Zur Erhöhung der Sensitivität sollte die Untersuchung an drei aufeinanderfolgenden Tagen durchgeführt werden. Probengefäß Steriles Magensaft-Röhrchen mit Natriumphosphatlösung (im Institut erhältlich) Abnahme - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - Einführen der Sonde in ein Nasenloch - vorsichtiges Vorschieben der Sonde - den Patient schlucken lassen und gleichzeitig die Sonde zügig vorschieben (ca. 50 cm) - mit einer sterilen Spritze ca. 2 ml Magensaft aspirieren 60/261 - Überführen des Magensekretes in das Magensaft-Räöhrchen Lagerung und Transport - innerhalb von 2 h bei Raumtemperatur - falls dies nicht möglich ist, müssen die Materialien bei 4°C im Kühlschrank gelagert werden. Weiterführende Diagnsotik bei Infektionen mit seltenen Erregern - Actinomyces spp. - Aspergillus spp. - Bacillus anthracis - Bordetella spp. - Candida spp. - Chlamydophila pneumoniae - Chalmydophila psittaci - Chlamydia trachomatis - Coxiella burnetii - Legionella spp. - Mycoplasma pneumoniae - Mycobacterium tuberculosis und MOTT - Nocardia spp. - Pneumocystis jirovecci 61/261 Cystische Fibrose Die Mukoviszidose ist eine autosomal rezessiv vererbte Erkrankung (Mutation im CysticFibrosis-Transmembrane-Conductance-Regulator-Gen), die zu einer generalisierten Störung des sekretorischen Epithels aller exokrinen Drüsen führt. Im Respirationstrakt wird ein sehr zäher Schleim produziert, der die Selbstreinigungsfunktion der Alveolen beeinträchtigt. Es siedeln sich Bakterien an, die zu chronischen Entzündungen und zu einem Umbau des Lungengewebes führen. Probengefäß Sputumröhrchen Untersuchungsmaterial Sputum, Bronchialsekret, BAL (mindestens 1 ml), Rachenabstrich bei Kleinkindern Transport Wegen der quantitativen Auswertung der Untersuchungsmaterialien ist ein sofortiger Transport bei Raumtemperatur notwendig. Die Dauer der Untersuchung ist langwierig und kann bis zu 1 Woche ausmachen. Das besondere Erregerspektrum, das durch seltene und langsam wachsende und schwer differenzierbare Erreger gekennzeichnet ist, verlangt spezielle Anlage- und Differenzierungsmethoden sowie persönliche Erfahrung. Von allen relevanten Keimen wird die minimale Hemmkonzentration (MHK) bestimmt. 62/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Ambulante Pneumonie häufige Erreger: Streptococcus pneumoniae Sputum, TS, BAL, Blut N + + 0 0 0 Haemophilus influenzae Sputum, TS, BAL , Blut N + + 0 0 0 Moraxella catarrhalis Sputum, TS, BAL N + + 0 0 0 Klebsiella pneumoniae Sputum, TS, BAL N + + 0 0 0 Legionella pneumophila Sputum, BAL, TS N 0 + + + + Mycoplasma pneumoniae BAL, TS, Rachenabstr. H 0 + + + + Chlamydia pneumoniae BAL, TS N 0 0 0 + + Bordetella pertussis Nasopharyngealsekret D 0 + 0 + + Coxiella burnetii Blut N 0 0 0 0 + Nocardia asteroides Sputum, TS, BAL N + + 0 0 0 Actinomyces spp. Sputum, TS, BAL N ++ + 0 0 0 Chlamydia trachomatis TS, Rachenabstr. N 0 0 0 + + Sputum, Blut N + + 0 0 0 Pseudomonas aeruginosa BAL, TS, Sputum N + + 0 0 0 Stapyhylococcus aureus BAL, TS, Sputum, Blut N + + 0 0 0 Klebsiella pneumoniae BAL, TS, Sputum N + + 0 0 0 Candida albicans BAL, TS, Sputum N ++ 0 0 0 + Aspergillus spp. BAL, TS, Sputum N ++ 0 0 0 + Legionella spp. BAL, TS, Sputum, Blut N 0 + + + + seltene Erreger: (bei Neu- und Frühgeborenen) Bacillus anthracis (Anthrax) Objektträger (bei Kontakt mit Weidetieren) Nosokomiale Pneumonie __________________________________________________________________________ TM = Transportmedium, S = Stuart- Medium®, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier 63/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mik Kultur AG PCR Sero __________________________________________________________________________ nach Auslandsaufenthalt Francisella tularensis (!) Sputum, Blut Speziallabor für Keime der Risikogruppe 3 Sputum Speziallabor für Keime der Risikogruppe 3 BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + BAL, TS, Biopsat N + + 0 0 + (USA, [Missouri, Arkansas, Oklahoma], Asien) Pseudomonas pseudomallei (!) (Südostasien, Nordaustralien) Histoplasma capsulatum (!) (USA [Ohio, Mississippi, Missouri], Afrika, Mittel- und Südamerika) Blastomyces dermatitidis (!) (USA [Ohio, Mississippi]), Indien, Zentral- und Südamerika, Mittelasien Coccidioides immitis (!) (USA [Südwest], Mexiko) Paracoccidioides brasiliensis (!) (Südamerika, bes. Brasilien) Pneumonie bei Immunsuppression Pseudomonas aeruginosa BAL, TS, Sputum N + + 0 0 0 Klebsiella pneumoniae BAL, TS, Sputum N + + 0 0 0 Enterobacter spp. BAL, TS, Sputum N + + 0 0 0 Proteus spp. BAL, TS, Sputum N + + 0 0 0 Morganella morganii BAL, TS, Sputum N + + 0 0 0 Staphylococcus aureus BAL, TS, Sputum N + + 0 0 0 Streptococcus pneumoniae Sputum, TS, BAL, Blut N + + 0 0 0 Nocardia asteroides Sputum, TS, BAL N ++ + 0 0 0 Legionella spp. BAL, TS, BAL, Blut N 0 + + + + Mycobacterium tuberculosis (!) Sputum, TS, BAL N ++ + 0 + 0 M. avium-intracellulare Sputum, TS, BAL N ++ + 0 0 0 Candida spp. TS, BAL N ++ + 0 0 + Aspergillus fumigatus BAL, TS, Sputum N ++ + 0 0 + Pneumocystis carinii BAL N +++ 0 0 + 0 __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier, (!) = Keime der Risikogruppe 3 64/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mik Kultur AG PCR Sero __________________________________________________________________________ Aspirationspneumonie Aerobier (wie amb. Pneumonie) BAL, Biopsie N + + 0 0 0 Peptostreptococcus spp. BAL, Biopsie N + + 0 0 0 Fusobacterium spp. BAL, Biopsie N + + 0 0 0 Prevotella melaninogenica BAL, Biopsie N + + 0 0 0 Porphyromonas spp. BAL, Biopsie N + + 0 0 0 Peptostreptococcus spp. Punktat, Biopsie + + + 0 0 0 Fusobacterium nucleatum Punktat, Biopsie + + + 0 0 0 Prevotella melaninogenica Punktat, Biopsie + + + 0 0 0 Bacteroides fragilis Gruppe Punktat, Biopsie + + + 0 0 0 Staphylococcus aureus Punktat, Biopsie + + + 0 0 0 Klebsiella pneumoniae Punktat, Biopsie + + + 0 0 0 Pseudomonas aeruginosa Punktat, Biopsie + + + 0 0 0 Streptococcus pneumoniae Punktat, Biopsie + + + 0 0 0 Haemophilus influenzae Sputum, TS, BAL N + + 0 0 0 Streptococcus pneumoniae Sputum, TS, BAL N + + 0 0 0 Moraxella catarrhalis Sputum, TS, BAL N + + 0 0 0 Klebsiella spp. Sputum, TS, BAL N + + 0 0 0 Staphylococcus aureus Sputum, TS, BAL N + + 0 0 0 Haemophilus influenzae Sputum, TS, BAL N + + 0 0 0 Pseudomonas aeruginosa Sputum, TS, BAL N + + 0 0 0 Burkholderia cepacia Sputum, TS, BAL N + + 0 0 0 Stenotrphomonas maltophilia Sputum, TS, BAL N + + 0 0 0 Candida spp. Sputum, TS, BAL N + + 0 0 0 Aspergillus fumigatus Sputum, TS, BAL N + + + 0 0 Lungenabszess Bronchitis CF Kinder Jugendliche _______________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, H = Hayflick-Medium, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial (Transport < 2 h), Mikr = Mikroskopie (+ = Keimwachstum, unspezifisch; ++ = Keimwachstum , spezifisch, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben), AG = Antigennachweis, Sero = Serologie, TS = Trachealsekret, BAL = bronchoalveoläre Lavage, Anaerobier, (!) = Keime der Risikogruppe 3 65/261 5. Infektionen am Auge Indikation Eine kulturelle und zytologische Untersuchung ergibt sich bei jeder Enzündung am Auge (bakterielle Konjunktivitis, Keratitis, Endophthalmitis und bei dem Verdacht auf eine Akanthamoebeninfektion. Die Probenentnahme sollte nach Möglichkeit unter sterilen Kautelen vor Anwendung von Lokalanästhetika und insbesondere von Lokalantibiotika sowie beim Nachweis von Chlamydien vor Fluoreszeinapplikation erfolgen. 5.1 Konjunktiva und Augenlider Probengefäß Universal-Abstrichtupfer mit oranger Kappe. Abnahme Die Abstriche werden durch Auswischen des unteren Konjunktivalsacks mit sterilen Dacrontupfern, die vorher mit einem flüssigen Transportmedium befeuchtet wordensind, gewonnen. Auch wenn nur ein Auge entzündet ist, sollten stets beide Augen abgestrichen werden (ein Abstrich dient zur Kontrolle). Transport: ≤ 1 h, RT Lagerung: ≤ 24 h, RT 5.2 Hornhaut Probengefäß Universal-Probenröhrchen mit blauer Verschlusskappe Abnahme Bei Entzündungen der Hornhaut wird Hornhautgeschabsel mit speziellen Schabern gewonnen und mit wenig physiologischer Kochsalzlösung versetzt. Transport: ≤ 1 h, RT Lagerung: eine Lagerung ist nicht möglich 66/261 5.3 Kontaktlinsen Probengefäß Universal-Probenröhrchen mit blauer Verschlusskappe Abnahme - Hände sorgfältig desinfizieren - Transportgefäß vorbereiten und mit wenig steriler Kochsalzlösung füllen - Kontaktlinse aus dem Auge entfernen und vorsichtig in das Tranmsportgefäß fallen lassen Transport: ≤ 2 h, RT Lagerung: ≤ 24 h, RT 5.4 Kammerwasser und Punktate bei Endophthalmitis Probengefäß - Redonflaschen aus dem OP - sterile Spritzen Abnahme Die Materialentnahme erfolgt intraoperativ unter sterilen Kautelen. Transport - Der Versand muss möglichst schnell bei Raumtemperatur erfolgen (< 1 h). - Punktate (i. d. R. sehr wenig) sollten in den Spritzen, mit denen sie entnommen wurden transportiert werden (ohne Kanüle) und sofort nach Abnahme in das Labor gebracht werden - die Spülflüssigkeit sollte in Redon-Flaschen gesammelt und ebenfalls schnell transportiert werden - Ist der sofortige Transport nicht möglich, müssen die Materialien in Blutkulturflaschen verimpft werden. Lagerung Eine Zwischenlagerung ist nicht möglich. 67/261 Die Materialien dürfen nicht eingefroren werden und nur kurzzeitig bei 4°C aufbewahrt werden. Bei Endophthalmitis sollte außerhalb der Dienstzeiten der zuständige Mikrobiologe verständigt werden (Tel. Dienst-Handy 0172 – 6633567). Das Material zur Untersuchung auf Acanthamoeba muss ebenfalls in einem entsprechenden Transportmedium transportiert werden. Eine Zwischenlagerung ist nicht möglich. Außerhalb der Dienstzeiten muss der Dienstarzt der Mikrobiologie verständigt werden. Interpretation Die Konjunktiven sind häufig mit Keimen der physiologischen Hautflora und bei Kindern mit der Flora des Oropharynx besiedelt. Die Wertung eines nachgewiesenen Erregers als kausalen Keim für die Infektion ist daher schwierig. Dagegen kann bei Endophthalmitis jedem nachgewiesenen Erreger eine ätiologische Bedeutung zukommen. Weiterführende Diagnostik bei Infektionen mit seltenen Erregern - Chlamydia trachomatis - Acanthamoeba 68/261 - Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mik Kultur AG PCR Sero __________________________________________________________________________ Eitrige Konjunktivitis bei Neugeborenen Neisseria gonorrhoeae Abstrich D --- + 0 0 0 Chlamydia trachomatis Abstrich 0 --- 0 + + + Staphylococcus aureus Abstrich + --- + 0 0 0 Streptokokken der Gruppe A Abstrich + --- + 0 0 0 Streptococcus pneumoniae Abstrich + --- + 0 0 0 Haemophilus influenzae Abstrich + --- + 0 0 0 Pseudomonas aeruginosa Abstrich 0 --- + 0 0 0 Bartonella hensleae Abstrich + --- + 0 + 0 Moraxella lacunata Abstrich + --- + 0 0 0 Staphylococcus spp. Abstrich + --- + 0 0 0 C. trachomatis Abstrich 0 IF 0 0 + 0 Toxoplasma gondii Abstrich 0 0 0 0 0 + Candida spp. Abstrich 0 ++ + 0 0 0 Borrelia burgdorferi Abstrich 0 0 0 0 + 0 Toxocara canis Abstrich 0 +++ 0 0 0 0 Abstrich + + + 0 0 0 Peptostreptococcus spp. Abstrich + + + 0 0 0 Pseudomonas aeruginosa Abstrich 0 + + 0 0 0 Haemophilus influenzae Abstrich + + + 0 0 0 Mycobacterium spp. Abstrich 0 ++ + 0 0 0 Akute Konjunktivitis Chronische Konjunktivitis Infektionen der Retina Infektionen der Orbita/ Orbitalphlegmone Staphylococcus aureus ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikro- organismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 69/261 _________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Orbitalphlegmone Zygomycetes Abstrich 0 ++ + 0 0 0 Aspergillus spp. Abstrich 0 ++ + + 0 + Echinococcus spp. Abstrich 0 0 0 0 0 + Staphylococcus aureus Abstrich + + + 0 0 0 Streptococcus pneumoniae Abstrich + + + 0 0 0 Haemophilus influenzae Abstrich + + + 0 0 0 Infektionen des Tränenkanals Dacryoadenitis (Tränendrüse) Neisseria gonorrhoeae Abstrich D ++ + 0 0 0 *Mycobacterium tuberculosis (!) Abstrich 0 ++ + 0 + 0 *Actinomyces israelii Abstrich + ++ + 0 0 0 Streptococcus spp. Abstrich + + + 0 0 0 Candida spp. Abstrich 0 ++ + 0 0 0 Aspergillus spp. Abstrich 0 ++ + 0 0 0 Streptococcus pneumoniae Abstrich + + + 0 0 0 Streptococcus pyogenes Abstrich + + + 0 0 0 Staphylococcus aureus Abstrich + + + 0 0 0 Haemophilus influenzae Abstrich + + + 0 0 0 Pseudomonas aeruginosa Abstrich 0 + + 0 0 0 Candida albicans Abstrich 0 ++ + 0 0 0 Aspergillus spp. Abstrich 0 ++ + 0 0 0 Staphylococcus aureus Abstrich + --- + 0 0 0 Streptococcus spp. Abstrich + --- + 0 0 0 Moraxella catarhhalis Abstrich + --- + 0 0 0 Canaliculitis (Tränenkanal) Dacryozystitis (Tränensack) Infektionen des Augenlides Blepharitis ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 70/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Infektionen des Augenlides Hordeolum Staphylococcus aureus Abstrich + --- + 0 0 0 Abstrich + + + 0 0 0 Lidabszess/Phlegmone Streptococcus spp. Haemophilus influenzae Abstrich + + + 0 0 0 Anaerobier Abstrich + + + 0 0 0 Staphylococcus spp. Abstrich + + + 0 0 0 Streptococcus pneumoniae Abstrich + ++ + 0 0 0 Pseudomonas aeruginosa Abstrich 0 + + 0 0 0 Bacillus cereus Abstrich 0 + + 0 0 0 Enterobacteriaceae Abstrich 0 + + 0 0 0 Moraxella lacunata Abstrich + + + 0 0 0 Mycobacterium fortuitum Abstrich 0 ++ + 0 0 0 Mycobacterium chelonei Abstrich 0 ++ + 0 0 0 Anaerobier Abstrich + + + 0 0 0 Fusarium solani Abstrich 0 + 0 0 0 Candida albicans Abstrich 0 ++ + 0 0 0 Aspergillus fumigatus Abstrich 0 ++ + 0 0 0 Alternaria spp. Abstrich 0 + + 0 0 0 Infektionen der Cornea Keratitis Acremonium spp. Abstrich 0 + + 0 0 0 Acanthamoeba spp. Abstrich + +++ + 0 0 0 Staphylococcus epidermidis-Gruppe Aspirat N + + 0 0 0 Staphylococcus aureus Aspirat N + + 0 0 0 Streptococccus spp. Aspirat N + + 0 0 0 Endophthalmitis Exogen/ nach Katarakt-OP ________________________________________________________________________________________ TM = Transportmedium, AG = Antigennachweis, Sero = Serologie, Anaerobier, Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), N = Nativ (Transport < 2 h) 71/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Endophthalmitis Exogen/linsenloses Auge Propionibacterium spp. Aspirat N + + 0 0 0 Haemophilus influenzae Aspirat N + + 0 0 0 Streptococcus pneumoniae Aspirat N + + 0 0 0 Streptokokken der Viridansgr. Aspirat N + + 0 0 0 Bacillus cereus Aspirat N + + 0 0 0 Koagulasenegative Staphylokokken Aspirat N + + 0 0 0 Candida spp. Aspirat N ++ + + 0 0 Aspergillus fumigatus Aspirat N ++ + + 0 + Aspergillus flavus Aspirat N ++ + + 0 0 Acremonium spp. Aspirat N + + 0 0 0 Penicillium spp. Aspirat N + + 0 0 0 Aspirat N + + 0 0 0 Exogen/Bläschen Exogen/posttraumatisch Pilze Endogen Staphylococcus aureus Neisseria meningitidis Aspirat N ++ + 0 0 0 Streptococcus spp. Aspirat N + + 0 0 0 Enterobacteriaceae Aspirat N + + 0 0 0 Pseudomonas aeruginosa Aspirat N + + 0 0 0 Nocardia asteroides Aspirat N + + 0 0 0 Candida albicans Aspirat N ++ + + 0 + ________________________________________________________________________________________ TM = Transportmedium, S = Stuarts Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --= nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 72/261 6. Infektionen der Haut, der Weichteile, Abszesse innerer Organe und postoperative Wundinfektionen Indikation für die mikrobiologische Untersuchung Die Indikation zur mikrobiologischen Untersuchung ergibt sich bei primären Haut-, Weichteil-, Knochen- oder Gelenkinfektionen, bei Abszessen, bei infizierten traumatischen Wunden, Bissverletzungen und Zysten sowie bei operativ eröffneten Körperhöhlen. 6.1 Eiter, Sekrete, Abszesse, Empyem, Gangrän, Pusteln, Bläschen, Punktate Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss Abnahme - perkutane Punktion und Sekretaspiration mit einer Spritze unter aseptischen Bedingungen (ein Tupferabstrich besitzt wenig Wert) → Transportmodus 1 oder 2, bei längerem Transport erfolgt Transportmodus 3 - bei Abszessspaltung Entnahme von Abszessinhalt mit chirurgischem Löffel → Transportmodus 1 - bei exsudatarmen Prozessen Aspiration vom Grund der Läsion mit Tuberkulinspritze nach Entfernen der Kanüle und Verschließen der Spritze → Transportmodus 1 oder 2, ggf. 3 - bei intraoperativer Entnahme sollte zusätzlich eine Probe von Granulationsgewebe ingesandt werden → Transportmodus 1 6.2 Fisteln Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss 73/261 Abnahme - Öffnung desinfizieren, Katheter zur Aspiration oder Gewebekürettage im Fistelgang einführen und Untersuchungsmaterial entnehmen → Transportmodus 1 6.3 Ulzerationen, Wunden, Bisswunden Die Materialentnahme bei Bisswunden sollte nicht unmittelbar nach dem Biss erfolgen, sondern erst dann, wenn die ersten Entzündungsreaktionen auftreten, in der Regel nach 12 h. Probengefäß - Universal-Probengefäß mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Kappe Abnahme - Wundränder desinfizieren - oberflächlich Schorf abheben, ggf Wundgrund kürettieren - evtl. vorhandenes Exsudat mit steriler Spritze aspirieren oder mit sterilem Abstrichtupfer entnehmen → Transportmodus 2 oder 3 6.4 Phlegmonöse Prozesse Probengefäß Universal-Probengefäß mit blauem Schraubverschluss Abnahme - Desinfektion der Hautoberfläche - Probeexzision aus Rand der Entzündung → Transportmodus 1. 74/261 6.5 Chronisch granulomatöse Prozesse und Aktinomykose, Myzetome, Osteomyelitis Probengefäß - Universal-Probengefäß mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Kappe Abnahme - Gewebe, Punktat oder Biopsat ggf. in physiologischer Kochsalzlösung aufnehmen - bei Verdacht auf Aktinomykose keine Kochsalzlösung, sonder Ringerlösung verwenden → Transportmodus 1 6.6 Verdacht auf Infektionen mit Dermatophyten Probengefäße - Universal-Probengefäß mit blauem Schraubverschluss Abnahme - verdächtige Hautstellen mit Alkohol vorsichtig desinfizieren - danach Hornhautgeschabsel, Nagelspäne oder Hautschuppen vom entzündlichen Randwall abkratzen - in ein trockenes Gefäß überführen → Transportmodus 1 bei Raumtemperatur maximal bis zu 48 h. Versand Die Untersuchungsproben müssen innerhalb von 2 h ins Labor gebracht werden, da jede Art der Lagerung die Ausbeute verringert. Falls dies nicht möglich ist, können die Proben bei 4°C gelagert werden. Dabei muss man sich aber im klaren sein, dass empfindliche Keime bei einer Lagerung bei 4°C absterben. Daher sollten flüssige Untersuchungsmaterialien bei längerem Transport in Blutkulturflaschen verimpft werden. Transportmodus 1 Der Transport erfolgt in sterilen leeren Gefäßen (Universal-Röhrchen mit blauem Schraubverschluss), ggf. mit Zusatz von wenig physiologischer Kochsalzlösung, um ein 75/261 Austrocknen der Proben zu vermeiden. Diese Aufbewahrungsart erfordert einen sofortigen Transport, eine Lagerung ist nicht erlaubt ! Transportmodus 2 Diese Aufbewahrungsart erfordert sofortigen Transport, eine Lagerung ist nicht erlaubt! Falls dies nicht möglich ist, müssen flüssige Untersuchungsmaterialien in Blutkulturflaschen verimpft werden. Transportmodus 3 Der Transport erfolgt in Medien für anspruchsvoll wachsende Keime oder für Anaerobier (Thioglykolatlösung) oder in Abstrichtupfern mit Transportmedium (Abstrichtupfer mit blauer Kappe). Diese Aufbewahrungsart erlaubt eine Transportzeit von mehr als 2 h, maximal 24 h bei 4°C; Anaerobier müssen bei Zimmertemperatur aufbewahrt werden. Fehler bei Materialgewinnung und –transport - Kontamination mit Begleitkeimen aus der Umgebung der Wunde - Gewinnung von zu wenig Material - Absterben empfindlicher Keime am trockenen Tupfer - Entnahme unter antibiotischer Therapie - zu lange Lagerungs- oder Transportzeiten - bei zu kühler Lagerung: Absterben sensibler Keime - bei Lagerung in der Wärme: Überwucherung durch schnellwachsende Mikroorganismen Interpretation Bei exakter Abnahme der Untersuchungsmaterialien ist das Risiko der Kontamination durch die Normalflora der Haut bzw. der Schleimhäute gering, so dass die isolierten Erreger als relevant zu betrachten sind. 76/261 Weiterführende Untersuchungen bei Infektionen mit seltenen Erregern - Bacillus anthracis (Anthrax) - Bartonella spp. - Capnocytophaga canimorsus (bei Hundebissen) - Corynebacterium diphtheriae (Hautdiphtherie) - Erysipelothrix rusiopathiae (Schweinerotlauf) - Francisella tularenisis (Tularämie) - Mycobacterium tuberculosis und MOTT 77/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Impetigo und Echthyma Staphylococcus aureus Abstrich + --- + 0 0 0 Streptokokkken der Gruppe A Abstrich + --- + 0 0 + Abstrich + --- + 0 0 0 Abstrich + --- + 0 0 0 Streptokokken der Gruppen A-G Abstrich + --- 0 0 0 + Staphylococcus aureus Abstrich +- --- + 0 0 0 Streptokokken der Gruppe A Biopsie N + + 0 0 0 Staphylococcus aureus Biopsie N + + 0 0 0 Haemophilus influenzae Biopsie N + + 0 0 0 Enterobacteriaceae Biopsie N + + 0 0 0 Clostridium spp. Biopsie N ++ + 0 0 0 Bacillus anthracis Biopsie N ++ + 0 0 0 Pasteurella multocida Biopsie N + + 0 0 0 Folliculitis Staphylococcus aureus Furunkel/Karbunkel Staphylococcus aureus Erysipel Zellulitis/Phlegmone häufige Erreger seltene Erreger Erysipelothrix spp. Biopsie N + + 0 0 0 Aeromonas hydrophila Biopsie N + + 0 0 0 Vibrio vulniferus Biopsie N + + 0 0 0 *Mycobacterium spp. Biopsie N ++ + 0 + 0 ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, * = langsames Wachstum, Anaerobier 78/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Panaritium Streptococcus pyogenes Sekret, Abstrich + + + 0 0 0 Staphylococcus aureus Sekret, Abstrich + + + 0 0 0 Biopsie N 0 0 0 + + Abstrich + + + 0 0 + Staphylococcus aureus Abstrich + + + 0 0 0 Streptococcus pyogenes Abstrich + + + 0 0 0 Enterococcus spp. Abstrich + + + 0 0 0 Enterobacteriaceae Abstrich + + + 0 0 0 Anaerobier Abstrich + + + 0 0 0 Staphylococcus aureus Abstrich + + + 0 0 0 Pseudomonas aeruginosa Abstrich + + + 0 0 0 Enterobacteriaceaae, bes. Proteus Abstrich + + + 0 0 0 Candida albicans Abstrich + ++ + 0 0 0 Erythema migrans/chronicum Borrelia burgdorferi, B. garinii, B. afzelii Nekrotisierende Fasciitis Streptokokken der Gruppe A Postoperative Wundinfektionen (Bacteroides, Fusobacterium, Clostridium, Peptostreptokokken) Verbrennungswunden Myositis Staphylococcus aureus Punktat, Biopsie + + + 0 0 0 Streptococcus spp. Punktat, Biopsie + + + 0 0 0 Clostridium perfringens Punktat, Biopsie + ++ + 0 0 0 __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, * = langsames Wachstum, Anaerobier 79/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Hautmykosen Tinea Trichophyton rubrum Hautgeschabsel 0 + + 0 0 0 infizierte Haare 0 + + 0 0 0 Trichophyton rubrum Nagelspäne 0 + + 0 0 0 Trichophyton mentagrophytes Nagelspäne 0 + + 0 0 0 Candida albicans Nagelspäne 0 + + 0 0 0 Geotrichum candidum Nagelspäne 0 + + 0 0 0 Acremonium spp. Nagelspäne 0 + 0 0 0 0 Scopulariopsis brevicaulis Nagelspäne 0 + + 0 0 0 Staphylococcus aureus Abstrich, Sekret + + + 0 0 0 Streptococcus pyogenes Abstrich, Sekret + + + 0 0 0 Eikenella coorodens Abstrich, Sekret + + + 0 0 0 Favus Trichophyton schoenleinii (Afrika, Mittelmeerraum) Nagelmykosen Bißwunden Menschenbisse Haemophilus influenzae Abstrich, Sekret + + + 0 0 0 Anaerobier Abstrich, Sekret + + + 0 0 0 Pasteurella multocida Abstrich, Sekret + + + 0 0 0 Pasteurella spp. Abstrich, Sekret + + + 0 0 0 Staphylococcus intermedius Abstrich, Sekret + + + 0 0 0 Staphylococcus aureus Abstrich, Sekret + + + 0 0 0 Häm. Streptokokken Abstrich, Sekret + + + 0 0 0 Eikenella corrodens Abstrich, Sekret + + + 0 0 0 Capnocytophaga spp. Abstrich, Sekret + + + 0 0 0 Anaerobier Abstrich, Sekret + + + 0 0 0 Prevotella, Porophyromonas, Fusobacterium, Peptostrept. Tierbisse __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, * = langsames Wachstum, Anaerobier 80/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Abszesse Haut Staphylococcus aureus Punktat N + + 0 0 0 Propionibacterium spp. Punktat N + + 0 0 0 Peptostreptococcus spp. Punktat N + + 0 0 0 Leishmania tropica-Komplex Punktat, Biopsie 0 +++ + (+) 0 + (Indien, Afghanistan, Türkei) (am Wundrand) Leishmania braziliensis-Komplex Punktat, Biopsie 0 +++ 0 0 0 + (Zentralamerika, Südamerika) (am Wundrand) Erysipelothrix rhusiopahiae Biopsie, Blut N + + 0 0 0 Staphylococcus aureus Punktat N + + 0 0 0 Propionibacterium spp. Punktat N + + 0 0 0 Peptostreptococcus spp. Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Bacteroides spp. Punktat N + + 0 0 0 Escherichia coli Punktat N + + 0 0 0 Bacteroides spp. Punktat N + + 0 0 0 Enterococcus spp. Punktat N + + 0 0 0 Peptostreptococcus spp. Punktat N + + 0 0 0 Clostridium spp. Punktat N ++ + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Fusobacterium spp. Punktat N ++ + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Pseudomonas spp. Punktat N + + 0 0 0 Staphylococcus spp. Punktat N + + 0 0 0 Eubacterium spp. Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Streptokokken der Gruppe A Punktat N + + 0 0 + (bei beruflicher Exposition, z. B. Metzger) Perianal, Vulvovaginal, Scrotum Abdomen, Divertikulitis ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 81/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Leber Escherichia coli Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Peptostreptococcus spp. Punktat N + + 0 0 0 Fusobacterium spp. Punktat N ++ + 0 0 0 Bacteroides spp. Punktat N + + 0 0 0 Entamoeba histolytica Punktat N +++ 0 0 0 + Leishmania donovani Punktat N +++ 0 0 0 + Microsporidien Punktat N +++ 0 0 0 0 Actinomyces spp. Punktat N ++ + 0 0 0 Staphylococcus aureus Punktat N + + 0 0 0 Salmonella spp. Punktat N + + 0 0 + Escherichia coli Punktat N + + 0 0 0 Enterococcus Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Pseudomonas spp. Punktat N + + 0 0 0 Milz Shigella spp. Punktat N + + 0 0 0 Bacteroides spp. Punktat N + + 0 0 0 Propionibacterium spp. Punktat N + + 0 0 0 Clostridium spp. Punktat N + + 0 0 0 Fusobacterium spp. Punktat N ++ + 0 0 0 Candida spp. Punktat N ++ + 0 0 + Aspergillus spp. Punktat N ++ + 0 0 + Leishmania donovani Punktat N +++ 0 0 0 + *Blastomyces dermatitidis (!) Punktat, Biopsie N +++ + 0 0 + Mikrosporidien Punktat, Biopsie N +++ 0 0 0 0 ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 82/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren ---------------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Lebergranulome *Mycobacterium tuberculosis (!) Punktat N + + 0 0 0 *Brucella spp. (!) Punktat N + + 0 0 + Francisella tularensis (!) Punktat Speziallabor Treponema pallidum Punktat N 0 0 0 0 + Echinococcus spp. Punktat N + 0 0 0 + Schistosoma spp. Punktat N + 0 0 0 + *Histoplasma capsulatum (!) Punktat N + + 0 0 + *Coccioides immitis (!) Punktat N + + 0 0 + Coxiella burnetii Punktat N 0 + 0 0 + ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 83/261 7. Infektionen der Knochen und Gelenke Indikation für die mikrobiologische Untersuchung Alle Infektionen der Knochen und Gelenke müssen durch eine mikrobiologische Untersuchung abgeklärt werden. Probengefäß - Universalröhrchen mit blauem Schraubeverschluss - Weithalsgefäß mit Thioglykolatbouillon für intraoperativ gewonnene Materialien der Orthopädie Materialentnahme - Desinfektion der Einstichstelle mit 70%-igem Alkohol (Einwirkzeit 3 min, allenfalls orientierend bis zum Trocknen des Alkohols) - streng aseptisches Vorgehen wie bei der Blutkulturentnahme (Händedesinfektion des Arztes, Einmalhandschuhe, Mundschutz) Untersuchungsvolumen Da in den meisten Fällen nicht mit einer hohen Keimzahl im Gelenkpunktaten ect. zu rechnen ist, sollten möglichst große Mengen an Untersuchungsmaterial entommen und eingesandt werden. Darüber hinaus sollte neben dem kulturellen Erregernachweis eine PCR (spezifisch oder universell) in Erwägung gezogen werden. Transport Der Transport sollte so schnell wie möglich, am besten ≤ 2 h nach Abnahme erfolgen. Ist dies nicht möglich, sollte entweder ein Transportmedium für anspruchsvoll wachsende Mikroorganismen verwendet werden (Thioglykolatbouillon) oder eine Verimpfung der Materialien in Blutkulturflaschen erfolgen. Dennoch sollte die Transportdauer 24 h nicht überschreiten. Die Proben müssen bei Raumtemperatur gelagert werden. 84/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren -------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Osteomyelitis bei Erwachsenen Staphylococcus aureus Punktat N + + 0 0 0 Streptokokken der Gruppe A Punktat N + + 0 0 + Candida spp. Punktat N ++ + + 0 + Pseudomonas aeruginosa Punktat N + + 0 0 0 Salmonella spp. Punktat N + + 0 0 0 Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Propionibacterium spp. Punktat N + + 0 0 0 Enterobacteriaceae Punktat N + + 0 0 0 bei Kindern Haemophilus influenzae nach Trauma Pseudomonas spp. Punktat N + + 0 0 0 Staphylococcus spp. Punktat N + + 0 0 0 Anaerobier Punktat P + + 0 0 0 Arthritis Häufige Erreger Neisseria gonorrhoeae Punktat D/N ++ + 0 0 0 Staphylococcus aureus Punktat N + + 0 0 0 Streptokokken der Gruppe A Punktat N + + 0 0 + Streptococcus pneumoniae Punktat N + + 0 0 0 Enterococcus spp. Punktat N + + 0 0 0 Enterobacteriaceae Punktat N + + 0 0 0 *Brucella spp. (!) Punktat N + + 0 0 + Salmonella spp. Punktat N + + + 0 + *Mycobacterium spp. (!) Punktat N ++ + 0 + 0 Seltene Erreger ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 85/261 8. 8.1 Infektionen des Urogenitaltraktes Zystitis, Urethritis, Pyelonephritis Als wichtigstes Untersuchungsmaterial dient der Urin. Indikation für die Abnahme von Urin Immunsuppression, vor und nach Intervention an den Harnwegen, in der Schwangerschaft, bei Diabetikern, bei neurogenen Harnblasenentleerungsstörungen, bei Fieber, Durchfall, Erbrechen oder unklarer Gedeihstörung beim Säugling, bei unklaren abdominellen Schmerzen oder Flankenschmerzen. Bei asymptomatischen Patienten nach vorausgegangener Bakteriurie, während der Schwangerschaft, bei laborchemischem Verdacht auf eine Harnwegsinfektion (z. B. Hämaturie oder positiver Nitrit-Test) sowie nach Beendigung der antibiotischen Therapie eines komplizierten Harnwegsinfektes. Bei symptomatischen Patienten bei Anzeichen einer Harnwegsinfektion bei stationärem Aufenthalt, bei Fortbestehen der Symptome unter antibiotischer Therapie, bei Fieber oder Sepsis unklarer Genese und bei prädisponierenden Faktoren. Probengefäß - Universal-Probenröhrchen, konisch mit rotem Schraubverschluss - Urin-Eintauch-Nährmedium (Uricult) Uringewinnung Am besten geeignet zur Untersuchung ist der Morgenurin. Im Idealfall sollte zwischen der Gewinnung der Urinprobe und der letzten Miktion mindestens 3 h liegen. Bei einer vorliegenden Pollakisurie ist dies allerdings nicht möglich. Die Urinentnahme sollte vor Beginn einer antibiotischen Therapie erfolgen. Bei positivem Hemmstofftest (Nachweis von antibiotischer Aktivität im Urin) sollte die Urinuntersuchung nach Absetzen der Antibiotika wiederholt werden. Bei der Therapie mit Chinolonen oder Aminoglykosiden ist ein therapiefreies Intervall von 5 Tagen, bei den übrigen Antibiotika von 3 Tagen einzuhalten. 86/261 8.1.1 Mittelstrahlurin Mittel der Wahl für die Uringewinnung ist die Gewinnung von Mittelstrahlurin (MSU), da es dabei zu keiner Beeinträchtigung der Patienten kommt. Bei Kindern wird die Gewinnung von MSU etwa ab dem 4. Lebensjahr empfohlen, wenn keine Balanitis oder Vulvitis vorliegt. Bei den Fällen, bei denen keine eindeutigen Befunde mittels MSU-Proben zu gewinnen sind oder die Gewinnung von MSU nicht möglich ist sowie bei Kindern unter 3 Jahren, müssen andere Verfahren angewandt werden. Die Entnahme von Mittelstrahlurin sollte zur Vermeidung von Kontaminationen sehr sorgfältig durchgeführt werden. bei der Frau - Unterwäsche ausziehen, Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - mit einer Hand Labien spreizen - mit der anderen Hand Vulva mittels einem mit Leitungswasser angefeuchteten Tupfer durch Wischen von vorne nach hinten reinigen, mit einem zweiten Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer nachtrocknen - um Harnrückfluß und damit mögliche Verunreinigung durch Fluor zu verhindern, den dritten Tupfer in den Introitus vaginae einlegen - erste Urinprobe (ca. 50 ml) verwerfen, und ohne den Harnstrahl zu unterbrechen, Urinprobe ( 5 ml) in einem Einwegbecher mit einem weiten Lumen auffangen Beschriften des Gefäßes und bis zum Transport in den Kühlschrank stellen beim Mann - Hände mit Wasser und Seife waschen, mit Einmalhandtuch abtrocknen - Vohaut mit einer Hand zurückstreifen; Glans penis mit der anderen Hand mittels einem mit Leitungswasser angefeuchteten Tupfer reinigen, mit zweitem Tupfer nachreinigen und Harnröhrenöffnung mit einem dritten Tupfer trocknen - erste Urinprobe (ca. 50 ml) verwerfen und, ohne den Harnstrahl zu unterbrechen, Urinprobe ( 5 ml) im sterilen Einwegbecher auffangen - Beschriften des Gefäßes und bis zum Transport in den Kühlschrank stellen 87/261 8.1.2 Katheterurin (Einmalkatheter) Eine transurethrale Katheterisierung kann routinemässig nicht empfohlen werden. Wegen der Gefahr der Keimeinschleppung sollte sie bei Männern oder Jungen zur diagnostischen Uringewinnung gar nicht und bei Frauen oder Mädchen nur in Ausnahmefällen durchgeführt werden, z. B. wenn eine MSU-Gewinnung oder eine Blasenpunktion nicht möglich sind. Abnahme - Patientenaufklärung - Lagerung des Patienten - Hygienische Händedesinfektion - sterile Unterlage ausbreiten, Übergießen der sterilen Tupfer mit Desinfektionsmittel - nach ausreichender Blasenfüllung wird das Orificium urethrae wie oben beschrieben gereinigt und die Umgebung sorgfältig mit einer Desinfektionslösung desinfiziert - bei der Frau wird der letzte Tupfer in den Vaginaeingang gelegt - danach wird unter aseptischen Bedingungen der Katheter ca. 5 cm in die Urethra eingeführt; sobald Urin läuft, Katheter nicht mehr weiter schieben! - nach Einführen des Katheters wird die erste Urinprobe verworfen, dann wird der Urin in einem sterilen Behälter aufgefangen - beim Mann erfolgt zunächst die Applikation eines Loakalanästhetikum-haltigen Gleitmittels mit einer sterilen Spritze in die Urethralöffnung - Einführen des Katheters mit einer sterilen Pinzette etwa 10 cm bis der Urin fließt - am Schluss Katheter durch leichten Zug entfernen 8.1.3 Dauerkatheterurin Um eine Einschleppung von Mikroorganismen in das System zu vermeiden, erfordert die Probenentnahme eine exakte Entnahmetechnik. Abnahme Für die Gewinnung des Untersuchungsmaterials hygienische Händedesinfektion durchführen und Einmalhandschuhe anziehen. Die Uringewinnung erfolgt durch Punktion des Katheters nach sorgfältiger Desinfektion an der bereits für die Punktion vorgesehenen Einstichstelle. Bei länger liegendem Dauerkatheter gibt es folgende Indikationen zur Unrinuntersuchung: 88/261 bei symptomatischen Patienten mit Fieber, bei interventionellen Eingriffen, z. B. bei Katheterwechsel. Bei der Abnahme von Dauerkatheterurin ist darauf zu achten, dass der Urin frisch gewonnen wird. Es sollte kein Urin entnommen werden, der sich über einen längeren Zeitraum im Beutel befand, da im Beutel eine Vermehrung der Keime stattfindet. 8.1.4 Blasenpunktionsurin Durch suprapubische Aspiration von Blasenurin ist eine Kontamination der Probe nahezu ausgeschlossen. Voraussetzung ist eine gut gefüllte Harnblase (ggf. sonographische Kontrolle). Indikationen - Schwierigkeiten hinsichtlich einwandfreier Uringewinnung durch andere Methoden - fragliche bakteriologische Ergebnisse, insbesondere Mischkulturen - V. a. Pyelonephritis bei Säuglingen und Kleinkindern - bei Vorliegen einer Vulvovaginitis, anogenitaler Dermatitis oder bei Phimose Abnahme - Palpation und Perkussion der Harnblase, ggf. sonographische Beurteilung des Füllungsstandes; eine suprapubische Punktion darf nur bei gefüllter Harnblase vorgenommen werden! - Desinfektion der Haut - Hygienische Händedesinfektion durchführen und Einmalhandschuhe anziehen - steriles Abdecken des Unterbauchs mittels Schltztuch - 2 Querfinger oberhalb der Symphyse streng in der Mittellinie wird mit einer 10 cm langen Nadel die Infiltrationsanästhesie gesetzt - dann Vorschieben der Nadel bis in die Blase - Aspiration von Urin - Stichinzision der Haut mit einem Skalpell - Einführen des Punktionsbesteckes durch die Inzisionsstelle in die Blase - nach der Punktion wird ein Schlauch als Zystostomie belassen und die Punktionskanüle entfernt 89/261 - Hautnaht und Fixation des Katheters, steriler Verband, Anschluss an ein geschlossenes Harnableitungssystem - Urinportion im Probengefäß auffangen. 8.1.5 Beutelurin bei Säuglingen Bei Säuglingen und Kleinkindern erfolgt die Gewinnung des Spontanurins mit Hilfe eines Beutels (Beutelurin). In diesem Fall werden die Genitalien wie oben beschrieben gereinigt; danach wird ein selbstklebender Urinbeutel befestigt. Idealerweise sollte dann bei reichlicher Flüssigkeitszufuhr die Miktion abgewartet und danach der Beutel entfernt werden. Diese Methode gilt allerdings nur als orientierende Untersuchung. Jeder positive Befund muss z. B. durch eine Blasenpunktion überprüft werden. 8.1.6 Erststrahlurin Gewinnung des Urins am Morgen vor dem Wasserlassen. Bei V. a. eine Tuberkulose ist Erststrahlurin dem Mittelstrahlurin vorzuziehen (mindestens 30 ml), da sich die Erreger über Nacht im Urin sammeln. Bei einer Leukozyturie ohne signifikante Bakteriurie ist an eine Tuberkulose zu denken. Urinmenge V. a. Zystitis 5 ml Tuberkulose 30 – 50 ml Schistosoma haematobium ca. 400 ml früher Nachmittagsurin (Zeitpunkt höchster Eiausscheidung) Lagerung und Versand Nativurin Der Urin sollte innerhalb 2 h nach Abnahme ins Labor gebracht werden. Ist dies nicht möglich, kann der Urin bis zu 24 h bei 4°C gelagert werden. 90/261 Vorteile von Nativurin - Möglichkeit der makroskopischen und mikroskopischen Beurteilung - Möglichkeit der Untersuchung auf antimikrobielle Substanzen (Hemmstofftest) Nachteile von Nativurin Bei längeren Transportwegen bzw. längerer Aufbewahrung der Proben in ungekühltem Zustand ist die Keimzahl nicht mehr exakt. Urineintauchkulturen Bei der Abahme ist darauf zu achten, dass das Röhrchen gleichmäßig benetzt ist und keine Restflüssigkeit enthält, da diese durch wiederholte Benetzung der Kulturoberfläche während des Transports fälschlicherweise zu erhöhten Keimzahlen führen kann. Die Proben können bei 37°C im Brutschrank bebrütet werden. Bei Keimwachstum Transport ins Labor, die Transportdauer von 24 h sollte aber nicht überschritten werden. Vorteile der Urineintauchkultur - Exakte Keimzahlbestimmung zum Zeitpunkt der Urinabnahme - Alternative bei Verzögerung von Transport und Bearbeitung Nachteile der Urineintauchkultur - makroskopische und mikroskopische Beurteilung nicht möglich - Untersuchung auf antimikrobielle Substanzen nicht möglich → falsch negative Befunde - Keimzahlbestimmung bei konfluierenden Kolonien nicht zulässig - Mischkulturen können nur schwer erkannt werden - anspruchsvoll wachsende Keime werden nicht von allen handelsüblichen Nährmedien erfasst Interpretation Urin ist eine sterile Flüssigkeit. Da die vordere Harnröhre physiologisch mit Bakterien besiedelt ist, kann dies bei der Gewinnung des Urins zu einer klinisch unbedeutenden Kontamination führen. Zu den häufigsten Kontaminanten gehören: koagulasenegative Staphylokokken, Streptokokken der Viridans-Gruppe, Enterokokken, Korynebakterien, Propionibakterien. Diagnostisch bedeutend ist daher die Abgrenzung einer Kontamination von pathogenen Infektionserregern. Zeichen einer Kontamination sind niedrige Keimzahlen, 91/261 Mischkulturen, unterschiedliche Keime in seriellen Proben oder Keime, die gewöhnlich nicht mit einer Infektion der Harnwege assoziiert sind. Bei komplizierten Harnwegsinfektionen ist die Anzüchtung mehrerer Erreger aber nicht ungewöhnlich. Da Patienten mit einem Harnwegsinfekt deutlich höhere Keimzahlen im Urin aufweisen, muss das Ausmaß der Bakteriurie ermittelt werden, d. h. die Urinuntersuchung muss quantitativ erfolgen. In Abhängigkeit von der Uringewinnung sind unterschiedliche Keimzahlen beweisend für eine Infektion der Harnwege: Bedeutung der Keimzahlen in der Urinkultur ________________________________________________________________________________ Uringewinung Kontamination Verdacht auf Harnwegsinfekt Harnwegsinfekt ________________________________________________________________________________ MSU < 10 000 KBE/ml 10 000 – 100 000 KBE/ml > 100 000 KBE/ml Katheterurin < 1 000 KBE/ML 1 000 – 10 000 KBE/ml > 10 000 KBE/ml Blasenpunktat jeder Keimnachweis ________________________________________________________________________________ Unter antibiotischer Therapie und bei erhöhter Diurese sind die Keimzahlen niedrig, auch wenn eine Infektion vorliegt. Bei einer Leukozyturie ohne Bakteriurie ist an eine Urethritis oder eine Infektion durch einen seltenen Erreger zu denken. 92/261 Diagnostisches Vorgehen __________________________________________________________________________ Klinischer Verdacht auf Harnwegsinfektion ↓ Abnahme von Mittelstarhlurin ↓ Beginn einer kalkulierten Antiotika-Therapie Gezielte Therapie nach Befundmitteilung Negativer Erregernachweis und fehlende Besserung gutes Ansprechen der Therapie keine Kontrolluntersuchung ↓ Wiederholung der Untersuchung Rezidiv nach initial gutem Untersuchung ausdehnen auf atypische Erreger Ansprechen ggf. Urethritis-Diagnostik ↓ erneute Urinuntersuchung __________________________________________________________________________ 93/261 Keimspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) Infektionen der Harnwege __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Cystitis akut, unkompliziert Escherichia coli Urin 0 + + 0 0 0 Enterococcus faecalis Urin 0 + + 0 0 0 Staphylococcus saprophyticus Urin 0 + + 0 0 0 Proteus mirabilis Urin 0 + + 0 0 0 Klebsiella spp. Urin 0 + + 0 0 0 Escherichia coli Urin 0 + + 0 0 0 Proteus mirabilis Urin 0 + + 0 0 0 Proteus vulgaris Urin 0 + + 0 0 0 Morganella morganii Urin 0 + + 0 0 0 Providencia spp. Urin 0 + + 0 0 0 Klebsiella spp. Urin 0 + + 0 0 0 Pseudomonas aeruginosa Urin 0 + + 0 0 0 Enterococcus faecalis Urin 0 + + 0 0 0 Corynebacterium urealyticum Urin 0 + + 0 0 0 Candida spp. Urin 0 ++ + 0 0 0 Staphylococcus aureus Urin 0 + + 0 0 0 Escherichia coli Urin 0 + + 0 0 0 Enterobacteriaceae Urin 0 + + 0 0 0 Mycoplasma hominis Urin 0 0 + 0 0 0 Punktat N + + 0 0 0 nosokomial oder kompliziert Pyelonephritis Nierenabszesse Kortikal Staphylococcus aureus __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, N = Nativmaterial (transport < 2 h), D = Direktbeimpfung des Mediums, Mikr = Mikroskopie Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --= nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 94/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Kortikomedullär Escherichia coli Punktat N + + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Staphylococcus aureus Punktat N + + 0 0 0 Escherichia coli Punktat N + + 0 0 0 Proteus spp. Punktat N + + 0 0 0 Klebsiella spp. Punktat N + + 0 0 0 Pseudomonas aeruginosa Punktat N + + 0 0 0 Streptococcus spp. Punktat N + + 0 0 0 Perinephritisch Enterococcus faecalis Punktat N + + 0 0 0 *Mycobacterium spp. (!) Punktat N ++ + 0 + 0 Bacteroides spp. Punktat N + + 0 0 0 Candida spp. Punktat N ++ + + 0 + __________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, N = Nativmaterial (transport < 2 h), D = Direktbeimpfung des Mediums, Mikr = Mikroskopie Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --= nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 95/261 8.2 Urogenitale Infektionen beim Mann 8.2.1 Urethritis Probengefäß - Urinröhrchen - Universal-Abstrichröhrchen mit oranger Kappe - Universal-Probenröhrchen mit blauem Schraubverschluss - Sterile Gefäße mit speziellen Transportmedien Untersuchungsmaterial Für die mikrobiologische Diagnostik der Urethritis ist die 3-Gläser-Probe nach Meares zu empfehlen. Materialentnahme (3-Gläser-Probe) 1. Erste Urinprobe (Gewinnung siehe Harnwegsinfektionen) (5 – 10 ml) 2. Mittelstahlurin (Gewinnung siehe Harnwegsinfektionen) (5 – 10 ml) 3. Urethralsekret bzw. Urethralabstrich Urin Probengefäß Urinröhrchen Transport und Lagerung - ≤ 2 h bei RT oder ≤ 24 h bei 4°C - bei Nachweis von Mykoplasmen ≤ 2 h, RT; eine Lagerung ist nicht möglich - bei Nachweis von Chlamydien mittels LCX ≤ 2 h bei RT oder ≤ 24 h, 4°C - bei Nachweis auf Trichomonas vaginalis ≤ 1 ; eine Lagerung ist nicht möglich. Abstriche Probengefäß Universal-Abstrichröhrchen mit blauer oder oranger Kappe. Abnahme Der Abstrich sollte mindestens 1 h nach dem Wasserlassen abgenommen werden. - Hände desinfizieren und Einmalhandschuhe anziehen 96/261 - mit dem Watteende des Tupfers in die Urethraöffnung streichen; dabei darauf achten, dass der Tupfer nicht mit der Haut in Berührung kommt (Kontamination mit Hautflora) - Tupfer in Gefäß stecken und Gefäß verschließen. Transport und Lagerung Der Transport und die Lagerung müssen innerhalb von 24 h bei Raumtemperatur erfolgen. Zum Nachweis folgender Keime, müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. Es müssen gesonderte Lagerungszeiten eingehalten werden: - Neisseria gonorrhoeae (Thayer-Martin-Agar oder Spezial-Agarplatte) Transport ohne Transportmedium (TM) nicht möglich, in TM ≤ 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX) Transport ohne TM ≤ 2 h bei RT, in TM ≤ 24 h bei 4°C - Mycoplasma hominis und Ureaplasma urealyticum (10 B Medium für Abstrich, Mittelstrahlurin) Transport ohne TM ≤ 2 h bei RT, Abstriche in TM ≤ 24 h bei 4°C - Gardnerella vaginalis und Anaerobier (Abstrich) Transport ohne TM ≤ 2 h bei RT, mit TM ≤ 24 bei RT - Trichomonas vaginalis (Nativurin, erste Urinprobe) Transport ≤ 1 h bei RT, Lagerung nicht möglich 8.2.2 Prostatitis Leitkeim der akuten und chronischen Prostatitis ist Escherichia coli, gefolgt von anderen Enterobacteriaceae. Die Rolle von Chlamydia trachomatis und urogenitalen Mykoplasmen bei der chronisch bakteriellen Prostatitis ist umstritten. Für die mikrobiologische Diagnostik der Prostatitis ist zum Nachweis pathogener Erreger, einschließlich der Ureaplasmen, die 4-Gläser-Probe nach Meares (klassisch oder vereinfacht) zu empfehlen. Als einfache Screening-Untersuchung hat sich der Leukozyten-Nachweis mit einem Teststreifen im Urin vor und nach der Prostatamassage bewährt. Bei fehlender Leukozyturie 97/261 spricht ein positiver Leukozyten-Nachweis im Exprimaturin für eine Prostatitis. Alternativ kann, da Prostataexprimaturin nur in kleinen Mengen zur Verfügung steht, Ejakulat zur Untersuchung eingeschickt werden. Untersuchungsmaterial Klassische 4 - Gläser - Probe: 1. Erste Urinprobe (Gewinnung siehe Harnwegsinfektionen) 2. Mittelstrahlurin (Gewinnung siehe Harnwegsinfektionen) 3. Exprimat nach Prostatamassage 4. Exprimaturin Vereinfachte 4 - Gläser – Probe: 1. Prostataexprimat 2. Exprimaturin 3. Ejakulat Voraussetzung für die quantitative Untersuchung ist ein steriler Mittelstrahlurin (vorherige Überprüfung notwendig!). Exprimaturin Probengefäß Urinröhrchen Abnahme - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung wird die Prostata vom Rektum aus massiert - das ausfließende Exprimat in sterilem Gefäß auffangen - den dann gelassenen Urin in einem sterilen Gefäß auffangen Prostatasekret Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss 98/261 Abnahme - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - nach Reinigung der Harnröhrenmündung wird die Prostata vom Rektum aus massiert - das ausfließende Exprimat in sterilem Gefäß auffangen - bei kleinen Mengen das Sekret mit dem Abstrichtupfer aufnehmen und in Transportmedium einbringen Transport und Lagerung ≤ 24 h bei Raumtemperatur, Ausnahmen wie bei Urethritis beschrieben. Interpretation Eine um den Faktor von mindestens 10 höhere Keimzahl in der Urinprobe nach der Prostatamassage spricht dafür, dass der Infektionserreger in der Prostata lokalisiert ist. 8.2.3 Epididymitis Bei der Epididymitis gelingt der Erregernachweis trotz Einsatzes aller diagnostischen Mittel nur bei zwei Drittel der Patienten. Das diagnostische Vorgehen ergibt sich wie folgt: _____________________________________________________________ Beschwerden Untersuchungsmaterial _____________________________________________________________ Epididymitis Ejakulat, Urethralabstrich Epididymitis mit Harnwegsinfektion Mittelstrahlurin, Urethralabstrich Epididymitis mit Begleiturethritis 3-Gläser-Probe Epididymitis mit Begleitprostatitis 4-Gläser-Probe _____________________________________________________________ Transport und Lagerung Urethralabstriche und-sekrete: ≤ 24 h bei Raumtemperatur, Ausnahmen siehe Urethritis Urin: ≤ 2 h bei Raumtemperatur 99/261 Ejakulat Probengefäß Universal- Weithalsgefäß Abnahme - Hygienische Händedesinfektion durchführen und Einmalhandschuhe benutzen - nach sorgfältiger Reinigung der Genitalien mit wasser und Seife Probe in einem sterilen Gefäß auffangen Transport und Lagerung Der Transport muss umgehend (≤ 2 h) bei Raumtemperatur erfolgen, eine Lagerung ist nicht möglich. Weiter führende Diagnostik bei Infektionen mit seltenen Erregern - Chlamydia trachomatis - Neisseria gonorrhoeae - Ureaplasma urealyticum 100/261 - Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) _______________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Urethritis Neisseria gonorrhoea Urethralabstrich + ++ + 0 0 0 Chlamydia trachomatis Urethralabstrich, Urin ** 0 0 + + + Ureaplasma urealyticum Urethralabstrich B 0 + 0 0 0 Streptokokken der Gruppe B Urethralabstrich + + + 0 0 0 Enterobacteriaceae Urethralabstrich + + + 0 0 0 Escherichia coli 4-Gläser Probe + + + 0 0 0 Enterobacteriaceae 4-Gläser Probe + + + 0 0 0 Pseudomonas aeruginosa 4-Gläser Probe + + + 0 0 0 Staphylococcus aureus 4-Gläser Probe + + + 0 0 0 Enterococcus faecalis 4-Gläser Probe + + + 0 0 0 Trichomonas vaginalis 4-Gläser Probe + +++ 0 0 0 0 Chlamydia trachomatis Ejakulat, Urethralabstr. ** 0 0 + + + Neisseria gonorrhoeae Ejakulat, Urethralabstr. + ++ + 0 0 0 Enterobacteriaceae Ejakulat, Urethralabstr. + + + 0 0 0 Pseudomonas aeruginosa Ejakulat, Urethralabstr. + + + 0 0 0 Ureaplasma urealyticum Ejakulat, Urethralabstr. B 0 + 0 0 0 Prostatitis Epididymitis Urin Orchitis Escherichia coli 4-Gläser Probe + + + 0 0 0 Pseudomonas aeruginosa 4-Gläser Probe + + + 0 0 0 Staphylococcus aureus 4-Gläser Probe + + + 0 0 0 Candida albicans Abstrich + + + 0 0 0 Streptokokken der Gruppe B Abstrich + + + 0 0 0 Staphylococcus aureus Abstrich + + + 0 0 0 Balanitis ________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, ** = Objektträger 101/261 8.3 Urogenitale Infektionen der Frau 8.3.1 Urethritis Die mikrobiologische Diagnose der Urethritis der Frau wird durch den Nachweis pathogener Keime aus dem Urethralabstrich gestellt. Probengefäß - Universal-Abstrichröhrchen mit oranger Kappe - Sterile Gefäße mit speziellen Transportmedien Abnahme Der Abstrich sollte mindestens 1 h nach dem Wasserlassen abgenommen werden. - Hände desinfizieren und Einmalhandschuhe anziehen - mit dem Watteende des Tupfers in die Urethraöffnung streichen; dabei darauf achten, dass der Tupfer nicht mit der Haut in Berührung kommt (Kontamination mit Hautflora) - Tupfer in Gefäß stecken und Gefäß verschließen. Transport und Lagerung Der Transport und die Lagerung müssen innerhalb von 24 h bei Raumtemperatur erfolgen. Zum Nachweis folgender Keime, müssen gesonderte Urethralabstriche abgenommen und in speziellen Transportmedien verschickt werden. Es müssen gesonderte Lagerungszeiten eingehalten werden: - Neisseria gonorrhoeae (Thayer-Martin-Agar oder Spezial-Agarplatte) Transport ohne Transportmedium (TM) nicht möglich, in TM ≤ 24 h bei RT - Chlamydia trachomatis (nativer Abstrich für LCX) Transport ohne TM ≤ 2 h bei RT, in TM ≤ 24 h bei 4°C - Mycoplasma hominis und Ureaplasma urealyticum (10 B Medium für Abstrich, Mittelstrahlurin) Transport ohne TM ≤ 2 h bei RT, Abstriche in TM ≤ 24 h bei 4°C - Gardnerella vaginalis und Anaerobier (Abstrich) Transport ohne TM ≤ 2 h bei RT, mit TM ≤ 24 bei RT - Trichomonas vaginalis (Nativurin, erste Urinprobe) Transport ≤ 1 h bei RT, Lagerung nicht möglich 102/261 8.3.2 Zervizitis Für die Entnahme von Zervixsekret müssen Kontaminationen durch Vaginalsekret (Spekulum-Einstellung) vermieden werden. Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Kappe Abnahme des Zervikalabstrichs - Hände desinfizieren und Einmalhandschuhe anziehen - Vagina mit den Fingern leicht spreizen - Spekulum einführen - mit dem Watteende des Tupfers in die Öffnung des Zervixkanals streichen; dabei darauf achten, dass der Tupfer nicht mit der Schleimhaut der Vagina in Berührung kommt (Kontamination mit Vaginalflora) - Tupfer in Gefäß stecken und versenden Bei Verdacht auf Listeriose sollte das Zervikalsekret am Ende der Menses mit Abstrichtupfern entnommen und, wenn möglich, direkt auf Tryptose- und Blutagar ausgestrichen werden (Agar in der Mikrobiologie anfordern, Tel. 46918). Der Nachweis von Gonokokken und Chlamydien erfolgt wie oben beschrieben. Transport und die Lagerung sind unter Urethritis beschrieben- Transport und Lagerung ≤ 24 h bei RT; Ausnahmen wie bei Urethritis beschrieben. 8.3.3 Endometritis und Salpingitis Wegen der Kontaminationsmöglichkeit lassen Zervikalabstriche nur ungenaue Rückschlüsse auf das Keimspektrum einer Endometritis zu. Zur Untersuchung ist am besten ein intraoperativ oder bei einer Abrasio entnommenes Material geeignet. Der Transport und die Lagerungen erfolgen innerhalb von 24 h bei RT. 103/261 8.3.4 Postpartale Endometritis Die postpartale Endometritis ist eine Infektion, die in zwei klinischen Verlaufsformen beobachtet wird, und die fast immer fieberhaft verläuft (>38°C). Die Frühform tritt 48 h nach der Entbindung ein und ist assoziiert mit einer bakteriellen Vaginose, einer Sectio oder einem Amnioninfektionssyndrom. Die Spätform (>48 h) ist die Folge einer aszendierenden Infektion. Erkrankungen sind auch noch 6 Wochen nach der Entbindung möglich. 8.3.5 Bartholinitis Als Untersuchungsmaterial eignet sich durch den Ausführungsgang entnommenes Exsudat. Bei Abszessen sollten möglichst Punktate vor der Abszessspaltung gewonnen werden. Die Materialien müssen in Transportmedium innerhalb von 24 h bei RT verschickt bzw. gelagert werden. 8.3.6 Bakterielle Vaginose (BV) Bei der BV ist die normale Standortflora der Vagina unterdrückt. Aufgrund der Alkalisierung des pH-Wertes wird das Wachstum von Gardnerella vaginalis und aneroben Bakterien gefördert. Die Diagnose der BV erfolgt in der Praxis anhand der sog. Spiegel-Kriterien, von denen mindestens drei positiv sein müssen: - typischer grau-weißer, homogener Ausfluss - vaginaler pH-Wert > 4,5 - positiver Amintest: Geruchsverstärkung (typischer Fischgeruch) bei Zugabe von 10%iger KOH-Lösung zum Fluor - mikroskopischer Nachweis von Schlüsselzellen (clue cells.vaginale Epithelzellen mit massenhaft Bakterien besetzt). Mikrobiologisch wird die Diagnose der BV durch die Bestimmung des BV-Index im Grampräparat gestellt. Dabei wird die durchschnittliche Anzahl von Laktobazillen, Gardnerella vaginalis und Anaerobiern (Bacteroides und Mobiluncus) pro Gesichtsfeld bestimmt. Ein alleiniger Nachweis von G. vaginalis ist nicht beweisend für eine BV. 104/261 Beurteilungskriterien für das Grampräparat bei Verdacht auf eine BV bei 1000-facher Vergrößerung __________________________________________________________________________ Indexzahl I Laktobazillen Indexzahl II G. vaginalis Indexzahl III gebogene Stäbchen Bacteroides __________________________________________________________________________ 0 4+ 0 0 0 0 1 3+ 1 1+ 1 1+, 2+ 2 2+ 2 2+ 2 3+, 4+ 3 1+ 3 3+ 4 0 4 4+ __________________________________________________________________________ Bewertung: Gesamtindexzahl 4+ = > 30 Morphotypen = Indexzahl I + Indexzahl II + Indexzahl III (Max. 10) 3+ = 6 - 30 Morphotypen 0 - 3 Punkte: kein Hinweis auf BV 2+ = 1 - 5 Morphotypen 4 - 6 Punkte: kein eindeutiger Hinweis auf BV 1+ = < 1 Morphotyp > 7Punkte: Hinweis auf BV Abnahme Vaginalabstrich - Einweghandschuhe anziehen - Vagina mit den Fingern etwa spreizen - mit dem watteende des Tupfers in die Vagina streichen, darauf achten., dass der Tupfer nicht mit der Haut in Berührung kommt, um eine Kontamination mitder physiologischen Vagiinalflora zu vermeiden Objektträgerbeschickung - die Probe sofort nach der Entnahme auf einen sterilen Objektträger aufbringen - Präparat lufttrocknen lassen - Versand in einem bruchsicheren Plastikbehälter. 105/261 8.3.7 Infektionen durch Intrauterinpessare (IUP, Spirale) Probengefäß Steriles Weithalsgefäß Abnahme - Vorbereitung eines sterilen Weithalsgefäßes - Zugabe von ca. 20 ml Ringerlösung (Kochsalz schädigt Aktinomyzeten !) - Entnahme des IUP unter sterilen Kautelen - Überführen in das Transportgefäß Transport Möglichst innerhalb von 2 h bei Raumtemperatur, bei Verdacht auf Aktinomyzeten ist eine Lagerung darüber hinaus nicht möglich. Nachweis von Mycobacterium tuberculosis Zum Nachweis einer Urogenitaltuberkulose ist Menstrualblut am besten geeignet (2-10 ml Menstrualblut in einem sterilen Gefäß auffangen und im Verhältnis 1 : 1 mit Aqua dest. versetzen) Nachweis von Listeria spp. Bei Verdacht auf Listeriose sollte das Zervikalsekret am Ende der Menses mit Abstrichtupfern entnommen und, wenn möglich, direkt auf Tryptose- und Blutagar ausgestrichen werden (Agar in der Mikrobiologie anfordern, Tel. 46918). 106/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren ------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Urethritis Escherichia coli Urethralabstrich, -sekret + + + 0 0 0 Staphylococcus saprophyticus Urethralabstrich, -sekret + + + 0 0 0 Chlamydia trachomatis Abstrich, Sekret, Urin + 0 0 + + + Ureaplasma urealyticum Urethralabstrich, -sekret B 0 + 0 0 0 Neisseria gonorrhoeae Urethralabstrich, -sekret + ++ + 0 0 0 Salpingitis Neisseria gonorrhoeae intraoperativ + ++ + 0 0 0 Chlamydia trachomatis intraoperativ + 0 0 + + + Mycoplasma hominis intraoperativ B 0 + 0 0 0 Peptostreptococcus spp. intraoperativ + + + 0 0 0 Bacteroides spp. intraoperativ + + + 0 0 0 Enterobacteriaceae intraoperativ + + + 0 0 0 Actinomyces spp. intraoperativ + + + 0 0 0 Chlamydia trachomatis Zervixabstrich + 0 0 + + + Escherichia coli Zervixabstrich + + + 0 0 0 Streptokokken der Gruppe A, B Zervixabstrich + + + 0 0 0 Mycoplasma hominis Zervixabstrich B 0 + 0 0 0 *Mycobacterium tuberculosis (!) Zervixabstrich N ++ + 0 + 0 *Actinomyces spp. Zervixabstrich + ++ + 0 0 0 Bacteroides spp. Zervixabstrich + + + 0 0 0 Streptokokken der Gruppe B Zervixabstrich + + + 0 0 0 Escherichia coli Zervixabstrich + + + 0 0 0 Enterococcus spp. Zervixabstrich + + + 0 0 0 Bacteroides spp. Zervixabstrich + + + 0 0 0 Endometritis postpartal __________________________________________________________________________ TM = Transportmedium, S = Spezialmedium, B = 10 B Medium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Diagnose erlauben, --- = Spezialfärbungen,-techniken, die eine mikrobiologische nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, (!) = Keime der Risikogruppe 3, * = langsames Wachstum 107/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ postpartal Prevotella spp. Zervixabstrich + + + 0 0 0 Clostridium spp. Zervixabstrich + + + 0 0 0 Mycoplasma hominis Zervixabstrich B 0 + 0 0 0 Chlamydia trachomatis Zervixabstrich S 0 0 + + + Neisseria gonorrhoeae Zervixabstrich + ++ + 0 0 0 Listeria monocytogenes Zervixabstrich + + + 0 0 0 Trichomonas vaginalis Vaginalabstrich N +++ 0 0 0 0 Candida spp. Vaginalabstrich 0 ++ + 0 0 0 Bacteroides spp. Vaginalabstrich + + + 0 0 0 Prevotella spp. Vaginalabstrich + + + 0 0 0 *Actinomyces spp. Vaginalabstrich + ++ + 0 0 0 Peptostreptococcus spp. Vaginalabstrich + + + 0 0 0 Zervizitis Vaginitis Eubacterium nodatum Vaginalabstrich + + + 0 0 0 Mobiluncus spp. Vaginalabstrich + ++ + 0 0 0 Vaginalabstrich + +* + 0 0 0 Mycoplasma hominis Vaginalabstrich B 0 + 0 0 0 Mobiluncus spp. Vaginalabstrich + ++ + 0 0 0 Bacteroides spp. Vaginalabstrich + + + 0 0 0 Neisseria gonorrhoeae Exsudat + ++ + 0 0 0 Chlamydia trachomatis Exsudat + 0 0 + + + Staphylococcus aureus Exsudat + + + 0 0 0 Anaerobier Exsudat + + + 0 0 0 Bakterielle Vaginose Gardnerella vaginalis (*Nachweis von "clue cells") Bartholinitis _________________________________________________________________________ TM = Transportmedium, S = Spezialmedium, B = 10 B Medium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikros = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier, * = langsames Wachstum 108/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Spirale B-Streptokokken Spirale in Ringer-Lösung 0 --- + 0 0 0 Escherichia coli Spirale in Ringer-Lösung 0 --- + 0 0 0 Actimomyces spp. Spirale in Ringer-Lösung 0 --- + 0 0 0 Candida spp. Spirale in Ringer-Lösung 0 --- + 0 0 0 Ureaplasma urealyticum Amnionfl., Abstr. bei Sectio B 0 + 0 0 0 Mycoplasma hominis Amnionfl., Abstr. bei Sectio B 0 + 0 0 0 Bacteroides spp. Amnionfl., Abstr. bei Sectio N + + 0 0 0 Gardnerella vaginalis Amnionfl., Abstr. bei Sectio N + + 0 0 0 Streptokokken der Gruppe B Amnionfl., Abstr. bei Sectio N + + 0 0 0 Peptostreptococcus spp. Amnionfl., Abstr. bei Sectio N + + 0 0 0 Escherichia coli Amnionfl., Abstr. bei Sectio N + + 0 0 0 Enterococcus faecalis Amnionfl., Abstr. bei Sectio N + + 0 0 0 Amnioninfektionssyndrom _________________________________________________________________________ TM = Transportmedium, S = Stuarts Medium®, B = 10 B Medium, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich (Transport < 2 h); Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Nachweis von Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 9. Infektionen des Gastrointestinaltraktes Indikation zur mikrobiologischen Untersuchung von Stuhl - Diarrhoe durch bakterielle, parasitäre und virale Erreger - Antibiotika-induzierte Diarrhoe (Clostridium difficile) - Verdacht auf Darmtuberkulose Indikation zur ergänzenden Untersuchung bei Infektionen des Magen-Darm-Traktes - Magensaft zur Untersuchung auf Tuberkulose - Magenschleimhautbiopsie zur Untersuchung von Helicobacter pylori - Duodenalsaft zur Untersuchung auf Lamblien - Dünndarmbiopsie zur Untersuchung von Mykobakterien - Dickdarmbiopsie zur Untersuchung von Amöben 109/261 Untersuchungsmaterial - Darminfektionen Für die Diagnose der bakteriellen Darminfektionen sind in erster Linie Stuhlproben und Rektalabstriche geeignet. Rektalabstriche sollten wegen der geringeren Ausbeute nur untersucht werden, wenn Stuhl nicht gewonnen werden kann. In speziellen Fällen sind auch extraintestinale Proben wie Blutkulturen, Urin, Lebensmittel oder auch Operationsmaterial von Bedeutung. - Bei V. a. Typhus oder Paratyphus ist die kulturelle Untersuchung von Blut immer notwendig. - Bei Verdacht auf eine Clostridium difficile –assoziierte Colitis sollte nur flüssiger Stuhl (> 5 ml) untersucht werden. Bei weniger Untersuchungsmaterial ist eine weitere Untersuchung angezeigt. - Bei Verdacht auf Parasitenbefall des Darmes sollten 3 Stuhlproben untersucht werden, die im Abstand zwischen 1 – 3 Tagen eingesandt werden sollten. Stuhluntersuchung Probengefäß Stuhlröhrchen mit Löffel Abnahme - Stuhl in ein sauberes Gefäß oder in eine frisch gespülte Toilettenschüssel entleeren - mit dem im Transportgefäß enthaltenen Löffelchen eine haselnußgroße Menge entnehmen - blutige, eitrige oder schleimige Anteile bevorzugen! Transportund Lagerung - Stuhl muss ohne Kühlung ≤ 24 h, in der warmen Jahreszeit ≤ 12 h transportiert werden, bei längerer Transportdauer Verfälschung der Untersuchungsergebnisse - bei längerem Transport sind Transportmedien zu verwenden (Stuart-Medium) - bei Nachweis von Campylobacter, Shigellen und Cholera ≤ 4 h bei RT 110/261 bei V. a. Cholera ist das Labor sofort telefonisch zu verständigen (Tel. 46940) und die Probe schnellstens durch Boten zu übermitteln! Als Transportmittel sollte alkalisches Peptonwasser mit 1% NaCl verwendet werden (im Labor anfordern, Tel. 46940) - Campylobacter und Shigellen in Transportmediem (Carry-Blair-Medium) ≤ 24 h bei RT - C. difficile zum kulturellen Nachweis ≤ 2 h bei RT, ≤ 24 h bei 4°C - C. difficile zum Toxinnachweis ≤ 2 h bei RT, ≤ 48 h bei 4°C. Rektalabstriche Probengefäß Universal-Abstrichtupfer mit blauer Kappe Abnahme - bei Rektalabstrichen Tupfer bis in das Rektum einführen und vorsichtig mehrmals drehen - Analabstriche sind nicht geeignet Transport und Lagerung ≤ 2 h bei RT, in TM ≤ 24 h bei RT Lebensmittelproben - Lebensmittelproben unter Vermeidung von Kontamination entnehmen - Lebensmittel müssen sofort und gekühlt transportiert werden Duodenalsaft Probengefäß Universal-Probenröhrchen mit Schraubverschluss, fest stehend Abnahme - Hygienische Händedesinfektion und Verwendung von Einmalhandschuhen - Endoskopische Einführung eines Schlauches aus Gummi oder flexiblem Kunststoff in den Zwölffingerdarm durch Mund oder Nase 111/261 - nach erfolgter Einführung in den Magen (ca. 50-60 cm) folgt ein weiteres Vorschieben des Schlauches bei Beckenhoch- und Rechtsseitenlage des Patienten (bis zur Marke 70 - 80cm) - nach Duodenalsondierung Aspiration von Duodenalsaft Transport und Lagerung Der Transport sollte möglichst schnell erfolgen. Ist das nicht möglich müssen die Proben bei Raumtemperatur, aber nicht länger als 24 h gelagert werden. 112/261 Erregerspektrum (alle aufgelisteten Erreger sind im Rahmen der üblichen mikrobiologischen Diagnostik nachweisbar) __________________________________________________________________________ Material Angewandte Nachweisverfahren --------------------------------------------TM Mikr Kultur AG PCR Sero __________________________________________________________________________ Diarrhoe Erwachsene und Kinder Salmonella spp. Stuhl 0 --- + 0 0 0 Shigella spp. Stuhl 0 --- + 0 0 0 Campylobacter spp. Stuhl 0 --- + 0 0 0 Yersinia enterocolitica Stuhl 0 --- + 0 0 + Yersinia pseudotuberculosis Stuhl 0 --- + 0 0 0 Plesiomonas shigelloides Stuhl 0 --- + 0 0 0 Aeromonas hydrophila Stuhl 0 --- + 0 0 0 Vibrio cholerae Stuhl + --- + 0 0 0 Salmonella typhi Stuhl, Blut 0 --- + 0 0 + Salmonella paratyphi Stuhl, Blut 0 --- + 0 0 + Stuhl 0 --- 0 0 + +* Stuhl 0 --- 0 + 0 0 Stuhl 0 --- + 0 0 0 Stuhl 0 +++ 0 0 0 + (C. jejuni, C. coli, C. lari, C. fetus) Kinder < 2 Jahre Escherichia coli (EHEC*, ETEC, EPEC, EIEC) (Toxinnachweis) Antibiotikatherapie/Intensivpflege Clostridium difficile (Toxinnachweis) Candida spp. Persistierende Enteritis (> 3 Wochen) Entamoeba histolytica Giardia lamblia Stuhl 0 +++ 0 0 0 0 Blastocystis hominis Stuhl 0 +++ 0 0 0 0 Clostridium difficile Stuhl 0 --- 0 + 0 0 Stuhl 0 --- + 0 0 0 Appendizitische Symptome Yersinia spp. ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 113/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Reiseanamnese Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Isospora belli Stuhl 0 +++ 0 0 0 0 Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 Strongyloides stercoralis Stuhl 0 +++ 0 0 0 0 Cyclospora cayetanensis Stuhl 0 +++ 0 0 0 0 Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 Vibrio parahaemolyticus Stuhl 0 0 + 0 0 0 Aeromonas hydrophila Stuhl 0 0 + 0 0 0 Plesiomonas shigelloides Stuhl 0 0 + 0 0 0 Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Campylobacter jejuni Stuhl 0 --- + 0 0 0 EHEC Stuhl 0 --- 0 0 + +* Giardia lamblia Stuhl 0 +++ 0 0 0 0 Cryptosporidium spp. Stuhl 0 +++ 0 0 0 0 wässriger Stuhl Fieber, Blut im Stuhl Immunsuppression/HIV-Infektion Entamoeba histolytica Stuhl 0 +++ 0 0 0 + Microsporidium spp. Stuhl 0 +++ 0 0 0 0 Blastocystis hominis Stuhl 0 +++ 0 0 0 0 Strongyloides stercoralis Stuhl 0 +++ 0 0 0 0 Candida spp. Stuhl 0 --- + 0 0 0 atypische Mykobakterien Stuhl 0 +++ + 0 0 0 Biopsat 0 --- + 0 0 + Ulcuserkrankung Helicobacter pylori ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 114/261 __________________________________________________________________________ Material Angewandte Nachweisverfahren -----------------------------------------------------TM Mikro Kultur AG PCR Sero __________________________________________________________________________ Infektionen nach dem Genuß von Lebensmitteln Salmonella spp. Stuhl, Lebensmittel 0 --- + 0 0 + Staphylococcus aureus Lebensmittel 0 --- + 0 0 0 Bacillus cereus Lebensmittel 0 ++ + 0 0 0 Clostridium botulinum Lebensmittel, Blut 0 --- 0 0 0 0 Clostridium perfringens Lebensmittel 0 ++ + 0 0 0 Vibrio parahaemolyticus Stuhl, Lebensmittel 0 --- + 0 0 0 Listeria monocytogenes Lebensmittel 0 --- + 0 0 0 Taenia saginata Stuhl 0 +++ 0 0 0 0 Taenia solium Stuhl 0 +++ 0 0 0 0 (auch Toxinnachweis) (Toxinnachweis) ________________________________________________________________________________________ TM = Transportmedium, S = Stuart-Medium®, P = Port-A-Cul Medium®, D = Direktbeimpfung des Mediums, N = Nativmaterial bzw. nativer Abstrich; Mikr = Mikroskopie (+ = Nachweis von Mikroorganismen allgemein, ++ = Mikroorganismen, gattungsspezifische Zuordnung möglich, +++ = Nachweis von Spezialfärbungen,-techniken, die eine mikrobiologische Diagnose erlauben, --- = nicht durchgeführt), AG = Antigennachweis, Sero = Serologie, Anaerobier 115/261 10. Infektionen durch Parasiten Materialien zur Untersuchung auf Parasiten Endoparasiten (Protozoen und Helminthen) können zu unterschiedlichen Zeitpunkten verschiedene Kompartimente Untersuchungsverfahren und des die menschlichen Materialien sehr Wirtes befallen. unterschiedlich sind Da die (Serologie, mikroskopischer Nachweis in Organbiopsien, Körpersekreten u.ä.) ist ein allgemeines Parasiten-Screening nicht möglich. Vielmehr muss vor der Untersuchung eine Eingrenzung aufgrund der (Reise-) Anamnese sowie der organbezogenen Symptomatik vorgenommen werden. Daraufhin erfolgt die Auswahl des einzusendenden Materials. Bei negativem Befund müssen Untersuchungen gegebenenfalls (mehrmals) wiederholt werden, da die Präpatenzzeit (Zeit bis zum Nachweis von Nachkommen des Parasiten bzw. dessen Geschlechtsprodukten) möglicherweise noch nicht abgelaufen ist. Prinzipiell sind zwei Untersuchungsaufträge möglich: - Parasiten-Diagnostik aufgrund der klinischen organbezogenen Symptomatik - Gezielte Diagnostik bei Verdacht auf eine bestimmte Parasitose Materialentnahme Blut und Knochenmark Nativblut (aus dem Finger, dem Ohrläppchen oder aus der Spritze) ist besser geeignet als Blut mit gerinnungshemmenden Zusätzen. Bei Knochenmark läßt sich wegen der schnell einsetzenden Gerinnung ein Heparinzusatz in der Regel nicht vermeiden. Vom aspirierten Mark werden 0,2 – 0,3 ml steril auf 2 Kulturröhrchen verteilt (Gefäße bei Speziallabor anforderbar, Tel. 46912). Bereits auf Objektträgern ausgestrichenes Blut oder Knochenmark können nach Lufttrocknung ebenfalls versendet werden. Stuhl Bei Verdacht auf Parasitenbefall des Darmes sollten 3 Stuhlproben untersucht werden, die im Abstand zwischen 1 – 3 Tagen eingesandt werden sollten. Stuhlmenge: ca. 5 g (etwa bohnengroß) Lagerung: ≤ 24 h bei Raumtemperatur, in Ausnahmefällen bei 4°C 116/261 Duodenalsaft Duodenalsaft kann zur Untersuchung auf Trophozoiten von Giardien (rascher Transport erforderlich!) und zum Nachweis von Eiern hepatischer Trematoden eingesendet werden. Material darf nicht gekühlt werden! Urin In der Regel wird 24 h-Sammelurin benötigt. Der Versand von größeren Volumina kann vermieden werden, indem ein Sediment des 24 h-Urins vorab hergestellt wird. Sputum Zum Nachweis von Helminthen, die als Larve einen pulmonalen Wanderweg durchlaufen (Ascaris, Hakenwürmer, Strongyloides) sowie von Eiern des Lungenegels kann Sputum bei respiratorischen Symptomen in einem Sputumröhrchen eingesendet werden. Nadelpunktion, Hautbiopsie, Organbiopsie Durch Nadelpunktion oder Hautbiopsie kann Material aus der Randzone von Hautulzera gewonnen werden. Alle Gewebebiopsien (z.B. Leber, Milz, Lymphknoten, Duodenum, Colon) sollten in wenig NaCl versendet werden, damit sie während des Transportes nicht eintrocknen. Tupfpräparate von Organschnitten Diese Materialien können unmittelbar nach dem Eintrocknen auf dem Objektträger versendet werden; eine Fixierung in absolutem Methanol kann auch bereits vor dem Versand erfolgen. Beim Versand sollte darufhin angegeben werden, ob die Präparate bereits fixiert sind. 117/261 Versand Die Proben können mit Ausnahme von Untersuchungen auf Amöben und Giardien bis zu 24 h bei Raumtemperatur gelagert werden. Bei V. a. Giardiasis oder eine invasive Amöbiasis muss frischer Stuhl untersucht werden, d. h. der Stuhl muss innerhalb von 30 Minuten ins Labor gebracht werden (bewegliche Trophozoiten sind etwa eine Stunde lang nachweisbar). Falls trotz wiederholter Stuhluntersuchungen keine Giardien nachweisbar sind, sollte Duodenalsaft untersucht werden. Bei einer asymptomatischen Amöbeninfektion genügt der Nachweis von Amöbenzysten (Dauerformen), d. h. der Stuhl kann bis zu 24 Stunden gelagert werden. 118/261 Parasitendiagnostik aufgrund der klinischen Symptomatik Symptomatik Untersuchung Parasitose Gastrointestinale Symptomatik Mikroskopie v. Stuhl Giardiasis, Amöbiasis, Balantidiose, BlastocystisInfektion, Mikrosporidiose, Kokzidien-Infektion, Nematoden-, Zestoden- und Trematoden-Befall Mikr. v.Duodenalsaft Giardiasis, Befall mit hepatischen Trematoden Blutausstrich/Dicker Tr. Malaria Serologie Amöbiasis, Schistosomiasis, TrematodenInfektionen*, Toxocariasis, Trichinellose Duodenalbiopsie** Giardiasis, Mikrosporidiose, Strongyloidiasis Colon-, Rektumbiopsie** enterale Schistosomiasis Fieber Blutausstrich/Dicker Tr. Malaria, Babesiose, afrik. Schlafkrankheit, ChagasErkrankung, Filariasis Serologie Toxoplasmose, Leishmaniasis, Schistosomiasis, Filariasis*, Chagas-Erkrankung*, Trichinellose Hepatische Erkrankung Mikroskopie v. Stuhl Schistosomiasis, Lebertrematoden-Infektionen, Amöbiasis, Mikrosporidien Mikrosk. v. Duodenalsaft Mikrosporidien, Lebertrematoden-Befall Serologie Amöbiasis, Leishmaniasis, Schistosomiasis, Echinokokkose, Toxocariasis, TrematodenInfektion* Leberbiopsie** Mikrosporidiose, Schistosomiasis, Toxocara-, Trematoden-Infektion Splenomegalie Atemwegserkrankungen Bluttausstrich/Dicker Tr. Malaria, Babesiose Serologie Leishmaniasis Milzbiopsie** Leishmaniasis Mikroskopie v. Sputum Nematoden-Infektionen, Paragonimiasis*, Mikrosporidiose und Kryptosporidiose (immunsupprimierte Patienten) Lymphadenopathie Serologie Echinokokkose, Paragonimiasis* Lymphknotenpunktat** Toxoplasmose, Leishmaniasis, afrik. Schlafkrankheit, Chagas-Erkrankung Serologie Toxoplasmose, Leishmaniasis, Filariasis*, ChagasErkrankung*, afrik. Schlafkrankheit* __________________________________________________________________________ 119/261 __________________________________________________________________________ Symptomatik Untersuchung Parasitose _________________________________________________________________________ Urogenitale Erkrankung Kardiale Erkrankung Mikrosk. v. Vaginalabstr. Trichomoniasis Mikroskopie v. Urin Mikrospiridien, Schistosomiasis Blutausstrich Malaria Blutausstrich Malaria, Chagas-Erkrankung Serologie Toxoplasmose, Trichinellose, Toxocariasis, Chagas-Erkrankung* Hautveränderungen Myokardbiopsie** Chagas-Erkrankung Hautbiopsie**, Punktat Leishmaniasis, Filariasis (Onchozerkose und Mansonellose), Zerkariendermatitis Serologie Leishmaniasis, Schistosomiasis, Onchozerkose*, Trichinellose, Toxocariasis ZNS-Erkrankungen Blutausstrich Liquor Malaria, afrik. Schlafkrankheit Acanthamöben-, Naegleria-Infektionen, afrik. Schlafkrankheit Serologie Toxoplasmose, Toxocariasis, Schistosomiasis, Echinokokkose, Zystizerkose, afrik. Schlafkrankheit* Augen-Erkrankungen Hirnbiopsie** Acanthamöben-, Naegleria-Infektionen Kornealmaterial Acanthamöben-Infektion, Mikrosporidiose Serologie Toxoplasmose, Toxocariasis, Zystizerkose, Echinokokkose, Onchozerkose* Eosinophilie Serologie Toxocariasis, Trichinellose, Schistosomiasis, Filariasis*, Sputum Askariasis, Hakenwurminfektion, Strongyloidiasis Stuhl Askariasis, Hakenwurminfektion, Strongyloidiasis, Schistosomiasis Muskelbiopsie** Trichinellose __________________________________________________________________________ *) Diese Untersuchungen werden auswärtig vom Bernhard-Nocht-Institut durchgeführt (BernhardNocht-Institut für Tropenmedizin, Berhard-Nocht-Str. 74, 20359 Hamburg). **) Es sollte von diesen Materialien immer parallel eine Probe zur histopathologischen Untersuchung n das Institut für Pathologie geschickt werden (ggf. Spezialfärbungen für Parasiten). 120/261 Vorgehen bei der Untersuchung auf bestimmte Parasiten Parasit Probenmaterial Versand Ascaris lumbricoides Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Balantidium coli (bei Metzgern, Bauern) blutiger Stuhl Raumtemperatur, ≤ 1 h Babesia microti, divergens, canis Kapillarblut, evtl. EDTA-Blut Raumtemperatur, ≤ 1 h Bandwürmer (Taenia, Diphyllobothrium, Hymenolepis )Stuhl Raumtemperatur, ≤ 24 h Blastocystis hominis (fakultativ pathogen) Stuhl Raumtemperatur, ≤ 24 h Cryptosporidium parvum (bes. Immunsupprimierte) Stuhl, Bronchiallavage, (Sputum) Raumtemperatur, ≤ 1 h Echinococcus ssp. Serologie Raumtemperatur, ≤ 24 h Ektoparasiten (Flöhe, Läuse, Zecken) Parasit selbst oder Teile dessen 70%-iger Alkohol Endoparasiten (ganze Würmer oder Bestandteile) Parasit selbst oder Teile dessen Kochsalzlösung, ≤ 24 h Entamoeba histolytica Stuhl mit blutigem Schleim Raumtemperatur , ≤ 1 h Serum bei invasiven Formen Raumtemperatur, ≤ 24 h perianales Abklatschpräparat Raumtemperatur, ≤ 24 h Enterobius vermicularis (Oxyuren) (Tesafilm aufObjtr.) Filarien (Haut: Onchocerca u.a.) Skin snips in NaCl, Raumtemperatur , ≤ 1 h (Scapula, Beckenkamm, Wade) Filarien (Blut: Loa, Wuchereria, Brugia u.a.) Serologie* Raumtemperatur, ≤ 24 h EDTA-Blut (12:00 Loa, Raumtemperatur , ≤ 1 h 24:00 Wuchereria/Brugia), Giardia lamblia Serologie* Raumtemperatur, ≤ 24 h Stuhl, Duodenalsaft Raumtemperatur, ≤ 1 h Hakenwürmer (Ancylostoma, Necator) Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Kokzidien (Isospora, Cyclospora, Sarcocystis) Stuhl Raumtemperatur, ≤ 24 h Lebertrematoden (Fasciola*, Clonorchis u.a.) Stuhl, Serum*, Duodenalsaft Raumtemperatur, ≤ 24 h Leishmania spp. .bei kutaner Leishmaniose Punktat, Biopsie Raumtemperatur, ≤ 1 h Leishmania spp. bei viszeraler Form Punktat, Biopsie, Serum Raumtemperatur ,≤ 1 h Leishmania spp. bei mukokutaner Form Punktat, Biopsie, Serum Raumtemperatur ,≤ 1 h Mikrosporidien (Enterocytozoon spp. u.a.) Stuhl, Urin, Duodenalaspirat Raumtemperatur, ≤ 24 h Duodenalbiopsie, Konjunktivalabstrich, Raumtemperatur ,≤ 1 h Korneaspäne Paragonimus spp. (nach Krabbengenuß) Sputum, Serologie* Raumtemperatur, ≤ 24 h Plasmodium spp. (Malaria) Kapillarblut, evtl. EDTA-Blut Raumtemperatur ,≤ 1 h Schistosoma haematobium (Blasenbilharziose) 24 h-Sammelurin, Serologie, Raumtemperatur, ≤ 1 h S. japonicum, S. mansoni u.a. (Darmbilharziose) Stuhl, Serologie, Rektumbiopsie Strongyloides stercoralis Stuhl, (Sputum) Raumtemperatur, ≤ 24 h Toxocara canis, catis Serologie Raumtemperatur, ≤ 24 h Toxoplasma gondii Serologie, Lypmhknotenaspirat Raumtemperatur, ≤ 24 h Trichomonas vaginalis Zervix-, Vaginalsekret, Urin Raumtemperatur, ≤ 24 h Trichuris trichiura Stuhl Raumtemperatur, ≤ 24 h Trichinella spiralis Serologie, Muskelbiopsie Raumtemperatur, ≤ 1 h Trypanosoma brucei rh/gamb (afrik. Schlafkrankheit) EDTA-Blut, Liquor, Serologie* Raumtemperatur, ≤ 1 h Trypanosoma cruzi (Chagas-Erkrankung) EDTA-Blut, Organbiopsien, Serologie* Raumtemperatur, ≤ 1 h Blasenbiopsie Raumtemperatur, ≤ 1 h 121/261 III Diagnostik bei Infektionen mit seltenen Erregern Acanthamoeba Klinik Acanthamöben verursachen im ZNS eine Meningoenzephalitis und am Auge eine Keratitis. Der mikrobiologische Nachweis erfolgt mikroskopisch oder kulturell. Untersuchungsmaterial - Liquor bei Enzephalitis - Abstrich aus Hornhautulzera - Hornhaut-Abrasio-Material - Hornhautgeschabsel auf Objektträger - Kontaktlinsen oder Kontaktlinsen-Aufbewahrungsmedium Probengefäß Universalröhrchen mit blauem Schraubverschluss Zur kulturellen Anzüchtung muss ein Transportmedium (Page-Medium) verwendet werden (Anforderung unter Tel. Nr. 46939). Transport Der Transport muss innerhalb von 2 h bei Raumtemperatur erfolgen. Da Acanthamöben kälteempfindlich sind, sollen die Untersuchungsmaterialien nicht im Kühlschrank aufbewahrt werden. Lagerung Eine längere Lagerung ist nicht möglich Dauer der Untersuchung Die mikroskopische Untersuchung dauert ca. 2 h, die kulturelle Anzüchtung bis zu. 7 Tagen.. 122/261 Actinomyces spp. Klinik Aktinomyzeten verursachen zervikofaziale, thorakale, abdominale und pelvine Aktinomykosen. Untersuchungsmaterial Geeignet sind endoskopisch gewonnene Bronchialsekretproben, Absezss- oder Empyemeiter durch transthorakale Lungenpunktion oder durch perkutane Nadelbiopsie gewonnen. Probengefäß - Universal-Probenröhrchen mit blauen Schraubverschluss - Universal-Probenröhrchen mit Thioglykolatbouillon - Universal-Abstrichröhrchen mit blauer Kappe Untersuchungsmaterialien Abszesspunktate, Wundabstriche, Fistelsekret, Biopsien, respiratorische Sekrete, intraoperativ gewonnene Materialien, Spiralen Transport: - ≤ 2 h bei RT Lagerung - ≤ 24 h im Transportmedium bei RT - Aktinomyzeten sind sehr kälteempfindlich und dürfen nur kurzfristig bei 4°C gelagert werden - manche Aktinomyzeten sind empfindlich gegen Kochsalz und sollten daher nicht mit Kochsalz versetzt werden; zum Transport sollte Ringerlösung verwendet werden. Dauer der Untersuchung Die kulturelle Anzüchtung ist langwierig und dauert etwa 2 Wochen. 123/261 Anaerobier Klinik Abszesse, Pleuraempyem, Aspirationspneumonie, Appendizitis., Peritonitis, infizierte Ulzera Untersuchungsmaterialien Geeignete Materialien Abszess- und Biopsiematerial, Fistelsekrete, Eiter aus tiefen Wunden, intraoperative Abstriche (falls die Gewinnung von Aspiraten nicht möglich), Punktate (z. B. Pleurapunktat), Pericardflüssigkeit, Peritonealflüssigkeit, Ascites, Gewebeproben bei Myositis oder Cellulitis, tracheales Aspirat, bronchoalveoläre Lavage (BAL), Blasenpunktionsurin, Nierenbeckenurin, Zervixabstriche, Knochenstücke bei Osteomyelitis, Blutkulturen und Liquores, jedoch nur auf Anforderung und bei V.a. Hirnabszess. Ungeeignete Materialien Alle Materialien, die mit Normalflora kontaminiert sind, sind zur Untersuchung auf Anaerobier ungeeignet (Sputum, Trachealsekret, Vaginalabstriche): Nasen- oder Rachenabstriche, Abstriche von oberflächlichen Wunden, Sputum, Mittelstrahl- oder Katheterurin und Vaginalabstriche. Probegefäße - Universal-Abstrichtupfer mit blauer Kappe (enthalten Transportmedium für Anaerobier) - Universal-Probenröhrchen mit blauem Schraubverschluss (enthalten kein Transportmedium, daher nur für den sofortigen Transport geeignet) - Probenröhrchen mit Thioglykolatbouillon (anzufordern unter Tel. 46939) Materialentnahme - Untersuchungsmaterialien rasch und blasenfrei entnehmen - die Materialien dürfen nicht mit Normalflora kontaminiert werden, daher empfiehlt sich vor der Abnahme eine gründliche Desinfektion der Haut bzw. Schleimhaut und die Aspiration mit Kanüle und Spritze - falls möglich, Einsendung von Punktionsmaterial (>1 ml) oder Gewebebiopsien (in wenig Kochsalz oder besser in hochwertiger Nährbouillon oder Ringer-Lösung) 124/261 - statt Ulzera sind Biopsate oder Aspirate zu bevorzugen, die möglichst vom Ulkusrand entnommen werden sollten - Abstriche sind nur in Ausnahmefällen und mit Transportmedium zu verwende - Wichtige Materialien wie Hirnabszesse sollten telefonisch im Labor (Tel. 46939) angemeldet werden. Transport und Lagerung Die Materialien müssen von der Probenahme bis zur Verarbeitung im Labor vor Sauerstoffeinfluß geschützt werden! Die Transportzeiten sind daher so kurz wie möglich zu halten; am besten sollten die Proben sofort nach der Gewinnung in das Labor geschickt werden. Ist dies nicht möglich, müssen Transportmedien für Anaerobier verwendet werden, ersatzweise, falls nicht anders möglich,Transportmedien für anspruchsvoll wachsende Keime oder Blutkulturflaschen, in die das Material eingeimpft wird. Ein trockener Abstrich ist unakzeptabel! Flüssige Materialien sollten nicht in verschlossenen Spritzen transportiert werden, der Spritzeninhalt sollte in ein steriles Gefäß überführt werden. Liquor sollte sofort nativ und nicht in Nährmedien transportiert werden! Die Untersuchungsmaterialien bis zum Transport bei Raumtemperatur lagern! Sie gehören weder in den Kühlschrank noch sollten sie eingefroren werden! - flüssige Materialien (Punktate, Sekrete usw.): ohne Transportmedium: ≤ 2 h bei Raumtemperatur mit Transportmedium: ≤ 24 h bei Raumtemperatur - Biopsiematerial: ohne Transportmedium: ≤ 2 h bei Raumtemperatur - Abstriche: ohne Transportmedium: ≤ 2 h bei Raumtemperatur mit Transportmedium ≤ 24 h bei Raumtemperatur Dauer der Untersuchung Kultur 4-7 Tage, Resistenzbestimunng 2 Tage. 125/261 Aspergillus spp. Klinik Organ- und Systemmykosen, Otomykose Untersuchungsmaterial - Sputum, BAL, Bronchial-, Trachealsekret, Spülflüssigkeit, Liquor, Biopsiematerial - Blut, Liquor und Sekrete aus den Atemwegen für den Antigenenachweis Um die Sensitivität der Sputumkultur zu steigern, sollten bei klinischem Verdacht wenigstens 3 aufeinanderfolgende Kulturen untersucht werden. Bei immunsupprimierten Patienten empfiehlt sich der wesentlich sensitivere Antigennachweis. Probengefäß Universal-Probenröhrchen mit blauer Verschlusskappe Untersuchungsmethode - Mikroskopie des Nativmaterials - Kultur mit Resistenzbestimmung (MHK) - Antigennachweis - Serologie Aspergillen sind aus Blut und Liquor nur selten anzüchtbar (geringe Sensitivität), ggf. kann ein Anzüchtungsversuch mit Nativblut in einer mykologischen Bouillon versucht werden (Kontaktaufnahme mit dem Pilzlabor Tel. 46910). Aufgrund der besseren Sensitivität empfiehlt sich bei V. a. eine Aspergillose ein AntigenNachweis aus Blut, Liquor oder aus Sekreten aus den Atemwegen. Der im Institut durchgeführte Platelia-Test Antigennachweis hat eine Sensitivität von 60-90% und eine Spezifität von 90%. Transport und Lagerung ≤ 24 h bei Raumtemperatur (Aspergillen sind empfindlich gegenüber Kälte) Dauer der Untersuchung Mikroskopie: 30 – 60 min Kultur: 2 – 5 Tage, Resistenzbestimmung 2 Tage (muss gesondert angefordert werden!) Antigennachweis: 1 Tag. 126/261 Außereuropäische Pilze Dazu gehören Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis und Paracoccidioides brasiliensis. Außereuropäische Pilze gehören zu den Mikroorganismen der Risikogruppe 3. Wegen der Gefahr einer Laborinfektion sollte bei V. a. eine außereuropäische Pilzinfektion das Labor vor Einsendung des Materials telefonisch verständigt werden (Tel. 46910). Außerdem muß ein Vermerk auf dem Einsendeschein gemacht werden. Klinik Außereuropäische Pilze verursachen Pneumonien und Organmykosen insbesondere im ZNS. Untersuchungsmethoden - Kultur - Serologie Untersuchungsmaterial - Sputum, BAL, Trachealsekret, Bronchialsekret - Liquor - Abszessmaterial, Punktate, Biopsien Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichtupfer Die Gefäße müssen bruchsicher sein! Transport und Lagerung ≤ 24 h bei Raumtemperatur Dauer der Untersuchung Die kulturelle Anzucht kann bis zu 4 Wochen dauern. Ein negativer Befund wird nach 4 Wochen erstellt. 127/261 Bacillus anthracis (Anthrax) Wegen der Gefahr einer Laborinfektion, Verdachtsdiagnose "Anthrax" oder "Milzbrand" auf dem Einsendeschein vermerken! B. anthracis gehört zu den Mikroorganismen der Risikogruppe 3. Infektionen treten nach Exposition zu Weidetieren (Rinder, Schafe, Ziegen, Pferde, Schweine) auf, ferner bei Kontakt mit Roh-Wolle und Fellen. Betroffen sein können Veterinäre, Scherer, Gerber sowie Beschäftigte in Woll-, Leder- und Pinselfabriken. Bei der Hautinfektion bildet sich an der Inokulationsstelle eine hämorrhagische Pustel mit zentraler Nekrose. Lymphogene Aussaat ist möglich. Klinik Lungen-, Haut- und Darmmilzbrand Untersuchungsmaterial Sekrete der Atemwege, Wundabstriche, Biopsien Untersuchungsmethode - Kultur mit Resistenzbestimmung - Identifizierung der Erreger mittels PCR Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Verschlusskappe Transport: und Lagerung ≤ 24 h bei Raumtemperatur oder bei 4°C. Dauer der Untersuchung Die Dauer der Untersuchung beträgt ca. 4 Tage. 128/261 Bartonella spp. Klinik Bartonellen verursachen in den meisten Fällen die Katzenkratzkrankheit (B. henselae), die durch Bisse, häufiger jedoch durch Kratzverletzungen von Katzen auf den Menschen übertragen werden. Nach 2 Wochen kommt es zu einer regionalen Lymphadenopathie, zu Kopfschmerzen, Fieber und Müdigkeit. Schwere Verläufe einer Enzephalitis, chronische Lymphadenopathien, Bakteriämien mit und ohne Endokarditis sind beschrieben. Bei immunsupprimierten Patienten kann sich eine generalisierte Form mit Beteiligung von Leber, Milz und Knochenmark entwickeln. Der Erreger der Katzenkratzkrankheit ist Bartonella henselae. B. henselae ist auch der Erreger der bazillären Angiomatose und der bazillären Peliosis. B. quintana verursacht das WOLHYNISCHEN Fieber (Fünftagefieber, trench fever) und führt bei HIV-infizierten und anderen immungeschwächten Patienten zu Bakteriämien und Lymphadenopathien. Untersuchungsmaterial Blut, Biopsiematerial, Lymphknoten Untersuchungsmethode - Kultur mit Resistenzbestimmung - PCR - Serologie Die Anzüchtung der Bakterien aus Blut und Biopsiematerial wird in Speziallaboratorien, (Institut für Mikrobiologie der Universität Tübingen, Tel. ....) durchgeführt. Da die üblichen Blutkultursysteme Inhibitoren enthalten, müssen diese vorher im Labor neutralisiert werden. Auch unter optimalen Bedingungen gelingt der Erregernachweis selten. Sehr sensitiv sind dagegen die PCR oder der Antikörpernachweis. Beide Untersuchungen werden im Institut für Mikrobiologie der Universität Tübingen durchgeführt. Gegebenenfalls kann die Diagnose histologisch durch den Nachweis stäbchenförmiger Bakterien mit der WARTHIN-STARRYSilberfärbung (Pathologie) bestätigt werden. Probengefäß Universal-Probenröhrchen mit blauem Schraubverschluss 129/261 Transport und Lagerung Wegen der Empfindlichkeit der Erreger sollte die Transportzeit kurz sein (≤ 1 h). Eine Lagerung ist nur in Blutkulturflaschen möglich. Dauer der Untersuchung Die kulturelle Anzüchtung erfordert mindestens 14 Tage. PCR und Serologie 1 Tag. Allerdings werden die Untersuchungen nicht täglich durchgeführt. 130/261 Bordetella pertussis/parapertussis Klinik Der typische Verlauf des Keuchhustens wird in 3 Stadien eingeteilt: Beginn mit dem Stadium catarrhale über 1–2 Wochen, Stadium convulsivum über 4-6 Wochen und im Anschluss daran das Stadium decrementi. Untersuchungsmaterial - transnasale Rachenhinterwandabstriche - nasopharyngeale Absaugungen - Rachenabstriche sind ungeeignet Untersuchungsmethoden - Kultur (Sensitivität bei 60-70%) - PCR (ist der Kultur überlegen) - Serologie Die Anzüchtung der Erreger des Keuchhustens ist nur während der katarrhalischen Phase und während des frühen Konvulsivstadiums auf Spezialagar möglich. Probengefäß - Universal-Probengefäße mit Transportmedien - Calcium-Alginat oder Dacrontupfer mit flexiblem Führungsdraht (Abstrichtupfer mit oranger Kappe) mit Transportmedium für anspruchsvoll wachsende Keime - feste Spezialnährmedien (Bordetella-Platten, anzufordern unter Tel. 46939) - Probengefäße mit Regan-Lowe-Medium (cephalexinhaltiges Kohle-Pferdeblutmedium), das für den Postversand geeignet ist Abnahme Nasopharyngeale Aspirate werden mit einem engen Katheter oder einer nasopharyngealen Sonde für Kinder aus dem hinteren Nasopharynx durch die Nasenlöcher entnommen. Dazu eignen sich Calcium-Alginat- oder Dacron-Tupfer mit einem flexiblen Fürhrungsdraht Wattetupfer (Abstrichtupfer mit blauer Kappe) wirken wachstumshemmend auf Bordetellen und sind daher nicht geeignet. Calcium-Alginat-Tupfer können auf die PCR inhibitorisch wirken. 131/261 Transport mit Transportmedium ≤ 2 h, ein Transport ohne Transportmedium ist nicht möglich. Lagerung Bei Verwendung von Transportmedien ≤ 24 h bei RT. Dauer der Untersuchung Die Anzüchtung dauert 3-4 Tage, die PCR einen Tag. Der Nachweis von IgA- oder IgG-Antikörpern ist für die Akutdiagnostik nicht geeignet. Er ist für epidemiologische Fragestellungen von Interesse. 132/261 Brucella spp. Brucellen gehören zu den Mikroorgannismen der Risikogruppe 3. Wegen der Gefahr der Laborinfektion sollten alle Antragsformulare den Vermerk “cave Brucellose“ haben. Klinik Infektionen mit Brucellen treten nach Exposition zu Rindern (Brucella abortus, Morbus Bang), Schweinen (B.suis), Ziegen (B.melitensis, Maltafieber) oder nach Verzehr von unpasteurisierten Milchprodukten auf. Beschäftigte als Veterinär- oder Tierpfleger sind häufiger betroffen. Menschen aus Mittelmeerländern oder aus der Türkei erkranken ebenfalls häufiger an einer Brucellose (Reiseanamnese!). Untersuchungsmaterial Blut, Abszessmaterial, Knochenmark, Liquor; wenig geeignet ist Urin Untersuchungsmethode - Kultur - PCR (in Speziallaboratorien) - Serlogie Die Anzüchtung der Brucellen aus Blutkulturen erfolgt im Institut für Hygiene und Mikrobiologie und dauert etwa 8 - 21 Tage. Die Differenzierung auf Speziesebene und Resistenzbestimmnng erfolgen beim RKI in Berlin. Bei Brucelloseverdacht sind zusätzliche serologische Untersuchungen dringend erforderlich. 85% der Brucellosen werden nur serologisch daignostiziert. Probegefäß - Blutkulturflaschen für flüssige Untersuchungsmaterialien - Biopsate in wenig physiologischer Kochsalzlösung Transport und Lagerung - Blutkulturflaschen ≤ 24 h bei RT - Abszessmaterial ≤ 1 h bei RT, dann einfrieren bei minus 70°C oder Verimpfen in Blutkulturflaschen. Dauer der Untersuchung Kulturelle Anzüchtung 5 – 21 Tage, PCR 1 Tag. 133/261 Candida spp. Bei der Untersuchung von Pilzen sind klinische Angaben unverzichtbar, denn nur unter Berücksichtigung des Immunstatus des Patienten und der klinischen Symptome kann eine Wertung des Befundes erfolgen. Die Zusammenarbeit zwischen Kliniker und Mikrobiologen ist daher Voraussetzung für eine aussagekräftige Diagnostik. Klinik Man unterscheidet oberflächliche Candidosen der Haut (Windelsoor, Vaginalsoor) und Candidosen der Schleimhäute (Mundsoor, Soor des Oesophagus) sowie Organmykosen mit Absiedelung im ZNS. Untersuchungsmethoden - Mikroskopie - Kultur - Antigen-Nachweis - PCR - Serologie Die Sensitivität des Antigentestes liegt bei ca. 76%, die Spezifität bei 79%.Wegen der kurzen Halbwertszeit des Antigens im Serum sind engmaschige Antigenbestimmungen notwendig. Die Sensitivität der PCR leigt bei etwa 80%, die Spezifität bei 79%. Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Sputumröhrchen - Universal-Abstrichröhrchen mit blauer Kappe - Urinröhrchen - Stuhlröhrchen Untersuchungsmaterial Geeignet ist nur Material aus den tiefen Atemwegen, kein Sputum! Um das Ausmaß einer Candida-Besiedlung für eine Infektion abschätzen zu können, sollte bei Immunsupprimierten stets Untersuchungen anderer Materialien (Blut, Urin) sowie ein Antigen-Test oder ein histologischer Nachweis angestrebt werden. 134/261 __________________________________________________________________________ Klinik Ra-Abstrich BAL Stuhl Sputum Katheter- Blut Urin __________________________________________________________________________ Status bei Immunsuppression + + + + ± Sepsis, Endokarditis 0 0 + + + Infektion der Harnwege 0 0 + + 0 Infektion des Genitaltraktes Gental-Abstr. 0 + + 0 Infektion der Atemwege + + 0 0 0 Infektion Verdauungstrakt + 0 + 0 0 Meningitis + 0 + + Liquor _________________________________________________________________________ Transport und Lagerung ≤ 2 h bei Raumtemperatur, ≤ 24 h bei 4°C. Dauer der Untersuchung Die Dauer der Untersuchung liegt bei 2 Tagen. Eine Resistenzbestimmung ist möglich und muss gesondert angefordert werden. Interpretation Jeder positive Candida-Nachweis im Blut, Liquor, Blasenpunktionsurin, BAL oder sterilen Kompartimenten muss als pathologisch angesehen werden und bedarf der diagnostischen Abklärung. Negaive Kulturbefunde schließen eine Candida-Infektion nicht aus. Der Nachweis von Candida-Antigen im Serum ist als Hinweis auf eine invasive CandidaInfektion zu werten, jedoch nicht als Beweis. Negative Candida-Antigenbefunde schließen eine Mykose nicht aus. Antigenteste eigenen sich zur Therapiekontrolle von Candidosen (Absinken des Antigentiters bei Therapieerfolg). 135/261 Capnocytophaga canimorsus Klinik Der Erreger kann durch Hundebisse übertragen werden und führt vor allem bei immunsupprimierten Patienten, bei Patienten mit Hepatopathien oder bei splenektomierten Patienten zu schweren septischen Verläufen mit Endokarditis, Meningitis mit einer hohen Letalität von 25%. Untersuchungsmaterial Wundabstriche, Wundsekrete Untersuchungsmethode Kultur Probengefäß - Universal-Abstrichröhrchen mit blauer Kappe - Universal-Probenröhrchen mit blauem Schraubverschluss Transport und Lagerung Der Transport sollte sofort (≤ 1 h) bei RT durchgeführt werden. Eine Lagerung ist nicht erlaubt Dauer der Untersuchung Der mikrobiologische Nachweis erfolgt durch kulturelle Anzüchtung und Bestätigung mittels Sequenzierung. Die Dauer der Untersuchung beträgt ca. 5 Tage. 136/261 Chlamydien Chlamydia trachomatis Klinik Durch C. trachomatis werden Infektionen der Konjunktiva, des Urogenitaltraktes (Urethritis, Zervizitis, Salpingitis, Adnexitis, Epididymitis, Prostatitis) und der Atemwege (Pharyngitis, Otitis nedia, Bronchitis, Pneumonie bei Neu- und Frühgeborenen verursacht. In seltenen Fällen kommt es zu Myokarditis, Endokarditis, Peritonitis und Arthritis. Untersuchungsmethode - Mikroskopischer Nachweis durch Imunfluoreszenz - PCR - Serologie Da der kulturelle Erregernachweis aufwendig und wenig sensitiv ist, erfolgt die Diagnostik mittel der Immunfluoreszenz oder mittels der Ligase-Ketten-Reaktion (LCX) Untersuchungsmaterial Atemwege Trachealsekret und BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum ist ungeeignet. Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. Urogenitaltrakt - Universal-Abstrichtupfer mit oranger Kappe - Erststrahlurin für die PCR - Serum zum Antikörpernachweis Konjunktivitis Konjunktivalabstrich Probengefäß - Universalabstrichtupfer mit oranger Kappe - Universal-Probenröhrchen mit blauem Schraubverschluss - Objektträger mit markierten Testfeldern für die Immunfluoreszenz (Tel. 46939) 137/261 Materialentnahme Urethralabstrich Der Abstrichtupfer wird 2 – 3 cm tief in die Harnröhre eingeführt. Drehbewegungen bei der Entnahme sollen erreichen, dass möglichst viel mit Chlamydien infizierte Epithelzellen am Tupfer haften. Die Patienten sollten mindestens 1 h vor der Probenentnahme nicht mehr uriniert haben Konjunktivalabstrich Die Abstriche werden durch Auswischen des unteren Konjunktivalsacks mit sterilen Dacrontupfern, die vorher mit einem flüssigen Transportmedium befeuchtet wordensind, gewonnen. Auch wenn nur ein Auge entzündet ist, sollten stets beide Augen abgestrichen werden (ein Abstrich dient zur Kontrolle). Rachenabstrich, Trachealsekret siehe Infektionen des Respirationstraktes Objektträger für die Immunfluoreszenz - Tupfer kräftig auf dem Testfeld des Objektträgers ausrollen, so dass die Testfläche bedeckt ist - Material kurz trocknen lassen, dann mit Methanol 5 min lang fixieren und lufttrocknen Transport und Lagerung PCR ≤ 2 h bei RT oder ≤ 24 h bei 4°C Immunfluoreszenz sofortiger Transport des Objektträgers bei Zimmertemperatur in bruchsicheren Gefäßen (Transportküvette) oder Lagerung bei 4°C bis zu 24 h. Dauer der Untersuchung Die Dauer der Untersuchung beträgt bei der PCR 1 Tag, bei der Immunfluoreszenz 4 h. 138/261 Chlamydophila pneumoniae Klinik Durch C. pneumophila werden Infektionen der oberen (Sinusitis, Pharyngitis, Otitis media) und unteren Atemwege (Bronchitis, Pneumonie) verursacht. Untersuchungsmethode - PCR - Serologie Untersuchungsmaterial - Trachealsekret und BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum ist weniger gur geeignet. Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. - Serum für den Nachweis von Antikörpern Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Kappe Probenentnahme siehe Infektionen des Respirationstraktes Transport und Lagerung ≤ 24 h bei 4°C für die PCR Dauer der Untersuchung Die Dauer der PCR beträgt 1 Tag; die Untersuchungen werden nicht täglich durchgeführt. 139/261 Chlamydophila psittaci Klinik Durch C. psittaci werden Infektionen der unteren Atemwege (Pneumonie mit Schüttelfrost, hohem Fieber, Kopf- und Muskelschmerzen und Exanthem) verursacht. Untersuchungsmethode - PCR - Serologie Die PCR und weiterführende Serologie wird im Nationalen Referenzzentrum für Chlamydien, Universität Jena, durchgeführt. Untersuchungsmaterial - Trachealsekret und BAL, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser oropharyngeale Absaugungen, Sputum. Die Materialien sollten zellreich sein, da Chlamydien nur intrazellulär wachsen. - Serum für den Nachweis von Antikörpern Probengefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichtupfer mit blauer Kappe Probenentnahme siehe Infektionen des Respirationstraktes Transport und Lagerung ≤ 24 h bei 4°C für die PCR, bei längerem Transport einfrieren bei minus 70°C. Dauer der Untersuchung Die Dauer der PCR beträgt 1 Tag; da die Untersuchungen in Jena durchgeführt werden, kann die Diagnostik bis zu 1 Woche dauern. 140/261 Corynebacterium diphtheriae Ein Verdacht auf Diphtherie sollte immer im Labor angemeldet werden, ferner sollte der Dianstarzt verständigt werden. Klinik C. diphtheriae verursacht die Diphtherie der Atemwege und in seltenen Fällen eine Hautdiphtherie. Die Hautmanifestation der Diphtherie kann sich auf 3 verschiedene Arten äußern: - durch Infektion der intakten Haut (aus einer pustulösen Läsion geht ein Ulkus hervor; der Ulkusboden ist mit einer grau-weißen Membran bedeckt) - durch Wundinfektionen, deren Wundfläche mit einer Membran bedeckt ist - durch Super-infektion ekzematöser Haut Untersuchungsmethoden - Kultur - Nachweis des Toxins mitttels ELEK-Test oder PCR - Serologie Untersuchungsmaterial Zum Nachweis von Corynbacterium diphtheriae sollten immer mehrere Abstriche vor Gabe der Antibiotika oder des Antitoxins aus Rachen, Nase oder Tonsillen sowie der Haut abgenommen werden. Probengefäß - Universal-Abstrichtupfer mit blauer Kappe für Abstriche - Pseudomembranen mit wenig physiologischer NaCl in Universal-Probenröhrchen mit blauem Deckel Abnahme Rachen- und Tonsillenabstriche sollten am besten unter den Pseudomembranen entnommen werden (diese mit einer sterilen Pinzette hoch halten). Ausserdem sollte ein Stück der Pseuomembran in einem sterilen Gefäß eingesandt werden. Sinnvoll ist die Entnahme von Serum zur Bestimmung des Impfstatus des Patienten. Transport umgehend bei Raumtemperatur. 141/261 Dauer der Untersuchung Der Nachweis von Corynebacterium diphtheriae erfolgt kulturell. Nach Isolation der Keime muss der Nachweis des Toxingens mittels ELEK-Test oder PCR am Konsiliarlbor (Max von Pettenkofer-Institut in München) erbracht werden. Dadurch verlängert sich die Dauer der Untersuchung auf ca. 5-6 Tage. 142/261 Coxsiella burnetii Q-Fieber tritt nach Exposition zu symptomlos erkrankten Haustieren (Schafe, Rinder oder Ziegen) auf. Die Erreger werden in großen Mengen mit dem Kot, Urin oder der Milch ausgeschieden und bleiben monatelang infektiös. Die Infektion erfolgt durch Einatmen des erregerhaltigen Staubs. Die Diagnosestellung erfolgt serologisch, nicht bakteriologisch! Klinik Die Mehrzahl der Erkrankungen verläuft als milde, selbstlimitierende fieberhafte Erkrankung mit Kopfschmerzen. In schweren Fällen treten Pneumonie, Endokarditiks, Hepatitis, seltener Myo- oder Perikarditis sowie Meningitis oder Enzephalitis auf. Die chronische Infektion manifestiert sich als Endokarditis oder Osteomyelitis. Untersuchungsmethoden - Serologie - die kulturelle Anzüchtung und PCR erfolgen in Speziallaboratorien Untersuchungsmaterial Serum Dauer der Untersuchung 1 Tag 143/261 Erysipeloid (Schweinerotlauf) Die Übertragung von Erysipelothrix rhusiopathiae, einem Erreger, der bei Schweinen, Geflügel, Salzwasserfischen und Schalentieren vorkommt, erfolgt durch Hautverletzungen. Systemische Infektionen wie Sepsis und Endokarditis sind möglich. Klinik Nach Infektion zeigt sich an der Eintrittspforte zunächst ein schmerzhaftes, hellrotes Infiltrat, das sich langsam ausbreitet. Untersuchungsmethode Kultur mit Resistenzbestimmung Untersuchungsmaterial Wundabstriche, Wundsekrete, Blut Untersuchungsgefäß - Universal-Abstrichröhrchen mit blauer Kappe - Blutkulturen Transport ≤ 2 h bei RT Lagerung ≤ 24 h bei 4°C, Blutkulturen bei Raumtemperatur oder bei 37°C. Dauer der Untersuchung Die Anzüchtung dauert 2 Tage, die Resistenzbestimmung dauert ebenfalls 2 Tage. 144/261 Legionella spp. Etwa 90% der Legionellosen werden durch einen der 15 Serotypen von L. pneumophila hervorgerufen, wobei anteilsmäßig die Serotypen 1 (70-80%), 4 und 6 überwiegen. Weitere wichtige humanpathogene Spezies sind: L. micdadei, L. bozmanii, L. dumoffii und L. longbeachae. Klinik Atypische Pneumonie (schwerer Verlauf Legionärskrankheit, leichter Verlauf Pontiac Fieber), extrapulmonale Organbeteiligung ist möglich (Sinusitis, Phlegmone, Pankreatitis, Peritonitis, Pyelonephritis, Enzephalitis, Enod- und Myokarditis). Untersuchungsmethode - Kultur - Immunfluoreszenz - PCR - Serologie für epidemiologische Untersuchungen Die größte Sensitivität weist die PCR auf (siehe Molekularbiologie). Die Serologie ist zur Akutdiagnostik ungeeignet und sollte nur bei epidemiologischen Fragestellungen herangezogen werden. Kultureller Nachweis (in Ausnahmefällen nach Rücksprache mit dem Labor) Untersuchungsmaterial Geeignet sind Sputum, Trachealsekret, BALs, Pleurapunktate und Biopsien. Probengefäß Sputumröhrchen Transport und Lagerung innerhalb von 24 h bei Raumtemperatur Dauer der Untersuchung Die Dauer der Untersuchung beträgt 3-4 Tage. Die Sensitivität der Untersuchung beträgt etwa 80 %, die Spezifität etwa 100 %. 145/261 Direkte Immunfluoreszenz Geeignet sind Sputum, Trachealsekret, BALs, Pleurapunktate und Biopsien. Lagerung und Transport erfolgen wie für die kulturelle Anzüchtung. Die Sensitivität ist 35-70 %, die Spezifität 96-99 %. Die Dauer der Untersuchung beträgt 4 h. Antigen-Nachweis aus Urin für die Schnelldiagnostik Geeignet zu Beginn der Erkrankung (1 – 10 Tage, dann unsicher), in Einzelfällen unter Therapie und noch nach Wochen der Erkrankung positiv. Nach den Angaben in der Literatur scheint die Gabe von Makroliden den Antigentest nichz zu beeinflussen. Probengefäß Urinröhrchen Transport und Lagerung ≤ 2 h bei RT, ≤ 24 h bei 4°C. Die Sensitivität des Antigen-Nachweises beträgt bei der ambulant erworbenen Legionelleninfektion 70-80 %, die Spezifität ca. 99 %. Durch 2-malige Wiederholung kann die Sensitivität des Testes auf 95% gesteigert werden. Bei der nosokomialen Pneumonie nimmt die Sensitivität in Abhängigkeit von der die Erkrankung verursachenden Serovarianten ab. Die Dauer der Untersuchung beträgt 4 h. PCR Probengefäß - Sputumröhrchen - Universalabstrichtupfer mit blauer Kappe Transport ≤ 2 h bei RT, ≤ 24 h bei 4°C. Die Sensitivität der PCR beträgt 64-100%, die Spezifität 88-100%. Die Untersuchungsdauer liegt bei 1 Tag. 146/261 Leptospira spp. Infektionen mit Leptospiren (L. interrogans) treten nach Hautkontakt mit Wasser auf, das mit dem Urin infizierter Tiere kontaminiert ist. Man findet Leptospirosen z. B. bei Patienten nach Sturz in Tümpel oder Bäche oder nach Auslandsaufenthalten in Sumpfgebieten Asiens oder Südamerikas. Klinik Leptospiren verursachen 3 Formen der Leptospirose: asymptomatische Infektion, anikterische Leptospirose und ikterische Leptospirose (Morbus Weil). Untersuchungsmethoden - Kultur - Serologie Untersuchungsmaterial - Blut innerhalb der ersten 10 Tage der Erkrankung - Liquor innerhalb der ersten 10 Tage der Erkrankung - Urin ab der zweiten Krankheitswoche - Serum für die Serologie ab der 2. Krankheitswoche Bei der Entnahme von Urin muss darauf geachtet werden, dass der Urin frisch ist. Da Leptospiren nur in Spezialnährmedien wachsen, muss bei klinischem Verdacht das Labor verständigt und die entsprechenden Nährmedien werden (Tel. 46939). Die Beimpfung der Nährmedien erfolgt entsprechend der Vorschriften des Referenzlabors. Alle Untersuchungen zum Nachweis von Leptospiren werden im Landesuntersuchungsamt Oberschleißheim (Tel. 089-31560-322) durchgeführt. Dauer der Untersuchung Die Dauer der Untersuchung beträgt ca. 1 Woche. 147/261 Listeria spp. Listerien kommen in der Umwelt vor und lassen sich im Stuhl von ca. 3 % aller Menschen nachweisen. Klinik Listerien verursachen in der Schwangerschaft eine Chorioamnionitis, Von dieser ausgehend kann es zu einer Infektion des Foetus kommen mit Abort, Totgeburt oder Infektion des Kindes. Bei Neugeborenen können Listerien Pneumonien und Sepsis (Frühmanifestation) bzw. Meningitis und Enzephalitis (Spätmanifestation) verursachen. Bei immunsupprimierten und alten Patienten können die Erreger zu Sepsis und Meningitis führen. Untersuchungsmethoden Kultur mit Resistenzbestimmung Untersuchungsmaterial - Abstriche von Zervix, Placenta, Vagina und Rektum - Mekonium - Blut und Liquor Probengefäß - Universal-Abstrichtupfer mit blauer Kappe - Blutkulturen - Liquorröhrchen Transport und Lagerung ≤ 2 h bei RT, ≤ 24 h bei 4°C. Dauer der Untersuchung Die Anzüchtung dauert 2 Tage, die Resistenzbestimmung 1 Tag. 148/261 Mycoplasma hominis Klinik Mycoplasma hominis gilt als seltener Erreger der Pyelonephritis, des postpartalen Fiebers, der Bakteriämie bei Wundinfektionen und der Sepsis und Meningitis (Hydrocephalus) bei Neu- und Frühgeborenen. Untersuchungsmethoden - Kultur - PCR Die Resistenzbestimmung der angezüchteten Keime erfolgt nur in Ausnahmefällen und nach telefonischer Rücksprache. Untersuchungsmaterial - Urin zur Diagnose der Pyelonephritis (Nativurin nur bei schnellem Transport) - Blut zur Diagnose des postpartalen Fiebers - Liquor bei Hydrocephalus - Wundabstriche oder Wundsekrete Probengefäß - Urinröhrchen - Universal-Abstrichröhrchen mit blauen Kappen - Sterile Röhrchen mit 10B-Medium (Tel. 46939) Die normalen Nährmedien und Blutkultursysteme sind zur Anzucht von Mykoplasmen nicht geeignet. Hierfür bedarf es Spezialnährmedien, die im Labor angefordert werden müssen (Tel. 46939). Für die Untersuchung von Blut müssen 2 ml Heparinblut (1 mg/10 ml) in 9 – 18 ml Transportmedium (10 B Bouillon) eingesandt werden. Abstriche müssen in 10B-Medium transportiert werden. Der Abstrichtupfer wird gut in dem Transportmedium ausgedrückt und dann aus dem Untersuchungsgefäß entfernt. Transport - Nativurin und Abstriche ohne Transportmedium ≤ 2 h bei RT - Blut in Transportmedium ≤ 2 h bei RT 149/261 Lagerung - nur im Transportmedium möglich - ≤ 24 h bei 4°C, darüber hinaus bei minus 70°C Dauer der Untersuchung Die Dauer der Untersuchung beträgt 4–7 Tage. Die Resistenzbestimmung dauert 4-7 Tage, die PCR ist nach 1 Tag abgeschlossen. 150/261 Mycoplasma pneumoniae Klinik M. pneumoniae gilt als Erreger von Infektionen der oberen (Pharyngitis, Rhinitis, Otitis media) und unteren Atemwege (Bronchitis, Pneumonie). Darüber hinaus sind extrapulmonale Infektionen möglich: Meningitis, Enzephalitis, Fazialisparesen, transverse Myelitis, Myokarditis, Pankreatitis, Nephritis, Hepatitis. Untersuchungsmethoden - Kultur nur bei epidemiologischen Fragestellungen - PCR - Serologie DNA Nachweis (PCR) (Dauer 24-48 Stunden) Untersuchungsmaterialien - Trachealsekret und BAL, Sputum ist wenig geeignet, bei Kindern in Ausnahmefällen tiefe Rachenabstriche, besser nasopharyngeale Absaugung - Liquor Probengefäß - Sputumröhrchen für Nativmaterial - Universal-Probengefäß mit blauem Schraubverschluss - Universal-Abstrichröhrchen mit blauer Kappe - besser Universal-Röhrchen mit 2 ml Hayflick-Medium mit Glucose Transport und Lagerung - Nativmaterial ohne Transportmedium ≤ 2 h bei RT, eine Lagerung ist nicht möglich - Materialien in Transportmedium ≤ 2 h bei RT, eine Lagerung ist bis zu 24 h bei 4°C möglich Die Sensitivität der PCR liegt etwa bei 70-95%, die Spezifität bei 99 %. 151/261 Dauer der Untersuchung Die Dauer der Untersuchung beträgt 1 Tag. Mykobakterien – Mycobacterium tuberculosis Komplex In Deutschland kommt am häufigsten Mycobacterium tuberculosis, selten M. bovis (Reservoir bei Rindern) vor. Bei immunsupprimierten Patienten kann der TuberkuloseImpfstamm M. bovis BCG eine Impf-Tuberkulose hervorrufen. In sehr seltenen Fällen Infektionen durch M. microti (Vorkommen bei Nagern). Aufgrund ihrer engen genotypischen und phänotypischen Verwandschaft werden M. tuberculosis, M. bovis, M. bovis BCG, M. africanum (in Afrika vorkommend) und M. microti zum Mycobacterium tuberculosis-Komplex zusammengefasst. Klinik Lungentuberkulose, extrapulmonale Erkrankungen Untersuchungsmaterialien - Sputum oder indiziertes Sputum, BAL, Tracheal- und Bronchialsekret - Magensaft in Natriumphophatlösung (Tel. 46939) - Urin - Nativblut (Heparin- oder Citratblut) - Liquor - Biopsate und Wundsekrete (nativ, nicht in Abstrich-Röhrchen!) Bei der Lungentuberkulose sollte die Diagnostik aus drei am Morgen gewonnenen Sputumproben erfolgen. Ist dies nicht möglich, so sollte induziertes Sputum gewonnen werden. Als weitere Möglichkeit kommt die dreimalige Untersuchung von Magensaft in Frage. Invasiv gewonnene Untersuchungsmaterialien sind ebenfalls geeignet und haben eine größere Sensitivität, insbesondere die BAL. Zum Nachweis von Mycobacterium tuberculosis aus Blut sind die herkömmlichen Blutkultursysteme nicht geeignet. Hierzu bedarf es der in der Tb-Diagnostik üblichen Methoden. Dafür sollten 10-12 ml Heparin- oder Citratblut eingesandt werden, die dann im Labor in Spezialnährmedien verimpft werden. 152/261 Transport und Lagerung innerhalb von 24 h bei 4°C Untersuchungsmengen - Sputum ≥ 2 ml - Bronchialsekret 5 - 10 ml - Magensaft (immer bei Kindern) 20 – 30 ml - BAL, Pleurapunktat 10 – 30 ml - Urin (am besten konzentrierter Morgenurin) 30 – 50 ml - Liquor ≥ 5 ml - Blut (heparinisiert oder Citratblut) 5 – 10 ml - Stuhl etwa 5 g (bohnengroß) - Darmbiopsie bei HIV-Patienten in 1 ml NaCl-Lösung Diese Mengen müssen unbedingt eingehalten werden! Bei Einsendung von kleineren Mengen schließt ein negativer Befund eine Tuberkulose nicht aus! Untersuchungsmethoden - Mikroskopie der Nativmaterialien - Kultur mit Resistenzbestimmung - PCR Die Mikroskopie wird anhand des nach Ziehl-Neelen gefärbten Direktpräparates beurteilt. Die Menge nachgewiesener säurefester Stäbchen (SFS) wird semiquantitativ angegeben: +/-: 1-3 SFS/Präparat +: 4-10 SFS/Präparat ++: 10-100 SFS/Präparat +++: 1-10 SFS/Gesichtsfeld ++++: > 10 SFS/Gesichtsfeld Nachweisgrenze der Untersuchungsmethoden Die Nachweisgrenze der Mikroskopie liegt bei 105 Mykobakterien pro ml Sputum bzw. bei 104 Mykobakterien bei angereicherten Proben. Die Nachweisgrenze der PCR liegt bei 102-103 Mykobakterien/ml Sputum und die der Kultur bei 10-100 Mykobakterien/ml Sputum. Die 153/261 Kultur hat demnach die größte Sensitivität. Bei Vorhandensein von wenig Untersuchungsmaterial sollte daher der Kultur vor der PCR der Vorzug gegeben werden. Interpretation Ein positives Ergenis bei der Mikroskopie oder eine positives Wachstum in Flüssigmedien erlaubt noch keine Artdiagnose. Ein negatives PCR-Ergebnis schließt eine Tuberkulose nicht aus! Dauer der Untersuchung Die Dauer der Untersuchung beträgt je nach der Konzentration der Erreger im Untersuchungsmaterial und nach deren Wachstumsgeschwindigkeit 2 – 4 Wochen. Ein negativer Befund wird nach 10 Wochen erstellt. Die Dauer der Resistenzbestimmung liegt bei ca. 2 Wochen. 154/261 MOTT – Mycobacteria other than tuberculosis Klinik Pulmonale Infektionen M. avium-intrazellulare Komplex, M. kansasii, M. malmoense, M.chelonae, M.abscessus, M. xenopi Haut- und Weichteilinfektionen M. marinum, M. ulcerans, M. fortuitum, M. chelonae, M. abscessus, M. ulcerans, M. haemophilum Wund- und Fremkörperinfektionen M.chelonae, M.abscessus, M. fortuitum Systemische Infektionen M. avium, M. kansasii (bei HIV-positiven Patienten), M. abscessus, M. chelonae, M. haemophilum (bei HIV-negativen Patienten) Lymphadenitis M. avium, M. scrofulaceun, M. malmoense Untersuchungsmaterialien - Sputum oder indiziertes Sputum, BAL, Tracheal- und Bronchialsekret - Blut (Heparin- oder Citratblut) - Biopsate und Wundsekrete Zum Nachweis von MOTT aus Blut sind die herkömmlichen Blutkultursysteme nicht geeignet. Hierzu bedarf es der in der Tb-Diagnostik üblichen Methoden. Dafür sollten 10-12 ml Heparin- oder Citratblut eingesandt werden, die dann im Labor in Spezialnährmedien verimpft werden. Untersuchungsmethoden - Mikroskopie - Kultur (Resistenzbestimmung nicht bei allen Arten möglich) 155/261 Untersuchungsmengen - Sputum ≥ 2 ml - Bronchialsekret 5 - 10 ml - BAL, Pleurapunktat 10 – 30 ml - Blut (heparinisiert oder Citratblut) 5 – 10 ml - Biopsiematerial in 1 ml NaCl-Lösung Transport und Lagerung Der Transport erfolgt innerhalb von 24 h bei 4°C. Dauer der Untersuchung Die Dauer der Untersuchung beträgt je nach Konzentration der Erreger im Untersuchungsmaterial und nach ihrer Wachstumsgeschwindigkeit 1 Woche bis zu 8-12 Wochen. Ein negativer Befund wird nach 12 Wochen erstellt. Eine Resistenzbestimmung ist nicht bei allen MOTT-Stämmen möglich. 156/261 Neisseria gonorrhoeae Klinik Gonokokken verursachen bei sexuell aktiven Jugendlichen und Erwachsenen Infektionen des Genitaltraktes (Urethritis, Vaginitis, Endometritis, Salpingitis, Adnexitis) und bei Neugeborenen Augenentzündungen. Untersuchungsmethoden - Kultur mit Resistenzbestimmung - PCR Untersuchungsmaterialien - Abstriche (Urethra, Konjunktiva, Vagina, Zervix) - Gewebebiopsien, Sekrete Die Abstriche müssen entweder - sofort auf Selektivmedien (Thayer-Martin-Agar) verimpft werden oder - im Thayer-Martin-Agar direkt ins Labor gebracht werden Probengefäß - Sterile Universal-Röhrchen mit Transportmedium - kommerzielle Transportmedien Gefäße ohne Transportmedien können nicht verwendet werden. Transport: ≤ 2 h nach Abimpfen auf die Platte oder ≤ 24 h im Thayer-Martin-Agar Ein Transport von Materialien ohne Verwendung eines Transportmediums ist nicht möglich! Dauer der Untersuchung Die kulturelle Anzüchtung dauert 2-5 Tage, die Resistenzbestimmung 2 Tage. 157/261 Nocardia spp. In Deutschland kommen in erster Linie N. asteroides und N. farcinica, sltener N. abscessus, N. paucivorans und N. nova vor. N. brasiliensis führt eher zu superfizialen Nocardiosen und kommt in den Tropen vor. Klinik Nocardien können als Erreger bei Immunsupprimierten oder bei Patienten nach einer Organtransplantation eine Rolle spielen. Man unterscheidet pulmonale (Pneumonie), systemische (Abszesse in Organen insbesondere im ZNS und Endokarditis) und superfiziale Nocardiosen (Hautaffektionen). Untersuchungsmethoden Kultur Untersuchungsmaterial - Sputum oder besser bronchoskopisch gewonnenes Material - Liquor - Abszessmaterial - Wundabstriche, Wundsekrete Untersuchungsgefäß - Universal-Probenröhrchen mit blauem Schraubverschluss - Universal-Abstrichröhrchen mit blauer Kappe Transport und Lagerung ≤ 24 h bei RT Da Nocardien sehr empfindlich gegenüber Kälteeinflüssen sind, sollte eine Kühlung des Untersuchungsmaterials unterbleiben. Dauer der Untersuchung Der kulturelle Nachweis und die Resistenzbestimung dauert etwa 2 Wochen. 158/261 Pneumocystis jiroveci Klinik Pneumocystis jiroveci (früher Pneumocystis carinii) verursacht bei immunsupprimierten Patienten eine Pneumonie. Extrapulmonale Manifestationen sind selten. Untersuchungsmethode - Mikroskopie mit Giemsa-Färbung oder mit fluoreszierenden Antikörpern - bei HIV-Patienten PCR Untersuchungsmaterialien Das Untersuchungsmaterial muss Material aus den Alveolen enthalten. Am besten zur Untersuchung geeignet sind die BAL und transtracheale Biopsate (Sensitivität 80-90%). Die Sensitivität induzierter Sputumproben, Bronchial- und Trachealssekreten liegt bei 50-60%. Sputum ist zum Nachweis von Pneumocystis jiroveci nicht geeignet. Transportgefäß Universal-Probenröhrchen mit blauer Verschlusskappe Transport und Lagerung ≤ 24 h bei 4°C. Die Dauer der Untersuchung beträgt 3 h. 159/261 Staphylokokken SSSS = Staphylococcal Scalded Skin Syndrome Erreger: Staphylococcus aureus mit exfoliativen Toxinen A und B Nachweis: Exfoliativtoxine (Gene eta oder etb) im Referenzzentrum (Prof. Witte, Wernigerode) TSS = Toxic Shock Syndrome Erreger: Staphylococcus aureus mit toxic shock syndrome toxin 1 (TSST-1) , z. T auch mit Enterotoxin A und B Nachweis: Toxinnachweis von TSST-1, Enterotoxin A und B, PCR zum Nachweis der Gene tst, sea und seb, im Referenzzentrum (Prof. Witte, Wernigerode, Tel. 039-43679246) MRSA Methicillin-resistenter S. aureus Untersuchungsmethode - Kultur und Resistenzbestimmung (MHK) - mecA-Gen mittels PCR (Referenzmethode) - Bestimmung der Penicillin-Bindeproteine (PBP) mittels Agglutination Untersuchungsmaterialien für die Screening-Untersuchung - Nasenabstrich - Rachenabstrich - Leistenabstrich - Axillaabstrich Probengefäß Universal-Abstrichtupfer mit blauer Kappe 160/261 Transport und Lagerung ≤ 2 h bei RT oder ≤ 24 h bei 4°C Dauer der Untersuchung Die kulturelle Anzüchtung dauert 2 Tage, die Resistenzbestimmung 1 Tag. Die Untersuchung auf PBPs dauert 2 h, die PCR 1 Tag. Insgesamt ist der Zeitaufwand für die endgültige Diagnose 48 h. 161/261 Streptococcus pyogenes A-Streptokokken Scharlach Erreger: Streptococcus pyogenes mit erythrogenem Toxin Kulturelle Anzüchtung des Erregers STSS = Streptococcal Toxic Shock Syndrome Erreger: Streptococcus pyogenes (A-Streptokokken), B-Streptokokken und C- Streptokokken mit erythrogenen Toxinen Nachweis: Nachweis der erythrogenen Toxine (SPE, SPA, SPB, SPC) mittels ELISA und PCR zum Nachweis der Gene spea, speb und spc im Referenzzentrum (PD Dr. Reinert, Aachen, Tel. 0241-808-9787) 162/261 Tularämie Der Erreger der Tularämie, Francisella tularensis, ist ein Keim der Risikogruppe 3. Klinik Francisella wird in seltenen Fällen durch Bisse von Nagetieren auf den Menschen übertragen. An der Bissstelle entwickelt sich eine papulöse Primärläsion, der nach 2 – 4 Tagen eine regionale Lymphknotenschwellung folgt. Im Vordergrund der Erkrankung stehen hohes Fieber mit Schüttelfrost, Kopf- und Gliederschmerzen. Bei Verdacht auf eine Tularämie ist die serologische Diagnose dringend erforderlich. Wegen der Gefahr einer Laborinfektion bei Verdacht auf Tularämie unbedingt das Labor benachrichtigen (Tel. 46938). Die kulturelle Anzucht erfolgt dann in einem L3-Labor. Untersuchungsmethode - Kultur in Speziallaboratorien - Serologie Untersuchungsmaterial Eiter, Lympgknotenpunktate, Gewebebiopsien, Sputum, Liquor, Blut Dauer der Untersuchung ca. 1 Woche 163/261 Ureaplasma urealyticum Klinik Ureaplasma urealyticum verursacht Infektionen des Urogenitaltraktes (Urethritis) und ist ein seltener Erreger der Sepsis und Pneumonie bei Frühgeborenen. Darüber hinaus können Ureaplasmen zur Frühgeburtlichkeit führen. Untersuchungsmethoden - Kultur - PCR Die Resistenzbestimmung der angezüchteten Keime erfolgt nur in Ausnahmefällen und nach telefonischer Rücksprache. Untersuchungsmaterial - Blut zur Diagnose des Sepsis bei Frühgeborenen - Liquor bei Hydrocephalus - Trachealsekret, Bronchialsekret, Rachenabstriche bei Frühgeborenen - Abstriche aus dem Urogenitaltrakt Probengefäß - Universal-Abstrichröhrchen mit blauen Kappen - Universal-Probenröhrchen mit 10B-Medium (Tel. 46939) Die normalen Nährmedien und Blutkultursysteme sind zur Anzucht von Mykoplasmen nicht geeignet. Hierfür bedarf es Spezialnährmedien, die im Labor vor der Blutentnahme angefordert werden müssen (Tel. 46939). Für die Untersuchung von Blut müssen 2 ml Heparinblut (1 mg/10 ml) in 9 – 18 ml Transportmedium (10 B Bouillon) eingesandt werden. Abstriche müssen in 10B-Medium transportiert werden. Der Abstrichtupfer wird gut in dem Transportmedium ausgedrückt und dann aus dem Untersuchungsgefäß entfernt. Transport - Abstriche ohne Transportmediujm ≤ 2 h bei RT - Blut in Transportmedium ≤ 2 h bei RT 164/261 Lagerung - nur im Transportmedium möglich - ≤ 24 h bei 4°C, darüber hinaus bei minus 70°C Dauer der Untersuchung Die Dauer der Untersuchung beträgt 3–5 Tage. Die Resistenzbestimmung dauert 4-5 Tage, die PCR ist nach 1 Tag abgeschlossen. Für die Diagnose einer mit Ureaplasmen assoziierten Urethritis sind folgende Einsendungen notwendig: - erster Morgenurin (Transport ≤ 2 h ) - Urethralsekret (falls möglich eine definierte Millilitermenge) in 2 ml 10 B – Medium - Urethralabstrich (in 2 ml 10 B – Medium, Menge vom Labor abgefüllt) Bei der Abnahme sind folgende Besonderheiten zu beachten: - da auch die Harnröhre von Gesunden mit Ureaplasmen besiedelt sein kann, sollte der Nachweis dieser Keime quantitativ geführt werden - das Untersuchungsmaterial (Urethralsekret bzw. -abstriche ) sollte, falls möglich, mit einer kalibrierten Platin- bzw. Plastiköse entnommen werden und in 2 ml Transportmedium (10 B-Medium, vom Labor anfordern, Tel. 46939) inokuliert werden - für die Entnahme von Urethralabstrichen sollten Dacron-Tupfer verwendet werden, da Baumwolltupfer Inhibitoren enthalten können - Urin kann nativ eingeschickt werden, muss aber innerhalb von 2 h im Labor sein - Transport der Urethralabstriche bzw. -sekrete: ≤ 2 h bei Raumtemperatur, ≤ 24 h bei 4°C oder auf Trockeneis. 165/261