thermo 1
Werbung

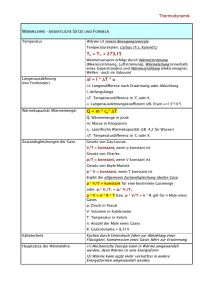
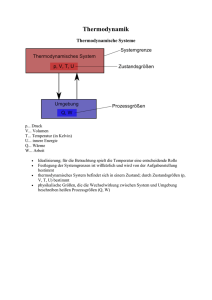
Thermodynamik 1. Typen der thermodynamischen Systeme. Intensive und extensive Zustandsgröße. Phasenübergänge. Ausdehnung bei Erwärmung. Nullter und Erster Hauptsatz der Thermodynamik. Thermodynamische Systeme Ein thermodynamisches System ist ein durch eine Systemgrenze von seiner Umgebung abgetrennter Raumbereich, der durch Zustandsgrößen gekennzeichnet werden kann. Solche Zustandsgrößen, die ein System kennzeichnen, sind z.B. die Temperatur, der Druck, das Volumen, die Dichte, die innere Energie, die Teilchenanzahl oder die Geschwindigkeit der Teilchen. Wie andere physikalische Systeme kann auch ein thermodynamisches System abgeschlossen, geschlossen oder offen sein. Zustandsgrößen Es gibt zwei Sorten von Zustandsgrößen: 'Extensive' und 'intensive' Zustandsgrößen. Extensive Größen zeichnen sich dadurch aus, dass sie von der Menge der Systembestandteile abhängen, dass also eine Systemteilung zu einer Reduktion der Größe führt. Beispiele für extensive Größen sind Volumen, Masse oder Energie. Intensive Größen sind unabhängig von der Menge der Systembestandteile. Verdoppelt oder halbiert man ein System, so bleiben die intensiven Zustandsgrößen, die das System beschreiben, trotzdem konstant. Beispiele für intensive Zustandsgrößen sind Druck und Temperatur sowie alle spezifischen Größen. Beispiel: Wenn zu 10 kg kaltem Wasser noch einmal 10 kg kaltes Wasser hinzugefügt werden, so verdoppelt sich das Volumen des Wassers (extensiv), die Temperatur des Wassers ändert sich dadurch jedoch nicht (intensiv). Wärme und Temperatur Phasenübergänge Die Abhängigkeit der Temperatur eines Körpers von der zugeführten Wärme läßt sich für verschiedene Körper messen. Aufgetragen in einem Q/T-Diagramm sieht man die Graden, also die konstanten Temperaturen, bei denen die zugeführte Energie keine Temperaturerhöhung sondern eine Änderung des Aggregatzustandes bewirkt. Diese Diagramme lassen sich für verschiedene Stoffe aufnehmen. Bei dem Diagramm für Eis-Wasser-Dampf können die Fixpunkte der Celsius-Skala abgelesen werden. Ausdehnung bei Erwärmung Die meisten festen, flüssigen und gasförmigen Körper dehnen sich beim Erwärmen aus und ziehen sich beim Abkühlen zusammen. Gase dehnen sich bei Erwärmung am meisten, feste Stoffe am wenigsten aus. Die Längenänderung eines Festkörpers der Länge ist proportional zur Temperaturänderung sowie zum (vom Material abhängigen) thermischen Längenausdehnungskoeffizient : Für die neue Länge der Temperaturänderung gilt damit: nach Ideale Gase Defintion eines idealen Gases: 1. Als Modell für die betrachteten Gasteilchen (Atome, Moleküle) werden starre Kugeln gesehen, d.h die Gasteilchen sollen nicht verformbar sein. 2. Die Zusammenstöße der Teilchen miteinander und mit der Wand sollen vollkommen elastisch sein, d.h. es geht dabei keinerlei Energie verloren. 3. Der zur Verfügung stehende Raum soll unendlich groß sein, d.h. das Gas kann sich unendlich weit ausdehnen. 4. Der Durchmesser der Teilchen soll unendlich klein sein, d.h. das Gas besteht aus Teilchen, deren Durchmesser sehr klein ist im Gegensatz zu ihrem Abstand zueinander und im Verhältnis zu der Raumgröße. 5. Die Teilchen haben keine Wechselwirkungen miteinander (keine Anziehung oder Abstoßung), das heisst sie sind elektrisch absolut neutral (keine Dipole). Zustandsänderungen Aus der allgemeinen Zustandsgleichung für das ideale Gas kann man Gleichungen für den Fall ableiten, dass eine der drei Größen konstant ist. Mit p = konstant ergeben sich Gleichungen für die isobare Zustandsänderung, mit V = konstant für die isochore Zustandsänderung und mit T = konstant für die isotherme Zustandsänderung. Die Gleichungen für diese speziellen Zustandsänderungen wurde früher gefunden als der allgemeine Fall. Durch die allgemeine Zustandsgleichung für das ideale Gas in der Form wird der Zusammenhang zwischen Druck, Volumen und Temperatur angegeben. Die isobare Zustandsänderung (I. Gesetz von GAY-LUSSAC) Isobare Zustandsänderungen sind dadurch gekennzeichnet, dass der Druck konstant ist. Aus der allgemeinen Zustandsgleichung für das ideale Gas erhält man mit p = konstant: Die Volumenänderung bei Temperaturänderung wird z.B. bei einem Gasthermometer genutzt (Bild 3). In einem Glasröhrchen befindet sich ein Gas, im einfachsten Falle Luft. Das Gas ist durch einen Quecksilbertropfen abgeschlossen. Der Quecksilbertropfen wirkt mit seiner Gewichtskraft auf das eingeschlossene Gas. Dadurch besteht im Gas ein bestimmter, konstanter Druck. Die isochore Zustandsänderung (II. Gesetz von GAY-LUSSAC) Isochore Zustandsänderungen sind dadurch gekennzeichnet, dass das Volumen konstant ist. Aus der allgemeinen Zustandsgleichung für das ideale Gas erhält man mit V = konstant: Beispiele sind Gasflaschen, Spraydosen oder PKW-Reifen, in denen sich eine abgeschlossene Menge eines Gases befindet, das sich näherungsweise wie das ideale Gas verhält. Erhöht sich z. B. durch Sonneneinstrahlung oder durch andere Einwirkungen die Temperatur, so erhöht sich auch der Druck im Gas. Bei Gasflaschen und Spraydosen darf die Temperatur bestimmte Werte nicht übersteigen, weil sonst wegen der Erhöhung des Druckes mit der Temperatur Explosionsgefahr besteht. So sollte bei Spraydosen auf keinen Fall eine Temperatur von 50 °C überschritten werden. Wegen der Explosionsgefahr ist das lebensgefährlich. Die isotherme Zustandsänderung (Gesetz von BOYLE und MARIOTTE) Isotherme Zustandsänderungen sind dadurch gekennzeichnet, dass die Temperatur konstant ist. Aus der allgemeinen Zustandsgleichung für das ideale Gas erhält man mit T = konstant: Ein Beispiel dafür sind Pumpen (Luftpumpen, Pumpen für Sauerstoff in der Medizin). Bei näherungsweise konstanter Temperatur wird das Volumen des Gases verringert. Dadurch erhöht sich der Druck in ihm. Bei einem bestimmten höheren Druck strömt das Gas in den gewünschten Raum, z. B. bei einer Luftpumpe in den Schlauch oder bei einer medizinischen Pumpe in die Lunge. Die Wärmekapazität Um die Temperatur eines Körpers zu erhöhen, muss seine innere Energie vergröß werden. Verschiedene Stoffe lassen sich unterschiedlich leicht erwärmen. Spezifische Wärmekapazitäten Bei homogenen Systemen ist es häufig zweckmäßig, die Wärmekapazität auf die Masseneinheit zu beziehen. Hier gilt folgender Zusammenhang: https://www.lernhelfer.de/schuelerlexikon/physik-abitur/artikel/thermodynamische-systeme http://www.thermo-bestehen.de/glos_prozess_zustand.html http://web.physik.rwth-aachen.de/~fluegge/Vorlesung/PhysIpub/Exscript/10Kapitel/X3Kapitel.html http://schulen.eduhi.at/riedgym/physik/10/waerme/temperatur/laengenaus.htm https://www.lernhelfer.de/schuelerlexikon/physik-abitur/artikel/spezielle-zustandsaenderungen