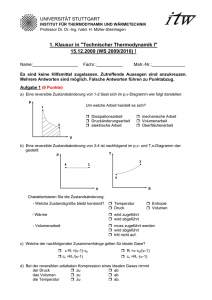
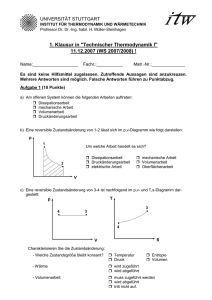
Aufgabe H3
Werbung

LTT ERLANGEN 1 VON 5 FRAGENSAMMLUNG Mögliche Klausurfragen und –aufgaben (Beispiele mit keinem Anspruch auf Vollständigkeit) Neben den Fragen können einfachste Rechenaufgaben gestellt werden. Bei einigen Kapiteln findet sich dazu ein Beispiel. 1. Grundlagen und grundlegende Begriffe: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. Was sind homogene Systeme? Was sind heterogene Systeme? Was charakterisiert ein offenes (geschlossenes, abgeschlossenes) System? Wodurch ist ein adiabates System charakterisiert? Was ist eine Zustandsgröße? Benennen Sie zwei äußere (vier innere) Zustandsgrößen. Was versteht man unter intensiven und extensiven Zustandsgrößen? Was unterscheidet molare von spezifischen Zustandsgrößen? Was kennzeichnet eine Zustandsgröße? Was ist das thermische Gleichgewicht? Was ist das thermodynamische Gleichgewicht? Was ist eine Zustandsänderung? Nennen und erläutern Sie fünf verschiedene Zustandsänderungen. Wodurch wird eine Zustandsänderung bewirkt? Was ist ein Prozess? Was besagt der Nullte Hauptsatz der Thermodynamik? Was versteht man unter dem Begriff ideales Gas? Unter welchen Voraussetzungen darf ein reales Gas näherungsweise als ein ideales Gas angesehen werden? Wie ist die isochore (isobare) Wärmekapazität eines idealen Gases definiert? Welche Zusammenhänge zwischen beiden Größen können Sie angeben? Ist die isochore Wärmekapazität eine Funktion der Temperatur? kinetische Gastheorie Wie lautet die thermische (1. kalorische; 2. kalorische) Zustandsgleichung idealer Gase? Wir messen nach der kinetischen Gastheorie mit der Temperatur eigentlich welche Größe des Gases? Berechnen Sie spezifische Wärmekapazität cv von Helium (M = 4 g/mol, R ≈ 8 J/(molK)).(Ergebnis: cV = 3000 J/(kgK)) Nenne Sie drei Formen der inneren Energie in zweiatomigen Molekülen. Wie viel Freiheitsgerade f besitzt ein zweiatomiges Molekül nach der kin. Gastheorie? Andere Methoden zur Temperaturmessung Nennen Sie drei Gruppen temperaturabhängiger Eigenschaften von Objekten. Geben sie den Zusammenhang der Temperaturskalen nach Celsius und Kelvin an. Was besagt das Wien’sche Verschiebungsgesetz? Bei welchem Messprinzip tritt der Seebeck-Koeffizient auf und wie ist er definiert? Welchen Wert nimmt das Besetzungsverhältnis N1/N0 von zwei Energieniveaus bei unendlich hoher Temperatur nach Boltzmann an? 2. Erster Hauptsatz und Energie 30. 31. Was kennzeichnet Prozessgrößen? Benennen Sie zwei davon. Wie lautet die aus der Mechanik bekannte Formel zur Berechnung der Arbeit? VERSION: FEBRUAR 2007 LTT ERLANGEN 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 2 VON 5 FRAGENSAMMLUNG Nennen Sie zwei unterschiedliche Formen von äußerer Arbeit. Nennen Sie vier unterschiedliche Formen von innerer Arbeit. Was ist Wärme? Wie lautet der 1. Hauptsatz der Thermodynamik für nicht ruhende, geschlossene Systeme? Wie lautet der 1. Hauptsatz der Thermodynamik für ein einfaches, geschlossenes System in der Schreibweise mit spezifischen Größen? Welche Beziehung kennen Sie für eine reversible Änderung der Volumenarbeit an einem geschlossenen System? Wie lautet der 1. Hauptsatz der Thermodynamik für einen stationären Fließprozess bei Benutzung spezifischer Größen? Was ist die Enthalpie? Erläutern Sie den Begriff Technische Arbeit im Unterschied zur Volumenänderungsarbeit. Was verstehen Sie unter technischer Arbeit? Wo ist diese im p, v-Diagramm zu finden? Wie lauten die Gleichungen zur Beschreibung folgender Zustandsänderungen eines idealen Gases: a. isotherme Zustandsänderung (n = 1) b. reversibel adiabate Zustandsänderung (n = κ) c. polytrope Zustandsänderung (1 < n < κ) d. isochore Zustandsänderung (n = ∞) Veranschaulichen Sie mit Hilfe eines p, v-Diagramms die Arbeiten zur Kompression eines idealen Gases vom Druck p1 auf p2, wenn man die unter 42. genannten Zustandsänderungen jeweils als reversible Prozesse zugrunde legt. Was bedeutet das unter 43. gewonnene Ergebnis für den Bau eines Kompressors (isotherme Kompression)? Was ist eine isentrope Zustandsänderung und was eine reversibel adiabate? Unter welchen Voraussetzungen sind beide identisch? 3. Zweiter Hauptsatz – Entropie 46. 47. 48. 49. 50. 51. 52. 53. 54. 55. 56. Was ist ein reversibler (irreversibler) Prozess? Was verstehen Sie unter Dissipationsarbeit oder Dissipationsenergie? Wie lautet die mathematische Formulierung der beiden Teile des 2. Hauptsatzes der Thermodynamik? Wie ist die Entropieänderung eines offenen (geschlossenen, adiabaten) Systems mit Arbeit, Wärme- und Stoffübertragung verbunden? Zeigen Sie am Beispiel eines geschlossenen adiabaten Systems, welche Beziehungen zwischen der Entropieänderung und der dissipierten Arbeit besteht. Bei welchem Prozess mit einem geschlossenen adiabaten System wird die Entropieänderung größer, kleiner bzw. gleich Null? Welche Eigenschaften der Entropie zeichnen den Gleichgewichtszustand eines abgeschlossenen Systems aus? Wie lautet das Differential der Entropie, wenn als unabhängige Variablen Druck und Enthalpie verwendet werden? Bei welcher Zustandsänderung kann man die dabei auftretende Enthalpieänderung in einem T, s-Diagramm als Fläche unter dieser Zustandsänderung darstellen? Durch welche Zustandsänderungen kann die Entropie eines offenen Systems verändert werden? Durch welche Zustandsänderung kann die Entropie eines Systems abnehmen? VERSION: FEBRUAR 2007 LTT ERLANGEN 57. 58. 59. 60. 61. 62. 3 VON 5 FRAGENSAMMLUNG Eine reversibel adiabate Zustandsänderung eines geschlossenen Systems entspricht immer einer isentropen Zustandsänderung. Warum ist der umgekehrte Schluss nicht allgemein gültig? Verdichter: Erklären Sie mit Hilfe eines h, s-Diagramms den Begriff des Arbeitsmehraufwands und wie der isentrope Verdichterwirkungsgrad definiert ist. Wie lautet die mathematische Formulierung des 2. Hauptsatzes für (adiabate) Systeme mit konstanter Masse? Durch welche Zustandsänderung(en) kann man die Entropie eines geschlossenen (offenen) Systems verkleinern? Wodurch ist eine reversible Wärmeübertragung charakterisiert und warum? Unter konstantem Druck werden 4 kg Wasser mit einer Temperatur von 60°C adiabat mit 3 kg Wasser von 20°C gemischt (cpW = const. = 4,184 J/(gK)) a. Wie groß ist die Mischungstemperatur? 4. Energie, Exergie und Anergie 63. Leiten Sie den Carnot-Wirkungsgrad ηC als Funktion der Temperaturen aus der Energie- und Entropiebilanz für eine reversible ideale Wärmekraftmaschine her. 64. 65. 66. 67. 68. 69. Was verstehen Sie unter Exergie und Anergie? Welche Energien sind reine Exergien und reine Anergien? Für welche Energieformen muss der Exergieanteil berechnet werden? Wie hängen Exergieverlust und Entropieerzeugung zusammen? Wie ist der exergetische Wirkungsgrad definiert? Wie groß ist die Entropieproduktion bei der Wärmeübertragung Übertragungswand, wenn die Wärme Q von TA nach TB übertragen wird? in der B 5. Thermodynamische Eigenschaften reiner Fluide 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 82. 83. 84. 85. Was ist eine Fundamentalgleichung? Wie ist das chemische Potential definiert? Wie ist die freie Gibbssche Enthapie definiert? Was ist das Guggenheim Merkschema und wozu wird es verwendet? Leiten Sie die Fundamentalgleichung für die innere Energie (Enthalpie, freie Gibbssche Enthalpie, freie Energie) aus dem Guggenheim-Schema her. Leiten Sie für ideale Gase die Bestimmungsgleichung für die Entropie her, wenn diese als Funktion von Temperatur und Druck (Volumen) gegeben ist. Welches sind die thermischen Zustandsgrößen? Benennen Sie drei kalorische Zustandsgrößen. Was unterscheidet die Zustandsgleichung von van der Waals von der idealer Gase? Wie lautet sie? Wie ändert sich Druck und Temperatur bei der Verdampfung (Kondensation)? Skizzieren Sie das p, V- (p, T) -Diagramm eines typischen reinen Stoffes und benennen Sie die verschiedenen charakteristischen Punkte, Bereiche und Grenzen (alle 3 Phasen). Erklären Sie die Begriffe Taulinie und Siedelinie. Was beschreibt der Realgasfaktor z? Wie groß ist er für ein ideales Gas? Geben Sie die Clausius-Clayperon-Gleichung für die Dampfdruckkurve an. Geben Sie die Gibbssche Phasenregel an und erklären Sie die Bedeutung der einzelnen Terme. kritischer Punkt Was gilt für die Isotherme im p, v-Diagramm am kritischen Punkt? VERSION: FEBRUAR 2007 LTT ERLANGEN 86. 87. 88. 4 VON 5 FRAGENSAMMLUNG Was versteht man unter kritischer Opaleszenz? Kann man analog zum kritischen Volumen vK ein vTripelpunkt angeben? Nimmt die Enthalpie h (die spez. Wärmekapazität cp der Isentropenexponent κ) am kritischen Punkt einen Extremwert an? 6. Kreisprozesse 89. 90. 91. 92. 93. 94. 95. 96. 97. 98. 99. 100. 101. 102. 103. 104. Was versteht man unter einem Kreisprozess? Wie lautet der 1. Hauptsatz für die Nutzleistung eines Kreisprozesses? Was kann in einem p, v-Diagramm als Fläche dargestellt werden und warum? Was kann in einem T, s-Diagramm als Fläche dargestellt werden und warum? Was für den isochoren (isobaren) Prozess und warum? Was kann man in einem h, s-Diagramm einfach veranschaulichen und warum? Wie ist der thermische Wirkungsgrad definiert? Wie ist der Carnot-Wirkungsgrad definiert? Erläutern Sie den Unterschied zwischen einer Verbrennungskraftmaschine und einer Wärmekraftmaschine. Was unterscheidet eine Wärmepumpe von einer Kältemaschine? Wie unterscheidet sich das Bauteil zur Druckerhöhung in einer Kältemaschine und einer Wärmekraftmaschine? Zeichnen Sie ein Schema der Temperaturniveaus für Kältemaschine, Wärmepumpe und Wärmekraftmaschine. Welcher grundlegende Unterschied besteht zwischen einem Joule- und einem ClausiusRankine Prozess? Skizzieren Sie einen idealen Clausius-Rankine-Prozess im T, S-Diagramm (mit wichtigen Bezeichnungen). Welche Anwendung wird oft hierdurch beschrieben? Skizzieren Sie im p, v-Diagramm die Zustandsänderungen eines idealisierten Vergleichprozesses für Otto(Diesel-)motoren. Benennen Sie die Zustandsänderungen. Warum führt eine Erhöhung des Vedichtungsverhältnisses ε beim Ottomotor zu einem höheren thermischen Wirkungsgrad (Formel und Begründung)? Berechnen Sie die abzuführende Wärmeleistung Pab von einem Kraftwerk mit Pel = 800 MW elektrischer Leistung und einem thermischen Wirkungsgrad von ηth = 40%. 7. Einführung in die Stoffgemische 105. Wie ist der Partialdruck einer Gaskomponente in einer idealen Gasmischung definiert? 106. Geben sie den Zusammenhang zwischen Volumenanteil und Molanteil einer idealen Gasmischung an. 107. Nennen Sie zwei Mischungsgrößen, die bei der Mischung idealer Gase gleich Null sind. 108. Nenne Sie eine Mischungsgröße, die bei der Mischung idealer Gase zunimmt (abnimmt). 109. Unter welchen Bedingungen ist ein Mischungsvorgang zweier Fluide reversibel? 8. Feuchte Luft 110. Wie ist der Wassergehalt der feuchten Luft definiert und zwischen welchen Grenzen können sich die Zahlenwerte für dieses Konzentrationsmaß bewegen? 111. Welcher Zusammenhang besteht zwischen dem Wassergehalt und dem Partialdruck des Wasserdampfes für ungesättigte und gesättigte feuchte Luft? 112. Was versteht man unter relativer Feuchte? VERSION: FEBRUAR 2007 LTT ERLANGEN 5 VON 5 FRAGENSAMMLUNG 113. Erklären Sie, warum in einem Raum mit einer Lufttemperatur von 22°C und einer relativen Feuchte von 60% die Fenster von innen beschlagen können. 114. Wie ändert sich die relative Feuchte bei isobarer Erwärmung feuchter Luft? 115. Leiten Sie die Gleichung zur Berechnung der Dichte feuchter Luft ausgehend vom Wassergehalt x her. 116. Ist die Dichte ungesättigter feuchter Luft größer oder kleiner als die Dichte trockener Luft bei gleichem t und p? Begründung. 117. Zeichnen Sie für h1+x > 0 schematisch ein vollständiges h1+x, x-Diagramm für feuchte Luft mit einigen Isenthalpen, Isothermen und Linien mit ϕ = const. 118. Begründen Sie die Abweichung der Isothermen von der Horizontalen, sowohl im ungesättigten Gebiet als auch im Nebelgebiet. 119. Erläutern Sie stichpunktartig das Messprinzip eines Aspirationspsychrometers. Praktikum Lasertomographie 120. 121. 122. 123. Wie ist der Brechungsindex eines transparenten Gases definiert? Nennen Sie die drei Hauptkomponenten eines Lasers. Was bedeutet die Abkürzung LASER? Nennen Sie drei verschiedene Wechselwirkungsmechanismen von Photonen mit den Molekülen des Lasermediums. VERSION: FEBRUAR 2007