Praktikumsbericht - Institut für Simulation und Graphik
Werbung

Praktikumsbericht
Bildanalyse von radiologischen Datensätzen aus den
”
Bereichen Rechtsmedizin und HNO-Heilkunde “
Jeanette Cordes
Otto-von-Guericke-Universität Magdeburg
Fakultät für Informatik, Institut für Simulation und Graphik
Betreuer: Prof. Dr.-Ing. Bernhard Preim
Wintersemester 2003/2004
2
Inhaltsverzeichnis
1
Motivation
5
2
Medizinischer Hintergrund
6
2.1
2.2
2.3
3
Klinische Fragestellungen . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
6
2.1.1
Rechtsmedizin . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
6
2.1.2
Halslymphknotenausräumung . . . . . . . . . . . . . . . . . . . . . .
7
Anatomie des Menschen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
8
2.2.1
Thorax-und-Abdominalraum . . . . . . . . . . . . . . . . . . . . . . .
8
2.2.2
Hals-Nacken-Region . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
Radiologische Bildaufnahmetechniken . . . . . . . . . . . . . . . . . . . . . . 12
2.3.1
Computertomographie . . . . . . . . . . . . . . . . . . . . . . . . . . 12
2.3.2
Magnetresonanztomographie . . . . . . . . . . . . . . . . . . . . . . . 13
Bildanalyse
14
3.1
Das DICOM-Format . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14
3.2
Vorverarbeitung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
3.3
3.4
3.5
3.2.1
Anonymisierung der Datensätze . . . . . . . . . . . . . . . . . . . . . . 15
3.2.2
Medianfilter . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
3.2.3
Sigmafilter . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
3.2.4
Diffusionsfilter . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16
Segmentierungsverfahren . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16
3.3.1
Region Growing . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17
3.3.2
Wasserscheidentransformation . . . . . . . . . . . . . . . . . . . . . . 17
3.3.3
Live Wire . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 18
Die Bildanalyse- und Visualisierungsbibliothek . . . . . . . . . . . . . . . . . 19
3.4.1
HepaVision . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20
3.4.2
InterventionPlanner . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
Anwendung und Beurteilung der Bildanalyseverfahren für den Thorax-undAbdominalraum . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3.5.1
Lunge . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3.5.2
Leber . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3.5.3
Nieren . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
3
4
Mediastinum . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3.5.5
Entwurf in ILAB für das Organslicing . . . . . . . . . . . . . . . . . . 29
3.6
Anwendung und Beurteilung der Bildanalyseverfahren für die Hals-NackenRegion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
3.7
Aufgetretene Probleme . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3.8
Quantitative Analyse von medizinischen Bilddaten . . . . . . . . . . . . . . . 35
Fallbeispiele
4.1
4.2
5
3.5.4
38
Beispiele aus der Rechtsmedizin . . . . . . . . . . . . . . . . . . . . . . . . . . 38
4.1.1
Fall 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
4.1.2
Fall 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
4.1.3
Fall 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
4.1.4
Fall 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
Beispiele aus der HNO-Heilkunde . . . . . . . . . . . . . . . . . . . . . . . . . 43
4.2.1
Fall 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
4.2.2
Fall 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
4.2.3
Fall 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
4.2.4
Fall 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
Zusammenfassung/Fazit
50
4
1
Motivation
Heutzutage gewinnt die Bildanalyse, auch in der Medizin, immer mehr an Bedeutung. Die zu
verarbeitenden Datenmengen werden aufgrund der fortschreitenden Technik ständig größer
und dienen zur Verbesserung der Diagnostik und Therapieplanung. Es sollen, zum Beispiel,
Strukturen über die Zeit verglichen, einzelne Strukturen visualisiert und quantitativ analysiert werden. Zu diesen Zwecken gibt es immer schnellere und bessere Algorithmen, mit
denen sich die Objekte sehr realitätsnah, ohne großen Interaktionaufwand segmentieren und
auch (halb-)automatisch vermessen lassen. In meinem Praktikum habe ich hierzu zwei Themen bearbeitet.
Virtuelle Autopsie
Leichen mit Verdacht auf einen unnatürlichen Tod oder mit ungeklärter Todesursache werden heutzutage in den meisten Fällen einer Autopsie unterzogen. Es muss geklärt werden,
woran diese Menschen gestorben sind. Die Rechtsmediziner schneiden dazu den Leichnam
auf und entnehmen die Organe. Diese werden dann in Scheiben geschnitten und genauer auf
mögliche Ursachen, die zum Tod geführt haben könnten, untersucht.
Zur Zeit gibt es ein System, mit dessen Hilfe die Autopsie virtuell durchgeführt werden
r wurde vom Institut für Rechtsmedizin in Bern entwickelt. Es werden
kann. Virtopsy
Magnetresonanz-, Spektroskopie- oder Computertomographien-Aufnahmen vom Körper des
Toten gemacht und mit deren Hilfe die Anatomie möglichst realistisch dreidimensional rekonstruiert. Diese Rekonstruktion dient den Rechtsmedizinern zur Bestimmung der Todesursache und soll helfen, Fehldiagnosen zu reduzieren.
Im Rahmen meines Praktikums habe ich verschiedene Methoden zur Segmentierung der
relevanten Organe, die Aufschluss über die Todesursache geben könnten, auf ihre Eignung
getestet. Es soll eine neue Form der virtuellen Autopsie entstehen. Der Anwender soll nicht
mehr nur die Organe anschauen können, er soll auch Informationen, wie Größe, Ausdehnung,
Volumen und Masse erhalten. Ein ihn interessierendes Organ soll ausgewählt werden können
und anschließend, unter Einbeziehung der originalen Daten, soll es eine Möglichkeit geben,
wie bei einer realen Autopsie, das Organ aufzuschneiden“und sich die inneren Schichten
”
anzuschauen.
Planung von HNO-chirurgischen Eingriffen
In Deutschland erkranken pro Jahr ca. 8000 Männer und 2100 Frauen an Tumoren
in Mund, Nase und Kiefer 1 , wobei sich oft Metastasen in den Lymphknoten bilden, die
in CT-Bildern schwer erkennbar sind. Es sollen in diesem Zusammenhang, die für eine
Neck-Dissection (Halslymphknotenausräumung) wichtigsten Strukturen aus CT- oder MRTDatensätzen segmentiert werden. Bei einer Neck-Dissection gibt es mehrere Behandlungskonzepte. Es muss entschieden werden, ob alle Lymphknotengruppen entfernt werden und im
schlimmsten Fall auch einige andere Strukturen (Vene, Muskeln, Nerven). Die dreidimensionalen Segmentierungsergebnisse sollen bei der Entscheidung helfen, ob eine Operation
sinnvoll ist oder nicht, eventuelle Metastasen für den Arzt besser sichtbar zu machen und
darzustellen, inwieweit das umliegende Gewebe oder andere Strukturen infiltriert sind.
1 Quelle:
http://www.dkfz-heidelberg.de, 02.12.2003
5
2
2.1
2.1.1
Medizinischer Hintergrund
Klinische Fragestellungen
Rechtsmedizin
Heute wird bei jeder zehnten Leiche eine Autopsie durchgeführt, um die genaue Todesursache
zu klären. Dazu muss der Rechtsmediziner den Leichnam äußerlich auf Gewalteinwirkungen
oder eventuelle Krankheitssymptome, die zum Tod geführt haben könnten, untersuchen.
Anschließend wird, in den meisten Fällen, mit einem Skalpell der Körper geöffnet und es
werden die inneren Organe untersucht. Dazu werden diese entnommen und es wird geprüft,
ob das Gewebe in irgendeiner Art Veränderungen aufweist, die zum Beispiel auf Tumoren
oder ähnliches deuten und zum Tode geführt haben könnten. Die Angehörigen haben das
Recht, wenn es sich nicht um eine unklare Todesursache handelt, einer Autopsie, die die
Ärzte in einigen Fällen aus wissenschaftlichem Interesse durchführen, zu widersprechen. In
diesen Fällen kann eine Biopsie durchgeführt werden. Eine Biopsie ist ein minimal-invasiver
Eingriff, bei dem mit einer kleinen Nadel Gewebeproben entnommen werden, die histologisch und zytotoxisch analysiert werden. Der Rechtsmediziner muss allerdings einen Verdacht
haben, was den Tod verursacht haben könnte und welche Organe er deshalb genauer untersuchen sollte. Es besteht die Gefahr, dass er etwas Relevantes übersieht.
Die Radiologen und Rechtsmediziner der Universitätsklinik Magdeburg fänden es hilfreich,
eine virtuelle Autopsie als Ergänzung zur herkömmlichen Diagnose zur Verfügung zu haben.
Ihre Vorstellung ist ein System, was auf der Grundlage von CT- oder MRT-Schichtbilddaten
des gesamten Körpers, eine dreidimensionale Rekonstruktion der Leiche erstellt. Es sollen
relevante Organe und pathologische Prozesse hervorgehoben werden können und Informationen, wie Größe, Ausdehnung, Volumen, Masse, über diese angegeben werden. Außerdem
wünschen sie sich ein realitätsnahes, virtuelles Aufschneiden und Anschauen der entsprechenden Organe. Die Daten müssen in verschiedenen Eben angezeigt werden können. Dabei
ist vor allem die Sicht der Daten von koronar wichtig, weil die Rechtsmediziner die Leichen
hauptsächlich aus dieser Sicht untersuchen.
Abbildung 1: Sichten auf die 2D-Daten: axial, sagittal, koronar
Mit diesem System könnten, auch bei einer abgelehnten Autopsie, postmortale Befunde
erstellt werden. Durch die Schnitte, die in verschiedenen Richtungen gelegt werden können,
werden zum Beispiel auch kleine Frakturen der Wirbelsäule sichtbar, die kein Arzt bei einer Autopsie gesucht bzw. gefunden hätte. Verläufe von Stich- und Schussverletzungen, versteckte Knochenbrüche (länger zurückliegende oder verheilte, die keine äußeren Spuren mehr
besitzen) und Verletzungen oder Veränderungen des Gehirns, auch nach längerer Liegezeit,
sind erkennbar. Und eine Suche nach Fremdkörpern und Gasansammlungen im gesamten
Körper ist möglich. Eine Schwierigkeit besteht darin, dass die virtuelle Autopsie auf CT6
oder MRT-Schichtbildern basiert, die aufgrund der fehlenden Möglichkeit der Kontrastmittelgabe, einen schlechten Kontrast aufweisen. Auch unterscheiden sich die Organe und Gewebestrukturen teilweise von denen von Lebenden. Ein positiver Aspekt ist die hohe Auflösung
der Schichtbilddaten. Ihr sind nur technische Grenzen gesetzt, weil die Strahlendosis höher
gewählt werden kann, es keine Bewegungsartefakte gibt und somit die Schichtdicke und der
Schichtabstand sehr gering sind.
2.1.2
Halslymphknotenausräumung
Die Metastasen in den Lymphknoten, die sich bei Tumoren der Hals- und Nackenregion oft
bilden, sind auch mit Hilfe bildgebender Verfahren nur sehr schwer nachweisbar und diagnostizierbar. Nicht selten werden sie nicht einmal bei einem sagittalen Schnitt durch den
Lymphknoten erkannt.
Um die Überlebenschance eines Patienten zu erhöhen, müssen die Ärzte entscheiden, welche
Lymphknotengruppen und einbezogenen Strukturen sie entfernen sollten, um eine fortschreitende Metastasierung aufzuhalten. Die Diagnose fällen sie anhand von CT- und MR-Daten
und dann wird entschieden, welches Behandlungskonzept angewandt wird:
• Wait-and-See“: Bei diesem Konzept, werden keine Lymphknoten entfernt. Der Arzt,
”
der sehr erfahren sein sollte, beobachtet den Patienten und den Krankheitsverlauf.
Dazu sind viele Kontrolluntersuchungen nötig.
• Radikale Neck-Dissection“: Diese Art der Neck-Dissection wird selten angewandt.
”
Zusätzlich werden zu den ipsilateralen Lymphknotengruppen der Halsregion auch einige andere Strukturen (Vene, Muskel, Nerv) entfernt bzw. unterbunden. Die Folgen
für den Patienten sind Funktionsstörungen im Gesichts- und Schulterbereich.
• Modifizierte Radikale Neck-Dissection“: Es werden dieselben Lymphknotengruppen
”
wie bei der Radikalen Neck-Dissection ausgeräumt, allerdings wird eine von den nichtlymphatischen Strukturen erhalten, um die Spätfolgen zu reduzieren.
• Selektive Neck-Dissection“: Bei der Selektiven Neck-Dissection, wird mindestens eine,
”
der bei den anderen Dissections entfernten Lymphknotengruppen nicht entfernt.
Es gibt keine festgelegten Richtlinien, wann welche Methode eingesetzt wird, aber viele
Leitlinien aus Lehrbüchern [LWD]. Laut Dr. Gero Strauß (Oberarzt an der Universitätsklinik Leipzig) wird heute immer noch in den meisten Fällen erst am offenen Patienten ein
Behandlungskonzept gewählt. Das bedeutet allerdings eine unnötige Belastung für den Patienten, wenn festgestellt wird, dass eine erfolgreiche Operation nicht möglich ist. Außerdem
kann der Stoffwechsel des Tumors durch diesen Eingriff angeregt werden und er wächst. Der
Patient wird einfach unnötigen Risiken ausgesetzt, die zu vermeiden wären, wenn präoperativ eine sicherere Diagnose gestellt werden könnte. Um die Ärzte bei der Diagnose zu
unterstützen, sollen die für solch eine Operation relevanten Strukturen segmentiert (halbautomatisch, wenn möglich automatisch) und ihre dreidimensionale Beziehung zueinander
dargestellt werden. So erhält der Mediziner einen Eindruck, von der patientenspezifischen
Anatomie und kann besser beurteilen ob eine Operation machbar und sinnvoll ist.
7
2.2
Anatomie des Menschen
In den folgenden beiden Abschnitten wird die Anatomie, der für die Arbeit wichtigen, Regionen des menschlichen Körpers beschrieben.
2.2.1
Thorax-und-Abdominalraum
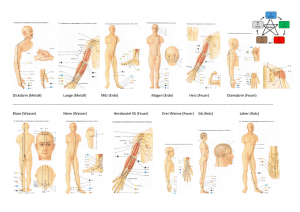
In den folgenden Abbildungen sind die wichtigsten Organe des menschlichen Körpers zu
sehen, die für die Rechtsmediziner bei einer Untersuchung der Leiche interessant sind, um
auf die Todesursache schließen zu können.
Die Lunge, mit dem linken und dem rechten Lungenflügel, liegt im Brustraum und umschließt das Mediastinum, welches das Herz enthält.
Die Leber grenzt von unten direkt an den rechten Lungenflügel und das Mediastinum. Ein
weiteres paariges Organ, die Nieren, befinden sich im Bauchraum.
Abbildung 2: Anatomie des Thorax-und Abdominalraumes (in Anlehnung an [RK88])
8
Abbildung 3: Anatomie des Thorax-und Abdominalraumes (in Anlehnung an [RK88])
9
2.2.2
Hals-Nacken-Region
Der Hals ist das Verbindungsstück zwischen Kopf und Rumpf. Durch ihn verläuft die Wirbelsäule mit dem Rückenmark. Der Hautmuskel des Halses wird Platysma genannt. An der
linken und der rechten Seite des Halses befindet sich je ein großer Muskel (m. sternocleidomastoideus), der dazu dient, den Kopf zur Seite und nach hinten zu neigen und zu drehen.
An seinem Vorderrand verläuft die Halsschlagader (Aorta carotis communis), die sich dann
in die Aorta carotis externa, die das Hals- und Kopfgebiet versorgt und in die Aorta carotis
interna, die das Gehirn mit Blut versorgt, teilt. Um diese Gefäße verläuft eine Bindegewebsschicht, in der sich auch die Vena jugularis interna befindet. Dieses Gewebe wird durch einen
Muskel ( M. omohyoideus) geformt, wodurch das Blut, was aus dem Gehirn kommt, auf seinem Weg zum Herzen besser die Vene passieren kann. Das ist nicht seine einzige Funktion, er
ist auch für die Senkung des Zungenbeins zuständig. Gehoben und fixiert wird das Zungenbein durch den Muskel digastricus und der nervus hypoglossus (siehe Abb.4 (12))versorgt
die Zungenbeinmuskulatur. Der XI-te Hirnnerv, der nervus accessorius (siehe Abb.4 (11)),
ist der Schulter- und Nackennerv und ist für die Versorgung des Sternocleidomastoideus und
des oberen Trapezius (ebenfalls ein Muskel) verantwortlich.
Abbildung 4: Anatomie der Hals-Nacken-Region [WM87]
10
Die Speichendrüsen, die je paarig unterhalb der Ohren liegen, dienen dazu, den Mund
zu befeuchten und die Nahrung aufzuweichen und vorzuverdauen. Die größten Drüsen sind
die Ohrspeicheldrüse (Gl. parotidea, siehe Abb.5 (7)) und die Unterkieferspeicheldrüsen (Gl.
submandibularis, siehe Abb.5 (10)).
Abbildung 5: Gefäßsystem und Speicheldrüsen [McC00]
Der Körper ist außer mit Blutgefäßen auch noch mit Lymphbahnen durchzogen. Die Aufgabe dieses Systems ist es, Fette aus dem Darm abzutransportieren und Zellzwischenräume
von überschüssiger Flüssigkeit zu befreien. Die Lymphkapillaren verlaufen parallel zu den
venösen Blutgefäßen und vereinigen sich immer weiter zu größeren Lymphbahnen, die sich
schließlich in den Lymphknoten treffen und von dort gesammelt weitergeführt werden. Dabei fungieren die Lymphknoten als Filter, die die Lymphflüssigkeit (Lymphe) reinigen. In
ihnen werden die Lymphozyten gebildet, die zusammen mit den Makrophagen (Fresszellen)
Fremdkörper, abgestorbene Zellen und Krankheitserreger beseitigen. Die einzelnen Knoten
sind etwa linsengroß und normalerweise von außen nicht zu ertasten. Bei Infektionskrankheiten, Leukämie oder bösartigen Tumoren können sie anschwellen.
Abbildung 6: Nodi lymphatici cervicalis (Lymphknoten der Hals-Nackenregion)[McC00]
11
2.3
Radiologische Bildaufnahmetechniken
Die Grundlage für die radiologisch bildgebenden Verfahren, war 1895 die Entdeckung der
Röntgenstrahlung, deren physikalischen Eigenschaften genutzt werden können, um den menschlichen Körper und seine Funktion darzustellen. Zwei, auf dieser Grundlage, entwickelte moderne Verfahren sind die Computertomographie und die Magnetresonanztomographie. Beide
Bildaufnahmetechniken sind Schnittbildverfahren und unterscheiden sich in den Eigenschaften der entstehenden Bilder. Darauf wird in den folgenden Abschnitten etwas näher eingegangen.
2.3.1
Computertomographie
Der erste Schnittbildscanner (CT-Scanner) wurde 1971 von Geofrey N. Hounsfield entwickelt
[GP98]. Er diente erst nur zur Untersuchung des Schädels, wurde aber rasch weiterentwickelt, so dass der gesamte menschliche Körper untersucht werden konnte. Damit war es
möglich, viele Erkrankungen zu diagnostizieren, deren Diagnose vorher mit Schwierigkeiten
oder mit einer erheblich größeren Strahlenbelastung für den Patienten verbunden waren. Bei
einer Computertomographie wird der Körper des Patienten aus verschiedenen Richtungen
(schichtweise) mit Röntgenstrahlung bestrahlt. Mit einem Detektor wird gemessen, wieviel
Strahlung wieder aus dem Körper austritt, und daraus die lokale Röntgenschwächung für
jeden Punkt des Körpers berechnet. Der berechneten Schwächung wird ein Dichtewert zugeordnet und anschließend grauwertkodiert als Bild dargestellt. Jeder Bildpunkt entspricht, je
nach Schichtdicke und Auflösung, einem (meistens anisotropen) Voxel, mit einer bestimmten
Größe. Die Einheit der Röntgenschwächung ist nach dem Erfinder des ersten CT-Scanners
Hounsfield benannt. Bei der Zuordnung Dichtewert- Grauwert werden hohe Hounsfieldwerte
auf helle und kleine bzw. negative Hounsfieldwerte auf dunkle bis schwarze Grauwerte abgebildet. Beispiele [Weg92]:
Struktur/Organ:
HE:
Knochen
1000
Nieren
20- 40
Leber
50- 60
Wasser
0
Lunge
-500- -800
Luft
-1024
Mit einem CT lassen sich, ähnlich gut wie beim konventionellen Röntgen, Knochen, Thorax,
Organe und große Gefäße darstellen. Ein Problem ist allerdings der geringe Weichteilkontrast, der auch durch elektronische Kontrastverstärkung nur unbefriedigend ausgeglichen
werden kann. Ein weiterer Nachteil ist die Strahlenbelastung für den Patienten.
Abbildung 8: Beispiel CT des Brustraumes
Abbildung 7: Beispiel CT des Bauchraumes
12
2.3.2
Magnetresonanztomographie
Im Gegensatz zur Computertomographie, wird bei der Magnetresonanztomographie keine
schädigende Strahlung in den Körper eingebracht, und es sind keine Nebenwirkungen bekannt. Dadurch kann sie beliebig oft bei einem Patienten eingesetzt werden. Es entstehen
hochaufgelöste Bilder, die je nach verwendeter MR-Sequenz, einen guten Weichteilkontrast
besitzen. Mit dieser Art Tomographie lassen sich sehr gut Tumoren diagnostizieren und die
Hirnfunktion oder andere Funktionen des Körpers untersuchen. Es ist ein sehr flexibles Verfahren, denn je nachdem welche Anforderungen der Mediziner an die entstehenden Bilder
stellt, können eine Vielzahl von Parametern variiert werden. Bei dieser Untersuchungsmethode wird ausgenutzt, dass der menschliche Körper viele Wasserstoffatomkerne besitzt. Sie
und andere Atomkerne mit ungerader Protonen- oder Neutronenanzahl besitzen einen Eigendrehimpuls und wenn sie einem Magnetfeld ausgesetzt werden, richten sie sich entlang
der Feldlinien aus. Das Magnetfeld muss homogen und stufenweise regelbar sein und ist entweder horizontal oder vertikal ausgerichtet. Befindet sich ein Patient in solch einem Magnetresonanztomographen, richten sich die Protonen (Wasserstoffatomkerne) in seinem Körper
entlang des Magnetfeldes aus. Dann werden Hochfrequenzwellen im Kurzwellenbereich ausgestrahlt, die die Protonen zum kreiseln anregen. Werden diese Wellen ausgeschaltet, kehren
die Protonen wieder in die Ausgangslage zurück und entsenden dabei elektromagnetische
Impulse, die durch die Spulen des Tomographen empfangen werden. Über einen Computer
werden diese Signale mit komplexen mathematischen Berechnungen in Bilder umgewandelt.
Jedes Organ besitzt eine unterschiedliche Dichte von Wasserstoffprotonen und kann dadurch
differenziert werden. Je nach Einstellung der Parameter entstehen Bilder in denen Wasser
hell und Fett dunkel (T2-Wichtung) oder umgekehrt (T1-Wichtung) erscheinen. Weil leider auch Implantate, wie Schrittmacher metallisch sind und auf Magnetstrahlung reagieren,
ist es in diesen Fällen empfehlenswert, sich für ein anderes bildgebendes Verfahren zu entscheiden. Ein Herzschrittmacher kann in seiner Funktion gestört werden oder metallische
Gegenstände können anfangen im Körper herumzuwandern. Zahnfüllungen führen zu Artefakten, eine Bildaufnahme ist aber trotzdem möglich.
Durch die eingesetzten Spulen sind die Bilder, im Gegensatz zum CT, sehr inhomogen. In
MRT-Bildern ist es wegen der Aufnahmesituation und -einstellungen unmöglich, für ein Organ oder Gewebe einen festen Grauwertbereich zu definieren.
Abbildung 9: Beispiel MRT des Kopfes
(axiale Sicht), T1-gewichtet
Abbildung 10: Beispiel MRT des Kopfes
(axiale Sicht), T2-gewichtet
13
3
Bildanalyse
3.1
Das DICOM-Format
Seit 1995 ist DICOM ( Digital Imaging and Communications in Medicine“) der formale
”
Standard in der medizinischen Bildverarbeitung zur herstellerunabhängigen Kommunikation
von medizinischen Bildern und bildbezogenen Informationen. DICOM dient, unter anderem,
zur Beschreibung von Datenformaten für medizinische Bilder und bildbezogene Daten. Eine
DICOM-Datei besteht aus einem Header und den eigentlichen Bild-Daten. Im Header befinden sich DICOM-Tags, die die Informationen in Gruppen und Elemente unterteilen und
diese verschlüsseln. Es gibt eine bestimmte Anzahl von Attributen, die Informationen über
den untersuchten Patienten (Name, Geburtsdatum, Größe, Gewicht...), die Untersuchungsmethode (Datum der Untersuchung, Fragestellung, eingestellte Parameter, Kalibrierung,
Strahlendosis, Kontrastmittel...) und die entstehenden Bilder (Auflösung, Fensterung) zusammensetzen. Für jede Modalität/Bildaufnahmetechnik gibt es Vorschriften, welche Attribute angegeben werden müssen und welche optional sind. Somit erhält der Mediziner neben
den eigentlichen Bilddaten weitere Informationen zum Patienten, dem benutzten Bildaufnahmeverfahren und den Parametern, welche für die Interpretation der Bilder notwendig
sind. Neben diesen Festlegungen zur Speicherung der Bilddaten, ist auch die Kommunikation dieser Daten (netzwerkorientierte Dienste) zwischen verschiedenen Applikationen und
Geräten oder Abfrage eines Bilderarchivs definiert. 2
Abbildung 11: DICOM-Header (DicomTagViewer von ILAB)
Abbildung 11 zeigt den ersten Teil von einem DICOM-Header eines CT-Datensatzes
(zu erkennen an der Angabe hinter der Gruppe und dem Element: (00008,0060))mit einem
Gerät von Siemens. Das 20. Element der 8. Gruppe gibt Auskunft über das Datum der
Bildaufnahme. In diesem Format sind weiter unten die Angaben zum Patienten, weitere
Informationen zur Bildaufnahme und zum Bild zu finden.
2 Quelle:
http://dicom.offis.de/index.php.de, 11.02.2004
14
3.2
Vorverarbeitung
In diesem Abschnitt werden einige Arbeitsschritte erläutert, die für eine Aufarbeitung der
Daten nötig sind, zum Beispiel die Anonymisierung, damit kein Rückschluss auf den Patienten möglich ist. Der zweite Teil der Vorverarbeitung ist der Einsatz von Bildverarbeitungsfiltern, die die Qualität der Daten verbessern können.
3.2.1
Anonymisierung der Datensätze
Da die Radiologen mit dem Weiterreichen von Patientendaten, auch die Schweigepflicht
übertragen, müssen die DICOM-Bilder, die persönliche Angaben über den Patienten enthalten anonymisiert werden. Das heißt, es werden alle Informationen, die eine Zuordnung der
Daten zu einer bestimmten Person ermöglichen entfernt.
Dazu wurde ein Tool mit dem Namen anonDicom“verwendet, bei dem man mehrere Op”
tionen zur Verfügung hat, Informationen aus den DICOM-Daten zu entfernen bzw. zu überschreiben. Es können optional der Patientenname, die Patienten-ID, das Geburtsdatum, die
Aufnahmezeit und das -datum durch Pseudoangaben ersetzt und weitere patientenbezogene
Daten (Gewicht, Größe...) gelöscht werden.
Die vorliegenden Datensätze wurden alle jeweils auf diese Weise anonymisiert.
3.2.2
Medianfilter
Der Medianfilter ist ein nichtlinearer Rangordnungsfilter. Diese Filter ordnen die Pixel unter
der Filtermaske und der neue Grauwert für jeden Pixel ergibt sich aus dieser Sortierung.
Der neue Wert berechnet sich aus dem Durchschnittsgrauwert seiner Umgebung, unter Einbeziehung seines ursprünglichen Wertes.
fˆ(x, y) = median{g(s, t)}, (s, t)S(xy)
(1)
Dadurch werden die lokalen Unterschiede von Grauwerten verringert, die zum Beispiel
durch Rauschen entstehen und keine relevanten Informationen enthalten. Aber die Kanten
des Bildes bleiben erhalten.[GW02]
Abbildung 12: Originalbild/ Medianfilter 3x3/ Medianfilter 9x9
3.2.3
Sigmafilter
Der Sigmafilter arbeitet ähnlich wie ein Gauss-Glättungs-Filter. Der aktuelle Pixel wird
durch den Mittelwert der Nachbarpixel ersetzt, wobei Nachbarpixel aus der Rechnung ausgeschlossen werden, deren Intensität stark von der des betrachteten Pixels abweicht. Diese
15
entscheidende Intensität muss vorher in einem Toleranzfeld definiert werden. Der Sigmafilter reduziert Rauschen und verstärkt bzw. verbessert Regionen, wobei Kanten und dünne
Linien erhalten bleiben.
Abbildung 13: Originalbild/ Sigmafilter mit Faktor 2/ Sigmafilter mit Faktor 5
3.2.4
Diffusionsfilter
Wie in der Physik bedeutet auch in der Bildverarbeitung Diffusion Konzentrationsausgleich.
Hier bezieht sich dieser Ausgleich auf die Grauwerte. Diffusion ist die Beziehung zwischen
zeitlicher und räumlicher Ableitung der Konzentrationsverteilung der Grauwerte. Da die Berechnung sehr komplex ist, wird der Algorithmus nur angenähert und es wird die Diffusion
als eine Folge von kleinen Zeitschritten berechnet. Dabei wird die Konzentration für jeden
Punkt, aus der im vorherigen Schritt vorliegenden, Konzentration berechnet. Die Diffusionsformel für eine Dimension 3 :
∂u
∂u
∂
k
(2)
=
∂t
∂x
∂x
Diffusionsfilter werden wegen ihrer Eigenschaften zum Glätten von Grauwertbildern verwendet, das Rauschen wird entfernt. Man unterscheidet zwischen linearen und nichtlinearen
Diffusionsfiltern. Die linearen Filter haben den Nachteil, dass sie eine konstante Diffusität
besitzen, wodurch auch Kanten zerstört werden. Dagegen besitzen die nichtlinearen Filter
eine gehemmte Diffusion an Kanten, wodurch sie erhalten werden.
3.3
Segmentierungsverfahren
Für die Segmentierung von Objekten aus Bilddaten gibt es verschiedene Ansätze. Es existieren Algorithmen die regionenbasiert arbeiten, zum Beispiel das Regionenwachstum, wobei
Eigenschaften, wie Grauwerte oder Textur als Zusammengehörigkeitskriterium ausgenutzt
und danach die Objekte bestimmt werden. Kantenbasierte Verfahren (Live Wire, Wasserscheidentransformation) nutzen das Vorhandensein von Objektgrenzen, die glatt, zusammenhängend und geschlossen sind, und ermitteln mit Hilfe der Gradienten ein Objekt. Eine
andere Möglichkeit ein Objekt zu detektieren und zu extrahieren, ist die Suche nach Formen.
Dabei werden entweder dynamische Form-Modelle benutzt (Aktive Konturen), die sich der
gesuchten Struktur unter Einfluss bestimmter Bedingungen anpassen oder statistische Modelle erstellt, die Formvariationen der gesuchten Struktur enthalten (durch Trainingsdaten)
und mittels Optimierung sich ihr annähern.
Für die Segmentierung der genannten Fragestellungen wurden einige regionen- und kantenbasierte Ansätze getestet.
3 Quelle:
http://www.st.cs.uni-sb.de/edu/perspektiven/weickert.pdf, 04.02.2004
16
3.3.1
Region Growing
Das Region Growing ist ein Verfahren, welches benachbarte Pixel ähnlicher Intensität zu einer Region zusammenfasst. Zur Segmentierung wird nur ein Startpunkt und ein Schwellwert
vom Benutzer gewählt. Der Schwellwert gibt ein Homogenitätskriterium für den Grauwertbereich an, in dem der Grauwert der betrachteten Pixel liegen muss, damit sie zur segmentierten Region gehören. Vom Startpunkt aus werden alle Nachbarpixel betrachtet, die, wenn
sie innerhalb des gewählten Schwellwertes liegen, als zur Region zugehörig bestimmt werden.
1 : Istartpunkt − I(x, y) < Schwellwert
erg(x, y) =
(3)
0 : sonst
Für alle Pixel, die diese Bedingung erfüllen, werden wiederum die angrenzenden Pixel untersucht. Das Verfahren stoppt, wenn alle Bildpunkte als zugehörig bestimmt wurden, oder
keine mehr der Region zugeordnet werden können.
3.3.2
Wasserscheidentransformation
Bei der Wasserscheidentransformation werden die Grauwerte eines Bildes als Erhebungen
entsprechender Höhe aufgefasst. Man geht von einem Grauwertgebirge aus, bei dem ein
Objekt durch zusammenhängende Becken repräsentiert wird. Ganz wie in der Natur, beginnt
man nun dieses Gebirge zu fluten und das Wasser sammelt sich in den lokalen Minima.
Zwischen diesen Minima werden Wasserscheiden errichtet, die ein überfluten, und somit
verschmelzen von verschiedenen Objekten, verhindern. Zu Beginn der Transformation liegt
eine starke Übersegmentierung vor, kleine und flache Becken sollten noch durch weiteres
Fluten verschmelzen, weil sie keine eigenständigen Objekte darstellen.
Abbildung 14: Schrittweises Verschmelzen von Regionen durch Flutung [SP]
Die Verschmelzung findet zwischen aneinandergrenzenden Becken mit ähnlichen mittleren Grauwerten statt. Dazu wird ein Schwellwert (Mask Threshold) definiert. Die Wasserscheiden können auch mittels Include- bzw Excludepunkten gesetzt oder aufgehoben werden.
Setzt der Nutzer einen weiteren Includepunkt, wird die Wasserscheide zu dieser Region aufgehoben. Definiert er einen Excludepunkt, wird eine neue Wasserscheide gesetzt, die ein
überfluten angrenzender Regionen verhindert (siehe Abbildung 15).
Abbildung 15: Prinzip nach Hahn et al.[HP]
17
Ein weiterer Parameter, auf den der Nutzer Einfluss hat, ist die Preflooding Height. Der
Wert der Preflooding Height bestimmt die Höhe (den Grauwert), bei der zwei aneinandergrenzende Cluster verschmelzen. Die gefundenen Regionen werden größer, je höher dieser
Wert gewählt wird.
Eine Darstellung des mit der Wasserscheidentransformation segmentierten Bildes entsteht,
wenn jedem Staubecken der mittlere Grauwert der zugehörigen Pixel zugeordnet wird.
3.3.3
Live Wire
Live Wire ist ein semiautomatisches Verfahren zur Segmentierung, das Objektgrenzen in
Bildern findet. Diese Objektgrenzen sind Kanten in den Bilddaten, die durch die Ableitung
in x- und y-Richtung charakterisiert ist. Diese Ableitung nennt man Gradient, der die Richtung der stärksten Steigung und dessen Betrag die Stärke der Grauwertänderung angibt.
Mittels Graphensuche wird in einem gewichteten Graphen, ausgehend vom Startpixel zu
jedem Pixel den kostengünstigsten Weg, mit Hilfe von Annahmen über Grauwerte und Gradienten, berechnet. Die Knoten des Graphen sind die einzelnen Pixel, die Kanten beinhalten
die Kosten von einem Pixel zum nächsten, wobei von einer Achternachbarschaft ausgegangen wird. Der Graph wird so aufgespannt, dass große Gradienten, die in einem definierten
Grauwertbereich liegen, die geringsten Kosten verursachen. Damit soll erreicht werden, dass
der günstigste Pfad entlang nahe liegender Objektkanten verläuft.
Für die Pfadbestimmung werden folgende Berechnungen vorgenommen: Zuerst wird mit einem Laplace-Filter nach Kanten gesucht. Jedem Pixel wird eine 1 zugewiesen, wenn er ein
Kantenpixel ist und eine 0, wenn er nicht zu einer Kante gehört. Damit existiert aber noch
keine Information über die Stärke der vorliegenden Kanten. Um die Gradientenstärke zu berechnen, wird die erste Ableitung des Bildes, mittels eines Sobelfilters, in x- und y-Richtung
gebildet. An Stellen mit einem hohen Wert befindet sich eine Kante. Da aber später nach
einem Pfad minimaler Kosten gesucht werden soll, muss die Gradientenstärke umgekehrt
werden. Um zu verhindern, dass der günstigste Pfad auf eine andere Kante überspringt,
werden Richtungswechsel, zum Beispiel an Kreuzungen von zwei Kanten, mit hohen Kosten
bestraft. Konstante Richtungen sind also kostengünstiger, weil sie mit größerer Wahrscheinlichkeit auch zu einem Objekt gehören. Live Wire ist ein Verfahren, das trainiert werden
kann. Um die Lernfunktion des Systems zu nutzen, muss der Anwender ein Teilstück (3264 Pixel)der Kante manuell bestimmen. Anhand dieses manuell segmentierten Teilstücks
wird ein Histogramm der Gradientenstärken berechnet und die dynamische Kostenmap so
angepasst, dass in Gebieten, die der Lernkante am ähnlichsten sind, die geringsten Kosten
vorliegen. Diese Anpassung wird im Verlauf der Segmentierung, mit der aktuellen Kontur, immer wieder vorgenommen. Der Anwender setzt einen Startpunkt und führt die sich
aufbauende und an die Objektgrenze anschmiegende Konturlinie nahe der Objektgrenze entlang. Durch erneutes Setzen von Punkten, welches nötig ist wenn die Konturlinie merklich
von der Objektgrenze abweicht, wird die bisher gezeichnete Konturlinie fixiert und ein neues Teilstück begonnen. Mit einem abschließenden Mausklick wird das letzte Konturstück
mit dem Startpunkt verbunden und die Kontur geschlossen. Auch 3D-Objekte lassen sich
mit diesem Verfahren segmentieren. Es werden die erste, die letzte und ca. jede 4. oder
5. Schicht des Datensatzes halbautomatisch mit Live Wire segmentiert und die restlichen
Schichten werden, anhand der vorhandenen Pixelintensitäten, interpoliert. [SPPa] [SPPb]
In der Abbildung 16 ist ein Arbeitsablauf mit Live Wire dargestellt. Für die Segmentierung der Leber in dieser Schicht sind, einschließlich des Startpunktes, drei Punkte durch
Benutzerinteraktion einzugeben.
18
Abbildung 16: Beispiel für die Segmentierung mit Live Wire
3.4
Die Bildanalyse- und Visualisierungsbibliothek
Bei der Segmentierung wurden hauptsächlich zwei Applikationen von ILAB4 benutzt, die in
den folgenden Abschnitten noch etwas näher beschrieben werden. ILAB wird seit 1993 bei
MeVis entwickelt und ist eine Softwareplattform, die zur schnellen Anwendungsentwicklung
dient, in der alle bekannten Konzepte in einem einheitlichen System vereint sind [HLP]. ILAB
bedeutet Image LABoratory“, bei dem mit Hilfe einer graphischen Oberfläche per Drag &
”
Drop OpenInventor-Klassen und Bildverarbeitungsmodule zu einem Netzwerk verbunden
werden können.
Abbildung 17: ILAB-Netz zum Einlesen und Anzeigen eines Datensatzes
Ein simples Beispiel ist in Abb.17 zu sehen. Die beiden Module imgLoad und SimpleView3D wurden mittels Drag & Drop in den Arbeitsbereich eingefügt und zu einem Netz
verbunden. Mit dem imgLoad-Modul kann eine Datei ausgewählt werden, die anschließend
im SimpleView3D volumengerendert zu sehen ist, gedreht, herangezoomt und mit ClippEbenen bearbeitet werden kann.
19
3.4.1
HepaVision
HepaVision ist eine Anwendung zur präoperativen Planung, die für zwei Arten von Leberoperationen nötige Arbeitsschritte vereint. Zum einen können mit HepaVision mögliche
Leber-Organspender, bei einer Lebendspende, auf ihre Eignung untersucht werden und zum
anderen kann eine notwendige Resektion der Leber simuliert werden. Die Planung erfolgt
an den jeweiligen Patientendaten, die in Form von CT-Schichtbildern im DICOM-Format
vorliegen. Je nach klinischer Fragestellung werden schrittweise nacheinander erst die Leber,
dann die Gefäße und zum Schluss eventuelle Tumore semiautomatisch mit Benutzerinteraktion segmentiert. Dafür wird für die Leber ein Live-Wire-Algorithmus verwendet, der mittels
einer Kostenfunktion nach einem Pfad minimaler Kosten entlang von Kanten sucht und so
die Organgrenzen recht zuverlässig findet. Der Benutzer muss nur einige Punkte setzen,
um die Leber auf einer CT-Schicht zu segmentieren und das auch nur auf jeder 4. oder 5.
Schicht. Die anderen Schichten können interpoliert werden, so dass man schnell und ohne
großen Aufwand das gesamte Organ abgegrenzt hat. Mehr zu Live Wire ist im Abschnitt
3.3.3. zu lesen. Die Ergebnisse werden in einer XML-Datei abgespeichert, um dann die Planung in anderen Anwendungen ausführen und bearbeiten zu können [BSL+ ].
Abbildung 18: HepaVision: ein Schritt bei der Segmentierung, die Lebersegmentierung. In
diesem Beispiel wurde allerdings ein Muskel des Halses segmentiert, da HepaVision auch für
andere Bildanalyseaufgaben verwendet werden kann, die auf CT-Daten basieren.
Die HepaVision-Anwendung besteht aus einem großen 2D-Viewer auf der linken Seite,
der die Schichten der Originaldaten, auf denen die Segmentierung ausgeführt wird, darstellt.
Die obere rechte Seite ist für die 2D-Darstellung der Kostenfunktion der aktuellen Schicht
reserviert. Darunter befinden sich, die Bedienelemente für die Segmentierung mit Live Wire
und am unteren Rand sind die einzelnen Arbeitsschritte als eine Kette von verbundenen
Punkten dargestellt. Der größte Punkt kennzeichnet den aktuellen Arbeitsschritt, die hellen
Punkte alle aktuell ausführbaren Teilschritte für die geladenen Daten. Wenn ein Schritt
erfolgreich beendet und gespeichert wird, werden einer oder mehrere Punkte hell und damit
ausführbar.
20
3.4.2
InterventionPlanner
Der InterventionPlanner wurde zur Unterstützung der Operationsplanung bei Leberoperationen entwickelt und es wird das XML-File mit Segmentierungsergebnissen aus HepaVision
geladen, um die Strukturen darzustellen und zu bearbeiten.
Es werden die 2D-Schichtdaten präsentiert (siehe Abb.19 linke obere Ecke), durch die der
Anwender blättern kann und in denen die Ergebnisse einer vorhergehenden Segmentierung
farblich, je Schicht, eingeblendet werden. So hat der Chirurg die Möglichkeit, die Ergebnisse anhand der Originaldaten auf ihre Richtigkeit zu überprüfen und ihnen so besser zu
vertrauen. In der dreidimensionalen Darstellung (siehe Abb.19 linke Seite) können die vorher segmentierten Strukturen und Organe aus verschiedenen, frei wählbaren, Blickwinkeln
betrachtet oder herangezoomt werden. Sie können auch im Zusammenhang mit den volumengerenderten Originaldaten betrachtet werden, um ihre Lage besser beurteilen zu können.
Weiterhin ist es möglich Applikatoren und Schnittebenen zu platzieren, die Organe zu vermessen oder Resektionslinien einzuzeichnen. Es können Eingriffe zur thermischen Zerstörung
von Tumoren mittels dieser Applikatoren oder zur Resektion eines Lebertumors simuliert
werden. Der Arzt kann so an individuellen Patientendaten jede Operation gezielter planen
und auch seine Ergebnisse mit den vorhandenen Dokumentationsmöglichkeiten (Screenshots
und Movies) festhalten.
Abbildung 19: InterventionPlanner, links oben: Ansicht der Original-2D-Daten mit Einblendung der Segmentierung, links unten: 3D-Ansicht des Segmentierungsergebnisses, rechts:
Liste der segmentierten Strukturen
21
3.5
Anwendung und Beurteilung der Bildanalyseverfahren für den
Thorax-und-Abdominalraum
In den folgenden Abschnitten, werden die Verfahren des Region Growings, der Wasserscheidentransformation und des Live Wire auf ihre Eignung für die verschiedenen Problemstellungen getestet. Dabei wird auf jedes Organ in einem separaten Abschnitt eingegangen, weil
die Güte der Ergebnisse sehr stark von den organspezifischen Grauwerten abhängt.
Die Bildanalyse der Leichendatensätze gestaltet sich generell schwieriger, da die CT- Schichtbilddaten oft sehr verrauscht sind. Das ist der Grund, warum dieses Gebiet, im Gegensatz
zur Analyse von CT-Daten von lebenden Patienten, noch nicht so ausführlich untersucht
worden ist.
Die im Kapitel 3.3 näher beschriebenen Filter, wurden auf ihre Eignung als Vorverarbeitung
zur Verbesserung der Ergebnisse der Rechtsmedizindatensätze geprüft. Leider konnte der
Diffusionsfilter nur bedingt getestet werden, weil er in ILAB noch nicht stabil läuft (siehe
Kapitel 3.7. Aufgetretene Probleme).
3.5.1
Lunge
Das schnellste Verfahren um bei den vorliegenden Datensätzen die Lunge zu segmentieren,
ist das Region Growing. Die oberen und unteren Schwellwerte brauchen nur einmal gewählt,
ein Startpunkt gesetzt werden und das Lungengewebe wird bestimmt. Dieses Ergebnis ist
allerdings nicht ganz fehlerfrei, denn es entstehen einige Löcher in der Lunge, weil das Gewebe
als nicht zugehörig gewählt wird. Zu einer groben Bestimmung der Form ist dieses Verfahren
sicher geeignet, aber um ein genaues Volumen und eine realitätsnahe Darstellung zu erhalten,
ist es ungeeignet.
Abbildung 20: Segmentierung der Lunge mit Region Growing, rechts: Ergebnis der Segmentierung
In der Abbildung ist zu erkennen, dass das Ergebnis an der rechten Seite unvollständig
ist. Diese Löcher lassen sich auch mit der Wahl von anderen Schwellwerten, ohne große
Ausläufe, nicht verhindern.
Ein weiteres Verfahren, was getestet wurde, ist die Wasserscheidentransformation. Dort
sind zwei Parameter einzustellen, ein Schwellwert und die Höhe der Überflutungsgrenze.
Anschließend definiert der Benutzer Punkte, die geflutet werden sollen und Punkte, die
22
nicht zum Objekt gehören. Das setzen dieser Punkte geht recht schnell und somit ist auch
dieses Verfahren nicht sehr zeitaufwändig. Das Lungengewebe wird vollständig erfasst und
weist keine großen fehlenden Bereiche, wie beim Region Growing, auf. Allerdings ist es
schwer, die Punkte so zu setzen, dass die Wirbelsäule komplett ausgeschlossen wird (siehe
folgende Abbildung). Die genauen Organgrenzen werden also nicht immer korrekt erkannt.
Deshalb ist die Darstellung schon realitätsnaher als beim Region Growing, aber noch nicht
ausreichend.
Abbildung 21: Segmentierung der Lunge mit Wasserscheidentransformation, rechts: Ergebnis
der Segmentierung
Wird nach der Anwendung eines Diffusionsfilters die Wasserscheidentransformation für
die Lunge ausgeführt, wirkt das Segmentierungsergebnis in den 2D-Daten auf den ersten
Blick viel besser. Die Grenzen sind regelmäßiger und glatter, kleine Löcher geschlossen und
einige Objekte, die vorher als zugehörig bestimmt wurden, es aber nicht sind, werden nicht
geflutet. Allerdings wird das Auslaufen in angrenzende Regionen nicht verhindert, sondern,
trotz der kantenerhaltenden Eigenschaft des Filters, eher begünstigt. Diese Ausläufe sind
häufig auch nicht durch das Setzen von Excludepunkte zu korrigieren, weil man dadurch
auch einen Teil des zu segmentierenden Objekts löscht. Deshalb ist in diesem Fall eine
Segmentierung ohne den Diffusionsfilter zu empfehlen.
Abbildung 22: links: Segmentierung der Lunge ohne Filter, rechts: Segmentierung mit Diffusionsfilter
Das Beispiel oben zeigt den Vergleich der beiden Ergebnisse, mit und ohne Diffusionsfilter
als Vorverarbeitung. Beim Betrachten ist kein großer Unterschied der beiden entstandenen
Volumina zu erkennen.
23
Dagegen sind bei der Anwendung eines Sigmafilters (9x9) schon Unterschiede auffällig.
Ein großer Teil der fälschlicherweise segmentierten Wirbelsäule entfällt bei der Wasserscheidentransformation durch die Vorverarbeitung mit diesem Filter.
Abbildung 23: links: Segmentierung der Lunge ohne Filter, rechts: Segmentierung mit Sigmafilter
Ein Medianfilter bringt keine sichtbaren Vorteile oder Nachteile bei der Segmentierung.
Er erhöht nur die Rechenzeit und wird darum auch nicht weiter beschrieben.
Führt man die Segmentierung mit Live Wire durch, bedeutet das einen höheren Interaktionsaufwand. In jeder vierten Schicht muss halbautomatisch die Kontur der Lunge eingezeichnet werden, die restlichen Schichten werden interpoliert. Der Nutzer hat zusätzlich
die Möglichkeit einer Korrektur der Linien, so dass die Grenzen des Organs genau bestimmt
werden. Dieses Verfahren bedeutet für den Anwender einen höheren Aufwand als bei den
anderen genannten Verfahren, aber am Ende erhält er ein korrekt segmentiertes Ergebnis,
was nicht nur einen ungefähren Eindruck von der Form vermittelt, sondern ein sehr realitätsnahes Modell, mit dessen Hilfe sich auch das Volumen genau bestimmen lässt. Der Einsatz
von Filtern bei Live Wire bringt keine merklichen Vorteile bei der Segmentierung, weil das
Segmentierungsverfahren sehr gut die Kanten erkennt und auch variabel auf Änderungen in
der Kantenstärke reagiert (lernfähig, siehe Kapitel 3.3.3. Live Wire ).
Abbildung 24: Segmentierung der Lunge mit Live Wire auf zwei Schichten, rechts: Ergebnis
der Segmentierung
24
3.5.2
Leber
Das erste getestete Verfahren zur Segmentierung der Leber ist das Region Growing. Die
Grauwerte der Umgebung der Leber sind allerdings denen der Leber so ähnlich, dass es
keinen unteren und oberen Schwellwert gibt, der ausgehend vom Startpunkt innerhalb der
Leber, diese korrekt segmentiert. Es kommt immer zu großen Ausläufen in die angrenzenden Organe. Diese schwerwiegenden Fehler lassen sich auch mit Hilfe der zur Verfügung
stehenden Vorverarbeitungsfilter nicht so eindämmen, dass ein zufriedenstellendes Ergebnis
entsteht (siehe folgende Abbildung).
Abbildung 25: Segmentierung der Lunge mit Region Growing auf zwei Schichten, rechts:
Ergebnis der Segmentierung
Ähnlich erfolglos wie das Region Growing, ist die Anwendung der Wasserscheidentransformation für die Leber. Versucht man auf einer der zweidimensionalen Schichten eine gute
Segmentierung, durch Setzen von Include- und Excludepunkten, zu erreichen, ist das Ergebnis der angrenzenden Schichten komplett anders (siehe folgende Abbildung), weil große
Teile des Lebergewebes nicht geflutet werden. Auch durch das Plazieren von sehr vielen
dieser Punkte, wird nie ein Ergebnis erreicht, was der Form der Leber auch nur annähernd
entspricht.
Abbildung 26: Segmentierung der Lunge mit Wasserscheidentransformation, rechts: Ergebnis
der Segmentierung
25
Dagegen liefert die Segmentierung mit Live Wire zufriedenstellende Ergebnisse. Der Aufwand ist zwar wieder etwas höher, liegt aber in einem annehmbaren Rahmen (5-10 Minuten
pro Organ). Die unklaren Übergänge von zwei Strukturen erschweren dem Anwender die korrekte Bestimmung der Organgrenzen, machen es aber, dank der Adaptivität des Verfahrens,
nicht unmöglich die Leber zu bestimmen.
Abbildung 27: Segmentierung der Lunge mit Live Wire auf zwei Schichten, rechts: Ergebnis
der Segmentierung
3.5.3
Nieren
Das Region-Growing-Verfahren versagt bei den Nieren, genau wie bei der Segmentierung der
Leber. Es gibt keine Einstellungen, bei denen das Ergebnis akzeptabel ist. Das Verfahren
läuft in die gesamte Körperregion aus (siehe Ergebnisbeispielbild).
Abbildung 28: Segmentierung der Niere mit Region Growing, rechts: Ergebnis der Segmentierung
26
Die Wasserscheidentransformation hingegen, liefert bei einem enormen Interaktionsaufwand (es müssen weit über 100 Punkte gesetzt werden) die grobe Form der Nieren als
Ergebnis. Zu einer quantitativen Analyse der Organe ist es allerdings immer noch ungeeignet.
Abbildung 29: Segmentierung der Niere mit Wasserscheidentransformation, rechts: Ergebnis
der Segmentierung
Das beste Segmentierungsergebnis, liefert wieder das Live-Wire-Verfahren in HepaVision
von ILAB. Durch die Lernfunktion, wird die Kostenfunktion für die Kanten den Grauwerten
angepasst und wenn das Ergebnis dann noch immer nicht gut genug ist, hat der Nutzer die
Möglichkeit, die Konturen manuell zu verbessern.
Abbildung 30: Segmentierung der Niere mit Live Wire auf zwei Schichten, rechts: Ergebnis
der Segmentierung
3.5.4
Mediastinum
Für das Mediastinum ist weder das Region Growing noch die Wasserscheidentransformation geeignet. Die Grenze zur Leber ist selbst für Ärzte nur schwer zu erkennen, weil die
Grauwerte von Mediastinum und Leber im gleichen Bereich liegen. Beim Regionenwachstum
läuft das Ergebnis immer in die gesamte Körperregion aus und bei der Wasserscheidentransformation wären nahezu unendlich viele Punkte, die durch den Benutzer gesetzt werden
müssten nötig, um auch nur annähernd die Form des Mediastinums zu erreichen. Auch eine
Vorverarbeitung durch Filter verbessert die Situation nicht.
27
Abbildung 31: Segmentierung des Mediastinums mit Region Growing, rechts: Ergebnis der
Segmentierung
Abbildung 32: Segmentierung des Mediastinums mit Wasserscheidentransformation, rechts:
Ergebnis der Segmentierung
Mit Live Wire besteht das Problem der unklaren Grenze zwischen Mediastinum und
Leber selbstverständlich auch, aber hier hat der Anwender mehr Einfluss auf das Ergebnis
und mit ein bisschen Erfahrung, ist das Erkennen nicht unmöglich. Es ist mehr Interaktion
nötig als bei einigen anderen Organen, weil an dieser Stelle die Kontur fast manuell (nicht
mehr halbautomatisch wegen der geringen Kantenstärke) eingezeichnet werden muss, aber
das auch nicht auf jeder Schicht, da der Rest recht zuverlässig interpoliert wird.
Abbildung 33: Segmentierung des Mediastinums mit Live Wire, rechts: Ergebnis der Segmentierung
28
3.5.5
Entwurf in ILAB für das Organslicing
Wie in der Einführung schon erwähnt, soll es bei der virtuellen Autopsie die Möglichkeit
geben, sich die inneren Schichten eines bestimmten Organs anzuschauen. Für diese Umsetzung, wurde in ILAB4 ein erster Entwurf eines Netzes erstellt. Dort ist es möglich, sich ein
zuvor segmentiertes Organ in einem Viewer anzeigen zu lassen und eine beliebig orientierte
Schicht anzuschauen. Dazu wird eine im Raum gelegene Clipebene benutzt, die in alle Richtungen rotiert und verschoben werden kann und jeweils auf einer Seite den Teil des Organs
abschneidet bzw. ausblendet und somit die Sicht ins Innere freigibt.
Der rechte Teilbaum des Netzes dient dazu, die Clipebene direkt im Organ zu platzieren
und nicht willkürlich im Raum. Dazu wird der Mittelpunkt des Organs berechnet und die
Plane dorthin verschoben.
Abbildung 34: ILAB4-Netz zum Legen beliebiger Clipebenen durch ein Organ
29
3.6
Anwendung und Beurteilung der Bildanalyseverfahren für die
Hals-Nacken-Region
Die Grauwerte in den CT-Datensätzen der Hals-Nackenregion lassen sich auf den ersten
Blick in zwei Bereiche teilen. Es sind sehr helle Strukturen zu erkennen, die Gefäße und
die Knochen, die einen Grauwert von 1200-2600 besitzen und im Bild für den Betrachter
einheitlich weiß erscheinen. Dann gibt es die Muskeln, die in einer großen Anzahl im Hals zu
finden sind, die alle einheitlich grau sind und in dem Bereich 100-1200 GW liegen. Es gibt
also zwischen den einzelnen Strukturen keine großen Kontraste, die bei einer Segmentierung
hilfreich wären.
Abbildung 35: links: die Muskeln besitzen alle einen gleichen Grauwert, rechts: die Gefäße
und Knochen besitzen auch einen ähnlichen Grauwert
Es lassen sich mit dem Region-Growing-Verfahren die Gefäße, die einen hellen Grauwert
besitzen, gut segmentieren. Da aber die Knochen einen ähnlichen Grauwert haben, werden
sie auch immer als zum Objekt gehörig ausgewählt. Auch ist es nicht möglich, eine bestimmte Vene oder Arterie zu selektieren, denn sobald sie eine Verbindung untereinander besitzen,
werden sie durch das Regionenwachstum mit segmentiert. Ein ähnliches Problem tritt bei
den Muskeln auf. Wird der Startpunkt für das Wachstumsverfahren im M. sternocleidomastoideus gewählt, erhält man als Ergebnis auch alle anderen Muskeln, weil sie in einem
ähnlichen Grauwertbereich liegen und aneinandergrenzen. Um eine bestimmte Struktur zu
segmentieren, ist das konventionelle Region Growing also nicht geeignet. Anwendbar wäre
es, wenn man vorher die interessierende Struktur grob eingrenzt und dann dieses Verfahren
anwendet. Das würde aber doppelten Aufwand bedeuten, denn wenn man die Objektgrenzen gleich korrekt mit Live Wire bestimmt, erhält man sofort ein gutes Ergebnis. In der
Abbildung unten, ist links ein Segmentierungsversuch für die Gefäße zu sehen. Diese werden
auch gut mit ihren Grenzen erkannt, allerdings werden auch Teile der Knochen segmentiert.
In der Mitte sollte nur der M. sternocleidomastoideus segmentiert werden (dort ist der rote
Startpunkt gesetzt), aber als Ergebnis sind alle Muskeln des Halses selektiert. Rechts ist der
Segmentierungsversuche der Speicheldrüsen, die etwas heller sind als die Muskeln, trotzdem
läuft das Verfahren in die angrenzenden Strukturen (Muskeln). Auch die Vorverarbeitung
mit Filtern brachte keine Verbesserungen, weil sich durch sie das Hauptproblem des geringen
Kontrasts auch nicht ändert.
30
Abbildung 36: Segmentierung der Halsstrukturen mit Region Growing
Zur Segmentierung der umliegenden knöcherner Strukturen wurde in einigen der Fälle
das Region Growing verwendet. Allerdings wurde vorher eine interessierende Region aus den
Daten herausgeschnitten und nur dort das Regionenwachstum für die Knochen angewandt,
so dass es keine Ausläufe gab.
Bei den vorliegenden MRT-Datensätzen liefern das Regionenwachstum und die Wasserscheidentransformation, aufgrund der Inhomogenitäten der Bilddaten, noch schlechtere Ergebnisse.
Dagegen lassen sich für die Segmentierung der Vena Jugularis bei der Wasserscheidentransformation sehr gute Parameter finden (preflooding height: 111, mask threshold: 1172),
bei der nur 28 Marker gesetzt werden mussten und folgendes Ergebnis entstand:
Abbildung 37: Segmentierung der v. jugularis mit Wasserscheidentransformation, rechts:
Ergebnis
Durch einige Exclude-Punkte ließen sich andere Blutgefäße und Strukturen gut ausschließen. Damit ist dieses Verfahren gut geeignet, in CT-Daten die größeren Blutgefäße zu
segmentieren.
31
Für den M. sternocleidomastoideus, als Beispiel für die Muskeln, funktioniert das wiederum nur mit erhöhtem Aufwand. Die Überflutungsgrenze muss hoch gewählt werden, um
Ausläufe zu verhindern. Deshalb sind viele Include-Punkte (im folgenden Beispiel waren es
130) und auch einige Exclude-Punkte bei unklaren Objektgrenzen notwendig.
Abbildung 38: Segmentierung der v. jugularis mit Wasserscheidentransformation, rechts:
Ergebnis
Das Ergebnis gibt dem Betrachter einen guten Eindruck der groben Form des Muskels,
es ist aber nicht realitätsnah genug. Außerdem sind die Grenzen zu unregelmäßig und für
eine Operationsplanung somit gänzlich ungeeignet.
Live Wire hat sich auch hier wieder als Verfahren erwiesen, welches die zuverlässigsten
Ergebnisse erzeugt. Es eignet sich selbstverständlich nicht bei allen Strukturen gleich gut,
weil die Grenzen bei den Muskeln zum Beispiel nicht immer klar sind. Aber es ist das einzige
Verfahren, mit dem man gut fast alle Strukturen segmentieren kann. Selbst die nicht immer
einfach erkennbaren, vergrößerten Lymphknoten lassen sich mit ausreichend Benutzerinteraktion selektieren.
Abbildung 39: segmentierte Lymphknoten und Schädelknochen
32
Bei den dünnen Gefäßen treten Probleme auf, weil sie von Schicht zu Schicht ihre Lage
stark verändern können und dadurch nicht immer als zusammenhängend erkannt werden
(siehe 3.7. Aufgetretene Probleme).
Abbildung 40: links: Segmentierung (Speicheldrüse, Vene, Muskel) mit Live Wire, mitte:
Segmentierungsergebnis M. sternocleidomastoideus, rechts: Vena jugularis
3.7
Aufgetretene Probleme
Bei der Bearbeitung der vorliegenden Datensätze mit Live Wire stellte sich heraus, dass
MRT-Schichtbilder ungeeigneter sind als CT-Schichtbilder. Sie waren schwieriger zu segmentieren, weil sie, in den meisten Fällen, eine geringere Auflösung besaßen und einen relativ
großen Schichtabstand. Diese Faktoren könnten die Radiologen sicher bei der Bildaufnahme
berücksichtigen, allerdings sind die Grauwerte in den Bilddaten, bedingt durch die Aufnahmetechnik, nicht ideal. Sie sind inhomogen und erschweren das Segmentieren mit allen
Verfahren zusätzlich.
Im folgenden Beispiel sind diese Inhomogenitäten gut zu erkennen. Der untere Bereich des
Nackens im Bild ist viel heller als der obere und das entspricht nicht der Realität, sondern
ist bedingt durch das Bildaufnahmeverfahren.
Abbildung 41: Beispiel für Inhomogenitäten bei MRT-Bildern (siehe Aufhellung im unteren
Bereich)
Eine weitere Beobachtung war, dass der Algorithmus, der in der Applikation HepaVision
verwendet wird, Probleme hat, schmale längliche Strukturen korrekt zu segmentieren. Die
Gefäße können in aufeinander folgenden Schichten stark hin-und-her springen“und ihre La”
ge verändern. Sie werden deshalb oft nach der Interpolation nicht als eine zusammenhängende Struktur erkannt und unterbrochen dargestellt. Da HepaVision zur Segmentierung der
33
Leber entwickelt wurde und die Leber keine lange und schmale Struktur ist, ist diese Form
dort sicher als unüblich festgelegt und wird deshalb nicht erkannt.
Abbildung 42: Problemstelle der Arterie A. carotis
Desweiteren konnte der Diffusionsfilter, der gute Ergebnisse zu versprechen schien, in
ILAB nicht immer zur Vorverarbeitung der Halsdatensätze getestet werden, weil das entsprechende Modul nicht stabil läuft und oft zum Absturz des Systems führte.
Zur Dokumentation der Grauwerte und Größen der segmentierten Strukturen wurde für
jeden Datensatz eine Statistik erstellt. Deshalb ist bei der Auswertung dieser Ergebnisse
allerdings zu beachten, dass nicht alle Datensätze den gleichen Grauwertbereich besitzen.
34
3.8
Quantitative Analyse von medizinischen Bilddaten
Die quantitative Analyse der segmentierten Organe und Strukturen ist mit dem InterventionPlanner von ILAB möglich. Es wird zu jedem Segmentierungsergebnis das Volumen
angegeben, welches durch Multiplikation der Voxelgröße mit der Anzahl der segmentierten
Voxel berechnet wird. Weiterhin ist es möglich, die Ausdehnung, Winkel, Abstände und minimale Abstände zu messen. Vor allem für das Volumen und die Ausdehnung der Organe im
Thorax-und-Abdominalraum gibt es festgelegte Normwerte für alle Alters-, Gewichts- und
Körpergrößenklassen. Die Vermessung der Organe kann Aufschluss über mögliche Erkrankungen oder Abnormalitäten liefern. Die minimale Abstandsmessung spielt bei der Analyse
der Hals-Nacken-Region eine große Rolle. Dort ist es wichtig, zum Beispiel den minimalen
Abstand eines Tumors zu den Blutgefäßen zu bestimmen. Wenn es nicht möglich ist, ihn
mit entsprechendem Sicherheitsrand zu entfernen, ohne die Vene oder Arterien zu verletzen,
ist eine Operation nicht sinnvoll.
Um bei der manuellen Messung von Abständen die gewünschten Punkte besser selektieren zu können, ist es hilfreich Clipplanes zu benutzen. Durch sie entfernt man Details,
die beim Setzen der Punkte im dreidimensionalen Raum stören. Durch die Clipplanes an
der entsprechenden Stelle, erhält man eine Ebene, auf der es leichter ist, einen Punkt zu
festzulegen.
Abbildung 43: Minimaler Abstand Pharynx(haut)-Tumor(weiß)/ Minimaler Abstand
Tumor(weiß)- Gefäß(blau)/ Ausdehnung Tumor
Das linke Bild der oberen Abbildung zeigt den minimalen Abstand des Tumors (weiß eingefärbt)und des Pharynx (hautfarben eingefärbt) von 0 mm. Das bedeutet, dass der Tumor
in den Pharynx infiltriert ist, was auf den CT-Schichtbildaufnahmen schwierig zu erkennen
ist. Im mittleren Bild ist er minimale Abstand zwischen dem Tumor (weiß eingefärbt) und
dem Gefäß (blau eingefärbt) dargestellt. Er beträgt in diesem Fall nur 0,6 mm, ist damit
dem Gefäß auch schon gefährlich nahe und eine Resektion des Tumors, dessen Ausdehnung
im rechten Bild zu sehen ist, mit ausreichend Sicherheitsrand nicht mehr möglich.
Die quantitative Analyse der segmentierten Organe der Rechtsmedizindatensätze erfolgt
wie oben beschrieben. Vor allem für die Organe von Babys und Kleinkindern, existiert eine
Vielzahl von Normwerten. Diese werden anhand der Körpergröße, des Gewichts oder des
Alters bestimmt und in Tabellen oder Diagrammen festgehalten.
35
Für die ersten drei Datensätze, wurden anhand des jeweils bekannten Alters oder der
Größe die entsprechenden Normwerte bestimmt und in einer Tabelle mit den Segmentierungsergebnissen verglichen:
Tabelle 1: Gegenüberstellung der Normwerte und Ergebnisse der Segmentierung für die
Organe
Daten
Kind1
5M
Organ
rechte Niere
linke Niere
Leber
Milz
rechte Lunge
linke Lunge
Herz/
Mediastinum
Kind2
3M
rechte Niere
linke Niere
Leber
Milz
rechte Lunge
linke Lunge
Herz/
Mediastinum
Normwerte Ausdehnung & Volumen
Länge: 5,9 +- 0,52cm
Volumen: 13-30ml
Länge: 6,1 +- 0,46cm
Volumen: 13-30ml
STL: 4,7 +- 1,14cm
MCL: 6,2 +- 1,68cm
Volumen: Länge: 3,71 +- 1,48cm
Breite: 4,77 +- 1,94cm
Volumen: 25ml
Höhe: Volumen: Höhe: Volumen: Volumen Herz: 59-107ml
Volumen Mediastinum: Länge: 5,0 +- 0,55cm
Volumen: 13-30ml
Länge: 5,0 +- 0,58cm
Volumen: 13-30ml
STL: 3,86 +- 1,7cm
MCL: 5,54 +- 2,12cm
Volumen: Länge: 3,46 +- 1,02cm
Breite: 4,46 +- 1,1cm
Volumen: 10-12ml
Höhe: Volumen: Höhe: Volumen: Volumen Herz: 40-72ml
Volumen Mediastinum: -
36
segm. Ausdehnung & Volumen
Länge: 5,48cm, Breite: 2,77cm
Volumen: 19,67
Länge: 5,36cm, Breite: 3,08cm
Volumen: 19,01ml
STL: 5,23cm
MCL: 6,77cm
Volumen: 227,69ml
Länge: 3,79cm
Breite: 5,29cm
Volumen: 24,02ml
Höhe: 7,8cm
Volumen: 86,51ml
Höhe: 8,0cm
Volumen:83,88ml
Volumen Herz: ca. 61,81ml
Volumen Mediastinum: 96,85ml
Länge: 5,73cm, Breite: 2,35cm
Volumen: 19,74
Länge: 5,76cm, Breite: 2,50cm
Volumen: 20,62ml
STL: 3,0cm
MCL: 6,12cm
Volumen: 261,92ml
Länge: 2,54cm
Breite: 4,95cm
Volumen: 15,66ml
Höhe: 6,97cm
Volumen: 141,64ml
Höhe: 7,12cm
Volumen:163,09ml
Volumen Herz: ca. 59,79ml
Volumen Mediastinum: 90,12ml
Daten
Kind3
5-8 M
Organ
rechte Niere
linke Niere
Leber
Milz
rechte Lunge
linke Lunge
Herz/
Mediastinum
Normwerte Ausdehnung & Volumen
Länge: 5,3 +- 0,53cm
Volumen: 13-30ml
Länge: 5,6 +- 0,55cm
Volumen: 13-30ml
STL: 3,86 +- 1,7cm
MCL: 5,54 +- 2,12cm
Volumen: Länge: 3,46 +- 1,02cm
Breite: 4,46 +- 1,1cm
Volumen: 10-12ml
Höhe: Volumen: Höhe: Volumen: Volumen Herz: 59-107ml
Volumen Mediastinum: -
Quelle: [KS01], [PR91]
37
segm. Ausdehnung & Volumen
Länge: 5,85cm, Breite: 2,95cm
Volumen: 23,84
Länge: 6,45cm, Breite: 2,2,6cm
Volumen: 23,34ml
STL: 3,08cm
MCL: 8,14cm
Volumen: 300,06ml
Länge: Breite: Volumen: Höhe: 7,14
Volumen: 97,96ml
Höhe: 6,92cm
Volumen:126,83ml
Volumen Herz: ca. 77,12ml
Volumen Mediastinum: 110,74ml
4
Fallbeispiele
4.1
Beispiele aus der Rechtsmedizin
Auf den folgenden Seiten, werden die Ergebnisse der Datensätze aus der Rechtsmedizin, zu
denen keine Diagnosen bekannt sind, vorgestellt. Die Segmentierung wurde mit HepaVision
von ILAB und die Betrachtung der Strukturen in 3D mit dem InterventionPlanner von ILAB
durchgeführt. Zu jedem Fall werden die bekannten Patientendaten und Eigenschaften der
Schichtbilddaten genannt und die Ergebnisbilder präsentiert.
4.1.1
Fall 1
Ein 5 Monate altes Mädchen. Die Todesursache ist nicht bekannt. Die CT-Daten liegen vom
gesamten Körper vor und besitzen eine Schichtdicke von 1 mm und einen Schichtabstand
von 0,8 mm.
Abbildung 44: Segmentierungsergebnisse: Lunge, Mediastinum, Nieren, Leber, Milz
Abbildung 45: Segmentierungsergebnisse: alle Organe ohne und mit Einblendung des Volumenrenderings der Originaldaten
38
4.1.2
Fall 2
Dieser CT-Datensatz ist von einem 3 Monate alten Jungen. Er ist mit einem Schichtabstand
von 0,4 mm und einer Schichtdicke von 0,5 mm sehr hoch aufgelöst.
Abbildung 46: Segmentierungsergebnisse: Lunge, Mediastinum, Nieren, Leber, Milz
Abbildung 47: Segmentierungsergebnisse: alle Organe ohne und mit Einblendung des Volumenrenderings der Originaldaten
39
4.1.3
Fall 3
Bei diesen Datensatz handelt es sich auch um CT-Schichtbildaufnahmen, mit einem
Schichtabstand von 0,8 mm. Er ist von einem Mädchen, das ca. 60-70 cm groß ist und somit
vermutlich zwischen 5-8 Monate alt.
Abbildung 48: Segmentierungsergebnisse: Lunge, Mediastinum, Nieren, Leber, Milz
Abbildung 49: Segmentierungsergebnisse: alle Organe ohne und mit Einblendung des Volumenrenderings der Originaldaten
40
4.1.4
Fall 4
Der vorliegende CT-Datensatz wurde von einem Mann aufgenommen, der durch Stichwunden im Brustraum zu Tode kam. Es sind auf den Bildern mehrere Stichkanäle zu sehen.
Wichtig für die Rechtsmediziner ist, herauszufinden, welcher der Stiche zum Tod geführt
hat. Das hat möglicherweise Einfluss auf das Strafmaß, wenn bekannt ist, wer von den
Tätern welchen Stich ausgeführt hat.
Segmentiert wurde das Messer, welches noch im Brustkorb steckt, die Lunge, das Mediastinum und das Blut im Brustraum.
Abbildung 50: Segmentierungsergebnisse in den 2D-Schichtdaten; rot: Blut, blau: Lunge,
gelb: Mediastinum
Abbildung 51: Segmentierungsergebnisse in 3D; rot: Blut, blau: Lunge, gelb: Mediastinum,
schwarz: Messer
41
Abbildung 52: Segmentierungsergebnisse in 3D, links Darstellung mit Knochen, rechts Darstellung mit Volumenrendering; rot: Blut, blau: Lunge, gelb: Mediastinum, schwarz: Messer
Durch die Einstiche, wurde die linke Lunge durch das austretende Blut verdrängt, ebenso
wie das Mediastinum etwas nach rechts gerückt ist. Ein Ziel für die Zukunft bei diesem
Datensatz ist, die Lage der Organe zu rekonstruieren, die sie vor den Verletzungen hatten.
42
4.2
Beispiele aus der HNO-Heilkunde
In den folgenden Abschnitten wird ein kurzer Überblick über die Ergebnisse der verschiedenen HNO-Schichtbilddaten gegeben. Die Segmentierung von Strukturen und Organen erfolgte, auch hier, ausschließlich mit HepaVision von ILAB und die Betrachtung der Strukturen
in 3D mit dem InterventionPlanner von ILAB. Knöcherne Strukturen wurden mit dem
Region-Growing-Verfahren oder mit der Wasserscheidentransformation extrahiert. Bei der
dreidimensionalen Darstellung der Strukturen, wurde die Farbgebung, nach Absprache mit
Dr. Gero Strauß und Frau Dr. Ilka Hertel, an die in anatomischen Lehrbüchern angelehnt.
Die Mediziner sind diese Farben gewohnt und erkennen so die abgebildeten Strukturen leichter. Bis zur Fertigstellung der Studienarbeit wurden 9 Datensätze analysiert. Im Folgenden
wird an 4 ausgewählten Beispielen die Bildanalyse veranschaulicht.
Tabelle 2: Überblick über die segmentierten Strukturen je HNO-Datensatz:
Strukturen:
a. carotis
a. thyreoidea superior
a. lingualis
a. facialis
v. jugularis
v. facialis
n. accessorius
n. hypoglossus
n. vagus
m. sternocleidomastoideus
m. digastricus
m. omohyoideus
gl. submandibularis
gl. parotidea
platysmas
nodi lymphatici cervicalis
oropharynx
Tumor/ Malignom
Knöcherne Strukturen
CT- Daten 1
x
MRT-Daten 2
x
x
x
x
x
x
x
x
x
x
x
x
43
CT-Daten 3
CT-Daten 4
x
x
x
x
Tabelle 3: Überblick über segmentierte Strukturen und benutztes Verfahren:
HNO-Datensatz
Nr. 1 (hals-ct)
Nr. 2 (hals2)
Nr. 3 (gerhard3)
Nr. 4 (nnh)
4.2.1
Segmentierte Strukturen
a. carotis, v. jugularis,m. sternocleidomastoideus
m. digastricus, gl. parotis, gl. submandibularis
[alles mit Live Wire]
oropharynx, -tumor, Gefäße, gl. parotis,
m. sternocleidomastoideus
[alles mit Live Wire]
Malignom
[ mit Live Wire],
umliegende Knochen einschließlich sella turcica
[mit Region Growing]
Tumor
[mit Live Wire]
Siebbein
[Wasserscheidentransformation]
Fall 1
Ein CT-Datensatz mit der Auflösung 512x512x65 , wobei der Schichtabstand 3 mm beträgt.
Eine krankhafte Veränderung der Strukturen im Hals-Nackenbereich ist nicht bekannt. Es
scheint aber eine Veränderung in der Region des Mundbodens und Zungengrunds zu geben.
Auch sind viele Lymphknoten größer als normal. Es sollten Strukturen segmentiert werden,
die für eine Neck-Dissection relevant sind.
Abbildung 53: Segmentierungsergebnis: einzelne Strukturen des ersten Halsdatensatzes
Bild links:
Bild rechts:
Bild mitte:
Muskeln: m. sternocleidomastoideus, m. digastricus, m. omohyoideus
Gefäße: a. carotis, v. jugularis; Lymphknoten: nodi lymphatici cervicalis
Speicheldrüsen: gl. submandibularis, gl. parotis
44
Abbildung 54: Segmentierungsergebnis: alle Strukturen des ersten Halsdatensatzes, rechts:
segmentierte Strukturen mit einem Volumenrendering, wobei durch das Setzen einer Clipebene das Volumenrendering nur auf der linke Seite zu sehen ist
Abbildung 55: Alle segmentierten Objekte, einschließlich Lymphknoten
45
Für diesen Fall, wurde außerdem ein Diagramm ausgearbeitet, was die Lagebeziehungen der Hals-Strukturen zueinander wiedergibt. Dies soll eine Grundlage für eine zukünftige
modellbasierte Segmentierung sein. Die Baumstruktur beschreibt, aus welchen Teilen ein
Schichtbild besteht und zeigt die hierarchischen Zusammenhänge auf. Es wird die Lage der
einzelnen Strukturen zueinander beschrieben (umschließt, befindet sich oberhalb von, befindet sich weiter hinten als..., befindet sich weiter innen als...) und deren Grauwert (minimaler,
maximaler und mittlerer Grauwert).
Abbildung 56: Die Lagebeziehungen der Strukturen zueinander
46
4.2.2
Fall 2
Ein MRT-Datensatz mit der Auflösung 384x512x24 und einem Schichtabstand von 6,5mm.
Der Befund ist eine Metastase eines Oropharynxkarzinoms auf der rechten Seite. Der Tumor
schien präoperativ operabel zu sein, aber während der Operation wurde festgestellt, dass er
zu weit Richtung Schädelbasis gewachsen ist und eine metastasenbedingte Thrombosierung
der Vene (v. jugularis) vorliegt. Der Tumor konnte deswegen nicht mit ausreichend Sicherheitsrand entfernt werden, es wurden nur die vorhandenen Metastasen reduziert.
Die Frage des operierenden Arztes war, ob die große Metastase durch eine Segmentierung
darstellbar ist und ob dies ein anderes Herangehen an den Tumor bewirkt hätte.
Nachdem der Arzt die Segmentierungsergebnisse gesehen hatte, bestätigte er, dass er mit
diesen Bildern die Situation vorher hätte besser einschätzen können.
Abbildung 57: Segmentierungsergebnis: Oropharynxtumor
Bild links:
Bild rechts:
Oropharynxtumor in einem sagittalen Schichtbild (grün umrandet)
Volumenrendering der Originaldaten mit Pharynx (haut) und Tumor (weiß)
Abbildung 58: Segmentierungsergebnis: Übersicht über die segmentierten Strukturen
47
Abbildung 59: Segmentierungsergebnis: Unterschied bei Segmentierung aus zwei Sichten
In der letzten Abbildung ist der Tumor, der aus zwei Ansichten segmentiert wurde,
dargestellt. Der rote wurde aus axialer Sicht und der blaue aus sagitallen Schichtdaten
segmentiert. Das Volumen vom roten Tumor beträgt 18,84 ml und vom Blauen 15,09 ml.
Den Unterschied kann man sich aus den unterschiedlichen Auflösungen der verschiedenen
Richtungen erklären.
4.2.3
Fall 3
Ein CT-Datensatz mit einer Auflösung von 512x512x47 und einem Schichtabstand von 2,5
mm. Die Daten stammen von einem 70-jährigen Patienten mit einer chronischen Nasennebenhöhlenentzündung, gefolgt von einer Polyposis nasi (Polypen). Im Bereich der Hypophyse
und Sella wird der Knochen nicht mehr respektiert, deshalb besteht der Verdacht auf ein
Malignom.
Die Daten sollten mit möglichst hoher Genauigkeit segmentiert und die knöchernen Erosionen dargestellt werden.
Abbildung 60: Segmentierungsergebnis: Malignom
Bild links:
Bild rechts:
Blick von hinten in den Schädel mit dem Malignom (rot)
Volumenrendering der Originaldaten mit Malignom (blau) und umliegenden
knöchernen Strukturen (rot)
48
4.2.4
Fall 4
Dieser CT-Datensatz hat eine Auflösung von 512x512x56 und einen Schichtabstand von 2
mm. Er stammt von einem jungen Patienten, welchen an einer zunächst isolierten Entzündung
der rechten Stirnhöhle gelitten hat. Die Entzündung hat dann die Stirnhöhlenvorderwand
durchbrochen und zu einem Abszess unterhalb der Stirnhaut geführt. Der Patient wurde
operiert und dabei festgestellt, dass die Siebbeinzellen auf der rechten Seite mitbeteiligt
sind und deshalb eine Operation von außen (endonasal) und von innen (extranasal) nötig
wurde.
Dargestellt werden sollte bei diesem Fall die Ausbreitung der entzündlichen Flüssigkeit (Eiter).
Abbildung 61: Segmentierungsergebnis: Eiter (ocker) und Siebbeinzellen (grau)
Abbildung 62: Segmentierungsergebnis: mit Volumenrendering und rechts mit Clipping der
linken Seite
49
5
Zusammenfassung/Fazit
In der Arbeit wurden einige Verfahren und Filter auf deren Eignung für die Anwendung zur
Segmentierung der relevanten Strukturen bei einer Neck-Dissection und der interessierenden
Organe bei einer virtuellen Autopsie getestet. Die Eigenschaften der segmentierten Strukturen (Form, Ausdehnung, Lage, Grauwert...) wurden statistisch festgehalten, um von dieser
Testdatenmenge auf Möglichkeiten zur automatischen Segmentierung zu schließen.
Wünschenswert für die HNO-Ärzte und Chirurgen einer Neck-Dissection, wäre eine vollständige Automatisierung, der bis jetzt noch manuellen oder halbautomatischen Segmentierungsverfahren. Das eigentliche Ziel dabei sollte die automatische Extraktion der Lymphknoten,
deren Darstellung und anschließend eventuell sogar eine automatische Klassifikation sein.
Als Grundlage zur automatischen Segmentierung der Lymphknoten könnte man ihre, in
den meisten Fällen, runde Form benutzen (bei Wucherungen durch Metastasen besteht die
Möglichkeit, dass sie nicht mehr diese Form besitzen). Im Hals-Nacken-Bereich besitzen, bis
auf die Speicheldrüsen, deren Lage bekannt ist, die im Normalfall selten kleiner sind als
Lymphknoten und unregelmäßiger geformt sind, sonst keine Strukturen eine ähnliche Form,
so dass man auf dieser Tatsache gut aufbauen kann.
Wichtig ist es auch noch, eine Benutzeroberfläche zu schaffen, die es den Ärzten und Chirurgen ermöglicht, schnell, übersichtlich und mit geringem Aufwand, anhand der segmentierten
Daten, die Operation zu planen.
Das Ziel bei der virtuellen Autopsie sollte es sein, eine Applikation zu entwickeln, die alle
gewünschten Funktionen vereint. Für das Slicing durch die Originaldaten in einem dreidimensional dargestelltem Organ, wurde schon ein Entwurf (siehe 3.5.5) in ILAB4 gemacht,
welcher allerdings noch erweitert, verbessert und in eine benutzerfreundliche Anwenderoberfläche integriert werden muss. Das Netz sollte so erweitert werden, dass nach einmaligem
Einladen der Daten, eine Liste der segmentierten Organe vorliegt, aus der der Nutzer ein
ihn interessierendes Organ auswählen und bearbeiten kann.
50
Literatur
[BSL+ ]
H. Bourquain, A. Schenk, F. Link, B. Preim, G. Prause, and H.O. Peitgen.
HepaVision2- A software assistant for preoperative planning in living-related liver transplantation and oncologic liver surgery.
[GP98]
Michael Galanski and Mathias Prokop. Ganzkörper-Computertomographie. Georg
Thieme Verlag Stuttgart, 1998.
[GW02] Rafael C. Gonzales and Richard E. Woods. Digital Image Processing. second
edition. Prentice-Hall, Inc., 2002.
[HLP]
H.K. Hahn, F. Link, and H.O. Peitgen. Concepts for Rapid Application Prototyping in Medical Image Analysis and Visualization. Proc SimVis-Simulation und
Visualisierung SCS, Erlangen, 2003, pages 283–298.
[HP]
H.K. Hahn and H.O. Peitgen. The Skull Stripping Problem In MRI Solved By A
Single 3D Watershed Transform. Medical Image Computing and Computer-Assisted Intervention (MICCAI’2000), Pittsburgh, Springer, 2000, pages 134–143.
[KS01]
Theodore E. Keats and Christopher Sistrom. Altas of Radiologie Measurement.
seventh edition. Mosby Inc., 2001.
[LWD]
B.M. Lippert, J.A. Werner, and A.A. Dünne. Indikationen zur Halsoperation bei
nicht nachweisbaren Lymphknotenmetastasen, Teil 2. Neck dissection beim klinischen N0-Hals. HNO, Springer-Verlag 2002, 4:370–379.
[McC00] Thomas O. McCracken. Der 3D Anatomie Altas. Visible Productions LLC, USA,
deutsche Übersetzung: Weltbild Verlag GmbH Augsburg, 2000.
[PR91]
Holger Petterson and Hans Ringertz. Measurements in Petiatric Radiology. Springer Verlag London, 1991.
[RK88]
Rauber and Kopsch. Anatomie des Menschen, Lehrbuch und Atlas, Band IV,
Topographie der Organsysteme, Systematik der peripheren Leitungsbahnen. Georg
Thieme Verlag Stuttgart, 1988.
[SP]
T. Schindewolf and H.O. Peitgen. Interaktive Bildsegmentierung von CT- und
MR-Daten auf Basis einer modifizierten Wasserscheidentransformation. Bildverarbeitung für die Medizin, Springer-Verlag, März 2000, pages 92–96.
[SPPa]
A. Schenk, G. Prause, and H.-O. Peitgen. Local Cost Computation for Efficient
Segmentation of 3D Objects with Live Wire. Medical Imaging 2001: Image Processing (San Diego, USA, 17.-23. February), M. Sonka, K.M. Hanson (Eds.), Proceedings of SPIE, 4322:1357–1364.
[SPPb]
A. Schenk, G. Prause, and H.-O. Peitgen. Optimierte Semi-automatische Segmentierung von 3D-Objekten mit Live Wire und Shape-Based Interpolation. Bildverarbeitung für die Medizin 2001, Lübeck, Springer Verlag.
[Weg92] O.H. Wegener. Ganzkörpertomographie. 2. völlig neubearbeitete Auflage. Blackwell
Wissenschafts-Verlag GmbH, Berlin, 1992.
[WM87] A. Waldeyer and A. Mayet. Anatomie des Menschen. de Gruyter, 1987.
51