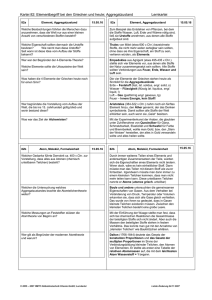
Chemie - hep Verlag
Werbung

Für die Berufsmaturität Typ Gesundheit wird dieser Band ergänzt durch einen weiteren, der die Themen der organischen Chemie behandelt. Franz Heini Studium der Biologie mit Nebenfach Biochemie. Höheres Lehramt für das Fach Biologie. Unterrichtstätigkeit an der KDMS und an Gymnasien in Fribourg. Lehrer für Chemie, Biologie sowie Technik und Umwelt an der Berufsmaturitätsschule Bern. Dr. Doris Kohler-Staub Ausbildung zur Primarlehrerin. Studium der Biochemie an der ETH Zürich, Forschungstätigkeit auf dem Gebiet der mikrobiellen Enzymologie an der ETHZ und an der University of California, Riverside. Höheres Lehramt für das Fach Chemie. Lehrerin für Chemie und Naturwissenschaften an der Berufsmaturitätsschule Zürich. Markus Isenschmid Textillaborant. Studium der Chemie und Biologie. Privatwirtschaftliche Tätigkeit als Umwelttechniker und in verschiedenen chemischen Betrieben. Lehrtätigkeit in der Berufsausbildung, an höheren Fachschulen, Technikerschulen, in der Weiterbildung von Lehrpersonen und an der pädagogischen Hochschule. Lehrer für Chemie, Biologie sowie Technik und Umwelt an der Berufsmaturitätsschule Bern. UG_Baars_Chemie BM_Schu_1A_15_ire.indd 1 www.hep-verlag.ch/chemie-bm Lernen, trainieren, nachschlagen: die kostenlose App zum Buch Chemie für die Berufsmaturität Dieser leicht verständliche Lehrgang vermittelt das Grundwissen der Chemie anschaulich und praxisnah. Er basiert auf dem Rahmenlehrplan 2012 für die Berufsmaturität der Ausrichtungen Technik, Architektur und Life Sciences sowie Gesundheit und Soziales, Typ Gesundheit. Die einzelnen Kapitel bauen aufeinander auf und vermitteln Inhalte so, dass Zusammenhänge erkennbar sind. Merksätze, zahlreiche Aufgaben mit detaillierten Lösungen sowie ein umfangreiches Glossar helfen, den Überblick zu behalten und Gelerntes zielgerichtet zu repetieren. Unter Mitarbeit von Franz Heini, Markus Isenschmid und Doris Kohler Chemie für die Berufsmaturität Suspension Rückstand Rückstand Filtrat zur Vakuumpumpe Baars Prof. Dr. Günter Baars Studium der Chemie, Geografie und Geologie. Gymnasiallehrer und Chemiedidaktiker, Flad-Preisträger der Gesellschaft Deutscher Chemiker sowie Balmer-Preisträger der Schweizerischen Chemischen Gesellschaft. Autor mehrerer Chemiebücher. Publikationen zur Chemiedidaktik. Günter Baars Waschflasche Filtrat Rückstand zur Vakuumpumpe Waschflasche Filtrat 09.06.15 12:40 Die Gesamtheit der Ursachen von Phänomenen ist dem menschlichen Verstand unzugänglich. Doch das Bedürfnis, Ursachen ausfindig zu machen, ist dem Menschen in die Seele gelegt. Tolstoi, Lew: Krieg und Frieden. Carl Hanser Verlag. München. 2010. Zweiter Band, drittes Buch, Teil III. S. 389 Liebe Schülerinnen und Schüler Tag für Tag nehmen wir mit unseren Sinnen vielfältige und oft auch überraschende Eindrücke auf. Dass dabei immer wieder Fragen nach den Ursachen dieser Erscheinungen auftauchen, die nach einer Antwort verlangen, scheint «dem Menschen in die Seele gelegt zu sein», wie Tolstoi es in seinem Roman so treffend ausgedrückt hat. Nützen wir die Erklärungen von Fachleuten oder die Informationen, die uns mit den modernen Medien in reicher Zahl zur Verfügung stehen, so wird bald deutlich, dass gerade die Chemie viele der uns umgebenden Phänomene verständlich machen kann. Es ist anspruchsvoll und erfordert Ausdauer und Neugier, sich mit den Grundlagen der Chemie vertraut zu machen. Das Eintauchen in die Details versperrt ausserdem oft den Blick auf die grossen Zusammenhänge. Mit fortschreitendem Wissensstand lassen sich die übergreifenden Gesetzmässigkeiten jedoch immer deutlicher erkennen. Das vorliegende Lehrbuch möchte Sie auf dem Weg zu diesem Wissen leiten und unterstützen. Es bietet Ihnen nicht nur fachliche Grundlagen, sondern versucht an ausgewählten Beispielen aufzuzeigen, wie die Wissenschaft im Verlauf der Jahrhunderte viele Rätsel gelöst hat. Die Kapitel 1 bis 13 enthalten die verbindlichen Inhalte für das Schwerpunktfach Naturwissenschaften gemäss dem Eidgenössischen Rahmenlehrplan für die Berufsmaturität der Ausrichtungen Technik, Architektur und Life Sciences sowie Gesundheit und Soziales, Typ Gesundheit. Der Zusatzband umfasst in den Kapiteln 14 bis 16 die notwendigen Ergänzungen in organischer Chemie für den Typ Gesundheit. Wenn Sie Anregungen und Wünsche bezüglich dieses Lehrmittels haben oder Fehler bzw. unverständliche Textabschnitte entdecken, so bitte ich um eine Nachricht. Nun wünsche ich Ihnen viel Freude und Erfolg beim Eintauchen in die faszinierende Welt der Chemie. Bern, im April 2015 Günter Baars [email protected] BM_Chemie_Baars.indb 5 09.06.2015 10:32:12 Inhaltsverzeichnis I Betrachtung von Stoffen 1 Ordnung in der Vielfalt der Stoffe14 1.1 Stoffe im Alltag.........................................................................................15 1.2 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I................18 1.3 Stoffe bestehen aus kleinsten Teilchen: das allgemeine Teilchen­modell und die Aggregatzustände...................25 1.4 Gemische sind aus mindestens zwei Reinstoffen aufgebaut ................28 1.5 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden......30 1.6 Reinstoffe sind entweder Verbindungen oder Elemente........................36 Zentrale Begriffe Kapitel 1..................................................................................38 Aufgaben zum Kapitel 1.....................................................................................39 2Die chemischen ­Elemente und ihre ­Atome41 2.1 Das Universum besteht aus Protonen, Elektronen und Neutronen, den Bausteinen der Atome..................................................42 2.2 Die Atome der Elemente sind durch ihre Protonenzahl ­charakterisiert; das Periodensystem .......................................................44 2.3 Atome desselben Elements unterscheiden sich: Isotope ......................44 2.4 Wie schwer sind eigentlich Atome? Atommasse und molare Masse....46 6 BM_Chemie_Baars.indb 6 09.06.2015 10:32:12 Inhaltsverzeichnis 2.5 Elektrisch geladene Teilchen üben aufeinander Kräfte aus; das Coulomb-Gesetz ...............................................................................51 Zentrale Begriffe Kapitel 2 .................................................................................53 Aufgaben zum Kapitel 2.....................................................................................54 3Modellvorstellungen über Atome – die Atomstruktur56 3.1 Atome sind fast leer; das Kern-Hülle-Modell .........................................57 3.2 Das Schalenmodell der ­Elektronenhülle.................................................60 3.3 Wie werden die Schalen der verschiedenen Elemente mit ­Elektronen besetzt? Die Elektronenkonfiguration ..................................65 3.4 Modellhafte Darstellung der Valenzelektronen ......................................68 3.5 Metall- bzw. Nichtmetallatome binden ihre Valenzelektronen unterschiedlich stark ...............................................................................72 3.6 Energie aus Atomkernen: ­Kernverschmelzung und ­Kernspaltung .......73 3.7 Atomkerne können sich auch spontan verändern; die Radioaktivität .....................................................................................77 Zentrale Begriffe Kapitel 3 .................................................................................82 Aufgaben zum Kapitel 3.....................................................................................83 4 Atome verbinden sich: Ein Überblick85 4.1 Elemente – ihre kleinsten Teilchen und deren Beschreibung mit chemischen Symbolen und Formeln ......................................................86 4.2 Nichtmetallatome bilden Moleküle; Molekülverbindungen; ­Reaktionsgleichungen II ..........................................................................89 4.3 Bei der Reaktion von Metall- mit Nichtmetallatomen entstehen Ionen; Ionenverbindungen (Salze) .........................................................94 4.4 Metallatome bilden Gitter; die Bindung zwischen Metallatomen.........98 4.5 Die Benennung binärer Verbindungen ...................................................99 7 BM_Chemie_Baars.indb 7 09.06.2015 10:32:13 Inhaltsverzeichnis Zentrale Begriffe Kapitel 4................................................................................101 Aufgaben zum Kapitel 4...................................................................................102 5Massen, Reaktions­gleichungen und ­Konzentrationsangaben104 5.1 Die Masse von Atomen, Molekülen und Formeleinheiten; molares Volumen ..................................................................................105 5.2 Reaktionsgleichungen erlauben Aussagen über Massen-, Volumen- und Teilchenverhältnisse ......................................................106 5.3 Stoffmengen und Massen charakterisieren Lösungen.........................108 Zentrale Begriffe Kapitel 5................................................................................109 Aufgaben zum Kapitel 5...................................................................................110 6 Stoffe aus Nichtmetallen112 6.1 Atombindungen und Energieumsatz; die Bindungs- und R­eaktionsenthalpie ................................................................................113 6.2 Die räumliche Gestalt (Struktur) von Molekülen .................................115 6.3 Aggregatzustände und zwischenmolekulare Kräfte .............................119 6.4 Die Mischbarkeit molekularer Stoffe ....................................................131 Zentrale Begriffe Kapitel 6 ...............................................................................133 Aufgaben zum Kapitel 6...................................................................................134 7 Salze und ihre Eigenschaften135 7.1 Ionenverbindungen (Salze) sind fest und spröde................................136 7.2 Salzlösungen und Hydrationsenthalpie................................................139 7.3 Elektrischer Strom zersetzt Salzschmelzen und Salzlösungen............142 Zentrale Begriffe Kapitel 7................................................................................143 Aufgaben zum Kapitel 7...................................................................................144 8 BM_Chemie_Baars.indb 8 09.06.2015 10:32:13 Inhaltsverzeichnis 8Metalle145 8.1 Metalle leiten den elektrischen Strom und Wärme und sind mit einer Ausnahme fest .......................................................................146 8.2Legierungen ...........................................................................................149 Zentrale Begriffe Kapitel 8 ...............................................................................150 Aufgaben zum Kapitel 8...................................................................................151 II Chemische Reaktionen 9Redoxreaktionen: Elektronen werden verschoben154 9.1 Oxidation und Reduktion; Reduktor und Oxidator...............................155 9.2 Oxidationszahlen als Erkennungsmerkmal von Redoxreaktionen ....................................................................................159 9.3 Redoxreaktionen lassen sich vorhersagen: die Redoxreihe .......................................................................................162 9.4 Strom durch Redoxreaktionen: Batterien und Akkumulatoren............165 9.5 Metalle korrodieren ...............................................................................174 Zentrale Begriffe Kapitel 9 ...............................................................................176 Aufgaben zum Kapitel 9...................................................................................177 10Säure-Base-­Reaktionen: Protonen werden ­ausgetauscht178 10.1 Säuren und Basen, saure und basische Lösungen – ein Gegensatz .....................................................................................179 10.2 Saure und basische Lösungen neutralisieren sich ...............................187 10.3 Der pH-Wert charakterisiert wässrige Lösungen .................................189 10.4 Säuren und Basen im Alltag..................................................................193 9 BM_Chemie_Baars.indb 9 09.06.2015 10:32:13 Inhaltsverzeichnis Zentrale Begriffe Kapitel 10 .............................................................................196 Aufgaben zum Kapitel 10.................................................................................197 11 Chemische Reaktionen­laufen oft nicht voll­ständig ab; das chemische Gleichgewicht198 11.1 Chemische Reaktionen kommen nicht zum Stillstand: dynamische Gleichgewichte..................................................................199 11.2 Chemische Gleichgewichte lassen sich beeinflussen...........................201 11.3 Säure-Base-Gleichgewichte ...................................................................205 Zentrale Begriffe Kapitel 11..............................................................................208 Aufgaben zum Kapitel 11.................................................................................209 12Warum laufen ­chemische Reaktionen ab?210 12.1 Die Reaktionsenthalpie..........................................................................211 12.2 Die Reaktionsentropie ...........................................................................212 12.3 Freiwillig ablaufende Reaktionen...........................................................214 Zentrale Begriffe Kapitel 12 .............................................................................217 Aufgaben zum Kapitel 12.................................................................................218 III Kohlenstoff-Verbindungen 13Kohlenstoff-Verbindungen (organische Stoffe), ein Überblick220 13.1 Kohlenstoff als Grundelement des Lebens...........................................221 13.2 Funktionelle Gruppen bestimmen die Stoffklassen; ein Überblick ..........................................................................................222 10 BM_Chemie_Baars.indb 10 09.06.2015 10:32:13 Inhaltsverzeichnis 13.3 Wichtige Stoffklassen: Alkane, Alkene, Alkohole, Carbonsäuren und Amine .....................................................................225 13.4 Die Verbrennung organischer Stoffe liefert Energie; der Kohlenstoffkreislauf ........................................................................229 Zentrale Begriffe Kapitel 13 .............................................................................233 Aufgaben zum Kapitel 13.................................................................................234 Lösungen zu den Aufgaben.............................................................................235 Anhang249 GHS: Das neue Kennzeichnungssystem für Chemikalien; ­Gefahren­piktogramme (Gefahrensymbole) mit Signalwort und Erklärungen ......................................................................................................250 Drei Bindungsarten, ihre Stoffe und Eigenschaften; eine Gegen­überstellung...................................................................................252 Glossar .............................................................................................................253 Sachregister......................................................................................................271 Bildnachweis ....................................................................................................276 11 BM_Chemie_Baars.indb 11 09.06.2015 10:32:13 Inhaltsverzeichnis Ergänzungen in organischer Chemie für Gesundheit und Soziales, Typ Gesundheit 14Kohlenwasserstoffe 15 Organische Moleküle mit Sauerstoff- und Stickstoff-Atomen 16 Fette, Kohlenhydrate, Proteine und Nukleinsäuren 12 BM_Chemie_Baars.indb 12 09.06.2015 10:32:13 Hauptgruppen I Betrachtung von Stoffen 5 10.81 6 B Bor 2075 2.34 4000 2.0 0 13 26.98 IB 93 28 58.69 29 Ni Nickel 1455 8.9 2913 1.9 VI A 12.01 7 14.01 8 C N Si P Ge As 16.00 9 O F S Cl Se Br Phosphor Aluminium Silicium 44 1.82 660 2.70 1414 2.33 281 2.1 0 2519 1.5 0 3265 1.8 65.41 31 69.72 32 72.64 33 74.92 Chlor Schwefel 3.2 – 115 2.07 –102 3.0 – 445 2.5 0 – 34 34 78.96 35 79.90 3 Zn Ga .91 46 106.42 47 107.87 48 112.41 49 114.82 50 118.71 Pd Ag Cd In Sn Pt Au Hg Tl Ds* Rg* Cn* Uut* Arsen Subl. 5.72 – 2.0 Selen 221 4.79 685 2.4 0 m Brom –7 3.12 – 59 2.8 0 – 51 121.76 52 127.60 53 Sb Te Pb Bi Po* Fl* Uup* Lv* m Silber Palladium Cadmium Indium Zinn Antimon Tellur 962 10.50 321 8.69 232 7.29 631 6.68 450 157 7.31 2.4 1555 12.02 6.23 2.2 2162 1.9 767 1.7 0 2072 1.7 0 2602 1.8 0 1587 1.9 2.2 2963 988 2.1 .22 78 195.08 79 196.97 80 200.59 81 204.38 82 207.02 83 208.98 84 [208.98] * – – 19.00 1 Sauerstoff Fluor –219 1.43 –220 1.7 – –183 3.5 0 –188 4.0 – 16 32.07 17 35.45 1 Gallium Germanium Kupfer Zink 938 5.32 30 5.90 1085 8.96 420 7.13 2562 1.9 0 907 1.6 0 2204 1.6 0 2833 1.8 Platin Gold 56 1768 21.45 1064 19.3 2.2 3825 2.2 2856 2.4 .14] 110 [271] 111 [272.15] VII A 2 II B 63.55 30 Cu VA Kohlenstoff Stickstoff (3550) 2.2 –210 1.25 4830 2.5 –196 3.0 0 14 28.09 15 30.97 Al I .9 .9 IV A III A 126.90 5 I Iod 114 4.93 – 184 2.4 0 – 85 [209.99] 8 At* Quecksilber Blei Polonium Thallium Bismut Astat –39 13.54 304 11.85 328 11.35 271 9.79 254 9.2 302 – – 357 1.9 1473 1.8 0 1749 1.9 1564 1.9 962 2.0 337 2.2 – 112 [285] 113 [284] 114 [289] 115 [288] 116 [289] 117 [293] 1 Uus* Darmstadtium Roentgenium Copernicum Ununtrium Flerovium Ununpentium Livermorium Ununseptium U – – – – – – – – – – –– –– – – –– – – – – – – – – – – –– –– – – –– BM_Chemie_Baars.indb 13 09.06.2015 10:32:14 1 Ordnung in der Vielfalt der Stoffe ››Worum geht es? Das gesamte Universum, einschliesslich unserer Erde, ist aus einer erstaunlich geringen Anzahl unterschiedlicher chemischer Elemente aufgebaut. Sie begegnen uns im Alltag jedoch nur sehr selten in reiner Form. Die meisten Stoffe, mit denen der Mensch in Berührung kommt, sind Verbindungen aus mehreren Elementen. Das einleitende Kapitel dieses Buches zeigt mithilfe von Experimenten, wie sich die grosse Vielfalt der Stoffe in eine Ordnung bringen lässt. Kräfte und Energie steuern die unzähligen in der Natur ablaufenden Prozesse. Ein Mensch beispielsweise gibt wie eine 100-Watt-Glühbirne dauernd Wärme ab, gewonnen aus komplexen chemischen Vorgängen. In den folgenden Abschnitten wird deshalb immer wieder von Kräften, Energien und Energiedifferenzen die Rede sein. 1.1 Stoffe im Alltag 15 1.2 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I 18 1.3 Stoffe bestehen aus kleinsten Teilchen: das allgemeine Teilchen­modell und die Aggregatzustände 25 1.4 Gemische sind aus mindestens zwei Reinstoffen aufgebaut 28 1.5 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden30 1.6 Reinstoffe sind entweder Verbindungen oder Elemente 36 Zentrale Begriffe Kapitel 1 38 Aufgaben zum Kapitel 1 39 14 BM_Chemie_Baars.indb 14 09.06.2015 10:32:14 Stoffe im Alltag 1.1 Stoffe im Alltag Wenn wir mit offenen Augen durch die Welt gehen, sehen wir faszinierende und rätselhafte Alltagserscheinungen. So überrascht der Nebel an einem Herbstmorgen, obwohl sich der vorhergehende Abend mit einem prächtigen Sonnenuntergang bei klarer Luft zeigte. Noch schlaftrunken übersieht der Frühaufsteher meistens die feinen Gasblasen, die beim Kochen des Wassers vom Boden der Pfanne aufsteigen, bevor die Siedetemperatur erreicht ist. Aus dem mit einer feinen Kalkschicht bedeckten Gefäss ergiesst sich das klare, durchsichtige, sprudelnde Wasser über die Teeblätter in die Kanne, wobei sich die Flüssigkeit allmählich hellgelb bis dunkelbraun färbt. Die dazugegebenen Würfelzuckerstücke sind nach wenigen Rührbewegungen mit dem Löffel in der Tasse aufgelöst und auch die Milch hat sich gleichmässig verteilt. Verschiedene Klingeltöne zahlreicher Mobiltelefone, mehr oder weniger leise geführte Telefonate wie auch der dumpfe Rhythmus der Musik aus einem Smartphone im überfüllten Vorortzug zeugen von den raschen Fortschritten der modernen Elektronik. Diese benötigt eine grosse Anzahl von Rohstoffen, wie edle und halbedle Metalle (Gold, Silber, Kupfer), seltene Erden (Lanthan, Neodym usw., hauptsächlich in China abgebaut) und weitere Metalle wie Silicium, Palladium, Tantal usw. Einige von ihnen sind nur in sehr geringen Mengen auf der Erde vorhanden. Ein Artikel in der Wochenzeitschrift DIE ZEIT über den «verlorenen Schatz»1 listet die Stoffe detailliert auf, die in den rund 60 Millionen nicht mehr gebrauchten und in deutschen Schubladen liegenden Handys verbaut sind: 3 Tonnen Gold, 30 Tonnen Silber, 1900 Tonnen Kupfer, 1151 Tonnen Aluminium und 105 Tonnen Zinn. Beim Überqueren des Münsterplatzes in Bern fällt der Blick auf ein mächtiges Gerüst am hoch aufragenden Kirchturm. Seit Jahrzehnten müssen immer wieder Steine des Münsters ausgewechselt oder mit Mörtel neu aufgebaut werden. Die Sandsteinblöcke, hauptsächlich verwendetes Baumaterial des Münsters, bestehen aus Quarzkörnern, die eine Grundmasse von Kalk zusammenhält. Abgase aus Verkehr, Haushalten und Industrie sowie der damit im Zusammenhang stehende Abb. 1.1 Smartphone 1 Kunze, A.: Der verlorene Schatz; Deutschland gehen die Rohstoffe aus. DIE ZEIT. Nr. 20; 10. Mai 2012 15 BM_Chemie_Baars.indb 15 09.06.2015 10:32:15 1 Ordnung in der Vielfalt der Stoffe Abb. 1.2 Berner Münster mit Gerüst «saure Regen» lösen den Kalk des Sandsteins auf, der dadurch allmählich zerfällt. Gebäude aus diesem Material müssen deshalb immer wieder saniert werden. Karsterscheinungen wie Dolinen, Schratten oder die oft riesigen Höhlensysteme («Tropfsteinhöhlen») sind ebenfalls das Produkt von Lösevorgängen. Der Saft einer Zitrone, eine saure Lösung, kann die Oberfläche von Kalk- oder Marmorplatten schädigen (Marmor = während einer Gebirgsbildung unter hohem Druck umkristallisierter Kalk). Zuhause gelingt das Entfachen eines Feuers im offenen Kamin erst, nachdem einige Stücke Holz zu feinen Spänen gespalten worden sind. Eine kleine Unaufmerksamkeit beim Grillen auf dem offenen Feuer führt zur Verkohlung der Fleischstücke. Beim Nachtessen schliesslich faszinieren die Farbe eines einfachen purpurroten Landweins und das sprudelnde Mineralwasser. Der silberne Kerzenständer zeigt nach erfolgter Reinigung schon bald wieder Spuren eines grauschwarzen Belags. Was aber passiert genau beim Auflösen von Kalk durch saure Lösungen, beim Zersetzen von Sandstein aufgrund der zunehmenden Luftverschmutzung? Woher stammt die Wärme, die die Verbrennung von Holz, Heizöl­oder Benzin liefert, und welche Abgase entstehen dabei? Wie gewinnt man das für die Elektronik benötigte Silizium und wie funktioniert z. B. ein Lithium-Ionen-Akkumulator, die Stromquelle der meisten Elektronikgeräte? Wie laufen die Prozesse bei der Produktion von alkoholischen Getränken ab? Die Chemie versucht, derartige Veränderungen von Stoffen zu erklären. Sie beschäftigt sich aber auch mit den Eigenschaften von Stoffen. Warum sind viele von ihnen farbig? Wieso löst das heisse Wasser nur ganz bestimmte Anteile aus den Teeblättern und weshalb verteilen sich Zucker und Milch ohne Probleme im Tee, während Öl und Essig sich bei der Zubereitung von Salatsauce nicht mischen? 16 BM_Chemie_Baars.indb 16 09.06.2015 10:32:16 Stoffe im Alltag Weshalb leitet Kupfer den elektrischen Strom, viele andere Stoffe jedoch nicht? Woher stammt der Kohlenstoff, wenn Nahrungsmittel beim zu starken Erhitzen verkohlen? Um all diese Fragen beantworten zu können, ist es nötig, sich mit den Denk- und Arbeitsweisen der Wissenschaft Chemie vertraut zu machen. Dies erfordert eine solide Basis an Grundkenntnissen. Die Chemie beschäftigt sich mit den Eigenschaften von Stoffen der belebten und der unbelebten Natur, ihren Veränderungen und den dabei herrschenden Gesetzmässigkeiten. Abb. 1.3 Höhle im Kalkgestein; Dröhenlandschlot F1, Hohgant 17 BM_Chemie_Baars.indb 17 09.06.2015 10:32:16 1 Ordnung in der Vielfalt der Stoffe 1.2 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I Änderung der Stoffeigenschaften Chemische Reaktionen beherrschen den Alltag. Beim Menschen etwa sorgen sie u. a. für die Körpertemperatur und ermöglichen Muskelarbeit, sie steuern Prozesse in der Tier- und Pflanzenwelt und liefern Stoffe wie Metalllegierungen, Medikamente, Farben, Kunststoffe, Fasern jeglicher Art usw. Was aber sind chemische Reaktionen, wodurch zeichnen sie sich aus und woran erkennt man sie? An frisch gereinigten Silbergegenständen ist nach einiger Zeit ein schwarzgrauer Belag zu beobachten. Bei zu grosser Hitze «verkohlt» ein Stück Fleisch. Salzsäure greift die Oberfläche von Kalkstein an, wobei ein farb- und geruchloses Gas gebildet wird, Kohlenstoffdioxid, das sich durch Aufschäumen bemerkbar macht. Beim Verbrennen von Holz bleibt «Asche» zurück, die ganz anders aussieht und ein viel geringeres Volumen besitzt. Schliesslich kann der aufgeladene Akku wieder zum Betrieb eines Smartphones, eines Tablets usw. benützt werden. All diesen Vorgängen ist gemeinsam, dass aus Stoffen andere Stoffe gebildet werden. Die typischen (spezifischen) Eigenschaften der Edukte (Ausgangsstoffe) und Produkte (Endstoffe) unterscheiden sich. Bei einer chemischen Reaktion entstehen Stoffe mit neuen Eigenschaften. • • • • • • • Druck Zeichen: p Einheit: Pa (Pascal) DichteZeichen: ρ (rho) Einheit: g/cm3Verknüpfungen: ρ = _ m V Volumen Zeichen: V Einheit: cm3, l (Liter) Masse Zeichen: m Einheit: g, kg, t Celsius-Temperatur Zeichen: t Einheit: °C (Grad Celsius) Schmelztemperatur Zeichen: tm (engl. to melt = schmelzen) Einheit: °C Siedetemperatur Zeichen: tb (engl. to boil = sieden) Einheit: °C Abb. 1.4 Verschiedene Metalle zeigen den charakteristischen Metallglanz Abb. 1.5 Gold auf Quarz 18 BM_Chemie_Baars.indb 18 09.06.2015 10:32:17 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I Tabelle 1.1: Stoffeigenschaften Eigenschaft Beispiele Aggregatzustand bei Raumtemperatur Sauerstoff: gasförmig; Wasser: flüssig; PVC (Polyvinylchlorid): fest Schmelztemperatur tm Schwefel: tm = 119 °C Siedetemperatur tb Wasser: tb = 100 °C bei Normaldruck (p = 101 325 Pa) Dichte ρ Gold: ρ = 19.3 g/cm3 (Masse pro Volumeneinheit) Löslichkeit Kochsalz: 36 g lösen sich in 100 cm3 Wasser bei Raumtemperatur elektrische Leitfähigkeit Kupfer: sehr gut leitend PVC: nicht leitend Wärmeleitfähigkeit Metalle: sehr gut leitend Brennbarkeit z. B. Alkohol Farbe Gold: gelb; Brom flüssig und gasförmig: braun; Schwefel: gelb Härte Diamant: härtester Naturstoff Aussehen Metallglanz Kristallform* Kochsalz: Würfel Verformbarkeit Gold: gute Verformbarkeit (Blattgold) Geruch Dihydrogensulfid (Schwefelwasserstoff): nach faulen Eiern * In einem Kristall sind die Atome (Atomgitter; Abschnitt 4.1) oder Ionen (Ionengitter; Abschnitt 7.1) nach bestimmten, für den jeweiligen Stoff charakteristischen Gesetzmässigkeiten angeordnet. Abb. 1.6 Brom ist braun im flüssigen und im gasförmigen Zustand Abb. 1.7 Diamanten Abb. 1.8 Kristalle von Pyrit 19 BM_Chemie_Baars.indb 19 09.06.2015 10:32:19 1 Ordnung in der Vielfalt der Stoffe Abb. 1.9 Reaktion von Silber mit Schwefel; links: Versuchsanordnung; rechts Aufglühen des Silbers während der Reaktion Abb. 1.10 Silberblech und Silbersulfid Energieumsatz Dass neben der Stoffumwandlung weitere Kriterien eine chemische Reaktion kennzeichnen, lässt sich an folgendem Beispiel zeigen2: Entsprechend der Versuchsanordnung in Abb. 1.9 reagiert Silber mit Schwefel zu Silbersulfid, nachdem das Metall erwärmt und der Schwefel gasförmig gemacht wurde (Aktivierungsenergie), wobei das Metall für kurze Zeit hell aufglüht. Dies weist darauf hin, dass insgesamt Wärme frei wird. Das erhaltene Produkt (Abb. 1.10) ist grauschwarz und lässt sich nicht mehr verbiegen, es ist spröde und bricht bei der geringsten Krafteinwirkung auseinander, ganz im Gegensatz zum verwendeten Silberblech. Das Silbersulfid wird nun in einem mit zwei Siliconstopfen verschlossenen Quarzrohr (Abb. 1.11) kräftig mit einem Brenner erhitzt. Nach einiger Zeit beobachtet man fein verteilten gelben Schwefel in der Glasröhre und ein Stück glänzendes Metall, Silber: Das Silbersulfid wurde unter Energieaufwand (Wärmezufuhr) wieder in die Ausgangsstoffe zerlegt. Charakteristisch für chemische Reaktionen ist, neben der Bildung von Stoffen mit neuen Eigenschaften, auch ein Energieumsatz: Energieabgabe, wenn Silber mit Schwefel reagiert bzw. Energieaufnahme bei der Umkehrung der Reaktion, der Zersetzung von Silbersulfid. • Bei chemischen Reaktionen wird Energie umgesetzt. • Chemische Reaktionen lassen sich umkehren. 2 Die Versuchsbeschreibung sowie die dazu nötigen Materialien sind erhältlich bei: Zitt-Thoma GMBH, Laborbedarf, Glasbläserei, D-79115 Freiburg. 20 BM_Chemie_Baars.indb 20 09.06.2015 10:32:22 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I Abb. 1.11 Zersetzung von Silbersulfid in Schwefel und Silber. Das Silber zeigt noch Spuren von Silbersulfid, das bei weiterem Erhitzen unter Luftzufuhr leicht entfernt werden kann Reaktionsgleichungen Um chemische Reaktionen einfach darstellen zu können, verwendet man Reaktionsgleichungen. Die links vom Pfeil stehenden Stoffe heissen Ausgangsstoffe oder Edukte, die rechts stehenden Endstoffe oder Produkte. Der Pfeil bedeutet «reagieren zu». Oft wird auch noch der Aggregatzustand der Stoffe in Klammern angegeben. Für die Bildung bzw. Zersetzung von Silbersulfid lauten die Gleichungen: Silber(s) Silbersulfid(s) + Schwefel(s) Silber(s) + Silbersulfid(s) (Energie wird frei) Schwefel(s) (Energie wird zugeführt) • Chemische Reaktionen lassen sich mit Reaktionsgleichungen beschreiben. Ausgangsstoffe (Edukte) reagieren zu ( ) den Endstoffen (Produkten). • Symbolische Darstellung der Aggregatzustände: • s: fest (engl. solid = fest) • l: flüssig (engl. liquid = flüssig) • g: gasförmig (engl. gaseous = gasförmig) Prinzip vom Energieminimum Wird bei einem chemischen Vorgang Energie frei, so sind die Produkte energieärmer als die Ausgangsstoffe. Dies ist bei der Bildung von Silbersulfid aus Silber und Schwefel der Fall. Um die energiereicheren Stoffe Silber und Schwefel wieder herzustellen, den Vorgang also umzukehren, ist ein Energieaufwand erforderlich. Im ersten Fall, bei der Bildung eines energieärmeren Stoffes, verläuft die Reaktion freiwillig, nachdem sie in Gang gesetzt worden ist (Aktivierungsenergie). Im zweiten Fall muss die Reaktion bis zu ihrem Ende erzwungen werden, wobei wieder energiereichere Stoffe entstehen. Die Beobachtung, dass viele Reaktionen freiwillig ablaufen, wenn dabei Energie frei wird, lässt sich an zahlreichen anderen Beispielen zeigen. In der Natur herrscht das Prinzip vom Energieminimum (Erreichen einer minimalen potenziellen Energie). 21 BM_Chemie_Baars.indb 21 09.06.2015 10:32:26 1 Ordnung in der Vielfalt der Stoffe E Silber(s)/Schwefel(s) Abb. 1.12 Energieumsatz bei der Bildung bzw. Zersetzung von Silber­ sulfid (E: Energie) Silbersulfid(s) Energie- Energie wird aufwand freigesetzt Bildung und Zersetzung von Silbersulfid lassen sich unter Verwendung eines Doppelpfeils in einer einzigen Reaktionsgleichung beschreiben: Silber(s) + Schwefel(s) Silbersulfid(s) + Energie [Der Energiegewinn bezieht sich auf den von links nach rechts ablaufenden Vorgang; betrachtet man die Reaktion von rechts nach links, so kehrt sich die Energiebilanz um: Bei der Zersetzung von Silbersulfid muss Energie (Wärme) zugeführt werden.] Drei Charakteristika kennzeichnen eine chemische Reaktion: Chemische Reaktionen erkennt man • daran, dass aus den Ausgangsstoffen (Edukten) Endstoffe (Produkte) mit anderen Eigenschaften gebildet werden (= Stoffveränderung), • am Energieumsatz, • an der Umkehrbarkeit.3 Reaktionsenthalpie (Reaktionswärme) Die Energiebilanz einer chemischen Reaktion entspricht dem Unterschied der Energie von Edukten und Produkten und wird mit dem Symbol ∆H für die Reaktionswärme (Reaktionsenthalpie4) gekennzeichnet. ∆ (Delta) steht für den Unterschied der Energieinhalte und H für heat (engl. = Hitze). Reaktionen, bei denen Energie z. B. als Wärme, Licht oder Luftdruckwelle bei Explosionen frei wird, heissen exotherme Reaktionen (gr. exo = aussen; gr. therme = Wärme, Hitze) und werden mit ∆H < 0 gekennzeichnet. Das Vorzeichen der an die Umwelt abgegebenen Energie erhält in diesem Fall ein Minus, da die Produkte gegenüber 3 Eine Änderung des Aggregatzustandes wird nicht als chemische Reaktion bezeichnet, weil dabei keine Stoffveränderung erfolgt. 4 Energien, die sich auf Messungen unter konstantem Druck beziehen, werden Enthalpien genannt (gr. thalpos = Wärme, Hitze; gr. en = innen, drin). Die Reaktionswärme bezeichnet man deshalb als Reaktionsenthalpie. Chemische Reaktionen finden oft bei konstantem Luftdruck statt. 22 BM_Chemie_Baars.indb 22 09.06.2015 10:32:29 Chemische Reaktionen auf Stoff­ebene: Stoffeigenschaften, Energieumsatz, Reaktions­gleichungen I den Edukten energieärmer sind (Abb. 1.13). Wenn für den Ablauf chemischer Reaktionen kontinuierlich Energie benötigt wird, spricht man von endothermen Reaktionen (gr. endo = innen); ∆H ist grösser als null (∆H > 0). Das Vorzeichen der gemessenen aufzuwendenden Energie erhält ein Plus, da die Produkte gegenüber den Edukten energiereicher sind (Abb. 1.14). Aktivierungsenergie Reaktionsenthalpie < 0 Produkte Energie Aktivierungsenergie Viele Reaktionen können erst dann ablaufen, wenn man den Ausgangsstoffen zuerst, wie in Abb. 1.13 und 1.14 ersichtlich, Energie zuführt, die Aktivierungsenergie (Anzünden von Holz, einer Kerze, von Benzin usw.). Bei der Reaktion Silber + Schwefel musste z. B. das Metall erwärmt und der Schwefel gasförmig gemacht werden. Edukte Man kann sich vorstellen, dass die Aktivierungsenergie dem Energieaufwand entspricht, der nötig ist, um ein Auto auf eine Bergkuppe zu schieben, damit es von selber den Berg hinunterrollt (Abb. 1.15). Reaktionsweg Aktivierungsenergie Edukte Produkte Aktivierungsenergie Reaktionsenthalpie < 0 Reaktionsenthalpie > 0 Energie Energie Produkte Edukte Reaktionsweg Reaktionsweg Abb. 1.13 Energieschema einer exothermen Reaktion Abb. 1.14 Energieschema einer endothermen Reaktion E ohne Katalysator Energie Edukte Reaktionsweg Produkte AktivierungsReaktionsenthalpie > 0 energie Energie Aktivierungsenergie mit Katalysator Edukte Produkte Reaktionsenthalpie Reaktionsprodukt Abb. 1.15 Die Aktivierungsenergie versetzt die Ausgangsstoffe in einen reaktionsfähigen Zustand Reaktionsweg Abb. 1.16 Energieschema einer exothermen Reaktion unter Verwendung eines Katalysators (vgl. Abb. 1.13) 23 BM_Chemie_Baars.indb 23 09.06.2015 10:32:29 1 Ordnung in der Vielfalt der Stoffe • Reaktionsenthalpie (Reaktionswärme): Energieumsatz bei einer chemischen ReaktionZeichen: ∆H Einheit: J (Joule) oder kJ (Kilojoule) • Bei einer exothermen Reaktion wird Energie frei, die Produkte sind energieärmer als die Edukte; ∆H < 0. • Bei einem endothermen Vorgang muss kontinuierlich Energie zugeführt werden. Sie wird von den reagierenden Stoffen aufgenommen. Die Produkte sind energiereicher als die Edukte; ∆H > 0. • Die Aktivierungsenergie ist die minimal benötigte Energie, damit eine Reaktion überhaupt in Gang kommen kann. Die Gleichungen für die Reaktionen mit Silbersulfid lassen sich jetzt mit der Energiebilanz ergänzen: Silber(s) + Silber(s) Silbersulfid(s) Silbersulfid(s) ∆H < 0 exotherm Schwefel(s) + Schwefel(s) ∆H > 0 endotherm Als eine Reaktionsgleichung geschrieben: Silber(s) + Schwefel(s) Silbersulfid(s) ∆H < 0 Katalysatoren Die Aktivierungsenergie hat oft zur Folge, dass auch bei erhöhter Temperatur Reaktionen nur sehr langsam oder überhaupt nicht ablaufen. Nun gibt es Stoffe, die zwar an einem chemischen Vorgang teilnehmen, aber am Schluss wieder unverändert vorhanden sind. Solche Stoffe wirken als Katalysatoren: Sie erniedrigen die Aktivierungsenergie, indem sie reaktionsfähigere Zwischenprodukte bilden, die sofort weiterreagieren und dabei das Produkt und den wieder einsatzfähigen Katalysator liefern (Abb. 1.16). Dadurch wird die Reaktionsgeschwindigkeit erhöht. Die in Lebewesen wirksamen Katalysatoren, die Enzyme, sorgen zum Beispiel dafür, dass im menschlichen Organismus Reaktionen bereits bei der relativ niedrigen Temperatur von 37 °C ablaufen können. Bekannt ist das Enzym Amylase, das, von den Speicheldrüsen abgesondert, im Mund seine Wirkung entfaltet. Beim langen Kauen wird die im Brot enthaltene Stärke in ihre Zuckerbausteine zerlegt, die einen süsslichen Geschmack hervorrufen. Auch bei der Herstellung vieler Stoffe in der Industrie kann auf geeignete Katalysatoren nicht verzichtet werden. Katalysatoren führen zu reaktionsfähigen Zwischenprodukten, zu deren Bildung eine geringere Aktivierungsenergie erforderlich ist als für die nicht-katalysierte Reaktion. 24 BM_Chemie_Baars.indb 24 09.06.2015 10:32:29 Stoffe bestehen aus kleinsten Teilchen: das allgemeine Teilchen­modell und die Aggregatzustände Beispiel Die für das Leben auf der Erde wichtigste chemische Reaktion, erkennbar an den drei oben aufgeführten Kriterien, ist die Fotosynthese und im Zusammenhang damit ihre Umkehrung, die Zellatmung. Aus Wasser, Kohlenstoffdioxid und Sonnenenergie können Pflanzen (= Produzenten) in einem endothermen Vorgang Sauerstoff und Glucose (Traubenzucker) bilden, die in Pflanzen- und Tierzellen zu Kohlenhydraten (Cellulose, Stärke, Glykogen usw.), Fetten (Lipide) und Eiweissen (Proteinen) weiterreagieren. Mit dem Luftsauerstoff, der durch die Atmung von Organismen aufgenommen wird, entstehen in den Zellen exotherm aus diesen Naturstoffen (symbolisch mit Glucose wiedergegeben) erneut die Ausgangsstoffe der Fotosynthese: Wasser(l)+ Kohlenstoffdioxid(g) Fotosynthese Zellatmung Sauerstoff(g)+ Glucose(s) ∆H > 0 1.3 Stoffe bestehen aus kleinsten Teilchen: das allgemeine Teilchen­ modell und die Aggregatzustände Gibt man einige Tropfen Brom in einen Glaszylinder, so füllt sich dieser nach kurzer Zeit vollständig mit braunem Bromgas; die Flüssigkeit ist verdunstet, d. h. in den gasförmigen Zustand übergegangen.5 Da sowohl das flüssige wie auch das gasförmige Brom eine braune Farbe besitzt, lässt sich dieser Vorgang sehr gut beobachten. Abb. 1.17 Flüssiges Brom geht spontan in den gasförmigen Zustand über, es verdunstet 5 Verdunsten bezieht sich auf den Übergang flüssig – gasförmig unterhalb der Siedetemperatur der Flüssigkeit. 25 BM_Chemie_Baars.indb 25 09.06.2015 10:32:34 1 Ordnung in der Vielfalt der Stoffe Wie lässt sich diese Beobachtung verstehen? Man stellt sich vor, dass alle Stoffe aus kleinsten Teilchen bestehen (allgemeines Teilchenmodell6). Da die BromTeilchen den flüssigen Verband spontan verlassen (Brom verdunstet) und sich gleichmässig in dem zur Verfügung stehenden Raum ausbreiten können, müssen sie eine Eigenbewegung besitzen. Neben dem Prinzip vom Energieminimum (Abschnitt 1.2) herrscht in der Natur auch das Prinzip der grösseren Wahrscheinlichkeit. Der gasförmige Zustand ist bei Raumtemperatur wahrscheinlicher als der flüssige, deshalb verdunstet eine Flüssigkeit spontan aus einem offenen Gefäss. Brom(l) Brom(g) Diese Schreibweise stellt den Übergang vom flüssigen zum gasförmigen Aggregatzustand dar. Für jedes chemische und physikalische System gelten sowohl das Energieminimum wie auch das Wahrscheinlichkeitsmaximum. Da das Volumen des Glaszylinders deutlich grösser ist als das der Flüssigkeit, haben die Abstände zwischen den Brom-Teilchen beim Übergang flüssig – gasförmig zugenommen. Steckt man die Spitze eines Thermometers in einen mit Ether getränkten Wattebausch, so stellt man ein rasches Absinken der Temperatur fest und nimmt den Geruch der Flüssigkeit wahr. Ether geht, wie das Brom, spontan in den gasförmigen Zustand über. Es zeigt sich also auch an diesem Experiment, dass die EtherTeilchen eine Eigenbewegung besitzen. Um aber gasförmig zu werden, d. h. den Abstand zwischen den Teilchen zu vergrössern, ist Energie (Wärme) nötig, die in diesem Fall der Umgebung und damit auch dem Wattebausch sowie dem Thermometer entzogen wird. Eine entsprechende Erscheinung ist beim Wasser zu beobachten. Ein offenes Glas Wasser ist nach einer gewissen Zeit leer, die Flüssigkeit ist verdunstet. Beim Schwitzen scheidet der Körper an der Hautoberfläche Wassertropfen ab, die ebenfalls verdunsten und die dabei benötigte Energie (Wärme) von der Umgebung (Haut) aufnehmen, wodurch sich der Körper abkühlt. ∆H > 0 endothermer Vorgang Ether(l) Ether(g) Wasser(l) Wasser(g) ∆H > 0 endothermer Vorgang Da ein Energieaufwand (Wärme) nötig ist, um den Abstand zwischen den kleinsten Teilchen eines Stoffes zu vergrössern, müssen zwischen ihnen anziehende Kräfte wirken. Gibt man in eine Uhrschale etwas Iod und legt darüber eine zweite Schale mit einer dünnen Kartoffelscheibe, so färbt sich diese schon nach kurzer Zeit blauviolett 6 Ein Modell gibt nur einzelne Aspekte der Natur wieder und dient dem Verständnis bestimmter, beobachtbarer Phänomene. 26 BM_Chemie_Baars.indb 26 09.06.2015 10:32:34 Stoffe bestehen aus kleinsten Teilchen: das allgemeine Teilchen­modell und die Aggregatzustände Tabelle 1.2 Stoffe, ihre Aggregatzustände und Merkmale Aggregatzustand Teilchenabstand Teilchenbewegung anziehende Kräfte Form und Volumen fest (s) sehr klein sehr gering stark fest flüssig: tm konstant, bis beide konstant der Körper vollständig geschmolzen ist flüssig (l) klein gering schwach Volumen konstant, Form variabel gasförmig (g) gross gross sehr schwach beide variabel Aggregatzustands­änderung flüssig gasförmig: tb konstant, bis die gesamte Flüssigkeit gasförmig geworden ist (Abb. 1.18). Das feste Iod ändert bei Raumtemperatur spontan den Aggregatzustand, es wird gasförmig, ohne dazwischen flüssig geworden zu sein. Iod sublimiert, wie der Fachausdruck dazu heisst. Einige der Iod-Teilchen gelangen zur Kartoffelscheibe und bilden mit der darin enthaltenen Stärke die blauviolette Farbe (Nachweis von Iod bzw. von Stärke). Die kleinsten Iod-Teilchen besitzen also, wie die Teilchen einer Flüssigkeit oder eines Gases, eine Eigenbewegung, um den festen Verband verlassen zu können. Genaue Messungen würden zeigen, dass sich dabei das feste Iod abkühlt. Es ist also Energie (Wärme) nötig, um die herrschenden anziehenden Kräfte zwischen den Iod-Teilchen zu überwinden. Eine ähnliche Erscheinung ist im Winter zu beobachten: Eisreste auf den Strassen verschwinden allmählich, ohne dass das Eis flüssig wird. Auch hier findet eine Sublimation, ein direkter Übergang fest – gasförmig, statt. Abb. 1.18 Nachweis von Stärke einer Kartoffelscheibe mit Iod (links); festes Iod sublimiert und wird durch die blauviolette Farbe nachgewiesen (rechts) Allgemeines Teilchenmodell: • Alle Stoffe bestehen aus kleinsten Teilchen. • Die kleinsten Teilchen haben in allen Aggregatzuständen eine Eigenbewegung. • Zwischen den kleinsten Teilchen herrschen anziehende Kräfte. • Die Abstände zwischen den kleinsten Teilchen nehmen in Richtung fest flüssig gasförmig zu (Ausnahme: Wasser). • Für den Übergang fest flüssig gasförmig sowie fest gasförmig ist Zufuhr von Energie (Wärme) nötig (Überwindung der anziehenden Kräfte; endotherme Vorgänge). • Beim Übergang gasförmig flüssig fest sowie gasförmig fest wird Wärme frei (exotherme Vorgänge). 27 BM_Chemie_Baars.indb 27 09.06.2015 10:32:37 1 Ordnung in der Vielfalt der Stoffe Gas (Dampf ) Verdampfen, Verdunsten endotherm Sublimieren endotherm Kondensieren exotherm Resublimieren exotherm Flüssigkeit Feststoff Erstarren exotherm Schmelzen endotherm Abb. 1.19 Modellvorstellung zu den Aggregatzuständen Mit dem Teilchenmodell lässt sich verstehen, dass zwischen den kleinsten Teilchen eines Stoffs anziehende Kräfte herrschen. Über die Art dieser Kräfte kann damit jedoch keine Aussage gemacht werden. Dazu sind genauere Modelle der kleinsten Teilchen nötig, die in den folgenden Kapiteln vorgestellt werden. 1.4 Gemische sind aus mindestens zwei Reinstoffen aufgebaut Wird in einer Pfanne mehrmals Hahnenwasser abgekocht, so setzt sich am Boden und an der Seitenwand des Gefässes allmählich ein weisser Belag ab. Dieser lässt sich mit Putzessig entfernen, wobei eine schwache Gasentwicklung zu beobachten ist. Das im Haushalt verwendete Wasser enthält den im nahen Gebirge vom Regen gelösten Kalk. Je nach Zusammensetzung der Gesteine ist das Wasser mehr oder weniger hart.7 Wasser mit gelöstem Kalk ist ein Gemisch oder, genauer ausgedrückt, ein homogenes Gemisch, eine Lösung. Homogen deswegen, weil der gelöste Kalk mit blossem Auge oder einem Lichtmikroskop nicht zu erkennen ist. Damit lässt sich schon eine erste, grobe Einteilung der Stoffe vornehmen: Man unterscheidet Gemische von den Reinstoffen. 7 Hartes Wasser enthält im Gegensatz zu weichem Wasser sehr viel gelösten Kalk. 28 BM_Chemie_Baars.indb 28 09.06.2015 10:32:37 Gemische sind aus mindestens zwei Reinstoffen aufgebaut Tabelle 1.3 Beispiele von Gemischen Aggregatzustände der Bezeichbeteiligten Stoffe nung Beispiele heterogen fest-fest Gemenge Granit, Rohsalz, Erde, Nagelfluh fest-flüssig Suspension Lehmwasser fest-gasförmig Rauch Tabakrauch, Staubluft, Rauch eines Feuers flüssig-flüssig Emulsion Milch (Fetttröpfchen in Wasser) flüssig-gasförmig Schaum Seifenschaum (Gasblasen in einer Flüssigkeit) Nebel Wolken (Flüssigkeitstropfen in einem Gas) fest-fest Legierung (Lösung) Bronze (Kupfer/Zinn), Messing (Kupfer/Zink), Stahl (Eisen/Kohlenstoff) flüssig-flüssig Lösung Wein, Benzin flüssig-fest Lösung Salzwasser, Zuckerwasser flüssig-gasförmig Lösung Mineralwasser gasförmig-gasförmig Gasgemisch Luft, Erdgas homogen Abb. 1.20 Oben: Granit ist ein heterogenes Gemisch, ein Gemenge, aus den Mineralien Feldspat, Quarz und Glimmer und besteht somit aus drei Phasen. Unten: Die Bestandteile von Granit (von links): Feldspat, Quarz sowie dunkler und heller Glimmer Abb. 1.21 Schaum (links) und Rauch (rechts) 29 BM_Chemie_Baars.indb 29 09.06.2015 10:32:41 1 Ordnung in der Vielfalt der Stoffe Gemische bestehen aus mindestens zwei Stoffen und haben aufgrund ihrer variablen Zusammensetzung keine klar definierten Eigenschaften wie Schmelz- oder Siedetemperaturen. Lassen sich die Bestandteile eines Gemischs als verschiedene Phasen mit dem Auge oder dem Lichtmikroskop unterscheiden (z. B. Salatsauce), so handelt es sich um heterogene Gemische (gr. heteros = verschieden, anders). Sind sie hingegen homogen, dann kann nur eine Phase (z. B. Luft, Salzwasser) beobachtet werden (gr. homos = gleich). Reinstoffe hingegen haben eindeutige Eigenschaften. Unsere Umwelt besteht fast ausschliesslich aus Gemischen, wobei diese homogen oder heterogen sein können. • Reinstoffe bestehen aus einer Stoffart und haben eindeutige (spezifische) Eigenschaften. • Gemische enthalten mindestens zwei verschiedene Stoffarten (Reinstoffe), deren Mischungsverhältnis in gewissen Grenzen variabel ist. Die Eigenschaften sind deshalb von der Zusammensetzung abhängig. • Die verschiedenen Bestandteile (Phasen) eines heterogenen Gemischs, z. B. Granit (Abb. 1.20), lassen sich an ihren unterschiedlichen spezifischen Eigenschaften wie Glanz, Farbe, Härte, elektrische und Wärmeleitfähigkeit usw. erkennen. • Bei homogenen Gemischen, wie z. B. Salzwasser, kann man die einzelnen darin enthaltenen Reinstoffe weder von blossem Auge noch mit einem Lichtmikroskop unterscheiden. Solche Gemische verhalten sich rein optisch wie Reinstoffe. • Phase: Homogener, in allen Bereichen optisch gleichartig erscheinender Bereich eines Stoffs. 1.5 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden Oft ist es wichtig, Reinstoffe zur Verfügung zu haben. In der Pharmaindustrie z. B. sind viele aufwendige Verfahren nötig, um reine Produkte zu erhalten. Auch bei der Gewinnung von Benzin, Diesel, Heizöl, Schmierölen usw., die im Erdöl enthalten sind, werden die zahlreichen Komponenten voneinander getrennt. Die beiden Beispiele zeigen die grosse Bedeutung der Trennmethoden, die in vielen Bereichen der Industrie und der Forschung zur Anwendung gelangen. Da die einzelnen Komponenten in Gemischen unterschiedliche spezifische Eigenschaften aufweisen, lassen sich diese zur Auftrennung in die verschiedenen Bestandteile nutzbar machen. Filtration Zur Trennung einer Suspension in ihre Bestandteile nützt man die unterschiedliche Grösse der Partikel gegenüber den Teilchen der flüssigen Phase des Gemischs aus, der entsprechende Vorgang heisst Filtration. Im Laboratorium werden dafür meistens Filter aus ungeleimtem Papier, das Poren einer Grösse von 2 bis 5 µm (1 µm = 10–6 m) besitzt, aber auch Watte, Glaswolle oder feinporiges Sinterglas 30 BM_Chemie_Baars.indb 30 09.06.2015 10:32:41 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden Rückstand Suspension Rückstand zur Vakuumpumpe Waschflasche Filtrat Filtrat Abb. 1.22 Filtration einer Suspension mit einem Faltenfilter Abb. 1.23 Vakuum­filtration Filtertuch Filterrahmen Rückstand zu filternde Flüssigkeit Filtrat Abb. 1.24 In der Industrie verwendet man zur Filtration oft Filterpressen, in denen die zu filternde Suspension durch Tücher gepresst wird (rechts schematisch) (Fritten) verwendet. Für technische Zwecke kommen auch Filterpressen mit Tuch- oder Sandfiltern in Frage, Letzteres z. B. bei der Filtration von Seewasser zur Bereitstellung von Trinkwasser. Durch Vakuumfiltration erhöht man den Druckunterschied und steigert damit die Filtrationsgeschwindigkeit. Adsorption Bei der Adsorption (lat. adsorbere = anziehen, anlagern) werden Gase oder in Flüssigkeiten gelöste Stoffe an der Oberfläche eines Festkörpers festgehalten (adsorbiert). Dieses Verfahren verwendet man z. B. bei der Trinkwasserreinigung mit Aktivkohle oder in Gasmasken, um sich vor giftigen Gasen zu schützen. Extraktion Die Extraktion (lat. extrahere = herausziehen) nützt die unterschiedliche Löslichkeit von Stoffen aus. Dabei werden bestimmte Bestandteile aus flüssigen oder festen Substanzgemischen mithilfe geeigneter Lösemittel (Extraktionsmittel) entfernt. Beispiele dafür sind die Teezubereitung, das Entfernen von Koffein aus Kaffeebohnen, die Gewinnung von Zucker aus Zuckerrüben oder von Kochsalz aus Gesteinsschichten. 31 BM_Chemie_Baars.indb 31 09.06.2015 10:32:42 1 Ordnung in der Vielfalt der Stoffe Pillen Abb. 1.25 Extraktion eines roten Farbstoffs aus Pillen Destillation Die Destillation dient zur Trennung bzw. Reinigung von Lösungen (flüssig-flüssig bzw. flüssig-fest) oder leicht schmelzbaren, festen Stoffgemischen. Bei dieser Trennungsmethode müssen die einzelnen Komponenten unterschiedliche Siedetemperaturen aufweisen. Einer der Bestandteile sollte hinreichend flüchtig sein, d. h. eine niedrige Siedetemperatur besitzen, und sie dürfen sich bei erhöhter Temperatur nicht zersetzen. Um dies zu verhindern, führt man die Destillation oft unter vermindertem Druck aus, wodurch die Siedetemperatur um bis zu 70 °C herabgesetzt werden kann. Wasser siedet zum Beispiel im Vakuum bereits bei Raumtemperatur. Beim Erhitzen einer Salzlösung geht das Wasser in den gasförmigen Zustand über und der Feststoff (Kochsalz) bleibt zurück. Im Kühler wird das Gas wieder flüssig und kann als Destillat zurückgewonnen werden (Abb. 1.26). Die Destillation eignet sich sehr gut zur Trennung von zwei Flüssigkeiten, wenn ihre Siedetemperaturen einen grossen Unterschied aufweisen. Ist dieser jedoch gering, enthält der Dampf bei der Siedetemperatur des Gemischs beide Kompo- Abb. 1.26 Destillations­ apparatur Thermometer Liebigkühler kondensierende Flüssigkeit Vorstoss Thermometer Abfluss Liebigkühler kondensierende Flüssigkeit Fraktionierkolonne Vorstoss Kühlwasserzufluss Destillat Abfluss Lösung Kühlwasserzufluss Destillat Lösung 32 BM_Chemie_Baars.indb 32 09.06.2015 10:32:43 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden Benzindämpfe Kondensator Chem. Grundstoffe Fraktionierturm Leichtöle Benzin Petroleum Petrolether Treibstoff Testbenzin Raffin. Petroleum Mittelöle Absorptionsöl Gasöl Benzin- + Benzolrückgewinnung Reinigungs- + Färbemittel, Seifen Dieselkraftstoffe - Heizöle Heizöle Schweröle Schmieröle Bodenprodukte Heizöle Gasöl Gase Röhrenofen Rohöldämpfe Dampf Rohöl Wasserstoff Glasbläserei, Schweisstechnik Alkohole, Ester, Wachse, Harze Farben, Lacke, Lösemittel Heiz- + Leuchtgas Gummi Petrolkoks Techn. + med. Weissöle Emulgierende Öle Paraffinwachs, Fettsäuren Vaseline Schmiermittel Bitumen (Asphalte) Frostschutzmittel Flug- + Autokraftstoffe Sprengstoffe, Lampenöle Pestizide, Motoren- +Getriebeöle Feine Öle, Kaugummi Kerzen, Wachse, Pflanzenschutzmittel Salben Imprägnier- + Isoliermittel, Feuerungskoks, Rostschutzmittel, Dachpappe, Strassenbau Abb. 1.27 Fraktionierte Destillation von Erdöl. Der Turm ist durch Zwischenböden abgeteilt, auf denen sich Destillat ansammelt. Jeder Boden hat durch Glocken überdeckte Durchlässe. Die aufsteigenden Dämpfe erhitzen die Flüssigkeit auf den Böden, sodass auf jeder Stufe eine Destillation stattfindet. Die höher siedenden Anteile des Erdöls werden von den unteren, die niedrig siedenden von den höheren Böden abgezogen. Oben entweicht nicht kondensiertes Gas Boden 2 Boden 1 Heizschlangen Abb. 1.28 Detaildarstellung von Glockenböden nenten, da von derjenigen mit der höheren Siedetemperatur auch ein Teil in den gasförmigen Zustand übergeht. Obwohl das Destillat stark mit der flüchtigeren Substanz (derjenigen mit der tieferen Siedetemperatur) angereichert ist, lässt sich auf diese Weise keine vollständige Trennung erreichen. Andere Verfahren sind deshalb nötig. Eines der wichtigsten ist in diesem Zusammenhang die fraktionierte Destillation von Erdöl in die verschiedenen Komponenten wie Autobenzin, Kerosin (Treibstoff für Düsenflugzeuge), Heizöle oder Paraffin zur Kerzenherstellung (Abb. 1.27 und 1.28). 33 BM_Chemie_Baars.indb 33 09.06.2015 10:32:43 Startlinie Startlinie Startlinie 1 Ordnung in der Vielfalt der Stoffe Startlinie Trägermit mit Pufferlösung Träger Träger mitPufferlösung Pufferlösung eilchen positiv geladen; bewegen sich zum negativen Pol T Teilchen elektrisch neutral; werden von keinem Pol angezogen Teilchen negativ geladen; bewegen sich zum positiven Pol Träger mit Pufferlösung Abb. 1.29 Wirkungs­weise der Elektropho­rese (schematisch) Elektrophorese Elektrisch geladene Teilchen (Abschnitt 2.5) werden vom Plus- oder Minuspol einer Stromquelle gemäss Abb. 1.29 angezogen. Je kleiner die Teilchen und je höher ihre Ladung, desto schneller wandern sie auf den entsprechenden Pol zu. Dadurch lässt sich eine gute Trennung erreichen. Heute benutzt man bei dieser Methode als Trägermaterial oft gelartige ­Stoffe8 (Gelelektrophorese), die wie ein Sieb wirken, das die grösseren Teilchen stärker zurückhält als die kleineren. Besonders gut lassen sich auf diese Weise Gemische von DNA-Bruchstücken, kleinen Proteinen (Eiweissen) oder Aminosäuren (Abschnitt 16.3) auftrennen. In der Medizin, der Biologie, der Umweltchemie sowie bei der Reinheitsprüfung von Medikamenten ist die Elektrophorese eine oft eingesetzte Trenn- resp. Analysemethode. Chromatografische Verfahren Diese Trennverfahren beruhen auf der unterschiedlichen Verteilung der Bestandteile eines Gemischs auf eine bewegliche und eine stationäre Phase. Als bewegliche Phase dient ein Lösemittel wie Wasser, ein Gemisch aus verschiedenen Flüssigkeiten oder ein Gas, und als stationäre Phase Papier, Aluminiumoxid, Siliciumdioxid usw. Grundlage des Verfahrens sind die unterschiedlichen Löslichkeiten der einzelnen Gemischbestandteile in der beweglichen und ihre verschieden starke Adsorption an der stationären Phase. Dünnschichtchromatografie Papier, Aluminiumoxid bzw. Siliciumdioxid auf Glas, Kunststoff oder Aluminiumblech bilden bei der Dünnschichtchromatografie die stationäre Phase. Ihre Kapillarwirkung9 ermöglicht, dass eine Lösung des Stoffgemischs wandert. Je besser nun die Löslichkeit der Gemischbestandteile im Lösemittel, je kleiner die Teilchen und je geringer die Adsorption, d. h., je weniger stark ein Stoff von der stationären Phase gebunden wird, desto weiter wandert er. Auf diese Weise lassen sich kleinste Stoffmengen in ihre Bestandteile auftrennen. Abb. 1.30 Beispiel eines Gels nach der Stofftrennung; ganz unten: bekannte Vergleichssubstanzen, darüber: gespaltene DNA einiger Petunien-Arten. Die verschiedenen Fragmente wandern unterschiedlich weit von links nach rechts 8 Gel (von Gelatine: lat. gelatum = Gefrorenes): Ein formbeständiges, aber leicht deformierbares System, das aus mindestens zwei Komponenten besteht: eine Flüssigkeit, in der ein fester Stoff so verteilt ist, dass das ganze System fest ist. 9 Kapillarwirkung: Erscheinung, dass Flüssigkeiten in engen Hohlräumen fester Körper nach oben steigen. 34 BM_Chemie_Baars.indb 34 09.06.2015 10:32:44 Gemische lassen sich in ihre Reinstoffe zerlegen: Trennmethoden Chromatografiepapier Fliessmittelfront Getrenntes Stoffgemisch Stoffgemisch Startlinie Fliessmittel Abb. 1.31 Dünnschicht­ chromatografie Gaschromatografie Bei der Gaschromatografie muss das Substanzgemisch verdampft werden. Zusammen mit einem reaktionsträgen (inerten) Trägergas (Helium oder Stickstoff) bildet es die bewegliche Phase, die man mittels einer Pumpe oder Druckflasche durch ein langes, dünnes Rohr (Trennsäule) leitet. Als stationäre Phase dienen ein Festkörpergranulat oder eine nicht flüchtige Flüssigkeit, mit welcher das Granulat getränkt ist. Die einzelnen Komponenten des Gemischs werden je nach ihren Eigenschaften verschieden stark von der stationären Phase festgehalten (adsorbiert). Am Ende des Rohrs können sie somit nach längerer oder kürzerer Strömungszeit des Trägergases in einem Detektor nachgewiesen werden. Diese Methode eignet sich zur Untersuchung gasförmiger oder vollständig verdampfbarer Stoffe. A+B Trägergas Detektor t0 A Trägergas Detektor t1 B A Trägergas Detektor t2 B A Trägergas Detektor t3 B Abb. 1.32 Trennprinzip bei der Gaschromatografie. Zur Zeit t0 sind die Stoffe A und B noch gemischt. Da B von der stationären Phase weniger stark absorbiert wird als A, wird es vom Trägergas schneller weitertransportiert. Zur Zeit t3 ist B von A praktisch getrennt und erreicht den Detektor früher als A 35 BM_Chemie_Baars.indb 35 09.06.2015 10:32:44 1 Ordnung in der Vielfalt der Stoffe 1.6 Reinstoffe sind entweder Verbindungen oder Elemente Bei Normdruck10 (1013 hPa) sind Schmelz- und Siedetemperatur von Wasser immer gleich: tm = 0 °C und tb = 100 °C; somit ist Wasser ein Reinstoff (vgl. Abschnitt 1.5). Mithilfe von elektrischem Strom lässt sich Wasser in zwei neue Stoffe zerlegen. Das dabei am negativen Pol (Kathode) der Stromquelle entstehende Gas, Wasserstoff, verbrennt nach dem Zumischen von Luft, Sauerstoff, mit «heulendem» Ton (Knallgasprobe). Am positiven Pol (Anode) bildet sich Sauerstoff, der einen glimmenden Span entzündet (Glimmspanprobe; Abb. 1.33). Das Volumenverhältnis Wasserstoff zu Sauerstoff beträgt bei einem derartigen Versuch immer 2 : 1. Wasser(l) Wasserstoff(g) + Sauerstoff(g) ∆H > 0 (elektrischer Strom; Elektrolyse) 2V 1V V: Volumen Wasser lässt sich also mithilfe des elektrischen Stroms (Elektrolyse; gr. elektro = Strom, gr. lysis = Auflösung) in Wasserstoff und Sauerstoff im Volumenverhältnis 2 : 1 zerlegen. Reinstoffe, die sich wie Wasser in weitere Stoffe auftrennen lassen, heissen Verbindungen, Reinstoffe wie Wasserstoff und Sauerstoff, die nicht weiter zerlegbar sind, Elemente. Da bei der Elektrolyse von Wasser das Volumenverhältnis der beiden dabei entstehenden Gase immer 2 : 1 ist, muss man annehmen, dass die kleinsten Wasser-Teilchen eine ganz bestimmte Zusammensetzung aufweisen. • Verbindungen sind Reinstoffe mit konstanter Zusammensetzung, die sich in Elemente auftrennen lassen. Einen derartigen Vorgang nennt man Analyse.11 • Elemente können durch chemische Reaktionen nicht weiter zerlegt werden. • Elektrolyse: Zersetzung einer Verbindung in die Elemente mithilfe von elektrischem Strom. Bei einer Elektrolyse heisst der positive Pol der Versuchsapparatur Anode, der negative Pol Kathode. Anode und Kathode fasst man unter der Bezeichnung Elektroden zusammen.12 Was geschieht nun eigentlich bei der Knallgasprobe? Man kann Wasserstoff durch vorsichtiges Ausströmen aus einem Vorratsgefäss kontrolliert verbrennen, d. h. mit dem Sauerstoff der Luft reagieren lassen. Wird die Flamme13 dabei in einen grossen Erlenmeyerkolben gehalten (Abb. 1.34), so beschlägt die kalte Innenseite des Gefässes mit kleinen Wassertröpfchen. Die Reaktion von Wasserstoff mit 10 Normbedingungen (Normzustand): tn = 0 °C; pn = 101 325 Pa = 1013 hPa 11 Der Begriff Analyse wird heute auch dann verwendet, wenn die Zusammensetzung eines Gemischs untersucht wird. 12 Die Namen der Elektroden, Kathode und Anode, richten sich nicht nach ihrer Ladung, wie man vermuten könnte. Wie noch gezeigt wird, sind die Ladungsverhältnisse bei Batterien und Akkumulatoren gerade umgekehrt: Die Anode ist dann der negative und die Kathode der positive Pol. 13 Flammen sind nichts anderes als glühende Gase (Gase, die Licht aussenden). 36 BM_Chemie_Baars.indb 36 09.06.2015 10:32:44 Reinstoffe sind entweder Verbindungen oder Elemente a) b) 10V c) Abb. 1.33 a) Knallgasprobe b) Zerlegung von Wasser im Hofmann-Apparat (Elektrolyse) c) Glimmspanprobe: Sauerstoff entflammt einen glimmenden Span Abb. 1.34 Wasserstoffflamme in einem Erlenmeyer­kolben S­ auerstoff liefert also gasförmiges Wasser, das sich beim Abkühlen an der Innenwand des Erlenmeyerkolbens verflüssigt. Bei der Knallgasprobe läuft die Reaktion so schnell ab, dass es zu einer kleinen Explosion kommt. Die Zerlegung von Wasser in die beiden Elemente Wasserstoff und Sauerstoff lässt sich also wieder umkehren. Die Bildung einer Verbindung aus den Elementen nennt man Synthese (gr. syn = zusammen, gr. thesis = setzen, legen). Reaktionsgleichung: Wasserstoff(g) + Sauerstoff(g) Synthese Analyse Wasser(l) ∆H < 0 Synthese: Bildung einer Verbindung aus den Elementen.14 Mit der Unterscheidung der Reinstoffe in Elemente und Verbindungen ist die Einteilung der Stoffe abgeschlossen (Abb. 1.35). 14 Der Begriff Synthese wird ebenfalls ganz allgemein gebraucht und gilt für jede Herstellung einer neuen Verbindung, unabhängig davon, ob die Ausgangsstoffe Elemente oder andere Verbindungen sind. 37 BM_Chemie_Baars.indb 37 09.06.2015 10:32:46 1 Ordnung in der Vielfalt der Stoffe Stoffe Gemische homogen heterogen Lösung Legierung Gasgemisch Abb. 1.35 Einteilung der Stoffe Reinstoffe Verbindungen Elemente Gemenge Wasser Kupfer Emulsion Kohlenstoffdioxid Eisen Suspension Methan Sauerstoff Rauch Glucose Wasserstoff Nebel Zentrale Begriffe Kapitel 1 ›› Celsius-Temperatur ›› Schmelztemperatur ›› Siedetemperatur ›› Aggregatzustände ›› Reaktionsgleichung ›› Ausgangsstoffe, Edukte ›› Endstoffe, Produkte ›› Reaktionsenthalpie, Reaktionswärme ›› exotherme Reaktion ›› endotherme Reaktion ›› Aktivierungsenergie ›› Gemische ›› Reinstoffe ›› Phasen ›› Gemenge ›› Suspension ›› Schaum ›› Nebel ›› Lösung ›› Bronze ›› Messing ›› Elektrolyse ›› Emulsion ›› Legierung ›› Filtration ›› Destillation ›› Elektrophorese ›› Analyse ›› Synthese ›› Verbindung ›› Elemente 38 BM_Chemie_Baars.indb 38 09.06.2015 10:32:47 Aufgaben zum Kapitel 1 Aufgaben zum Kapitel 1 1.1 Ergänzen Sie die Tabelle 1 durch Kreuze in 1.5 Über die kleinsten Teilchen von Stoffen den zutreffenden Spalten. lassen sich folgende Aussagen machen: a) Die kleinsten Teilchen üben untereinander anziehende Kräfte aus. b) Die kleinsten Teilchen besitzen in allen Aggregatzuständen eines Stoffs eine Eigenbewegung. c) Die Abstände zwischen den Teilchen nehmen normalerweise in Richtung fest – flüssig – gasförmig zu. Mit welchen Experimenten lassen sich die Aussagen a), b) und c) überprüfen? 1.2 Nennen Sie zwei Beispiele für Stoffe, die direkt vom festen in den gasförmigen Zustand übergehen. 1.3 Gegeben sind die Schmelz- und Siede­ temperaturen folgender Stoffe: Stoff tm in °C tb in °C Butan –138.5 – 0.5 Octadecan Hexan 28 317 –95.4 69 1.6 Stoffe bestehen aus kleinsten Teilchen und besitzen bestimmte Eigenschaften. Erklären Sie folgende Aussagen, indem Sie von dieser Teilchenvorstellung ausgehen: a) Eine Flüssigkeit passt sich jeder Gefässform an, ein fester Stoff hingegen nicht. b) Wasser verdunstet, wenn man es in einem offenen Gefäss stehen lässt. Welche Aggregatzustände besitzen diese Stoffe bei Raumtemperatur (22 °C)? Bei welchem Stoff sind die Kräfte zwischen den kleinsten Teilchen am grössten? 1.4 Zur Änderung des Aggregatzustands eines Stoffs muss man in Richtung fest – flüssig – gasförmig Energie aufwenden. Was bedeutet dies für die kleinsten Teilchen des betrachteten Stoffs? 1.7 Ein gasförmiger Stoff kann ohne viel Kraft- aufwand zusammengedrückt werden, ein fester Stoff hingegen nicht. Wie lässt sich diese Erscheinung erklären? Tabelle 1 zu Aufgabe 1.1 Chemische Reaktion Vorgang endotherm ja exotherm nein Rosten von Eisen (∆H < 0) Kondensation von Wasserdampf Verbrennen von Benzin Erstarren von Wasser zu Eis Sublimation von Iod Reaktion von Wasserstoff- und Sauerstoffgas zu Wasser Verdampfen von Wasser 39 BM_Chemie_Baars.indb 39 09.06.2015 10:32:47 1 Aufgaben zum Kapitel 1 1.8 Bildet sich im Herbst nachts Nebel, so fällt die Lufttemperatur meistens nicht unter 0 °C. Worauf ist dieses Phänomen zurückzuführen? 1.9 Destilliert man Petroleum und misst dabei die Siedetemperatur, so beobachtet man, dass sie während des Destillierens langsam, aber ständig ansteigt. Welcher Schluss lässt sich daraus ziehen? 1.10Gegeben sei ein homogener Stoff (Flüssig- keit), von dem man vermutet, dass es sich um ein Gemisch handelt. Wie lässt sich diese Vermutung experimentell bestätigen? 1.11Worin unterscheiden sich Reinstoffe von Gemischen? 1.13Definieren Sie: – Verbindung – Element – Gemisch – homogener Stoff 1.14Worin besteht der Unterschied zwischen dem Verdampfen von Wasser und der Zersetzung von Wasser in Wasserstoff und Sauerstoff? Begründen Sie auf Teilchen­ ebene. 1.15Von einer Flüssigkeit nimmt man an, dass es sich um einen reinen Stoff handelt. Wie lässt sich diese Vermutung experimentell beweisen? Falls es ein reiner Stoff ist, wie könnte man nachweisen, ob es sich um eine Verbindung oder ein Element handelt? 1.12Ein Gemisch von Eisenpulver, feinem Sand und Kochsalz soll in die einzelnen Bestandteile zerlegt werden. Wie gehen Sie vor und welche spezifischen Eigenschaften der einzelnen Stoffe benützen Sie zur Trennung? 40 BM_Chemie_Baars.indb 40 09.06.2015 10:32:47