Medizinische Parasitologie
Werbung
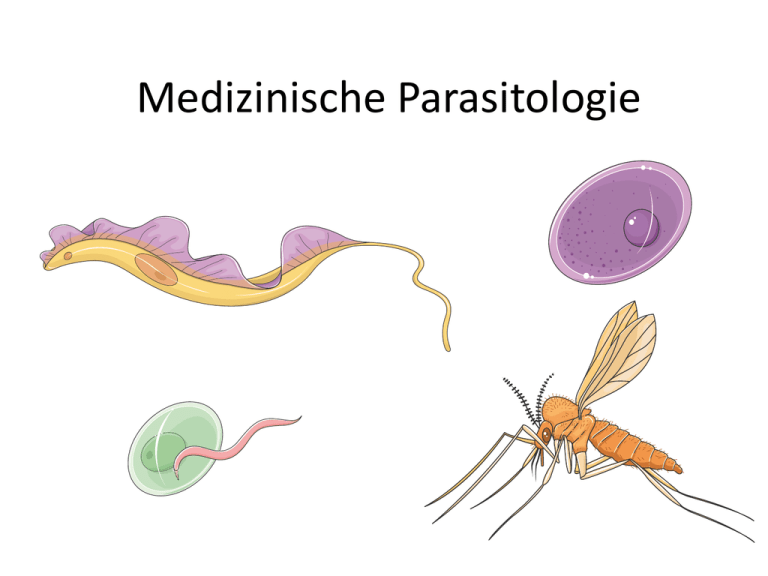
Medizinische Parasitologie Medizinische Parasitologie Was sind Parasiten? eukaryote, heterotrophe Organismen ohne Zellwand sehr unterschiedliche Organismen-Gruppen in drei großen Einheiten zu- sammengefasst werden: Protozoen Helminthen Arthropoden Medizinische Parasitologie Erreger von Infektionen oder Infestationen des Menschen: Prionen Proteine (vermutlich) ohne DNS oder RNS Viren DNS oder RNS + Proteine (+ Lipidhülle) Bakterien (inkl. Chlamydien, Rickettsien, Mycoplasmen) Prokaryote (zumeist mit Zellwand) Pilze Eukaryote mit Zellwand Protozoen Helminthen Arthropoden Eukaryote ohne Zellwand Grundbegriffe der Parasitologie Endwirt: In ihm wird der Parasit geschlechtsreif und produziert Nachkommen (Teilungsprodukte der Zygote, Eier, Larven). Wirte, in denen die sexuelle Phase der Reproduktion abläuft, werden Endwirte genannt. Fuchsbandwurm: Echinococcus multilocularis Grundbegriffe der Parasitologie Zwischenwirt: In ihm setzt der Parasit seine Entwicklung fort, ohne die Geschlechtsreife zu erreichen. Der Parasit ist zumeist in einem bestimmten Stadium, in einem bestimmten Organ arretiert und gelangt in den Endwirt, indem dieser den Zwischenwirt frisst.. Wirte, in denen eine asexuelle oder unisexuelle Fortpflanzung stattfindet, nennen wir Zwischenwirte. Fuchsbandwurm: Echinococcus multilocularis Grundbegriffe der Parasitologie Fehlwirt: Ein Wirt, in dem die normale Entwicklung des Parasiten aus physiologischen Gründen nicht möglich ist. Fuchsbandwurm: Echinococcus multilocularis Grundbegriffe der Parasitologie Haupt- und Nebenwirt Nach ihrer epidemiologischen Bedeutung unterscheiden wir Hauptwirte von Nebenwirten. Hauptwirte sind die für den Parasiten bedeutendsten, Nebenwirte dagegen die nebensächlichsten End- oder Zwischenwirte Sammel- (Warte)wirt Der Begriff paratenischer Wirt bezeichnet einen Wirt, der für die Entwicklung des Parasiten nicht essentiell ist; daher auch der Name Wartewirt. Die ökologische Bedeutung liegt in der Tatsache, dass Parasiten in paratenischen Wirten aggregieren; daher auch der Name Sammelwirt. Grundbegriffe der Parasitologie Überträger: — auch Vektoren genannt — sind Ektoparasiten, die einen Parasiten von einem Wirt auf den nächsten übertragen und in denen eine Vermehrung und/oder eine Entwicklung stattfindet. Malaria-Mücke: auch als Endwirt (!) mit Entwicklung und Vermehrung der Plasmodien. Grundbegriffe der Parasitologie Reservoir: bezeichnet die Gesamtheit aller infizierter Wirte, wobei vor allem langlebige, tolerante Wirtsarten und -populationen geeignet sind. Aus menschlicher Sicht sind Reservoirwirte Tiere, von denen Zoonosen übertragen werden können. Beispiel: Ostafrikanische Schlafkrankheit (Trypanosoma brucei): Von gesunden Reservoirwirten (Wildtieren) wird die Schlafkrankheit durch Tse-Tse-Fliegen auf den Menschen übertragen. http://www.dpd.cdc.gov/ Grundbegriffe der Parasitologie Wirt-Parasitbeziehungen: Endoparasiten: leben im Wirtsinneren. Sie besiedeln Hohlräume, Epithelien, das Blut wie auch Gewebe verschiedener Organe. Ihre Lokalisation ist: 1) extrazellulär (Giardia auf Darmepithel) Ektoparasiten: leben auf der Oberfläche des Wirtes. Sie ernähren sich von Hautsubstanzen oder nehmen Blut oder Gewebeflüssigkeit auf. Beispiele dafür sind blutsaugende Arthropoden wie etwa Stechmücken, Läuse oder Zecken. 2) intrazellulär (Malariaerreger in Leberzellen und in roten Blutkörperchen) Ei: Nisse adulte (ausgewachsene) Laus Grundbegriffe der Parasitologie Wirt-Parasitbeziehungen: Obligate Parasiten Fakultative Parasiten Freilebende Lebewesen, die gelegentlich auch in einem Wirt gefunden werden, nennt man fakultative oder Gelegenheitsparasiten. Beispiele dafür finden sich bei Bodennematoden, die gelegentlich im Darm oder Hämocoel eines Käfers gefunden werden. Ihre Entwicklung kann ohne parasitische Phase ablaufen. Ohne geeigneten Wirt ist eine Vermehrung oder Entwicklung nicht möglich. Giardia intestinalis Leishmania Plasmodium falciparum Trypanosoma Toxoplasma gondii Rhabditis pellio http://www.dpd.cdc.gov/ Entamoeba histolytica Grundbegriffe der Parasitologie Lebenszyklus (schematisch): Grundbegriffe der Parasitologie Monoxener und Heteroxener Lebenszyklus Parasiten mit direktem Lebenszyklus: monoxene Parasiten (= mit einem Wirt) Beispiel: Giardia lamblia (Erreger der Lamblienruhr) Parasiten mit indirektem Lebenszyklus und obligatem Wirtswechsel: heteroxene Parasiten (= mit mehreren Wirten) Beispiel: Plasmodium falciparum (Erreger der Malaria) http://www.dpd.cdc.gov/ Mechanismen der Wirtsschädigung Invasion/Adhärenz Parasit Exotoxine Endotoxine Zellzerstörung Befall von Epithelien/Zellen Makrophagen Antigene Sauerstoffradikale, NO Enzyme, Zytokine (TNFa) Immunabwehr (Innate, angeborene) Gewebeschäden durch Nekrose oder Entzündung eventuell Wirtstod Immunantwort (Zytotoxizität) Effektormechanizmen adaptives Immunsystem, T und B Zellen Elimination des Parasites Systematik Euglenozoa / Kinetoplastida Trypanosoma, Leishmania Ascomycota Pneumocystis carnii Giardia Trichomonas Giardia lamblia trofozoit Trichomonas vaginalis Entamoeba ciszta Alveolata / Apicomplexa Toxoplasma, Plasmodium, Cryptosporidium, Babesia, Isospora Apicomplexa Lokalisation Magen-Darm System Urogenitalsystem Gattung Infektionsart Erkrankungen Entamoeba histolytica Giardia lamblia Cryptosporidium sp. oral oral oral Amoebiasis Giardiasis Cryptosporidiosis Trichomonas vaginalis sex Trichomoniasis T. cruzi Wanze Chagas-Krankheit T. gambiense Tsetsefliege Schlafkrankheit T. rhodesiense Tsetsefliege Schlafkrankheit Trypanosoma sp. Leishmania sp. Blut und Gewebe Leishmaniasis L. donovani Sandfliege Kala-Azar-Krankheit (viszerale Leishmaniase) L. tropica Sandfliege kutane Leishmaniose L. braziliensis Sandfliege mukosal Leishmaniose Plasmodium sp. Malariamücke Malaria Toxoplasma gondii oral, Katzen Toxoplasmosis Malaria Allgemeine Infos Weltweit jährlich rund 300 bis 500 Millionen klinischer Malariafälle 90% davon im tropischen Afrika Todesfälle zwischen 1,5 Millionen und 2,7 Millionen jährlich Verbreitung der Malaria 270 Plasmodium arten (5 Menschen, 31 Affen, 29 Saugetiere, 67 Vögel, 76 Reptilien) Plasmodium accipiteris, Plasmodium achiotense, Plasmodium achromaticum, Plasmodium acuminatum, Plasmodium adunyinkai, Plasmodium aegyptensis, Plasmodium aeuminatum, Plasmodium agamae, Plasmodium alaudae, Plasmodium alloelongatum, Plasmodium anasum, Plasmodium anomaluri, Plasmodium arachniformis, Plasmodium ashfordi, Plasmodium atheruri, Plasmodium audaciosum, Plasmodium auffenbergi, Plasmodium aurulentum, Plasmodium australis, Plasmodium attenuatum, Plasmodium azurophilum, Plasmodium balli, Plasmodium bambusicolai, Plasmodium basilisci, Plasmodium beebei, Plasmodium beltrani, Plasmodium berghei, Plasmodium bertii, Plasmodium bigueti, Plasmodium bioccai, Plasmodium bitis, Plasmodium biziurae, Plasmodium booliati, Plasmodium bouillize, Plasmodium bowiei, Plasmodium brozdeni, Plasmodium brasilianum, Plasmodium brasiliense, Plasmodium brumpti, Plasmodium brucei, Plasmodium brygooi, Plasmodium bubalis, Plasmodium bucki, Plasmodium bufoni, Plasmodium buteonis, Plasmodium caloti, Plasmodium capistrani, Plasmodium carinii, Plasmodium cathemerium, Plasmodium causi, Plasmodium cephalophi, Plasmodium cercopitheci, Plasmodium chabaudi, Plasmodium chalcidi, Plasmodium chiricahuae, Plasmodium circularis, Plasmodium circumflexum, Plasmodium clelandi, Plasmodium cnemaspi, Plasmodium cnemidophori, Plasmodium coatneyi, Plasmodium coggeshalli, Plasmodium coluzzii, Plasmodium colombiense, Plasmodium columbae, Plasmodium cordyli, Plasmodium corradettii, Plasmodium coturnixi, Plasmodium coulangesi, Plasmodium cuculus, Plasmodium cyclopsi, Plasmodium cynomolgi, Plasmodium dherteae, Plasmodium diminutivum, Plasmodium diploglossi, Plasmodium dissanaikei, Plasmodium divergens, Plasmodium dominicana, Plasmodium dorsti, Plasmodium draconis, Plasmodium durae, Plasmodium effusum, Plasmodium egerniae, Plasmodium elongatum, Plasmodium eylesi, Plasmodium fabesia, Plasmodium fairchildi, Plasmodium falciparum, Plasmodium falconi, Plasmodium fallax, Plasmodium fieldi, Plasmodium fischeri, Plasmodium foleyi, Plasmodium formosanum, Plasmodium forresteri, Plasmodium floridense, Plasmodium fragile, Plasmodium gaboni, Plasmodium galbadoni, Plasmodium garnhami, Plasmodium gallinaceum, Plasmodium gemini, Plasmodium georgesi, Plasmodium ghadiriani, Plasmodium giganteum, Plasmodium giganteumaustralis, Plasmodium giovannolai, Plasmodium ginsburgi, Plasmodium girardi, Plasmodium gonderi, Plasmodium globularis, Plasmodium gologoense, Plasmodium gonatodi, Plasmodium gracilis, Plasmodium griffithsi, Plasmodium guangdong, Plasmodium gundersi, Plasmodium guyannense, Plasmodium heischi, Plasmodium hegneri, Plasmodium hermani, Plasmodium herodiadis, Plasmodium heteronucleare, Plasmodium hexamerium, Plasmodium holaspi, Plasmodium holti, Plasmodium huffi, Plasmodium hydrochaeri, Plasmodium hylobati, Plasmodium incertae, Plasmodium icipeensis, Plasmodium iguanae, Plasmodium inconstans, Plasmodium inopinatum, Plasmodium inui, Plasmodium japonicum, Plasmodium jeanriouxi, Plasmodium jefferi, Plasmodium jiangi, Plasmodium josephinae, Plasmodium joyeuxi, Plasmodium juxtanucleare, Plasmodium kempi, Plasmodium kentropyxi, Plasmodium knowlesi, Plasmodium koreafense, Plasmodium lacertiliae, Plasmodium lagopi, Plasmodium lainsoni, Plasmodium landauae, Plasmodium leanucteus, Plasmodium lemuris, Plasmodium lepidoptiformis, Plasmodium limnotragi, Plasmodium lionatum, Plasmodium lophurae, Plasmodium loveridgei, Plasmodium lucens, Plasmodium lutzi, Plasmodium lygosomae, Plasmodium mabuiae, Plasmodium mackerrasae, Plasmodium mackiei, Plasmodium maculilabre, Plasmodium maior, Plasmodium majus, Plasmodium malariae, Plasmodium multivacuolaris, Plasmodium marginatum, Plasmodium matutinum, Plasmodium megaglobularis, Plasmodium megalotrypa, Plasmodium melanoleuca, Plasmodium melanipherum, Plasmodium mexicanum, Plasmodium michikoa, Plasmodium minasense, Plasmodium minuoviride, Plasmodium modestum, Plasmodium morulum, Plasmodium multiformis, Plasmodium murinus, Plasmodium narayani, Plasmodium necatrix, Plasmodium neotropicalis, Plasmodium neusticuri, Plasmodium nucleophilium, Plasmodium octamerium, Plasmodium odocoilei, Plasmodium osmaniae, Plasmodium ovale, Plasmodium paddae, Plasmodium papernai, Plasmodium parahexamerium, Plasmodium paranucleophilum, Plasmodium parvulum, Plasmodium pedioecetii, Plasmodium pelaezi, Plasmodium percygarnhami, Plasmodium pessoai, Plasmodium petersi, Plasmodium pifanoi, Plasmodium pinotti, Plasmodium pinorrii, Plasmodium pitheci, Plasmodium pitmani, Plasmodium polare, Plasmodium pulmophilum, Plasmodium pythonias, Plasmodium quelea, Plasmodium reichenowi, Plasmodium relictum, Plasmodium reniai, Plasmodium rhadinurum, Plasmodium rhodaini, Plasmodium robinsoni, Plasmodium rousetti, Plasmodium rousseloti, Plasmodium rouxi, Plasmodium sandoshami, Plasmodium sasai, Plasmodium saurocaudatum, Plasmodium schwetzi, Plasmodium scelopori, Plasmodium scorzai, Plasmodium semiovale, Plasmodium semnopitheci, Plasmodium shortii, Plasmodium siamense, Plasmodium silvaticum, Plasmodium simium, Plasmodium simplex, Plasmodium smirnovi, Plasmodium snounoui, Plasmodium stuthionis, Plasmodium tanzaniae, Plasmodium tenue, Plasmodium tejerai, Plasmodium telfordi, Plasmodium tomodoni, Plasmodium torrealbai, Plasmodium toucani, Plasmodium traguli, Plasmodium tribolonoti, Plasmodium tropiduri, Plasmodium tumbayaensis, Plasmodium tyrio, Plasmodium uilenbergi, Plasmodium uluguruense, Plasmodium uncinatum, Plasmodium uranoscodoni, Plasmodium utingensis, Plasmodium uzungwiense, Plasmodium watteni, Plasmodium wenyoni, Plasmodium vacuolatum, Plasmodium vastator, Plasmodium vaughani, Plasmodium vautieri, Plasmodium venkataramiahii, Plasmodium vinckei, Plasmodium vivax, Plasmodium volans, Plasmodium voltaicum, Plasmodium wenyoni, Plasmodium yoelii, Plasmodium youngi, Plasmodium zonuriae Malaria Erregerarten MALARIAERREGER KRANKHEITSBILD Plasmodium falciparum Malaria tropica Plasmodium vivax Plasmodium ovale Plasmodium malariae Malaria tertiana Malaria quartana Entwicklungszyklus der Malaria Entwicklungszyklus der Malaria Zyklus-Abschnitt im Mensch (1) Sporozoiten werden mit Speichel von weiblichen Stechmücken beim Stich injiziert Sporozoiten dringen nach wenigen Minuten über den Blutstrom in Leberzellen (2) ein. Entwicklung von Leberschizonten. Durch asexuelle Vermehrung (Leberschizogonie, präerythrozytäre Phase) entstehen Tausende von Merozoiten (3). Merozoiten (3) dringen in Erythrozyten ein (4) (5) Ringstadium (Trophozoit) Entwicklung von reifen Schizonten (6) - (7) mit 8 - 24 Merozoiten (erythrozytäre Schizogonie) Merozoiten (8) befallen entweder neue Erythrozyten (4) oder werden zu Mikro- (9.1) oder Makrogamonten (9.2). Beim Blutmahl werden die Gamonten im Mückendarm frei (10) und (11). Entwicklungszyklus der Malaria Zyklus-Abschnitt in der Stechmücke (12) Der Mikrogamont teilt sich in Mikrogameten (13) Mikrogameten (13) befruchten den Makrogameten (14), (Gamogonie) Aus der Zygote (15) entsteht ein Ookinet (17) Der Ookinet (18) durchdringt die peritrophe Membran und das Darmepithel Entwicklung zwischen Epithelzelle und Basalmembran zur Oozyste (19) und (20), Sporogonie In der Sporozyste entstehen Tausende von Sporozoiten (21), die zur Speicheldrüse (22) wandern (1) Sporozoiten werden mit Speichel von weiblichen Stechmücken beim Stich injiziert Entwicklungszyklus der Malaria Animation Diagnostik der Malaria Die klassische Methode ist die mikroskopische Untersuchung von peripherem Blut. Neuere Methoden erlauben eine indirekte Diagnose durch den Nachweis von spezifischen Antigenen, die aber bei schwachen Parasitämien falschnegativ ausfallen können. Trophozoit Gamonten Merozoiten/ Schizonten in Erythrozyten Trophozoit Symptomatik der Malaria schlagartiger Beginn mit: Kopf- und Rückenschmerzen, Schüttelfrost Hitzegefühl deutlichem Fieber Rhythmische Fieberschübe Anämie Multiple Organschädigungen Symptomatik der Malaria Das Malaria-Fieber kann als "Wechselfieber" auftreten. Zu Fieberschüben kommt es, wenn infizierte Erythrozyten aufplatzen. Dabei werden Malaria-Antigene freigesetzt, die im Wirt — wegen induzierter Zytokinproduktion (IL- 1, IL-6) — Fieber bewirken. Therapie der Malaria Chinin Blutschizontozid Nur Therapie Chloroquin Blutschizontozid Prophylaxe und Therapie Halofantrin Blutschizontozid Nur Therapie Mefloquin Prophylaxe und Therapie Pyrimethamin+ Sulfadoxin Gewebe- und Blutschizontozid Nur Therapie Primaquin (int.Apotheke) Hypnozid, gewebeschizontozid, gametozid Nur Therapie der Malaria tertiana Zyste Giardia lamblia (Lamblia intestinalis) Bei Giardia lamblia handelt es sich um einen parasitischen Flagellaten mit einem direkten Lebenszyklus. Die Infektion erfolgt durch die per orale Aufnahme von Zysten. Angeheftet an das Dünndarmepithel des Menschen vermehren sich die Trophozoiten. Häufig bleibt die Infektion symptomlos. Wird der Erreger nicht eliminiert, kann es zu Darmbeschwerden und Durchfall kommen. Trophozoit Zyste Giardia lamblia (Lamblia intestinalis) Trophozoit 1. Orale Aufnahme von Zysten (nach fäkaler Verunreinigung von Wasser oder Nahrung) 2. Trophozoiten exzystieren in Dünndarm und vermehren sich durch Zweiteilung 3. Trophozoiten adhärieren an die Oberfläche der Microvilli des Darmepithels 4. Freie Trophozoiten enzystieren in Dünndarm 5. Zysten werden im Stuhl ausgeschieden. Zyste Giardia lamblia (Lamblia intestinalis) Trophozoit 1. Orale Aufnahme von Zysten (nach fäkaler Verunreinigung von Wasser oder Nahrung) 2. Trophozoiten exzystieren in Dünndarm und vermehren sich durch Zweiteilung 3. Trophozoiten adhärieren an die Oberfläche der Microvilli des Darmepithels 4. Freie Trophozoiten enzystieren in Dünndarm 5. Zysten werden im Stuhl ausgeschieden. Trypanosoma spp. (Trypanosoma gambiense, T. rhodesiense, T. cruzi) Morbus Chagas T. b. gambiense T. b. rhodesiense • Genus: Typanosoma Schizotrypanum cruzi Trypanosoma cruzi Erreger zuerst im Blut, dann im Gewebe West- und Zentralafrika Ost- und Zentralafrika Beginn der Parasitämie: 2-3 Wochen nach Infektion Beginn der Parasitämie: 1-2 Wochen nach Infektion Eindringen der Erreger in das ZNS: 4-6 Monate nach Infektion oder später Eindringen der Erreger in das ZNS: oft bereits nach wenigen Wochen Schlafkrankheit • Genus: Trypanosoma • Spezies: brucei • Subspezies: rhodesiense, gambiense (menschenpathogen) Trypanosoma rhodesiense Trypanosoma gambiense Erreger hptsl. im Blut, Liquor Parasitämie-assoziierte Symptome: ZNS-assoziierte Symptome: Fieber, Schüttelfrost, Kopf-, Gelenk- und Muskelschmerzen, Ödeme, Gewichtsverlust, Jucken, endokrine Probleme, Schwellung der Lymphknoten am Nacken; Störungen der Herzfunktion (v.a. bei T. b. rhodesiense), Anämie, Thrombozytopenie, erhöhte IgM-Spiegel im Blut. Verwirrungszustände, Koordinationsschwierigkeiten, Sinnesstörungen, Gestörter Schlafzyklus, Abmagerung, epileptiforme Krämpfe, Apathie, Koma. Pleozytose im Liquor, erhöhte Gesamtprotein- und IgMSpiegel. Trypanosoma spp. (Trypanosoma gambiense, T. rhodesiense) Trypanosoma spp. (Trypanosoma gambiense, T. rhodesiense) Zyklus-Abschnitt im Mensch I. 1. Die infizierte Tsetse-Fliege überträgt bei einem Stich bis zu 20’000 metazyklische, trypomastigote Trypanosomen in die Haut des Menschen. In der Nähe der Einstichstelle vermehren sich die Parasiten, was zur Bildung eines Schankers führen kann. Trypanosoma spp. (Trypanosoma gambiense, T. rhodesiense) Zyklus-Abschnitt im Mensch II. 2. Die Trypanosomen erreichen über das Lymphsystem in den Blutkreislauf. 3. 4. Dort sind die trypomastigoten Blutformen (Länge: 15 bis 30 µm) zunächst langgestreckt (slender), beweglich und teilungsaktiv. (Alle 6 Stunden erfolgt eine Verdoppelung der Population. Innerhalb kurzer Zeit wird so das Blut mit Trypanosomen überschwemmt. Erregerzahlen von 6’000 pro Mikroliter Blut sind keine Seltenheit). Bei Erreichen einer hohen Parasitendichte entwickeln sich die zunächst schlanken Formen zu intermediären und anschliessend zu gedrungenen trypomastigoten Formen (short-stumpy) weiter. Gedrungene trypomastigoten sind nicht mehr teilungsaktiv, aber infektiös für TsetseFliegen. Trypanosoma spp. (Trypanosoma gambiense, T. rhodesiense) Zyklus-Abschnitt im Tsetse-Fliege 5. Die Fliegen nehmen die Trypanosomen mit dem Blutmahl auf. 6. Die short-stumpy-Formen differenzieren sich im Mitteldarm der Fliege zu langgestreckten „prozyklischen Trypomastigoten“, die sich vermehren. 7. Prozyklischen Trypomastigoten durchdringen die peritrophische Membran und wandern über das Darmlumen und Ösophagus in die Speicheldrüse. Hier entwickeln sie sich zu epimastigoten Formen. 8. Epimastigoten heften sich an die Mikrovilli der Drüsenzellen und teilen sich. Danach erfolgt die Weiterentwicklung zu trypomastigoten metazyklischen Trypanosomen, die einen Oberflächencoat aus Glykoproteinen aufbauen und für den Menschen infektiös werden. promastigote Form (geißeltragend) Leishmania spp. (Leishmania tropica, L. major) amastigote Form (unbegeißelt) Leishmanien sind Einzeller, die durch Schmetterlings- oder Sandmücken übertragen werden. Sandmücken Die Leishmaniosen sind in über 88 Ländern der Tropen und Subtropen verbreitet. Die WHO schätzt, dass weltweit etwa 12 Mio. Menschen mit den Erregern infiziert sind, jährlich kommen etwa 2 Mio. Neuerkrankungen dazu. kutanen Leishmaniosen Die Verbreitung der Leishmaniose ist streng an das Vorkommen ihrer Vektoren, der Schmetterlingsmücken, gebunden. promastigote Form (geißeltragend) Leishmania spp. (Leishmania tropica, L. major) amastigote Form (unbegeißelt) Leishmanien werden durch weibliche (Sandmücken) übertragen. Die promastigoten Stadien werden von Phagozyten wie beispielsweise Makrophagen, dendritische Zellen oder Langerhans-Zellen aufgenommen. Dort werden sie nicht zerstört, sondern wandeln sich in amastigote Formen um. Diese vermehren sich in der parasitophoren Vakuole durch Zweiteilung, bis die Wirtszelle schliesslich platzt. Die freigewordenen Amastigoten werden entweder erneut von Phagozyten phagozytiert oder von einem geeigneten Vektor aufgenommen. (Ebenso können infizierte zirkulierende Makrophagen vom Vektor aufgenommen werden). promastigote Form (geißeltragend) Leishmania spp. (Leishmania tropica, L. major) amastigote Form (unbegeißelt) Im Darm der Schmetterlingsmücke wandeln sie sich zu promastigoten, begeisselten Stadien um, die sich durch Zweiteilung stark vermehren. Schliesslich sind Vorderdarm der Mücke mit Promastigoten angefüllt, die beim nächsten Blutmahl in einen Wirt übertragen werden. Toxoplasma gondii Bradyzoit sporolierte Oozyste Oozyst (mit 2 Sporozysten) Merozoit Gamete Sporozyste T.gondii, der Erreger der Toxoplasmose, ist ein obligat intrazellulärer Gewebsparasit Toxoplasma gondii Systematik Einzeller (Alveolata, Apicomplexa) Lebensweise obligat intrazellulär Verbreitung weltweit Infektionsweg Wasser, Fleisch Rohwasser: 87%, Trinkwasser: 27% Toxoplasma gondii Infektionsweg Toxoplasma gondii 1. Im Darm der Katze geschieht die geschlechtliche Vermehrung mit Bildung von Oozysten, die durch den Kot in die Umwelt gelangt (enteroepitheliale Phase). 2. Diese Oozysten sporulieren etwa zwei Tage nach der Ausscheidung und werden dadurch widerstandsfähig und infektiös (exogene Phase). 3. Werden die gebildeten Sporozysten oral aufgenommen, dringen sie durch die Darmwand (extraintestinale Phase) und streuen hämatogen oder lymphogen vorwiegend in das RES und in die Muskulatur. Hier vermehren sie sich intrazellulär durch ungeschlechtliche Zweiteilung. Hierbei kommt es zum Platzen der Wirtszellen und Nekrosen. Toxoplasmose • Epidemiologie – ~35-37% der Bevölkerung – ~1,5% Katzen scheiden Oozysten aus (1-2 Wochen), ~100 Mio Oozysten – wasserassoziierte Ausbrüche • Inkubationszeit – Monate-Jahre • Symptomatik – ungeborene Kinder, Immunsupprimierte – Zerebrale Toxoplasmose, Augentoxoplasmose • Therapie – Spiramycin (vor SSW 16) – Pyrimethamin + Sulfadiazin (Sulfadoxin) + Folinsäure • Prophylaxe – Lebensmittel-Hygiene Zerebrale Toxoplasmose Augentoxoplasmose Toxoplasmose in der Schwangerschaft • Erstmalige Infektion – in A: 3-6/ 1.000 Schwangerschaften (CH, D ~0,5-0,7%) diaplazentare Übertragung: 1/ 10.000 Übertragungs-Risiko im 1. Trimenon gering (~15%, Thiebaut et al. 2007) • mögliche Folgen (Zielorgane: Lymphknoten, ZNS, Muskulatur) – 10% klinisch schwerer Verlauf • 15% perinataler Tod, 85% Gehirnschäden (Hydrocephalus, Verkalkungen) – 15% mildere Symptome • 1% Gehirnschäden, 99% Chorioretinitis – 75% subklinisch • 15% keine Schädigung, 85% Chorioretinitis • Erkrankungen im Kindesalter (Hirn-, Augenschäden) Infektionszeitpunkt Diagnostik • Mutter – spez. IgM • bereits 1 Woche nach Erstinfektion nachweisbar • Maxima nach 2-4 Wochen • Persistenz wenige Monate (>1 Jahr) – spez. IgG • Maxima nach 2-4 Monaten • Persistenz mehrere Jahre • Kind – Toxoplasma-DNA (PCR aus Fruchtwasser) Zusammenfassung • • • • • seltene Erkrankung schwerer Verlauf aufdeckbar verhütbar bzw. behandelbar ~90% in utero Infizierter bei Geburt unauffällig, meist aber spätere Manifestation • Screening seit 1975 • >5000 Kinder vor Toxoplasmose bewahrt Trichomonaden T. intestinalis T. vaginalis Nicht sehr häufig Männer: keine Beschwerden Frauen: unangenehmen Ausfluss, Brennen und Jucken in der Genitalregion Medikamentöse Behandlung zu 95% erfolgreich Trichomonaden T. intestinalis T. vaginalis Nicht sehr häufig, Sexuelle Übertragung! Männer: keine Beschwerden Frauen: unangenehmen Ausfluss, Brennen und Jucken in der Genitalregion Medikamentöse Behandlung zu 95% erfolgreich Grundanforderungen Grundbegriffe der Parasitologie: Parasite, Endwirt, Zwischenwirt, Fehlwirt, Haupt- und Nebenwirt, Sammelwirt, Überträger, Reservoir, Endoparasit, Ectoparasit, fakultative Parasiten, obligate Parasiten, Monoxener und Heteroxener Lebenszyklus, Mechanismen der Wirtsschädigung Parasiten mit Lebenszyklus: Parasiten und Krankheit (ohne Lebenszyclus): Plasmodium spp (Malaria) Trypanosoma spp (Schlafkrankheit) Giardia lamblia Leishmania spp (Leishmaniosis) Toxoplasma gondii (Toxoplasmosis) Trichomonaden Extraanforderungen Lebenszyklus: Leishmania spp. Toxoplasma gondii Vielen Dank für Ihre Aufmerksamkeit











