SIRT - Dank
Werbung

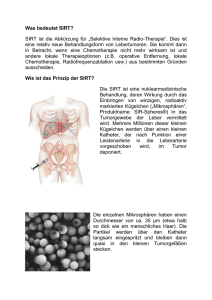
Selektive Interne Radiotherapie – SIRT aus der Sicht des Onkologen I B O Dr. med. Dorit Kürschner Klinik für Internistische Onkologie und Hämatologie Klinikum St. Georg gGmbH Leipzig I B O SIRT Grundlagen • Grundlage Blutgefäßversorgung: gesundes Lebergewebe > 75 % aus Pfortader Tumor (Metastasen) > 90 % aus den Aa. hepaticae • Prinzip: Einbringen von radioaktiven Yttrium- 90 -Mikrosphären ( SIR– Spheres® ) in die arteriellen Gefäße der Leber, Anreicherung der Mikrosphären in den präkap. Gefäßen des Tumors → ionisierende ß - Strahlung I B O • Tumornekrose durch direkte Bestrahlung, embolisierender Effekt der Mikrosphären ( keine ischämische Nekrose ), Dosiseskalation der Rtx am Tumor unter Schonung des gesunden Gewebes SIRT I B O Effektive Strahlendosis im Vergleich SIRT RILD – Radiation-Induced Liver Disease Gy: 20 30 Effective Dose: Testicular Ca Lymphoma Myeloma 40 50 60 70 80 90 100 Curative Doses: Adenocarcinoma Preoperati ve Radiation: Rectal Ca Kennedy et al. Int J Rad Oncol Biol Phys 2004; 60: 1520–1533. I B O SIRT- Indikation I • EU Zulassung für die Therapie von unresektablen Lebertumoren • Lokoregionale Therapie ohne Einfluß auf die extrahepatische Erkrankung • Einsatz bei leberdominanter Erkrankung, wenn keine Resektion , Transplantation (HCC) oder RFA möglich …als Monotherapie bei: → mCRC und and. metast. Karzinomen (chemorefraktäre Erkr.) → HCC → mNET → Cholangiocellulären Karzinomen ( 1st-line, 2nd-line) ( 1st-line, 2nd-line) ( 2nd-line) I B O SIRT- Indikation II • Einsatz in Kombination mit systemischer Chemound Antikörpertherapie bei → mCRC ( 2nd-line,in Studien 1stline) → mNET → Mammakarzinome ( 2nd-line) ( 2nd-line) • Studienergebnisse: früherer Einsatz führt zu größerem Benefit • Potential für Downstaging mit der Möglichkeit der sekundären Resektion oder Ablation I B O Warum die SIRT früher einsetzen? Potential Median overall survival (months) Benefit First-line chemo + SIRT Second-line chemo + SIRT Salvage therapy with SIRT 16.6 months up to 5.8 months 4.8 months 35 29.4 30 25 20 15 16.6 mo 12.8 12.2 2.8 to 5.8 mo 10 9.4 8.3 6.4 4.8 mo 5 0 5FU/LV + SIRSpheres† Irinotecan Irinotecan + SIR-Spheres† (Schoemaker et al 11 (van ) Hazel et al 12) (n = 174) (n = 25) 3.5 SIR-Spheres vs.† supportive care (Rühl et al 15) (n = 58) (van Hazel et al 9) † SIR-Spheres (n =Hazel 21) et al. J Surg Oncol 2004.88:78–85. Schoemaker et al. Brit J Cancer 2004;91:1434–41. van microspheres van Hazel et al. J Clin Oncol 2009;27:4089–95. Rühl et al. ECCO 15 Eur J Cancer Suppl 2009;7(2):343 Abs. 6071. I B O SIRT- Kontraindikation I • vorausgegangene perkutane Bestrahlung der Leber • deutliche Einschränkung der Leberfunktion - Bilirubin > 34 µmol / l ( 2mg / dl ) - Quick < 70 % - Thrombozyten < 75 Gpt/l - klinisch: Ascites - manifeste Cholestase • Tumorlast hepatisch > 50-75% • fehlende Hyperperfusion der Filiae I B O SIRT- Kontraindikation II • disseminierte extrahepatische Metastasierung • > 20% hepatopulmonale Shunts, bestimmt durch Technetium – MAA - Scan • Gefäßanomalien in der prätherapeutischen Angiografie, die zu einem signifikanten Reflux von Blut aus der A. hepatica in den Magen, Pankreas oder Darm führen • Komplette Pfortaderthrombose • Lebenserwartung < 3 Monate I B O Tumor Board Chirurgie Radiologie Gastroenterologie Intern. Onkologie Strahlentherapie Nuklearmedizin Pathologie andere FB Konsensus für SIRT 1–2 Wochen 1. Staging komplettieren 2. Wenn Voraussetzungen erfüllt , dann Gefäßdiagnostik PreTreatment Screening , Hep. Angiografie , T / MRT/Sonovue-Sonografie 1–2 Wochen protektive Embolisation von extrahep.Gefäßen Labor Besprechung Bildgebung im Team,und 99mTc-MAA Scan Tumorvolumen Leberdominante Erkrankung Dosisfestlegung Voraussetzungen erfüllt Therapieplanung Leberfunktion ausreichend Tumorbefall < 50% 1 Woche Applikation der 90Y-Microspheres posttherapeutisch Bremsstrahlung (gamma) Scan post-implant-Dokumentation Nach Kennedy A et al. Int J Radiat Oncol Biol Phys 2007; 68: 13–23. I B O SIRT Nebenwirkungen/Komplikationen • Postembolisations-Syndrom (Fieber, Schmerzen, Übelkeit) • Leberwertveränderungen • Ektope Implantation (GI Ulzeration, Pankreatitis, Cholezystitis) sorgfältige Gefässanalyse und ggf. -okklusion, medik. Prophylaxe • Strahlenhepatitis (RILD) und Veno-Occlusive Disease (VOD) - bis zu 3 Monate nach RXT (Aszites, Albumin, AP, Bilirubin) • Strahlenpneumonitis (durch MAA Lungen Shuntstudien vermieden) I B O SIRT – eigene Erfahrungen • 24 Patienten ( Kolonkarzinome 13/ NET 3/ HCC 3/ Mamma-CA 1/andere CA 4) • Krankheitsstabilisierung 2-24 Monate, median 8 Monate TTP • Nebenwirkungen/Komplikationen: PES 1x ausgeprägt prärenales Nierenversagen 1Pat. reversibel RILD 4 Patienten • Kolonkarzinome: 3 Patienten zuvor Lebermetastasenchirurgie, 9 Patienten 2 oder mehr Chemotherapielinien I B O SIRT – Follow up Follow up Woche • • • • 2 - 6 , 12 ,18 2,4,6,12 10 -12, 24, 36 10 -12, 24, 36 Klin.Untersuchg.+ Labor TU-Marker CT /MRT PET → morphologisches ≠ metabolisches Ansprechen! SIRT aus radiologisch- interventioneller Sicht J. Scheibe Aufgaben des Radiologen Indikationsstellung • Nachweis der art. Hypervaskularisation! • Abschätzung des Tumoranteils am Lebervolumen Problem: Volumetrie zu aufwendig, Abschätzung?! art. Blutflussvolumenanteil ist eigentl. relevant! Planung und Ausführung • Angiographie: Typ der art. Leberversorgung, Fluß in V. portae Nachweis von Kollateralisierungen! (Katheter-CT) Katheterpositionierung für Nuk-Med (1.Sitzung MAA-SPECT / 2. Sitzung SIRT) Ausschluß von Embolisatverschleppung: ggf. Coiling, Katheterlage- und alt. Flusskontrolle Technik und Material • Axiom Artis mit großem BV (2012 Gerät mit FD / Rotationsangio / Dyna- CT geplant) • CT (16- Zeilen MSCT) unmittelbar benachbart • Angiographie : transfemoraler (transbrach.) Zugang) bei erhebl. elong. Beckenachsen lange 4 -F-Schleuse 4-F-Katheter 38er Lumen, Cobra (bis Sidewinder) (notwendiger Fluß zur opt. Kontrastierung der art. Stämme!) Teleskoptechnik mit Progreat- 2,7-F - System, 1,10 lang incl. 21er Führungsdraht (Terumo) Coils: 0,18 Hilal oder Tornado (Cook) ggf. ablösbare Coils (Azur / Terumo) Technisches Vorgehen (1. Sitzung) • Zöliako- und Mesenterikographie, ggf. Portogr. • Selektive- bzw. superselektive Hepatikographie Cave: (A. cystica?), A.gastroduodenalis, atypische Abgänge oder atypische Fremdversorgungen aus Leberarterien • Verlegung zur Szintigraphie mit am geplanten Embolisationsort liegendem Katheter • Ggf. Angio-CT nach Szintigramm (Coiling?!) Kontraindikationen aus angiographischer Sicht: • • • • Allgemeine Angiographiekontraindikation Pfortaderthrombose AV-Kurzschlüsse Technische Probleme der selektiven Angiographie (Varianten!) • Varianten mit dem Risiko von Fehlembolisationen (Magen, Darm, Pankreas) ohne Möglichkeit des Coiling unmögliche Variante (HCC mit AV-Kurzschluss) unmögliche Variante (Tr. coel. – Verschlüsse) art. Hypervaskularisation: Hepatikogr. oder CT mit art. KM via Katheter Goldstandard! Der „ideale Patient ! unkomplizierte Variante komplizierte Variante Katheterlage zur SIRT Technisches Vorgehen (2. Sitzung) • Ggf. Coiling extrahep. aberrierender Gefäße • Selektive bzw. superselektive Platzierung des Katheters zur SIRT, evtl. in zwei tumorversorgende Arterien pro Sitzung • Applikation der Yttrium-Mikrosphären unter alternierender Kontrolle des Blutstromes mittels zwischenzeitiger KM-Injektion (Cave! retrograde Fehlembolisation) Coiling während 1. oder 2. Sitzung? • anfangs in 1. Sitzung aus Managementvorteil im Anschluß an MAA-SPECT (Kontraindikation?) • jetzt in 2. Sitzung unmittelbar vor SIRT Nachteil: nicht planbarer Zeitbedarf Vorteil: keine „Kollateralen-Neubildung im Intervall (bei akzident. Coilfehlplatzierung Gefäßverschlußrisiko unmittelbar vor SIRT geringer) Coiling der A. cystica? Fehlplanung! 3. Ebene? komplizierte Variante mit atyp. Duodenarterien techn. nicht coilbar laminarer Fluss Katheterpositionen zur SIRT laminarer Fluss differenter Embolisationsgrad Stase 2 aberrierende Arterien 1 2 1 1 2 Zusammenfassung • Indikationsstellung in Tumorkonferenz Tumorlast, Leber- hämatolog. Reserve, Radiosensitivität • 1. Sitzung: Diagnostik angiographisch und Nuk-Med • 2. Sitzung: ggf. Coiling, möglichst proximale, ggf. superselekt. Katheterpositionierung (lamin. Fluss!) flussgesteuerte Applikation der vorberechneten Dosis von Sirtex- Partikeln (REILD!) • Erweiterung der Palette intervention. Lebertumortherapie Differentialindikation TACE – SIRT nach Chemobzw. Radiosensibilität und Lokalisation • Vorteil einmalige Intervention (ggf. zweizeitig) • Ziel: Intervention in früherem Stadium (SIRFLOX-Studie?) Vielen Dank für Ihre Aufmerksamkeit. THEMA Durchführung der SIRT Nuklearmedizinischer Teil Dr. med. Kerstin HOHDORF Delitzscher Straße 141 | 04129 Leipzig Telefon 0341/9 09 24 80 o. 0341/4 77 99 82 | Telefax 0341/9 09 24 81 E-Mail [email protected] www.nuklearmedizin-stgeorg-leipzig.de GLIEDERUNG - vorbereitende Diagnostik - Implantation - posttherapeutisches Regime VORBEREITENDE DIAGNOSTIK/STAGING - Leberdominanz? - Skelettszintigraphie - PET-CT mit F18-FDG ossäre Metastasierung vitales Tumorgewebe Leber Lungenmetastasierung, Lymphknotenmetastasierung SKELETTSZINTIGRAMM anterior posterior PET-CT MIT F18-FDG coronal Mit freundlicher Genehmigung: Prof. Dr. med. habil. Osama Sabri, Klinikdirektor Universität Leipzig, Klinik und Poliklinik für Nuklearmedizin INTRAARTERIELLE DIAGNOSTIK - 100 MBq Tc99m-MAA - dynam. Szintigramme bis 5´p.i. - statische Szintigramme 10´p.i. - SPECT der Leber (3 Ebenen) Erfassung betroffener Leberanteile über Partikelgröße (ca. 35 µm) der Makro-Albumin-Aggregate (MAA) Simulation der Therapiebedingungen quantitative Bestimmung des Leber-Lungen-Shunts QUANTIFIZIERUNG LEBER-LUNGEN-SHUNT < 10% 10-15% 15-20% Applikation volle kalkulierte Aktivitätsmenge 20% Reduktion 40% Reduktion > 20% KEINE APPLIKATION SPECT LEBER PARTIKEL Harzkugeln, Durchmesser ca. 35 µm Y90 beladen (Elektronen-Emitter) HWZ 2,7 d Reichweite 2,5 bis max. 10 mm VORBEREITUNG IMPLANTATION Ermittlung individuelle Aktivitätsmenge Körperoberfläche, Tumorbefall Leber (%) 66% für re (33% für li) Leberlappen + 10% (Schlauchsystem) IMPLANTATION BREMSSTRAHLEN-SZINTIGRAMM anterior posterior DOSIMETRISCHE ÜBERWACHUNG AUF STATION - Messung effektive Dosis - Kontrolle auf Kontamination mobiler Kontaminationsmonitor Dr. med. Kerstin HOHDORF Delitzscher Straße 141 | 04129 Leipzig Telefon 0341/9 09 24 80 o. 0341/4 77 99 82 | Telefax 0341/9 09 24 81 E-Mail [email protected] www.nuklearmedizin-stgeorg-leipzig.de