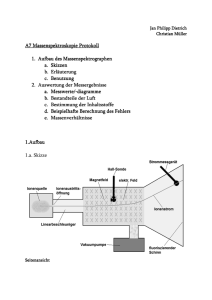
Elektrolyte
Werbung

100 12 Wasser (Wasserstoffoxid), H2O In einem gewissen Abstand von der Sonne erstreckt sich eine Zone, in der Temperaturen herrschen, bei denen Wasser flüssig bleibt. In diesem Gürtel kreist auch die Erde um die Sonne. Ihr Oberflächenwasser ist überwiegend flüssig, und sie bietet gute Lebensbedingungen. Auf der Venus oder auf dem Mars kann Wasser nicht in flüssiger Form vorkommen. Auf der Venus ist es wegen der Nähe zur Sonne zu heiß, auf dem Mars zu kalt, weil der Planet weiter von der Sonne entfernt ist und nicht genug Masse hat, um eine isolierende Atmosphäre zusammenzuhalten. Vorkommen: Die Oberfläche des Planeten Erde wird von Wasser beherrscht. Wasser ist die wichtigste chemische Verbindung. Wasser ist der wichtigste Bestandteil aller Pflanzen sowie aller Tiere und Mikroorganismen. Der menschliche Körper besteht zu etwa ²/3 aus H2O, manche Gemüse und Früchte zu 9/10 und mehr. Alle Lebensprozesse spielen sich in wässerigem Milieu ab (man könnte auch sagen: sind auf Wasser eingespielt). Die Wasservorräte der Erde sind seit Milliarden von Jahren in ihrer Gesamtmenge unverändert. Sie liegen bei rund 1,38 1018 m3. In Volumenanteilen gemessen, entfallen 97,4 % davon auf salziges Meerwasser – gut zwei Drittel der Erdoberfläche (71 %) werden von Ozeanen und Randmeeren bedeckt – und 2,6% auf Süßwasser. Demgegenüber ist der gesamte Wasservorrat der Atmosphäre mit einem Volumenanteil von 0,001 % verschwindend gering. Dies entspricht einer Wasserschicht von nur 25 mm auf der Erdoberfläche. Physikalische Eigenschaften: In reinstem Zustand ist Wasser eine klare, geruch- und geschmacklose, farblose – in dicker Schicht jedoch ebenso wie Eis bläulich schimmernde – Flüssigkeit. Schmp. 0° C = 273,15 K Sdp. 100° C = 373,15 K 101 Durch den Schmelzpunkt und Siedepunkt des Wassers bei 101,3 kPa ist die Celsius-Temperatur-Skala festgelegt. Wasser kommt in Abhängigkeit von den Zustandsgrößen Druck und Temperatur als festes Eis, flüssiges Wasser und als Wasserdampf vor. Der Zusammenhang zwischen Aggregatzustand, Druck und Temperatur lässt sich anschaulich im Zustandsdiagramm des Wassers darstellen. Zustandsdiagramm des Wassers Dem Zustandsdiagramm des Wassers kann man folgende Informationen entnehmen: - Jenseits der Kurven (Dampfdruckkurve, Sublimationskurve und Schmelzkurve) kann Wasser in recht variablen T- und p-Bereichen in nur jeweils einem Aggregatzustand existieren. Auf den Kurven sind zwei Phasen koexistent; p und T sind aber festgelegt. Im Schnittpunkt der drei Kurven, dem „Tripelpunkt“ (6,10 mbar und 0,01° C) sind alle drei Phasen nebeneinander beständig. Siede- und Schmelzpunkt bei Normaldruck ergeben sich als Temperatur im Schnittpunkt der 1,013 bar Geraden mit der Schmelzpunkts- bzw. Dampfdruckkurve. Bei sehr hohen Dampfdrücken erreicht der Wasserdampf die gleiche Dichte wie das flüssige Wasser. Der Unterschied zwischen der Gasphase und der flüssigen Phase verschwindet, es existiert nur noch eine einheitliche Phase. Der Punkt, bei dem die einheitliche Phase entsteht und an dem die Dampfdruckkurve endet, heißt kritischer Punkt. Der zum kritischen Punkt gehörige Druck heißt kritischer Druck pK,, die zugehörige Temperatur kritische Temperatur TK. Oberhalb der kritischen Temperatur kann daher Wasserdampf auch bei beliebig hohen Drücken nicht verflüssigt werden. Im Unterschied zu fast allen Flüssigkeiten sinkt der Schmelzpunkt des Wassers unter Druck und beträgt z. B. bei 2000 bar –22° C. Das ist eine Folge der Tatsache, dass sich die flüssige Phase beim Gefrieren ausdehnt (s. u.). Eis kann daher durch Druck verflüssigt werden. Dieses Verhalten erleichtert das Schlittschuhlaufen ganz ungemein. 102 Struktur: Die in mancher Hinsicht anomalen Eigenschaften des Wassers lassen sich auf die Struktur des H2O-Moleküls zurückführen, in dem die beiden H-Atome unter einem Winkel von 104,5° angeordnet sind. Die unterschiedlichen Elektronegativitäten von O (3,5) und H (2,2) führen zu einer Polarisierung der O─H-Bindungen (= Polare Atombindungen), angedeutet durch negative und positive Teilladungen (= Partiallandungen) - und +. Da die entgegengesetzten elektrischen Pole in ihrer räumlichen Lage nicht zusammenfallen, bildet das Wassermolekül einen Dipol ( 1,85 Debye ). Struktur (a) und Molekülorbitale (b) von H2O H - O + H 1 0 4 ,5 ° H 96 pm H + 1 5 1 ,3 p m a b Die Winkelung im H2O-Molekül kann man aufgrund folgender Überlegung verstehen: Die Elektronenkonfiguration in der Valenzschale des Sauerstoffatoms ist s2 px2 py1 pz1 . Diese vier Orbitale hybridisieren (= kreuzen) zu vier äquivalenten sp3-Hybridorbitalen. Diese vier Hybridorbitale, von denen zwei mit einem Elektronenpaar und zwei mit Einzelelektronen besetzt sind, sind in die vier Ecken eines Tetraeders gerichtet. Die beiden einzelnen besetzten Hybridorbitale überlappen nun mit den ebenfalls einzeln besetzten s-Orbitalen zweier Wasserstoffatome. Die geringe Abweichung des Bindungswinkel von Tetraederwinkel (109° 28’) ist bedingt durch die abstoßenden Kräfte zwischen den beiden freien Elektronenpaaren (Valenzelektronenpaarabstoßungsmodell: freie Elektronenpaare benötigen mehr Platz als bindende Elektronenpaare!) Der stark polare Charakter des Wassers erklärt die Eignung des Wassers als Lösungsmittel für polare Stoffe, die elektrolytische Dissoziation von Salzen, Basen und Säuren; die Neigung zur Komplexbildung, die Hydratation und die Fähigkeit zur Ausbildung von WasserstoffBrückenbindungen und damit auch die Strukturen von flüssigem und festem Wasser. 103 Wasserstoffbrückenbindung (Wasserstoffbindung): Bei einer Reihe kovalenter Wasserstoffbindungen elektronegativer Elemente erfolgt eine Bindung zwischen den Molekülen durch Wasserstoffbrücken. Dieser spezielle Bindungstyp wird Wasserstoffbindung (Wasserstoffbrückenbindung) genannt: X H X H Zwischen dem positiv geladenen H-Atom des Moleküls HX und dem freien Elektronenpaar eines X-Atoms eines Nachbarmoleküls kommt es zu einer elektrostatischen Anziehung. Die Anziehung ist um so größer, je größer die Elektronegativität des X-Atoms und je kleiner das X-Atom ist. Dadurch wird die X─H-Bindung polarer. Geeignet für starke Wasserstoffbindungen sind die Atome F, O und N. Cl, S, P und C sind nur zu schwachen Wasserstoffbindungen befähigt. Die Wasserstoffbrücken X─H......X sind meistens linear angeordnet, da dann die Anziehung H.....X am größten, die Abstoßung zwischen den X-Atomen am kleinsten ist. Die Bindungsenergien der Wasserstoffbindungen liegen im Bereich bis 40 kJ/mol. Hinsichtlich der Bindungsenergie liegt die Wasserstoffbindung zwischen der von der Waals-Bindung und der Ionenbindung. Wasserstoffbrücken beeinflussen die physikalischen Eigenschaften. Sie erhöhen z. B. Schmelztemperatur, Siedetemperatur, Verdampfungsenthalpie, Dipolmoment, elektrische Feldkonstante und Viskosität. Die Wasserstoffbrücken führen zu typischen Ketten-, Schicht- und Raumnetzstrukturen (vergl. Schichtstruktur der Borsäure H3BO3, Kapitel 24; Zickzackketten im kristallinen HF, Kapitel 20). Eine Reihe von Eigenschaften heben das Wasser aus der Gruppe der Wasserstoff-Verbindungen der dem Sauerstoff benachbarten Elemente heraus: Während alle einkernigen Wasserstoff-Verbindungen der Nichtmetalle Gase sind, ist Wasser als einzige flüssig (hypotheticher Schmp. –100° C, hypothetischer Sdp. -80° C); Während viele dieser „Hydride“ toxisch sind, ist Wasser völlig ungefährlich und bildet sogar den Hauptbestandteil der Körperflüssigkeit aller Organismen Siedepunkte von H-Verbindungen der HGE Siedepunkt (in K bei 1 bar) 400 300 200 100 2 3 4 5 Periode Die zusätzlichen Bindungskräfte durch WB in HF, H2O und NH3 können erst bei anomal hohem Siedepunkt überwunden werden. 104 Wasserstoffbrückenbindungen im Eis: Mikrophotographien natürlicher Schneekristalle Wassermoleküle haben eine große Affinität zueinander. Eine positiv geladene Region eines H2O-Moleküls ist bestrebt, sich zu einem negativ geladenen Bereich eines Nachbarmoleküls hin zu orientieren. Eis besitzt eine hochgeordnete kristalline Struktur mit einem Maximum an Wasserstoffbrücken. Flüssiges Wasser hat eine teilweise geordnete Struktur, in der sich ständig Gruppen von Molekülen über Wasserstoffbrücken zusammenschließen und wieder auflösen. Im Schnitt ist in flüssigem Wasser jedes Molekül mit 3 bis 4 Nachbarn über Wasserstoffbrücken verbunden, im Eis sind es 4. 105 Eisstruktur mit Wasserstoffbrücken Die Tetraederstruktur erzeugt Hohlräume. Im Eis ist jedes O-Atom tetraedrisch von vier H-Atomen umgeben. Zwei dieser H-Atome sind an ein O-Atom kovalent, zwei durch Wasserstoffbrückenbindung gebunden. Auf diese Weise wird eine Raumnetzstruktur, die von Hohlräumen durchsetzt ist (relativ „offene Struktur“) gebildet. Der Übergang des Wassers vom flüssigen in den festen Zustand ist also mit einer Volumenvergrößerung verbunden. Dichteanomalie des Wassers: Während sich fast alle Flüssigkeiten beim Gefrieren zusammenziehen und sich dadurch ihre Dichte erhöht, dehnt sich Wasser beim Erstarren aus. Dichte des Wassers zwischen 0 und 20° C: Temperatur [° C] Dichte [g/ml] _______________________________________ 0 (Eis) 0 (Wasser) 4 10 20 0,9168 0,99984 1,000000 0,99970 0,99821 Das Dichtemaximum (Volumenminimum) des Wassers liegt bei 4° C. Diese Eigenschaft bewirkt nicht nur, dass es Eisberge gibt (von denen aufgrund der Dichtedifferenz zwischen Eis und Meerwasser nur 12 % sichtbar sind) und dass – zusammen mit der geringen Wärmeleitfähigkeit des Eises – Gewässer von der Oberfläche her, nicht aber bis zum Grund gefrieren (Überlebenschance für Organismen), sondern auch, dass gefrierende Wasserleitungen etc. platzen und Gesteine mit Wassereinschüssen gesprengt werden können. 106 Van – der – Waals Kräfte: Wassermoleküle bilden im flüssigem Wasser untereinander Wasserstoffbrückenbindungen aus, die eine geringe Lebensdauer haben (Bruchteile einer Sekunde). Sie werden dauernd gelöst und neu geknüpft. Für die Aggregation der H2O-Moleküle im flüssigen Wasser sind außerdem Dipol-Dipol Kräfte verantwortlich. Anziehungen zwischen Dipolen werden als Van-der-Waals Kräfte bezeichnet. Es sind zwischenmolekulare Kräfte (Nebenvalenzbindungen, vergl. S. 65) Sie sind elektrostatischer Natur (vergl. Abb. S. 75 unten). Die Reichweite ist sehr gering – sie ist praktisch auf die nächsten Nachbarn beschränkt, denn da die Wechselwirkungsenergie proportional r-6 ist, nimmt sie mit wachsendem Abstand viel schneller ab als die Ionen-Ionen Wechselwirkung (Wechselwirkungsenergie proportional r-2). Man unterscheidet drei Komponenten der van-der-Waals Kräfte. Wechselwirkung permanenter Dipol-permanenter Dipol (Richteffekt): Bei der Anziehung von Dipolen mit einem permanenten Dipolmoment kommt es zu einer Ausrichtung der Dipole (S. 75 unten), die dadurch in einem energieärmeren Zustand übergehen. Wechselwirkung permanenter Dipol-induzierter Dipol (Induktionseffekt): Ein permanenter Dipol induziert in einem benachbarten Teilchen ein Dipolmoment, es kommt zu einer Anziehung. Besitzt das benachbarte Teilchen ein permanentes Dipolmoment, so überlagern sich Induktionseffekt und Richteffekt. Wechselwirkung fluktuierender Dipol-induzierter Dipol (Dispersionswechselwirkung, auch LondonKräfte). In allen Atomen und Molekülen entstehen durch Schwankungen in der Ladungsdichte der Elektronen flukturierende Dipole. Im Nachbaratom werden durch diese „momentan“ vorhandenen Dipole gleichgerichtete Dipole induziert, so dass eine Anziehung entsteht. Diese Anziehungskräfte werden mit zunehmender Größe der Atome bzw. Moleküle stärker, da in diesen die Elektronen leichter verschiebbar sind und sich damit leichter Dipole induzieren lassen (vergl. Kapitel 20 Halogene). Der Dispersionseffekt ist zwischen allen Atomen, Ionen und Molekülen wirksam. Die Dispersionswechselwirkung ist die einzige anziehende Art von Wechselwirkung zwischen EdelgasAtomen. Van- der-Waals Radien: Aus den Gleichgewichtsabstand in Molekülkristallen und kristallisierten Edelgasen kann man van-der-Waals Radien ableiten. Kleinere Abstände im Gitter als die Summe der van-der-Waals Radien sind Anzeichen für kovalente Bindungskräfte. 107 Van-der-Waals-Radien in Angström (Å) H 1,2 He 1,4 N 1,5 O 1,4 F 1,4 Ne 1,6 P 1,8 S 1,8 Cl 1,8 Ar 1,9 As 1,9 Se 1,9 Br 1,9 Kr 2,0 Te 2,1 I 2,0 Xe 2,2 Kovalente Bindungsabstände und van-der-Waals Radien im H2O-Molekül 108 Wasser als Lösungsmittel: Die guten Lösungseigenschaften von Wasser für Verbindungen, die aus polaren Molekülen wie Zucker oder aus Ionen (Salze) aufgebaut sind, beruhen auf seinen Dipoleigenschaften und seiner Fähigkeit zur Ausbildung von Wasserstoffbrücken. Die bei der Auflösung des Molekülgitters (Zucker) bzw. Ionengitters (Salz) aufzubringende Energie wird erbracht durch die Stabilisierung der gelösten Moleküle über die Ausbildung von Wasserstoffbrückenbindungen zwischen H2O und den polaren Gruppen des Zuckermoleküls (z. B. Hydroxylgruppen und Aldehydgruppe der Glucose) bzw. durch Hydratation (Hydratisierung) der Ionen, d.h. durch die Anlagerung der negativen Dipolenden an die Kationen und vice versa, ein Vorgang den man Dissoziation nennt und der zu einer Umhüllung der Ionen mit einer Hydrathülle, symbolisiert durch „aq“ führt. Beispiel: NaCl löst sich (dissoziiert) in Wasser NaCl (s) + H2O (l) Na+ (aq) + Cl- (aq) HL = +4 kJ/mol HL = Lösungsenthalpie Trennung von Na+- und Cl--Ionen durch H2O-Moleküle 109 Na+ (aq) Cl- (aq) Die Zahl der hydratisierenden Moleküle hängt von der Größe des Ions und seiner Ladung ab, für die meisten Ionen ist sie etwa sechs. Wasser vermindert die Stärke von elektrostatischen Wechselwirkungen gegenüber dem Zustand im Vakuum, um den Faktor 80- was seiner Dielektrizitätskonstanten entspricht. Wasser hat wegen seiner Polarität und seiner Fähigkeit, gerichtete Lösungsmittelhüllen (Hydrathüllen) um Ionen zu bilden, eine außerordentlich hohe Dielektrizitätskonstante. Die gerichteten Hydrathüllen erzeugen eigene elektrische Felder, die den Feldern der jeweiligen Ionen entgegengerichtet sind. Dadurch schwächt Wasser die elektrostatische Anziehung zwischen Ionen beträchtlich. Das Auflösen von Salzen kann exotherm und endotherm verlaufen: CaCl2 (s) NH4NO3 (s) H2O (l) H2O (l) Ca2+ (aq) + 2Cl- (aq) HL = - 81,3 kJ/mol NH4+ (aq) + NO3- (aq) HL = + 15,16 kJ/mol Elektrolyte Viele polare Verbindungen lösen sich in Wasser unter Bildung frei beweglicher Ionen. Diese Stoffe nennt man Elektrolyte, da ihre Lösungen den elektrischen Strom leiten. Träger des elektrischen Stromes sind Ionen (im Gegensatz zu metallischen Leitern, wo der Stromstransport durch Elektronen erfolgt). Die positiv geladenen Ionen (Kationen) wandern im elektrischen Feld zur Kathode (negative Elektrode), die negativ geladenen Ionen (Anionen) zur Anode (positive Elektrode). 110 Leitfähigkeit durch Elektrolyte In Ionenkristallen liegen im festen Zustand bereits Ionen in bestimmten geometrischen Anordnungen vor. Beim Lösungsvorgang geht die geometrische Ordnung des Ionenkristalls verloren, es erfolgt eine Separierung in einzelne Ionen, eine Ionendissoziation. Bei polaren kovalenten Verbindungen wie z. B. HCl entstehen die Ionen erst durch Reaktion mit dem polaren Wasser: H Cl H + O H H 2Ol H3O+ (aq) + Cl- (aq) Verbindungen wie Zucker oder Alkohol, deren wässrige Lösungen den elektrischen Strom nicht leiten, bezeichnet man als Nichtelektrolyte. In diesen Lösungen sind die gelösten Teilchen einzelne Moleküle, die von H2O-Molekülen umhüllt sind. Den Salzgehalt von Wasser kann man über Leitfähigkeitsmessung ermitteln. Reines Wasser leitet den elektrischen Strom fast nicht; bei Zugabe ionogener Stoffe (also z. B. Salze) nimmt die Leitfähigkeit zu. Versuch: Glühbirne führt erst dann Strom, wenn der Stromkreis der durch zwei in dest. Wasser tauchende Elektroden unterbrochen ist, durch Zugabe von Kaliumnitrat geschlossen wird. 111 Versuch: Leitfähigkeitsmessungen mit wässerigen Lösung verschiedener Verbindungen Lösung Leitfähigkeit 1 l [ S / cm] R q 13 1) dest. Wasser 10620 2) NaCl-Lösung (c = 0,1 mol/l) 14 3) D-Glucose-Lösung (c = 0,1 mol/l) 24300 4) HCl (c = 0,01 mol/l) 522 5) CH3COOH ( c = 0,1 mol/l) 1) In reinem Wasser befinden sich nur sehr wenige Ladungsträger. Autoprotolyse des Wassers: H2O + H2O K = 1,8 . 10-16 H3O+ + OH- Gelöstes CO2: CO2 + H2O CO2 (aq) HCO3- + H3O+ 2) starker Elektrolyt 3) Nichtelektrolyt, Leitfähigkeit durch Autoprotolyse des Wassers und gelöstes CO 2 verursacht (vergl. 1) 4) Starker Elektrolyt, H3O+ (große Ionenbeweglichkeit, siehe unten) 5) schwacher Elektrolyt CH3COOH + H2O H3O+ + CH3COO- KS = 1,8 . 10-5 mol/l Sobald ein elektrischer Strom durch eine Elektrolytlösung fließt, wandern die darin befindlichen Ionen zu der Elektrode entgegengesetzter Ladung. Ihre Geschwindigkeit ist dabei proportional zum Reibungswiderstand, den das Ion bei der Bewegung durch die Lösung erfährt. Der Reibungswiderstand selbst ist mit der Größe des geladenen Teilchens verknüpft. Dabei fällt auf, dass die Ionenbeweglichkeit sowohl von H3O+ als auch von OH- um ein Vielfaches über denen anderer Ionen liegt. Für H3O+ resultiert diese hohe Beweglichkeit aus der Fähigkeit des Protons schnell von einem Wassermolekül zum nächsten zu springen. Auch wenn ein einzelnes Hydronium-Ion durch eine Lösung wandern kannn, wie beispielsweise ein Natrium-Ion, so erhöht doch der beschriebene Mechanismus des Protonensprungs die tatsächliche Ionenbeweglichkeit um ein Beträchtliches. Die ungewöhnliche Ionenbeweglichkeit des OH--Ions ist ebenfalls auf Protonensprünge zurückzuführen, nur ist in diesem Fall die Ionenwanderung entgegengesetzt zur Bewegung des Protonensprungs. 112 Ionenbeweglichkeiten in Wasser bei 25°C Ion Beweglichkeit · 10-5 in cm2 · V-1 s-1 H3O+ Li+ Na+ K+ NH4+ Mg2+ Ca2+ OHClBrCH3COOSO42- 362.4 40.1 51.9 76.1 76.0 55.0 61.6 197.6 76.3 78.3 40.9 79.8 Protonensprung-Mechanismus der Wanderung von Hydronium-Ionen durch wässrige Lösungen 113 Gefrierpunktserniedrigung und Siedepunktserhöhung: Durch in Wasser gelöste Verbindungen wird das Wasser gewissermaßen verdünnt, so dass im Mittel weniger H2O-Moleküle aus der Wasseroberfläche austreten und damit bei gegebener Temperatur der Dampfdruck geringer ist als in reinem Wasser: Gefrierpunktserniedrigung und Siedepunktserhöhung Diese Dampfdruckerniedrigung führt zu einer Gefrierpunktserniedrigung (tg) und einer Siedepunktserhöhung (ts), die man sich in der Kryoskopie und Ebullioskopie zur Molmassebestimmung zunutze macht: Wenn E eine lösungsmittelspezifische Konstante ist und b die Molalität, so gilt das Raoultsche Gesetz: t = E b Ist i der gelöste Stoff und LM das Lösungsmittel, so wird mit b = n(i) / m(LM) und n(i) = m(i) / M(i) M(i) = E m(i) / t m (LM) Osmose Eine weitere Eigenschaft von Lösungen, die im wesentlichen von der Konzentration des gelösten Stoffes und weniger von der Art der gelösten Teilchen abhängt, ist die Osmose. Bezeichnung für die Diffusion von Lösemittel-Molekülen durch eine semipermeable Trennwand (Membran) hindurch. Befinden sich beiderseits der Trennwand verschieden konz. Lösungen, so wird beim Vorliegen einer permeablen Trennwand, die allen Komponenten des Lösungssystems den Durchtritt gestattet, ein Konzentrationsausgleich nach Art der freien Diffusion erfolgen. Ist jedoch die Trennwand nur semipermeabel (halbdurchlässig), so wird nur noch Teilen des Systems der Durchtritt gestattet. Um nun gleiche Konzentrationen zu beiden Seiten der Trennwand herzustellen, wandern Lösungsmittelmoleküle vom Raum niedrigerer in den Raum höherer Konzentration. Anschaulich spricht man auch von einem „Verdünnungsbestreben“ der konzentrierten Lösung. Der Wanderungsvorgang setzt sich so lange fort, bis jeweils gleich viele Lösungsmittelmoleküle nach beiden Seiten der Trennwand diffundieren. 114 Befand sich die höher konzentrierte Lösung in einem abgeschlossenen System, so wurde durch das Hereindiffundieren des Lösungsmittels allmählich ein hydrostatischer Überdruck erzeugt, der dem Verdünnungsbestreben entgegenwirkt. Diesen manometrisch messbaren Druck bezeichnet man als osmotischen Druck. Demonstration des osmotischen Druckes Steigrohr hydrostat. Überdruck B Zucker-Lsg. dest. Wasser semipermeable Membran A a Schematischer Aufbau der Pfefferschen Zelle h = Steighöhe des Hg = osmot. Druck Hg Manometerrohr Lsg. (z. B. Zuckerwasser) Tonzylinder Wasser b 115 Rote Blutkörperchen in isotonischer Lösung in reinem Wasser in konzentrierter Zuckerlösung Oben: normales Aussehen in einer isotonischen Lösung Mitte: in reinem Wasser blähen sich die Zellen auf und platzen schließlich Unten: in einer konzentrierten Zucker-Lösung schrumpfen die Zellen (Rasterelektronenmikroskop-Aufnahmen)