3. PRAKTIKUMSTAG
Werbung

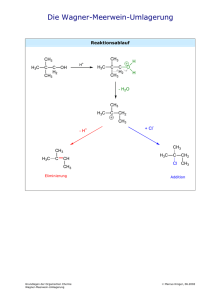
WS06-07 Chemisches Praktikum für Mediziner Vorlesungsnummer 13.861 PRAKTIKUMSUNTERLAGEN 3. PRAKTIKUMSTAG Themen: - Kohlenwasserstoffe - Funktionelle Gruppen I und ihre Reaktionen • Halogenalkane • Alkohole - Funktionelle Gruppen II und ihre Reaktionen • Aldehyde • Ketone - Funktionelle Gruppen II und ihre Reaktionen Hinweis: • Carbonsäuren • Carbonsäurederivate • Ausbeute Informieren Sie sich über die angegebenen Themen bitte vor dem jeweiligen Praktikumstag in den Ihnen zur Verfügung stehenden Lehrbüchern (s. Liste Merkblatt). Im Praktikum können nicht alle Themen behandelt werden, die für die Abschlussklausur in Chemie und für die ärztliche Vorprüfung relevant sind. Entsorgung: Entsorgungsbehälter A Entsorgungsbehälter B Entsorgungsbehälter C Entsorgungsbehälter D Entsorgungsbehälter H Entsorgungsbehälter K Entsorgungsbehälter L Andere Organische Lösemittel, halogenfrei (blau) Halogenorganische Lösemittel (rot) Anorg. Säuren, Nitrit-/Nitrathaltig Metallsalzlösungen, pH-neutral Andere Säuren, schwermetallsalzhaltig Kontaminiertes Laborglas Kontaminierte Betriebsmittel 3. PRAKTIKUMSTAG Seite 2 3.1. Kohlenwasserstoffe Die einfachsten organischen Verbindungen bestehen nur aus den Elementen Kohlenstoff und Wasserstoff, sie besitzen also keine sogenannten funktionellen Gruppen mit Heteroatomen wie -OH oder –NH2. Diese „Kohlenwasserstoffe“ lassen sich nach ihren chemischen Eigenschaften in drei Gruppen gliedern: • Gesättigte Kohlenwasserstoffe (Alkane, Cyloalkane – sp3-hybridisiert) • Ungesättigte Kohlenwasserstoffe (Alkene mit Doppelbindungen – sp2-hybridisiert; Alkine mit Dreifachbindungen – sp-hybridisiert) • Aromatische Kohlenwasserstoffe(planares Ringsystem mit konjugierten Doppelbindungen – sp2-hybridisiert, folgen der Hückel-Regel: (4n+2)π-Elektronen mit n = 0,1,2,.....) Außerdem werden Kohlenwasserstoffe nach ihrer Konstitution eingeteilt: Verbindungen mit verzweigten oder unverzweigten kettenförmigen Gerüsten werden als aliphatisch, mit ringförmigen Gerüsten als alicyclisch bezeichnet. Ringförmige Verbindungen gliedern sich in alicyclische und aromatische Kohlenwasserstoffe. Wegen der geringen Polarität der C-H-Bindung sind Kohlenwasserstoffe nahezu unpolar. Sie sind daher nicht mischbar mit polaren Lösungsmitteln wie Wasser und Ethanol. Zwischen den Molekülen wirken nur schwache zwischenmolekulare Kräfte. Diese VAN-DER-WAALSWechselwirkungen hängen nicht nur von der Molekülmasse sondern auch von der Gestalt des Moleküls ab. Dies zeigt sich deutlich in den Schmelz- und Siedepunkten von Kohlenwasserstoffen. Stark verzweigte Moleküle, die eine nahezu kugelförmige Raumerfüllung haben, sieden tiefer als kettenförmige Moleküle gleicher Kohlenstoffzahl. Kohlenwasserstoffe sind reaktionsträge, haben aber einen sehr hohen Energiegehalt, weshalb sie u.a. als Brennstoffe eingesetzt werden. So gibt 1 kg Benzin bei der Verbrennung etwa 42 MJ (42 • 106 J, ca. 170000 kcal) ab. Benzin (Fahrzeugbenzin) ist eine Sammelbezeichnung für ein Gemisch von ca. 150 verschiedenen Kohlenwasserstoffen wie Alkane, Alkene, Cycloalkane, -alkene, sowie Aromaten (z.B. Benzen), die 5- 12 C-Atome enthalten. Alkangemische (Waschbenzin, Petrolether) benutzt man aufgrund seiner fettlösenden Eigenschaften in der Chemischen Reinigung, als Fleckentfernungsmittel, als Lösungsmittel bei der Extraktion von Fetten, Harzen, Pflanzenölen, bei der Kautschuk-, Paraffin- und Vaselinefabrikation, als Terpentinölersatz und in zahlreichen weiteren Anwendungen. Trotz der Bezeichnung „organische“ Verbindungen kommen Kohlenwasserstoffe in diesem Sinne nicht im menschlichen Körper vor, sind jedoch Bestandteil bzw. Grundgerüst zahlreicher Biomoleküle. 3.2. Funktionelle Gruppen und ihre Reaktionen Teil I Kohlenwasserstoffe (Alkane) mit kovalenten C-C- und C-H-Bindungen sind reaktionsträge, da diese Bindungen aufgrund nahezu gleicher Elektronegativität nicht polarisiert sind. Die Mehrzahl der organischen Verbindungen enthält neben Kohlenstoff- und Wasserstoffatomen weitere Atome (O, N, S, F, Cl, Br), so genannt Heteroatome. Diese Bindungen zwischen Kohlenstoff- und Heteroatom sind aufgrund der höheren Elektronegativitätsunterschiede des Heteroatoms im Vergleich zum Kohlenstoff polarisiert und damit reaktionsfreudiger. Atomgruppen, die für eine Reihe von Verbindungen charakteristische Eigenschaften und Reaktionen zeigen, bezeichnet man als funktionelle Gruppe. 3. PRAKTIKUMSTAG Seite 3 In der organischen Chemie unterscheidet man mehrere funktionellen Gruppen, wie z.B. • • • • • Alkohole Thiole Ether Thioether Amine und Substituenten, wie z.B. • Halogenalkane Außerdem sind Doppelbindungen der Alkene und die Dreifachbindung der Alkine funktionelle Gruppen. Reaktionsmechanismen Typische Reaktionen der oben aufgeführten funktionellen Gruppen sind: • • • • Substitution: Ein Atom oder eine Atomgruppe wird durch ein/e andere/s ersetzt. Addition: An eine Doppelbindung wird ein Atom oder Atomgruppe addiert. Eliminierung: (Umkehrung der Addition) Ein Atom oder Atomgruppe verlässt/verlassen das Molekül unter Ausbildung einer Doppelbindung. Redox-Reaktionen Halogenierte Kohlenwasserstoffe Eine sowohl in der Technik als auch im Laboratorium vielfach angewandte Methode zur R X Darstellung der halogenierten Kohlenwasserstoffe (X = Cl, Br, F) ist die Umsetzung von Alkoholen mit Halogenwasserstoffsäuren (nukleophile Substitution). Großtechnisch werden halogenierte Kohlenwasserstoffe durch radikalische Photohalogenierung hergestellt. Halogenierte Kohlenwasserstoffe kommen kaum in natürlichen Quellen vor, trotzdem sind sie aufgrund ihrer zahlreichen Verwendung vielfach in der Natur nachweisbar, was auf der Tatsache beruht, dass sie nur sehr langsam abgebaut werden. Verbindungen wie Perchlorethylen (Cl2C=CCl2), kurz PER genannten, wurden in der chemischen Reinigung zur Entfernung von Fetten und in der Industrie zur Entfettung von Metalloberflächen,. Alkohole R OH Alkohole entstehen durch nukleophile Substitution an Halogenalkanen, durch elektrophile Additionen an Doppelbindungen und durch Oxidation der entsprechenden Alkane. Die funktionelle Gruppe der Alkohole ist die Hydroxylgruppe (-OH). Der bekannteste Alkohol ist Ethanol, der bei der alkoholischen Gärung entsteht. 3. PRAKTIKUMSTAG Seite 4 Versuch 3.1: Darstellung von 2-Chlor-2-methylpropan CH3 CH3 H3C C H3C OH + HCl C Cl + H 2O CH3 CH3 2-Methylpropan-2-ol 2-Chlor-2-methylpropan Versuchsdurchführung: Chemikalien • • • Geräte • • • 2-Methyl-2-propanol konz. Salzsäure (HCl) n-Heptan, Natriumchlorid Reagenzgläser, Stopfen Pipetten a) Geben Sie 2 ml 2-Methyl-2-propanol in ein Reagenzglas. Fügen Sie vorsichtig 1 ml konzentrierte Salzsäure (ätzend !) hinzu und verschließen Sie das Reagenzglas mit einem Stopfen b) Nach intensivem Schütteln (Überdruck!) und etwa halbstündigem (½ h) Stehen lassen wird die obere Phase mit einer Pipette abgehoben und in ein anderes Reagenzglas überführt.(Falls sich die Phasen nicht trennen. Heptan zugeben und nochmals schütteln und gegebenenfalls mit Natriumchlorid aussalzen!) Die organische Phase wird mit 3 ml Wasser ausgewaschen. Die obere Phase wird mit der Pipette abgehoben und in das andere Reagenzglas überführt. c) Das Produkt nicht sofort entsorgen! (Es wird noch für die Reaktionen 3.3 benötigt) Verwendete Chemikalien: 2-Methylpropan-2-ol 2-Chlor-2-methylpropan Salzsäure, konz. Xn, F F C R: R: R: 11-20 11 34-37 S: S: S: 9-16 9-16-29 26/36/37/39-45 Entsorgung: Das Produkt nicht sofort entsorgen! (Es wird noch für die Reaktionen 3.3 benötigt.) Wässrige Waschlösungen Entsorgungsbehälter D Die Hydroxy-Funktion eines Alkohols (R-OH) kann durch ein Halogen-Atom ersetzt werden. Man lässt dabei den Alkohol in Gegenwart einer Säure (die OH-Gruppe wird dabei protoniert und als H2O abgespalten) mit dem Halogenid, z.B. Cl–, reagieren. Es handelt sich hierbei um ein Beispiel für eine nukleophile Substitution (SN-Reaktion). • • • Primäre Alkylverbindungen reagieren hierbei meist nach dem SN2-Mechanismus Tertiäre Alkylverbindungen reagieren hierbei meist nach dem SN1-Mechanismus Für sekundäre Alkylverbindungen sind – je nach Reaktionsbedingungen – beide Mechanismen möglich. 3. PRAKTIKUMSTAG Seite 5 SN1-Reaktion (Substitution, nukleophil, monomolekular): Sie verläuft nach dem Geschwindigkeitsgesetz 1. Ordnung, d. h. die Reaktionsgeschwindigkeit ist nur von der Konzentration eines Reaktionspartners abhängig, nämlich von der Konzentration des Eduktes oder seiner protonierten Form. Dies ist darauf zurückzuführen, dass der Reaktionsschritt der Bildung des Carbeniumions vergleichsweise langsam verläuft und damit geschwindigkeitsbestimmend ist. Das dabei gebildete Carbeniumion reagiert dann schnell mit dem Nukleophil, so dass seine Konzentration keine Rolle spielt. Bei der SN1-Reaktion wird die Gesamtgleichung in die folgenden Reaktionsschritte unterteilt: Reaktionsmechanismus Schritt 1: Protonierung (Bildung eines Oxoniumions; schnell) CH3 CH3 H3C OH + H C H3C H Wasserabspaltung (Bildung eines Carbeniumions; langsam) CH3 H3C C CH3 H O CH3 Schritt 3: H O CH3 CH3 Schritt 2: C H3C H C H + O H CH3 Nukleophiler Angriff (Bildung des Produktes; schnell) CH3 CH3 H3C C CH3 + Cl H3C C Cl CH3 Energetischer Verlauf: SN2-Reaktion (Substitution, nukleophil, bimolekular): Die SN2 - Reaktion erfolgt nach dem Geschwindigkeitsgesetz 2. Ordnung, d.h. die Reaktionsgeschwindigkeit wird von den Konzentrationen beider Reaktionspartner, dem Substrat R-Br und dem Nukleophil OH-, bestimmt. Hier sind also beide am geschwindigkeitsbestimmenden Schritt beteiligt. Es handelt sich um eine Einstufenreaktion, bei der die Lösung der C-Br -Bindung und die Knüpfung der C-OH - Bindung konzertiert (gleichzeitig) erfolgen. Dabei greift das Nukleophil das C-Atom von der Seite an, die der nukleofugen Gruppe (Abgangsgruppe) gegenüber liegt. In dem Maße, in dem sich das Nukleophil dem C-Atom nähert und die nukleofuge Gruppe sich entfernt, weiten sich die Bindungswinkel zwischen den Substituenten auf 120o auf (penta-koordiniertes CAtom). 3. PRAKTIKUMSTAG Seite 6 Mit fortschreitender Ablösung von Br bewegen sich die Substituenten weiter in derselben Richtung, bis am Ende des Prozesses die Bindungswinkel wieder etwa 109.5o betragen. Die so erfolgte Inversion ist bildlich mit dem Umklappen eines Regenschirmes vergleichbar. Verlauf: H H HO + C Br HO H C H CH2 H HO Br C H CH2 CH2 CH3 CH3 + Br CH3 Energetischer Verlauf: Ungesättigte Kohlenwasserstoffe Alkene Alkene sind Kohlenwasserstoffe mit mindestens einer Doppelbindung (sp2-hybridisiert, Bindungswinkel von 120 °) und können im allgemeinen durch die Formel CnH2n beschrieben werden. Die chemischen Reaktionen der Alkene werden vorwiegend durch die π-Bindung bestimmt. Sie gehen leicht Additionsreaktionen ein, wobei gesättigte Verbindungen entstehen. Da die C=C- Doppelbindung nukleophil ist das angreifende Reagens elektrophil – elektrophile Addition(s. Seite 9). Dabei unterscheidet man je nach Reaktionsverlauf und eingesetzten Reagenzien cis-1,2-Adukte von trans-1,2-Adukte. + -(HO)2OsO2 Cyclohexen Br OH OsO4 Br + Br2 OH cis-1,2-Dihydroxycyclohexen Cyclohexen trans - 1,2 - Dibromcyclohexan Alkene entstehen durch industriell durch Crackverfahren und im Labor durch partielle Hydrierung von Alkinen oder Eliminierung entsprechender Verbindungen. Dabei treten E/Z-Isomere auf (E von entgegen und Z von zusammen). Wobei das E-Isomer energetisch günstiger ist. E-But-2-en Z-But-2-en Alkine Alkene sind Kohlenwasserstoffe mit mindestens einer Dreifachbindung (sp-hybridisiert, Bindungswinkel von 180 °) und können im allgemeinen durch die Formel CnH2n-2 beschrieben werden 3. PRAKTIKUMSTAG Seite 7 Alkine sind weniger reaktiv als Alkene. Das am sp-hybridisierten C-Atom gebundene H-Atom kann leicht abgespalten werden (C-H-azid). Additionsreaktionen sind typisch für Alkine, wobei im ersten Schritt Alkene entstehen, die dann zu Alkanen weiterreagieren können. Alkine werden industriell durch partielle Oxidation des Methans(aus Erdgas) gewonnen im Labor durch doppelte Eliminierung entsprechender Verbindungen. Monomolekulare Eliminierung (E1): OH Cyclohexanol [H ] + H 2O Cyclohexen Alkohole spalten in Gegenwart von starken Säuren, deren Anionen schwache Nukleophile sind, leicht in der Hitze Wasser ab. Diese Eliminierungstendenz nimmt von primären zu tertiären Alkoholen zu. Die Eliminierungsreaktion E1 verläuft nach erster Ordnung, sie ist eine Konkurrenzreaktion der SN1-Reaktion. Die Darstellung von Cyclohexen durch Dehydratisierung von Cyclohexanol in Gegenwart von Phosphorsäure kann in die Schritte (1) bis (3) unterteilt werden: Schritt 1: Protonierung (Bildung des Oxoniumions; schnell): H H O OH H + H H Abspaltung von Wasser (Bildung des Carbeniumions; langsam) H H O H H + H2O H H Schritt 3: H H H Schritt 2: H H H Bildung der Doppelbindung (Abspaltung des Protons; schnell) H H + H H H Energetischer Verlauf: H 3. PRAKTIKUMSTAG Seite 8 Versuch 3.2: Qualitativer Nachweis von Alkenen mit Brom R R C R C + C Br2 C R 1,2 Alken Br Br Dibromalkan Versuchsdurchführung: Brom ist ein starkes Ätz- und Atemgift! R- und S - Sätze beachten ! Chemikalien • • • • n-Heptan Styrol Brom in konz. Essigsäure 2 M Natronlauge Geräte • • • Pipette Reagenzgläser Bunsenbrenner a) Ca. 1 ml Heptan und 5 Tropfen Styrol werden in einem Reagenzglas mit einer 3 %igen Lösung von Brom in konz. Essigsäure (Vorsicht) tropfenweise unter Umschütteln versetzt. Beachten Sie die Entfärbung der Brom-Lösung! Man beendet die Bromzugabe, sobald eine bleibende Gelbfärbung zu beobachten ist. b) Dann neutralisiert man die Reaktionsmischung durch tropfenweise Zugabe von 2 M Natronlauge unter Kontrolle des pH-Wertes mit Indikatorpapier. Es scheidet sich öliges 1,2-Dibrom-1-phenylethan ab. Die obere Phase wird mit der Pipette abgehoben und in das andere Reagenzglas überführt. c) Das Produkt nicht sofort entsorgen! (Es wird noch für die Reaktionen 3.3 benötigt) Verwendete Chemikalien: Styrol 3%ige Lösung von Brom in konz. Essigsäure 2 M Natronlauge 1,2-Dibrom-1-phenylethan Entsorgung: Wässrige Phase F, Xn R: 10-20-36/38 C R: 36/37/38 C R: 35 A R: ? Entsorgungsbehälter S: S: S: S: D 23.2 81/2)7/9-26/45 (1/2)-26-37/39-45 ? 3. PRAKTIKUMSTAG Seite 9 Versuch 3.3: Qualitativer Nachweis von Halogenalkanen mit dem Beilstein Test. Versuchsdurchführung: (Wird mit dem Assistenten durchgeführt.) a) Unter dem Abzug wird ein Eurocent in die Flamme des Bunsenbrenners gehalten, bis diese Flamme keine Färbung mehr aufweist. b) Nach Abkühlen des Drahtes gibt man auf dessen Ende einen Tropfen 2-Chlor-2-methylpropan (Aus Versuch 3.1) Wird nun dieses Drahtende in die Flamme gehalten, verfärbt sie sich grün. c) Gleiche Prozedur mit 1,2-Dibrom-1-phenylethan.(Aus Versuch 3.2) Verwendete Chemikalien: 2-Chlor-2-methylpropan 1,2-Dibrom-1-phenylethan Entsorgung: 2-Chlor-2-methylpropan 1,2-Dibrom-1-phenylethan F R: 11 S: 9-16-29 A R: ? S: ? Entsorgungsbehälter: B Entsorgungsbehälter B Elektrophile Addition - anti-Bromierung von Cyclohexen (Additionsreaktion) Die Addition von Brom an eine Doppelbindung verläuft nach einem ionischen Mechanismus. Vor der eigentlichen Addition erfolgt eine Polarisierung des Broms durch die π-Elektronen der Doppelbindung und es kommt zur Ausbildung des cyclischen Bromoniumions. Darauf erfolgt aus sterischen Gründen ein nukleopiler trans-Angriff des Bromid-Ions. Br Br + Br2 trans - 1,2 - Dibromcyclohexan Cyclohexen Die Gesamtreaktion lässt sich in folgende Reaktionsschritte unterteilen: Schritt 1: Bildung eines cyclischen Bromonium-Ions Br + Schritt 2: Br2 + Br - Nukleophile Öffnung des cyclischen Bromonium-Ions durch trans-Angriff eines Br : Br Br + Br Br 3. PRAKTIKUMSTAG Seite 10 3.3. Funktionelle Gruppen Teil II: Carbonyle (Aldehyde und Ketone) Aldehyde Aldehyde entstehen durch Oxidation eines primären Alkohols. In der Natur kommen Aldehyde in gebundener Form in Kohlenhydraten vor, in freier Form nur in geringen C Konzentrationen in etherischen Ölen von Duft- und Aromastoffen. In der Industrie R H werden Aldehyde zu Aromen, Pharmazeutika, Pflanzenschutzmitteln und Farbstoffen verarbeitet. O Ketone Ketone entstehen durch Oxidation sekundärer Alkohole. Propan-2-on (Aceton) ist dar erste und wichtigste Vertreter in der Reihe der Ketone. Da es sich sowohl in Wasser als C R R auch in hydrophoben Flüssigkeiten löst, ist es in der Industrie und Technik ein vielfach eingesetztes Lösungsmittel. Früher war Aceton in Nagellackentfernern enthalten Da der Verdacht besteht, dass es krebserregend ist, wurde es durch andere Lösungsmittel ersetzt. O Redox-Reaktionen Oxidation bedeutet eine Abgabe von Elektronen, was sich formal in der Erhöhung der Oxidationszahl ausdrücken lässt. Dies gilt für die Reduktion in umgekehrter Weise. Oxidationstufen Verbindungen - IV CH4 - III CH3-CH3 - II CH2=CH2 CH3OH -I CH≡CH CH3CH2OH 0 CH2=O CH2Cl2 (CH3)2CHOH +I CH3CHO CH3CHCl2 (CH3)3COH + II HCO2H CHCl3 HCN + III CH3CO2H CH3COCl CH3CN + IV CO2 COCl2 CCl4 CH3Cl (CH3)2CO 3. PRAKTIKUMSTAG Seite 11 Versuch 3.4: Nachweis von Aldehyden mit Tollens-Reagenz O O R C R + 2 Ag + 2 OH C + H2O + 2 Ag OH H Carbonsäure Aldehyd Versuchsdurchführung: Chemikalien Geräte • 10 % Silbernitratlösung • Reagenzglas • 2 M Natronlauge • Wasserbad • konz. Ammoniaklösung • Aceton (Propan-2-on) • Ethanal a) 0,5 ml einer 10 %igen Silbernitratlösung werden mit 0,6 ml 2 M Natronlauge vermischt. Das ausgefallene Silberoxid wird durch tropfenweise Zugabe von konz. Ammoniaklösung gelöst und die Lösung auf zwei Reagenzgläser aufgeteilt. b) Zu dem frisch bereiteten Tollens-Reagenz gibt man jeweils einige Tropfen Aceton bzw. Ethanal. Falls sich in der Kälte kein Silberspiegel bildet, wird kurz auf 60 - 70 °C erwärmt (Wasserbad). Verwendete Chemikalien: Silbernitrat C,N R: 34-50/53 S: (1/2)26-45-60-61 2 M Natronlauge C R: 35 S: (1/2)-26-37/39-45 Silberoxid O, Xn R: 8-41-44 S: 26-39 konz. Ammoniaklösung C,N R: 34-50 S: (1/2)-26-36/37/39-45-61 Aceton (Propan-2-on) Ethanal Silber F,Xi F,Xn R: R: R: 11-36-66-67 S: 12-36/37-40 S: S: Entsorgung: gesamte Reaktionslösung Entsorgungsbehälter ansäuern C (2-)9-16-26 (2-)16-33-36/37 (Anorg. SäurenNitrat- / Nitrithaltig) Im Gegensatz zu Ketonen können Aldehyde von Oxidationsmitteln zu Carbonsäuren oxidiert werden. Auf diesem Prinzip beruhen die Nachweisreaktionen mit Tollens’ Reagenz. Stark reduzierende Substanzen wie Aldehyde scheiden aus ammoniakalischer Silberoxidlösung (Tollens-Reagenz) metallisches Silber aus (Silber wird von der Oxidationsstufe +1 zur Oxidationszahl 0 reduziert), welches sich als Silberspiegel an der Reagenzglaswand niederschlägt. 3. PRAKTIKUMSTAG Seite 12 3.4. Funktionelle Gruppen und ihre Reaktionen Teil III Carbonsäuren Durch Oxidation primärer Alkohole kommt man zu den entsprechenden Monocarbonsäuren. Bezeichnend für diese Stoffklasse ist die Carboxylgruppe (CarboxyR C Gruppe). Da einige höhere Carbonsäuren als Bestandteil der Fette auftreten, bezeichnet OH man diese als Fettsäuren. O Im Organismus kommen zahlreiche Carbonsäuren vor. Als schwache Säuren liegen sie beim physiologischen pH von etwa 7 deprotoniert, also als Anion vor. Das wird auch in der Benennung deutlich, man spricht also nicht von Essigsäure (Ethansäure), sondern von Acetat. Sie spielen eine zentrale Rolle im Stoffwechsel. Dies wird schon bei der Benennung der wichtigen Stoffwechselzyklen deutlich, dem Citronensäure- oder Citratzyklus. Carbonsäure-Derivate Man kennt in der Chemie eine große Anzahl von Carbonsäure-Derivaten. Von diesen sind unter anderen für Sie besonders wichtig: • • (Carbonsäure-)Ester (Carbonsäure-)Amide Ester Carbonsäuren reagieren mit Alkoholen in Gegenwart katalytischer Mengen einer Mineral- (HCl) oder Lewis-Säure (BF3) zu Carbonsäureestern und Wasser. Die Reaktion ist ein dynamisches Gleichgewicht zwischen Veresterung (Hinreaktion) und Hydrolyse (Rückreaktion). O 1 R C 2 OR O 1 R C + HO Veresterung 2 R OH Hydrolyse O 1 R C + 2 H2O OR Viele natürliche Fruchtaromen enthalten Carbonsäureester. Der Hauptbestandteil dieser Aromen wird häufig in Lebensmittel oder Süßigkeiten eingesetzt, z.B. Methansäureethylester im Rum- oder Ethansäure-3-methylbutylester im Bananenaroma. Die Triester des Glycerins (Propan-1,2,3-triol) spielen als Fette eine besondere Rolle und werden weiter unten behandelt. Amide O 1 R C Carbonsäureamide erhält man durch Umsetzung der entsprechenden Säurehalogenide, anhydride und –ester mit Ammoniak. NH2 O 1 R C X + NH3 - HX O O 1 X = Cl, Br, R R C NH2 Die biochemisch wichtigsten Amide sind Peptide und Proteine (Ksp. 4.4.) C , OR O 3. PRAKTIKUMSTAG Seite 13 Versuch 3.5: Darstellung von Acetylsalicylsäure (Aspirin) O OH O O H3C C C OH + C O O CH3 C O C O OH CH3 + HO C CH3 O Salicylsäure Ethansäureanhydrid (Essigsäureanhydrid) Ethanoylsalicylsäure (Acetylsalicylsäure) Ethansäure (Essigsäure) Versuchsdurchführung: Chemikalien • • • Geräte • • Salicylsäure Essigsäureanhydrid konz. Schwefelsäure Erlenmeyerkolben Saugflasche/Gummikonus/ Wasserstrahlpumpe Büchnertrichter/Filterpapier • Essigsäureanhydrid ist ätzend. R/S-Sätze beachten! a) In einem trockenen Erlenmeyerkolben werden 2 g Salicylsäure und 4 ml Essigsäureanhydrid unter dem Abzug - vermischt. b) Man gibt 6 Tropfen konzentrierte Schwefelsäure zu und erwärmt etwa 10 Minuten im Wasserbad (50 - 60 °C). Ab und zu schütteln. a) Nach dem Abkühlen werden 30 ml Wasser dazugeben. Der gebildete Niederschlag wird abfiltriert und mit wenig kaltem Wasser gewaschen. d) Das erhaltene Produkt wird gewogen und die Ausbeute bestimmt. Verwendete Chemikalien: Salicylsäure Xn R: 22-37/38-41 S: - Essigsäureanhydrid C R: 10-20/22-34 S: (1/2-)26-36/37/39-45 konz. Schwefelsäure C R: 35 26-30-45 Entsorgung: Reaktionslösung Entsorgungsbehälter D Waschwasser Entsorgungsbehälter D Salicylsäure Entsorgungsbehälter A (blaue Lösungsmitteltonne) S: Salicylsäure kann als Phenol mit Carbonsäurederivaten zu Estern reagieren (irreversible Esterdarstellung). Wir führen die Reaktion mit Essigsäureanhydrid durch. 3. PRAKTIKUMSTAG Seite 14 Mechanismus: OH O C + OH O CH3 CH3 C C O O CH3 CH3 C C O O OH O O C H3C CH3 O C O C OH + O OH O O O C C OH H3C + O H3C C O O C H OH Ausbeuteberechnung: Bei der Veresterung von 69 g von der Salicylsäure mit Ethansäureanhydrid erhält man Acetylsalicylsäure in einer Ausbeute von 70 %. Wie viel Gramm der Verbindung werden erhalten. (mit C = 12 g/mol, H = 1g/mol, O = 16 g/mol) O OH O C O H3C C OH C O CH3 C O + C O CH3 O OH + HO C CH3 O 138 g/mol 102 g/kol 180 g/mol C7H6O3 C4H6O3 C9H8O4 1. Berechnung der Stoffmenge des Edukts: mE = nE * ME nE = mE / ME = 0.5 g/mol mE = Masse des Edukt nE = Stoffmenge des Edukts ME = Molekulargewicht des Edukts 2. Berechnung der Stoffmenge des Produkts A = nP / nE * 100 % nP = A * nE / 100 % =0.35 mol A = Ausbeute nP = Stoffmenge des Produkts nE = Stoffmenge des Edukts 3. Berechnung der Masse des Produkts mP = nP * MP = 63 g mP = Masse des Produkts nP = Stoffmenge des Produkts MP = Molekulargewicht des Produkts 3. PRAKTIKUMSTAG Seite 15 Versuch 3.6: Veresterung von Salicylsäure: Herstellung von „Wintergrünöl“ OH OH O C OH O C HO CH3 + Salicylsäure OCH3 + Salicylsäuremethylester 2-Hydroxybenzoesäuremethylester Methanol H2O Wasser Versuchsdurchführung: Chemikalien Geräte • Reagenzgläser/Reagenzglashalter • Uhrenglas • Messzylinder • Bunsenbrenner a) Lösen Sie in einem Reagenzglas 1 Spatelspitze Salicylsäure in ca. 2-3- ml Methanol. • • • Salicylsäure Methanol konz. Schwefelsäure (H2SO4) b) Pipettieren Sie zu dieser Lösung vorsichtig (!) 0.5 – 1 ml konz. Schwefelsäure und erwärmen Sie die Probe für max. 1-2 min. leicht über der Sparflamme.(Schütteln nicht vergessen!) b) Geben Sie die Tropfen auf ein Uhrglas und prüfen Sie den typischen Geruch des entstandene Salicylsäuremethylesters („Wintergrünöl“). Verwendete Chemikalien: Salicylsäure Xn R: 22-37/38-41 S: - Methanol F,T R: 11-23/24/25-39/23/24/25 S: (1/2-)7-16-36/37-45 konz. Schwefelsäure C R: 35 S: 26-30-45 R: 22-36/38 S: - Salicylsäuremethylester Xn Entsorgung: Reaktionslösung Entsorgungsbehälter A Carbonsäuren sind relativ reaktionsträge Carboxylverbindungen. Ihre direkte Umsetzung mit Alkohol zu Carbonsäureestern gelingt daher meist nur in Gegenwart starker Säuren. Der Salicylsäuremethylester wird auch als „künstliches Wintergrünöl“ bezeichnet. Natürliches Wintergrünöl ist eine ölige, süß schmeckende Flüssigkeit, die aus den Blättern des „amerikanischen Immergrüns“ gewonnen wird. Aber auch in den Blüten der Passionsblume, auch als Maracuja bekannt, ist dieser Ester enthalten. 3. PRAKTIKUMSTAG Seite 16 Phenole OH Während in Alkohole die Hydroxy-Gruppe an Alkyl-C-Atome gebunden sind, enthalten Phenole eine oder mehrere OH-Gruppen direkt am aromatischen Ring. Die unterschiedliche Verknüpfungsart alkoholischer und phenolischer Hydroxy-Gruppen ist die Ursache der verschiedenartigen Reaktivität von Alkoholen und Phenolen. Versuch 3.7: Qualitative Nachweisreaktion auf Phenole Versuchsdurchführung: Chemikalien • • Geräte • • Ethanol 5% wässrige Eisen-(III)chlorid Lösung Reagenzgläser Pipette a) Man löst eine Spatelspitze - etwa 10 mg - Salicylsäure in 0,5 ml Ethanol. b) Dazu tropft man langsam eine 1%ige wässrige Eisen(III)-chlorid-Lösung und beobachtet die Färbung. Verwendete Chemikalien: Salicylsäure Xn R: 22-37/38-41 S: -- Ethanol F R: 11 S: (2-)7-16 5% wässrige Eisen-(III)chlorid -Lösung Xi R: 22-38-41 S: 26-39 Entsorgung: Reaktionslösung Entsorgungsbehälter Phenole und Enole geben mit charakteristische rot-blaue Färbung. . einer A (blaue Lösungsmitteltonne) wässrigen Eisen-(III)chlorid-Lösung eine
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)