MEMINIMUS zum GW Salze Metalle und Moleküle Lösung 8 NTG
Werbung

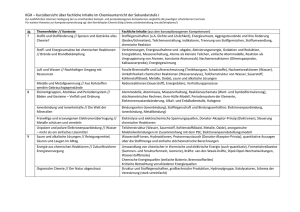
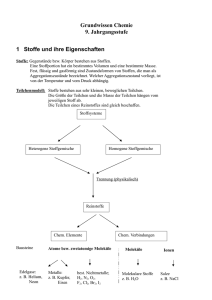
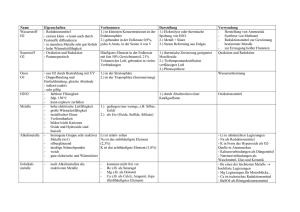
MEMINIMUS zu den Grundwissen-Kapiteln „Salze und Ionenbindung“, „Metalle und Metallbindung“ sowie „Moleküle und Atombindung“ LÖSUNG Es gibt zwei Seiten mit Memory-Kärtchen und zwei Seiten mit Mustern. Drucke jeweils die Seite mit den Memory-Kärtchen und die nächste Seite mit dem Muster so aus, dass sich das Muster auf der Rückseite der Memory-Seite befindet. Nun hast Du ein Set mit Begriffs-Kärtchen und ein Set mit Definitions-Kärtchen. Schneide nun alle Memory-Kärtchen aus und lege sowohl die Begriffs- als auch die Definitions-Kärtchen durcheinander hin. Decke immer zwei Memory-Kärtchen auf: Ein Begriffs- und ein AntwortKärtchen. Passt das Definitions-Kärtchen zum Begriffs-Kärtchen, darfst Du beide behalten, passten die beiden Kärtchen nicht zusammen, musst Du sie wieder umdrehen. Es beginnt der nächste Versuch! Salz Zwei Eigenschaften der Metalle Zwei Eigenschaften der Metalle Zwei Eigenschaften der Salze. Zwei Eigenschaften der Salze. Sulfat-Ion Carbonat-Ion Reaktionsverhalten von Metallen Reaktionsverhalten von Metallen Aufbau eines Metallgitters Stoffklasse, die aus Ionen aufgebaut ist (Metall- Kationen und Nichtmetall-Anionen). - Glanz - Verformbarkeit - leitet Wärme und Elektrizität - bei höherer Temperatur sinkt elektrische Leitfähigkeit - leiten in Lösung und als Schmelze elektrischen Strom - lösen sich häufig gut in Wasser - hoher Schmelz- & Siedepunkt - spröde SO42- CO32- Metallatome bilden Kationen Unedle Metalle reagieren mit Säuren unter Entwicklung von Wasserstoff, edle Metalle nicht. ValenzstrichFormel Einfachbindung Formeln, die die bindenden und nicht bindenden Elektronenpaare angeben. Ein bindendes Elektronenpaar zwischen zwei Atomen Elektrolyse Kationen werden an Kathode durch Aufnahme von Elektronen entladen, die Anionen an Anode durch Abgabe von Elektronen. Mehrfachbindung Zwei oder drei bindende Elektronenpaare zwischen zwei Atomen Gitterenergie Energie, die bei der Bildung eines Ionengitters frei wird. Phosphat-Ion Ammonium-Ion Nitrat-Ion Ionenbindung Atombindung PO43- NH4+ NO3Bindung zwischen Ionen, die durch elektrostatische Anziehungskräfte zwischen verschieden geladenen Ionen entsteht. Durch Überlappung von Atomorbitalen entstehen Molekülorbitale, die einem gemeinsamen Elektronenpaar entsprechen.