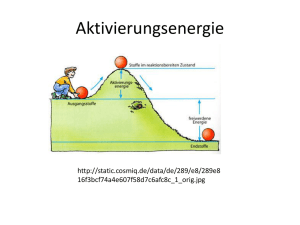
Reaktionskinetik
Werbung

Reaktionskinetik Maximilian Erlacher Quelle: Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Basisenzymreaktion Enzym: • Protein mit katalytischen Effekt • wirkt nur auf genau einen Stoff • wirkt hemmend oder aktivierend • liegt in niedriger Konzentration vor Basisenzymreaktion • S= ˆ # Ausgangsstoff • E= ˆ # Enzym • SE = ˆ # Zwischenzustand • P= ˆ # Produkt k1 k S + E SE →2 P + E k−1 ki Reaktionsraten Basisenzymreaktion Folgende Differentialgleichungen lassen sich aus den Änderungsraten herauslesen, wenn wir die Konzentrationen s = [S], e = [E], c = [SE], p = [P] betrachten: ds dt de dt dc dt dp dt = −k1 es + k−1 c, = −k1 es + (k−1 + k2 )c, = k1 es − (k−1 + k2 )c, = k2 c, Anfangswerte s(0) = s0 , e(0) = e0 , c(0) = 0, p(0) = 0. Basisenzymreaktion • p entkoppelt • verkürzen mit e(t) + c(t) = e0 System auf ds dt dc dt = −k1 e0 s + (k1 s + k−1 )c, = k1 e0 s − (k1 s + k−1 + k2 )c, Basisenzymreaktion Vergleich s und c nicht anschaulich! s0 0 s c t Basisenzymreaktion: Entdimensionalisierung • s und c Entdimensionalisierung klar: Betrachte u im Verhältnis zu s/s0 , v im Verhältnis zu c/e0 • Entdimensionalisierung von t nicht trivial, • tc , Entwicklung von c • ts , Entwicklung von s Basisenzymreaktion: Entdimensionalisierung • s und c Entdimensionalisierung klar: Betrachte u im Verhältnis zu s/s0 , v im Verhältnis zu c/e0 • Entdimensionalisierung von t nicht trivial, • tc , Entwicklung von c • ts , Entwicklung von s • Setze K = k−1 + k2 Km = k1 s0 s0 Km nennt man die Michaelis-Konstante Basisenzymreaktion: Entdimensionalisierung Standard Entdimensionalisierung τ = k1 e0 t, u(τ ) = s(t) , s0 v (τ ) = c(t) , e0 wir erhalten du dτ dv ε dτ = −u + (u + K − λ)v , = u − (u + K )v , u(0) = 1, v (0) = 0. ε= c0 , s0 Basisenzymreaktion: Entdimensionalisierung [C] 1 steigt in wenigen Sekunden sehr stark 2 bis Ausgleichszustand 3 danach gemäßigtes abklingen Aus dc = k1 e0 s0 − k1 (s0 + Km )c dt wähle Zeitskalierung tc = 1 k1 (s0 + Km ) Basisenzymreaktion: Entdimensionalisierung Annahme, e s ⇒ dc/dt ≈ 0 ⇒ c(t) = somit weshalb wir ds k2 e0 s =− , dt s + Km s0 ts ≈ ds dt max wählen. e0 s , s + Km ≈ s0 + Km , k2 e0 Basisenzymreaktion: Entdimensionalisierung Zeitskalierung τ= t , tc liefert du dτ dv dτ = ε −u + σ ρ uv + v , 1+σ (1 + σ)(1 + ρ) σ v = u− uv − , 1+σ 1+σ mit u(0) = 1, v (0) = 0. Basisenzymreaktion: Entdimensionalisierung Zeitskalierung T = (1 + ρ)t/ts = ε(1 + ρ)k2 t. Dadurch du dT dv ε dT = −(1 + σ)u + σuv + = (1 + σ)u − σuv − v . ρ v, 1+ρ Basisenzymreaktion: Veranschaulichung Schemenhafter Verlauf des entdimensionalisierten Systems, wenn ε 1 1 e/e0 = 1 − v 0 v u τ Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Michaelis-Menten-Analyse Ansatz zum Lösen der Differentialgleichungen durch Taylorentwicklung X X u(τ, ε) = εn un (τ ), v (τ, ε) = εn vn (τ ). n=0 n=0 Einsetzen in die bisherigen Differentialgleichungen liefert Sequenz von Differentialgleichungen für un (τ ) und vn (τ ). Michaelis-Menten-Analyse Die Gleichungen der Ordnung 1: du0 = −u0 + (u0 ) + K − λ)v0 , dτ u0 (0) = 1, 0 = u0 − (u0 + K )v0 , v0 (0) = 0. • Anfangsbedingungen nicht erfüllt. • Lösungen für die weitere Entwicklung von u und v interessant. Michaelis-Menten-Analyse Lösung ist: v0 = u0 u0 + K ⇒ du0 u0 = −λ dτ u0 + K und damit u0 (τ ) + K ln(u0 (τ )) = A − λτ. Michaelis-Menten-Analyse gute Lösung für kleine τ substituiere σ= τ , ε u(τ, ε) = U(σ, ε), v (τ, ε) = V (σ, ε). Dies führt zu dU dσ dV dσ = −εU + ε(U + K − λ)V , = U − (U + K )V , U(0) = 1, V (0) = 0. Michaelis-Menten-Analyse Gleichungen der Ordnung 1: dU0 = 0, dσ dV0 = U0 − (U0 + K )V0 . dσ Lösungen sind U0 (σ) = 1, V0 (σ) = 1 (1 − exp[−(1 + K )σ]) 1+K Gleichungen höherer Ordnungen liefern keine weiteren Informationen. Michaelis-Menten-Analyse Mit den Lösungen aus den O(1)-Gleichungen erhalten wir somit u(τ ; ) = u0 (τ ) + O(ε), u0 (τ ) + K log(u0 (τ )) = 1 − λτ, h 1 τ i v (τ ; ε) = 1 − exp −(1 + K ) + O(ε), für 0 < τ 1 1+K ε u0 (τ ) + O(), für 0 < ε τ. = u0 (τ ) + K Die Lösungen gelten demnach nur für kleine ε, was in der Reaktionskinetik aber üblich ist. Michaelis-Menten-Analyse Anfangsgeschwindigkeit r0 der Reaktion, zur Abschätzung wie schnell innere in die äußere Lösung umschlägt: du0 (τ ) u0 (0) λ r0 = =λ = . dτ u0 (0) + Km 1+K τ =0 Rücksubstitution r0 ∼ v v= k2 e0 s0 Vmax s0 = . s0 + K s0 + Km Michaelis-Menten-Analyse Michaelis-Konstante Km = ˆ Halbwertszeit Abbildung : Wikipedia Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Selbstauslöschende Kinetik • S= ˆ # Ausgangsstoff • E= ˆ # Enzym • Ei = ˆ # inaktives Enzym • X, Y= ˆ # Zwischenzustand • P= ˆ # Produkt k1 k k E + S X →2 Y →3 E + P, k−1 k Y →4 Ei . Anfangsbedingungen E(0) = e0 , S(0) = s0 , X (0) = Y (0) = Ei (0) = P(0) = 0. Selbstauslöschende Kinetik • [E] gegeben durch [E] = e0 − [X ] − [Y ] − [Ei ] Selbstauslöschende Kinetik • [E] gegeben durch [E] = e0 − [X ] − [Y ] − [Ei ] • [P] ist entkoppelt Selbstauslöschende Kinetik • [E] gegeben durch [E] = e0 − [X ] − [Y ] − [Ei ] • [P] ist entkoppelt Dies führt zu: d[S] dt d[X ] dt d[Y ] dt d[Ei ] dt = −k1 (e0 − [X ] − [Y ] − [Ei ])[S] + k−1 [X ], = k1 (e0 − [X ] − [Y ] − [Ei ])[S] − (k−1 + k2 )[X ], = k2 [X ] − (k3 + k4 )[Y ], = k4 [Y ]. Selbstauslöschende Kinetik • Innere Lösungen werden wie bei Michaelis-Menten bestimmt: 1 2 Mit tc entdimensionalisieren Potenzreihenansatz so weit entwickeln, bis man keine konstanten Lösungen erhält. • Äußere Lösungen entdimensionalisierte mit ts für ei ergibt sich insbesondere dei =φ·y dT Selbstauslöschende Kinetik Entwicklung kann zwei Formen annehmen 1 Enzym wird vollständig inaktiviert. 2 Ausgangsstoff wird vollständig abgebaut. Modellierungsannahmen 1 φ = O(1). 2 φ = O(ε). Selbstauslöschende Kinetik Lösungen für s und ei sind 1 im Fall φ = O(1): s(0) (T ) = 2 1−β 1 − βe , T [1−(1/β)]/(1+ρ) ei(0) (T ) = 1 − s(0) . β im Fall φ = O(ε): s(0) (T ) = e−T /(1+ρ) , ei(0) = 0, εei(1) (T ) = 1 − e−T /(1+ρ) . β Selbstauslöschende Kinetik Abbildung : Mathematical Biology:I. An Introduction,Third Edition J.D. Murray Springer Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Kooperatives Auftreten • Viele Enzyme haben mehr als eine Bindungsmöglichkeit • Erythrozyten können bis zu 4 O2 binden. • Eine solche Bindung nennt man kooperativ • Ausgangsstoffe, die die Aktivität eines Enzyms erhöhen nennt man Aktivator und im anderen Fall Inhibitor Kooperatives Auftreten • S= ˆ # Ausgangsstoff • E= ˆ # Enzym mit zwei bindenden Seiten • C1 , C2 = ˆ # Zwischenzustand • P= ˆ # Produkt k1 k S + E C1 →2 E + P, k−1 k3 k S + C1 C2 →4 C1 + P, k−3 mit Anfangswerten [S](0) = s0 , [E](0) = e0 , [C1 ](0) = [C2 ](0) = [P](0) = 0. Kooperatives Auftreten • p ist entkoppelt von dem System, • e = e0 − c1 − c2 , • Für den Rest ergibt sich ds dt dc1 dt = −k1 e0 s + (k−1 + k1 s − k3 s)c2 + (k1 + k−3 )c2 , = k1 e0 s − (k−1 + k2 + k1 s + k3 s)c1 +(k−3 + k4 − k1 s)c2 , dc2 dt = k3 sc1 − (k−3 + k4 )c2 . Kooperatives Auftreten • Standardentdimensionalisierung mit u ∼ s, v1 ∼ c1 und v2 ∼ c2 und gehen Michaelis-Menten-Verfahren durch. • O(1)-Gleichungen liefern nichtkonstante Lösungen v2 = a3 uv1 , a4 + a5 v1 = u a1 + a2 + u + a3 u 2 (a4 + a5 )−1 Demnach v1 = v1 (u), v2 = v2 (u) und somit du dτ = f (u, v1 (u), v2 (u)) a2 + a3 a5 u(a4 + a5 )−1 a1 + a2 + u + a3 (a4 + a5 )−1 u 2 = −r (u) < 0 = −u Kooperatives Auftreten Damit ergibt sich für die anfängliche Rektionsgeschwindigkeit R0 ds k2 Km0 + k4 s0 = e0 s0 R0 (s0 ) = dt t=0 Km Km0 + Km0 s0 + s02 mit Km0 = k4 + k−3 . k3 Kooperatives Auftreten Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Autokatalyse, Aktivierung und Inhibition Autokatalyse ist ein Prozess, bei dem ein Stoff bei seiner eigenen Produktion beteiligt ist. Beispielsweise hat k1 A + X 2X k−1 den Gleichgewichtszustand xS = Konzentration [A]. k1 a k−1 bei konstanter Mit diesem Modell hat man eine dynamische Regulierung des Stoffes X . Autokatalyse, Aktivierung und Inhibition Nun wird X zum Bilden eines anderen Stoffes benötigt k1 A + X 2X , k−1 k B + X →2 C Unter der Annahme, dass [A] und [B] konstant sind • ist xS = 0 stabil, wenn k1 a − k2 b ≤ 0 • ist xS = (k1 a − k2 b)/k−1 stabil, wenn k1 a − k2 b > 0 Autokatalyse, Aktivierung und Inhibition Betrachten wir nun k A + X →1 2X , k X + Y →2 2Y , k Y →3 B, wobei wir erneut annehmen, dass [A] konstant ist. Wir erhalten die DGLen dx = k1 ax − k2 xy , dt dy = k2 xy − k3 y , dt von denen wir aber keine stabilen Gleichgewichtspunkte bekommen. Autokatalyse, Aktivierung und Inhibition Modellierungsänderung! Wir wollen • u aktiviert v . • Umso größer v , desto kleiner die u-Produktion. • Das ist rückwirkende Inhibition. betrachte du dτ dv dτ = a − c · u = f (u, v ), b+v = d · u − e · v = g(u, v ). a, b, c, d, e > 0 konstant Autokatalyse, Aktivierung und Inhibition Modellierungsänderung! Wir wollen • u aktiviert v . • Umso größer v , desto kleiner die u-Produktion. • Das ist rückwirkende Inhibition. betrachte du dτ dv dτ = a − c · u = f (u, v ), b+v = d · u − e · v = g(u, v ). a, b, c, d, e > 0 konstant Autokatalyse, Aktivierung und Inhibition Gleichgewichtspunkte (u0 , v0 ): f (u0 , v0 ) = g(u0 , v0 ) = 0, v0 = du0 , e u02 + ebu0 ae − = 0. d cd Die Punkte stabil nach Analyse der Jacobi-Matrix von f g . Autokatalyse, Aktivierung und Inhibition Thomas-Mechanismus • Reaktion von Sauerstoff v mit Harnstoff u unter dem Enyzm Uricase. • entdimensionalisierte Gestalt: du dt dv dt = a − u − ρR(u, v ) = f (u, v ), = α(b − v ) − ρR(u, v ) = g(u, v ), R(u, v ) = uv , 1 + u + Ku 2 a, b, α, ρ, K > 0 konstant. Autokatalyse, Aktivierung und Inhibition R ist ein Substratinhibitor • u klein, R hemmend • u groß, R aktivierend Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Autokatalyse, Aktivierung und Inhibition Abhängig von den Parametern können wir mehrere Gleichgewichtszustände bekommen: • P1 und P3 linear stabil, wenn die Parameter nicht zu extrem. • P2 instabil. • S erfordert eine genauere Analyse. Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Themen: 1 Basisenzymreaktion 2 Michaelis-Menten-Analyse 3 Selbstauslöschende Kinetik 4 Kooperatives Auftreten 5 Autokatalyse, Aktivierung und Inhibition 6 Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Mehrfache Gleichgewichtszustände, Mushrooms und Isolas a) Mehrfache Gleichgewichtszustände b) Mushroom: Ein pilzähnlicher Körper c) Isolas: Ein isolierter Bereich Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Mehrfache Gleichgewichtszustände, Mushrooms und Isolas Modell von Gray und Scott X + 2Y → 3Y . entdimensionalisierte System: du dt dv dt = a(1 − u) − uv 2 − bu = f (u, v ), = a(c − v ) + uv 2 + bu − dv = g(u, v ), a, b, c, d > 0 konstant. Mehrfache Gleichgewichtszustände, Mushrooms und Isolas f (u, v ) = g(u, v ) = 0 liefert d 2 (a + d)2 2 us (1 + c − us ) = a 1 + (1 − us ) − bus . a a2 Je nach Parameterwahl erhählt man für us einen der folgenden Plots: Abbildung : Mathematical Biology: I. An Introduction, Third Edition J.D. Murray Springer Fazit • Enzymreaktionen haben in der Regel zwei wichtige Phasen, • eine, in der das Enzym einsetzt, • eine, in der der Stoff abgebaut wird. Fazit • Enzymreaktionen haben in der Regel zwei wichtige Phasen, • eine, in der das Enzym einsetzt, • eine, in der der Stoff abgebaut wird. • Analytische Näherungen durch Taylorentwicklung und Vergleich der beiden Phasen. Fazit • Enzymreaktionen haben in der Regel zwei wichtige Phasen, • eine, in der das Enzym einsetzt, • eine, in der der Stoff abgebaut wird. • Analytische Näherungen durch Taylorentwicklung und Vergleich der beiden Phasen. • Modellieren von Reaktionsgleichungen in unterschiedlichen Situationen, • selbstauslöschend, • kooperativ/kontrollierend anderen Enzymen gegenüber, • selbsterzeugend. • Verhalten von Gleichgewichtszuständen. Vielen Dank für ihre Aufmerksamkeit!